2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Кокки относятся к условно-патогенной микрофлоре и в незначительном количестве присутствуют в моче здоровой кошки. Беспокоиться нужно, если анализ показал стремительное размножение бактерий. Ведь этот фактор означает, что в организме животного начинает развиваться воспалительный процесс.
Содержание
Бактерии могут находиться в любом месте кошачьего организма, где начинается воспаление. В мочу бактериальные возбудители могут попадать несколькими способами:
Если местом локализации бактерий являются наружные половые органы, они могут смываться при опорожнении мочевого пузыря. Изредка в жидкость для анализа кокки попадают из анального отверстия.
Для того чтобы анализ мочи был достоверным, важно правильно собрать исследуемую жидкость. Зачастую положительный результат на кокки говорит о плохо вымытой емкости для сбора жидкости. Чтобы не допустить ошибок и не лечить котейку от несуществующей болезни, необходимо собирать мочу правильно:
Нюансы подготовки и самодиагностики.
Для анализа нужно использовать только свежую мочу! Хранение жидкости более 2-х часов приводит к получению недостоверного результата.
Без исследования мочи о наличии заболевания можно судить только по цвету. Если у здоровых животных она желтая, то при воспалительных процессах он может варьироваться от светло-коричневого до ярко-красного.
Читайте также:
При обнаружении кокков в моче, как правило, назначается анализ крови и дополнительный посев мочи на флору. Диагноз ставится по совокупности показателей. Наиболее часто микроорганизмы являются возбудителями уретрита, мочекаменной болезни, цистита и нефрита.
В официальной медицине и ветеринарии называется уролитиаз и характеризуется наличием песка или камней в области мочевого пузыря. Кроме бактерий, ее появление провоцируют:
Кроме бактерий, ее появление провоцируют:
Симптоматика. Наличие МКБ у кошки можно заподозрить, если она начала подолгу и часто ходить в лоток, при этом беспокойно мяукая. Кроме того, питомец часто вылизывает себя под хвостом и напрягается во время мочеиспускания. К более явным признакам относятся:
Лечение. Терапия, прежде всего, направлена на обезболивание, снятие воспалительного процесса, а также восстановление оттока мочи и выведения камней. Введение катетера или эндоскопа не должно быть резким и причинять боль пушистому питомцу, а время их нахождения в уретре – минимально возможным. Владелец кота должен помнить, что подобные процедуры чреваты повышенным травматизмом и занесением инфекций. Операция проводится только в том случае, если консервативные методики не дали результата.
Владелец кота должен помнить, что подобные процедуры чреваты повышенным травматизмом и занесением инфекций. Операция проводится только в том случае, если консервативные методики не дали результата.
Так называется воспалительный процесс, затрагивающий слизистую уретры. Чаще всего данной болезни подвержены самцы, особенно кастрированные. У самок заболевание возникает на фоне травматических повреждений, например, при выходе камней при уролитиазе или грубом введении катетера. У котов в результате уретрита может произойти закупорка мочеиспускательного канала. Это связано с тем, что уретра котов имеет большую длину чем у кошек.
Основные симптомы:
При хроническом вялотекущем уретрите признаки заболевания возвращаются при малейшем переохлаждении животного.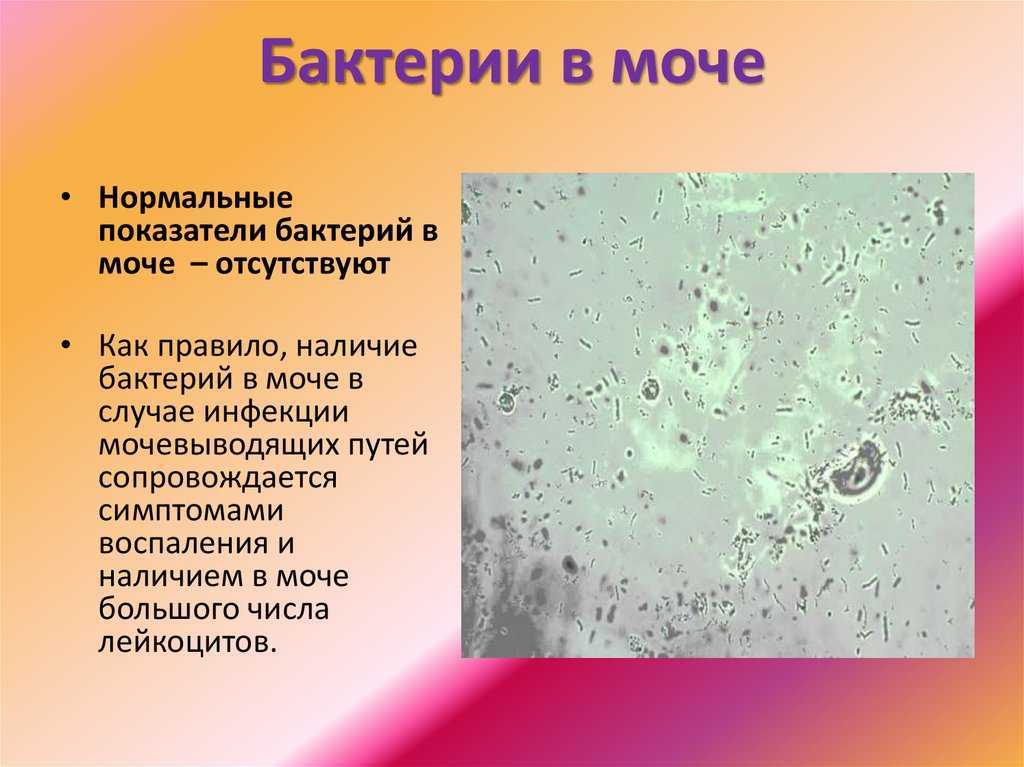 При лечении используются спазмолитики, мочегонные и антигистаминные препараты.
При лечении используются спазмолитики, мочегонные и антигистаминные препараты.
Воспаление начинает развиваться в стенках мочевого пузыря. Это одно из самых трудноизлечимых и возвратных заболеваний.
Циститом, спровоцированным кокками, чаще всего болеют кошки пожилого возраста.
Кроме бактерий, заболевание может возникнуть на фоне МКБ, плохой гигиены, диабета или травм в области живота.
Симптомы и лечение. Одним из наиболее заметных признаков цистита можно назвать игнорирование животным лотка. В остальном же симптомы те же самые, что и при мочекаменной болезни. Лечить цистит у котейки самостоятельно нельзя, только под контролем ветеринара. В первую очередь выясняется первопричина заболевания, потом разрабатывается схема лечения.
Воспаление почек у усатых-полосатых можно обнаружить по частым походам к лотку, появлению в моче гноя и крови, а также отекам век. Явным признаком можно считать постоянное сгорбленное положение питомца. Бактерии – виновники острой формы нефрита, которая легко перетекает в почечную недостаточность при отсутствии лечения. Хроническая форма проявляется расстройствами ЖКТ, анемией и частым мочеиспусканием. Выделенное количество мочи при этом бывает меньше обычного.
Бактерии – виновники острой формы нефрита, которая легко перетекает в почечную недостаточность при отсутствии лечения. Хроническая форма проявляется расстройствами ЖКТ, анемией и частым мочеиспусканием. Выделенное количество мочи при этом бывает меньше обычного.
Терапия. Лечение нефрита начинается с назначения безбелковой диеты, а также антибиотиков и диуретиков. Для предотвращения анемии прописываются железосодержащие препараты.
Также смотрите виде как собрать мочу для анализа у кошек:
Основные профилактические мероприятия против кокков направлены на соблюдение гигиены:
При обнаружении каких-либо отклонений в цвете или консистенции мочи владельцу следует незамедлительно обращаться к специалисту.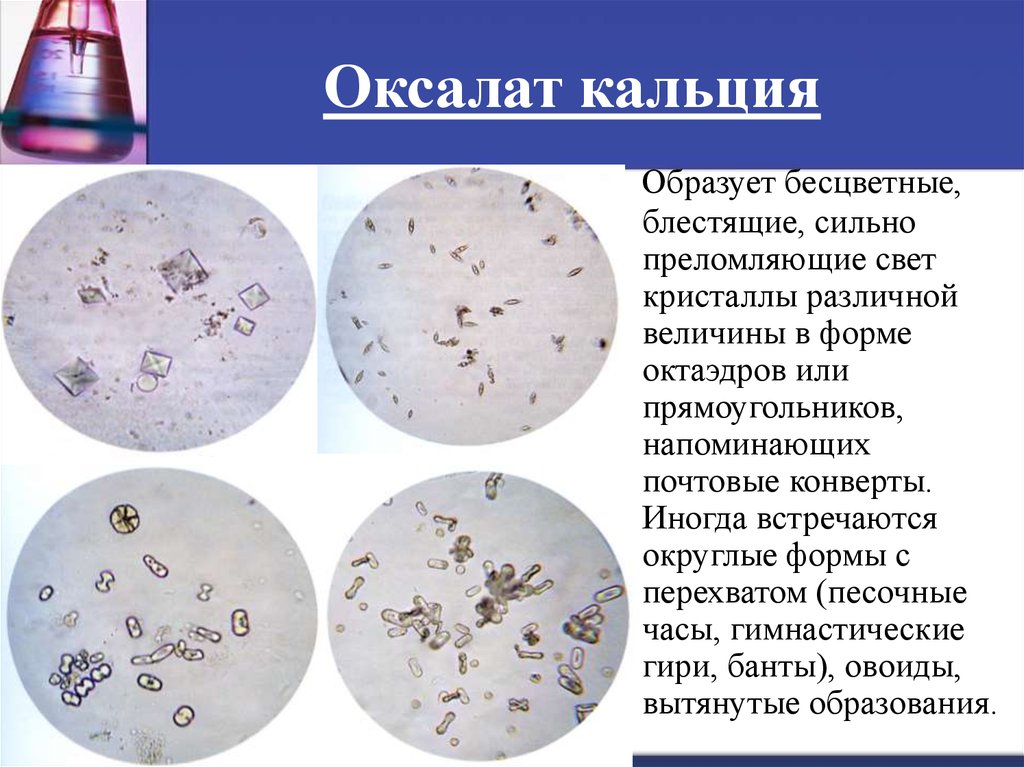
Поделиться этой статьёй
Рубрики: Болезни кошек |
автор redaktorporodakoshki
База знаний
1 июня 2017
Автор
Коновалова О. В.
свернуть
Содержание:
Состав мочи достаточно полно отображает процессы обмена веществ, происходящие в организме животного. Проведение лабораторного анализа позволяет выявить серьезные отклонения состояния здоровья, распознать заболевания мочеполовой системы, определить наличие инфекций или травм.
Общий анализ мочи с микроскопическим исследованием осадка назначается при многих заболеваниях кошек и собак, являясь информативным и достаточно простым для выполнения.
Иногда сбор выделений животного на исследование может быть затруднительным: кошки зачастую ходят в лотки с наполнителем, а собак выгуливают на улице. В таких случаях забор материала можно провести в клинике во время приема. Для этого применяют катетеризацию мочевого пузыря, либо отбирают мочу с помощью цистоцентеза (прокола мочевого пузыря иглой через брюшную полость). Последний метод считается наиболее информативным и качественным способом забора материала на анализ.
Результаты физических, химических и микроскопических исследований сводятся в таблицу. Их расшифровка дает возможность составить общую картину состояния организма животного. Опираясь на них, данные других анализов и обследований, опытный специалист ставит диагноз и назначает лечение.
Они исследуются методом органолептического анализа. Его суть заключается в оценке визуальных характеристик: цвета, запаха, консистенции, наличия видимых примесей.
Отмечаются такие показатели:
COL (цвет) — нормальным считается желтый и светло-желтый оттенок жидкости.
CLA (прозрачность) — у здоровых животных выделения полной прозрачности.
Наличие осадка — может присутствовать в небольших количествах.
Он формируется из нерастворимых солей, кристаллов, клеток эпителия (почек, уретры, мочевого пузыря, наружных половых органов), органических соединений, микроорганизмов. Большое количество осадка наблюдается при нарушениях обмена веществ, наличии болезней.
Дополнительно может отмечаться присутствие нехарактерного запаха, изменение консистенции.
Владелец животного должен обращать внимание на характер мочеиспускания и внешний вид выделений. При изменении цвета или запаха, появлении сгустков слизи или гноя, частиц крови при мочеиспускании необходимо показать собаку или кошку ветеринару.
Исследуются с применением анализатора. Этим методом проводится анализ состава выделенной жидкости на наличие и количество органических и химических веществ.
Этим методом проводится анализ состава выделенной жидкости на наличие и количество органических и химических веществ.
BIL (билирубин) — в норме у собак это вещество содержится в малых неопределяемых количествах. У кошек этого компонента в нормальном составе не присутствует.
Норма:
Собаки — отсутствует (следы).
Кошки — отсутствует.
Повышение показателя (билирубинурия) может свидетельствовать о заболеваниях печени, обструкции желчных протоков, нарушении гемолитических процессов.
URO (мочевина) — образуется в результате расщепления белков.
Норма:
Собаки — 3.5-9.2 ммоль/л.
Кошки — 5.4-12.1 ммоль/л.
Повышение показателя — свидетельство почечной недостаточности, белкового питания, острой гемолитической анемии.
Понижение содержания мочевины может указывать на недостаточное поступление белка, заболевания печени, почек.
KET (кетоновые тела) — в здоровом организме не выделяются.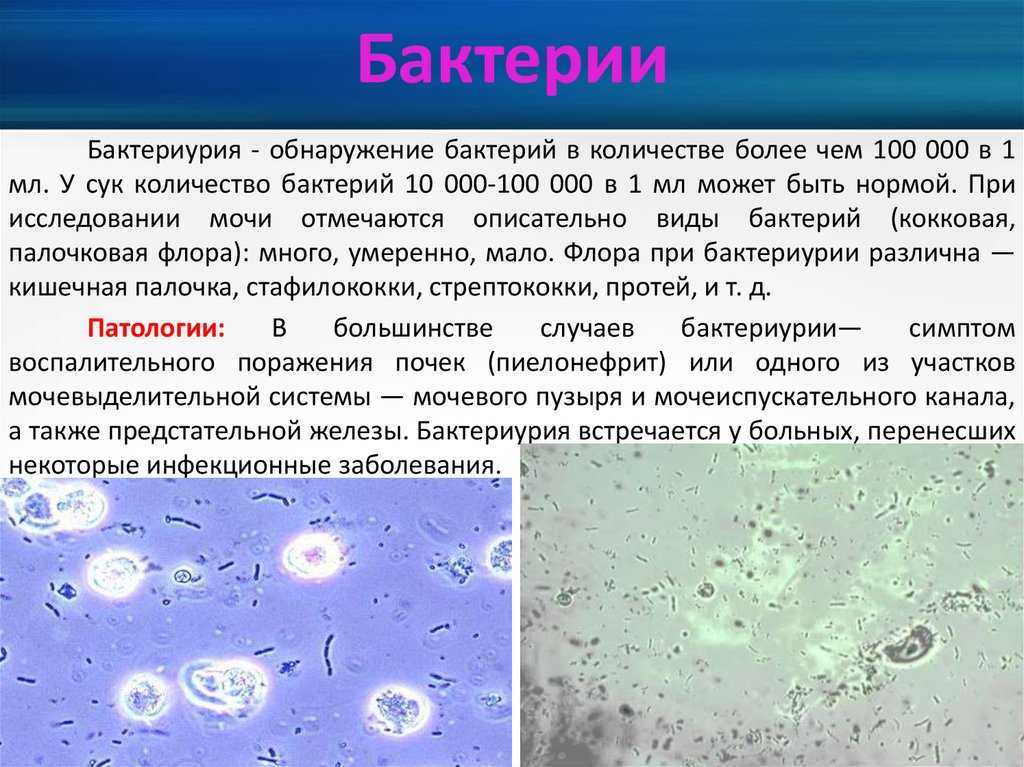
Наличие кетонов является результатом нарушений обмена веществ, возникающих из-за сахарного диабета, истощения, иногда как проявление острого панкреатита или обширных механических повреждений.
PRO (белок) — увеличение количества белковых соединений сопровождает большинство почечных заболеваний.
Норма:
Собаки — 0,3 г/л.
Кошки — 0,2 г/л.
Повышение уровня белка в моче сопровождает многие болезни почек. Оно может быть следствием мясной диеты или цистита. Зачастую требуется дополнительное комплексное исследование, позволяющее дифференцировать заболевание мочевыделительной системы.
NIT (нитриты) — у здоровых животных этих веществ в моче быть не должно, однако по ним не всегда можно достоверно судить о присутствии патогенной микрофлоры в мочевыводящих путях. Уточненный анализ покажет более точную картину.
Повышение содержания нитритов указывает на инфицирование тканей системы мочевыделения.
GLU (глюкоза) — у здорового животного это вещество отсутствует. Появление может быть спровоцировано стрессовым состоянием, что чаще наблюдается у кошек.
Появление может быть спровоцировано стрессовым состоянием, что чаще наблюдается у кошек.
Повышение уровня глюкозы является показателем сахарного диабета, для уточнения проводится анализ крови на сахар. Другими причинами глюкозурии могут быть: болезни поджелудочной, острая почечная недостаточность, гипертиреоз, гломерулонефрит, прием некоторых лекарственных препаратов.
pH (кислотность) — показатель концентрации свободных ионов водорода.
Изменения кислотности является одним из факторов, приводящих к образованию конкрементов в мочевыделительных путях. Отклонения показателя могут происходить при белковом перекорме, хроническом инфицировании мочевыводящих протоков, пиелитах, циститах, рвотных явлениях, диарее.
Норма:
Собаки и кошки — от 6,5 до 7,0.
S.G (плотность, удельный вес) — показывает концентрацию растворенных веществ. Анализ показателя важно проводить до начала лечения, для контроля при назначении капельниц и мочегонных медикаментов.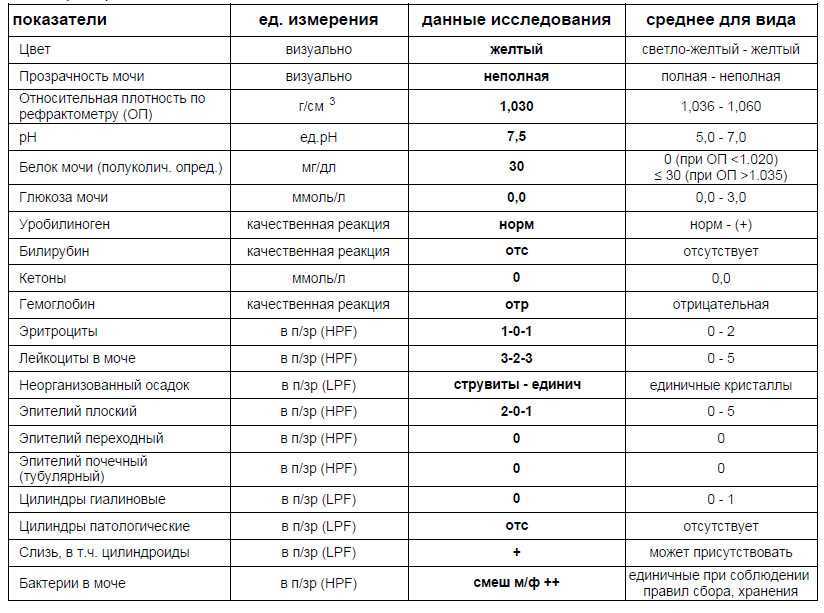
Норма:
Собаки — 1,015-1,025 г/мл.
Кошки — 1,020-1,025 г/мл.
Повышение свыше 1,030 и понижение до 1,007 свидетельствуют о функциональных нарушениях почек.
VTC (аскорбиновая кислота) — не депонируется организмом и при избытке выводится с мочой.
Норма:
Кошки и собаки — до 50 mg/dL.
Повышение вызывается переизбытком витамина при кормлении или приеме некоторых лекарственных средств.
Понижение связано с гиповитаминозом, несбалансированным питанием.
Она позволяет определить наличие некоторых заболеваний, не имеющих видимых симптомов. Помимо растворенных в моче веществ, ее состав дополнен твердыми кристаллами солей, клетками тканей, микроорганизмами. Их анализ позволяет составить максимально достоверную картину состояния здоровья животного.
Слизь — небольшое количество является результатом деятельности слизистых желез, принадлежащих мочевой и половой системам.
Повышение выделения слизи до образования сгустка сигнализирует о наличии цистита (воспаления стенки мочевого пузыря).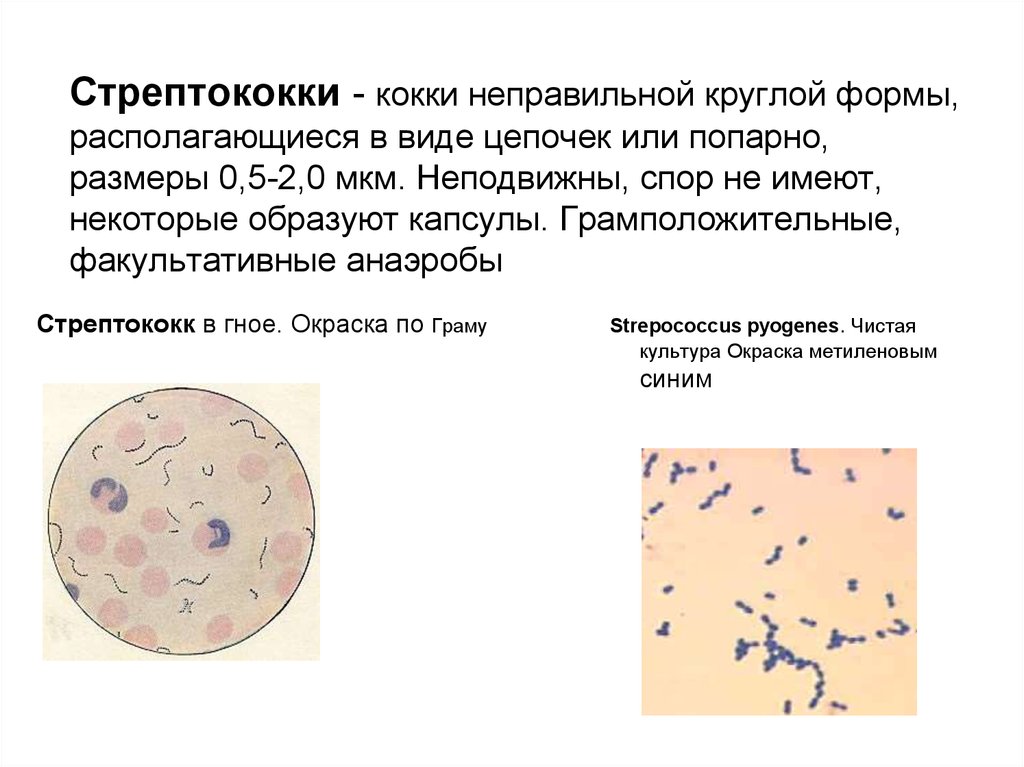
Жир (капельно) — может содержаться у здоровых животных, особенно кошек. Количество часто зависит от кормления.
Повышение связано с перекормом жирной пищей, иногда указывает на нарушение деятельности почек. Требует дополнительного исследования для уточнения диагноза.
Лейкоциты — у здорового животного единичные, до 3-х клеток в поле зрения при микроскопическом исследовании.
Повышение количества говорит о наличии воспаления или инфицирования мочевыводящих путей . Также может быть связано и с неправильным забором пробы.
Эритроциты — появляются в моче как результат кровотечения, возникающего в различных отделах мочеполовой системы.
Поэтому важно знать в какой порции мочи появилась кровь (вначале, в конце или на протяжении всего мочеиспускания).
Норма:
Допускается до 5 клеток.
Повышение эритроцитов (гематурия) или его производных (гемоглобина) приводит к окрашиванию мочи. Гематурия или гемоглобинурия в первой фазе мочеиспускания свидетельствует о повреждении мочевых протоков или прилегающих половых органов, а в финальной фазе — о поражении мочевого пузыря. Равномерное покраснение всей порции выделений может выявить травмы любых участков мочеполовой системы.
Равномерное покраснение всей порции выделений может выявить травмы любых участков мочеполовой системы.
Поверхностный эпителий — может появляться при некачественном заборе мочи, куда попали смывы с органов половой сферы.
Переходной эпителий — в норме не присутствует, его наличие говорит о воспалении мочевыводящих путей.
Почечный эпителий — в норме не присутствует, обнаруживается при заболеваниях почек.
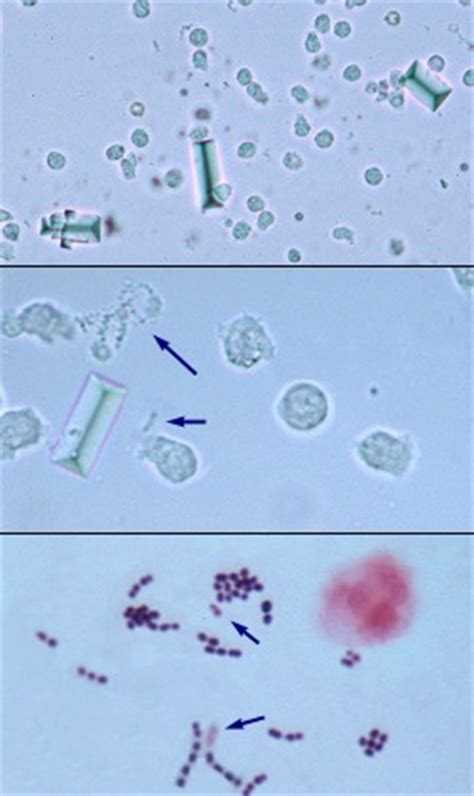
Кристаллы — представляют собой нерастворимые соли, которые могут обнаруживаться у здоровых животных без патологий.
Повышение количества наблюдается у животных, склонных к образованию камней. Однако это не является причиной назначения лечения без дополнительного исследования.
Бактерии — у здоровых животных моча стерильна. Обнаруживаться бактерии могут в неправильно взятых образцах, куда попадают смывы с прилегающих органов половой системы, а так же при инфицировании восходящих путей мочеполовой системы.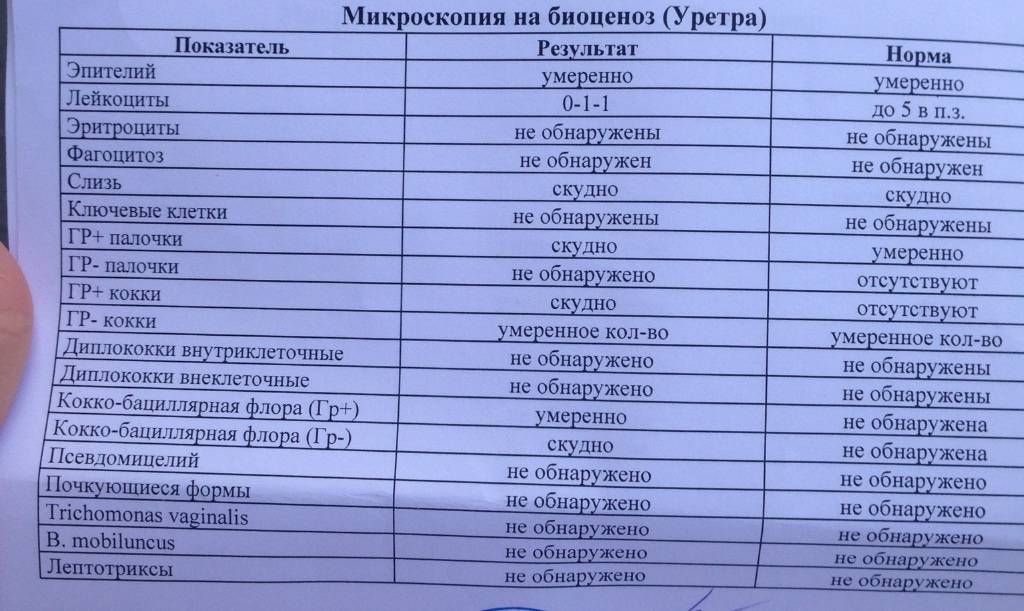
Сперматозоиды — попадают из половых органов при некачественном заборе мочи на анализ.
Цилиндры — при нормальном состоянии отсутствуют. Они имеют форму мочевых канальцев, являясь своеобразными пробками из скапливающихся в них органических структур различного происхождения, закупоривающими просветы и постепенно вымывающимися мочой.
Норма:
До 2 в поле микроскопа.
Повышение количества цилиндров происходит при заболевании мочевой системы. По их форме и происхождению диагностируют: явления застоя, процессы воспаления, обезвоживание, пиелонефриты, некрозы, поражения паренхимы и канальцев.
Общий анализ мочи животного с микроскопией осадка дает возможность врачу поставить предварительный диагноз, который должен быть подтвержден дополнительными исследованиями.
Обзор
. 2011 Январь; 187(1):18-22.
2011 Январь; 187(1):18-22.
doi: 10.1016/j.tvjl.2009.12.006. Epub 2009 30 декабря.
Аннет Литстер 1 , Мэри Томпсон, Сьюзен Мосс, Даррен Тротт
Обзор
Аннет Литстер и др. Вет Дж. 2011 Январь
2011 Январь
. 2011 Январь; 187(1):18-22.
doi: 10.1016/j.tvjl.2009.12.006. Epub 2009 30 декабря.
Аннет Литстер 1 , Мэри Томпсон, Сьюзан Мосс, Даррен Тротт
Хотя кошачья моча все чаще отправляется на бактериальный посев и тест на чувствительность в рамках более общей диагностической работы по целому ряду проявлений в ветеринарной практике, бактериальные инфекции мочевыводящих путей (ИМП) относительно редки из-за множества физических и иммунологических барьеров. к инфекции. Положительный посев мочи чаще всего получают от пожилых самок кошек, а история болезни может включать гематурию, дизурию и поллакиурию, или инфекция может быть скрытой. В анализе мочи обычно выявляют гематурию и пиурию, чаще всего культивируют Escherichia coli и грамположительные кокки. Большинство кошачьих ИМП можно успешно лечить с помощью перорального приема амоксициллина или амоксициллина/клавулановой кислоты в течение не менее 14 дней, но распространенность резистентности к противомикробным препаратам среди инфицированных видов бактерий вызывает растущую озабоченность. В настоящее время нет убедительной информации о безопасности и эффективности альтернативных терапевтических средств для лечения кошачьих ИМП.
к инфекции. Положительный посев мочи чаще всего получают от пожилых самок кошек, а история болезни может включать гематурию, дизурию и поллакиурию, или инфекция может быть скрытой. В анализе мочи обычно выявляют гематурию и пиурию, чаще всего культивируют Escherichia coli и грамположительные кокки. Большинство кошачьих ИМП можно успешно лечить с помощью перорального приема амоксициллина или амоксициллина/клавулановой кислоты в течение не менее 14 дней, но распространенность резистентности к противомикробным препаратам среди инфицированных видов бактерий вызывает растущую озабоченность. В настоящее время нет убедительной информации о безопасности и эффективности альтернативных терапевтических средств для лечения кошачьих ИМП.
2009 Elsevier Ltd. Все права защищены.
Инфекция мочевыводящих путей и субклиническая бактериурия у кошек: обновленная клиническая информация.
Дорш Р., Тайхманн-Кноррн С., Сьетне Лунд Х. Дорш Р. и соавт. J Feline Med Surg. 2019 ноябрь;21(11):1023-1038. дои: 10.1177/1098612X19880435. Epub 2019 10 октября. J Feline Med Surg. 2019. PMID: 31601143 Бесплатная статья ЧВК. Обзор.
Скрытые бактериальные инфекции нижних мочевыводящих путей у кошек – результаты анализа мочи и посевов.
Литстер А, Мосс С, Плателл Дж., Тротт Д.Дж. Помет А и др. Вет микробиол. 2009 14 апреля; 136 (1-2): 130-4. doi: 10.1016/j.vetmic.2008.10.019. Epub 2008 28 октября. Вет микробиол. 2009. PMID: 1
89[Значительная бактериурия у кошек: инфекция мочевыводящих путей и субклиническая бактериурия - текущий обзор].
Тейхманн-Кноррн С., Дорш Р. Тайхманн-Кноррн С. и соавт. Tierarztl Prax Ausg K Kleintiere Heimtiere. 2018 авг; 46 (4): 247-259. doi: 10.15654/ТПК-180521. Epub 2018 27 августа. Tierarztl Prax Ausg K Kleintiere Heimtiere. 2018. PMID: 30149407 Обзор. Немецкий.
Тайхманн-Кноррн С. и соавт. Tierarztl Prax Ausg K Kleintiere Heimtiere. 2018 авг; 46 (4): 247-259. doi: 10.15654/ТПК-180521. Epub 2018 27 августа. Tierarztl Prax Ausg K Kleintiere Heimtiere. 2018. PMID: 30149407 Обзор. Немецкий.
Патогены мочевыводящих путей кошек: распространенность видов бактерий и устойчивость к противомикробным препаратам за 10-летний период.
Дорш Р., фон Вопелиус-Фельдт С., Вольф Г., Штраубингер Р.К., Хартманн К. Дорш Р. и соавт. Ветеринар Рек. 2015 21 февраля; 176(8):201. дои: 10.1136/vr.102630. Epub 2014 28 октября. Ветеринар Рек. 2015. PMID: 25351232
Цистоцентез необходим для надежной диагностики инфекций мочевыводящих путей у кошек.
ван Дайкерен Э., ван Лаар П. , Хауэрс Д.Дж. ван Дуйкерен Э. и соавт. Tijdschr Diergeneeskd. 2004 15 июня; 129(12):394-6. Tijdschr Diergeneeskd. 2004. PMID: 15232961
, Хауэрс Д.Дж. ван Дуйкерен Э. и соавт. Tijdschr Diergeneeskd. 2004 15 июня; 129(12):394-6. Tijdschr Diergeneeskd. 2004. PMID: 15232961
Посмотреть все похожие статьи
Связь между сигналом о случае и диагностикой заболевания мочевого пузыря у австралийских кошек и собак.
Джонс Э., Алауна Дж., Томпсон М., Аллавена Р. Джонс Э. и др. Джей Вет Диагн Инвест. 2021 май;33(3):498-505. дои: 10.1177/10406387211004008. Epub 2021 2 апр. Джей Вет Диагн Инвест. 2021. PMID: 33797303 Бесплатная статья ЧВК.
Связь бактериурии с выживаемостью и прогрессированием заболевания у кошек с азотемической хронической болезнью почек.
Хиндар С., Чанг Ю.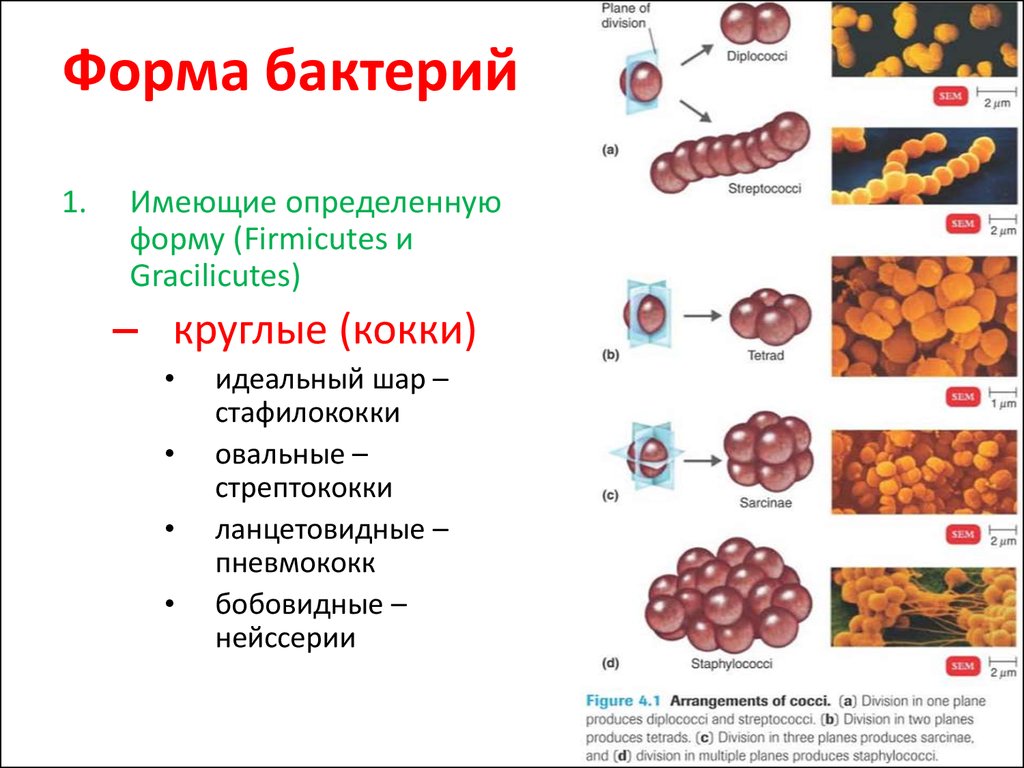 М., Сайм Х.М., Джепсон Р.Э. Хиндар С и др. J Vet Intern Med. 2020 ноябрь;34(6):2516-2524. дои: 10.1111/jvim.15918. Epub 2020 5 октября. J Vet Intern Med. 2020. PMID: 33016500 Бесплатная статья ЧВК.
М., Сайм Х.М., Джепсон Р.Э. Хиндар С и др. J Vet Intern Med. 2020 ноябрь;34(6):2516-2524. дои: 10.1111/jvim.15918. Epub 2020 5 октября. J Vet Intern Med. 2020. PMID: 33016500 Бесплатная статья ЧВК.
Инфекция мочевыводящих путей и субклиническая бактериурия у кошек: обновленная клиническая информация.
Дорш Р., Тайхманн-Кноррн С., Сьетне Лунд Х. Дорш Р. и соавт. J Feline Med Surg. 2019 ноябрь;21(11):1023-1038. дои: 10.1177/1098612X19880435. Epub 2019 10 октября. J Feline Med Surg. 2019. PMID: 31601143 Бесплатная статья ЧВК. Обзор.
Генетическая структура, устойчивость к противомикробным препаратам и частота связанных с человеком типов последовательностей Escherichia coli среди фекальных изолятов здоровых собак и кошек, живущих в Канберре, Австралия.
Борн Дж. А., Чонг В. Л., Гордон Д. М. Борн Дж.А. и соавт. ПЛОС Один. 2019 4 марта; 14 (3): e0212867. doi: 10.1371/journal.pone.0212867. Электронная коллекция 2019. ПЛОС Один. 2019. PMID: 30830915 Бесплатная статья ЧВК.
Обструктивный бактериальный цистит после цистотомии у персидской кошки.
Никусефат З., Хашемния М., Джавдани М., Гашгаи А. Никоузефат З. и соавт. Форум ветеринарной службы. 2018 Весна;9(2):199-203. doi: 10.30466/ВРФ.2018.30822. Epub 2018 15 июня. Форум ветеринарной службы. 2018. PMID: 30065810 Бесплатная статья ЧВК.
Просмотреть все статьи "Цитируется по"
Ir Vet J. 2015; 68 (1): 2.
2015; 68 (1): 2.
Опубликовано онлайн 2015 2015 февраля. DOI: 10.1186/S13620-015-0030-9
, , , , , , , и
9151, . Примечания к статье Информация об авторских правах и лицензиях Отказ от ответственностиЦелью данного исследования было определение видов бактерий, выявленных у 61 кошки с инфекцией нижних мочевыводящих путей (ИНМП), и их чувствительности к цефовецину in vitro .
Также сообщалось о клинических признаках и окончательном клиническом диагнозе кошек с подтвержденной ИМП. После физического осмотра кошек образцы мочи, содержащие ≥5-6 лейкоцитов при микроскопической оценке, были культивированы с использованием бактериологических методов. Изоляты идентифицировали обычными микробиологическими методами и тестировали на чувствительность in vitro с использованием метода дисковой диффузии Кирби-Бауэра, рекомендованного Институтом клинических лабораторных стандартов. Бактериальный рост наблюдался в 16 из 61 образца мочи. Тесты на чувствительность к противомикробным препаратам показали, что 13 из 16 (81%) изолятов были чувствительны к цефовецину. Наиболее часто выделяемая бактерия от кошек с признаками инфекции нижних мочевыводящих путей была Кишечная палочка .
Бактериальный рост наблюдался в 16 из 61 образца мочи. Тесты на чувствительность к противомикробным препаратам показали, что 13 из 16 (81%) изолятов были чувствительны к цефовецину. Наиболее часто выделяемая бактерия от кошек с признаками инфекции нижних мочевыводящих путей была Кишечная палочка .
Цефовецин оказался эффективным у кошек с ИНМП. Поскольку цефовецин является новым противомикробным препаратом в ветеринарии, исследований посева мочи кошек с ИНМП проведено всего несколько. Это первое исследование in vitro активности цефовецина в отношении бактериальных изолятов от кошек с инфекциями нижних отделов мочевыводящих путей в Стамбуле, Турция.
Ключевые слова: Кошка, инфекция мочевыводящих путей, посев мочи, чувствительность к противомикробным препаратам, цефовецин
Инфекции нижних мочевыводящих путей (ИНМП) редко наблюдаются у кошек, собак и людей. Различные заболевания нижних мочевыводящих путей могут предрасполагать к оппортунистическим инфекциям как осложнению основного заболевания или его лечения, а первопричиной могут быть бактерии [1].
Посев мочи является золотым стандартом для подтверждения диагноза инфекции мочевыводящих путей (ИМП). Образец мочи, используемый для этой цели, должен быть получен путем цистоцентеза, чтобы избежать бактериального загрязнения флорой нижних отделов мочеполового тракта [2].
При инфекциях мочевыводящих путей у кошек и собак чаще всего выделяют следующие виды бактерий: Escherichia coli, Proteus spp., Staphylococcus spp. и Streptococcus spp., хотя распространенность различных видов значительно различалась [3,4].
Цефалоспорины принадлежат к группе бета-лактамных антибиотиков и первоначально получены путем гидролиза природного соединения цефалоспорина С. Этот класс обладает бактерицидным действием и действует путем ингибирования синтеза пептидогликанового слоя клеточной стенки бактерий путем связывания с пенициллин-связывающий белок (PBP) [5].
Цефовецин натрия [Convenia®; Здоровье животных Пфайзер; США] представляет собой недавно разработанный полусинтетический инъекционный цефалоспорин третьего поколения с расширенным спектром действия, вводимый в дозе 8 мг/кг подкожно (п/к) для лечения ИМП и инфекций кожи и мягких тканей у собак и кошек, и он был одобрен для подкожные (п/к) инъекции кошкам с 2006 г. в ЕС и с 2008 г. в США [4,6-9].
в ЕС и с 2008 г. в США [4,6-9].
Цефалоспорины третьего поколения, как правило, менее активны, чем препараты первого или второго поколения, в отношении грамположительных микроорганизмов (например, Streptococcus spp. или Staphylococcus spp.) [5]. Stegemann и др. [4] сообщили, что цефовецин показал хорошую активность в отношении грамотрицательных микроорганизмов, выделенных от собак и кошек, в том числе Escherichia coli, Pasteurella multocida, Klebsiella spp. (включая K. pneumonia ), Enterobacter spp. и анаэробно-растущие патогены Fusobacterium spp. , Bacteriodes spp., Prevotella oralis . Однако он не был эффективен против большинства Pseudomonas aeruginosa изолятов.
Целью данного исследования было определение видов бактерий, выделенных от кошек с ИНМП, и их чувствительности к цефовецину in vitro . Также сообщалось о клинических признаках и окончательном клиническом диагнозе кошек с подтвержденной ИНМП.
В этом исследовании 90 кошек с одним или несколькими клиническими симптомами со стороны мочевыводящих путей, такими как странгурия, гематурия, поллакиурия, неадекватное мочеиспускание, чрезмерное облизывание половых органов и частые и/или длительные попытки мочеиспускания, были обследованы в отделении. внутренних болезней факультета ветеринарной медицины Стамбульского университета и их анамнеза. Общий анализ крови (ОАК), биохимический анализ сыворотки крови (глюкоза сыворотки, азот мочевины крови (АМК), креатинин, аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ)) и анализы мочи были выполнены у всех пациентов. Двадцать девять кошек были исключены из исследования, поскольку антимикробное лечение уже было начато в частных ветеринарных клиниках до нашего медицинского осмотра. В исследование была включена 61 кошка без антимикробного лечения с наличием ≥5-6 лейкоцитов при микроскопическом исследовании мочи. При обследовании основное внимание уделялось наличию пиурии (≥5 лейкоцитов/большое увеличение (объектив 40x; поле с высоким увеличением, (hpf)), которые были показателем ИНМП.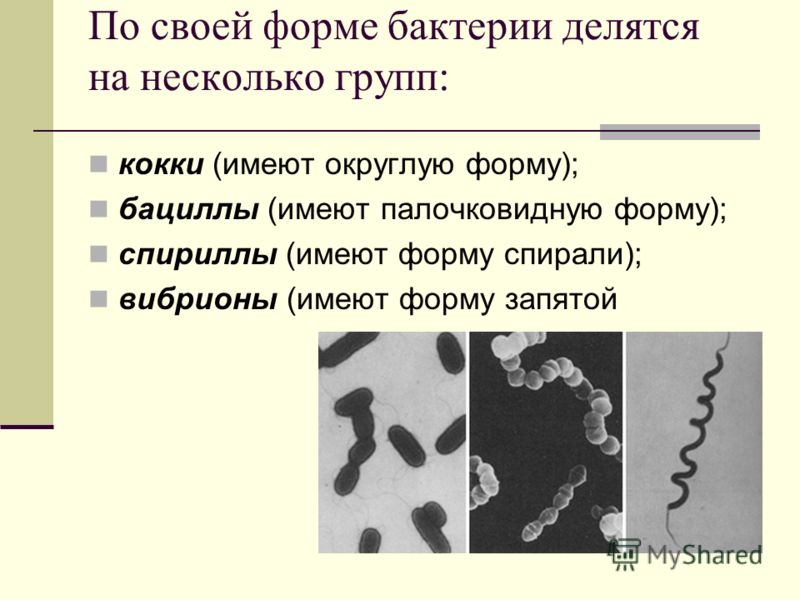 Кошки в выборке были разных пород: смешанные (n :38), персидская (n:11), сиамская (n:5), турецкий ван (n:3), турецкая ангора (n:4).Сорок один кот был самцом, 20 кошек были самками.Пять кошек были в возрасте одного года или младше, 38 в возрасте от 2 до 7 лет и 18 в возрасте 8 лет и старше. Образцы мочи объемом 5 мл были собраны с помощью цистоцентеза под ультразвуковым контролем. Кошки были зафиксированы в положении лежа на боку, каудальная область живота была очищена спиртом, затем была введена игла. Образцы мочи для посева и тестов на чувствительность к противомикробным препаратам были отправлены в лабораторию в течение 1 часа и хранились в холодильных камерах.
Кошки в выборке были разных пород: смешанные (n :38), персидская (n:11), сиамская (n:5), турецкий ван (n:3), турецкая ангора (n:4).Сорок один кот был самцом, 20 кошек были самками.Пять кошек были в возрасте одного года или младше, 38 в возрасте от 2 до 7 лет и 18 в возрасте 8 лет и старше. Образцы мочи объемом 5 мл были собраны с помощью цистоцентеза под ультразвуковым контролем. Кошки были зафиксированы в положении лежа на боку, каудальная область живота была очищена спиртом, затем была введена игла. Образцы мочи для посева и тестов на чувствительность к противомикробным препаратам были отправлены в лабораторию в течение 1 часа и хранились в холодильных камерах.
Рентгенография брюшной полости и ультразвуковое исследование также выполнялись для диагностики основных заболеваний/расстройств мочевыводящих путей у кошек. Ультрасонографию брюшной полости выполняли с использованием конвексного датчика 3,75 МГц (Schimadzu 350-A, Shimadzu Corporation, Киото, Япония).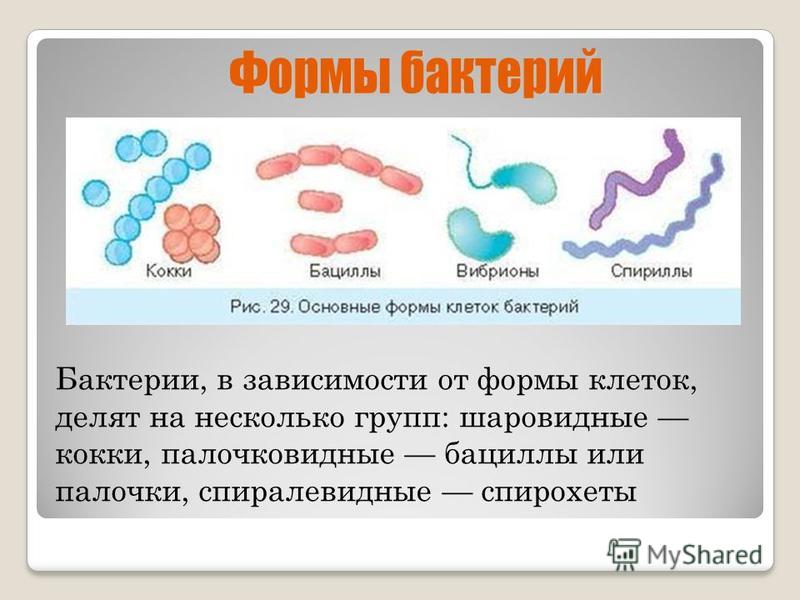
Образцы отправлены на бактериологическое исследование в лабораторию кафедры микробиологии Стамбульского университета, факультет ветеринарной медицины. Образцы мочи инокулировали на питательный агар с добавлением 7% овечьей крови (кровяной агар) и чашки с агаром МакКонки. В то время как чашки с агаром МакКонки инкубировали в аэробных условиях, чашки с кровяным агаром инкубировали в аэробных и микроаэробных условиях при 37°C в течение 7 дней. Колонии исследовали макроскопически, а затем микроскопически с использованием окрашивания по Граму. Биохимическая идентификация проводилась обычными методами, и все изоляты были подтверждены с помощью систем API (BioMérieux, SA, Marcy I’Etolie, Франция) [10,11]. Количество бактерий более 10 3 КОЕ/мл считалось диагностическим признаком ИМП [9]. Культуры без роста через 7 дней интерпретировались как отрицательные.
Тесты на чувствительность к антибиотикам проводились по методу Кирби-Бауэра, рекомендованному Институтом клинических лабораторных стандартов (CLSI) для выбора оптимального противомикробного препарата для лечения [12]. Измеряли зону ингибирования вокруг диска (30 мкг цефовецина). Зона торможения ≥ 23 мм считалась восприимчивой, 20–22 мм – промежуточной и ≤ 19 мм.мм как стойкий [6,12].
Измеряли зону ингибирования вокруг диска (30 мкг цефовецина). Зона торможения ≥ 23 мм считалась восприимчивой, 20–22 мм – промежуточной и ≤ 19 мм.мм как стойкий [6,12].
Результаты были проанализированы с помощью программы SPSS 13.0. Критерий хи-квадрат использовался для сравнения гендерных и возрастных групп в отношении бактериального роста. Различия считались достоверными при p < 0,05.
Наиболее частыми клиническими признаками бактериальной инфекции нижних мочевыводящих путей у кошек были поллакиурия (n = 41), сопровождаемая странгурией и гематурией соответственно.
Нарушения и количество пораженных кошек приведены в таблице. У шестнадцати кошек с положительным посевом были диагностированы следующие состояния: уретральные бляшки (n:4), кошачий идиопатический цистит (n:1), геморрагический цистит (n:2), камни мочевого пузыря (n:1), острая почечная недостаточность (n:1). :3), хроническая почечная недостаточность (n:2), сахарный диабет (n:1), другие заболевания (n:2). Окончательный диагноз был поставлен после сбора анамнеза, физического осмотра, анализа крови и мочи, медицинской визуализации и посева мочи.
:3), хроническая почечная недостаточность (n:2), сахарный диабет (n:1), другие заболевания (n:2). Окончательный диагноз был поставлен после сбора анамнеза, физического осмотра, анализа крови и мочи, медицинской визуализации и посева мочи.
Заболевания/расстройства, выявленные у 61 кошки с признаками поражения нижних мочевыводящих путей
| Заболевания | Количество кошек | Положительные по культуре кошки |
|---|---|---|
| Геморрагический цистит | 8 | 2 |
| Полиповидный цистит | 3 | - |
| Идиопатический цистит кошек | 4 | 1 |
| Переходно-клеточная карцинома (TCC) | 2 | - |
| Уретральная пластинка | 14 | 4 |
| Камни мочевого пузыря | 3 | 1 |
| Уретрит | 2 | - |
| Острая почечная недостаточность | 8 | 3 |
| Хроническая почечная недостаточность | 6 | 2 |
| Сахарный диабет | 2 | 1 |
| Другие болезни | 9 | 2 |
Открыть в отдельном окне
У всех животных, участвовавших в исследовании, показатели ОАК находились в пределах нормы. В то же время у 16 культур-позитивных кошек лейкоцитоз не наблюдался. У каждого больного определяли биохимические показатели сыворотки крови (глюкоза сыворотки, азот мочевины крови, креатинин, аланинаминотрансфераза, аспартатаминотрансфераза). В нашем исследовании эти параметры оказались незначимыми.
В то же время у 16 культур-позитивных кошек лейкоцитоз не наблюдался. У каждого больного определяли биохимические показатели сыворотки крови (глюкоза сыворотки, азот мочевины крови, креатинин, аланинаминотрансфераза, аспартатаминотрансфераза). В нашем исследовании эти параметры оказались незначимыми.
В мочевом пузыре у кошек с диагнозом геморрагический цистит наблюдалось образование кровяных сгустков. Эхогенность сгустков вариабельна (от гипо- до гипер-), стенка мочевого пузыря утолщена. Камни мочевого пузыря визуализировались гиперэхогенными, а дистальные тени определялись. Стенка мочевого пузыря также была утолщена у кошек с диагнозом почечная недостаточность и цистит. Никаких отклонений от нормы у кошек с уретритом обнаружено не было. Сонографический вид переходно-клеточного рака был неправильным, его форма была неправильной, а эхогенность казалась негомогенной. Результаты УЗИ соответствуют нашему диагнозу.
Количество лейкоцитов, обнаруженное при микроскопическом исследовании мочи, обобщено в таблице.
Количество лейкоцитов, обнаруженных при микроскопическом исследовании мочи
| Лейкоциты/HPF | Количество кошек | кошки с положительным посевом |
|---|---|---|
| 5-6 | 11 | 2 |
| 7-10 | 6 | 1 |
| 10-15 | 23 | 5 |
| ≥15 | 21 | 8 |
Открыто в отдельном окне
Бактериальный рост наблюдался в 16 из 61 (26,2%) образцов мочи кошек с содержанием лейкоцитов ≥ 5–6 лейкоцитов).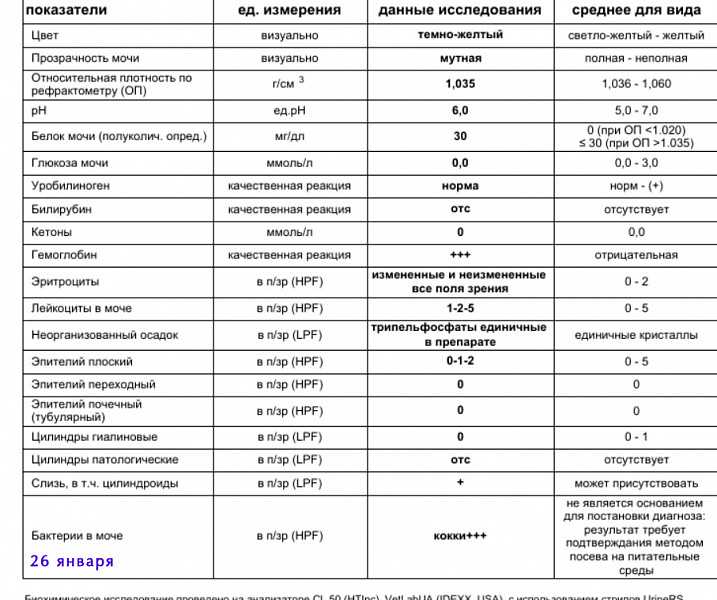 Все изоляты представляли собой чистые культуры.
Все изоляты представляли собой чистые культуры.
Открыть в отдельном окне
Тип и количество видов бактерий, выделенных у кошек.
Бактериальный рост наблюдался в 5 из 20 (25%) проб мочи самок и в 11 из 41 (26,8%) проб самцов ( p > 0,05). Три из пяти кошек (60%) с бактериальными ИНМП были в возрасте 1 года или младше, 9/38 (23,6%) в возрасте 2–7 лет и 4/18 (22,2%) в возрасте 8 лет и старше ( p > 0,05) . В этом исследовании не было обнаружено существенной разницы между самками и самцами кошек с бактериальной ИНМП (9).0167 p = 0,879). Различия между возрастными группами также были недостоверны ( p = 0,200).
Результаты тестов на чувствительность к противомикробным препаратам показали, что 13 из 16 (81%) изолятов были чувствительны к цефовецину. Изоляты E. avium и S. epidermidis были устойчивыми, а изолят Arcanobacterium renale был промежуточным.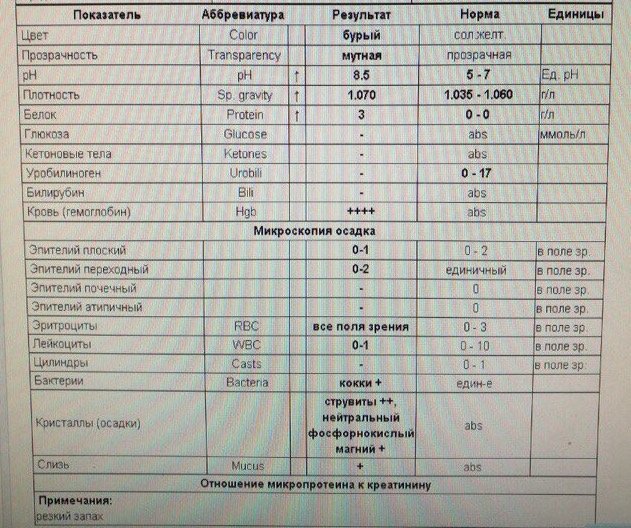
Неправильная терапия заболеваний мочевыводящих путей, чрезмерное и неправильное использование противомикробных препаратов может иметь негативные последствия для здоровья пациентов (например, неспособность вылечить инфекцию), распределения ресурсов (например, необходимость повторного или длительного лечения) и общественного здравоохранения (например, резистентность к противомикробным препаратам). ) и может вызвать озабоченность со стороны регулирующих органов (например, использование противомикробных препаратов) [13]. Антимикробная активность цефовецина аналогична активности других цефалоспориновых антибиотиков, которые обладают низкой токсичностью и хорошей активностью в отношении многих грамположительных и грамотрицательных аэробных бактерий [6].
Бактериальные инфекции мочевыводящих путей (ИМП) у кошек встречаются относительно редко [14]. Исследования кошек с клиническими признаками заболевания нижних мочевыводящих путей (дизурия, странгурия, поллакиурия) последовательно показали, что общая распространенность положительных бактериальных культур мочи составляет <3% [2,15].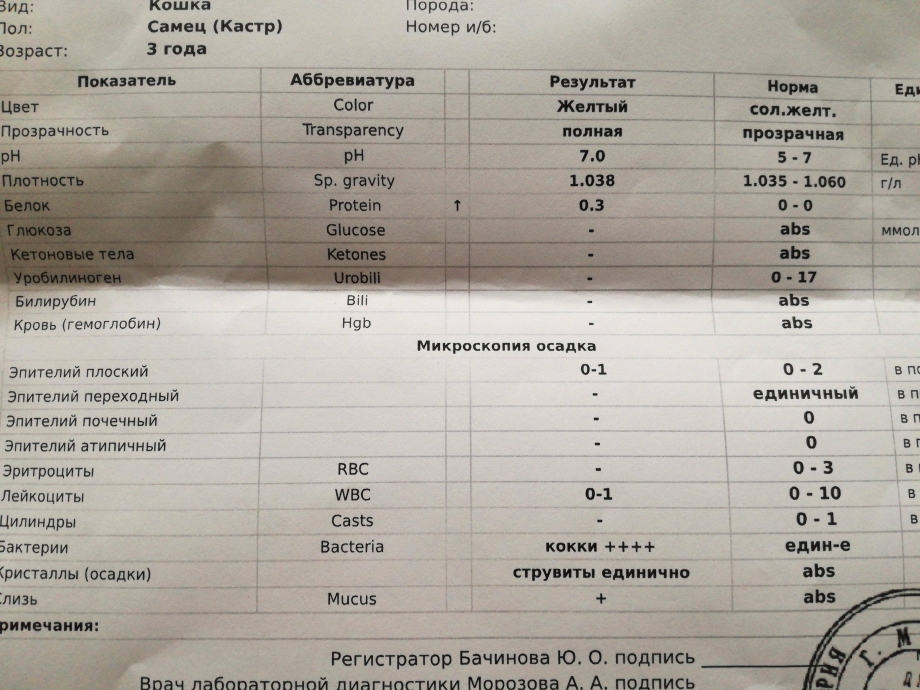 В некоторых исследованиях сообщалось о гораздо более высоких показателях распространенности (15–43%) у кошек, у которых защитные механизмы мочевыводящих путей были нарушены в результате воздействия других заболеваний и/или лечения [2]. В этом исследовании рост бактерий наблюдался в 26,2% образцов мочи кошек с ≥ 5–6 лейкоцитами. Наши результаты в значительной степени подтверждают результаты, полученные Weese et al. [15].
В некоторых исследованиях сообщалось о гораздо более высоких показателях распространенности (15–43%) у кошек, у которых защитные механизмы мочевыводящих путей были нарушены в результате воздействия других заболеваний и/или лечения [2]. В этом исследовании рост бактерий наблюдался в 26,2% образцов мочи кошек с ≥ 5–6 лейкоцитами. Наши результаты в значительной степени подтверждают результаты, полученные Weese et al. [15].
Бактериурия обычно наблюдается у пожилых кошек [16]. В нашем исследовании процент молодых кошек (возраст ≤1 года) был самым высоким. Большинство молодых кошек в нашей выборке проводили время как в помещении, так и на улице. Обычно они охотились и обычно пили воду из цветочных чаш и прудов. Эти факторы риска и их тесный контакт с бездомными кошками, возможно, способствовали высокой распространенности проблем с мочеиспусканием в этой возрастной группе по сравнению с домашними и пожилыми кошками.
Было показано, что анализ мочи является полезным индикатором ИМП.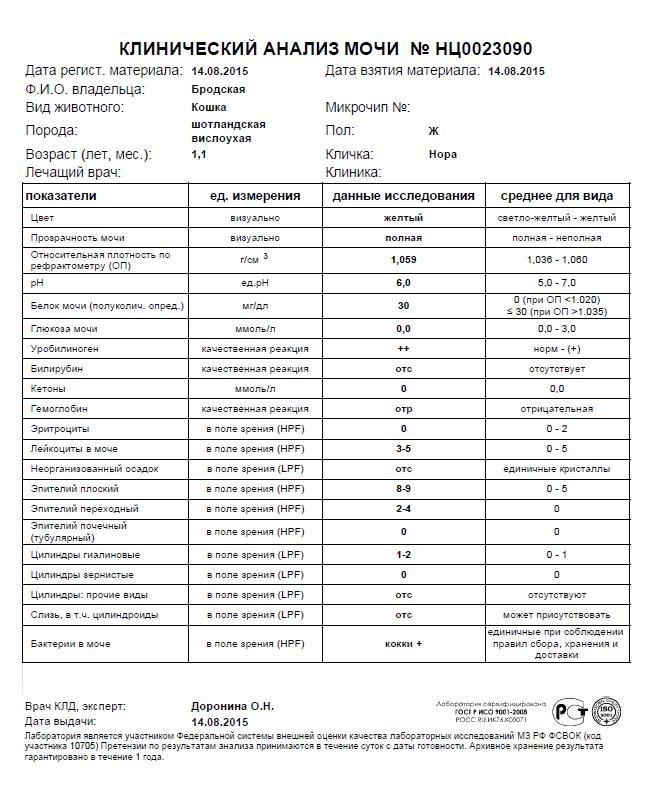 Сообщалось, что наиболее часто выделяемыми бактериями кошек с инфекциями мочевыводящих путей являются Escherichia coli, Enterococcus spp., Staphylococcus spp. и Streptococcus spp. [4,6,9]. Наши результаты подтверждают эти выводы.
Сообщалось, что наиболее часто выделяемыми бактериями кошек с инфекциями мочевыводящих путей являются Escherichia coli, Enterococcus spp., Staphylococcus spp. и Streptococcus spp. [4,6,9]. Наши результаты подтверждают эти выводы.
Правильная и своевременная диагностика имеет решающее значение для лечения инфекций нижних мочевыводящих путей, а также для выбора соответствующих противомикробных препаратов и препаратов. Цефовецин был специально разработан для ветеринарной практики как цефалоспорин третьего поколения пролонгированного действия с продолжительностью действия 14 дней. Стегеманн и др. [4] сообщили, что цефовецин проявлял широкую активность в отношении ряда грамотрицательных патогенов и не был активен in vitro в отношении P. aeruginosa . Верник и Мюнтенер [5] сообщили, что цефовецин не проявлял бактерицидной активности в отношении Enterococcus spp. но он активен в отношении Arcanobacterium renale. Наши результаты (81% изолятов, чувствительных к цефовецину) согласуются с этими выводами.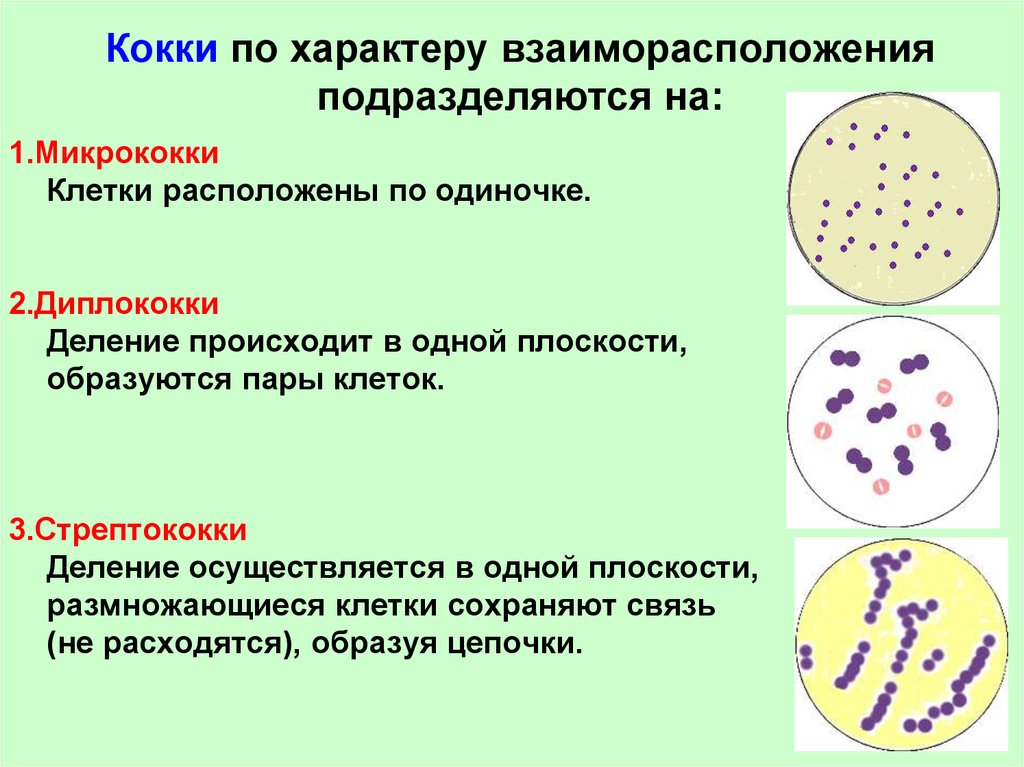 Однако было обнаружено, что изолят E. avium устойчив, а изолят Arcanobacterium renale имеет промежуточную чувствительность к цефовецину. Стегеманн и др. [4] сообщили, что цефовецин не был заметно активен в отношении Enterococcus spp., хотя в этом исследовании изолятов E. faecalis оказались чувствительными in vitro. В то время как литература свидетельствует о хорошей активности цефовецина против коагулазонегативных стафилококков, в этом исследовании изолят S. epidermidis оказался устойчивым к цефовецину [4,8].
Однако было обнаружено, что изолят E. avium устойчив, а изолят Arcanobacterium renale имеет промежуточную чувствительность к цефовецину. Стегеманн и др. [4] сообщили, что цефовецин не был заметно активен в отношении Enterococcus spp., хотя в этом исследовании изолятов E. faecalis оказались чувствительными in vitro. В то время как литература свидетельствует о хорошей активности цефовецина против коагулазонегативных стафилококков, в этом исследовании изолят S. epidermidis оказался устойчивым к цефовецину [4,8].
Известно, что противомикробные препараты являются краеугольным камнем терапии ИНМП. Несмотря на высокую стоимость цефовецина в Турции, в этом исследовании обсуждались его эффективность и полезность. Цефовецин является одним из противомикробных препаратов, которые можно использовать при инфекциях нижних мочевыводящих путей, и его легко вводить одной инъекцией.
Работа выполнена при поддержке отдела координации научно-исследовательских проектов Стамбульского университета.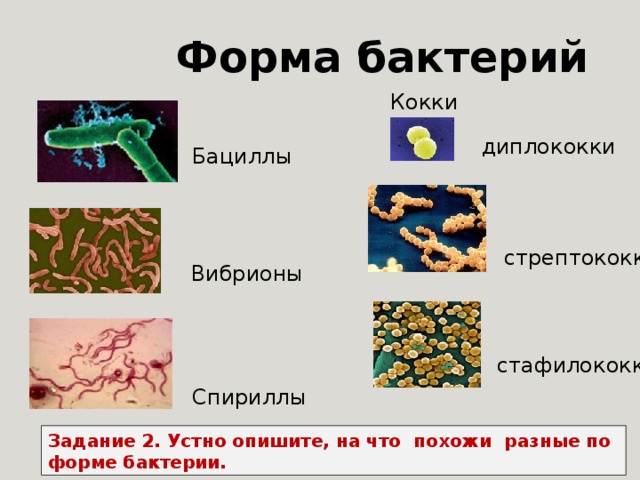 Проект № 38792. Авторы выражают благодарность д-ру Бюленту ЭКИЗ за статистический анализ.
Проект № 38792. Авторы выражают благодарность д-ру Бюленту ЭКИЗ за статистический анализ.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад авторов
BD, BBK, BDS, BÇ и AK разработали исследование; BD и AB собрали клинические данные; БД, АК, ББК, БДС и МЭО сделали все доработки; ББК, БДС, БЗ и СИ провели микробиологические исследования. Все авторы участвовали в подготовке рукописи, прочитали и одобрили окончательный вариант рукописи.
Banu Dokuzeylül, электронная почта: rt.ude.lubnatsi@lulye9b.
Берен Башаран Кахраман, электронная почта: rt.ude.lubnatsi@nereb.
Альпер Байракал, электронная почта: moc.liamg@lakaryabrepla.
Belgi Diren Siğirci, электронная почта: rt.ude.lubnatsi@sigleb.
Баран Челик, электронная почта: [email protected].
Серкан Икиз, электронная почта: rt.ude.lubnatsi@res.
Абдулла Каяр, электронная почта: rt. ude.lubnatsi@rayak.
ude.lubnatsi@rayak.
М Эрман О.Р., электронная почта: rt.ude.lubnatsi@ronamre.
1. Лис Г.Э. Бактериальные инфекции мочевыводящих путей. Ветеринарная клиника North Am Small Anim Pract. 1996;26(2):297–304. doi: 10.1016/S0195-5616(96)50209-3. [PubMed] [CrossRef] [Google Scholar]
2. Литстер А., Томпсон М., Мосс С., Тротт Д. Бактериальные инфекции мочевыводящих путей кошек: обновленная информация о развивающейся клинической проблеме. Вет Дж. 2011; 187:18–22. doi: 10.1016/j.tvjl.2009.12.006. [PubMed] [CrossRef] [Google Scholar]
3. Ling GV, Norris CR, Franti CE, Eisele PH, Johnson DL, Ruby AL, et al. Взаимосвязь распространенности микроорганизмов, метода сбора образцов и возраста хозяина, пола и породы среди 8 354 собак с инфекциями мочевыводящих путей (1969–1995) J Vet Intern Med. 2001;15(4):341–7. [PubMed] [Google Scholar]
4. Stegemann MR, Passmore CA, Sherington J, Lindeman CJ, Papp G, Weigel DJ, et al. Антимикробная активность и спектр действия цефовецина, нового цефалоспорина расширенного спектра действия, в отношении патогенов, полученных от собак и кошек в Европе и Северной Америке.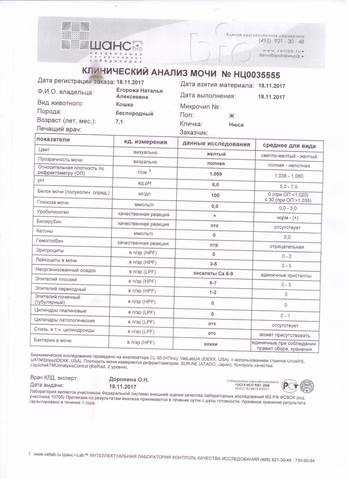 Противомикробные агенты Chemother. 2006; 50: 2286–92. doi: 10.1128/AAC.00077-06. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Противомикробные агенты Chemother. 2006; 50: 2286–92. doi: 10.1128/AAC.00077-06. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Wernick MB, Müntener CR. Цефовецин: новый цефалоспорин длительного действия. J Exot Pet Med. 2010;19(4): 317–22. doi: 10.1053/j.jepm.2010.10.002. [CrossRef] [Google Scholar]
6. Шеол Б., Матанович К., Мекич С., Старешина В. Активность in vitro цефовецина, цефалоспорина расширенного спектра действия, в отношении 284 клинических изолятов, собранных у кошек и собак в Хорватии. Ветеринарный архив. 2011;81(1):91–7. [Google Scholar]
7. Giboin H, Becskei C, Civil J, Stegemann MR. Безопасность и эффективность цефовецина (Convenia®) в качестве дополнительного лечения заболеваний пародонта у собак. Откройте J Vet Med. 2012;2:89–97. doi: 10.4236/ojvm.2012.23016. [CrossRef] [Google Scholar]
8. Stegemann MR, Sherington J, Blanchflower S. Фармакокинетика и фармакодинамика цефовецина у собак. J Vet Pharmacol Ther. 2006; 29: 501–11.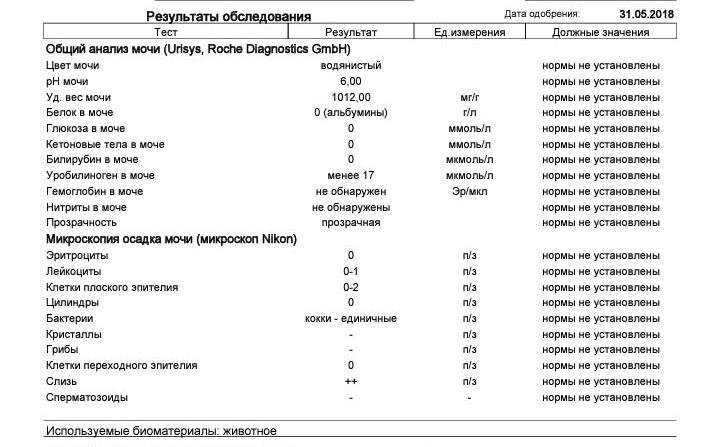 doi: 10.1111/j.1365-2885.2006.00801.x. [PubMed] [CrossRef] [Google Scholar]
doi: 10.1111/j.1365-2885.2006.00801.x. [PubMed] [CrossRef] [Google Scholar]
9. Passmore CA, Sherington J, Stegemann MR. Эффективность и безопасность цефовецина для лечения инфекций мочевыводящих путей у кошек. J Small Anim Pract. 2008; 49: 295–301. doi: 10.1111/j.1748-5827.2008.00545.x. [PubMed] [CrossRef] [Академия Google]
10. Куинн П.Дж., Картер М.Е., Марки Б., Картер Г.Р. Клиническая ветеринарная микробиология. Лондон: Издательство Вулф; 1994. С. 42–126. [Google Scholar]
11. Куинн П.Дж., Марки Б.К., Картер М.Е., Доннелли В.Дж., Леонард Ф.К. стафилококков видов. В: Куинн П.Дж., Марки Б.К., Картер М.Е., Доннелли В.Дж., Леонард Ф.К., редакторы. Ветеринарная микробиология и микробные заболевания. Оксфорд: Blackwell Science Ltd; 2002. стр. 43–8. [Google Scholar]
12. Эпли М., Бэйд Д.Дж., Браун С.Д., Грей Дж.Т., Хайне Х., Хантер Р.П., Мевиус Д.Дж., Папич М.Г., Силли П., Зуренко Г.Е. Стандарты эффективности для дисков с противомикробными препаратами и тестов на чувствительность к разбавлениям для бактерий, выделенных от животных; утвержден стандарт-третье издание.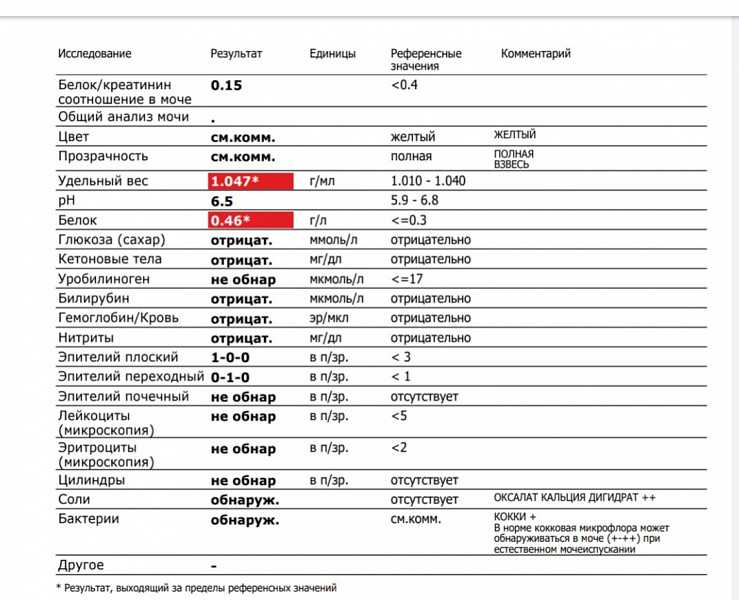 Документ CLSI M31-A3. Уэйн, Пенсильвания, США: Институт клинических и лабораторных стандартов. 2008. ISBN 1-56238-659.-ИКС.
Документ CLSI M31-A3. Уэйн, Пенсильвания, США: Институт клинических и лабораторных стандартов. 2008. ISBN 1-56238-659.-ИКС.
13. Buffington CA, Chew DJ, Kendall MS, Scrivani PV, Thompson SB, Blaisdell JL, et al. Клиническая оценка кошек с необструктивными заболеваниями мочевыводящих путей. J Am Vet Med Assoc. 1997;210(1):46–50. [PubMed] [Google Scholar]
14. Литстер А, Мосс С.М., Хоннери М., Рис Б., Тротт Д.Дж. Преобладание видов бактерий у кошек с клиническими признаками заболевания нижних мочевыводящих путей: признание Staphylococcus felis возможным возбудителем заболеваний мочевыводящих путей кошек. Вет микробиол. 2007; 121:182–8. doi: 10.1016/j.vetmic.2006.11.025. [PubMed] [CrossRef] [Академия Google]
15. Weese JS, Blondeau JM, Boothe D, Breitschwerdt EB, Guardabassi L, Hillier A, et al.: Руководство по применению противомикробных препаратов для лечения заболеваний мочевыводящих путей у собак и кошек: Рабочая группа по рекомендациям противомикробных препаратов Международного общества компаньонов Инфекционные болезни животных.