2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Просмотров: 5904 Опубликовано: / Обновлено:
ПЦР (полимеразная цепная реакция) — это молекулярно-биологический метод, в основе которого лежит амплификация (то есть многократное увеличение) фрагментов ДНК в биоматериале.
Метод ПЦР применяется во многих сферах деятельности, в том числе в качестве быстрого и высокоточного способа диагностики определенных инфекционных и генетических заболеваний человека, а также для выявления спонтанных или унаследованных изменений в ДНК, исследованиях генома сельскохозяйственных растений и животных для селекционных и других задач, в криминалистике, археологии, установлении отцовства, клонировании и секвенировании геномов и прочих сферах деятельности человека.
Вирусы, бактерии и грибы - основные человеческие патогены - содержат ДНК или РНК, причем для каждого вида последовательность нуклеотидов уникальна. Короткие фрагменты, комплементарные целевым участкам нуклеотидов каждого возбудителя, называются праймерами.
В основе анализа на ПЦР лежит создание большего числа копий генетического материала (ДНК или РНК) с помощью этих самых праймеров и специальных ферментов посредством серии циклов нагрева и охлаждения. Полученные амплифицированные сегменты далее методом гель-электрофореза (или с помощью другой технологии) сравниваются с другими нуклеотидными сегментами из известного источника (например, патогенного микроорганизма) для определения их идентичности.
ПЦР в реальном времени — это разновидность ПЦР, которая позволяет отслеживать процесс амплификации в режиме реального времени и может использоваться для количественной оценки присутствующей ДНК / РНК. Это один из основных методов обнаружения бактерий или вирусов на молекулярном уровне, с более высокой степенью точности, чем микроскопические или бактериологические исследования, и значительно более быстрый, чем метод культивирования.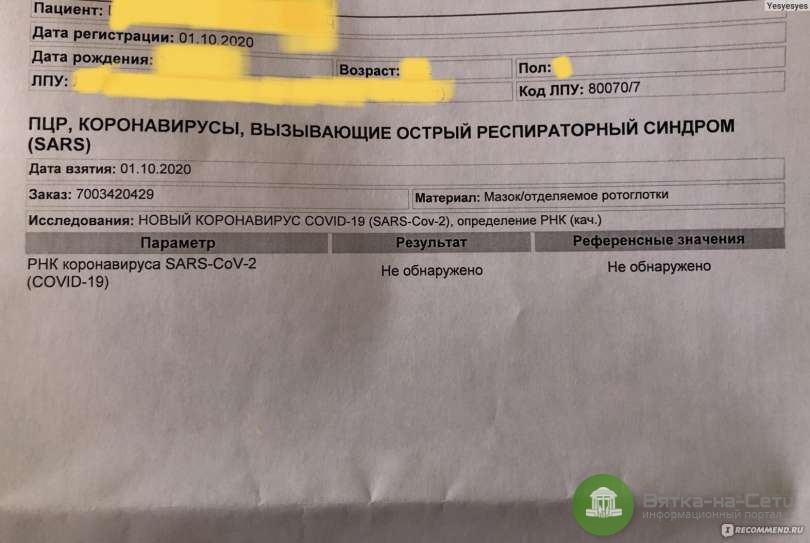
Это также единственный способ определить наличие генетических вариаций, указывающих на предрасположенность к онкологическим и другим заболеваниям. Чувствительность диагностических инструментов для выявления мутаций онкогенов и генов подавления опухоли была улучшена по крайней мере в десять тысяч раз благодаря ПЦР, что позволяет раньше диагностировать, например, такие виды рака, как лейкемия. Метод ПЦР также позволил разработать индивидуальную терапию для больных раком.
Кроме того, ПЦР может использоваться для типирования тканей, которое имеет жизненно важное значение для имплантации органов.
ПЦР также имеет клиническое применение в области пренатального тестирования различных генетических заболеваний и / или клинических патологий. Образцы берут либо с помощью амниоцентеза либо с помощью биопсии ворсин хориона.
В отличие от многих других тестов, ПЦР тест способен обнаружить признаки заболевания на самых ранних стадиях инфицирования, так как для выделения искомого ДНК или РНК достаточно минимального количества генетического материала патогена в образце биоматериала. Другие виды исследования могут оказаться ложноотрицательными из-за того, что в образце недостаточно много вирусов или бактерий или организм не успел выработать достаточное количество антител.
Другие виды исследования могут оказаться ложноотрицательными из-за того, что в образце недостаточно много вирусов или бактерий или организм не успел выработать достаточное количество антител.
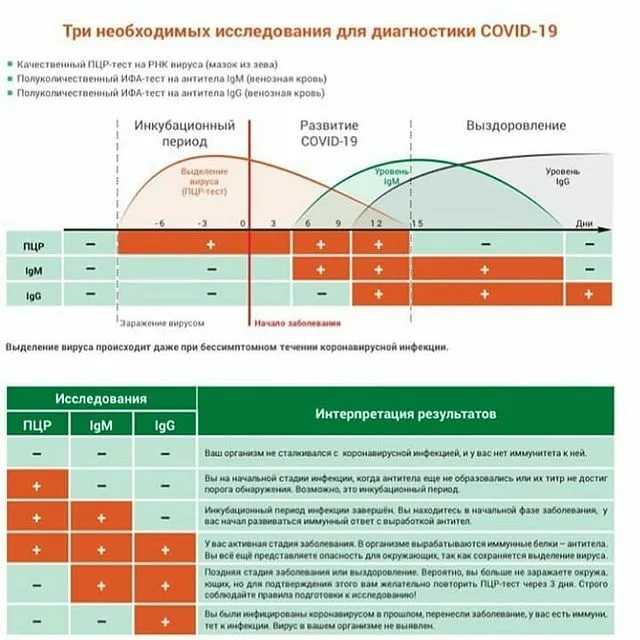
ПЦР-анализ проводится на образце одного из следующих видов биоматериала: кровь, слюна, слизь, ткань, гной, мокрота, моча. Некоторые вирусы, включая новый коронавирус, состоят из РНК, а не ДНК. Их РНК перед амплификацией должна быть преобразована в ДНК. Этот процесс называется ПЦР с обратной транскрипцией.
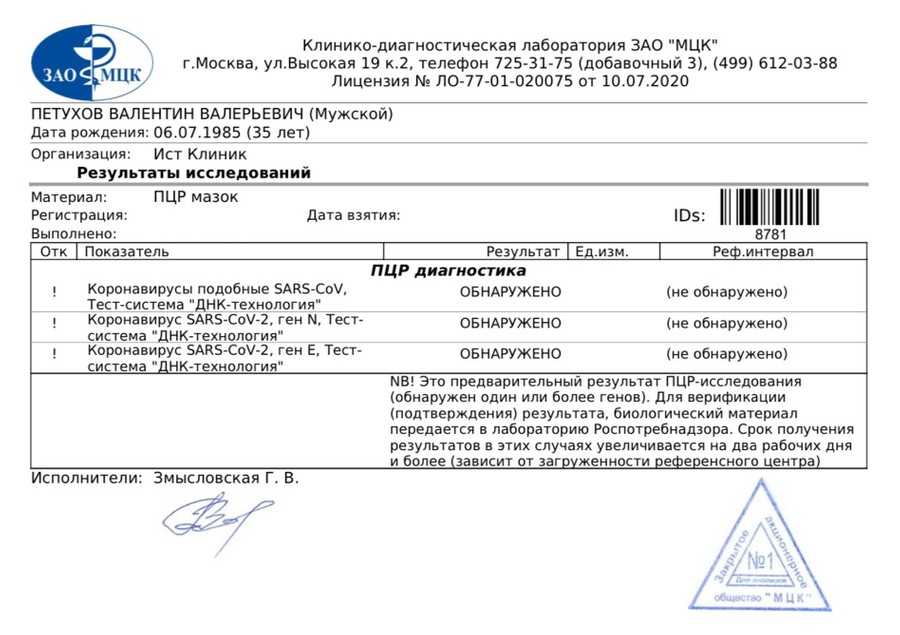
На сегодняшний день ПЦР тест является стандартом для выявления наличия коронавируса SARS-CoV-2, вызывающего Covid-19. Тесты ПЦР определяют, инфицирован ли пациент в настоящее время вирусом SARS-CoV-2 и, следовательно, заразен ли он. ПЦР может обнаружить РНК COVID-19 только в том случае, если человек был недавно инфицирован или уже длительное время болеет. Обнаружение вирусной РНК с помощью ПЦР позволяет обеспечить диагностику COVID-19 на ранней стадии - до того, как организм выработает ответ в виде антител или даже до того, как у человека появятся симптомы заболевания.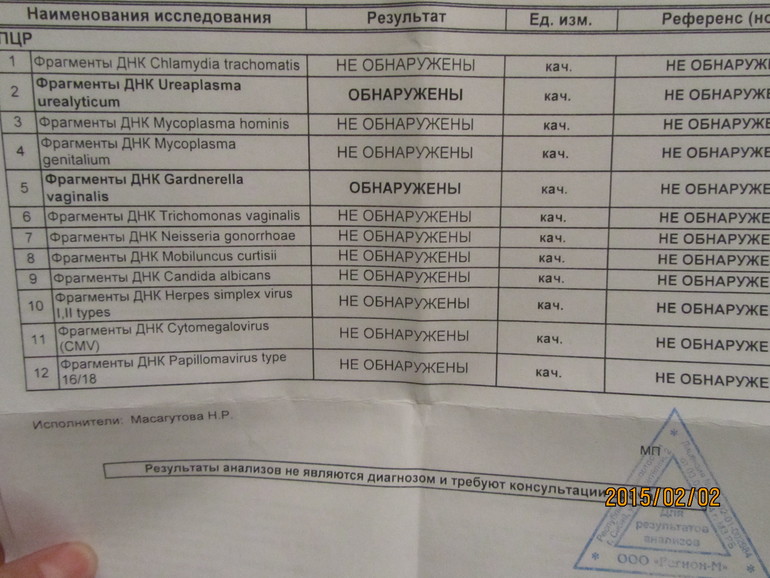
ПЦР тесты применяются в медицинской диагностике уже более 40 лет и считаются наиболее эффективным методом выявления многих инфекционных заболеваний, включая COVID-19, ВИЧ, Эбола, многих урогенитальных инфекций, герпесвирусов и других. Это “золотой стандарт” в медицинской инфекционной диагностике. Тесты ПЦР играют решающую роль в предотвращении распространения заболеваний, так как часто позволяют выявить инфекции на ранней стадии, еще до появления симптомов.
Анализ ПЦР обладает высокой чувствительностью (для обнаружения инфекционного агента достаточно всего нескольких молекул ДНК патогена) и специфичностью (для большинства инфекций она достигает 100%). Количественный ПЦР-анализ позволяет оценить инфекционную нагрузку на организм, а также используется для анализа изменений экспрессии генов в опухолях.
Важна также и высокая скорость проведения исследования. В отличие от традиционного посева при выявлении бактериальных инфекций, который занимает несколько дней, ПЦР тест обычно выполняется в течение суток.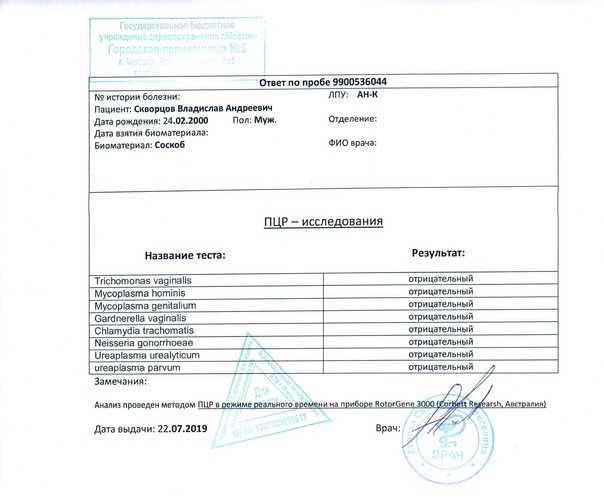 Это значительно увеличивает вероятность назначения своевременного лечения. Кроме того, с помощью ПЦР можно определить латентных носителей инфекции.
Это значительно увеличивает вероятность назначения своевременного лечения. Кроме того, с помощью ПЦР можно определить латентных носителей инфекции.
На чувствительность и специфичность ПЦР теста серьезно влияют правила и условия его проведения. Необходимо строго соблюдать правила сбора биоматериала и его хранения.
Важно выбрать правильное время взятия биоматериала и выполнить правила подготовки к тесту. В частности, это касается и нового коронавируса, который присутствует в выделениях носоглотки и ротоглотки только в течение определенного времени, по истечении которого анализ окажется отрицательным.
Кроме того, высокая чувствительность ПЦР может иногда превращаться из преимущества в недостаток. Следы примесей РНК или ДНК в образце могут привести к результатам, вводящим в заблуждение.
ПЦР-тесты используются для:

ПЦР-анализ широко используется для определения возбудителей респираторных инфекций, в том числе для диагностики коронавирусной инфекции SARS-CoV-2.
ПЦР тест также можно использовать для прямой диагностики наличия заболевания и мутаций в развивающемся эмбрионе. Например, впервые ПЦР была использована таким образом для диагностики серповидно-клеточной анемии путем обнаружения мутации одного гена.
Исследование на ПЦР не требует сложной и специальной подготовки.
Метод полимеразно-цепной реакции постоянно развивается.
Это только часть методов ПЦР, количество которых постоянно пополняется новыми технологичными вариантами.
Для проведения анализа биоматериала с помощью ПЦР необходимо обеспечить его правильное взятие. При взятии мазка из носоглотки или ротоглотки образец биоматериала собирают путем введения длинного зонда-тампона в ноздрю или в заднюю часть горла.
Во время анализа крови медицинский работник возьмет образец из вены на руке с помощью небольшой иглы.
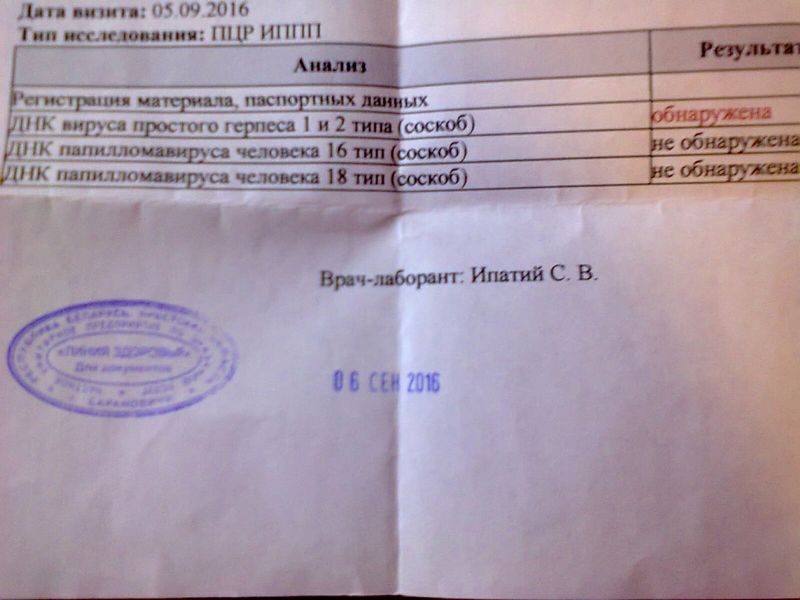
Положительный результат ПЦР теста означает, что пациент в настоящее время инфицирован определенным патогеном. Количественный ПЦР (в реальном времени) позволяет также оценить инфекционную нагрузку, а также определить момент, когда условно-патогенные микроорганизмы стали патогенными в результате неконтролируемого роста.
Отрицательный результат ПЦР теста может означать, что пациент в настоящее время не инфицирован, либо что ДНК/РНК патогена отсутствует во взятом образце биоматериала, либо что образец был взят спустя слишком долгое время после заражения, чтобы вирус был обнаружен.
 mayoclinic.org/tests-procedures/covid-19-diagnostic-test/about/pac-20488900
mayoclinic.org/tests-procedures/covid-19-diagnostic-test/about/pac-20488900ПЦР – сложная химико-биологическая цепная реакция, позволяющая методом поэтапного исследования определить в тканях организма человека чужеродные компоненты, вирусные и бактериальные структуры, грибки.
Вирус SARS-CoV-2 относится к респираторным агентам и в организм попадает через слизистые – нос, глаза, рот. В клетках слизистых тканей он фиксируется, прикрепляясь шипами оболочки к клеточным мембранам. А вот в крови и лимфе вируса нет. Анализ крови становится показательным только при длительной болезни, когда появляется иммунный ответ организма на вирусную атаку.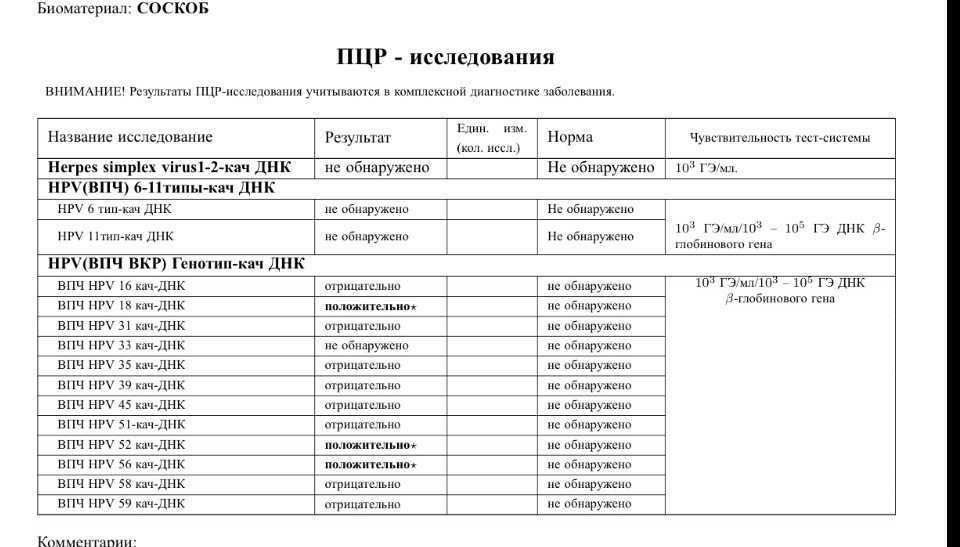 В этом случае ПЦР уже не информативен, и при подозрении на COVID стоит сдавать иммуноферментный анализ (ИФА) крови – определять антитела к вирусной инфекции.
В этом случае ПЦР уже не информативен, и при подозрении на COVID стоит сдавать иммуноферментный анализ (ИФА) крови – определять антитела к вирусной инфекции.
В первые дни заражения, когда симптоматика заболевания отсутствует или слабо выражена, SARS-CoV-2 уже активно размножается в носоглотке. Инфекцию легко обнаружить в тканях слизистых и даже в слюне. Носители вируса могут и не подозревать о его наличии, и определить, заразен ли человек, может только анализ ПЦР.
Мазок для выявления короновируса методом ПЦР берут из ротоглотки и носоглотки. Для этого используют зонд со стерильной щеточкой или тампоном. Медсестра безболезненно и аккуратно проводит несколько раз по слизистым пациента, а затем биоматериал запаковывают и передают в лабораторию для тщательного исследования.
Выделяют несколько категорий, кому показана диагностика на короновирус методом ПЦР:
 Исследование для них – возможность получить справку об отсутствии ковид для выезда или иных целей.
Исследование для них – возможность получить справку об отсутствии ковид для выезда или иных целей. Анализ проводят при отсутствии симптомов заболевания новой короновирусной инфекцией – пациентам без высокой температуры, кашля, слабости, отдышки.
Как записаться на сдачу ПЦР без очереди?Вам необходимо позвонить по телефону +7 (499) 110-53-21 или написать нам. |
Тест чувствительный, поэтому во избежание риска получения неправильного результата до проведения ПЦР следует соблюдать определенные правила:
Проведенный тест бывает:
Медицинский центр «ЛМ-клиника» проводит ПЦР-исследования на короновирусную инфекцию для частных лиц и организаций. Квалифицированный подход и внимательность медперсонала гарантируют высокую точность каждого исследования. Для записи на анализ методом ПЦР достаточно позвонить по телефону клиники или оставить заявку на сайте.
| Тестирование методом иммуноферментного анализа (ИФА) (COVID-19), ImG | 1 000 ₽ |
| Тестирование методом иммуноферментного анализа (ИФА) (COVID-19), ImM | 1 000 ₽ |
| Тестирование методом иммуноферментного анализа (ИФА) (COVID-19), ImM+ImG | 1 850 ₽ |
| Тестирование методом иммуноферментного анализа (ИФА) (COVID-19), ImG | 1 000 ₽ |
| Тестирование методом иммуноферментного анализа (ИФА) (COVID-19), ImM | 1 000 ₽ |
| Тестирование методом иммуноферментного анализа (ИФА) (COVID-19), ImM+ImG | 1 850 ₽ |
— это революционный метод, разработанный Кэри Маллис в 1980-х годах.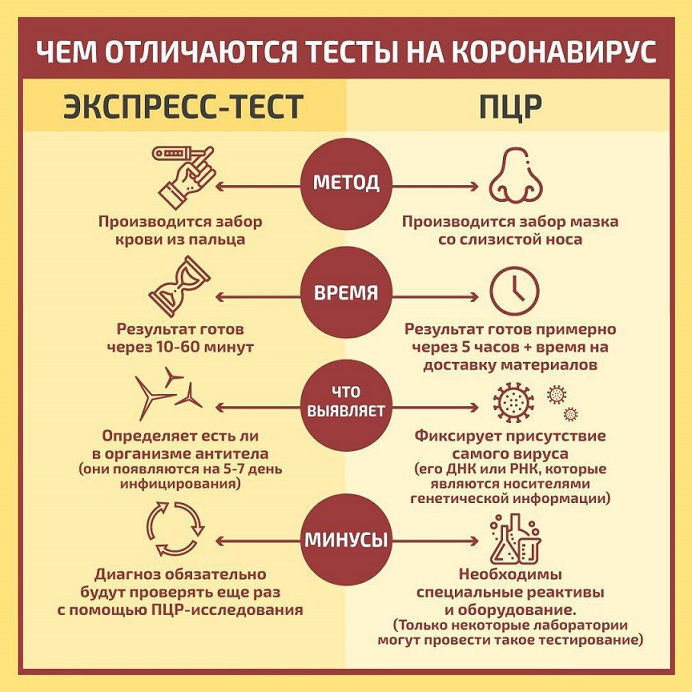 ПЦР основана на использовании способности ДНК-полимеразы синтезировать новую цепь ДНК, комплементарную предложенной цепи матрицы. Поскольку ДНК-полимераза может добавлять нуклеотид только к уже существующей 3'-ОН-группе, ей нужен праймер, к которому она может добавить первый нуклеотид. Это требование позволяет очертить конкретную область матричной последовательности, которую исследователь хочет амплифицировать. В конце реакции ПЦР конкретная последовательность будет накапливаться в миллиардах копий (ампликонов).
ПЦР основана на использовании способности ДНК-полимеразы синтезировать новую цепь ДНК, комплементарную предложенной цепи матрицы. Поскольку ДНК-полимераза может добавлять нуклеотид только к уже существующей 3'-ОН-группе, ей нужен праймер, к которому она может добавить первый нуклеотид. Это требование позволяет очертить конкретную область матричной последовательности, которую исследователь хочет амплифицировать. В конце реакции ПЦР конкретная последовательность будет накапливаться в миллиардах копий (ампликонов).
Компоненты ПЦРМатрица ДНК– образец ДНК, содержащий целевую последовательность. В начале реакции к исходной двухцепочечной молекуле ДНК прикладывают высокую температуру, чтобы отделить нити друг от друга.ДНК-полимераза— тип фермента, синтезирующего новые нити ДНК, комплементарные целевой последовательности. Первым и наиболее часто используемым из этих ферментов является 9. ДНК-полимераза 0022 Taq (из Thermis aquaticus ), тогда как ДНК-полимераза Pfu (из Pyrococcus furiosus ) широко используется из-за ее более высокой точности при копировании ДНК. Хотя эти ферменты слегка различаются, они оба обладают двумя свойствами, которые делают их подходящими для ПЦР: 1) они могут генерировать новые нити ДНК с использованием ДНК-матрицы и праймеров и 2) они термоустойчивы. ДНК-полимераза 0022 Taq (из Thermis aquaticus ), тогда как ДНК-полимераза Pfu (из Pyrococcus furiosus ) широко используется из-за ее более высокой точности при копировании ДНК. Хотя эти ферменты слегка различаются, они оба обладают двумя свойствами, которые делают их подходящими для ПЦР: 1) они могут генерировать новые нити ДНК с использованием ДНК-матрицы и праймеров и 2) они термоустойчивы. Праймеры– короткие фрагменты одноцепочечной ДНК, комплементарные целевой последовательности. Полимераза начинает синтезировать новую ДНК с конца праймера.Нуклеотиды (dNTP или дезоксинуклеотидтрифосфаты)— отдельные единицы оснований A, T, G и C, которые по существу являются «строительными блоками» для новых цепей ДНК.RT-PCR(ПЦР с обратной транскрипцией) представляет собой ПЦР, которой предшествует преобразование образца РНК в кДНК с помощью ферментаобратной транскриптазы.Ограничения ПЦР и ОТ-ПЦР Реакция ПЦР начинает экспоненциально генерировать копии целевой последовательности. |
| Поиск текста | Датчики |
|---|---|
| "выражение гена"[приложение] | 0 |
| "набор праймеров" [тип зонда] И "mus musculus" [организм] | 0 |
| TaqMan [тип зонда] И «успех в лабораторных условиях» [проверка] | 0 |
» «Полимеразная цепная реакция» [MAJR]
Примечание. [MAJR] — это тег медицинского предметного заголовка (MeSH) для основного заголовка. Тег используется для ограничения поиска статей, основные темы которых представлены терминами, включенными в базу данных NLM MeSH.
[MAJR] — это тег медицинского предметного заголовка (MeSH) для основного заголовка. Тег используется для ограничения поиска статей, основные темы которых представлены терминами, включенными в базу данных NLM MeSH.
Просмотреть каталог
В зависимости от требуемой информации существует множество различных методов анализа продуктов реакции ПЦР. Электрофорез в агарозном геле является распространенным методом для определения наличия или отсутствия целевой последовательности и длины фрагмента. Методы обнаружения мутаций, такие как денатурирующий градиентный гель-электрофорез (DGGE) и временной температурный гель-электрофорез (TTGE), используют акриламидный гель для облегчения идентификации мутаций в продукте ПЦР. Методы полуколичественного анализа позволяют использовать электрофорез в агарозном геле для приблизительного определения исходного количества материала. Секвенирование и метод секвенирования следующего поколения используются, когда необходимо определить последовательность ампликона.
Электрофорез в агарозном геле является распространенным методом для определения наличия или отсутствия целевой последовательности и длины фрагмента. Методы обнаружения мутаций, такие как денатурирующий градиентный гель-электрофорез (DGGE) и временной температурный гель-электрофорез (TTGE), используют акриламидный гель для облегчения идентификации мутаций в продукте ПЦР. Методы полуколичественного анализа позволяют использовать электрофорез в агарозном геле для приблизительного определения исходного количества материала. Секвенирование и метод секвенирования следующего поколения используются, когда необходимо определить последовательность ампликона.
Связанные темы: Приборы для ПЦР, реагенты для ПЦР, разработка и оптимизация ПЦР-анализа и поиск и устранение неисправностей ПЦР.
Продукты ПЦР чаще всего анализируют с помощью электрофореза в агарозном геле. Результаты можно визуализировать с помощью бромистого этидия или нетоксичных красителей, таких как SYBR ® зеленый. Интенсивность полосы можно использовать для оценки количества продукта данной молекулярной массы по отношению к лестнице. Гель-электрофорез также показывает специфичность реакции, где наличие нескольких полос указывает на вторичные продукты амплификации.
Интенсивность полосы можно использовать для оценки количества продукта данной молекулярной массы по отношению к лестнице. Гель-электрофорез также показывает специфичность реакции, где наличие нескольких полос указывает на вторичные продукты амплификации.
Вернуться к началу
ПЦР и ПЦР с обратной транскриптазой (ОТ-ПЦР) обычно используются для обнаружения видов ДНК и РНК соответственно. Однако количественное применение этих методов было ограничено. Теоретически ПЦР экспоненциально амплифицирует матричную ДНК с удвоением матрицы в каждом цикле, так что относительные различия между образцами можно измерить как интенсивность полос на геле.
Ограничение состоит в том, что на более поздних этапах ПЦР эффективность снижается, и амплификация выходит на плато. Это означает, что количество продукта в реакции больше не пропорционально количеству исходного материала и не может быть определено количественно. Относительные количества амплифицированной ДНК в различных реакциях ПЦР можно сравнивать только тогда, когда реакции все еще находятся в экспоненциальной фазе амплификации. По этим причинам qPCR является наиболее часто используемым методом количественного анализа.
По этим причинам qPCR является наиболее часто используемым методом количественного анализа.
Если принять надлежащие меры для обеспечения того, чтобы насыщение не было достигнуто, ПЦР по конечной точке можно успешно использовать в качестве полуколичественной меры относительных различий в исходных данных матрицы между образцами (см. бюллетень Bio-Rad 2915). Чтобы гарантировать, что реакция находится в экспоненциальной фазе амплификации, образцы можно амплифицировать с увеличивающимся числом циклов, проводить гель-электрофорез и количественно оценивать с помощью устройства для визуализации геля и программного обеспечения. Конкретные методы полуколичественной ПЦР включают относительную ОТ-ПЦР и конкурентную ОТ-ПЦР.
В относительной ОТ-ПЦР две пары праймеров предназначены для мультиплексной реакции ПЦР — одна для интересующего гена, а другая для гена «домашнего хозяйства» (Marone et al. 2001). Пары праймеров должны быть сконструированы так, чтобы не образовывались димеры и образовывались продукты достаточно разной длины, чтобы их можно было различить с помощью гель-электрофореза. Необходимо провести пилотные эксперименты, чтобы проверить продукт после различного количества циклов и определить экспоненциальную фазу реакции для обоих наборов праймеров. Используя программное обеспечение для визуализации геля для определения интенсивности полосы, затем можно рассчитать относительное изменение кратности между образцами, нормализованными по гену домашнего хозяйства. Проблема с этим подходом заключается в том, что гены домашнего хозяйства, необходимые для нормализации, обычно имеют гораздо более высокую экспрессию, чем интересующий ген. Один подход к этой проблеме заключается в использовании генов домашнего хозяйства с более низкой экспрессией и использовании более высоких концентраций праймеров для представляющего интерес гена и более низких концентраций праймеров для гена домашнего хозяйства, чтобы способствовать образованию продукта с более низкой экспрессией.
Необходимо провести пилотные эксперименты, чтобы проверить продукт после различного количества циклов и определить экспоненциальную фазу реакции для обоих наборов праймеров. Используя программное обеспечение для визуализации геля для определения интенсивности полосы, затем можно рассчитать относительное изменение кратности между образцами, нормализованными по гену домашнего хозяйства. Проблема с этим подходом заключается в том, что гены домашнего хозяйства, необходимые для нормализации, обычно имеют гораздо более высокую экспрессию, чем интересующий ген. Один подход к этой проблеме заключается в использовании генов домашнего хозяйства с более низкой экспрессией и использовании более высоких концентраций праймеров для представляющего интерес гена и более низких концентраций праймеров для гена домашнего хозяйства, чтобы способствовать образованию продукта с более низкой экспрессией.
В конкурентной ОТ-ПЦР экзогенный контроль РНК или ДНК синтезируется и вводится в образцы (Francesco et al.