2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
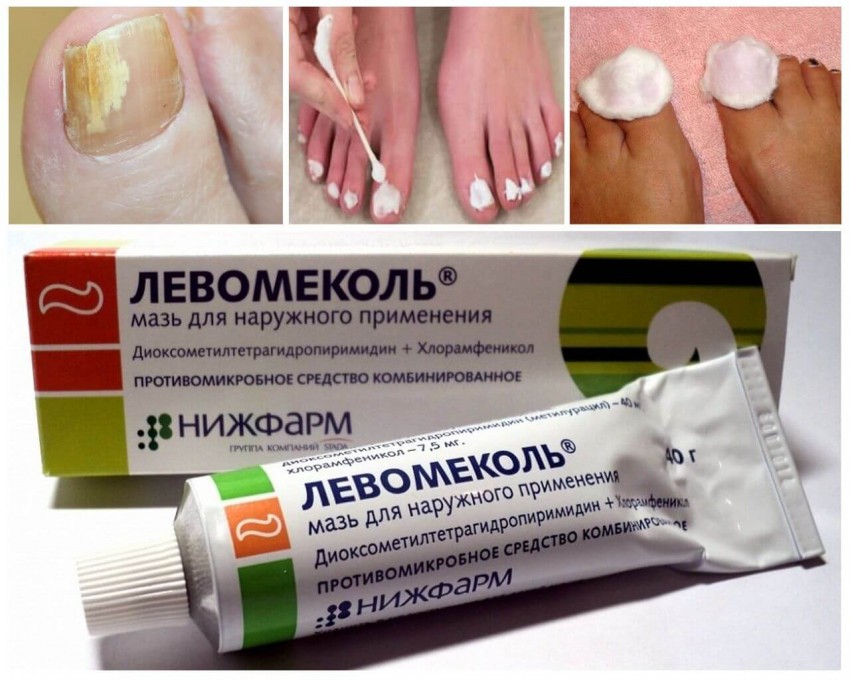
Синяки не украшают никого. Даже самая небольшая гематома не только портит эстетический вид лица или другой части тела, но и сопровождается болезненными ощущениями. Но избежать синяков еще никому не удавалось, поэтому правильнее будет ознакомиться с препаратами, которые избавляют от гематом в самые короткие сроки. Одним из таких средств от синяков является Левомеколь.
Содержание
Левомеколь выпускается в виде мази белого или желтоватого цвета. Субстанция не жидкая, тугая, продается в тубах. Средство может быть расфасовано в темные банки по 100 г или 1000 г.
Эту мазь производители выпустили еще в 70 годах, и благодаря своей эффективности она сразу же стала пользоваться спросом. В составе Левомеколя присутствуют метилурацил и хлорамфеникол, компоненты очень активные. Они-то и действуют против воспалений, микробов, повышают регенерацию организма. В паре эти компоненты работают так: хлорамфеникол убивает вредоносные микробы и бактерии, а метилурацил проникает в кожу и способствует созданию новых, здоровых клеток.
Помимо этого, все составляющие препарата благотворно влияют на выработку особенного компонента (интерферона), который необходим для борьбы с вирусами.
Мазь применяется наружно, то есть при втирании она не попадает в кровоток, а значит, у нее почти нет противопоказаний. Левомеколь рекомендован даже будущим мамам и детям. Это очень важно, потому что многие препараты запрещены этим группам людей.
Стоит относиться к препарату осторожно тем, у кого имеется индивидуальная непереносимость каких-то его составляющих. У этих людей возможна аллергическая реакция на компоненты препарата. Мазь Левомеколь стоит убрать из использования, если:
Мазь Левомеколь стоит убрать из использования, если:
В этом случае следует незамедлительно связаться с врачом.
Не рекомендуется мазь людям, у которых имеются такие кожные заболевания, как экзема, грибковые болезни, псориаз.
Если синяк сопровождается повреждением кожи и при травме рана загрязнена, то обязательно следует прибегнуть к помощи Левомеколя.
При применении мазь оказывает следующие действия:

Первоначально следует обработать рану перекисью водорода или хлоргексидином. Затем можно накладывать Левомеколь, чтобы оказать антисептическое действие.
Средство наносится тонким слоем на больной участок кожи, предварительно нужно нанести мазь на ватный тампон. При рассечении кожи следует поверх мази накладывать марлевую салфетку.
Применяется препарат не более четырех суток подряд. Дальше пользоваться мазью небезопасно, потому что в состав Левомеколя входят вещества, которые при долгом применении могут отрицательно сказаться на здоровье неповрежденных клеток.
Только врач может правильно оценить действие препарата и решить, стоит ли продолжать его применение или же целесообразнее поменять средство.
Случаются ситуации, когда помощь при ушибах и синяках с открытыми ранами приходит не сразу, а намного позже. В таких случаях раны уже начинают гноиться, синяки имеют желтоватый цвет, но исчезновение их происходит долго, и сами они не рассасываются.
Левомеколь поможет и в самых запущенных ситуациях. Компоненты, входящие в состав мази, очень активные. Они начинают действовать с момента попадания на поврежденный участок тела. Для правильного лечения следует обратиться к специалисту, он назначит эту мазь и проконсультирует, как долго нужно ее применять.
Иногда происходят случаи, которые не касаются лечения людей. Многие граждане имеют четвероногих любимцев, которые тоже нередко получают различные повреждения. Мазь Левомеколь может быть прописана и им. На их организм средство тоже действует положительно, заживляя ссадины и ранения.
Левомеколь не будет лишним в любой аптечке — домашней, автомобильной или садовой. Это объясняется тем, что врач все равно посоветует его приобрести, если произойдет непредвиденный случай и потребуется лечить:
Лучше всего избегать этих болезней, но грамотнее будет подстраховаться.
Может создаться ошибочное мнение, что мазью следует пользоваться в любых ситуациях. Однако стоит помнить, что в состав Левомеколя входит антибиотик. Он не наносит ощутимого вреда организму, так как его дозы четко рассчитаны, но бесконтрольное применение Левомеколя, как и любого лечебного препарата, для организма будет не полезно.
Перед применением следует все-таки обратиться к врачам. Они проведут тесты на аллергию к данному средству и назначат необходимый курс.
Самолечение, как правило, не самый верный путь к здоровью. Это же относится и к самостоятельному поиску аналогов Левомеколя. Их существует достаточно много. Однако их действие может несколько отличаться от базового препарата при лечении определенных заболеваний. Для того чтобы правильно определить нужное средство, необходима помощь специалиста.
Цены на Левомеколь и его наличие можно узнать по ссылке ниже:
Доставка по России в любую аптеку бесплатно.
Наружное средство Левомеколь принадлежит к группе препаратов с противовоспалительным и антимикробным действием. Его активными компонентами являются метилурацил (диоксометилтетрагидропиримидин) и левомицетин (хлорамфеникол).
Левомеколь защищает место повреждения от инфекций. Мазь распределяется по поверхности, проникает вглубь тканей и препятствует размножению стафилококка, синегнойной палочки, кишечных бактерий в ране или ожоге.
Вещества Левомеколя кроме противомикробного действия также стимулируют регенерационные процессы. Они проникают внутрь ткани не повреждая клеточную мембрану и ускоряют заживление микротравм кожи, капилляров.
Противовоспалительное свойство мази способствует:
Поэтому помогает Левомеколь от ушибов и прочих травм мягких тканей. Препарат может применяться в лечении беременных, лактирующих женщин, детей, пожилых людей. При появлении аллергических кожных реакций средство прекращают использовать.
Левомеколь противопоказан только людям, чувствительным к его веществам. Наличие гноя не является ограничением к применению мази: средство не теряет антимикробный эффект.
Детям, беременным, кормящим женщинам нельзя бесконтрольно использовать препарат с левомицетином. Дозирование и кратность применения Левомеколя назначает врач. Обычно мазь наносят на раны и ожоги 2―3 раза/день.
Ушибы бывают с глубоким и поверхностным нарушением целостности кожных покровов. При среднетяжелом ранении обследуются у травматолога. Ссадины себе или ребенку можно лечить самостоятельно.
Способ применения Левомеколя при ушибах с повреждением кожи:

Длительность лечения ран определяет врач. При ссадинах Левомеколь прекращают мазать после устранения отека на месте ушиба и при появлении корочки, указывающей на заживление ткани.
При ушибах применять Левомеколь надо так же, как при ссадинах, если на месте удара появилась припухлость без ран и кровоподтека. Кожу моют, обрабатывают антисептиком, просушивают бумажной салфеткой. Затем на болезненную зону накладывают марлю с мазью, фиксируют нетканым пластырем, либо втирают средство в кожу ватным тампоном. Процедуру проводят 1―2 раза/сутки на протяжении 2―5 дней.
Синяком называют подкожный кровоподтек на месте ушиба из-за повреждения капилляров. Гематома – это скопление крови (мягкий бугор) в любом участке тела. Левомеколь не обладает рассасывающим свойством, поэтому не помогает их устранить. Мазь только предупреждает воспаление тканей, что снижает боль, и ускоряет заживление.
Гематома – это скопление крови (мягкий бугор) в любом участке тела. Левомеколь не обладает рассасывающим свойством, поэтому не помогает их устранить. Мазь только предупреждает воспаление тканей, что снижает боль, и ускоряет заживление.
На заметку! При ушибе от гематом Левомеколь не спасает, но мазь используют после пункции (отсасывания крови) для профилактики инфицирования раны и ускорения заживления тканей.
Часто зимой при падении ушибают копчиковую область. Это бывает причиной рассечения кожи, обострения геморроя.
Как применять Левомеколь:
Важно! После падения надо обследоваться у травматолога, чтобы исключить перелом копчика. Врач индивидуально проконсультирует о целесообразности лечения ушиба Левомеколем или другим лекарством.
Врач индивидуально проконсультирует о целесообразности лечения ушиба Левомеколем или другим лекарством.
Видаль: https://www.vidal.ru/drugs/levomecol__1655
ГРЛС: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=cf36eacd-b2d6-4389-92b4-4fb0e257825f&t=
Нашли ошибку? Выделите ее и нажмите Ctrl + Enter
Понравился наш сайт? Расскажи о нем друзьям
Инсульт. Авторская рукопись; доступно в PMC 2017 1 июня. 2016 июнь; 47 (6): 1626–1631.
Published online 2016 Apr 28. doi: 10.1161/STROKEAHA.116.013146
PMCID: PMC5237112
NIHMSID: NIHMS841217
PMID: 27125525
, MD, 1, 2 , MD, Ph.D., 1 , MD, 1 , MD, Ph.D., 2 , Ph. D, 1 и, MD 1
D, 1 и, MD 1
Авторская информация об авторском правом и лицензионной информации Отказ
Очищение гематомы происходит в первые дни после внутримозгового кровоизлияния (ВМК) и недостаточно изучено. В настоящем исследовании мы изучили изменения гематомы на модели ВМК поросят. Также изучалось влияние дефероксамина на гематому.
Модель ICH была индуцирована инъекцией аутологичной крови в правую лобную долю поросят. Сначала определяли естественные сроки изменения гематомы до 7 дней. Во-вторых, изучалось влияние дефероксамина на изменения гематомы. Уровни гемоглобина и мембраноатакующего комплекса в гематоме исследовали методом иммуноферментного анализа. Иммуногистохимию и Вестерн-блоттинг использовали для исследования CD47 (регулятор эритрофагоцитоза), CD163 (рецептор-поглотитель гемоглобина) и гемоксигеназы-1 (фермент деградации гема) в сгустке.
После ВЧК со временем наблюдалось уменьшение диаметра эритроцитов внутри сгустка. Это сопровождалось накоплением мембраноатакующих комплексов и снижением уровня гемоглобина. В гематоме возникал эритрофагоцитоз, связанный со снижением уровня CD47 в сгустке. Активированные макрофаги/микроглия были положительными по CD163 и гемеоксигеназе-1 и со временем накапливались в сгустке. Лечение дефероксамином ослабляло процесс рассасывания гематомы за счет уменьшения образования комплексов атаки члена и ингибирования потери CD47 в сгустке.
Эти результаты показывают, что мембраноатакующий комплекс и эритрофагоцитоз способствуют исчезновению гематомы после ВЧГ, которое может быть изменено лечением дефероксамином.
Ключевые слова: кровоизлияние в мозг, дефероксамин, эритрофагоцитоз, рассасывание гемолиза, свинья
Рассасывание гематом происходит в первые дни после внутримозгового кровоизлияния (ВМК). Удаление гематомы может происходить за счет лизиса эритроцитов (эритроцитов) или фагоцитоза. Эритроциты внутри сгустка некоторое время сохраняют нормальную двояковогнутую конфигурацию, а затем начинают лизироваться. При этом эритроциты фагоцитируются микроглией/макрофагами.
Эритроциты внутри сгустка некоторое время сохраняют нормальную двояковогнутую конфигурацию, а затем начинают лизироваться. При этом эритроциты фагоцитируются микроглией/макрофагами.
Лизис эритроцитов после ВЧГ высвобождает гемоглобин и продукты его распада, такие как железо, что способствует окислительному стрессу, замедленному отеку мозга и гибели нейронов 1 . Лизис эритроцитов после ВМК может быть опосредован активацией комплемента и образованием мембраноатакующего комплекса (МАК), который содержит белки комплемента С5b, С6, С7, С8 и С9 (С5b–9). Наши предыдущие исследования показали, что истощение комплемента или ингибирование комплемента снижает повреждение головного мозга в крысиной модели ICH 9.0019 2, 3 .
Активация микроглии/макрофагов способствует рассасыванию гематомы и улучшению функционального исхода в модели ВКГ у крыс 4, 5 . CD47, также называемый интегрин-ассоциированным белком, экспрессируется на эритроцитах и других клетках, регулирующих фагоцитоз клеток-мишеней 6 . В нормальных эритроцитах CD47 ингибирует фагоцитоз посредством взаимодействия с ингибирующим рецептором, сигнальным регулирующим белком альфа (SIRPα), на фагоцитах. Наше недавнее исследование показало, что CD47 на эритроцитах играет роль в удалении сгустков после ICH 9.0019 7 .
В нормальных эритроцитах CD47 ингибирует фагоцитоз посредством взаимодействия с ингибирующим рецептором, сигнальным регулирующим белком альфа (SIRPα), на фагоцитах. Наше недавнее исследование показало, что CD47 на эритроцитах играет роль в удалении сгустков после ICH 9.0019 7 .
Разрешение гематомы связано с высвобождением гемоглобина и железа, полученного из гемоглобина 1 . Рецептор поглотителя гемоглобина, CD163, на микроглии/макрофагах опосредует эндоцитоз гемоглобина, высвобождаемого из эритроцитов 8 . CD163 транспортирует гемоглобин в микроглию/макрофаги с последующей индукцией гемоксигеназы-1 (HO-1) 8 . HO-1, фермент, ограничивающий скорость деградации гема, также считается модулятором эритрофагоцитоза 9 . Дефероксамин (DFX), хелатор железа, уменьшает отек головного мозга, повреждение белого вещества и гибель нейронов в моделях ICH крыс и свиней 10, 11 , а также уменьшает лизис сгустков после ICH 12 .
В настоящем исследовании изучался процесс удаления гематомы на модели ВМК поросят. Мы также исследовали влияние DFX на лизис сгустка и эритрофагоцитоз.
Протоколы процедур на животных были одобрены Университетским комитетом по использованию и уходу за животными Мичиганского университета и проводились в соответствии с Политикой Службы общественного здравоохранения США по гуманному уходу и использованию лабораторных животных . Всего в этом исследовании использовали 65 поросят-самцов (8–10 кг; Университет штата Мичиган, Ист-Лансинг). Один поросенок был исключен из исследования из-за высокой температуры после операции. Модели ICH были выполнены, как описано ранее 13, 14 . Свиней усыпляли кетамином (25 мг/кг, в/м) и анестезировали 2% изофлураном через носовой конус. Концентрация изофлурана поддерживалась на уровне 1,0–1,5% во время хирургических вмешательств. Центральную температуру тела поддерживали на уровне 37,5 ± 0,5 °C с помощью грелки с обратной связью (Gaymar, Orchard Park, NY). В правую бедренную артерию вводили полиэтиленовый катетер (PE-160) для получения крови для инъекций и контроля артериального давления, газов крови и концентрации глюкозы. В точке 11 мм справа от стреловидного шва и на 11 мм кпереди от венечного шва просверливали черепное трепанационное отверстие (1,5 мм). Стерильный пластиковый катетер 20 калибра длиной 18 мм стереотаксически помещали в центр белого вещества правой лобной доли головного мозга на уровне хвостатого ядра. Сначала с помощью инфузионного насоса вливали 1,0 мл аутологичной артериальной крови в течение 10 мин. Затем вводили 1,5 мл крови в течение 10 мин после 5-минутного перерыва. После инъекции игла удалялась, трепанационное отверстие заполнялось костным воском, разрез кожи закрывался швами.
В правую бедренную артерию вводили полиэтиленовый катетер (PE-160) для получения крови для инъекций и контроля артериального давления, газов крови и концентрации глюкозы. В точке 11 мм справа от стреловидного шва и на 11 мм кпереди от венечного шва просверливали черепное трепанационное отверстие (1,5 мм). Стерильный пластиковый катетер 20 калибра длиной 18 мм стереотаксически помещали в центр белого вещества правой лобной доли головного мозга на уровне хвостатого ядра. Сначала с помощью инфузионного насоса вливали 1,0 мл аутологичной артериальной крови в течение 10 мин. Затем вводили 1,5 мл крови в течение 10 мин после 5-минутного перерыва. После инъекции игла удалялась, трепанационное отверстие заполнялось костным воском, разрез кожи закрывался швами.
Это исследование состояло из двух частей. В первой части у поросят была ВЧГ в правой лобной доле. Мозг собирали через 4 часа или на 1, 3 и 7 день (n=8 в каждой группе) для гистологии головного мозга, ELISA и вестерн-блоттинга. Во второй части поросята с ВКГ в лобной доле получали носитель (физиологический раствор) или дефероксамин (50 мг/кг, внутримышечно через 2 ч после ВКГ, а затем каждые 12 ч в течение 7 дней). Мозг собирали на 3-й день (n=8 в каждой группе) и 7-й день (n=8 в каждой группе) для гистологии головного мозга, ELISA и вестерн-блоттинга.
Во второй части поросята с ВКГ в лобной доле получали носитель (физиологический раствор) или дефероксамин (50 мг/кг, внутримышечно через 2 ч после ВКГ, а затем каждые 12 ч в течение 7 дней). Мозг собирали на 3-й день (n=8 в каждой группе) и 7-й день (n=8 в каждой группе) для гистологии головного мозга, ELISA и вестерн-блоттинга.
Мозг замораживали in situ декантацией жидкого азота в сосуд на 12 унций. бездонная пенопластовая чашка, приклеенная к головке с помощью высоковакуумной смазки Dow-Corning (Dow Corning, Midland, MI), как описано ранее 15 . Продолжительность этого процесса обычно составляла около 1 часа, а голову удаляли после инъекции хлорида калия для остановки сердцебиения. Затем замороженную голову разрезали ленточной пилой на коронковые срезы толщиной 5 мм. Образцы тканей брали из точек интереса.
Для гистологии головного мозга поросят повторно анестезировали и мозг перфузировали in situ 10% формалином. Мозг рассекали коронарно. Залитый парафином головной мозг разрезали на срезы толщиной 10 мкм.
Мозг рассекали коронарно. Залитый парафином головной мозг разрезали на срезы толщиной 10 мкм.
Для измерения гемоглобина и МАК мозг был заморожен in situ , образцы ткани гематомы были собраны и гомогенизированы 16 . Количество гемоглобина и МАК измеряли с помощью набора Pig Hemoglobin Elisa (LifeSpan Biosciences, LS-F8543) и Pig C5b-9.Комплект Terminal Complement Complex Elisa (LifeSpan Biosciences, LS-F6300) соответственно в соответствии с инструкциями производителя.
Окрашивание гематоксилином и эозином использовали для изучения морфологии эритроцитов и фагоцитоза эритроцитов. Изображения были обработаны с помощью Image J для измерения диаметра эритроцитов. Средние значения рассчитывали из 30 эритроцитов на поле микроскопа в крае гематомы и в центре гематомы, соответственно, и анализировали 3 среза для каждого мозга.
Иммуногистохимическое окрашивание проводили, как описано ранее 14 . Вкратце, срезы депарафинизировали в ксилоле и регидратировали в последовательной серии спиртовых разведений. Выделение антигена проводили микроволновым методом с цитратным буфером (10 мМ, рН 6,0). Иммуногистохимические исследования проводили с использованием методов авидин-биотинового комплекса. Первичными антителами были поликлональные кроличьи анти-HO-1 (Enzo, ADI-SPA-895-F, разведение 1:400) и CD163 (AbD, MAC342R, разведение 1:100). Подсчет CD163-позитивных клеток проводили на изображениях с большим увеличением (40-кратное увеличение), полученных с помощью цифровой камеры. Подсчеты проводились на 4 участках в каждом отделе головного мозга.
Вкратце, срезы депарафинизировали в ксилоле и регидратировали в последовательной серии спиртовых разведений. Выделение антигена проводили микроволновым методом с цитратным буфером (10 мМ, рН 6,0). Иммуногистохимические исследования проводили с использованием методов авидин-биотинового комплекса. Первичными антителами были поликлональные кроличьи анти-HO-1 (Enzo, ADI-SPA-895-F, разведение 1:400) и CD163 (AbD, MAC342R, разведение 1:100). Подсчет CD163-позитивных клеток проводили на изображениях с большим увеличением (40-кратное увеличение), полученных с помощью цифровой камеры. Подсчеты проводились на 4 участках в каждом отделе головного мозга.
Вестерн-блоттинг проводили, как описано ранее 14 . Вкратце, мозг замораживали in situ и брали образцы гематомы. Концентрацию белка определяли с помощью набора для анализа белка Bio-Rad (Hercules, Калифорния, США). Равное количество белка (50 мкг) суспендировали в загрузочном буфере, денатурировав при 95°C в течение 5 мин и загружали в гель SDS-PAGE. После электрофореза и переноса на чистую нитроцеллюлозную мембрану Hybond-C (Amersham) мембрану блокировали нежирным молочным буфером на 2 ч, а затем инкубировали с первичными антителами. Первичными антителами были поликлональные кроличьи анти-HO-1 (Enzo, ADI-SPA-895-F, разведение 1:1000), моноклональные мышиные антитела против человеческого CD47 (AbD, MCA911, разведение 1:1000) и моноклональные мышиные анти-GAPDH. (Fitzgerald, 10R-G109A, разведение 1:10000). Мембраны инкубировали со вторичными антителами, конъюгированными с пероксидазой хрена, в течение 1 часа при комнатной температуре. Плотность белковых полос определяли с помощью пленки Kodak X-OMAT и количественно определяли с помощью NIH Image J. Уровни HO-1 и CD47 в гематоме выражали как отношение HO-1/GAPDH или CD47/GAPDH.
После электрофореза и переноса на чистую нитроцеллюлозную мембрану Hybond-C (Amersham) мембрану блокировали нежирным молочным буфером на 2 ч, а затем инкубировали с первичными антителами. Первичными антителами были поликлональные кроличьи анти-HO-1 (Enzo, ADI-SPA-895-F, разведение 1:1000), моноклональные мышиные антитела против человеческого CD47 (AbD, MCA911, разведение 1:1000) и моноклональные мышиные анти-GAPDH. (Fitzgerald, 10R-G109A, разведение 1:10000). Мембраны инкубировали со вторичными антителами, конъюгированными с пероксидазой хрена, в течение 1 часа при комнатной температуре. Плотность белковых полос определяли с помощью пленки Kodak X-OMAT и количественно определяли с помощью NIH Image J. Уровни HO-1 и CD47 в гематоме выражали как отношение HO-1/GAPDH или CD47/GAPDH.
Измерения проводились персоналом, не имеющим представления о группах лечения. Все данные выражены как среднее значение ± стандартное отклонение. Данные анализировали с помощью тестов Стьюдента t или однофакторного дисперсионного анализа (ANOVA). Различия считали достоверными при р <0,05.
Различия считали достоверными при р <0,05.
Исследовали процесс рассасывания гематом на коронарных срезах головного мозга свиней после окрашивания гематоксилин-эозином. В гематоме происходит лизис эритроцитов. Для изучения изменения морфологии эритроцитов при развитии разрешения кровоизлияния измеряли диаметры эритроцитов в крае гематомы и в центре гематомы. Мы обнаружили, что диаметр эритроцитов постепенно уменьшался у края гематомы и в центре гематомы (например, день-3 у края гематомы: 2,71 ± 0,38 мкм против 3,89).± 0,35 мкм через 4 часа, p <0,01; центр гематомы: 2,61 ± 0,29 мкм против 3,75 ± 0,25 мкм через 4 часа, p <0,01. ). Большинство эритроцитов через 4 часа после ВЧГ имели форму двустороннего вогнутого диска («дискоцит»; ). Эритроциты в крае гематомы были довольно неправильной формы с пиком на 3-й день после ВЧГ, тогда как эритроциты в центре гематомы деформировались в сферические клетки одинакового размера («сфероциты»; ). Изменение формы эритроцитов из дискоцитов в сфероциты может быть связано с изменением проницаемости мембран.
Открыть в отдельном окне
(A) Корональные срезы перфузированного мозга поросенка с гематомами. (B) Динамика изменений сгустка по краям и центру гематомы. Масштабная линейка = 10 мкм, масштабная линейка = 2,5 мкм на вставках. (C) Диаметр эритроцитов по краю и центру гематомы. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами.
Содержание гемоглобина в сгустке () измеряли для оценки рассасывания гематомы. Уровень гемоглобина постепенно снижался с течением времени после начала ВМК со значительным снижением на 3-и сутки. Содержание гемоглобина в сгустке составляло 26,2 ± 5,2 мг/г через 4 часа, но снижалось до 13,9.± 0,9 мг/г на 3-й день ( p <0,01).
Открыть в отдельном окне
(A) Корональный срез in situ замороженного мозга поросенка после ВЧГ. Квадрат представляет собой площадь образца. (Б) Динамика содержания гемоглобина в гематоме. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами. (C) Динамика содержания MAC в гематоме. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами.
(C) Динамика содержания MAC в гематоме. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами.
Активация системы комплемента и образование МАК приводили к повышению проницаемости мембран и лизису эритроцитов. В настоящем исследовании содержание МАК в сгустке постепенно увеличивалось с заметным накоплением на 3-й день (53,5 ± 8,2 против 11,0 ± 3,9 нг/г через 4 часа, p<0,01, ) и оставалось на высоком уровне на 7-й день.
Эритрофагоцитоз наблюдался в крае гематомы на 3-й день (), а отложение гемосидерина определялось в крае гематомы на 7-й день (). Эритроциты в центре гематомы начинали фагоцитироваться макрофагами/микроглией на 7-е сутки (). Экспрессия CD 47 в гематоме была высокой в течение первых суток после ВЧГ и достоверно снижалась на 3-и сутки (9).0005 p <0,01 по сравнению с 4 часами и p <0,05 по сравнению с днем-1, ). Он оставался на низком уровне в день-7 ().
Открыть в отдельном окне
(A) Эритрофагоцитоз (стрелки) на 3-й и 7-й день в гематоме и отложении гемосидерина (стрелка) на 7-й день. Масштабная линейка = 10 мкм. (B) Динамика уровней CD47 в гематоме. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами.
Масштабная линейка = 10 мкм. (B) Динамика уровней CD47 в гематоме. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами.
CD163 и HO-1 положительные клетки проникли в гематому от края к центру после ICH (). Значительное увеличение количества клеток CD163 было обнаружено на 3-й день. Уровни белка HO-1 в гематоме также увеличились на 3-й день (HO-1/GAPDH: 0,65 ± 0,08 на 3-й день по сравнению с 0,04 ± 0,01 на 4-й час, 9).0005 р <0,01). Морфологические характеристики положительных по CD 163 и НО-1 клеток в сгустке были сходными с микроглией/макрофагами.
Открыть в отдельном окне
(A) Динамика иммунореактивности CD163 и количество положительных клеток в гематоме во времени. Верхняя шкала = 50 мкм, нижняя шкала = 10 мкм. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4 часами. (B) Динамика иммунореактивности HO-1 и уровня белка во времени. Верхняя шкала = 50 мкм, нижняя шкала = 10 мкм. Значения средние ± SD, * p <0,05, # p <0,01 по сравнению с 4-часовым.
Чтобы выяснить, влияет ли DFX на процесс рассасывания гематомы, поросятам с ICH вводили DFX или носитель в течение 3 дней. Мы обнаружили, что содержание гемоглобина в гематоме было значительно выше в группе, получавшей DFX, по сравнению с группой, получавшей носитель (15,9 ± 1,8 против 11,8 ± 0,8 мг/г, p <0,05, ). DFX также снижал содержание МАК в сгустке на 3-й день (33,0 ± 6,6 против 56,2 ± 9,2 нг/г в группе, получавшей носитель, р <0,05, ). Эти результаты свидетельствуют о том, что лечение DFX снижает процесс гемолиза после ICH, что может быть связано с уменьшением образования MAC.
Открыть в отдельном окне
(A) Уровни гемоглобина, (B) MAC и (C) CD47 в гематоме в группах, получавших носитель и DFX, через 3 дня после ICH. Значения являются средними ± SD, * p <0,05 по сравнению с группой, получавшей носитель.
Также исследовали влияние DFX на CD 47 и эритрофагоцитоз в сгустке. Потеря CD47 в сгустке была значительно снижена при лечении DFX на 3-й день (CD47/GAPDH: 1,32 ± 0,16 в группе ICH + DFX по сравнению с 0,74 ± 0,07 в группе ICH + носитель, p <0,05, ) и 7-й день (p<0,01, Приложение, рисунок I). Лечение DFX также вызывало значительное снижение количества инфильтрирующих CD163-позитивных и HO-1-позитивных клеток в гематоме на 3-й и 7-й день (рис. II и III в Приложении). Вестерн-блоттинг показал, что экспрессия белка HO-1 снижалась в гематоме в группе, получавшей DFX, на 3-й день (HO-1/GAPDH: 0,32 ± 0,04 по сравнению с 0,98 ± 0,07 в группе, получавшей носитель, p<0,05). , ) и на 7-й день (p<0,05, Приложение III).
Лечение DFX также вызывало значительное снижение количества инфильтрирующих CD163-позитивных и HO-1-позитивных клеток в гематоме на 3-й и 7-й день (рис. II и III в Приложении). Вестерн-блоттинг показал, что экспрессия белка HO-1 снижалась в гематоме в группе, получавшей DFX, на 3-й день (HO-1/GAPDH: 0,32 ± 0,04 по сравнению с 0,98 ± 0,07 в группе, получавшей носитель, p<0,05). , ) и на 7-й день (p<0,05, Приложение III).
Открыть в отдельном окне
(A) Иммунореактивность CD163 и количество положительных клеток в гематоме в группах, получавших носитель и DFX, через 3 дня после ICH. Верхняя шкала = 50 мкм, нижняя шкала = 10 мкм. Значения средние ± SD, * p <0,05. (B) Иммунореактивность HO-1 и уровни белков в гематоме в группах, получавших носитель и DFX, через 3 дня после ICH. Верхняя шкала = 50 мкм, нижняя шкала = 10 мкм. Значения средние ± SD, * p <0,05.
Основные результаты этого исследования: 1) эритроциты в сгустке со временем становятся меньше; 2) постепенное повышение уровня МАК сгустка с прогрессирующим снижением уровня гемоглобина; 3) устойчивое снижение уровня CD47 в сгустке во времени, что может быть связано со значительным эритрофагоцитозом; 4) увеличение со временем числа CD 163- и НО-1-позитивных клеток, инфильтрирующих гематому; 5) DFX ослаблял образование МАК и эритрофагоцитоз.
Диаметр эритроцитов в пределах гематомы уменьшался со временем после ВЧГ. Это может быть связано с комплемент-опосредованным лизисом клеток. Настоящее исследование демонстрирует накопление МАК в сгустке с течением времени. Эритроциты чувствительны к комплементзависимому гемолизу с образованием МАК. После активации каскада комплемента МАК на клеточной мембране образует пору, что приводит к изменению проницаемости мембраны 17 , что в конечном итоге приводит к морфологическим изменениям эритроцитов и лизису эритроцитов. Аномалии клеточной мембраны вызывают морфологическое изменение эритроцитов от дискоцитов до сфероцитов с постепенным уменьшением диаметра эритроцитов 18, 19 . Однако следует отметить, что другие факторы могут вызывать уменьшение размера эритроцитов. Например, сморщивание эритроцитов происходит при эриптозе, форме суицидальной гибели клеток эритроцитов 20 . Возникает ли эриптоз в гематоме, требует дальнейшего изучения.
Фагоцитоз эритроцитов микроглией/макрофагами играет роль в исчезновении гематомы после ICH 7 . В текущем исследовании изучали естественную временную динамику экспрессии CD47 в гематоме на модели ВМК свиней и обнаружили, что уровни CD47 в сгустке со временем снижаются. Мы также показали, что снижение уровня CD47 в сгустке связано с инфильтрацией микроглии/макрофагов. CD47 как сигнал «не ешь меня» экспрессируется на эритроцитах и играет важную роль в регуляции эритрофагоцитоза 7 . CD47 оказывает ингибирующее действие на фагоцитоз посредством связывания с ингибирующим иммунорецептором SIRPα, экспрессируемым микроглией/макрофагами 21 . Таким образом, CD47-SIRPα представляет собой отрицательную обратную связь для эритрофагоцитоза 22 . Потеря экспрессии CD47 в эритроцитах может инициировать эритрофагоцитоз после ВМК и привести к исчезновению гематомы. Наше недавнее исследование показало, что истощение CD47 в эритроцитах приводит к более быстрому исчезновению гематомы, при этом микроглия/макрофаги с меньшей вероятностью фагоцитируют эритроциты с помощью CD47, чем эритроциты с дефицитом CD47 7 .
В текущем исследовании изучали естественную временную динамику экспрессии CD47 в гематоме на модели ВМК свиней и обнаружили, что уровни CD47 в сгустке со временем снижаются. Мы также показали, что снижение уровня CD47 в сгустке связано с инфильтрацией микроглии/макрофагов. CD47 как сигнал «не ешь меня» экспрессируется на эритроцитах и играет важную роль в регуляции эритрофагоцитоза 7 . CD47 оказывает ингибирующее действие на фагоцитоз посредством связывания с ингибирующим иммунорецептором SIRPα, экспрессируемым микроглией/макрофагами 21 . Таким образом, CD47-SIRPα представляет собой отрицательную обратную связь для эритрофагоцитоза 22 . Потеря экспрессии CD47 в эритроцитах может инициировать эритрофагоцитоз после ВМК и привести к исчезновению гематомы. Наше недавнее исследование показало, что истощение CD47 в эритроцитах приводит к более быстрому исчезновению гематомы, при этом микроглия/макрофаги с меньшей вероятностью фагоцитируют эритроциты с помощью CD47, чем эритроциты с дефицитом CD47 7 . Однако следует также отметить, что уровни CD47 в перигематомном мозге были повышены в этой модели свиней ICH 13 . Точная роль CD47 в клетках головного мозга нуждается в дальнейшем изучении.
Однако следует также отметить, что уровни CD47 в перигематомном мозге были повышены в этой модели свиней ICH 13 . Точная роль CD47 в клетках головного мозга нуждается в дальнейшем изучении.
Микроглия представляет собой резидентные фагоцитарные клетки головного мозга, которые активируются в ответ на травмирующие стимулы. Трансформация неактивной микроглии в фагоцитарный фенотип связана с изменениями в рецепторах клеточной поверхности 23 . Данные свидетельствуют о том, что CD163 действует как рецептор-поглотитель гемоглобина на микроглии/макрофагах, играя роль в эритрофагоцитозе 8 . Благодаря дополнительным исследованиям поляризации микроглии/микрофагов CD163 классифицируется как маркер альтернативно активируемого фенотипа (фенотип M2, фагоцитарный фенотип) 23–25 . Опосредованный CD163 клиренс гемоглобина/гематомы участвует в индукции HO-1, фермента, ограничивающего скорость деградации гема 26 . Обычно HO-1 рассматривается как белок окислительного стресса в микроглии и связан с повреждением головного мозга после ICH 11 . Однако недавнее исследование показало, что HO-1 связан с клиренсом крови за счет усиления эритрофагоцитоза после инсульта 9.0019 9 . В текущем исследовании мы обнаружили, что инфильтрация CD163 и HO-1-позитивных клеток в гематому увеличивалась со временем параллельно рассасыванию гематомы. Вопрос о том, участвует ли HO-1 в регуляции эритрофагоцитоза после ВЧГ, следует проверить дополнительно.
Однако недавнее исследование показало, что HO-1 связан с клиренсом крови за счет усиления эритрофагоцитоза после инсульта 9.0019 9 . В текущем исследовании мы обнаружили, что инфильтрация CD163 и HO-1-позитивных клеток в гематому увеличивалась со временем параллельно рассасыванию гематомы. Вопрос о том, участвует ли HO-1 в регуляции эритрофагоцитоза после ВЧГ, следует проверить дополнительно.
Наши исследования показали, что DFX оказывает нейропротекторное действие на повреждение головного мозга после ICH, в основном за счет детоксикации железа 10, 27 . Настоящее исследование показало, что лечение DFX снижает образование MAC в сгустке. Меньшее накопление МАК в сгустке может привести к уменьшению лизиса эритроцитов и меньшей перегрузке мозга железом. DFX также уменьшал потерю CD47 и инфильтрацию микроглии/макрофагов после ICH, предполагая, что он также влияет на эритрофагоцитоз. В совокупности эти данные могут лежать в основе наших предыдущих результатов, показывающих, что DFX замедляет рассасывание гематомы после ICH у старых крыс 12 . В наших будущих исследованиях будет проверено влияние комбинированной терапии (хелатирование железа плюс усиление эритрофагоцитоза) на повреждение головного мозга, вызванное ICH.
В наших будущих исследованиях будет проверено влияние комбинированной терапии (хелатирование железа плюс усиление эритрофагоцитоза) на повреждение головного мозга, вызванное ICH.
Хотя это новое исследование, посвященное изменениям гематомы с использованием модели ВМК на крупных животных, существует несколько ограничений: 1) размеры гематомы не измерялись; 2) причинно-следственной связи накопления МАК и просвета гематомы не установлено; и 3) до сих пор неясно, является ли гемолиз или фагоцитоз основным процессом очистки сгустка.
Таким образом, в этом исследовании представлены данные о естественном течении рассасывания гематомы после ВМК на модели поросят. Гемолиз и эритрофагоцитоз связаны с рассасыванием гематомы после ВЧГ, которое модифицируется DFX. Это исследование предоставляет важную информацию о разрешении гематомы и дает информацию для будущих исследований о том, как манипулировать этим процессом.
Нажмите здесь для просмотра. (6.7M, pdf)
Источники финансирования: Исследование выполнено при поддержке гранта NS-084049, NS-091545, NS-090925, NS-073595 и NS-079157 Национального института здравоохранения (NIH).
Возможные конфликты интересов: Мы заявляем об отсутствии конфликта интересов.
1. Xi G, Keep RF, Hoff JT. Механизмы повреждения головного мозга после внутримозгового кровоизлияния. Ланцет Нейрол. 2006; 5:53–63. [PubMed] [Google Scholar]
2. Hua Y, Xi G, Keep RF, Hoff JT. Активация комплемента в головном мозге после экспериментального внутримозгового кровоизлияния. Дж Нейрохирург. 2000;92:1016–1022. [PubMed] [Google Scholar]
3. Xi G, Hua Y, Keep RF, Younger JG, Hoff JT. Системное истощение комплемента уменьшает перигематомный отек головного мозга у крыс. Инсульт. 2001; 32: 162–167. [PubMed] [Google Scholar]
4. Zhao X, Grotta J, Gonzales N, Aronowski J. Разрешение гематомы как терапевтическая цель: роль микроглии/макрофагов. Инсульт. 2009;40:S92–94. [PubMed] [Google Scholar]
5. Zhao X, Sun G, Zhang J, Strong R, Song W, Gonzales N, et al. Разрешение гематомы как цель лечения внутримозгового кровоизлияния: роль гамма-рецептора, активируемого пролифератором пероксисом, в микроглии/макрофагах. Энн Нейрол. 2007; 61: 352–362. [PubMed] [Академия Google]
Энн Нейрол. 2007; 61: 352–362. [PubMed] [Академия Google]
6. Олденборг П.А., Железняк А., Фанг Ю.Ф., Лагенаур С.Ф., Грешам Х.Д., Линдберг Ф.П. Роль cd47 как самомаркера эритроцитов. Наука. 2000; 288:2051–2054. [PubMed] [Google Scholar]
7. Ni W, Mao S, Xi G, Keep RF, Hua Y. Роль эритроцитов cd47 в клиренсе внутримозговой гематомы. Инсульт. 2016; 47: 505–511. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Abraham NG, Drummond G. Cd163-опосредованное поглощение гемоглобина-гема активирует макрофаги ho-1, обеспечивая противовоспалительную функцию. Цирк рез. 2006;99:911–914. [PubMed] [Google Scholar]
9. Schallner N, Pandit R, LeBlanc R, 3rd, Thomas AJ, Ogilvy CS, Zuckerbraun BS, et al. Микроглия регулирует клиренс крови при субарахноидальном кровоизлиянии с помощью гемоксигеназы-1. Джей Клин Инвест. 2015;125:2609–2625. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Keep RF, Hua Y, Xi G. Внутримозговое кровоизлияние: механизмы повреждения и терапевтические цели. Ланцет Неврология. 2012; 11: 720–731. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ланцет Неврология. 2012; 11: 720–731. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Xi G, Strahle J, Hua Y, Keep RF. Прогресс в трансляционных исследованиях внутримозгового кровоизлияния: виден ли конец? Прог Нейробиол. 2014; 115С:45–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Hatakeyama T, Okauchi M, Hua Y, Keep RF, Xi G. Дефероксамин уменьшает гибель нейронов и лизис гематомы после внутримозгового кровоизлияния у старых крыс. Перевод инсульта Res. 2013; 4: 546–553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Zhou X, Xie Q, Xi G, Keep RF, Hua Y. Экспрессия cd47 в мозге на модели внутримозгового кровоизлияния у свиней. Мозг Res. 2014;1574:70–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Xie Q, Gu Y, Hua Y, Liu W, Keep RF, Xi G. Дефероксамин ослабляет повреждение белого вещества в модели внутримозгового кровоизлияния поросенка. Инсульт. 2014;45:290–292. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Wagner KR, Xi G, Hua Y, Kleinholz M, de Courten-Myers GM, Myers RE. Ранние метаболические изменения в отечных перигематомных областях головного мозга после экспериментального внутримозгового кровоизлияния. Дж Нейрохирург. 1998; 88: 1058–1065. [PubMed] [Google Scholar]
Wagner KR, Xi G, Hua Y, Kleinholz M, de Courten-Myers GM, Myers RE. Ранние метаболические изменения в отечных перигематомных областях головного мозга после экспериментального внутримозгового кровоизлияния. Дж Нейрохирург. 1998; 88: 1058–1065. [PubMed] [Google Scholar]
16. Wagner KR, Xi G, Hua Y, Kleinholz M, de Courten-Myers GM, Myers RE, et al. Модель крупозного внутримозгового кровоизлияния у свиней: быстрое развитие отека в перигематомном белом веществе. Инсульт. 1996;27:490–497. [PubMed] [Google Scholar]
17. Николсон-Веллер А., Гальперин Дж.А. Мембранная передача сигналов с помощью комплемента c5b-9, мембраноатакующего комплекса. Иммунол Рез. 1993; 12: 244–257. [PubMed] [Google Scholar]
18. Motoyama K, Arima H, Toyodome H, Irie T, Hirayama F, Uekama K. Влияние 2,6-ди-о-метил-альфа-циклодекстрина на гемолиз и морфологические изменения в эритроциты кролика. Eur J Pharm Sci. 2006; 29: 111–119. [PubMed] [Google Scholar]
19. Blasi B, D'Alessandro A, Ramundo N, Zolla L. Хранение эритроцитов и клеточная морфология. Трансфус Мед. 2012;22:90–96. [PubMed] [Google Scholar]
Хранение эритроцитов и клеточная морфология. Трансфус Мед. 2012;22:90–96. [PubMed] [Google Scholar]
20. Ланг Ф., Кадри С.М. Механизмы и значение эриптоза, суицидальной гибели эритроцитов. Очищение крови. 2012;33:125–130. [PubMed] [Google Scholar]
21. Burger P, Hilarius-Stokman P, de Korte D, van den Berg TK, van Bruggen R. Cd47 функционирует как молекулярный переключатель для фагоцитоза эритроцитов. Кровь. 2012;119:5512–5521. [PubMed] [Google Scholar]
22. Олссон М., Нильссон А., Олденборг П.А. Клетка-мишень cd47 регулирует активацию макрофагов и эритрофагоцитоз. Трансфус Клин Биол. 2006;13:39–43. [PubMed] [Google Scholar]
23. Франко Р., Фернандес-Суарес Д. Альтернативная активация микроглии и макрофагов в центральной нервной системе. Прог Нейробиол. 2015; 131:65–86. [PubMed] [Google Scholar]
24. Durafourt BA, Moore CS, Zammit DA, Johnson TA, Zaguia F, Guiot MC, et al. Сравнение поляризационных свойств микроглии взрослого человека и макрофагов крови. Глия. 2012;60:717–727. [PubMed] [Google Scholar]
Глия. 2012;60:717–727. [PubMed] [Google Scholar]
25. Дэвид С., Кронер А. Репертуар реакций микроглии и макрофагов после травмы спинного мозга. Нат Рев Нейроски. 2011;12:388–399. [PubMed] [Google Scholar]
26. Herz J, Strickland DK. Lrp: многофункциональный поглотитель и сигнальный рецептор. Джей Клин Инвест. 2001; 108: 779–784. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Gu Y, Hua Y, Keep RF, Morgenstern LB, Xi G. Дефероксамин снижает накопление железа, вызванное внутримозговой гематомой, и гибель нейронов у поросят. Инсульт. 2009;40:2241–2243. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Для местного лечения гнойных ран, инфицированных, в том числе смешанной микрофлорой (в т. ч. стафилококками, синегнойной и кишечной палочками), в первой фазе раневого процесса (гнойно-некротической).
ч. стафилококками, синегнойной и кишечной палочками), в первой фазе раневого процесса (гнойно-некротической).
Медитин является высокоспецифичным и селективным агонистом альфа-2-адренергических рецепторов. Механизм седативного действия Медитина отличается от механизма седативного действия бензодиазепинов и пропофола за счет влияния на гаммакергические пути. Минимально влияет на функцию дыхания. Более мягкий выход из наркоза.
(Ромына)

Для лечения крупного рогатого скота, лошадей, свиней, овец, коз, собак, пушных зверей, кроликов, уток, кур при инфекционных болезнях, возбудители которых чувствительны к пенициллину.
Заболевания копыт и копыт, при которых показано лечение дегтем, операции на копытах, лечение дефектов копыт, лечение после регулярной расчистки копыт, наложение повязок на копыта и закрывающих повязок. Дерматомикозы у животных, особенно на ранних стадиях или при последовательной терапии, когда благоприятно проявляются подсушивающие свойства дегтя.
(Румыния)
Лечение крупного рогатого скота, лошадей, овец, коз, свиней, собак, пушных зверей (норки, песцы) и кроликов, больных некробактериозом, пастереллезом, пневмонией, маститом, раневой инфекцией и инфекцией мочевыводящих путей , септицемия, флегмона, актиномикоз, эмфизема легких, карбункул и другие заболевания, вызванные микроорганизмами, чувствительными к пенициллинам.
Лечение крупного рогатого скота, лошадей, овец, коз, свиней, собак, пушных зверей (норки, песцы) и кроликов, больных некробактериозом, пастереллезом, пневмонией, маститом, раневой инфекцией и инфекцией мочевыводящих путей , септицемия, флегмона, актиномикоз, эмфизема легких, карбункул и другие заболевания, вызванные микроорганизмами, чувствительными к пенициллинам.
Виды Лошади, крупный рогатый скот, овцы, козы, свиньи, собаки, кошки, кролики и птицы. Состав 100 г препарата содержат действующие вещества: ксероформ – 5 г, стрептоцид – 5 г. Вспомогательные вещества: тальк, крахмал. Показания Лечение крупного рогатого скота, лошадей, овец, коз, свиней, собак
Назначают крупному рогатому скоту, лошадям, верблюдам, свиньям, мелкому рогатому скоту, собакам, кошкам, пушным зверям, кроликам и нутриям в комплексной терапии в качестве иммуномодулирующего средства при заболеваниях, сопровождающихся развитием иммунодефицита, в том числе агранулоцитоза и лейкопении.
СОЛЬ ПИЩЕВАЯ в брикетах 5 кг Основные характеристики: NaCl не менее 97%, влажность не более 0,5%, нерастворимые в воде вещества не более 2,00%, грануляция: 0-10 мм.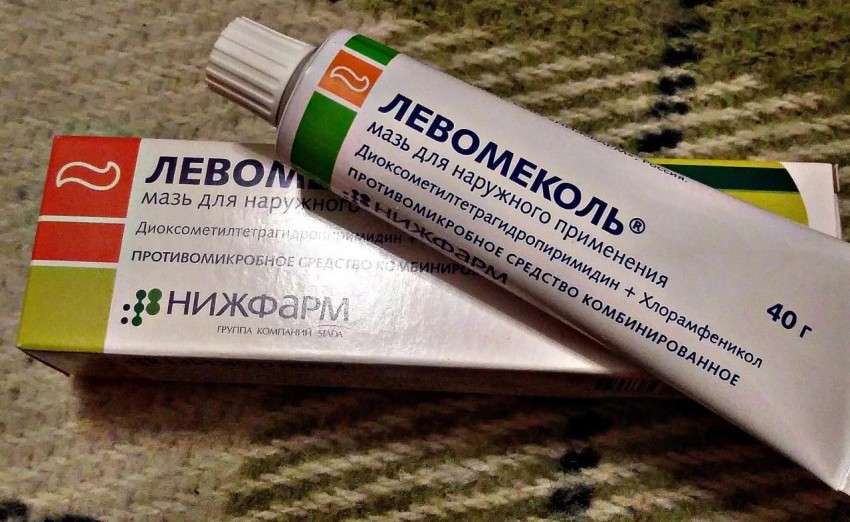 Кормовая соль обеспечивает соль, подходящую для всех видов животных. Здоровье и
Кормовая соль обеспечивает соль, подходящую для всех видов животных. Здоровье и
(Română)
(Румыния)