2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Метод определения
Хемилюминесцентный иммуноанализ (технология Architect, Abbott. SARS-CoV-2 IgG II Quant), количественный тест.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Для проведения исследования в медицинских офисах Москвы необходимо предъявить СНИЛС и документ удостоверяющий личность.
Синонимы: Анализ крови для количественного определения IgG-антител к спайковому (S) белку SARS-CoV-2; Количественное определение IgG антител к RBD домену S-белка SARS-CoV-2; IgG Антитела к коронавирусу SARS-CoV-2, включая нейтрализующие IgG; Тест на IgG антитела к спайковому (S) белку коронавируса; Антитела к рецептор-связывающему домену вируса, вызывающего COVID-19, Иммунитет к коронавирусу SARS-CoV-2; Антитела класса G к SARS-CoV-2 RBD; Анти-RBD антитела класса G.
Antibodies to RBD domain of spike (S) protein SARS-CoV-2, IgG; Antibodies IgG for RBD SARS-CoV-2 spike (S) protein; IgG antibodies to SARS-CoV-2 RBD domain of spike (S) protein of SARS-CoV-2; Сoronavirus immunity.
Диапазон количественного измерения: 2,9 - 5680 BAU/мл.
SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2 – тяжелого острого респираторного синдрома коронавирус 2) – официальное наименование вируса, вызвавшего эпидемию COVID-19. COVID-19 (coronavirus disease 2019 – коронавирусная болезнь 2019) – название болезни, которую индуцирует новый вид коронавируса.
Источником передачи инфекции SARS-CoV-2 является, в большинстве случаев, больной человек, в том числе находящийся в инкубационном периоде заболевания, который составляет от 2 до 14 (в среднем 5-7) дней. Клинические проявления могут быть аналогичны неспецифичным симптомам ОРВИ (повышение температуры, сухой кашель, затруднение дыхания). Дополнительные эпидемиологические признаки – вероятный либо подтвержденный контакт с больными COVID-19, а также проявления в виде пневмонии с характерными изменениями в легких по данным компьютерной томографии (КТ), свидетельствуют о высокой вероятности COVID-19.
Дополнительные эпидемиологические признаки – вероятный либо подтвержденный контакт с больными COVID-19, а также проявления в виде пневмонии с характерными изменениями в легких по данным компьютерной томографии (КТ), свидетельствуют о высокой вероятности COVID-19.
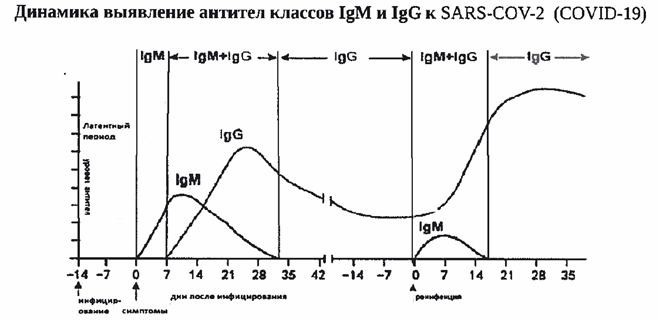
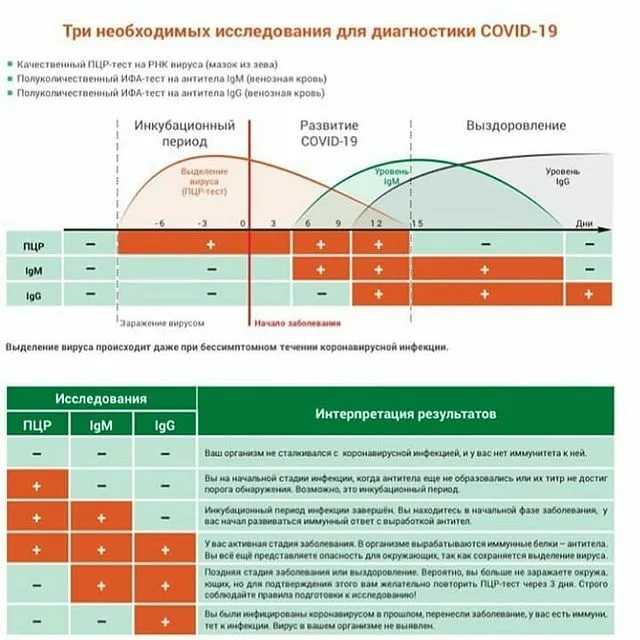
SARS-CoV-2 стимулирует гуморальный и клеточный ответ иммунной системы инфицированного человека. Гуморальный ответ характеризуется продукцией антител IgM и IgG классов, которые способны специфически распознавать и связывать чужеродные белки, характерные для патогена, участвуя в механизмах его нейтрализации и удаления. Антитела класса IgM появляются первыми, через несколько дней от появления симптомов. Почти одновременно или вскоре вслед за ними появляются IgG (более, чем у половины пациентов в период 8-14 дней от возникновения клинических признаков инфекции, а в период от 15 дней и более – у 99% пациентов). По уровню и динамике концентрации антител в крови гуморальный иммунный ответ индивидуально варьирует, в том числе в зависимости от тяжести болезни. Уровень IgM снижается до неопределяемого обычно в пределах до одного, реже – двух месяцев от начала заболевания, в то время как IgG антитела могут сохраняться в крови длительное время (3-5 месяцев и более), выполняя защитную функцию.
Уровень IgM снижается до неопределяемого обычно в пределах до одного, реже – двух месяцев от начала заболевания, в то время как IgG антитела могут сохраняться в крови длительное время (3-5 месяцев и более), выполняя защитную функцию.
Четыре структурных белка, которые кодирует РНК вируса SARS-CoV-2, – это спайковый (S), оболочечный (E), нуклеокапсидный (N) и мембранный (M). Структуры, выступающие на поверхности вируса подобно шипам и придающие вириону сходство с короной, сформированы спайковым (S) белком. S-белок состоит из двух субъединиц (S1 и S2). Нуклеокапсидный и спайковый белки в ходе инфекции вызывают наиболее выраженный антительный ответ. При этом нейтрализующая активность антител, вырабатываемых против SARS-CoV-2, преимущественно соотносится с антителами к S-белку (который является главной мишенью в вакцинологии). На S1 субъединице этого белка располагается рецептор-связывающий домен (RBD), который способен прочно связываться с рецепторами ангиотензин-превращающего фермента (ACE2), расположенными на клетках различных тканей, в том числе на эпителии легочных альвеол. Взаимодействие RBD домена с рецепторами ACE2 является начальным этапом внедрения вируса в клетку. Антитела, специфически связывающиеся с RBD областью S1 субъединицы спайкового белка коронавируса, способны ингибировать его связывание с клеточными рецепторами, оказывая выраженный нейтрализующий эффект.
Взаимодействие RBD домена с рецепторами ACE2 является начальным этапом внедрения вируса в клетку. Антитела, специфически связывающиеся с RBD областью S1 субъединицы спайкового белка коронавируса, способны ингибировать его связывание с клеточными рецепторами, оказывая выраженный нейтрализующий эффект.
Присутствие специфических антител к вирусу SARS-CoV-2 класса G указывает на факт недавнего или прошлого взаимодействия с вирусом. Поэтому такие тесты используют в комплексной диагностике при наличии подозрений на инфекцию новым коронавирусом или ее осложнения. Основной метод лабораторного подтверждения острой инфекции COVID-19 – выявление методами полимеразной цепной реакции (ПЦР) РНК вируса в биоматериале, взятом из дыхательных путей, обычно в мазке из носоглотки и ротоглотки. Однако информативность РНК-тестирования зависит от достаточности содержания вируса в биоматериале выбранной локализации на той или иной стадии инфекции, а также качества взятия материала.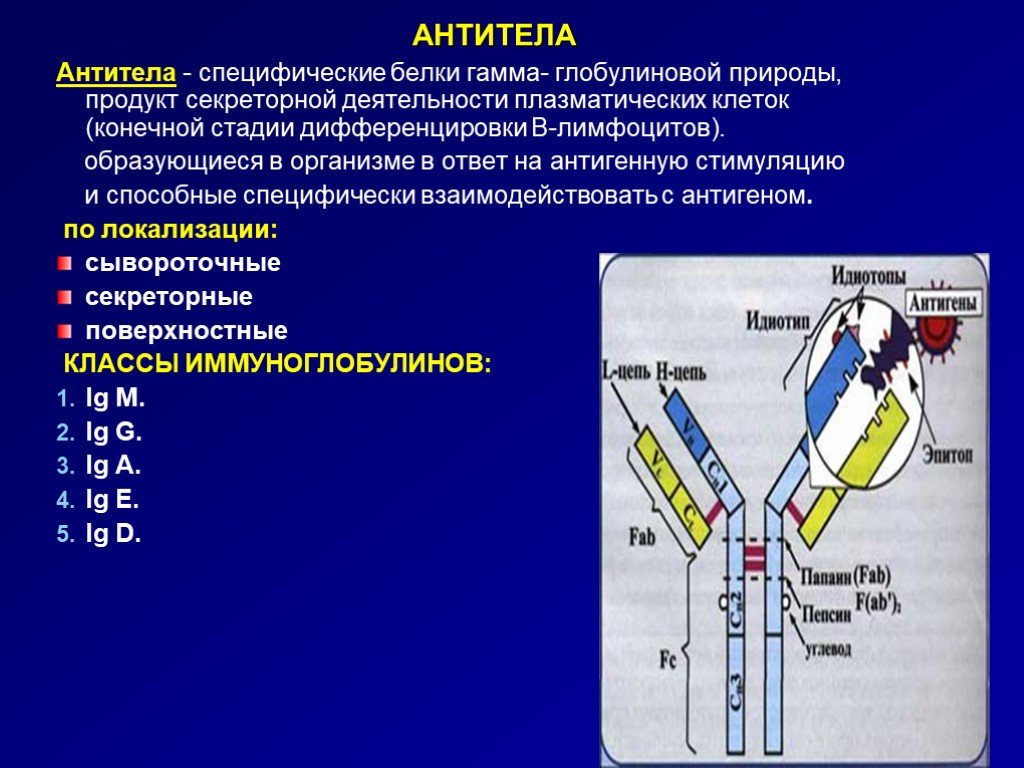 Наиболее информативны ПЦР-исследования мазков из рото- и носоглотки в первые 1-5 дней от начала клинических проявлений инфекции. На более поздних сроках (более 1-2 недель) целесообразно дополнительно к ПЦР-тестированию мазков применять исследование крови на наличие специфических антител, вырабатываемых организмом в ответ на инфекцию SARS-CoV-2.
Наиболее информативны ПЦР-исследования мазков из рото- и носоглотки в первые 1-5 дней от начала клинических проявлений инфекции. На более поздних сроках (более 1-2 недель) целесообразно дополнительно к ПЦР-тестированию мазков применять исследование крови на наличие специфических антител, вырабатываемых организмом в ответ на инфекцию SARS-CoV-2.
Оценка уровня IgG антител к SARS-CoV-2 может использоваться также с целью выявления иммунологических свидетельств прошлой (в том числе субклинической или бессимптомной) инфекции для оценки вероятного иммунного статуса обследуемого человека по отношению к этому вирусу, прослеживания контактов, популяционных эпидемиологических исследований.
Поскольку большинство зарегистрированных и разрабатываемых вакцин против SARS-CoV-2 нацелено на антитела к S-белку, количественное определение уровня IgG антител к SARS-CoV-2 S-белку (RBD) может быть информативным методом оценки динамики иммунного ответа на вакцинацию такими препаратами (в частности, для оценки ответа на применение вакцины Гам-КОВИД-Вак – «Спутник V»), Спутник Лайт, а также цельновирионных инактивированных вакцин (в том числе – КовиВак производства ФНЦ им. М.П. Чумакова) и вакцин на основе мРНК S-белка (в частности - вакцин Pfizer-BioNTech и Moderna или другие). Тест не применим для оценки иммунитета после вакцинации вакциной ЭпиВакКорона)).
М.П. Чумакова) и вакцин на основе мРНК S-белка (в частности - вакцин Pfizer-BioNTech и Moderna или другие). Тест не применим для оценки иммунитета после вакцинации вакциной ЭпиВакКорона)).
Следует отметить, что результаты предлагаемого теста количественного исследования IgG антител к SARS-CoV-2 S-белку (RBD), независимо от используемой антигенной мишени, нельзя считать прямым методом определения нейтрализующих антител, поскольку оценка нейтрализующей активности антител требует специальных методов, малодоступных для рутинного практического использования. Но результаты этого теста проявляют очень высокую корреляцию с результатами тестов нейтрализации при проведении параллельных исследований.
Оценка напряженности поствакцинального протективного иммунитета должна проводиться с использованием тест-систем, специфичных к наличию S-белка или RBD домену S-белка вируса SARS-CoV-2, не ранее чем на 42-й день после первого этапа вакцинации.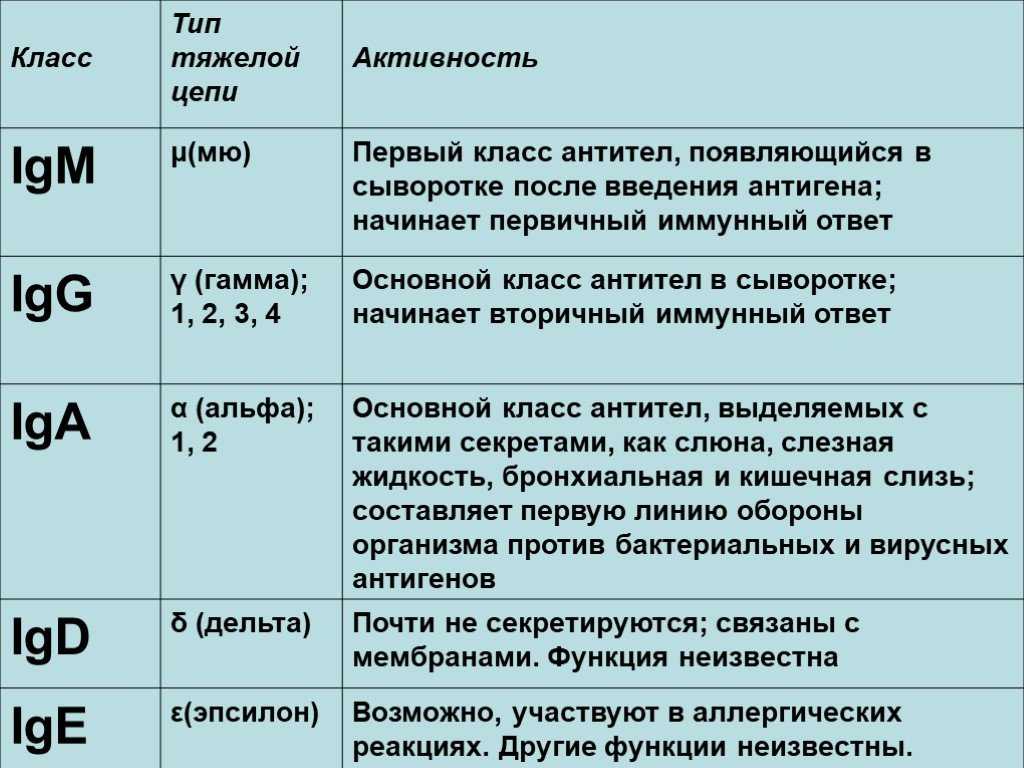
Версия для печати
Для данного исследования лаборатория принимает следующий биоматериал:
Условия подготовки определяются лечащим врачом.
Взятие биоматериала рекомендуется проводить: не ранее чем через 3 часа после последнего приема пищи, допускается употребление негазированной воды.
Результат теста будет автоматически выгружен на портал
Госуслуг и в приложении «Госуслуги Стопкоронавирус». При оформлении заказа потребуется предъявить
администратору документы - паспорт и СНИЛС - для внесения данных в Договор-заказ.
Как получить QR-код по результатам анализа на антитела на COVID-19 на едином портале Госуслуг.
Иммуноглобулины, или специфические антитела, формирующиеся в ответ на инфицирование коронавирусом SARS-CoV-2, отличаются не только классами: А, М, G, и периодом циркуляции в крови. Антитела, отличаются еще и особенностями иммунного ответа-в зависимости от того, к какому белку коронавируса они сформировались.
Антитела к spike-белку коронавируса SARS-CoV-2, способны прикрепляться к вирусу и, удерживая вирусные частицы на поверхности клетки, препятствуют инфицированию. Ig G к spike-белку обеспечивают защиту от коронавируса SARS-CoV-2, поэтому их еще называют нейтрализующие антитела.
Ig G к spike-белку обеспечивают защиту от коронавируса SARS-CoV-2, поэтому их еще называют нейтрализующие антитела.
Обнаружение при лабораторном исследовании антител к полноразмерному spike-белку коронавируса, отдельным субъединицам, и, к рецептор-связывающему домену – RBD - помогает не только подтвердить, что пациент перенес СOVID-19. Но и помогает судить о формировании защитного иммунного ответа против коронавируса SARS-CoV-2.
Количественное определение нейтрализующих антител к RBD spike-белка позволит оценить динамику изменений защитного иммунного ответа на перенесенный COVID-19 или вакцинацию. В том случае, если для иммунизации использовались вакцины «Спутник V», «Спутник Light». Или другие вакцины, антигеном в которых является spike-белок.
Выработка IgG нейтрализующих антител к RBD spike-белка наблюдается на 8-15 день болезни. Причем выработка иммуноглобулинов происходит вне зависимости от наличия или отсутствия симптомов СOVID-19.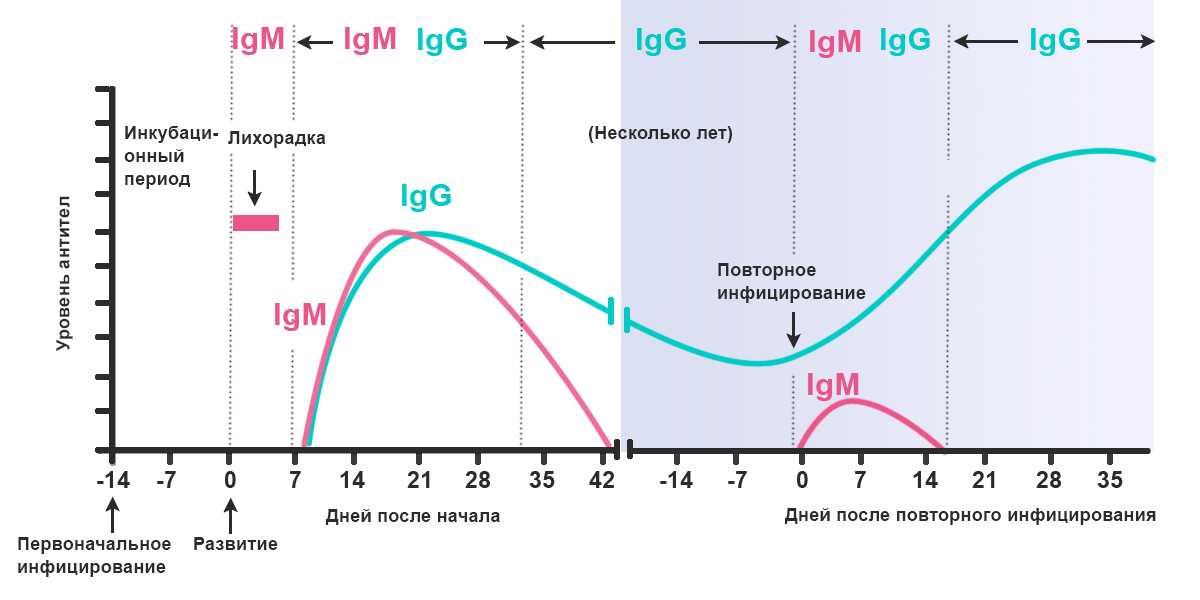
Данное исследование не подходит для оценки иммунного ответа после введения вакцины «ЭпиВакКорона».
Показания для проведения исследования:
Данный тест не может быть использован для диагностики или исключения диагноза острой инфекции SARS-CoV-2.
Данный тест не может быть использован для оценки протективного иммунитета после вакцинации вакциной «ЭпиВакКорона».
Аналитический интервал измерения для исследования составляет 21.0 – 40000.
Результат данного теста указывается в единицах связывающих антител –BAU (Binding Antibody Units), принятых первым международным стандартом ВОЗ.
Положительно
Формирование иммунного ответа против коронавируса SARS-CoV-2 в результате перенесенного COVID-19 или вакцинации.
Отрицательно
После перенесенного COVID-19 уровень антител может снижаться с течением времени до неопределяемого уровня. На данный момент нет окончательных данных о длительности протективного иммунитета.
На данный момент нет окончательных данных о длительности протективного иммунитета.
Результат исследования Ig G к RBD белка S1 не является прямым методом определения нейтрализующих антител против коронавируса SARS-CoV-2. Но в параллельных научных исследованиях, результаты этого анализа, показали высокую корреляцию с результатами тестов нейтрализации вируса.
Для пересчета результата в арбитражные единицы AЕ/ мл (условные единицы производителя тест-системы ARCHITECT SARS-CoV-2 IgG II Quant) необходимо воспользоваться формулой: результат исследования в BAU/0.142
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
044762
можно сдать на дому
При единовременном заказе нескольких услуг, услуга по сбору биоматериала оплачивается только один раз.
1 150 р.
в составе комплекса дешевле
Указанный срок не включает день взятия биоматериала.
1-2 к.д.
результаты за 3-6 часов (CITO)
COVID-19. Определение антител к SARS-CoV-2: IgM к S-белку и IgG к RBD-домену S-белка
 д.
д.Цена: 1 950 р.
COVID-19. Определение антител к SARS-CoV-2: IgG к нуклеокапсидному белку и IgG к RBD-домену S-белка
Цена: 1 775 р.
COVID-19. Определение антител к SARS-CoV-2: IgM к S-белку; IgG к нуклеокапсидному белку; IgG к RBD-домену S-белка
 д.
д.Цена: 2 595 р.
COVID-19. Определение антител к SARS-CoV-2: IgM к S-белку; IgG к нуклеокапсидному белку; IgG к RBD-домену S-белка
Цена: 1 р.
COVID-19. Определение антител к SARS-CoV-2: IgG к нуклеокапсидному белку и IgG к RBD-домену S-белка
 д.
д.Цена: 1 р.
Общий анализ крови + СОЭ с лейкоцитарной формулой (с микроскопией мазка крови при наличии патологических сдвигов), венозная кровь
Цена:
743 р.
Креатинин (Сreatinine)
Цена: 286 р.
Аланинаминотрансфераза (Alanine aminotransferase)
 д.
д.Цена: 275 р.
Аспартатаминотрансфераза (Aspartate aminotransferase)
Цена: 275 р.
Глюкоза (Glucose)
 д.
д.Цена: 270 р.
Показать еще
О возможных противопоказаниях необходимо проконсультироваться со специалистом
1. Berry JD, Jones S, Drebot MA, Andonov A, Sabara M, Yuan X, et al. Разработка и характеристика нейтрализующих моноклональных антител к SARS-коронавирусу. Дж. Вироловые методы. 2004; 120:87–96. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Gubbins MJ, Plummer FA, Yuan XY, Johnstone D, Drebot M, Andonova M, et al. Молекулярная характеристика панели мышиных моноклональных антител, специфичных к коронавирусу SARS. Мол Иммунол. 2005; 42: 125–136. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Stadler K, Masignani V, Eickmann M, Becker S, Abrignani S, Klenk HD, et al.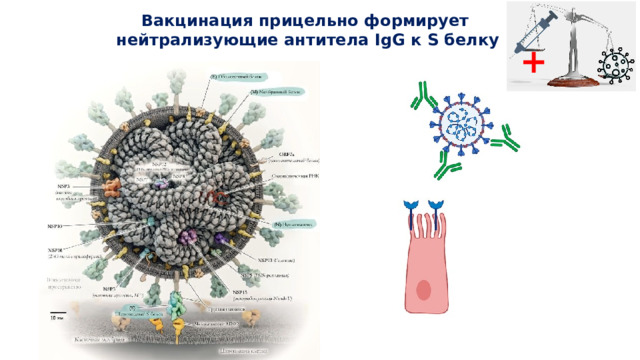 SARS — начинаем понимать новый вирус. Nat Rev Microbiol. 2003; 1: 209–218. [Бесплатная статья PMC] [PubMed] [Google Scholar]
SARS — начинаем понимать новый вирус. Nat Rev Microbiol. 2003; 1: 209–218. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Li F, Li W, Farzan M, Harrison SC. Структура рецептор-связывающего домена спайка коронавируса SARS в комплексе с рецептором. Наука. 2005; 309: 1864–1868. [PubMed] [Google Scholar]
5. Чакраборти С., Прабакаран П., Сяо Х., Димитров Д.С. Домен, связывающий рецептор S-гликопротеина коронавируса SARS: точное картирование и функциональная характеристика. Вирол Дж. 2005; 2:73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Liu S, Xiao G, Chen Y, He Y, Niu J, Escalante CR, et al. Взаимодействие между участками гептадных повторов 1 и 2 в спайковом белке коронавируса, связанного с SARS: последствия для механизма слияния вирусов и идентификация ингибиторов слияния. Ланцет. 2004; 363: 938–947. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Li W, Moore MJ, Vasilieva N, Sui J, Wong SK, Berne MA, et al. Ангиотензинпревращающий фермент 2 является функциональным рецептором коронавируса SARS. Природа. 2003; 426:450–454. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Природа. 2003; 426:450–454. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Wong SK, Li W, Moore MJ, Choe H, Farzan M. 193-аминокислотный фрагмент белка S коронавируса SARS эффективно связывает ангиотензинпревращающий фермент 2. J Biol Chem. 2004; 279:3197–3201. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Hwang WC, Lin Y, Santelli E, Sui J, Jaroszewski L, Stec B, et al. Структурные основы нейтрализации человеческим антителом против тяжелого острого респираторного синдрома, спайк-белком, 80R. Дж. Биол. Хим. 2006; 281:34610–34616. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Pak JE, Sharon C, Satkunarajah M, Auperin TC, Cameron CM, Kelvin DJ, et al. Структурное понимание иммунного распознавания домена, связывающего рецептор S-белка коронавируса тяжелого острого респираторного синдрома. Дж Мол Биол. 2009; 388: 815–823. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Prabakaran P, Gan J, Feng Y, Zhu Z, Choudhry V, Xiao X, et al. Структура рецептор-связывающего домена коронавируса тяжелого острого респираторного синдрома в комплексе с нейтрализующим антителом. Дж. Биол. Хим. 2006;281:15829–15836. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Структура рецептор-связывающего домена коронавируса тяжелого острого респираторного синдрома в комплексе с нейтрализующим антителом. Дж. Биол. Хим. 2006;281:15829–15836. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Forsell MN, Dey B, Morner A, Svehla K, O’dell S, Hogerkorp CM, et al. Распознавание В-клетками консервативного сайта связывания корецептора ВИЧ-1 изменяется эндогенным CD4 приматов. PLoS Патог. 2008;4:1000171. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Parren PW, Fisicaro P, Labrijn AF, Binley JM, Yang WP, Ditzel HJ, et al. Заражение антигеном in vitro библиотек человеческих антител для оценки вакцины: оболочка вируса иммунодефицита человека типа 1. Дж Вирол. 1996;70:9046–9050. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Parren PW, Burton DR, Sattentau QJ. Антитело к ВИЧ-1 — обломки или вирион? Нат Мед. 1997; 3: 366–367. [PubMed] [Google Scholar]
15. Паррен П.В., Мур Дж.П., Бертон Д.Р., Саттентау К.Дж. Реакция нейтрализующих антител на ВИЧ-1: уклонение от вируса и уход от гуморального иммунитета. СПИД. 1999; 13: 137–162. [PubMed] [Google Scholar]
СПИД. 1999; 13: 137–162. [PubMed] [Google Scholar]
16. King JC, Jr, Cox MM, Reisinger K, Hedrick J, Graham I, Patriarca P. Оценка безопасности, реактогенности и иммуногенности трехвалентного рекомбинантного бакуловируса FluBlok((R)) экспресс-гемагглютининовая гриппозная вакцина, вводимая внутримышечно здоровым детям в возрасте 6–59 летмесяцы. вакцина. 2009; 27: 6589–6594. [PubMed] [Google Scholar]
17. Olsen CW, McGregor MW, Dybdahl-Sissoko N, Schram BR, Nelson KM, Lunn DP, et al. Иммуногенность и эффективность гемагглютининовых вакцин против вируса лошадиного гриппа, экспрессируемых бакуловирусом, и основанных на ДНК, у мышей. вакцина. 1997; 15:1149–1156. [PubMed] [Google Scholar]
18. Treanor JJ, Wilkinson BE, Massoud F, Hu-Primmer J, Battaglia R, O'Brien D, et al. Безопасность и иммуногенность рекомбинантной гемагглютининовой вакцины против гриппа H5 у людей. вакцина. 2001;19: 1732–1737. [PubMed] [Google Scholar]
19. Wei CJ, Xu L, Kong WP, Shi W, Canis K, Stevens J, et al. Сравнительная эффективность нейтрализующих антител, индуцированных рекомбинантными белками гемагглютинина из вируса птичьего гриппа H5N1. Дж Вирол. 2008; 82: 6200–6208. [PMC бесплатная статья] [PubMed] [Google Scholar]
Сравнительная эффективность нейтрализующих антител, индуцированных рекомбинантными белками гемагглютинина из вируса птичьего гриппа H5N1. Дж Вирол. 2008; 82: 6200–6208. [PMC бесплатная статья] [PubMed] [Google Scholar]
20. Плоткин С.А., Мортимер Э.А., ред. Вакцина. 2-е изд. Филадельфия: В. Б. Сондерс; 1994. [Google Scholar]
21. Du L, He Y, Wang Y, Zhang H, Ma S, Wong CK, et al. Рекомбинантный аденоассоциированный вирус, экспрессирующий рецептор-связывающий домен S-белка коронавируса тяжелого острого респираторного синдрома, вызывает нейтрализующие антитела: значение для разработки вакцин против SARS. Вирусология. 2006; 353:6–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K, et al. ДНК-вакцина индуцирует нейтрализацию коронавируса SARS и защитный иммунитет у мышей. Природа. 2004; 428: 561–564. [PMC free article] [PubMed] [Google Scholar]
23. Bisht H, Roberts A, Vogel B, Subbarao K, Moss B.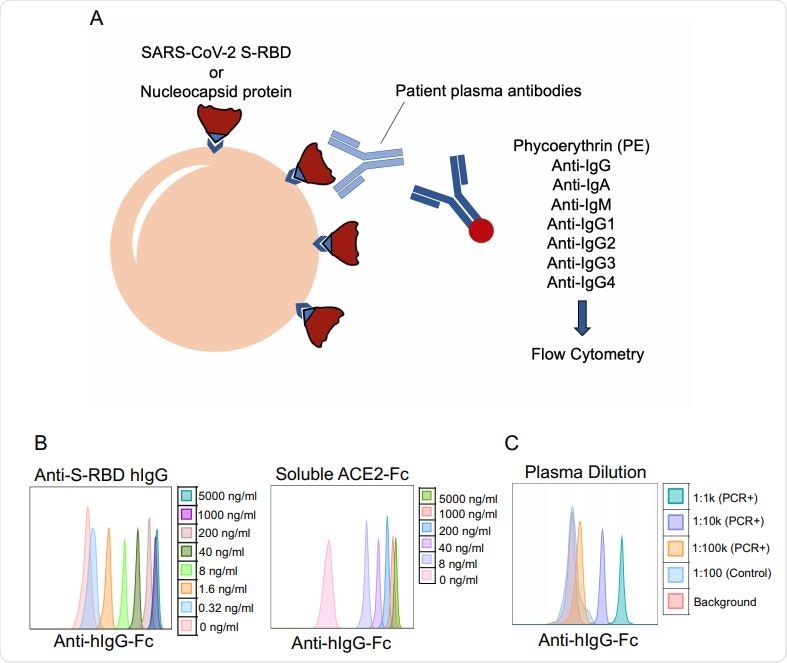 Нейтрализующее антитело и защитный иммунитет к коронавирусной инфекции SARS у мышей, индуцированной растворимым рекомбинантным полипептидом, содержащим и N-концевой сегмент гликопротеина шипа. Вирусология. 2005; 334: 160–165. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нейтрализующее антитело и защитный иммунитет к коронавирусной инфекции SARS у мышей, индуцированной растворимым рекомбинантным полипептидом, содержащим и N-концевой сегмент гликопротеина шипа. Вирусология. 2005; 334: 160–165. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Du L, Zhao G, He Y, Guo Y, Zheng BJ, Jiang S, et al. Рецептор-связывающий домен шиповидного белка SARS-CoV индуцирует долговременный защитный иммунитет в животной модели. вакцина. 2007; 25: 2832–2838. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. He Y, Zhou Y, Liu S, Kou Z, Li W, Farzan M, et al. Рецептор-связывающий домен спайкового белка SARS-CoV индуцирует сильнодействующие нейтрализующие антитела: значение для разработки субъединичной вакцины. Biochem Biophys Res Commun. 2004; 324: 773–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. He Y, Lu H, Siddiqui P, Zhou Y, Jiang S. Рецептор-связывающий домен шиповидного белка коронавируса тяжелого острого респираторного синдрома содержит несколько конформационно-зависимых эпитопов, которые индуцируют сильнодействующие нейтрализующие антитела. Дж Иммунол. 2005; 174:4908–4915. [PubMed] [Google Scholar]
Дж Иммунол. 2005; 174:4908–4915. [PubMed] [Google Scholar]
27. Zhang L, Zhang F, Yu W, He T, Yu J, Yi CE, et al. Ответы антител против коронавируса SARS коррелируют с исходом заболевания инфицированных людей. J Med Virol. 2006; 78:1–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. He Y, Zhou Y, Siddiqui P, Jiang S. Инактивированная вакцина против SARS-CoV вызывает высокие титры специфичных к шиповидным белкам антител, которые блокируют связывание с рецептором и проникновение вируса. Biochem Biophys Res Commun. 2004; 325:445–452. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Yu M, Stevens V, Berry JD, Crameri G, McEachern J, Tu C, et al. Определение и применение иммунодоминантных участков шиповидных и нуклеокапсидных белков коронавируса SARS, распознаваемых сыворотками различных видов животных. Дж Иммунол Методы. 2007; 331:1–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Zhu Z, Dimitrov AS, Chakraborti S, Dimitrova D, Xiao X, Broder CC, et al.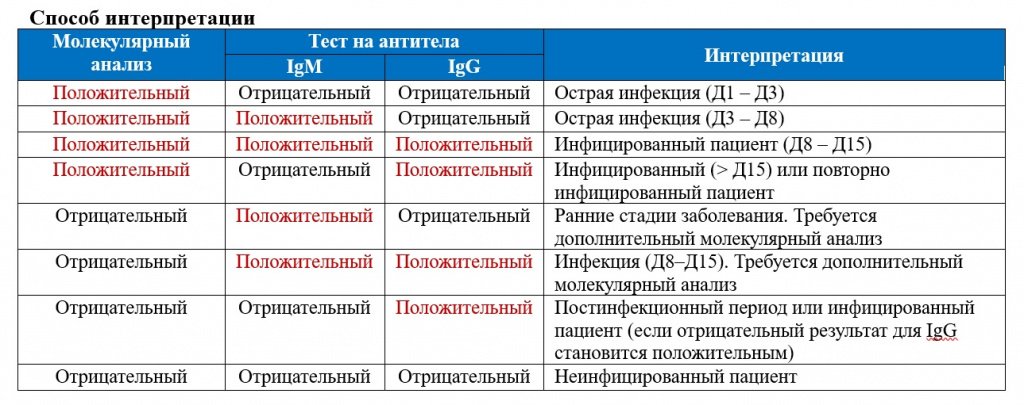 Разработка человеческих моноклональных антител против болезней, вызванных возникающими и связанными с биозащитой вирусами. Expert Rev Anti Infect Ther. 2006; 4: 57–66. [PubMed] [Google Scholar]
Разработка человеческих моноклональных антител против болезней, вызванных возникающими и связанными с биозащитой вирусами. Expert Rev Anti Infect Ther. 2006; 4: 57–66. [PubMed] [Google Scholar]
31. Stockman LJ, Bellamy R, Garner P. SARS: систематический обзор эффектов лечения. ПЛОС Мед. 2006; 3:343. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Sui J, Li W, Murakami A, Tamin A, Matthews LJ, Wong SK, et al. Мощная нейтрализация коронавируса тяжелого острого респираторного синдрома (ТОРС) человеческим mAb к белку S1, который блокирует ассоциацию с рецептором. Proc Natl Acad Sci USA. 2004; 101: 2536–2541. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. van den Brink EN, ter Meulen J, Cox F, Jongeneelen MA, Thijsse A, Throsby M, et al. Молекулярно-биологическая характеристика моноклональных антител человека, связывающихся с шиповидными и нуклеокапсидными белками коронавируса тяжелого острого респираторного синдрома. Дж Вирол. 2005; 79: 1635–1644. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Traggiai E, Becker S, Subbarao K, Колесникова L, Uematsu Y, Gismondo MR, et al. Эффективный метод получения человеческих моноклональных антител из В-клеток памяти: мощная нейтрализация коронавируса SARS. Нат Мед. 2004; 10: 871–875. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Traggiai E, Becker S, Subbarao K, Колесникова L, Uematsu Y, Gismondo MR, et al. Эффективный метод получения человеческих моноклональных антител из В-клеток памяти: мощная нейтрализация коронавируса SARS. Нат Мед. 2004; 10: 871–875. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Corbett CR, Elias MD, Simpson LL, Yuan XY, Cassan RR, Ballegeer E, et al. Высокопроизводительный гомогенный иммуноанализ легко идентифицирует моноклональные антитела к серовариантным клостридиальным нейротоксинам. Дж Иммунол Методы. 2007; 328:128–138. [PubMed] [Google Scholar]
36. Babcook JS, Leslie KB, Olsen OA, Salmon RA, Schrader JW. Новая стратегия получения моноклональных антител из отдельных изолированных лимфоцитов, продуцирующих антитела с определенной специфичностью. Proc Natl Acad Sci USA. 1996;93:7843–7848. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Smith K, Garman L, Wrammert J, Zheng NY, Capra JD, Ahmed R, et al. Быстрое образование полностью человеческих моноклональных антител, специфичных к вакцинирующему антигену.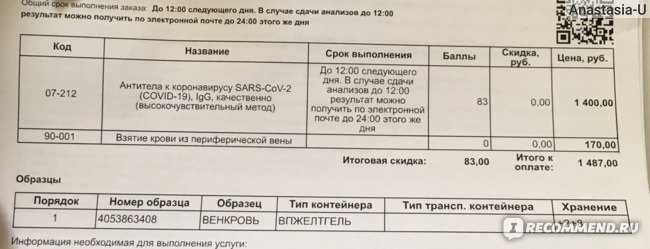 Нат Проток. 2009; 4: 372–384. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нат Проток. 2009; 4: 372–384. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Breathnach CC, Rudersdorf R, Lunn DP. Использование рекомбинантных модифицированных вирусных векторов осповакцины Анкара для вакцинации лошадей против гриппа. Вет Иммунол Иммунопатол. 2004; 98: 127–136. [PubMed] [Академия Google]
39. Galarza JM, Latham T, Cupo A. Вакцина на основе вирусоподобных частиц (VLP) обеспечивает полную защиту от смертельного заражения вирусом гриппа. Вирус Иммунол. 2005; 18: 244–251. [PubMed] [Google Scholar]
40. Mahmood K, Bright RA, Mytle N, Carter DM, Crevar CJ, Achenbach JE, et al. Вакцина H5N1 VLP индуцировала защиту хорьков от летального заражения высокопатогенными вирусами гриппа H5N1. вакцина. 2008; 26: 5393–5399. [PubMed] [Google Scholar]
41. Ноад Р., Рой П. Вирусоподобные частицы как иммуногены. Тенденции микробиол. 2003; 11: 438–444. [PubMed] [Академия Google]
42. Pushko P, Tumpey TM, Van Hoeven N, Belser JA, Robinson R, Nathan M, et al.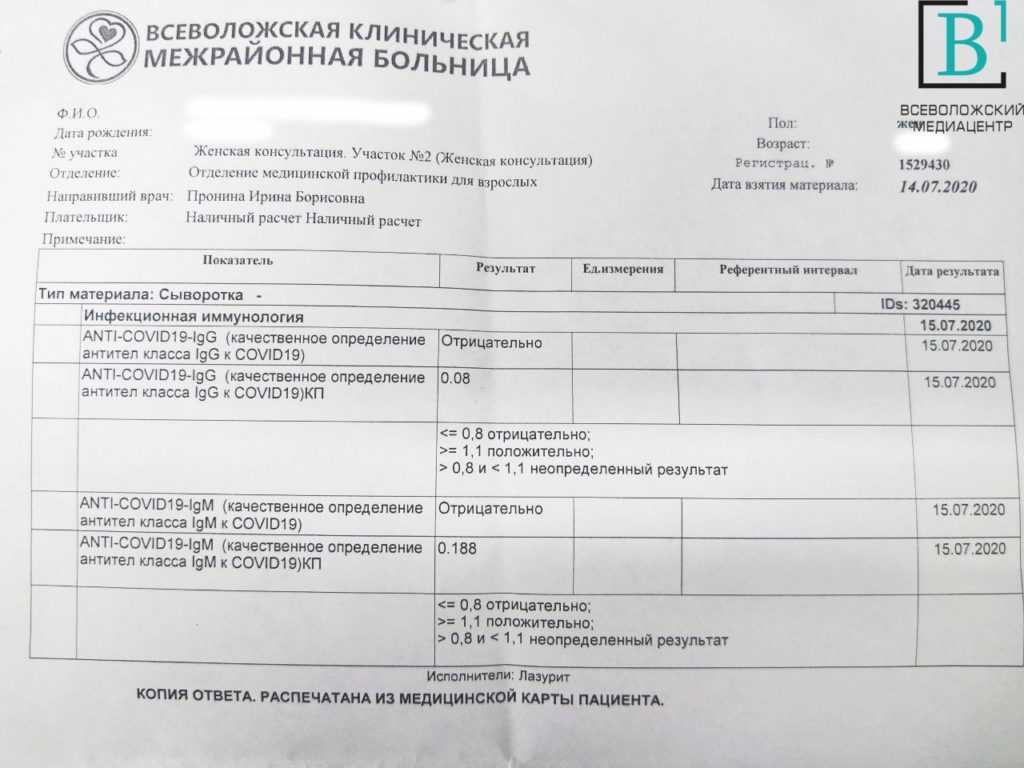 Оценка вирусоподобных частиц гриппа и адъюванта Novasome в качестве вакцины-кандидата против птичьего гриппа. вакцина. 2007; 25:4283–4290. [PubMed] [Google Scholar]
Оценка вирусоподобных частиц гриппа и адъюванта Novasome в качестве вакцины-кандидата против птичьего гриппа. вакцина. 2007; 25:4283–4290. [PubMed] [Google Scholar]
43. Уорфилд К.Л., Свенсон Д.Л., Деммин Г., Бавари С. Филовирусоподобные частицы как вакцины и инструменты исследования. Эксперт Rev Вакцины. 2005; 4: 429–440. [PubMed] [Google Scholar]
44. Kwong PD, Doyle ML, Casper DJ, Cicala C, Leavitt SA, Majeed S, et al. ВИЧ-1 избегает нейтрализации, опосредованной антителами, за счет конформационной маскировки сайтов связывания рецепторов. Природа. 2002; 420: 678–682. [PubMed] [Академия Google]
45. Moulard M, Phogat SK, Shu Y, Labrijn AF, Xiao X, Binley JM, et al. Моноклональные Fab человека с широкой перекрестной реактивностью, нейтрализующие ВИЧ-1, выбраны для связывания с комплексами gp120-CD4-CCR5. Proc Natl Acad Sci USA. 2002; 99: 6913–6918. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Pantophlet R, Wilson IA, Burton DR. Гипергликозилированные мутанты вируса иммунодефицита человека (ВИЧ) типа 1 мономерного gp120 как новые антигены для разработки вакцины против ВИЧ.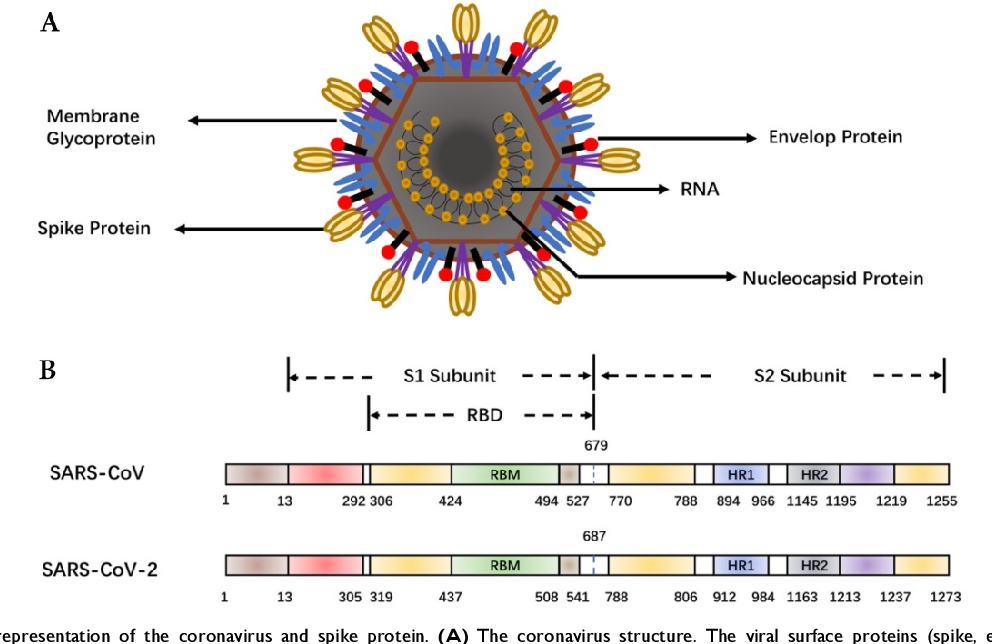 Дж Вирол. 2003; 77: 5889–5901. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж Вирол. 2003; 77: 5889–5901. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Пантофлет Р., Бертон Д.Р. Иммунофокусировка: антигенная инженерия для стимулирования индукции ВИЧ-нейтрализующих антител. Тренды Мол Мед. 2003; 9: 468–473. [PubMed] [Google Scholar]
48. Pantophlet R, Wang M, guilar-Sino RO, Burton DR. Спайк оболочки вируса иммунодефицита человека типа 1 первичных вирусов может подавлять доступ антител к вариабельным областям. Дж Вирол. 2009; 83: 1649–1659. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Selvarajah S, Puffer B, Pantophlet R, Law M, Doms RW, Burton DR. Сравнение антигенности и иммуногенности сконструированного gp120. Дж Вирол. 2005;79: 12148–12163. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Suguitan AL, Jr, Marino MP, Desai PD, Chen LM, Matsuoka Y, Donis RO, et al. Влияние многоосновного сайта расщепления гемагглютинина H5 на аттенуацию, иммуногенность и эффективность живого аттенуированного вакцинного вируса гриппа A H5N1, адаптированного к холоду.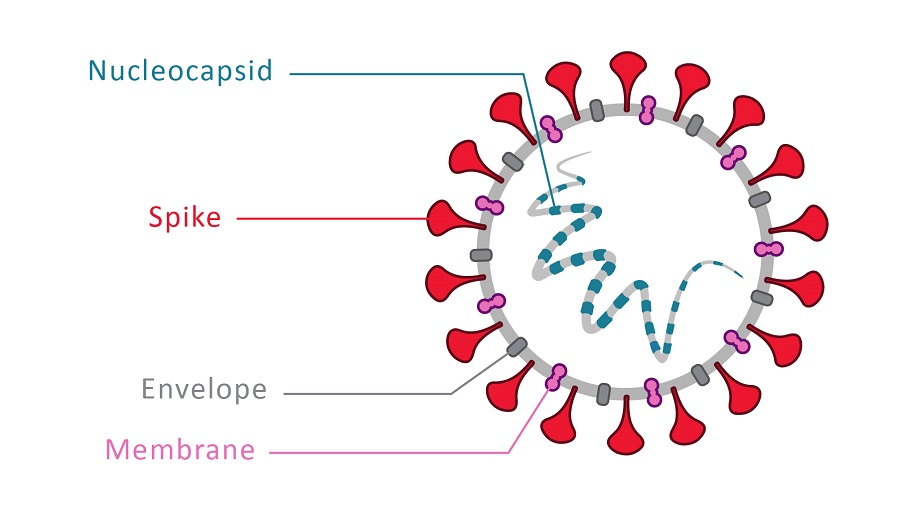 Вирусология. 2009; 395: 280–288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Вирусология. 2009; 395: 280–288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Берри Д.Д. Рациональная разработка моноклональных антител к возникающим патогенам, агентам биоугроз и возбудителям чужеродных болезней животных: шкала антигенов. Вет Дж. 2005; 170:193–211. [Статья бесплатно PMC] [PubMed] [Google Scholar]
52. Bui HH, Sidney J, Li W, Fusseder N, Sette A. Разработка инструмента анализа консервантности эпитопов для облегчения разработки диагностики и вакцин на основе эпитопов. Биоинформатика BMC. 2007; 8:361. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Davies V, Vaughan K, Damle R, Peters B, Sette A. Классификация вселенной литературы по иммунным эпитопам: представление и пробелы в знаниях. ПЛОС ОДИН. 2009; 4:6948. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Peters B, Sidney J, Bourne P, Bui HH, Buus S, Doh G, et al. База данных иммунных эпитопов и ресурсы для анализа: от видения к плану. PLoS биол. 2005;3:91. [Статья бесплатно PMC] [PubMed] [Google Scholar]
55. Zhong G, Berry JD, Choukri S. Картирование эпитопов нейтрализующих моноклональных антител с использованием фаговых случайных пептидных библиотек. J Ind Microbiol Biotechnol. 1997; 19:71–76. [PubMed] [Google Scholar]
Zhong G, Berry JD, Choukri S. Картирование эпитопов нейтрализующих моноклональных антител с использованием фаговых случайных пептидных библиотек. J Ind Microbiol Biotechnol. 1997; 19:71–76. [PubMed] [Google Scholar]
56. Sui J, Li W, Roberts A, Matthews LJ, Murakami A, Vogel L, et al. Оценка человеческого моноклонального антитела 80R для иммунопрофилактики тяжелого острого респираторного синдрома путем исследования на животных, картирования эпитопов и анализа вариантов спайков. Дж Вирол. 2005;79: 5900–5906. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Sui J, Aird DR, Tamin A, Murakami A, Yan M, Yammanuru A, et al. Расширение нейтрализующей активности для прямого блокирования доминирующего пути эволюции SARS-коронавируса, управляемого антителами. PLoS Патог. 2008;4:1000197. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Zhu Z, Chakraborti S, He Y, Roberts A, Sheahan T, Xiao X, et al. Мощная перекрестно-реактивная нейтрализация изолятов коронавируса SARS человеческими моноклональными антителами.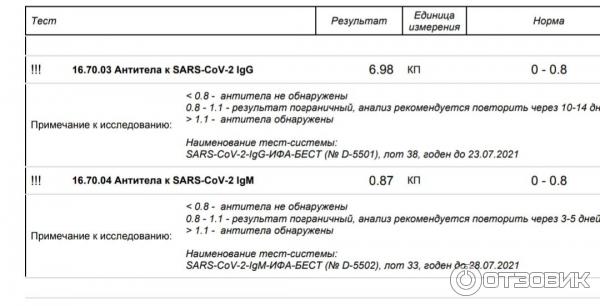 Proc Natl Acad Sci USA. 2007;104:12123–12128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA. 2007;104:12123–12128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Greenough TC, Babcock GJ, Roberts A, Hernandez HJ, Thomas WD, Jr, Coccia JA, et al. Разработка и характеристика человеческого моноклонального антитела, нейтрализующего коронавирус, связанный с тяжелым острым респираторным синдромом, которое обеспечивает эффективную иммунопрофилактику у мышей. J заразить дис. 2005; 191: 507–514. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Бениак Д.Р., Андонов А., Грудески Э., Бут Т.Ф. Архитектура всплеска префузии коронавируса SARS. Nat Struct Mol Biol. 2006; 13: 751–752. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Бениак Д.Р., де Варенн С.Л., Андонов А., Он Р., Бут Т.Ф. Конформационная реорганизация спайка коронавируса SARS после связывания с рецептором: значение для слияния мембран. ПЛОС ОДИН. 2007; 2:1082. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Захарчук А.Н., Шарон С., Саткунараджа М.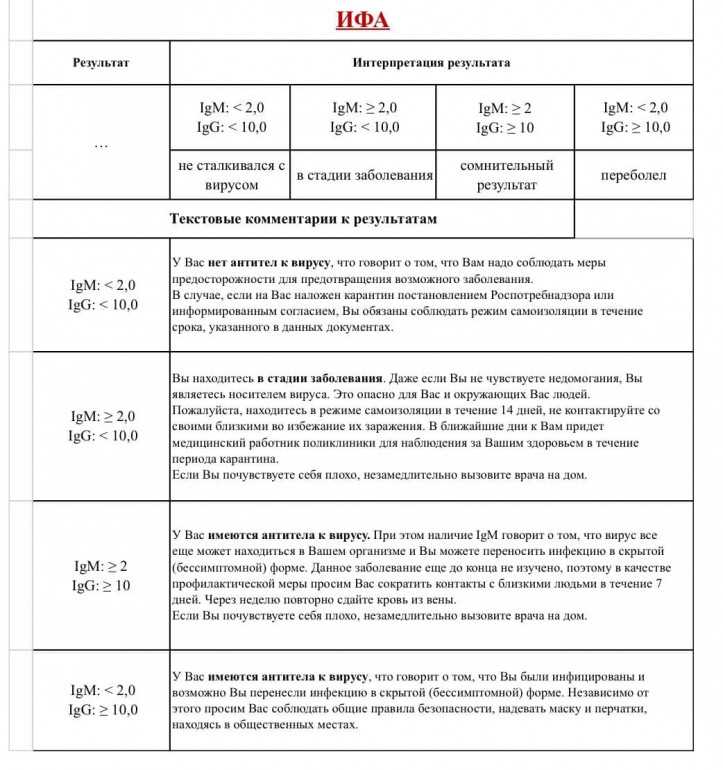 , Ауперин Т., Вишванатан С., Мутвири Г. и соавт. Иммуногенность рецептор-связывающего домена шиповидного белка коронавируса SARS у мышей: последствия для субъединичной вакцины. вакцина. 2007; 25: 136–143. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Ауперин Т., Вишванатан С., Мутвири Г. и соавт. Иммуногенность рецептор-связывающего домена шиповидного белка коронавируса SARS у мышей: последствия для субъединичной вакцины. вакцина. 2007; 25: 136–143. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Lu L, Manopo I, Leung BP, Chng HH, Ling AE, Chee LL, et al. Иммунологическая характеристика шиповидного белка коронавируса тяжелого острого респираторного синдрома. Дж. Клин Микробиол. 2004;42:1570–1576. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Torres M, Casadevall A. Константная область иммуноглобулина способствует аффинности и специфичности. Тенденции в Иммуноле. 2007; 29:91–97. [PubMed] [Google Scholar]
65. Lee JE, Fusco ML, Hessell AJ, Oswald WB, Burton DR, Saphire EO. Структура гликопротеина вируса Эбола, связанного с антителом выжившего человека. Природа. 2008; 454:177–182. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Parren PW, Fisicaro P, Labrijn AF, Binley JM, Yang WP, Ditzel HJ, et al.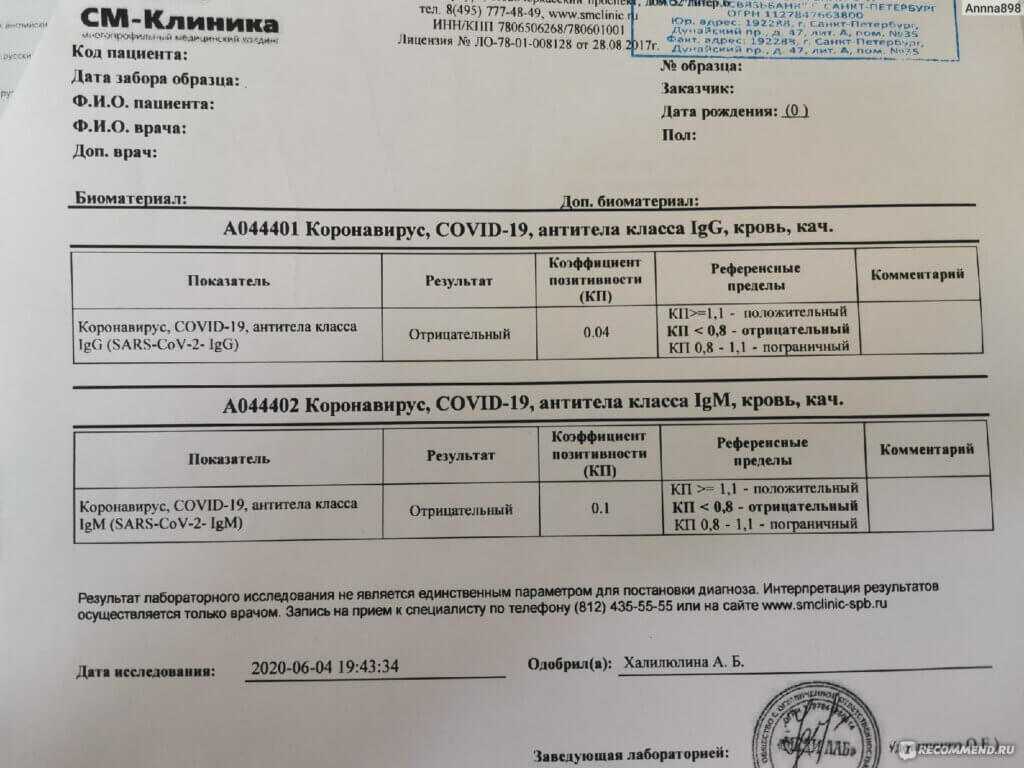 Заражение антигеном in vitro библиотек человеческих антител для оценки вакцины: оболочка вируса иммунодефицита человека типа 1. Дж Вирол. 1996; 70:9046–9050. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заражение антигеном in vitro библиотек человеческих антител для оценки вакцины: оболочка вируса иммунодефицита человека типа 1. Дж Вирол. 1996; 70:9046–9050. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Fraser D, Kaern M. Шанс на выживание: шум экспрессии генов и стратегии фенотипической диверсификации. Мол микробиол. 2009;71:1333–1340. [PubMed] [Google Scholar]
68. Кафлин М.М., Бабкук Дж., Прабхакар Б.С. Моноклональные антитела человека к SARS-коронавирусу ингибируют инфекцию по разным механизмам. Вирусология. 2009 г.;394:39–46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Guo Y, Tisoncik J, McReynolds S, Farzan M, Prabhakar BS, Gallagher T, et al. Идентификация новой области S-белка SARS-CoV, критической для проникновения вируса. Дж Мол Биол. 2009; 394: 600–605. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. См. Р.Х., Захарчук А.Н., Петрик М., Лоуренс Д.Дж., Мок С.П., Хоган Р.Дж. и соавт. Сравнительная оценка двух вакцин-кандидатов от тяжелого острого респираторного синдрома (ТОРС) у мышей, зараженных коронавирусом ТОРС.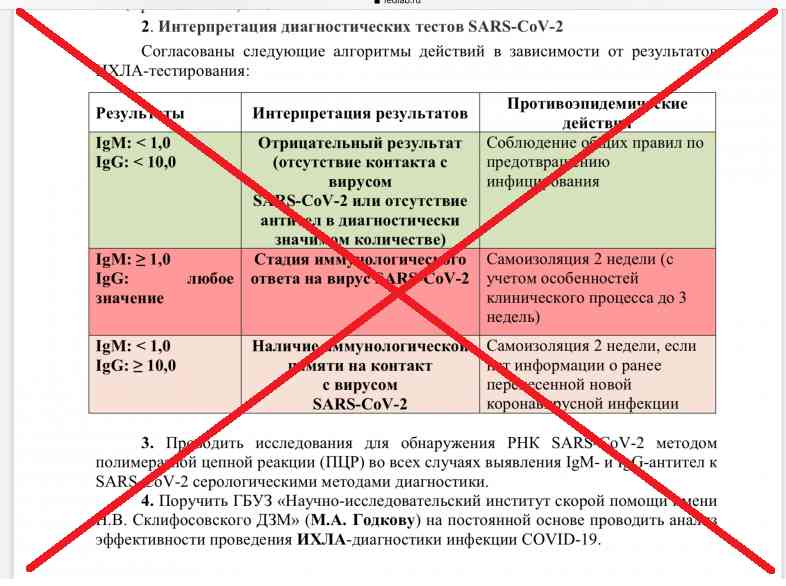 Джей Ген Вирол. 2006; 87: 641–650. [PubMed] [Академия Google]
Джей Ген Вирол. 2006; 87: 641–650. [PubMed] [Академия Google]
71. Берри Д.Д., Боз Д.Дж., Лоу Д.К., Золлингер В.Д., Цанг Р.С. Молекулярный анализ моноклональных антител к групповому варианту капсульного полисахарида Neisseria meningitidis: рекуррентные тяжелые цепи и альтернативные партнеры по легким цепям. Мол Иммунол. 2005; 42: 335–344. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Yuan X, Gubbins MJ, Berry JD. Простой и быстрый протокол для определения последовательности функциональных кДНК легкой цепи каппа из мышиных гибридом с положительной аберрантной цепью. Дж Иммунол Методы. 2004;294: 199–207. [PubMed] [Google Scholar]
73. Chung J, Rader C, Popkov M, Hur YM, Kim HK, Lee YJ, et al. Интегрин альфаIIbбета3-специфические синтетические человеческие моноклональные антитела и пептиды HCDR3, которые сильно ингибируют агрегацию тромбоцитов. FASEB J. 2004; 18: 361–363. [PubMed] [Google Scholar]
74. Hofer T, Tangkeangsirisin W, Kennedy MG, Mage RG, Raiker SJ, Venkatesh K, et al. Химерные кроличьи/человеческие Fab и IgG, специфичные к членам семейства рецепторов Nogo-66, отобранные по видовой перекрестной реактивности с улучшенным вектором фагового дисплея. Дж Иммунол Методы. 2007; 318:75–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Химерные кроличьи/человеческие Fab и IgG, специфичные к членам семейства рецепторов Nogo-66, отобранные по видовой перекрестной реактивности с улучшенным вектором фагового дисплея. Дж Иммунол Методы. 2007; 318:75–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Gubbins MJ, Berry JD, Corbett CR, Mogridge J, Yuan XY, Schmidt L, et al. Получение и характеристика нейтрализующих моноклональных антител, распознающих эпитоп в домене 2 защитного антигена Bacillus anthracis. FEMS Immunol Med Microbiol. 2006; 47: 436–443. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Shih YP, Chen CY, Liu SJ, Chen KH, Lee YM, Chao YC, et al. Идентификация эпитопов, ответственных за связывание нейтрализующих антител и DC-SIGN на гликопротеине спайка коронавируса тяжелого острого респираторного синдрома. Дж Вирол. 2006;80:10315–10324. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Tripp RA, Haynes LM, Moore D, Anderson B, Tamin A, Harcourt BH, et al. Моноклональные антитела к SARS-ассоциированному коронавирусу (SARS-CoV): выявление нейтрализующих и реактивных антител к S, N, M и E вирусным белкам. Дж. Вироловые методы. 2005; 128:21–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Дж. Вироловые методы. 2005; 128:21–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Zhou T, Wang H, Luo D, Rowe T, Wang Z, Hogan RJ, et al. Экспонированный домен в шиповидном белке коронавируса тяжелого острого респираторного синдрома индуцирует нейтрализующие антитела. Дж Вирол. 2004; 78:7217–7226. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Зачем использовать анализ на антитела к SARS-CoV-2, нацеленный на рецептор-связывающий домен (RBD) спайкового белка S1? Вот 3 причины:
Имея на рынке сотни тестов на антитела к SARS-CoV-2, 1 медицинские работники (HCP) должны быть уверены, что они могут использовать результаты, чтобы предоставить полезную информацию для управления здоровьем пациентов. Дизайн тестов оказался сильным фактором, определяющим ценность различных решений для тестирования, помогающих медицинским работникам защищать отдельных пациентов и сообщества.
Все антитела связываются; Только некоторые из них также нейтрализуют
Люди вырабатывают антитела против шиповидного белка и S1 RBD, а также против других белков, но ключевой вопрос, на который нужно ответить, — «нейтрализуют ли они антитела?» Многочисленные исследования указывают на основную роль нейтрализующих антител, нацеленных на спайковый белок SARS-CoV-2, при этом антитела к RBD S1, по оценкам, составляют ~ 90% нейтрализующей активности. 2-5
Наши тесты на антитела к SARS-CoV-2* †§ нацелен на RBD S1 для обнаружения и измерения уровня нейтрализующих антител к SARS-CoV-2 в крови. Это позволяет клиницистам оценивать и отслеживать уровень индивидуального иммунного ответа с течением времени.
Это позволяет клиницистам оценивать и отслеживать уровень индивидуального иммунного ответа с течением времени.
Корреляционное исследование с использованием теста на нейтрализацию вируса продемонстрировало сильную взаимосвязь между результатами теста Atellica® IM SARS-CoV-2 IgG (sCOVG)* † Index и титрами нейтрализующих антител. Это позволяет клиницистам оценивать и отслеживать уровни нейтрализующих антител у пациентов. В будущем эта сильная корреляция будет иметь решающее значение для идентификации потенциальных выздоравливающих доноров, а также потенциальной оценки эффективности вакцины и отслеживания поствакцинальных уровней антител. ‡
Наиболее частая мишень при разработке вакцины: шиповидный белок оказался важным для вакцин против SARS-CoV-2
RBD S1 является наиболее распространенной мишенью при разработке вакцин с целью получения защитных антител. RBD — это то, что распознает и связывает человеческий рецептор ACE2. Без успешного связывания вирус не может размножаться или вызывать инфекцию, поэтому он является критически важным для иммунитета. Оценка эффективности вакцин для тех, которые сосредоточены/включают RBD S1, может включать выявление сероконверсии этого антитела для выявления пациентов с соответствующим ответом антител.
Оценка эффективности вакцин для тех, которые сосредоточены/включают RBD S1, может включать выявление сероконверсии этого антитела для выявления пациентов с соответствующим ответом антител.
Выбор мишени влияет на вероятность перекрестной реактивности
Данные показывают, что на вероятность перекрестной реактивности влияет выбор мишени в тестах на SARS-CoV-2, и она может быть более вероятной в тестах, нацеленных как на S1, так и на S2 или белок N по сравнению с анализами, нацеленными только на S1 или S1 RBD, такими как анализы Siemens Healthineers. 6
 8
8 Подробное изучение шиповидного белка и нейтрализации
Люди вырабатывают антитела против нуклеокапсида и шиповидного белка, а также против других белков.
Но ключевые вопросы, на которые нужно ответить: «Нейтрализуют ли они антитела?» и «Могут ли они защитить вас от повторного заражения?» Обычной частью иммунного ответа человека является нейтрализация или блокирование связывания вируса с рецептором ACE2. Если антитело мешает связыванию, у вас может быть некоторый уровень защиты. Различные антитела будут нацелены на разные белки в структуре вируса.
Белок шипа (S1 и S2):
Нуклеокапсид (N) Белок:
Белок N расположен внутри капсида (белковой оболочки вируса) вместе с РНК SARS-CoV-2. Этот белок участвует в распространении генетического материала во время размножения вируса. Белок N SARS-CoV-2 очень похож по структуре на белок коронавируса SARS (SARS-CoV). 10
Этот белок участвует в распространении генетического материала во время размножения вируса. Белок N SARS-CoV-2 очень похож по структуре на белок коронавируса SARS (SARS-CoV). 10
Siemens Healthineers Тесты на антитела к SARS-CoV-2
Хотите оставить подробный отзыв?
125 / 125
* Этот тест не был одобрен или одобрен FDA. Этот тест был одобрен FDA в соответствии с EUA для использования уполномоченными лабораториями. Этот тест был разрешен только для обнаружения наличия антител против SARS-CoV-2, но не для каких-либо других вирусов или патогенов. Этот тест разрешен только на время действия заявления о наличии обстоятельств, оправдывающих разрешение на экстренное использование диагностики in vitro для обнаружения и/или диагностики COVID-19 в соответствии с разделом 564(b)(1) Закона 21 U.S.C. § 360bbb-3(b)(1), если разрешение не будет прекращено или отозвано ранее. Доступность продукта зависит от страны и зависит от различных нормативных требований.
Доступность продукта зависит от страны и зависит от различных нормативных требований.
† Заявления об обнаружении нейтрализующих антител и корреляции с тестами на нейтрализующие антитела не рассматривались FDA и недоступны в США. Доступность этих заявлений зависит от страны и зависит от различных нормативных требований.
§ Для анализа SARS-CoV-2 Total заявления об обнаружении нейтрализующих антител и корреляции с тестами на нейтрализующие антитела находятся в стадии разработки и недоступны для использования.
‡ Эффективность тестов Siemens Healthineers на антитела к SARS-CoV-2 у вакцинированных субъектов не установлена. Требования к измерению иммунного ответа после вакцинации находятся в стадии разработки и недоступны для использования.
1
https://www.fda.gov/medical-devices/emergency-situations-medical-devices/faqs-testing-sars-cov-2#offeringtests
2
Piccoli L, et al. Картирование нейтрализующих и иммунодоминантных участков в домене, связывающем рецептор шипа 2 SARS-CoV-2, с помощью структурно-ориентированной серологии высокого разрешения. Cell 2020. doi: https://doi.org/10.1016/j.cell.2020.090,037.
Cell 2020. doi: https://doi.org/10.1016/j.cell.2020.090,037.
3
Rodda LB, et al. Функциональная иммунная память, специфичная для SARS-CoV-2, сохраняется после легкой формы COVID-19. medRxiv 2020. doi: https://doi.org/10.1101/2020.08.11.20171843.
4
Premkumar L, et al. Рецептор-связывающий домен вирусного шиповидного белка является иммунодоминантной и высокоспецифичной мишенью антител у пациентов с SARS-CoV-2. Sci Immunol 2020;5:xx. doi: 10.1126/sciimmunol.abc8413.
5
Ю Б и др. Нейтрализующие антитела человека, вызванные инфекцией SARS-CoV-2. Природа 2020;584:115-119doi: https://doi.org/10.1038/s41586-020-2380-z.
6
Mesel-Lemoine, M et al. Дж. Вирол. 2012 июль; 86 (14): 7577–7587.
7
Инструкция по применению Atellica IM sCOVG. 11207632_RU Ред. 01, 2020-10.
8
Нг, К и др. https://doi.org/10.1101/2020.05.14.095414.
9
Tai, W., He, L., Zhang, X. et al. Характеристика рецептор-связывающего домена (RBD) нового коронавируса 2019 года: значение для разработки белка RBD в качестве ингибитора прикрепления вируса и вакцины.