2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Лютеинизирующий гормон (ЛГ) – гонадотропный гормон передней доли гипофиза, стимулирующий секрецию половых гормонов (эстрогенов и прогестеронов) у мужчин и женщин.
Синонимы русские
Гликопротеидный гонадотропный гормон, лютеотропин.
Синонимы английские
LH, Luteinizing hormone, ICSH, Interstitial cell stimulating hormone.
Метод исследования
Иммунохемилюминесцентный анализ.
Диапазон определения: 0,1 - 200 мМЕ/мл.
Единицы измерения
мМЕ/мл (международная миллиединица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
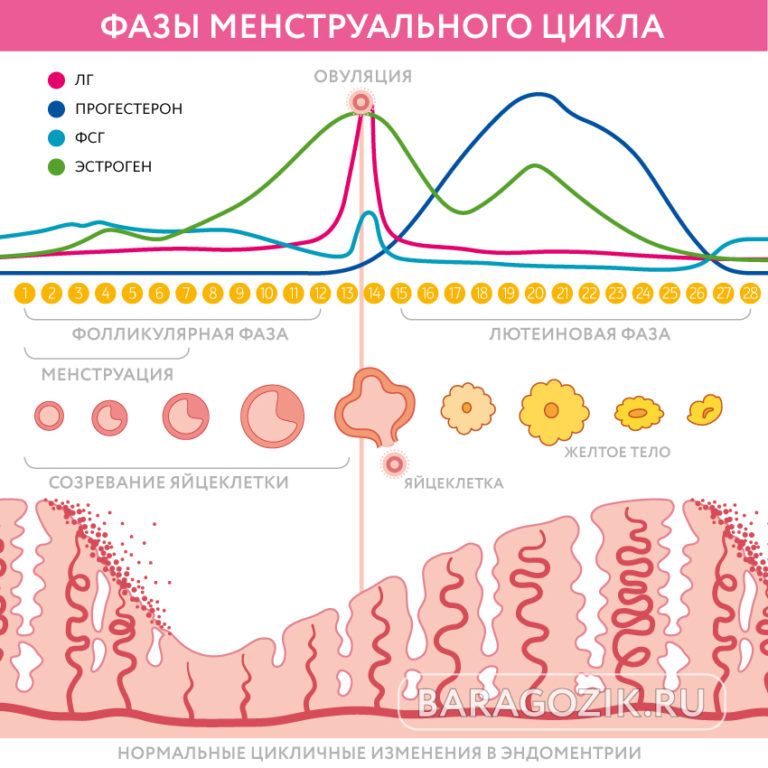
Лютеинизирующий гормон (ЛГ) – это гонадотропный пептидный гормон передней доли гипофиза, стимулирующий секрецию половых гормонов (эстрогенов и прогестеронов) у мужчин и женщин. У мужчин ЛГ воздействует на клетки Лейдига семенников, активируя в них синтез тестостерона, у женщин – на клетки оболочки яичника и желтое тело, стимулирует овуляцию и активирует в клетках яичников синтез эстрогенов и прогестерона. В середине менструального цикла наблюдается подъем уровня ЛГ, которому предшествует (за 12 ч.) преовуляторный пик эстрадиола. Овуляция происходит спустя 12-20 ч. после достижения максимальной концентрации ЛГ.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
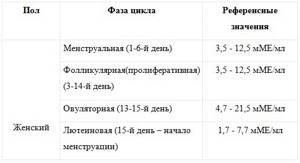
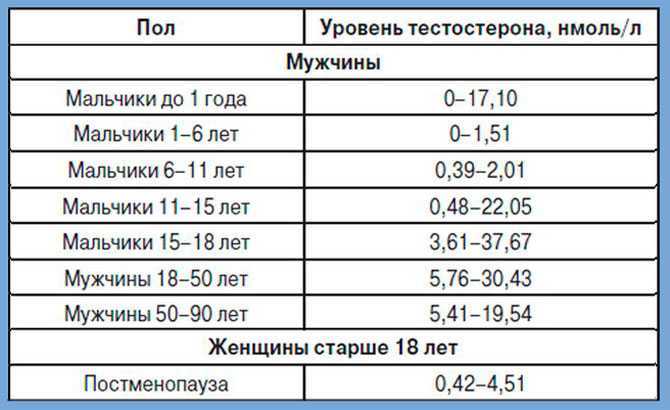
Референсные значения
|
Фаза цикла |
Референсные значения |
|
Менструальная (1-6-й день) |
2,4 - 12,6 мМЕ/мл |
|
Фолликулиновая (пролиферативная) (3-14-й день) |
2,4 - 12,6 мМЕ/мл |
|
Овуляторная (13-15-й день) |
14 - 96 мМЕ/мл |
|
Лютеиновая (15-й день – начало менструации) |
1 - 11,4 мМЕ/мл |
|
Постменопауза |
7,7 - 59 мМЕ/мл |
Причины повышения уровня ЛГ
 ч. гиперпитуитаризм).
ч. гиперпитуитаризм).Причины снижения уровня ЛГ

Что может влиять на результат?
Проведение радиоизотопных исследований менее чем за 7 дней до исследования, прием некоторых лекарственных препаратов.
Также рекомендуется
Кто назначает исследование?
Акушер-гинеколог, педиатр, уролог.
Литература
 И. Назаренко, А.А. Кишкун - М. : Медицина, 2006 – 543 с.
И. Назаренко, А.А. Кишкун - М. : Медицина, 2006 – 543 с.Фолликулостимулирующий гормон (ФСГ) – это гликопротеиновый гормон, который вырабатывается и накапливается в передней доле гипофиза и влияет на функционирование половых желез.
Синонимы русские
ФСГ, фоллитропин, гипофизарный гонадотропин.
Синонимы английские
Follicle-Stimulating Hormone, Follitropin, FSH, Pituitary Gonadotropin.
Метод исследования
Иммунохемилюминесцентный анализ.
Единицы измерения
мМЕ/мл (международная миллиединица на миллилитр).
Диапазон определения: 0,1 - 200 мМЕ/мл.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Фолликулостимулирующий гормон (ФСГ) совместно с лютеинизирующим гормоном (ЛГ) вырабатывается в передней доле гипофиза под воздействием гипоталамического гонадотропин-либерирующего гормона. Секреция ФСГ происходит в импульсном режиме с интервалами в 1-4 часа. Во время выброса длительностью около 15 минут концентрация ФСГ превышает средний показатель в 1,5-2,5 раза и регулируется уровнем половых гормонов по принципу отрицательной обратной связи. Низкие уровни половых гормонов стимулируют выделение ФСГ в кровь, а высокие – угнетают. Подавляет производство ФСГ также белок ингибин В, синтезирующийся в клетках яичников у женщин и клетках, выстилающих семенные канальцы (клетки Сертоли), у мужчин.
Подавляет производство ФСГ также белок ингибин В, синтезирующийся в клетках яичников у женщин и клетках, выстилающих семенные канальцы (клетки Сертоли), у мужчин.
У детей уровень ФСГ кратковременно увеличивается после рождения и очень сильно падает в 6 месяцев у мальчиков и в 1-2 года у девочек. Затем уже он повышается перед началом полового созревания и возникновением вторичных половых признаков. Одним из первых лабораторных показателей начала периода пубертата (полового созревания) у детей является увеличение концентрации ФСГ ночью. Вместе с этим усиливается ответ половых желез и повышается уровень половых гормонов.
У женщин ФСГ стимулирует созревание фолликулов яичников, готовит их к воздействию лютеинизирующего гормона и усиливает высвобождение эстрогенов. Менструальный цикл состоит из фолликулиновой и лютеиновой фаз. Первая фаза цикла проходит под воздействием ФСГ: фолликул увеличивается и вырабатывает эстрадиол, а в конце резкое повышение уровней фолликулостимулирующего и лютеинизирующего гормонов провоцирует овуляцию – разрыв созревшего фолликула и выход яйцеклетки. Затем наступает лютеиновая фаза, во время которой ФСГ способствует выработке прогестерона. Эстрадиол и прогестерон по принципу обратной связи регулируют синтез ФСГ гипофизом. Во время менопаузы яичники прекращают функционировать и сниженная секреция эстрадиола приводит к увеличению концентраций фолликулостимулирующего и лютеинизирующего гормонов.
Затем наступает лютеиновая фаза, во время которой ФСГ способствует выработке прогестерона. Эстрадиол и прогестерон по принципу обратной связи регулируют синтез ФСГ гипофизом. Во время менопаузы яичники прекращают функционировать и сниженная секреция эстрадиола приводит к увеличению концентраций фолликулостимулирующего и лютеинизирующего гормонов.
У мужчин ФСГ влияет на развитие семенных канальцев, увеличивает концентрацию тестостерона, стимулирует образование и созревание спермы в яичках и способствует продукции андрогенсвязывающего белка. После полового созревания уровень ФСГ у мужчин относительно постоянный. К увеличению его количества приводит первичная недостаточность яичек.
Анализ на гонадотропные гормоны позволяет определить уровень нарушений гормональной регуляции – первичный (зависимый от самих половых желез) или вторичный (связанный с гипоталамо-гипофизарной осью). У пациентов с расстройством функции яичек (или яичников) низкие показатели ФСГ свидетельствуют о дисфункции гипоталамуса или гипофиза. Повышение же ФСГ указывает на первичную патологию половых желез.
Повышение же ФСГ указывает на первичную патологию половых желез.
Одновременное проведение тестов на фолликулостимулирующий и лютеинизирующий гормоны используется для диагностики мужского и женского бесплодия и определения тактики лечения.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения
|
Пол |
Фаза цикла |
Референсные значения |
|
Мужской |
|
1,5 - 12,4 мМЕ/мл |
|
Женский |
Менструальная (1-6-й день) |
3,5 - 12,5 мМЕ/мл |
|
Фолликулиновая (пролиферативная) (3-14-й день) |
3,5 - 12,5 мМЕ/мл |
|
|
Овуляторная (13-15-й день) |
4,7 - 21,5 мМЕ/мл |
|
|
Лютеиновая (15-й день – начало менструации) |
1,7 - 7,7 мМЕ/мл |
|
|
Постменопауза |
25,8 - 134,8 мМЕ/мл |
|
|
Пременопауза |
1,7 - 21,5 мМЕ/мл |
Менопауза.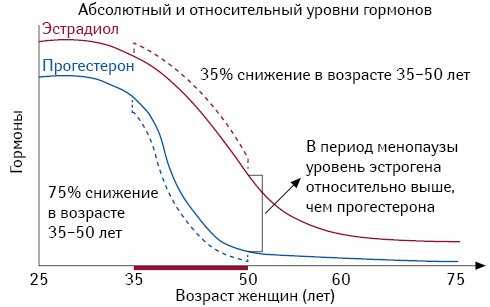 Причины повышения уровня ФСГ
Причины повышения уровня ФСГ
Причины понижения уровня ФСГ в крови

Что может влиять на результат?
Важные замечания

Также рекомендуется
Кто назначает исследование?
Эндокринолог, акушер-гинеколог, педиатр, андролог, репродуктолог.
Литература
 T., Dunning M.B. A Manual of Laboratory and Diagnostic Tests, 8th Ed. Lippincott Williams & Wilkins, 2008: 1344 pp.
T., Dunning M.B. A Manual of Laboratory and Diagnostic Tests, 8th Ed. Lippincott Williams & Wilkins, 2008: 1344 pp.Лютеинизирующий гормон представляет собой гонадотропный гормон, секретируемый гипофизом и необходимый для полового созревания и нормальной половой функции. Его дефицит приводит к половой дисфункции и бесплодию. Это мероприятие описывает оценку и лечение дефицита лютеинизирующего гормона и подчеркивает роль межпрофессиональной команды в оценке и лечении пациентов с этим заболеванием.
Цели:
Определите этиологию дефицита лютеинизирующего гормона.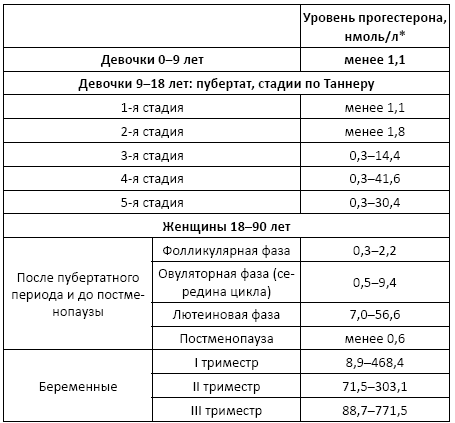
Ознакомьтесь с этапами оценки дефицита лютеинизирующего гормона.
Опишите возможные варианты лечения дефицита лютеинизирующего гормона.
Опишите некоторые межпрофессиональные групповые стратегии для улучшения координации помощи и общения с пациентами с дефицитом лютеинизирующего гормона и улучшения исходов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Лютеинизирующий гормон (ЛГ) представляет собой гликопротеиновый гормон, секретируемый гипофизом в ответ на пульсирующее высвобождение гонадотропин-высвобождающего гормона (ГнРГ) из гипоталамуса. Многие состояния могут вызывать его дефицит в ответ на поддержание гомеостаза и в ответ на регуляцию обратной связи гипоталамо-гипофизарно-гонадной системы. Однако изолированный дефицит лютеинизирующего гормона встречается редко и обычно возникает при применении экзогенного тестостерона, который снижает или останавливает выработку ЛГ из-за эффекта отрицательной обратной связи.
Дефицит ЛГ почти всегда возникает вместе с дефицитом фолликулостимулирующего гормона (ФСГ) из-за их общего источника секреции, т. е. гонадотропных клеток гипофиза. Лютеинизирующий гормон участвует в созревании первичных половых клеток у обоих полов. У мужчин он стимулирует яички к выработке тестостерона, а у женщин стимулирует яичники к выработке стероидных гормонов и играет решающую роль в овуляции.[1]
ЛГ и ФСГ являются основными гормонами, регулирующими гипоталамо-гипофизарно-гонадную систему, и их дефицит может проявляться задержкой полового созревания, нарушениями репродуктивной функции и гипогонадизмом в зависимости от того, возникает ли это состояние до или после полового созревания.
Дефицит ЛГ может быть врожденным или приобретенным, но в зависимости от гипоталамо-гипофизарно-гонадной оси причины дефицита ЛГ можно разделить на гипоталамические и гипофизарные.
Гипоталамические причины
Синдром Каллмана
Синдром Каллмана — врожденная причина дефицита ЛГ, которая часто проявляется гипо- или аносмией. Это происходит из-за генетических мутаций, которые приводят к нарушению дифференцировки или миграции нейронов гонадотропин-высвобождающего гормона (ГнРГ) [2]. Нейроны формируются в обонятельной слизистой оболочке и мигрируют в гипоталамус во время эмбрионального развития. Некоторые исследования предполагают, что эти ошибки развития являются результатом мутаций в гене KISS1, который кодирует гормон кисспептин, ключевой регулятор репродуктивных гормонов [3]. Снижение выработки гормона ГнРГ приводит к уменьшению выработки половых стероидов, что проявляется отсутствием полового созревания и вторичных половых признаков.
Это происходит из-за генетических мутаций, которые приводят к нарушению дифференцировки или миграции нейронов гонадотропин-высвобождающего гормона (ГнРГ) [2]. Нейроны формируются в обонятельной слизистой оболочке и мигрируют в гипоталамус во время эмбрионального развития. Некоторые исследования предполагают, что эти ошибки развития являются результатом мутаций в гене KISS1, который кодирует гормон кисспептин, ключевой регулятор репродуктивных гормонов [3]. Снижение выработки гормона ГнРГ приводит к уменьшению выработки половых стероидов, что проявляется отсутствием полового созревания и вторичных половых признаков.
Мутации бета-субъединицы ЛГ включают инактивирующие мутации в бета-субъединице ЛГ или рецептора ЛГ и приводят к бесплодию и аменорее из-за снижения уровня ЛГ, необходимого для овуляции. Уровни ЛГ могут быть высокими по сравнению с нормой, но мутантный гормон не обладает функциональной способностью.[4]
Идиопатический гипогонадотропный гипогонадизм (ИГГ) возникает в результате полного или частичного отсутствия ГнРГ-индуцированного высвобождения ЛГ и ФСГ. Это состояние относительно редкое и может встречаться как у мужчин, так и у женщин.[5]
Это состояние относительно редкое и может встречаться как у мужчин, так и у женщин.[5]
Гипогонадотропный гипогонадизм, связанный со стрессом, возникает из-за подавления гипоталамуса длительными напряженными физическими упражнениями и резкой потерей веса. Эти состояния вызывают повышение уровня кортикотропин-рилизинг-гормона (CRH), который подавляет пульсирующее высвобождение GnRH из гипоталамуса, что приводит к низким уровням FSH и LH, что проявляется аменореей.[6] Кроме того, эндогенная гиперсекреция глюкокортикоидов из-за повышенной секреции КРГ и АКТГ из-за физиологических или патологических причин экзогенной терапии глюкокортикоидами ингибирует секрецию лютеинизирующего гормона гипофиза и яичников эстрогена и прогестерона [7].
Гипофизарные причины
Гипофизарные причины многочисленны и включают опухоли гипофиза, синдром Шихана, гиперпролактинемию, инфекции и воспаления, нарушения мозгового кровообращения и травмы.
Гиперпролактинемия
Гиперпролактинемия обычно возникает в результате пролактинсекретирующей опухоли гипофиза (пролактиномы). Высокий уровень пролактина ингибирует секрецию ФСГ и ЛГ передней долей гипофиза и приводит к гипогонадизму, бесплодию и галакторее.[8]
Высокий уровень пролактина ингибирует секрецию ФСГ и ЛГ передней долей гипофиза и приводит к гипогонадизму, бесплодию и галакторее.[8]
Синдром Шихана
Синдром Шихана обусловлен массивным кровотечением во время родов и вызывает ишемический инфаркт гипофиза. Все гормоны, вырабатываемые гипофизом, снижены или отсутствуют (пангипопитуитаризм), а отсутствие репродуктивных гормонов гипофиза (ФСГ и ЛГ) вызывает гипогонадотропный гипогонадизм.[9]
Частота гипогонадотропного гипогонадизма (ГГ) составляет от 1 на 10 000 до 1 на 86 000 у мужчин и женщин. Почти 66% случаев связаны с синдромом Каллмана. Этот синдром чаще встречается у мужчин. Синдром Каллмана обычно диагностируется у детей с задержкой полового созревания.
Связанный со стрессом гипогонадотропный гипогонадизм часто встречается у молодых женщин и составляет 30% случаев вторичной аменореи в этой возрастной группе.
Опухоли гипофиза являются редкой причиной и могут возникать в любом возрасте, но обычно диагностируются в позднем взрослом возрасте. Идиопатический гипогонадотропный гипогонадизм также может возникнуть в любом возрасте.
Идиопатический гипогонадотропный гипогонадизм также может возникнуть в любом возрасте.
Синдром Каллмана проявляется аносмией или гипосмией с задержкой полового созревания и отсутствием вторичных половых признаков, таких как уменьшение волос на теле и лице, отсутствие огрубления голоса [10] и лобковых волос, евнухоидная форма тела, слабое развитие мышц , маленькие яички и маленький пенис у мужчин и отсутствие развития груди и других вторичных половых признаков у женщин. Женщины также сообщают в анамнезе о первичной аменорее. У мужчин может быть гинекомастия.
Гипогонадотропный гипогонадизм, связанный со стрессом, обычно возникает у женщин репродуктивного возраста, недавно перенесших значительный стресс или чрезмерную потерю веса, например, нервную анорексию. Факторы, которые вызывают потерю веса и возникающий в результате гипогонадотропный гипогонадизм, включают чрезмерные физические нагрузки, психические расстройства, такие как нервная анорексия, и недоедание.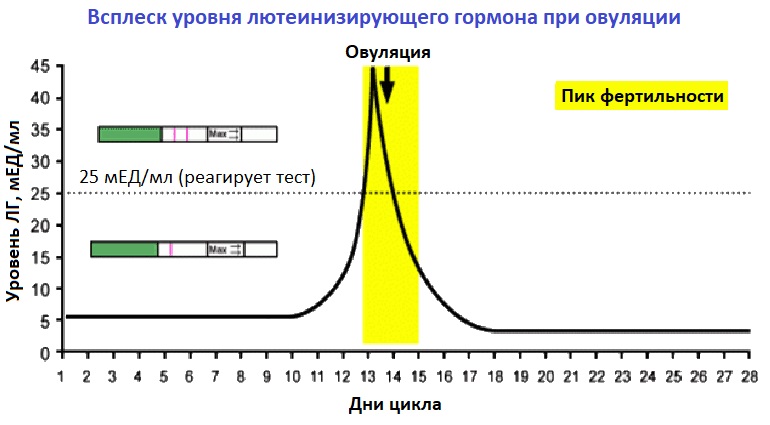
Идиопатический гипогонадотропный гипогонадизм (ИГГ) у детей протекает так же, как синдром Каллмана, за исключением аносмии. ИГГ во взрослом возрасте проявляется сексуальной дисфункцией (потеря либидо, эректильная дисфункция) у мужчин и аменореей у женщин [11].
Пациенты с опухолями гипофиза имеют различные проявления, но часто встречаются нарушения зрения и головная боль. Гиперпролактинемия проявляется аменореей и галактореей у женщин и импотенцией, бесплодием и гипогонадизмом у мужчин [12, 13]. У мужчин может быть ассоциированная галакторея; однако это редкость.
Лабораторные тесты: Первоначальная оценка направлена на исключение гипотиреоза путем измерения уровня ТТГ в сыворотке крови и беременности у женщин. Измеряют сывороточные уровни ЛГ, ФСГ и пролактина (ПРЛ). Опухоли гипофиза, которые распространяются выше ножки гипофиза, и супраселлярные опухоли нарушают доставку дофамина в ножку гипофиза. Они предотвращают ингибирование секреции пролактина лактотрофами дофамином и вызывают гиперпролактинемию.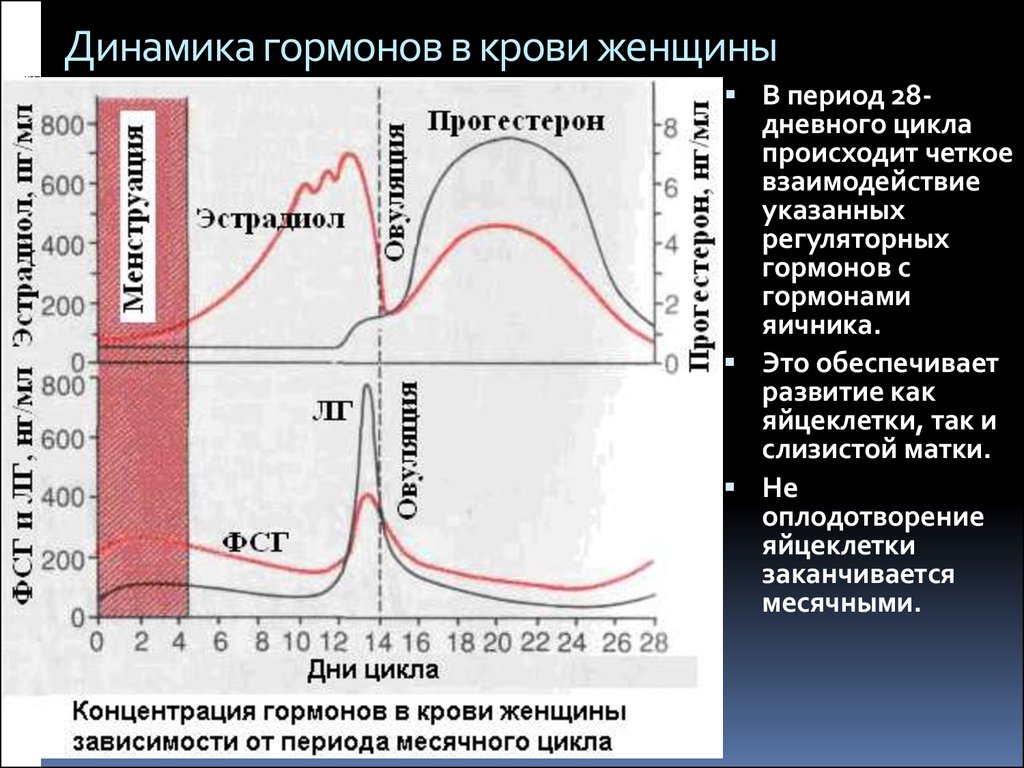 [14] Обонятельное тестирование используется при синдроме Каллмана для диагностики аносмии.
[14] Обонятельное тестирование используется при синдроме Каллмана для диагностики аносмии.
МРТ головы может помочь в изучении структурных аномалий гипоталамуса и гипофиза, особенно аденом гипофиза.
Лечение дефицита ЛГ зависит от основной причины, возраста и пола, а также от желаемого результата в отношении фертильности.
У мальчиков препубертатного возраста заместительная терапия андрогенами (тестостероном) вызывает половое созревание и развитие вторичных половых признаков.[15] Существует множество составов, доступных в нескольких формах, таких как трансдермальные пластыри, гели, внутримышечные инъекции и пероральные формы. Замещение тестостероном следует начинать в возрасте от 12 до 14 лет для индукции полового созревания.[16]
У мужчин, достигших половой зрелости, заместительная терапия андрогенами может обратить вспять признаки и симптомы гипогонадизма. Замена тестостерона также помогает в лечении других состояний, связанных с дефицитом тестостерона, таких как анемия, снижение плотности костей, атрофия мышц и изменения настроения / когнитивных способностей. Мужчинам, которые хотят стать отцами, гонадотропин-рилизинг-гормон (ГнРГ) помогает достичь фертильности. Для лечения доступны различные гонадотропины, такие как мочевые и рекомбинантные. Эффект лечения различен, и до начала сперматогенеза может пройти до 2 лет терапии.[10]
Мужчинам, которые хотят стать отцами, гонадотропин-рилизинг-гормон (ГнРГ) помогает достичь фертильности. Для лечения доступны различные гонадотропины, такие как мочевые и рекомбинантные. Эффект лечения различен, и до начала сперматогенеза может пройти до 2 лет терапии.[10]
Терапия эстрогенами — это терапия у девочек препубертатного возраста для индукции полового созревания и развития молочных желез. Доступны несколько лекарственных форм эстрогена, включая пероральный эстрадиол, пероральный конъюгированный эстроген, эстрогеновый гель и трансдермальные эстрогеновые пластыри. Возраст, в котором начинается терапия эстрогенами, индивидуален и включает в себя такие факторы, как хронологический возраст, костный возраст, абсолютный рост и психосоциальные проблемы.[18]
У женщин, желающих забеременеть, индукция овуляции происходит с помощью гонадотропинов наряду с терапией эстрогенами. Овуляция является результатом выброса ЛГ во время нормального овуляторного цикла и не происходит при регулярной заместительной терапии эстрогенами. Для этой цели подходят хорионический гонадотропин человека (ХГЧ) и менопаузальный гонадотропин человека (ЧМГ). Женщины со стрессовым гипогонадотропным гипогонадизмом обычно сообщают об исчезновении симптомов после снятия стресса. Прибавка в весе также восстанавливает гипогонадотропный гипогонадизм, если он обусловлен потерей веса и уменьшением жировой ткани ниже критического уровня.
Для этой цели подходят хорионический гонадотропин человека (ХГЧ) и менопаузальный гонадотропин человека (ЧМГ). Женщины со стрессовым гипогонадотропным гипогонадизмом обычно сообщают об исчезновении симптомов после снятия стресса. Прибавка в весе также восстанавливает гипогонадотропный гипогонадизм, если он обусловлен потерей веса и уменьшением жировой ткани ниже критического уровня.
Заболевания гипофиза лечатся в зависимости от этиологии и гормонального дисбаланса. Гиперпролактинемия, вызванная аденомами гипофиза, лечится агонистами дофамина и хорошо поддается медикаментозному лечению. Резистентные пролактиномы требуют хирургического вмешательства и тщательного наблюдения.[19]
Дефицит лютеинизирующего гормона является формой вторичного гипогонадизма и требует дифференциации от заболеваний половых желез, вызывающих первичный гипогонадизм, и других гормональных нарушений, поражающих гипофиз и гипоталамус. После постановки диагноза вторичного гипогонадотропного гипогонадизма врач должен установить причину заболевания.
Differential Diagnosis:
Primary hypogonadism
Primary amenorrhea
Hypogonadism due to thyroid dysfunction
Luteal phase dysfunction
Prolactinoma
Ovarian insufficiency
Decreased sperm производство
Синдром поликистозных яичников
Синдром Калмана и генетический идиопатический гипогонадотропный гипогонадизм пациенты нуждаются в пожизненной заместительной гормональной терапии для нормальной половой функции и фертильности. В некоторых случаях фертильность может не восстановиться, потому что реакция на гормональную терапию у разных людей разная.
Аденомы гипофиза могут спонтанно разрешаться, если они небольшого размера (микроаденомы). Микроаденомы требуют периодического наблюдения. Макроаденомы требуют визуализации не реже одного раза в год для контроля увеличения и могут потребовать хирургического удаления.
Гипогонадотропный гипогонадизм, связанный со стрессом, обычно разрешается после снятия стресса и имеет хороший прогноз. Гипогонадотропный гипогонадизм, связанный с потерей веса, как и нервная анорексия, обычно проходит после увеличения веса.
Отсутствие лечения дефицита ЛГ приводит к бесплодию, а если он возникает до полового созревания, у пациента не развиваются половое созревание и вторичные половые признаки. Недостаток тестостерона приводит к потере мышечной массы, снижению плотности костей и потере полового влечения у мужчин.
Дефицит ЛГ приводит к бесплодию и отсутствию полового созревания. Пациент должен получить информацию об основном механизме процесса. Пациенты и их семьи должны понимать, что заместительная гормональная терапия может помочь в достижении половой зрелости. С этой целью заместительная гормональная терапия должна начинаться сразу после установления диагноза задержки полового созревания и определения основной причины. Пожилым мужчинам следует рекомендовать терапию гонадотропинами для лечения бесплодия, а также следует понимать, что ответ на терапию может быть разным. Фертильность может быть достигнута или не достигнута в зависимости от их реакции и приверженности лечению.
Пожилым мужчинам следует рекомендовать терапию гонадотропинами для лечения бесплодия, а также следует понимать, что ответ на терапию может быть разным. Фертильность может быть достигнута или не достигнута в зависимости от их реакции и приверженности лечению.
Женщины с дефицитом ЛГ должны получать заместительную терапию эстрогенами. Если они хотят забеременеть, они должны получить направление к репродуктивной эндокринологии.
Пациенты должны быть осведомлены о побочных эффектах гормональной терапии.
ЛГ является одним из двух гормонов, регулирующих ось HPG, и его дефицит приводит к нарушению регуляции. Таким образом, его своевременная диагностика и лечение необходимы для надлежащего репродуктивного здоровья и предотвращения проблем с психическим здоровьем, связанных с этими состояниями. Это состояние требует лечения межпрофессиональной командой, в которую входят эндокринолог, гинеколог, медсестра, консультант по психическому здоровью, генетик и репродуктивный эндокринолог, если пациентка желает иметь фертильность.
Любая гормональная терапия, начатая эндокринологом, должна перевешивать риски, например, риск сердечно-сосудистых заболеваний, рака предстательной железы и полицитемии у мужчин при терапии тестостероном, рака молочной железы, тромбоэмболических осложнений, гипертонии и увеличения веса у женщин с заместительной гормональной терапией терапия. Бесплодие имеет серьезные последствия для психического здоровья и требует консультации с консультантом по психическому здоровью. Приверженность к медикаментозной терапии достигается с помощью медсестры и фармацевта. Необходимо тщательное наблюдение, поскольку результат гормональной терапии проявляется не сразу. Благодаря координации медицинской бригады и обучению пациента и его семьи репродуктивное и психическое здоровье этих пациентов может улучшиться.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Недрески Д., Сингх Г. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 28 сентября 2021 г. Физиология, лютеинизирующий гормон. [PubMed: 30969514]
Sonne J, Lopez-Ojeda W. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 июня., 2022. Синдром Каллмана. [PubMed: 30855798]
Комнинос А.Н., Дхилло В.С. Новые роли Кисспептина в сексуальной и эмоциональной обработке мозга. Нейроэндокринология. 2018;106(2):195-202. [PubMed: 28866668]
Арнхольд И.Дж., Лофрано-Порто А., Латронико А.С. Инактивирующие мутации бета-субъединицы лютеинизирующего гормона или рецептора лютеинизирующего гормона вызывают олигоаменорею и бесплодие у женщин. Горм Рез. 2009;71(2):75-82. [В паблике: 19129711]
Mao JF, Nie M, Lu SY, Wu XY. Идиопатический гипогонадотропный гипогонадизм у взрослых: возможная этиология, клинические проявления и лечение. Азиат Джей Андрол. 2010 июль; 12 (4): 611-4. [Бесплатная статья PMC: PMC3739368] [PubMed: 20531282]
Азиат Джей Андрол. 2010 июль; 12 (4): 611-4. [Бесплатная статья PMC: PMC3739368] [PubMed: 20531282]
Уоррен MP. Влияние физических упражнений на половое созревание и репродуктивную функцию у девочек. J Clin Endocrinol Metab. 1980 ноябрь; 51 (5): 1150-7. [PubMed: 6775000]
Калантариду С.Н., Макригианнакис А., Зумакис Э., Хрусос Г.П. Стресс и женская репродуктивная система. J Reprod Immunol. 2004 г., июнь; 62 (1–2): 61–8. [PubMed: 15288182]
Capozzi A, Scambia G, Pontecorvi A, Lello S. Гиперпролактинемия: патофизиология и терапевтический подход. Гинекол Эндокринол. 2015 июль; 31 (7): 506-10. [PubMed: 26291795]
Серт М., Тетикер Т., Кирим С., Коджак М. Клинический отчет о 28 пациентах с синдромом Шихана. Endocr J. 2003 июнь; 50 (3): 297-301. [PubMed: 12940458]
Fraietta R, Zylberstejn DS, Esteves SC. Повторный взгляд на гипогонадотропный гипогонадизм. Клиники (Сан-Паулу). 2013; 68 Дополнение 1:81-8. [Бесплатная статья PMC: PMC3583156] [PubMed: 23503957]
Клиники (Сан-Паулу). 2013; 68 Дополнение 1:81-8. [Бесплатная статья PMC: PMC3583156] [PubMed: 23503957]
Тан Р.Ю., Чен Р., Ма М., Линь С.К., Чжан Ю.В., Ван Ю.П. Клинические характеристики 138 китайских пациенток с идиопатическим гипогонадотропным гипогонадизмом. Эндокр Коннект. 2017 ноябрь;6(8):800-810. [Бесплатная статья PMC: PMC5682410] [PubMed: 2
55]Кумар П., Кумар Н., Такур Д.С., Патидар А. Мужской гипогонадизм: симптомы и лечение. J Adv Pharm Technol Res. 2010 июль; 1 (3): 297-301. [Бесплатная статья PMC: PMC3255409] [PubMed: 22247861]
Сампери И., Литгоу К., Каравитаки Н. Гиперпролактинемия. Дж. Клин Мед. 13 декабря 2019 г., 8(12) [бесплатная статья PMC: PMC6947286] [PubMed: 31847209]
Skinner DC. Переосмысление стебельчатого эффекта: новая гипотеза, объясняющая супраселлярную гиперпролактинемию, индуцированную опухолью. Мед Гипотезы. 2009 г.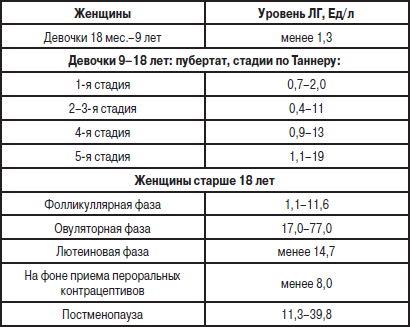 Март; 72 (3): 309-10. [Бесплатная статья PMC: PMC2668659] [PubMed: 1
Март; 72 (3): 309-10. [Бесплатная статья PMC: PMC2668659] [PubMed: 1
20]
Рей Р.А., Гринспон РП. Лечение андрогенами у подростков мужского пола с гипогонадизмом. Am J Mens Health. 2020 май-июнь;14(3):1557988320922443. [Бесплатная статья PMC: PMC7249582] [PubMed: 32448030]
Stancampiano MR, Lucas-Herald AK, Russo G, Rogol AD, Ahmed SF. Терапия тестостероном у мальчиков-подростков: необходимость структурированного подхода. Горм Рес Педиатр. 2019;92(4):215-228. [PubMed: 31851967]
Zitzmann M, Nieschlag E. Замещение гормонов при мужском гипогонадизме. Мол Селл Эндокринол. 2000 30 марта; 161 (1-2): 73-88. [PubMed: 10773395]
Вишванатан В., Югстер Э.А. Этиология и лечение гипогонадизма у подростков. Педиатр Клин Норт Ам. 2011 окт;58(5):1181-200, х. [Бесплатная статья PMC: PMC4102132] [PubMed: 21981955]
Casanueva FF, Molitch ME, Schlechte JA, Abs R, Bonert V, Bronstein MD, Brue T, Cappabianca P, Colao A, Fahlbusch R, Фиделефф Х. , Хадани М., Келли П., Клейнберг Д., Лоус Э., Марек Дж., Скэнлон М., Собриньо Л.Г., Васс Дж.А., Джустина А. Руководство Общества гипофиза по диагностике и лечению пролактином. Клин Эндокринол (Oxf). 2006 г., август; 65 (2): 265–73. [В паблике: 16886971]
, Хадани М., Келли П., Клейнберг Д., Лоус Э., Марек Дж., Скэнлон М., Собриньо Л.Г., Васс Дж.А., Джустина А. Руководство Общества гипофиза по диагностике и лечению пролактином. Клин Эндокринол (Oxf). 2006 г., август; 65 (2): 265–73. [В паблике: 16886971]
Лютеинизирующий гормон – это гонадотропный гормон, секретируемый гипофизом и необходимый для полового созревания и нормальной половой функции. Его дефицит приводит к половой дисфункции и бесплодию. Это мероприятие описывает оценку и лечение дефицита лютеинизирующего гормона и подчеркивает роль межпрофессиональной команды в оценке и лечении пациентов с этим заболеванием.
Цели:
Определите этиологию дефицита лютеинизирующего гормона.
Ознакомьтесь с этапами оценки дефицита лютеинизирующего гормона.
Опишите возможные варианты лечения дефицита лютеинизирующего гормона.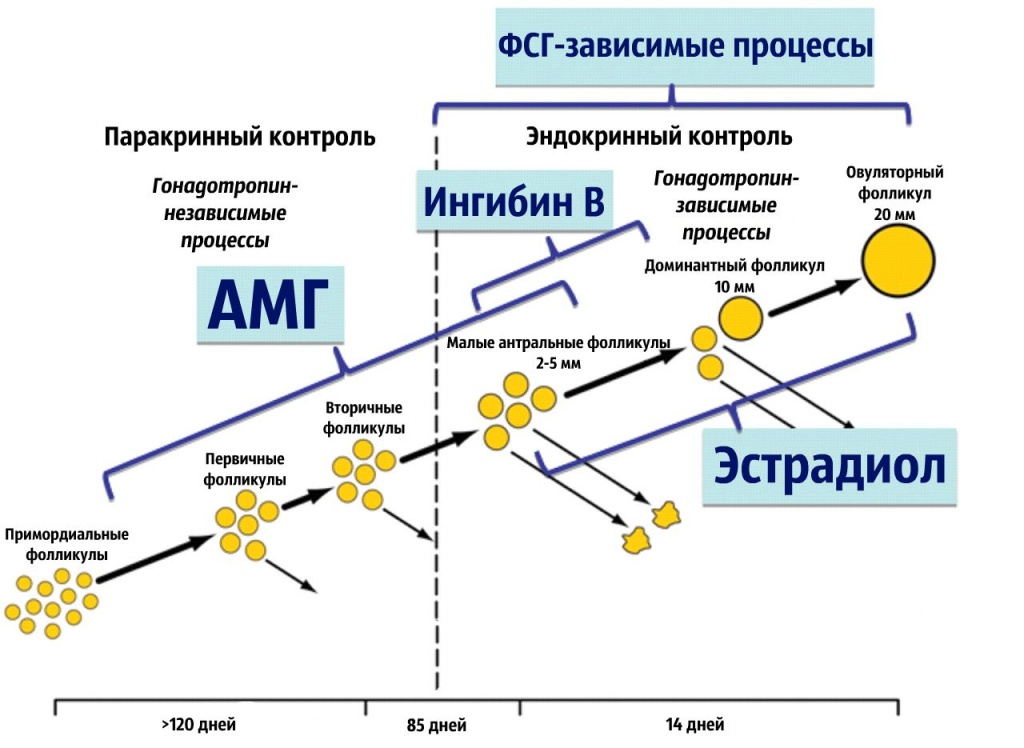
Опишите некоторые межпрофессиональные групповые стратегии для улучшения координации помощи и общения с пациентами с дефицитом лютеинизирующего гормона и улучшения исходов.
Получите доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Лютеинизирующий гормон (ЛГ) представляет собой гликопротеиновый гормон, секретируемый гипофизом в ответ на пульсирующее высвобождение гонадотропин-высвобождающего гормона (ГнРГ) из гипоталамуса. Многие состояния могут вызывать его дефицит в ответ на поддержание гомеостаза и в ответ на регуляцию обратной связи гипоталамо-гипофизарно-гонадной системы. Однако изолированный дефицит лютеинизирующего гормона встречается редко и обычно возникает при применении экзогенного тестостерона, который снижает или останавливает выработку ЛГ из-за эффекта отрицательной обратной связи.
Дефицит ЛГ почти всегда возникает вместе с дефицитом фолликулостимулирующего гормона (ФСГ) из-за их общего источника секреции, т. е. гонадотропных клеток гипофиза. Лютеинизирующий гормон участвует в созревании первичных половых клеток у обоих полов. У мужчин он стимулирует яички к выработке тестостерона, а у женщин стимулирует яичники к выработке стероидных гормонов и играет решающую роль в овуляции.[1]
е. гонадотропных клеток гипофиза. Лютеинизирующий гормон участвует в созревании первичных половых клеток у обоих полов. У мужчин он стимулирует яички к выработке тестостерона, а у женщин стимулирует яичники к выработке стероидных гормонов и играет решающую роль в овуляции.[1]
ЛГ и ФСГ являются основными гормонами, регулирующими гипоталамо-гипофизарно-гонадную систему, и их дефицит может проявляться задержкой полового созревания, нарушениями репродуктивной функции и гипогонадизмом в зависимости от того, возникает ли это состояние до или после полового созревания.
Дефицит ЛГ может быть врожденным или приобретенным, но в зависимости от гипоталамо-гипофизарно-гонадной оси причины дефицита ЛГ можно разделить на гипоталамические и гипофизарные.
Гипоталамические причины
Синдром Каллмана
Синдром Каллмана — врожденная причина дефицита ЛГ, которая часто проявляется гипо- или аносмией. Это происходит из-за генетических мутаций, которые приводят к нарушению дифференцировки или миграции нейронов гонадотропин-высвобождающего гормона (ГнРГ) [2]. Нейроны формируются в обонятельной слизистой оболочке и мигрируют в гипоталамус во время эмбрионального развития. Некоторые исследования предполагают, что эти ошибки развития являются результатом мутаций в гене KISS1, который кодирует гормон кисспептин, ключевой регулятор репродуктивных гормонов [3]. Снижение выработки гормона ГнРГ приводит к уменьшению выработки половых стероидов, что проявляется отсутствием полового созревания и вторичных половых признаков.
Нейроны формируются в обонятельной слизистой оболочке и мигрируют в гипоталамус во время эмбрионального развития. Некоторые исследования предполагают, что эти ошибки развития являются результатом мутаций в гене KISS1, который кодирует гормон кисспептин, ключевой регулятор репродуктивных гормонов [3]. Снижение выработки гормона ГнРГ приводит к уменьшению выработки половых стероидов, что проявляется отсутствием полового созревания и вторичных половых признаков.
Мутации бета-субъединицы ЛГ включают инактивирующие мутации в бета-субъединице ЛГ или рецептора ЛГ и приводят к бесплодию и аменорее из-за снижения уровня ЛГ, необходимого для овуляции. Уровни ЛГ могут быть высокими по сравнению с нормой, но мутантный гормон не обладает функциональной способностью.[4]
Идиопатический гипогонадотропный гипогонадизм (ИГГ) возникает в результате полного или частичного отсутствия ГнРГ-индуцированного высвобождения ЛГ и ФСГ. Это состояние относительно редкое и может встречаться как у мужчин, так и у женщин. [5]
[5]
Гипогонадотропный гипогонадизм, связанный со стрессом, возникает из-за подавления гипоталамуса длительными напряженными физическими упражнениями и резкой потерей веса. Эти состояния вызывают повышение уровня кортикотропин-рилизинг-гормона (CRH), который подавляет пульсирующее высвобождение GnRH из гипоталамуса, что приводит к низким уровням FSH и LH, что проявляется аменореей.[6] Кроме того, эндогенная гиперсекреция глюкокортикоидов из-за повышенной секреции КРГ и АКТГ из-за физиологических или патологических причин экзогенной терапии глюкокортикоидами ингибирует секрецию лютеинизирующего гормона гипофиза и яичников эстрогена и прогестерона [7].
Гипофизарные причины
Гипофизарные причины многочисленны и включают опухоли гипофиза, синдром Шихана, гиперпролактинемию, инфекции и воспаления, нарушения мозгового кровообращения и травмы.
Гиперпролактинемия
Гиперпролактинемия обычно возникает в результате пролактинсекретирующей опухоли гипофиза (пролактиномы). Высокий уровень пролактина ингибирует секрецию ФСГ и ЛГ передней долей гипофиза и приводит к гипогонадизму, бесплодию и галакторее.[8]
Высокий уровень пролактина ингибирует секрецию ФСГ и ЛГ передней долей гипофиза и приводит к гипогонадизму, бесплодию и галакторее.[8]
Синдром Шихана
Синдром Шихана обусловлен массивным кровотечением во время родов и вызывает ишемический инфаркт гипофиза. Все гормоны, вырабатываемые гипофизом, снижены или отсутствуют (пангипопитуитаризм), а отсутствие репродуктивных гормонов гипофиза (ФСГ и ЛГ) вызывает гипогонадотропный гипогонадизм.[9]
Частота гипогонадотропного гипогонадизма (ГГ) составляет от 1 на 10 000 до 1 на 86 000 у мужчин и женщин. Почти 66% случаев связаны с синдромом Каллмана. Этот синдром чаще встречается у мужчин. Синдром Каллмана обычно диагностируется у детей с задержкой полового созревания.
Связанный со стрессом гипогонадотропный гипогонадизм часто встречается у молодых женщин и составляет 30% случаев вторичной аменореи в этой возрастной группе.
Опухоли гипофиза являются редкой причиной и могут возникать в любом возрасте, но обычно диагностируются в позднем взрослом возрасте.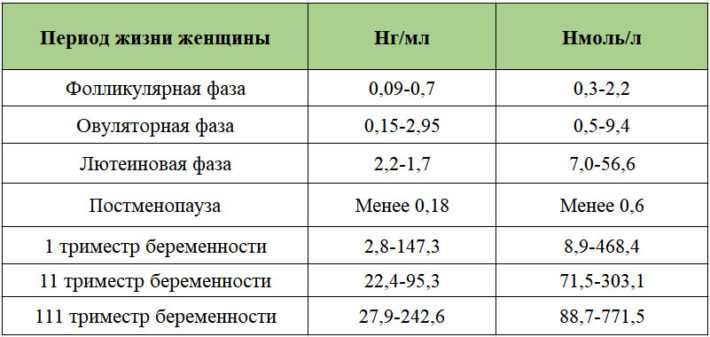 Идиопатический гипогонадотропный гипогонадизм также может возникнуть в любом возрасте.
Идиопатический гипогонадотропный гипогонадизм также может возникнуть в любом возрасте.
Синдром Каллмана проявляется аносмией или гипосмией с задержкой полового созревания и отсутствием вторичных половых признаков, таких как уменьшение волос на теле и лице, отсутствие огрубления голоса [10] и лобковых волос, евнухоидная форма тела, слабое развитие мышц , маленькие яички и маленький пенис у мужчин и отсутствие развития груди и других вторичных половых признаков у женщин. Женщины также сообщают в анамнезе о первичной аменорее. У мужчин может быть гинекомастия.
Гипогонадотропный гипогонадизм, связанный со стрессом, обычно возникает у женщин репродуктивного возраста, недавно перенесших значительный стресс или чрезмерную потерю веса, например, нервную анорексию. Факторы, которые вызывают потерю веса и возникающий в результате гипогонадотропный гипогонадизм, включают чрезмерные физические нагрузки, психические расстройства, такие как нервная анорексия, и недоедание.
Идиопатический гипогонадотропный гипогонадизм (ИГГ) у детей протекает так же, как синдром Каллмана, за исключением аносмии. ИГГ во взрослом возрасте проявляется сексуальной дисфункцией (потеря либидо, эректильная дисфункция) у мужчин и аменореей у женщин [11].
Пациенты с опухолями гипофиза имеют различные проявления, но часто встречаются нарушения зрения и головная боль. Гиперпролактинемия проявляется аменореей и галактореей у женщин и импотенцией, бесплодием и гипогонадизмом у мужчин [12, 13]. У мужчин может быть ассоциированная галакторея; однако это редкость.
Лабораторные тесты: Первоначальная оценка направлена на исключение гипотиреоза путем измерения уровня ТТГ в сыворотке крови и беременности у женщин. Измеряют сывороточные уровни ЛГ, ФСГ и пролактина (ПРЛ). Опухоли гипофиза, которые распространяются выше ножки гипофиза, и супраселлярные опухоли нарушают доставку дофамина в ножку гипофиза. Они предотвращают ингибирование секреции пролактина лактотрофами дофамином и вызывают гиперпролактинемию. [14] Обонятельное тестирование используется при синдроме Каллмана для диагностики аносмии.
[14] Обонятельное тестирование используется при синдроме Каллмана для диагностики аносмии.
МРТ головы может помочь в изучении структурных аномалий гипоталамуса и гипофиза, особенно аденом гипофиза.
Лечение дефицита ЛГ зависит от основной причины, возраста и пола, а также от желаемого результата в отношении фертильности.
У мальчиков препубертатного возраста заместительная терапия андрогенами (тестостероном) вызывает половое созревание и развитие вторичных половых признаков.[15] Существует множество составов, доступных в нескольких формах, таких как трансдермальные пластыри, гели, внутримышечные инъекции и пероральные формы. Замещение тестостероном следует начинать в возрасте от 12 до 14 лет для индукции полового созревания.[16]
У мужчин, достигших половой зрелости, заместительная терапия андрогенами может обратить вспять признаки и симптомы гипогонадизма. Замена тестостерона также помогает в лечении других состояний, связанных с дефицитом тестостерона, таких как анемия, снижение плотности костей, атрофия мышц и изменения настроения / когнитивных способностей. Мужчинам, которые хотят стать отцами, гонадотропин-рилизинг-гормон (ГнРГ) помогает достичь фертильности. Для лечения доступны различные гонадотропины, такие как мочевые и рекомбинантные. Эффект лечения различен, и до начала сперматогенеза может пройти до 2 лет терапии.[10]
Мужчинам, которые хотят стать отцами, гонадотропин-рилизинг-гормон (ГнРГ) помогает достичь фертильности. Для лечения доступны различные гонадотропины, такие как мочевые и рекомбинантные. Эффект лечения различен, и до начала сперматогенеза может пройти до 2 лет терапии.[10]
Терапия эстрогенами — это терапия у девочек препубертатного возраста для индукции полового созревания и развития молочных желез. Доступны несколько лекарственных форм эстрогена, включая пероральный эстрадиол, пероральный конъюгированный эстроген, эстрогеновый гель и трансдермальные эстрогеновые пластыри. Возраст, в котором начинается терапия эстрогенами, индивидуален и включает в себя такие факторы, как хронологический возраст, костный возраст, абсолютный рост и психосоциальные проблемы.[18]
У женщин, желающих забеременеть, индукция овуляции происходит с помощью гонадотропинов наряду с терапией эстрогенами. Овуляция является результатом выброса ЛГ во время нормального овуляторного цикла и не происходит при регулярной заместительной терапии эстрогенами. Для этой цели подходят хорионический гонадотропин человека (ХГЧ) и менопаузальный гонадотропин человека (ЧМГ). Женщины со стрессовым гипогонадотропным гипогонадизмом обычно сообщают об исчезновении симптомов после снятия стресса. Прибавка в весе также восстанавливает гипогонадотропный гипогонадизм, если он обусловлен потерей веса и уменьшением жировой ткани ниже критического уровня.
Для этой цели подходят хорионический гонадотропин человека (ХГЧ) и менопаузальный гонадотропин человека (ЧМГ). Женщины со стрессовым гипогонадотропным гипогонадизмом обычно сообщают об исчезновении симптомов после снятия стресса. Прибавка в весе также восстанавливает гипогонадотропный гипогонадизм, если он обусловлен потерей веса и уменьшением жировой ткани ниже критического уровня.
Заболевания гипофиза лечатся в зависимости от этиологии и гормонального дисбаланса. Гиперпролактинемия, вызванная аденомами гипофиза, лечится агонистами дофамина и хорошо поддается медикаментозному лечению. Резистентные пролактиномы требуют хирургического вмешательства и тщательного наблюдения.[19]
Дефицит лютеинизирующего гормона является формой вторичного гипогонадизма и требует дифференциации от заболеваний половых желез, вызывающих первичный гипогонадизм, и других гормональных нарушений, поражающих гипофиз и гипоталамус. После постановки диагноза вторичного гипогонадотропного гипогонадизма врач должен установить причину заболевания.
Differential Diagnosis:
Primary hypogonadism
Primary amenorrhea
Hypogonadism due to thyroid dysfunction
Luteal phase dysfunction
Prolactinoma
Ovarian insufficiency
Decreased sperm производство
Синдром поликистозных яичников
Синдром Калмана и генетический идиопатический гипогонадотропный гипогонадизм пациенты нуждаются в пожизненной заместительной гормональной терапии для нормальной половой функции и фертильности. В некоторых случаях фертильность может не восстановиться, потому что реакция на гормональную терапию у разных людей разная.
Аденомы гипофиза могут спонтанно разрешаться, если они небольшого размера (микроаденомы). Микроаденомы требуют периодического наблюдения. Макроаденомы требуют визуализации не реже одного раза в год для контроля увеличения и могут потребовать хирургического удаления.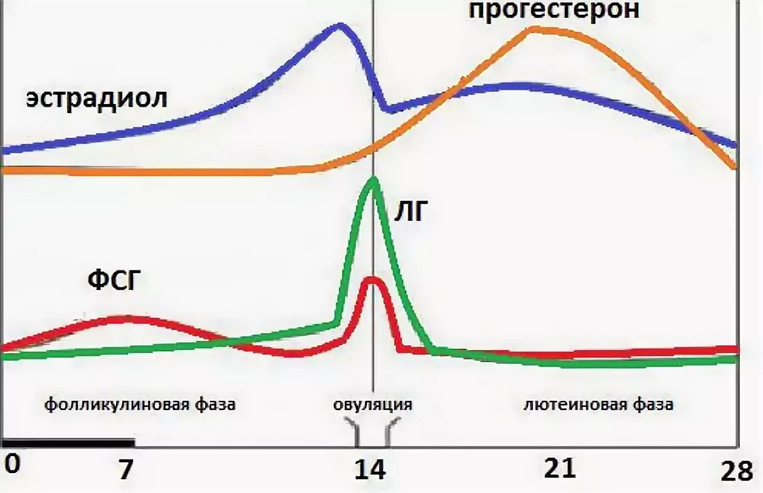
Гипогонадотропный гипогонадизм, связанный со стрессом, обычно разрешается после снятия стресса и имеет хороший прогноз. Гипогонадотропный гипогонадизм, связанный с потерей веса, как и нервная анорексия, обычно проходит после увеличения веса.
Отсутствие лечения дефицита ЛГ приводит к бесплодию, а если он возникает до полового созревания, у пациента не развиваются половое созревание и вторичные половые признаки. Недостаток тестостерона приводит к потере мышечной массы, снижению плотности костей и потере полового влечения у мужчин.
Дефицит ЛГ приводит к бесплодию и отсутствию полового созревания. Пациент должен получить информацию об основном механизме процесса. Пациенты и их семьи должны понимать, что заместительная гормональная терапия может помочь в достижении половой зрелости. С этой целью заместительная гормональная терапия должна начинаться сразу после установления диагноза задержки полового созревания и определения основной причины. Пожилым мужчинам следует рекомендовать терапию гонадотропинами для лечения бесплодия, а также следует понимать, что ответ на терапию может быть разным. Фертильность может быть достигнута или не достигнута в зависимости от их реакции и приверженности лечению.
Пожилым мужчинам следует рекомендовать терапию гонадотропинами для лечения бесплодия, а также следует понимать, что ответ на терапию может быть разным. Фертильность может быть достигнута или не достигнута в зависимости от их реакции и приверженности лечению.
Женщины с дефицитом ЛГ должны получать заместительную терапию эстрогенами. Если они хотят забеременеть, они должны получить направление к репродуктивной эндокринологии.
Пациенты должны быть осведомлены о побочных эффектах гормональной терапии.
ЛГ является одним из двух гормонов, регулирующих ось HPG, и его дефицит приводит к нарушению регуляции. Таким образом, его своевременная диагностика и лечение необходимы для надлежащего репродуктивного здоровья и предотвращения проблем с психическим здоровьем, связанных с этими состояниями. Это состояние требует лечения межпрофессиональной командой, в которую входят эндокринолог, гинеколог, медсестра, консультант по психическому здоровью, генетик и репродуктивный эндокринолог, если пациентка желает иметь фертильность.
Любая гормональная терапия, начатая эндокринологом, должна перевешивать риски, например, риск сердечно-сосудистых заболеваний, рака предстательной железы и полицитемии у мужчин при терапии тестостероном, рака молочной железы, тромбоэмболических осложнений, гипертонии и увеличения веса у женщин с заместительной гормональной терапией терапия. Бесплодие имеет серьезные последствия для психического здоровья и требует консультации с консультантом по психическому здоровью. Приверженность к медикаментозной терапии достигается с помощью медсестры и фармацевта. Необходимо тщательное наблюдение, поскольку результат гормональной терапии проявляется не сразу. Благодаря координации медицинской бригады и обучению пациента и его семьи репродуктивное и психическое здоровье этих пациентов может улучшиться.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.

Недрески Д., Сингх Г. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 28 сентября 2021 г. Физиология, лютеинизирующий гормон. [PubMed: 30969514]
Sonne J, Lopez-Ojeda W. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 19 июня., 2022. Синдром Каллмана. [PubMed: 30855798]
Комнинос А.Н., Дхилло В.С. Новые роли Кисспептина в сексуальной и эмоциональной обработке мозга. Нейроэндокринология. 2018;106(2):195-202. [PubMed: 28866668]
Арнхольд И.Дж., Лофрано-Порто А., Латронико А.С. Инактивирующие мутации бета-субъединицы лютеинизирующего гормона или рецептора лютеинизирующего гормона вызывают олигоаменорею и бесплодие у женщин. Горм Рез. 2009;71(2):75-82. [В паблике: 19129711]
Mao JF, Nie M, Lu SY, Wu XY. Идиопатический гипогонадотропный гипогонадизм у взрослых: возможная этиология, клинические проявления и лечение. Азиат Джей Андрол. 2010 июль; 12 (4): 611-4. [Бесплатная статья PMC: PMC3739368] [PubMed: 20531282]
Азиат Джей Андрол. 2010 июль; 12 (4): 611-4. [Бесплатная статья PMC: PMC3739368] [PubMed: 20531282]
Уоррен MP. Влияние физических упражнений на половое созревание и репродуктивную функцию у девочек. J Clin Endocrinol Metab. 1980 ноябрь; 51 (5): 1150-7. [PubMed: 6775000]
Калантариду С.Н., Макригианнакис А., Зумакис Э., Хрусос Г.П. Стресс и женская репродуктивная система. J Reprod Immunol. 2004 г., июнь; 62 (1–2): 61–8. [PubMed: 15288182]
Capozzi A, Scambia G, Pontecorvi A, Lello S. Гиперпролактинемия: патофизиология и терапевтический подход. Гинекол Эндокринол. 2015 июль; 31 (7): 506-10. [PubMed: 26291795]
Серт М., Тетикер Т., Кирим С., Коджак М. Клинический отчет о 28 пациентах с синдромом Шихана. Endocr J. 2003 июнь; 50 (3): 297-301. [PubMed: 12940458]
Fraietta R, Zylberstejn DS, Esteves SC. Повторный взгляд на гипогонадотропный гипогонадизм. Клиники (Сан-Паулу). 2013; 68 Дополнение 1:81-8. [Бесплатная статья PMC: PMC3583156] [PubMed: 23503957]
Клиники (Сан-Паулу). 2013; 68 Дополнение 1:81-8. [Бесплатная статья PMC: PMC3583156] [PubMed: 23503957]
Тан Р.Ю., Чен Р., Ма М., Линь С.К., Чжан Ю.В., Ван Ю.П. Клинические характеристики 138 китайских пациенток с идиопатическим гипогонадотропным гипогонадизмом. Эндокр Коннект. 2017 ноябрь;6(8):800-810. [Бесплатная статья PMC: PMC5682410] [PubMed: 2
55]Кумар П., Кумар Н., Такур Д.С., Патидар А. Мужской гипогонадизм: симптомы и лечение. J Adv Pharm Technol Res. 2010 июль; 1 (3): 297-301. [Бесплатная статья PMC: PMC3255409] [PubMed: 22247861]
Сампери И., Литгоу К., Каравитаки Н. Гиперпролактинемия. Дж. Клин Мед. 13 декабря 2019 г., 8(12) [бесплатная статья PMC: PMC6947286] [PubMed: 31847209]
Skinner DC. Переосмысление стебельчатого эффекта: новая гипотеза, объясняющая супраселлярную гиперпролактинемию, индуцированную опухолью. Мед Гипотезы. 2009 г. Март; 72 (3): 309-10. [Бесплатная статья PMC: PMC2668659] [PubMed: 1
Март; 72 (3): 309-10. [Бесплатная статья PMC: PMC2668659] [PubMed: 1
20]
Рей Р.А., Гринспон РП. Лечение андрогенами у подростков мужского пола с гипогонадизмом. Am J Mens Health. 2020 май-июнь;14(3):1557988320922443. [Бесплатная статья PMC: PMC7249582] [PubMed: 32448030]
Stancampiano MR, Lucas-Herald AK, Russo G, Rogol AD, Ahmed SF. Терапия тестостероном у мальчиков-подростков: необходимость структурированного подхода. Горм Рес Педиатр. 2019;92(4):215-228. [PubMed: 31851967]
Zitzmann M, Nieschlag E. Замещение гормонов при мужском гипогонадизме. Мол Селл Эндокринол. 2000 30 марта; 161 (1-2): 73-88. [PubMed: 10773395]
Вишванатан В., Югстер Э.А. Этиология и лечение гипогонадизма у подростков. Педиатр Клин Норт Ам. 2011 окт;58(5):1181-200, х. [Бесплатная статья PMC: PMC4102132] [PubMed: 21981955]
Casanueva FF, Molitch ME, Schlechte JA, Abs R, Bonert V, Bronstein MD, Brue T, Cappabianca P, Colao A, Fahlbusch R, Фиделефф Х.