2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
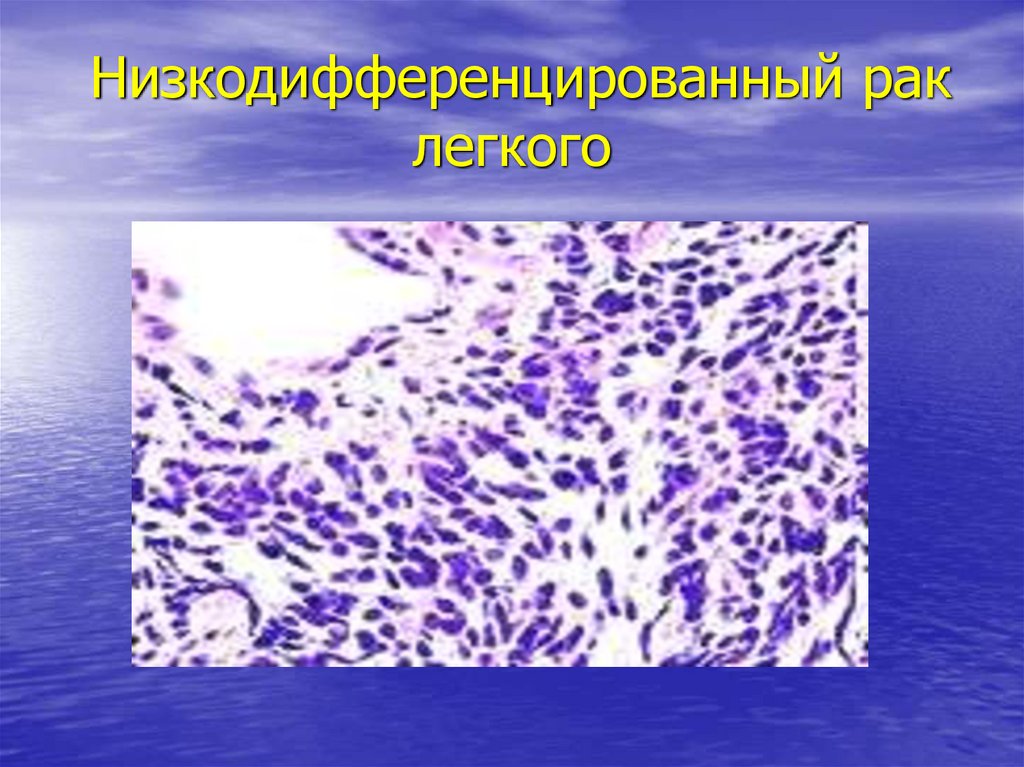
Злокачественные опухоли выглядят под микроскопом по-разному. В одних случаях они напоминают нормальную ткань, а в других сильно от неё отличаются. Часто пациенты слышал от онкологов такие словосочетания, как, например, «низкодифференцированная аденокарцинома» или «низкодифференцированный плоскоклеточный рак». Разберемся, что это означает – дифференцированный и недифференцированный рак.
В зависимости от этого, патологоанатомы и врачи условно делят злокачественные новообразования на два типа:
Иными словами, степень дифференцировки опухоли это то, насколько сильно ее ткань и отдельные клетки утратили черты нормальных.
От степени дифференцировки рака зависит то, насколько быстро он способен распространяться по организму. А это, в свою очередь, напрямую влияет на прогноз для пациента. Кроме того, низкодифференцированные опухоли хуже реагируют на лучевую терапию и химиотерапию. Врач-онколог учитывает это, составляя программу лечения.
Сами по себе термины «высокодифференцированная опухоль» и «низкодифференцированная опухоль» — достаточно общие и мало о чем говорят. Для более точной оценки врачи-онкологи выделяют 4 степени дифференцировки.
Часто от онкологических пациентов можно услышать еще один вопрос: «что означает G3 в онкологии?». Показатель степени дифференцировки опухоли принято обозначать латинской буквой G. Возможны пять вариантов:
 Такой диагноз может, например, звучать как «низкодифференцированная аденокарцинома G3».
Такой диагноз может, например, звучать как «низкодифференцированная аденокарцинома G3».Так выглядит общая схема, но для разных видов рака степень дифференцировки определяют по-разному. Например, во время осмотра под микроскопом опухолевой ткани из молочной железы учитывают наличие молочных канальцев, форму и размеры клеточных ядер, активность деления клеток. Каждый из трех признаков оценивают в баллах, затем подсчитывают их общее количество.
При раке простаты используют специальную систему Глисона. В ней предусмотрено 5 градаций, каждой из которых присвоено определенное количество баллов, в соответствии с нумерацией, от 1 до 5:
Обычно рак простаты имеет неоднородное строение, поэтому врач должен выбрать из списка две градации, которые встречаются в большей части опухоли. Складывают баллы, по полученной цифре определяют степень дифференцировки. Например, по результатам исследования может быть установлен диагноз «аденокарцинома низкодифференцированная».
Для описания злокачественной опухоли используют разные показатели. Деление в зависимости от степени дифференцировки — лишь одна из возможных классификаций.
Стадию рака определяют в зависимости от трех параметров, которые обозначают аббревиатурой TNM: насколько сильно опухоль проросла в соседние ткани, успела ли распространиться в лимфоузлы и дать метастазы.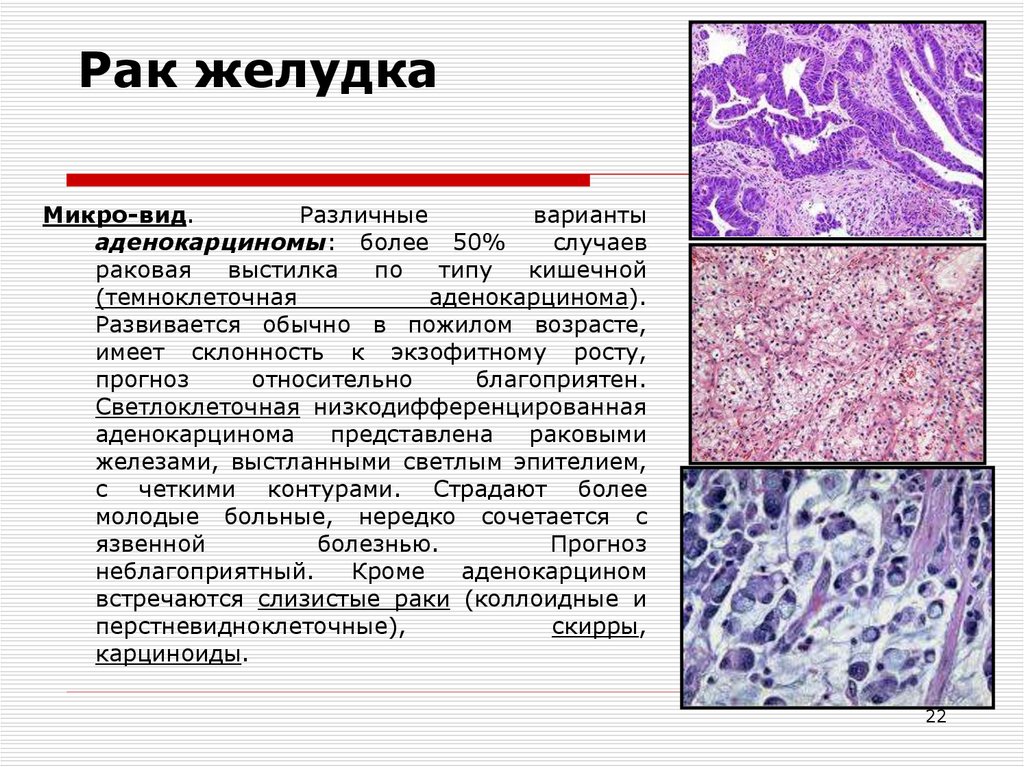
В настоящее время всё большее значение приобретает классификация опухолей в зависимости от их «молекулярного портрета», особенно на поздних стадиях.
Таким образом, например, низкодифференцированная карцинома желудка и карцинома желудка IV стадии – это совершенно разные понятия, они отражают разные особенности злокачественной опухоли.
Однозначно на этот вопрос ответить не получится, так как рак бывает очень разным. Для одних злокачественных опухолей (например, рак молочной железы, рак простаты) степень дифференцировки имеет особенно важное значение, в случаях с другими онкологическими заболеваниями данный показатель отходит на второй план.
В целом можно сказать, что низкодифференцированные опухоли более агрессивны и нуждаются в более агрессивном лечении.
При составлении плана лечения врач-онколог ориентируется на многие показатели: стадию рака, степень дифференцировки, вид и локализацию опухоли, её «молекулярный портрет», состояние здоровья и сопутствующие заболевания пациента. Ранняя диагностика сильно повышает шансы на успешное лечение, но даже в запущенных случаях всегда можно помочь, существенно продлить жизнь пациента. Поэтому при низкодифференцированном раке молочной железы прогноз не обязательно будет однозначно плохим, а при высокодифференцированном – однозначно хорошим. Важно учитывать многие факторы.
Ранняя диагностика сильно повышает шансы на успешное лечение, но даже в запущенных случаях всегда можно помочь, существенно продлить жизнь пациента. Поэтому при низкодифференцированном раке молочной железы прогноз не обязательно будет однозначно плохим, а при высокодифференцированном – однозначно хорошим. Важно учитывать многие факторы.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Абросимов А.Ю.
ФГУ Эндокринологический научный центр, Москва
Сидорин А.В.
Медицинский радиологический научный центр им. А.Ф. Цыба — ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Обнинск, Россия
Шинкаркина А.П.
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Низкодифференцированный рак щитовидной железы
Журнал: Архив патологии. 2014;76(2): 48‑54
2014;76(2): 48‑54
Как цитировать
Абросимов А.Ю., Сидорин А.В., Шинкаркина А.П. Низкодифференцированный рак щитовидной железы. Архив патологии. 2014;76(2):48‑54.
Abrosimov AIu, Sidorin AV, Shinkarkina AP. High-grade thyroid cancer. Arkhiv Patologii. 2014;76(2):48‑54. (In Russ.).
Авторы:
Абросимов А.Ю.
ФГУ Эндокринологический научный центр, Москва
Все авторы (3)
Читать метаданные
Представлен анализ данных литературы по вопросам морфологических и прогностических особенностей относительно редко встречающегося низкодифференцированного рака щитовидной железы. Показаны трудности и нерешенные вопросы морфологической диагностики, а также возможности современных методов иммуногистохимических исследований и молекулярной генетики в определении злокачественного потенциала опухоли и оценке прогноза.
Ключевые слова:
щитовидная железа
низкодифференцированный рак
морфология
иммуногистохимия
молекулярная генетика
прогноз
Авторы:
Абросимов А.Ю.
ФГУ Эндокринологический научный центр, Москва
Сидорин А.В.
Медицинский радиологический научный центр им. А.Ф. Цыба — ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России, Обнинск, Россия
Шинкаркина А.П.
Медицинский радиологический научный центр им. А.Ф. Цыба — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Обнинск, Россия
Закрыть метаданные
Низкодифференцированный рак щитовидной железы (НРЩЖ) - злокачественное новообразование фолликулярно-клеточного происхождения с ограниченными признаками структурной и функциональной дифференцировки, которое и морфологически, и клинически занимает промежуточное положение между дифференцированным (папиллярным и фолликулярным) и недифференцированным (анапластическим) раком. В соответствии с Международной классификацией опухолей эндокринных органов, различают три варианта гистологического строения НРЩЖ: инсулярный, трабекулярный и солидный [1]. НРЩЖ, как правило, имеет признаки распространенного инвазивного роста, включая сосудистую инвазию, повышенную митотическую активность клеток и очаги спонтанного коагуляционного некроза. По сравнению с предыдущим изданием гистологической классификации опухолей щитовидной железы [2], в которой инсулярная карцинома была лишь упомянута в разделе фолликулярного рака щитовидной железы (ФРЩЖ), в последнем издании НРЩЖ выделен в отдельную классификационную категорию. Частота НРЩЖ не превышает 4-7% всех злокачественных опухолей щитовидной железы [1]. Однако прогноз при НРЩЖ значительно хуже по сравнению с таковым при фолликулярном и папиллярном раке щитовидной железы (ПРЩЖ), что объясняет повышенное внимание к проблеме совершенствования его диагностики. После выхода в свет классификации 2004 г. [1] стало очевидно, что необходима разработка алгоритма морфологической диагностики НРЩЖ.
В соответствии с Международной классификацией опухолей эндокринных органов, различают три варианта гистологического строения НРЩЖ: инсулярный, трабекулярный и солидный [1]. НРЩЖ, как правило, имеет признаки распространенного инвазивного роста, включая сосудистую инвазию, повышенную митотическую активность клеток и очаги спонтанного коагуляционного некроза. По сравнению с предыдущим изданием гистологической классификации опухолей щитовидной железы [2], в которой инсулярная карцинома была лишь упомянута в разделе фолликулярного рака щитовидной железы (ФРЩЖ), в последнем издании НРЩЖ выделен в отдельную классификационную категорию. Частота НРЩЖ не превышает 4-7% всех злокачественных опухолей щитовидной железы [1]. Однако прогноз при НРЩЖ значительно хуже по сравнению с таковым при фолликулярном и папиллярном раке щитовидной железы (ПРЩЖ), что объясняет повышенное внимание к проблеме совершенствования его диагностики. После выхода в свет классификации 2004 г. [1] стало очевидно, что необходима разработка алгоритма морфологической диагностики НРЩЖ.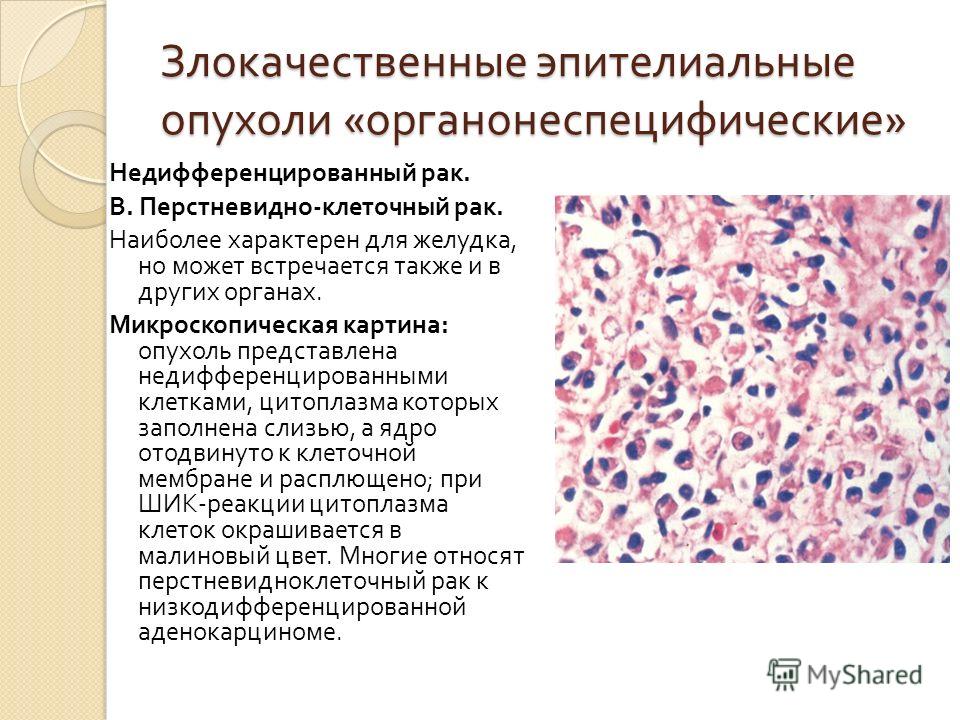 Это связано с тем, что разными авторами [3-6] используются не совсем одинаковые подходы к диагностике. Возникает закономерный вопрос, достаточно ли наличия хотя бы одного из трех структурных компонентов опухоли (инсулярного, трабекулярного и солидного) для установления диагноза НРЩЖ? Ответ очевиден - нет, так как по крайней мере трабекулярный и солидный типы роста могут встречаться в фолликулярной аденоме, гиалинизирующейся трабекулярной опухоли, ФРЩЖ, солидном варианте ПРЩЖ и др. Следовательно, в дифференциальной диагностике НРЩЖ с доброкачественными поражениями и высокодифференцированным раком щитовидной железы (РЩЖ) необходимо учитывать дополнительные критерии. Такие критерии были определены группой экспертов-патологов на рабочем совещании в Италии (Турин, 2006) и опубликованы в 2007 г. [7]. В соответствии с предложенным алгоритмом диагностики обозначена последовательность использования и диагностическая роль тех или иных морфологических, иммуногистохимических и молекулярно-генетических методов исследования.
Это связано с тем, что разными авторами [3-6] используются не совсем одинаковые подходы к диагностике. Возникает закономерный вопрос, достаточно ли наличия хотя бы одного из трех структурных компонентов опухоли (инсулярного, трабекулярного и солидного) для установления диагноза НРЩЖ? Ответ очевиден - нет, так как по крайней мере трабекулярный и солидный типы роста могут встречаться в фолликулярной аденоме, гиалинизирующейся трабекулярной опухоли, ФРЩЖ, солидном варианте ПРЩЖ и др. Следовательно, в дифференциальной диагностике НРЩЖ с доброкачественными поражениями и высокодифференцированным раком щитовидной железы (РЩЖ) необходимо учитывать дополнительные критерии. Такие критерии были определены группой экспертов-патологов на рабочем совещании в Италии (Турин, 2006) и опубликованы в 2007 г. [7]. В соответствии с предложенным алгоритмом диагностики обозначена последовательность использования и диагностическая роль тех или иных морфологических, иммуногистохимических и молекулярно-генетических методов исследования. В настоящей работе проведен анализ данных литературы, касающейся истории вопроса, проблем диагностики, значимости морфологических, иммуногистохимических, молекулярно-биологических критериев, оценки прогноза, а также ретроспективный анализ собственных наблюдений НРЩЖ.
В настоящей работе проведен анализ данных литературы, касающейся истории вопроса, проблем диагностики, значимости морфологических, иммуногистохимических, молекулярно-биологических критериев, оценки прогноза, а также ретроспективный анализ собственных наблюдений НРЩЖ.
История изучения НРЩЖ
В 1983 г. А. Sakamoto и соавт. [8], изучив гистологический тип злокачественных опухолей щитовидной железы и выживаемость 258 пациентов, предложили выделить группу НРЩЖ солидного, трабекулярного и/или скиррозного строения, отличающуюся от высокодифференцированного РЩЖ менее благоприятным прогнозом. В 1984 г. М. Carcangiu и соавт. [9] опубликовали свои наблюдения 25 случаев НРЩЖ с характерными микроскопическими особенностями, заключающимися в формировании различного размера хорошо очерченных гнезд или островков опухолевых клеток, что дало основание для использования термина «инсулярный РЩЖ». В гистологических препаратах островки инсулярного рака обычно разделены между собой тонкими фиброваскулярными прослойками и искусственными щелевидными пространствами вследствие дегидратации ткани. Полагают [9], что именно данный тип новообразований был описан Langhans в 1907 г. под названием «wuchernde struma» («пролиферирующий зоб»). Случаи инсулярного РЩЖ были представлены S. Flynn и соавт. [10] (как разновидности агрессивного варианта дифференцированного РЩЖ), а также С. Bal и соавт. [11] (как разновидности анапластического рака с менее агрессивным клиническим течением). Включение в группу НРЩЖ рака из столбчатых клеток [12, 13] нельзя признать оправданным, так как РЩЖ из высоких и столбчатых клеток - это гистологические разновидности папиллярного рака. Некоторые авторы [14] предлагали относить рак из столбчатых клеток к низкодифференцированному ПРЩЖ. Было замечено [15], что наряду с участками НРЩЖ в отдельных опухолях могут присутствовать солидные и трабекулярные структуры с повышенной митотической активностью опухолевых клеток и очагами некроза. Клетки таких опухолей характеризуются более крупным размером по сравнению с инсулярным раком. Категория НРЩЖ стала еще более гетерогенной после включения в нее опухолей с очаговыми изменениями ядер, характерными для ПРЩЖ, опухолей с участками ФРЩЖ и рака из оксифильных клеток.
Полагают [9], что именно данный тип новообразований был описан Langhans в 1907 г. под названием «wuchernde struma» («пролиферирующий зоб»). Случаи инсулярного РЩЖ были представлены S. Flynn и соавт. [10] (как разновидности агрессивного варианта дифференцированного РЩЖ), а также С. Bal и соавт. [11] (как разновидности анапластического рака с менее агрессивным клиническим течением). Включение в группу НРЩЖ рака из столбчатых клеток [12, 13] нельзя признать оправданным, так как РЩЖ из высоких и столбчатых клеток - это гистологические разновидности папиллярного рака. Некоторые авторы [14] предлагали относить рак из столбчатых клеток к низкодифференцированному ПРЩЖ. Было замечено [15], что наряду с участками НРЩЖ в отдельных опухолях могут присутствовать солидные и трабекулярные структуры с повышенной митотической активностью опухолевых клеток и очагами некроза. Клетки таких опухолей характеризуются более крупным размером по сравнению с инсулярным раком. Категория НРЩЖ стала еще более гетерогенной после включения в нее опухолей с очаговыми изменениями ядер, характерными для ПРЩЖ, опухолей с участками ФРЩЖ и рака из оксифильных клеток.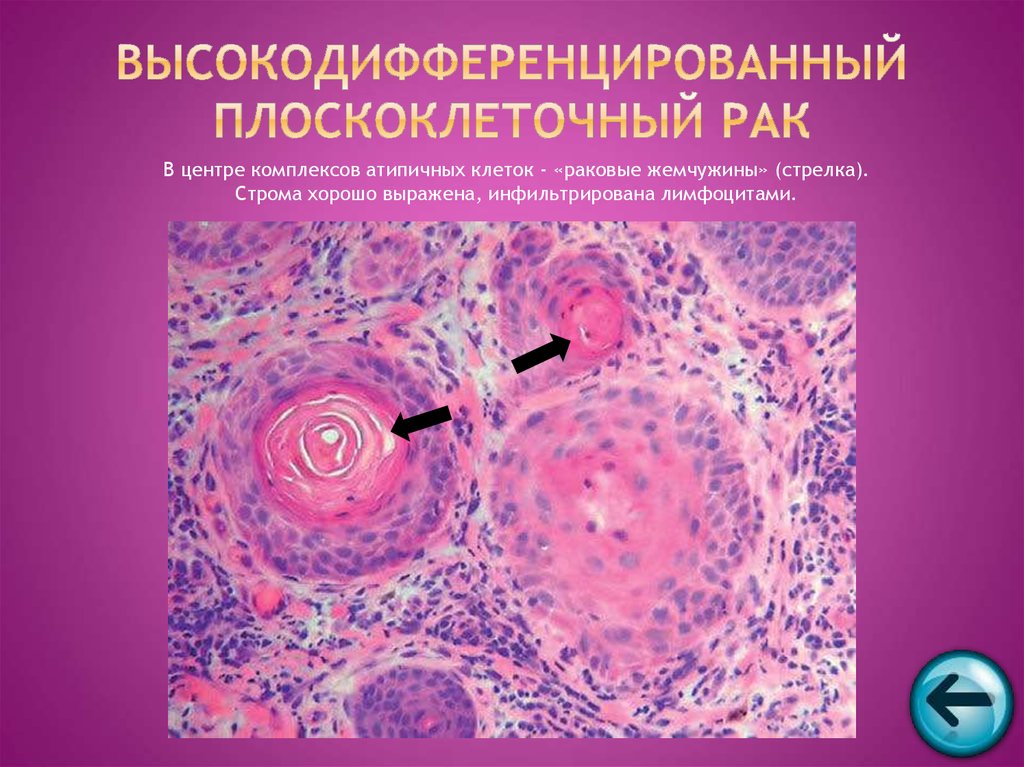 В 1996 г. М. Papotti и соавт. [16] представили анализ 60 случаев низкодифференцированных оксифильных (Гюртле-клеточных) карцином щитовидной железы. В 1999 г. Е. Nishida и соавт. [17], изучив 303 случая дифференцированного РЩЖ, установили, что в 102 случаях присутствовал низкодифференцированный компонент либо фокально (занимал менее 10% площади гистологического среза), либо диффузно (более 10%). Предложение относить в группу НРЩЖ опухоли с пограничным значением распространенности низкодифференцированного компонента, превышающим 10%, не нашло поддержки [18]. Это было связано с отсутствием общепринятых критериев диагностики НРЩЖ (в основу одного подхода положен гистологический тип роста опухоли, а в основу другого - степень злокачественности, grade). Что касается классификации по преобладающему структурному компоненту, то было рекомендовано использовать уровень распространенности, превышающий 75% площади гистологических срезов, для выделения отдельного гистологического подтипа опухоли [19].
В 1996 г. М. Papotti и соавт. [16] представили анализ 60 случаев низкодифференцированных оксифильных (Гюртле-клеточных) карцином щитовидной железы. В 1999 г. Е. Nishida и соавт. [17], изучив 303 случая дифференцированного РЩЖ, установили, что в 102 случаях присутствовал низкодифференцированный компонент либо фокально (занимал менее 10% площади гистологического среза), либо диффузно (более 10%). Предложение относить в группу НРЩЖ опухоли с пограничным значением распространенности низкодифференцированного компонента, превышающим 10%, не нашло поддержки [18]. Это было связано с отсутствием общепринятых критериев диагностики НРЩЖ (в основу одного подхода положен гистологический тип роста опухоли, а в основу другого - степень злокачественности, grade). Что касается классификации по преобладающему структурному компоненту, то было рекомендовано использовать уровень распространенности, превышающий 75% площади гистологических срезов, для выделения отдельного гистологического подтипа опухоли [19]. В качестве критериев степени злокачественности опухоли (grade), например ПРЩЖ, L. Akslen и V. LiVolsi [19] предложили использовать выраженную атипию ядер опухолевых клеток, митотическую активность, наличие некроза опухоли и сосудистой инвазии, так как они имеют более существенное прогностическое значение, нежели установление гистологического варианта ПРЩЖ [19]. Публикация L. Akslen и V. LiVolsi вызвала интерес среди патологов и обсуждение прогностической значимости различных характеристик РЩЖ [20]. Дальнейшие крупные вехи в изучении НРЩЖ связаны с выходом в свет Международной классификации опухолей эндокринных органов [1] и рабочим совещанием экспертов-патологов в Турине (Италия), нацеленными на уточнение и унификацию диагностических критериев НРЩЖ [7].
В качестве критериев степени злокачественности опухоли (grade), например ПРЩЖ, L. Akslen и V. LiVolsi [19] предложили использовать выраженную атипию ядер опухолевых клеток, митотическую активность, наличие некроза опухоли и сосудистой инвазии, так как они имеют более существенное прогностическое значение, нежели установление гистологического варианта ПРЩЖ [19]. Публикация L. Akslen и V. LiVolsi вызвала интерес среди патологов и обсуждение прогностической значимости различных характеристик РЩЖ [20]. Дальнейшие крупные вехи в изучении НРЩЖ связаны с выходом в свет Международной классификации опухолей эндокринных органов [1] и рабочим совещанием экспертов-патологов в Турине (Италия), нацеленными на уточнение и унификацию диагностических критериев НРЩЖ [7].
Диагностика и дифференциальная диагностика
За 30 лет, прошедших с момента публикаций А. Sakamoto и соавт. [8] и М. Cancangiu и соавт. [9], менялись определения, терминология и критерии диагностики НРЩЖ. Следует подчеркнуть, что клинические признаки, позволяющие точно установить диагноз НРЩЖ, отсутствуют. Лишь морфологические методы исследования, а в последние годы и иммуногистохимические, и молекулярно-генетические технологии помогают в диагностике [21]. Первые описания НРЩЖ были даны сходным по своим характеристикам опухолям, при этом диагностические критерии несколько отличались. Эти различия сохраняются до сих пор, так как некоторые авторы определяют НРЩЖ особой архитектурой опухолей (инсулярное, трабекулярное и солидное строение), а другие - наличием гистологических и цитологических признаков агрессивности их биологического поведения (некроз, митотическая активность, сосудистая инвазия) [21]. По-видимому, здесь нет необходимости в перечислении всех ранее предлагавшихся критериев морфологической диагностики. Остановимся лишь на критериях, разработанных на совещании в Турине, а также на возникающих диагностических и дифференциально-диагностических проблемах [22]. Предложенный алгоритм диагностики НРЩЖ предполагает, во-первых, признание злокачественности опухоли, имеющей фолликулярно-клеточное происхождение.
Следует подчеркнуть, что клинические признаки, позволяющие точно установить диагноз НРЩЖ, отсутствуют. Лишь морфологические методы исследования, а в последние годы и иммуногистохимические, и молекулярно-генетические технологии помогают в диагностике [21]. Первые описания НРЩЖ были даны сходным по своим характеристикам опухолям, при этом диагностические критерии несколько отличались. Эти различия сохраняются до сих пор, так как некоторые авторы определяют НРЩЖ особой архитектурой опухолей (инсулярное, трабекулярное и солидное строение), а другие - наличием гистологических и цитологических признаков агрессивности их биологического поведения (некроз, митотическая активность, сосудистая инвазия) [21]. По-видимому, здесь нет необходимости в перечислении всех ранее предлагавшихся критериев морфологической диагностики. Остановимся лишь на критериях, разработанных на совещании в Турине, а также на возникающих диагностических и дифференциально-диагностических проблемах [22]. Предложенный алгоритм диагностики НРЩЖ предполагает, во-первых, признание злокачественности опухоли, имеющей фолликулярно-клеточное происхождение.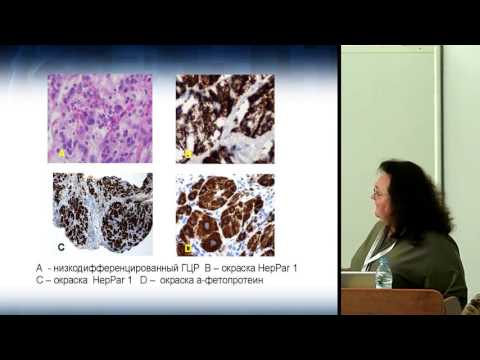 Во-вторых, НРЩЖ должен иметь инсулярное, трабекулярное и/или солидное строение (в противном случае следует диагностировать ФРЩЖ или ПРЩЖ). В-третьих, в НРЩЖ должны отсутствовать изменения ядер опухолевых клеток, характерные для ПРЩЖ. В противном случае опухоли солидного строения с наличием изменений ядер представляют солидный вариант ПРЩЖ [23]. В-четвертых, в НРЩЖ должен быть обнаружен хотя бы один из следующих признаков: конволютные ядра, некроз, митотическая активность, превышающая 3 фигуры митоза в 10 полях зрения при большом увеличении микроскопа. В противном случае опухоли солидного строения без указанных признаков следует классифицировать как ФРЩЖ солидного строения. НРЩЖ может встречаться в «чистом» виде, а также в сочетании с ПРЩЖ или другими типами рака фолликулярно-клеточного происхождения, содержать клетки с конволютными или круглыми ядрами [22]. Проблемы диагностики, несмотря на простоту схемы, связаны, во-первых, с трудностями установления злокачественности, так как не определены критерии этой злокачественности.
Во-вторых, НРЩЖ должен иметь инсулярное, трабекулярное и/или солидное строение (в противном случае следует диагностировать ФРЩЖ или ПРЩЖ). В-третьих, в НРЩЖ должны отсутствовать изменения ядер опухолевых клеток, характерные для ПРЩЖ. В противном случае опухоли солидного строения с наличием изменений ядер представляют солидный вариант ПРЩЖ [23]. В-четвертых, в НРЩЖ должен быть обнаружен хотя бы один из следующих признаков: конволютные ядра, некроз, митотическая активность, превышающая 3 фигуры митоза в 10 полях зрения при большом увеличении микроскопа. В противном случае опухоли солидного строения без указанных признаков следует классифицировать как ФРЩЖ солидного строения. НРЩЖ может встречаться в «чистом» виде, а также в сочетании с ПРЩЖ или другими типами рака фолликулярно-клеточного происхождения, содержать клетки с конволютными или круглыми ядрами [22]. Проблемы диагностики, несмотря на простоту схемы, связаны, во-первых, с трудностями установления злокачественности, так как не определены критерии этой злокачественности. Во-вторых, в схеме не учтена возможность наличия собственной капсулы опухоли, что вызывает трудности в проведении дифференциальной диагностики между инкапсулированным НРЩЖ и атипической аденомой (фолликулярным новообразованием неопределенного злокачественного потенциала). В-третьих, возможна субъективная оценка наличия конволютных ядер при отсутствии повышенной митотической активности или очагов коагуляционного некроза. В-четвертых, из предложенного алгоритма не понятно, как следует классифицировать опухоли, имеющие размер первичной опухоли, не превышающий 1 см (микрокарцинома?) [22]. В предложенном алгоритме диагностики не уделено внимания клеточному составу опухоли. Ранее было показано [1, 16, 24, 25], что НРЩЖ может содержать оксифильные и светлые опухолевые клетки. Остался нерешенным вопрос о пограничном уровне распространенности низкодифференцированного компонента, достаточного для классификации его как НРЩЖ [21, 26-28].
Во-вторых, в схеме не учтена возможность наличия собственной капсулы опухоли, что вызывает трудности в проведении дифференциальной диагностики между инкапсулированным НРЩЖ и атипической аденомой (фолликулярным новообразованием неопределенного злокачественного потенциала). В-третьих, возможна субъективная оценка наличия конволютных ядер при отсутствии повышенной митотической активности или очагов коагуляционного некроза. В-четвертых, из предложенного алгоритма не понятно, как следует классифицировать опухоли, имеющие размер первичной опухоли, не превышающий 1 см (микрокарцинома?) [22]. В предложенном алгоритме диагностики не уделено внимания клеточному составу опухоли. Ранее было показано [1, 16, 24, 25], что НРЩЖ может содержать оксифильные и светлые опухолевые клетки. Остался нерешенным вопрос о пограничном уровне распространенности низкодифференцированного компонента, достаточного для классификации его как НРЩЖ [21, 26-28].
Гистологические типы НРЩЖ
В классических случаях НРЩЖ имеет гистологический тип инсулярного рака [21, 29-32].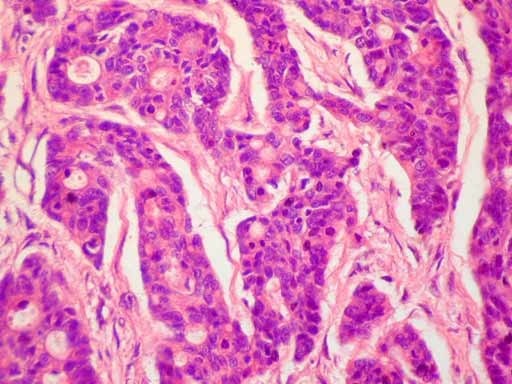 Однако «чистая» инсулярная карцинома встречается крайне редко, чаще обнаруживают инсулярноподобную карциному, демонстрирующую наряду с инсулярной трабекулярную и солидную картину роста [21, 30, 33]. В нашей серии из ретроспективно изученных 14 случаев НРЩЖ инсулярная карцинома, характеризовавшаяся гнездами и островками опухолевых клеток с круглыми и конволютными ядрами, диагностирована лишь в одном случае (рис. 1).Рисунок 1. Инсулярный (а), трабекулярный (в, г) и солидный (б, д, е) типы низкодифференцированного рака щитовидной железы. а - гнезда опухолевых клеток, разделенные фиброваскулярными прослойками; б - мономорфные опухолевые клетки с просветленными ядрами и заметными ядрышками; в - лентовидные структуры опухоли; г - клетки трабекулярной опухоли с фигурами митоза; д - солидные участки опухоли из мелких мономорфных клеток; е - очаг некроза (верхняя часть рисунка) опухоли солидного строения. а-е - окраска гематоксилином и эозином. а, в, д - ×200; б, г, е - ×400. Наиболее часто встречался солидный тип опухолевого роста, участки которого чередовались с очагами трабекулярного и микрофолликулярного строения.
Однако «чистая» инсулярная карцинома встречается крайне редко, чаще обнаруживают инсулярноподобную карциному, демонстрирующую наряду с инсулярной трабекулярную и солидную картину роста [21, 30, 33]. В нашей серии из ретроспективно изученных 14 случаев НРЩЖ инсулярная карцинома, характеризовавшаяся гнездами и островками опухолевых клеток с круглыми и конволютными ядрами, диагностирована лишь в одном случае (рис. 1).Рисунок 1. Инсулярный (а), трабекулярный (в, г) и солидный (б, д, е) типы низкодифференцированного рака щитовидной железы. а - гнезда опухолевых клеток, разделенные фиброваскулярными прослойками; б - мономорфные опухолевые клетки с просветленными ядрами и заметными ядрышками; в - лентовидные структуры опухоли; г - клетки трабекулярной опухоли с фигурами митоза; д - солидные участки опухоли из мелких мономорфных клеток; е - очаг некроза (верхняя часть рисунка) опухоли солидного строения. а-е - окраска гематоксилином и эозином. а, в, д - ×200; б, г, е - ×400. Наиболее часто встречался солидный тип опухолевого роста, участки которого чередовались с очагами трабекулярного и микрофолликулярного строения. Собственная капсула отсутствовала в 12 случаях, а в 2 остальных опухоли были частично инкапсулированными. Очаги коагуляционного некроза встречались более чем в половине случаев (8). Фигуры митоза, включая их патологические формы, были обнаружены в участках солидного и трабекулярного строения (см. рис. 1). Признаки инвазивного роста в окружающую ткань щитовидной железы и просветы кровеносных сосудов были зарегистрированы в 14 и 7 случаев соответственно. Инвазия за пределы капсулы щитовидной железы в прилежащие скелетные мышцы отмечена в одном случае. Заслуживает внимания тот факт, что оксифилия цитоплазмы опухолевых клеток была обнаружена в одном случае, еще в одном обнаружены участки опухолевых клеток со светлой цитоплазмой. Признаки внутрижелезистой диссеминации опухоли из светлых клеток напоминали метастазы рака иной локализации в щитовидной железе. Однако результаты иммуногистохимического исследования позволили установить фолликулярно-клеточное происхождение опухоли. В двух наблюдениях были обнаружены признаки предсуществующего ПРЩЖ (небольшие очаги из фолликулярных и сосочковых структур с характерными для ПРЩЖ изменениями ядер опухолевых клеток).
Собственная капсула отсутствовала в 12 случаях, а в 2 остальных опухоли были частично инкапсулированными. Очаги коагуляционного некроза встречались более чем в половине случаев (8). Фигуры митоза, включая их патологические формы, были обнаружены в участках солидного и трабекулярного строения (см. рис. 1). Признаки инвазивного роста в окружающую ткань щитовидной железы и просветы кровеносных сосудов были зарегистрированы в 14 и 7 случаев соответственно. Инвазия за пределы капсулы щитовидной железы в прилежащие скелетные мышцы отмечена в одном случае. Заслуживает внимания тот факт, что оксифилия цитоплазмы опухолевых клеток была обнаружена в одном случае, еще в одном обнаружены участки опухолевых клеток со светлой цитоплазмой. Признаки внутрижелезистой диссеминации опухоли из светлых клеток напоминали метастазы рака иной локализации в щитовидной железе. Однако результаты иммуногистохимического исследования позволили установить фолликулярно-клеточное происхождение опухоли. В двух наблюдениях были обнаружены признаки предсуществующего ПРЩЖ (небольшие очаги из фолликулярных и сосочковых структур с характерными для ПРЩЖ изменениями ядер опухолевых клеток)..jpg) Очаги сосочкового строения в одной из этих опухолей с единичными псаммомными тельцами обнаружены среди обширных участков инсулярного и микрофолликулярного строения, а также крупных разрозненно расположенных и групп клеток анапластического рака. Низкодифференцированный компонент рака занимал более 70% площади гистологических срезов. Возможность сочетания в пределах одной опухоли участков высоко- и низкодифференцированного, а также клеток недифференцированного (анапластического) рака была ранее установлена [34].
Очаги сосочкового строения в одной из этих опухолей с единичными псаммомными тельцами обнаружены среди обширных участков инсулярного и микрофолликулярного строения, а также крупных разрозненно расположенных и групп клеток анапластического рака. Низкодифференцированный компонент рака занимал более 70% площади гистологических срезов. Возможность сочетания в пределах одной опухоли участков высоко- и низкодифференцированного, а также клеток недифференцированного (анапластического) рака была ранее установлена [34].
Иммуногистохимическая характеристика НРЩЖ
Использование иммуногистохимического метода в диагностике НРЩЖ обосновано по следующим причинам. Во-первых, для исключения С-клеточного (медуллярного рака) и других карцином нейроэндокринной природы необходимо проведение реакций с антителами к кальцитонину, хромогранину А, синаптофизину. Во-вторых, для исключения метастазов рака иной локализации, например почечно-клеточного рака или прорастания рака околощитовидной железы, можно использовать реакции с антителами к CD10, RCC и гормону околощитовидной железы соответственно. В-третьих, для исключения лимфопролиферативного поражения щитовидной железы рекомендуют использовать реакции на В-лимфоцитарные маркеры клеточной дифференцировки (CD19, CD20) и плазматические клетки (CD138). В-четвертых, для подтверждения эпителиального и фолликулярно-клеточного происхождения НРЩЖ возможно использование реакций с антителами к цитокератинам широкого спектра, тиреоглобулину, TTF-1 - тиреоидному транскрипционному фактору 1 (рис. 2).Рисунок 2. Инсулярный (а), трабекулярный (в, г) и солидный (б, д, е) типы низкодифференцированного рака щитовидной железы. а - гнезда опухолевых клеток, разделенные фиброваскулярными прослойками; б - мономорфные опухолевые клетки с просветленными ядрами и заметными ядрышками; в - лентовидные структуры опухоли; г - клетки трабекулярной опухоли с фигурами митоза; д - солидные участки опухоли из мелких мономорфных клеток; е - очаг некроза (верхняя часть рисунка) опухоли солидного строения. а-е - окраска гематоксилином и эозином. а, в, д - ×200; б, г, е - ×400.
В-третьих, для исключения лимфопролиферативного поражения щитовидной железы рекомендуют использовать реакции на В-лимфоцитарные маркеры клеточной дифференцировки (CD19, CD20) и плазматические клетки (CD138). В-четвертых, для подтверждения эпителиального и фолликулярно-клеточного происхождения НРЩЖ возможно использование реакций с антителами к цитокератинам широкого спектра, тиреоглобулину, TTF-1 - тиреоидному транскрипционному фактору 1 (рис. 2).Рисунок 2. Инсулярный (а), трабекулярный (в, г) и солидный (б, д, е) типы низкодифференцированного рака щитовидной железы. а - гнезда опухолевых клеток, разделенные фиброваскулярными прослойками; б - мономорфные опухолевые клетки с просветленными ядрами и заметными ядрышками; в - лентовидные структуры опухоли; г - клетки трабекулярной опухоли с фигурами митоза; д - солидные участки опухоли из мелких мономорфных клеток; е - очаг некроза (верхняя часть рисунка) опухоли солидного строения. а-е - окраска гематоксилином и эозином. а, в, д - ×200; б, г, е - ×400. В-пятых, для уточнения уровня пролиферативной активности опухолевых клеток и других характеристик опухолевых клеток НРЩЖ рекомендуют использовать реакции к Ki-67, циклину D1, p53, HBME-1, галектину-3, CD44v6, Bcl-2. В нашей серии из 14 случаев НРЩЖ все опухоли были иммунопозитивны в реакциях к тиреоглобулину, TTF-1, а также цитокератинам AE1/AE3 и виментину. Экспрессия Ki-67 обнаружена в 10-30% клеток. Отдельные ядра опухолевых клеток в участке недифференцированного рака, возникшего в НРЩЖ с остатками ПРЩЖ, также были p53-позитивными (см. рис. 2). Несомненно, перечисленные реакции в отдельности не позволяют с уверенностью дифференцировать высокодифференцированный РЩЖ и НРЩЖ, но некоторые из предложенных иммуногистохимических маркеров заслуживают особого внимания. Как было установлено А. Rocha и соавт. [35], клетки НРЩЖ, в отличие от высокодифференцированного рака, демонстрируют гетерогенную потерю экспрессии E-кадгерина при сохранении экспрессии катенинов. Тем не менее мутации гена, кодирующего β-катенин, участвующего в передаче внутриклеточного сигнала в WNT-сигнальном каскаде, в целом обнаружены чаще (до 30%) по сравнению с высокодифференцированным раком [1, 35, 36].
В-пятых, для уточнения уровня пролиферативной активности опухолевых клеток и других характеристик опухолевых клеток НРЩЖ рекомендуют использовать реакции к Ki-67, циклину D1, p53, HBME-1, галектину-3, CD44v6, Bcl-2. В нашей серии из 14 случаев НРЩЖ все опухоли были иммунопозитивны в реакциях к тиреоглобулину, TTF-1, а также цитокератинам AE1/AE3 и виментину. Экспрессия Ki-67 обнаружена в 10-30% клеток. Отдельные ядра опухолевых клеток в участке недифференцированного рака, возникшего в НРЩЖ с остатками ПРЩЖ, также были p53-позитивными (см. рис. 2). Несомненно, перечисленные реакции в отдельности не позволяют с уверенностью дифференцировать высокодифференцированный РЩЖ и НРЩЖ, но некоторые из предложенных иммуногистохимических маркеров заслуживают особого внимания. Как было установлено А. Rocha и соавт. [35], клетки НРЩЖ, в отличие от высокодифференцированного рака, демонстрируют гетерогенную потерю экспрессии E-кадгерина при сохранении экспрессии катенинов. Тем не менее мутации гена, кодирующего β-катенин, участвующего в передаче внутриклеточного сигнала в WNT-сигнальном каскаде, в целом обнаружены чаще (до 30%) по сравнению с высокодифференцированным раком [1, 35, 36].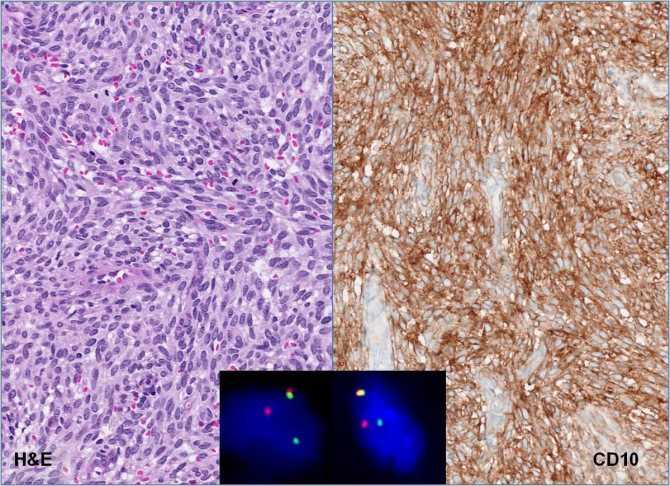 В последние годы возлагают надежды на то, что экспрессия IMP3 (mRNA-связывающего протеина-3 инсулиноподобного ростового фактора II) может служить не только диагностическим критерием, но и маркером неблагоприятного прогноза при НРЩЖ [37].
В последние годы возлагают надежды на то, что экспрессия IMP3 (mRNA-связывающего протеина-3 инсулиноподобного ростового фактора II) может служить не только диагностическим критерием, но и маркером неблагоприятного прогноза при НРЩЖ [37].
Молекулярно-генетические особенности и механизмы развития НРЩЖ
Полученные в настоящее время результаты изучения молекулярно-генетических нарушений в клетках НРЩЖ позволяют глубже раскрыть особенности канцерогенеза и способствуют разработке таргетной терапии. Молекулярные исследования подтверждают представления о том, что НРЩЖ может возникать de novo из предсуществующих ПРЩЖ или ФРЩЖ и утрачивать признаки фолликулярно-клеточной дифференцировки, трансформируясь в недифференцированный (анапластический) рак [21].
Предшествующими молекулярно-генетическими исследованиями установлен ряд соматических генных мутаций (RAS, BRAF, TP53) и хромосомных транслокаций с образованием перестроек RET/PTC, PAX8/PPARγ в высокодифференцированных карциномах фолликулярно-клеточного происхождения. Точковые мутации RAS (чаще HRAS в кодонах 12 и 61 и NRAS в кодоне 13) и BRAF (чаще в кодоне 600) или перестройки RET/PTC вследствие парацентрической инверсии 10-й хромосомы или реципрокной транслокации между 10-й и 17-й хромосомой приводят к активации MAP-киназного каскада. По сравнению с BRAF активирующие мутации генов семейства RAS могут участвовать не только в запуске MAP-киназного каскада, но и PI3K/AKT (фосфатидилинозитол-3-киназного) сигнального пути. Перестройки PAX8/PPARγ вследствие хромосомных транслокаций (2;3)/(q13; p25) являются результатом слияния гена фактора транскрипции PAX8 и гена рецептора γ, активируемого пролифератором пероксисом, ассоциированы с клетками ФРЩЖ. Нарушения гена TP53 (точковые мутации в кодоне 273) приводят к инактивации P53, они редко ассоциированы с высокодифференцированным РЩЖ, но распространены в клетках НРЩЖ и анапластического рака. Клетки ПРЩЖ, его классического, Уортиноподобного, онкоцитарного и особенно варианта из высоких клеток имеют мутации BRAF, реже - RAS онкогена.
Точковые мутации RAS (чаще HRAS в кодонах 12 и 61 и NRAS в кодоне 13) и BRAF (чаще в кодоне 600) или перестройки RET/PTC вследствие парацентрической инверсии 10-й хромосомы или реципрокной транслокации между 10-й и 17-й хромосомой приводят к активации MAP-киназного каскада. По сравнению с BRAF активирующие мутации генов семейства RAS могут участвовать не только в запуске MAP-киназного каскада, но и PI3K/AKT (фосфатидилинозитол-3-киназного) сигнального пути. Перестройки PAX8/PPARγ вследствие хромосомных транслокаций (2;3)/(q13; p25) являются результатом слияния гена фактора транскрипции PAX8 и гена рецептора γ, активируемого пролифератором пероксисом, ассоциированы с клетками ФРЩЖ. Нарушения гена TP53 (точковые мутации в кодоне 273) приводят к инактивации P53, они редко ассоциированы с высокодифференцированным РЩЖ, но распространены в клетках НРЩЖ и анапластического рака. Клетки ПРЩЖ, его классического, Уортиноподобного, онкоцитарного и особенно варианта из высоких клеток имеют мутации BRAF, реже - RAS онкогена. Для классического и солидно-фолликулярного вариантов ПРЩЖ характерны перестройки RET/PTC1 и RET/PTC3. В клетках ФРЩЖ выявлены мутации RAS или транслокации PAX8/PPARγ. Кроме вышеперечисленных молекулярно-генетических нарушений, в клетках НРЩЖ выявляют дополнительные мутации TP53 и гена, кодирующего β-катенин. Возможная цепочка молекулярных нарушений, лежащая в основе развития НРЩЖ, схематично представлена на рис. 3.Рисунок 3. Молекулярно-генетические механизмы развития низкодифференцированного рака щитовидной железы. Мутации гена BRAF определяют в 30-45% случаев ПРЩЖ, а также в среднем в 15% НРЩЖ. Мутации RAS установлены в 40-50% ФРЩЖ и в среднем в 35% НРЩЖ. Высказано предположение [38], что группа НРЩЖ, сформированная в строгом соответствии с критериями, принятыми на совещании в Турине, представляется достаточно гомогенной (не обнаружено мутаций KRAS, а также транслокаций, приводящих к образованию химерных генов RET/PTC и PAX8/PPARγ). Высокая частота мутаций NRAS и HRAS (23%) может свидетельствовать о причастности данного типа молекулярных нарушений к развитию НРЩЖ и определять неблагоприятный прогноз.
Для классического и солидно-фолликулярного вариантов ПРЩЖ характерны перестройки RET/PTC1 и RET/PTC3. В клетках ФРЩЖ выявлены мутации RAS или транслокации PAX8/PPARγ. Кроме вышеперечисленных молекулярно-генетических нарушений, в клетках НРЩЖ выявляют дополнительные мутации TP53 и гена, кодирующего β-катенин. Возможная цепочка молекулярных нарушений, лежащая в основе развития НРЩЖ, схематично представлена на рис. 3.Рисунок 3. Молекулярно-генетические механизмы развития низкодифференцированного рака щитовидной железы. Мутации гена BRAF определяют в 30-45% случаев ПРЩЖ, а также в среднем в 15% НРЩЖ. Мутации RAS установлены в 40-50% ФРЩЖ и в среднем в 35% НРЩЖ. Высказано предположение [38], что группа НРЩЖ, сформированная в строгом соответствии с критериями, принятыми на совещании в Турине, представляется достаточно гомогенной (не обнаружено мутаций KRAS, а также транслокаций, приводящих к образованию химерных генов RET/PTC и PAX8/PPARγ). Высокая частота мутаций NRAS и HRAS (23%) может свидетельствовать о причастности данного типа молекулярных нарушений к развитию НРЩЖ и определять неблагоприятный прогноз.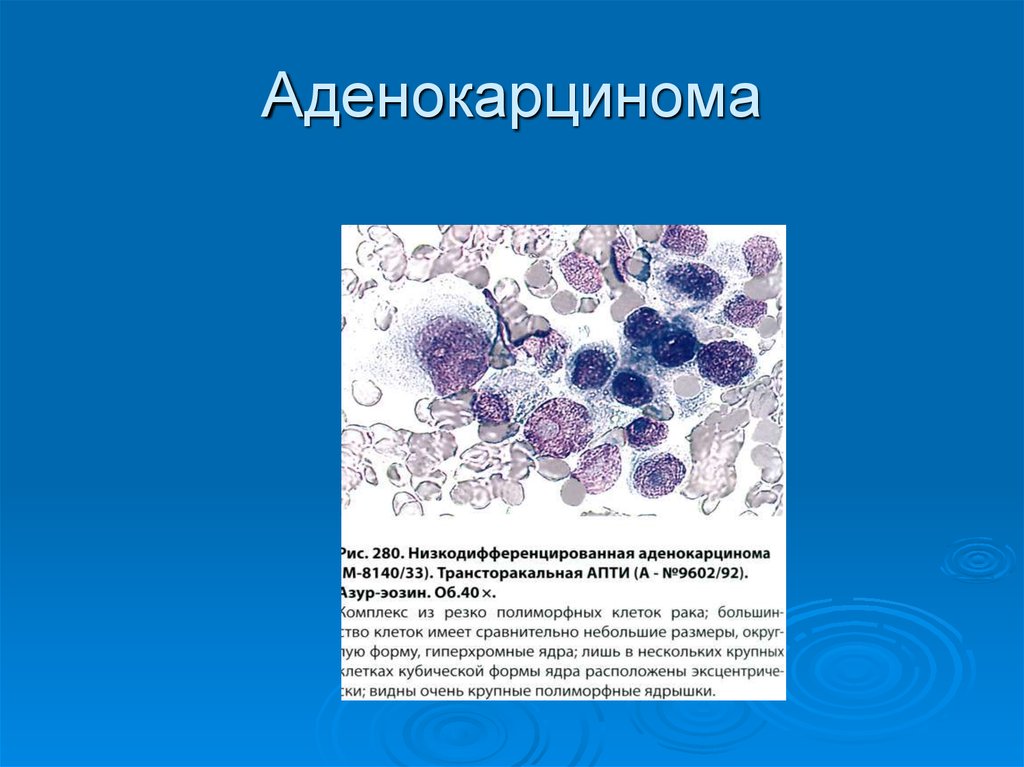 Полагают [31], что снижение дифференцировки опухоли не является следствием лишь мутаций RAS, которые с высокой частотой встречаются в высокодифференцированных РЩЖ и фолликулярных аденомах, а связано с комплексом генетических нарушений.
Полагают [31], что снижение дифференцировки опухоли не является следствием лишь мутаций RAS, которые с высокой частотой встречаются в высокодифференцированных РЩЖ и фолликулярных аденомах, а связано с комплексом генетических нарушений.
Прогноз
Сведения о местных рецидивах НРЩЖ и отдаленных метастазах, а также смертельных исходах от заболевания были представлены в литературе при описании отдельных случаев [39]. Проведенный однофакторный и многофакторный статистический анализ [29] показал прогностическую значимость возраста пациентов, наличия некроза опухоли и митотической активности опухолевых клеток НРЩЖ. Были выделены 3 подгруппы в зависимости от результатов 5- и 10-летней выживаемости пациентов с НРЩЖ: с прогнозом, аналогичным при высокодифференцированном РЩЖ; при недифференцированном раке; показателями выживаемости, пограничными между высокодифференцированным и недифференцированным РЩЖ. Было установлено [40] снижение безрецидивной выживаемости пациентов с НРЩЖ по сравнению с высокодифференцированным РЩЖ. Показатели 10-летней безрецидивной и общей выживаемости пациентов с НРЩЖ были значительно ниже таковых при высокодифференцированном, но выше, чем при недифференцированном (анапластическом) РЩЖ [41]. Подтверждением служит проведенное в последние годы широкомасштабное популяционное исследование [42], свидетельствующее также об эффективности лечения НРЩЖ, заключавшегося в тотальной тиреоидэктомии с шейной лимфодиссекцией и последующей высокодозной радиойодтерапией. Ранняя диагностика НРЩЖ и тщательное наблюдение за пациентами являются определяющими в улучшении показателей выживаемости.
Показатели 10-летней безрецидивной и общей выживаемости пациентов с НРЩЖ были значительно ниже таковых при высокодифференцированном, но выше, чем при недифференцированном (анапластическом) РЩЖ [41]. Подтверждением служит проведенное в последние годы широкомасштабное популяционное исследование [42], свидетельствующее также об эффективности лечения НРЩЖ, заключавшегося в тотальной тиреоидэктомии с шейной лимфодиссекцией и последующей высокодозной радиойодтерапией. Ранняя диагностика НРЩЖ и тщательное наблюдение за пациентами являются определяющими в улучшении показателей выживаемости.
Проведенный анализ данных литературы свидетельствует, что НРЩЖ - редкая опухоль, вызывающая трудности морфологической диагностики, основанной на комбинированном подходе с учетом не только типа гистологического строения (инсулярный, трабекулярный и солидный), но и критериев агрессивности биологического поведения (очаги некроза, митотическая активность опухолевых клеток). Дифференциальная диагностика НРЩЖ предполагает исключение других новообразований, демонстрирующих солидный характер роста (фолликулярный, папиллярный и медуллярный рак).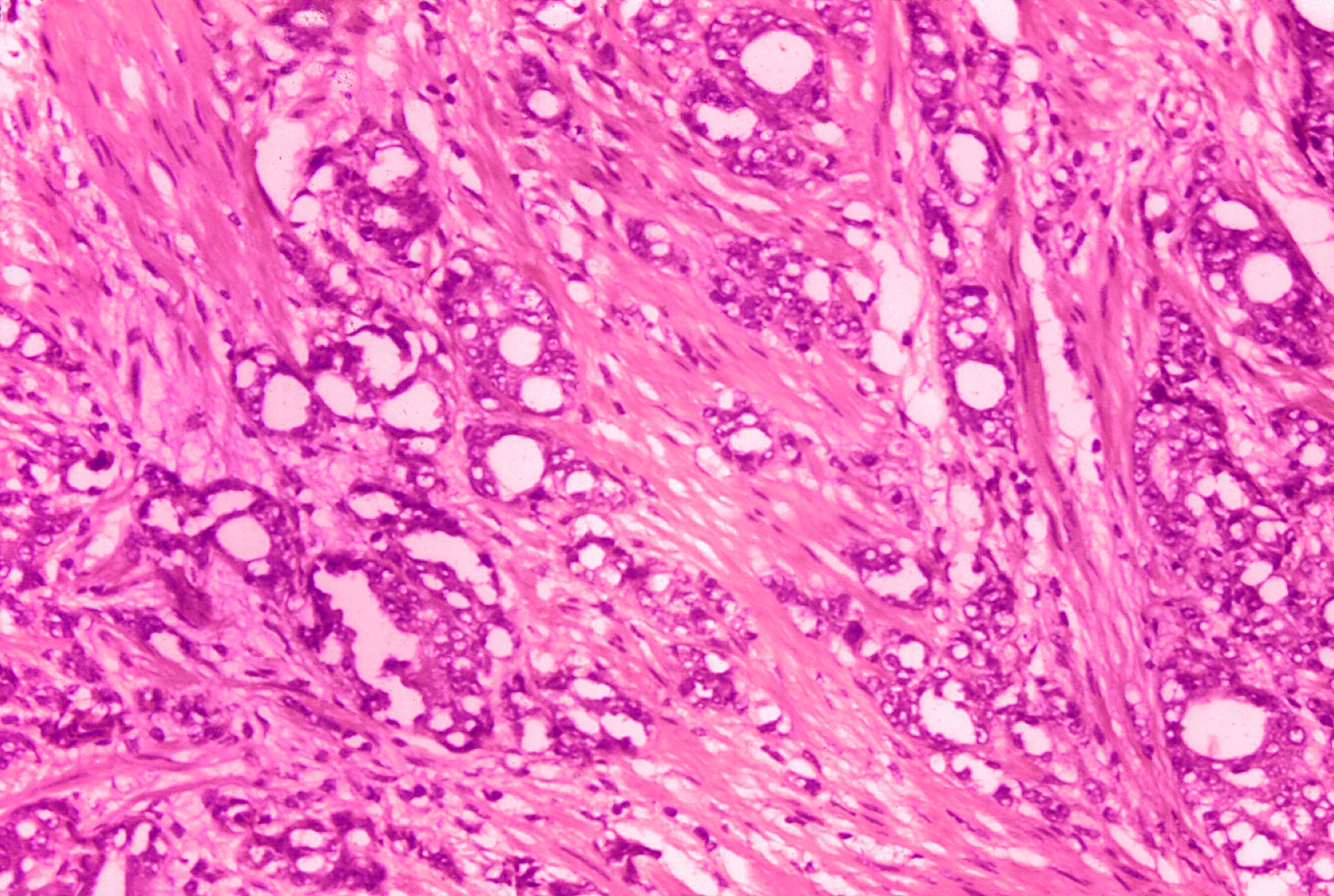 Не нашли пока окончательного решения вопросы о целесообразности выделения варианта НРЩЖ из оксифильных (и/или светлых) клеток и об уровне низкодифференцированного компонента, достаточном для классификации новообразования как НРЩЖ.
Не нашли пока окончательного решения вопросы о целесообразности выделения варианта НРЩЖ из оксифильных (и/или светлых) клеток и об уровне низкодифференцированного компонента, достаточном для классификации новообразования как НРЩЖ.
Рак начинается, когда клетки начинают бесконтрольно расти. Клетки почти в любой части тела могут стать раковыми и могут распространиться на другие области. Рак часто распространяется из своего первичного очага (часть тела, где начался рак) в один или несколько метастатических очагов (другие части тела). Злокачественные новообразования называются в зависимости от их первичного расположения, независимо от того, где в организме они распространяются. Например, рак легких, который распространяется на печень, по-прежнему классифицируется как рак легких, а не как рак печени.
Иногда неясно, откуда мог начаться рак. Когда рак обнаруживается в одном или нескольких метастатических очагах, но не может быть определен первичный очаг, это называется раком с неизвестным первичным раком (CUP) или скрытым первичным раком . Это происходит в небольшой части раковых заболеваний.
Это происходит в небольшой части раковых заболеваний.
Дальнейшие тесты могут в конечном итоге выявить первичную локализацию некоторых из этих видов рака. Когда это происходит, они больше не считаются раком неизвестного первичного происхождения, а переименовываются и лечатся в соответствии с тем, откуда они начались.
Например, у человека увеличен лимфатический узел сбоку на шее. Когда его удаляют, обнаруживается рак. Но под микроскопом это не похоже на рак, который обычно начинается в лимфатических узлах. На данный момент это может считаться раком неизвестного первичного происхождения. То, как он выглядит под микроскопом, может свидетельствовать о том, что рак начался во рту, горле или голосовом аппарате (гортани). При осмотре этой области может быть обнаружен небольшой рак гортани. С этого момента говорят, что у пациента рак гортани, а не рак неизвестной первичной формы, и он будет лечиться от этого типа рака.
Во многих случаях источник рака никогда не определяется. Даже самый тщательный поиск может не найти основной сайт. Даже когда врачи проводят вскрытие людей, умерших от рака неизвестного происхождения, они часто не могут найти место, где зародился рак.
Даже самый тщательный поиск может не найти основной сайт. Даже когда врачи проводят вскрытие людей, умерших от рака неизвестного происхождения, они часто не могут найти место, где зародился рак.
Основной причиной поиска первичной локализации CUP является выбор лечения. Поскольку рак, который начинается в одном месте, требует того же лечения, когда он распространяется, знание того, где рак начался, говорит врачу, какие виды лечения использовать. Это особенно важно для некоторых видов рака, которые хорошо реагируют на специфическую химиотерапию или гормональные препараты. Когда типы рака, которые лучше всего поддаются лечению, были исключены с помощью тестов, обычно становится менее важным найти точное происхождение или тип рака.
Но даже если первичная локализация неизвестна, лечение все равно может быть успешным. То, как раковые клетки выглядят под микроскопом, результаты лабораторных анализов и информация о том, какие органы они уже затронули, могут помочь врачам предсказать, какое лечение может быть полезным.
Чтобы узнать больше о том, как возникает и распространяется рак, см. Что такое рак ?
Рак классифицируется по первичной локализации. Их также можно сгруппировать по типам клеток в них, по тому, как раковые клетки выглядят под микроскопом, и по результатам определенных лабораторных анализов клеток. Знание типа клетки может дать врачам ключ к пониманию того, откуда начался рак. Когда раковые клетки очень похожи на нормальные клетки того органа, где они зарождаются, рак называется 9.0003 хорошо дифференцированный . Когда клетки не очень похожи на нормальные клетки, рак называется низкодифференцированным . Рак неизвестной первичной формы часто плохо дифференцируется.
Карцинома — это рак, который начинается в клетках, выстилающих внутренние или внешние органы тела. Эти клетки называются эпителиальными клетками . Существуют различные типы карциномы, в зависимости от того, как раковые клетки выглядят под микроскопом. Наиболее распространенными типами являются плоскоклеточный рак и аденокарцинома.
Наиболее распространенными типами являются плоскоклеточный рак и аденокарцинома.
Плоскоклеточный рак
Рак, образованный плоскими клетками, которые выглядят как клетки, которые обычно находятся на поверхности кожи или выстилке определенных органов, называется плоскоклеточным раком раком или плоскоклеточным раком 4. Плоскоклеточный рак может начаться во рту, горле, пищеводе, легких, анусе, шейке матки, влагалище и некоторых других органах.
Аденокарциномы
Рак, развивающийся из железистых клеток (клеток, выделяющих вещество), называется аденокарциномы . Железистые клетки находятся во многих органах тела, в том числе в тех, которые обычно не считаются железами. Например, большинство видов рака желудка, кишечника и толстой кишки являются аденокарциномами. Около 4 из 10 случаев рака легкого являются аденокарциномами. Аденокарциномы также могут развиваться во многих других органах.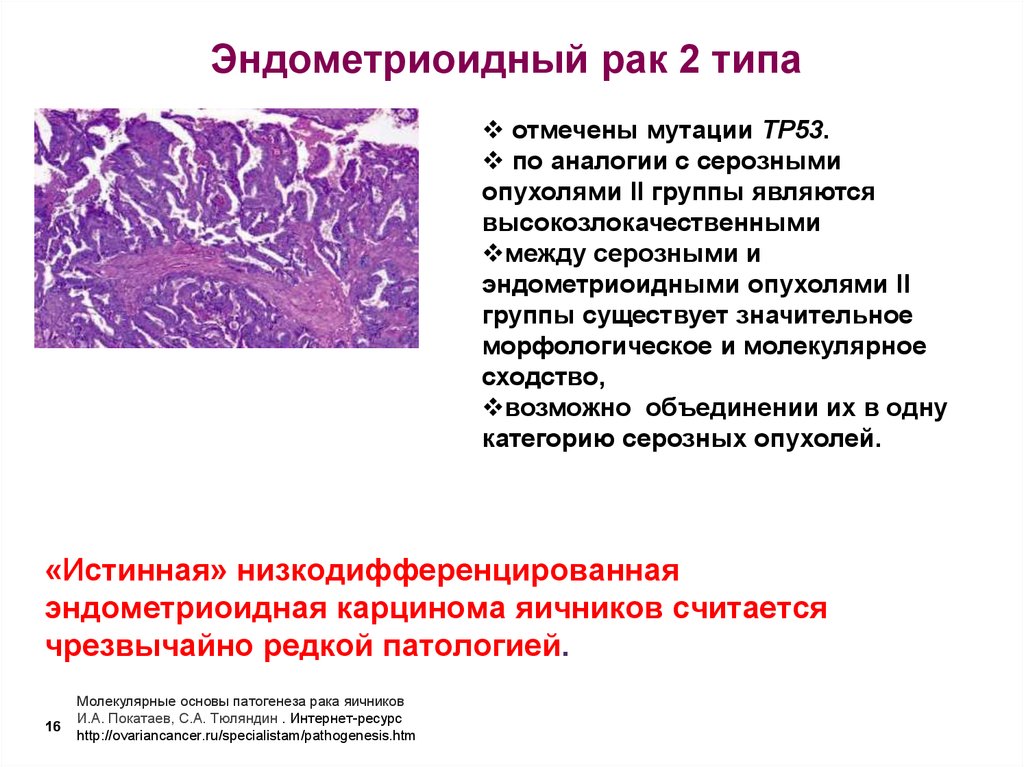
Менее распространенные виды рака могут развиваться из других типов клеток.
Этот список не предназначен для включения всех видов рака, а лишь для того, чтобы назвать наиболее распространенные из них.
При первом рассмотрении раковых клеток под микроскопом врачи обычно классифицируют рак неизвестной первичной формы (CUP) по одной из 5 широких категорий._________________________________2009/ss/ss_3_3.jpg) Многие из этих видов рака могут быть лучше классифицированы позже, после более тщательного тестирования.
Многие из этих видов рака могут быть лучше классифицированы позже, после более тщательного тестирования.
Как отмечалось ранее, эти виды рака развиваются из клеток железы. Они составляют около 6 из 10 случаев CUP.
При рассмотрении этих видов рака под микроскопом достаточно деталей, чтобы сказать, что это карциномы, но клетки слишком нерегулярны, чтобы их можно было классифицировать дальше. Эти виды рака составляют около 3 из 10 случаев CUP. При дальнейшем тестировании около 10% из них оказываются лимфомой, меланомой или саркомой.
Эти виды рака выглядят как плоские клетки на поверхности кожи или оболочке некоторых органов.
Это явно рак, но клетки настолько аномальны, что врач не может сказать, из какого типа клеток они произошли. Большинство из них оказываются лимфомами, саркомами или меланомами. Некоторые из них при дальнейшем тестировании оказываются карциномами.
Некоторые из них при дальнейшем тестировании оказываются карциномами.
Эти редкие виды рака начинаются из клеток диффузной нейроэндокринной системы. В этой системе есть клетки, которые в чем-то похожи на нервные клетки, а в чем-то на эндокринные клетки, вырабатывающие гормоны. Эти клетки не образуют настоящий орган, как надпочечники или щитовидная железа. Вместо этого они разбросаны по другим органам, таким как пищевод, желудок, поджелудочная железа, кишечник и легкие. Эти виды рака составляют небольшое количество случаев CUP. (Некоторые низкодифференцированные виды рака при дальнейшем тестировании оказываются нейроэндокринными карциномами.)
Даже когда врачи не знают, откуда начался рак, они делают все возможное, чтобы классифицировать тип рака. Это может помочь им выбрать лучшее лечение. Некоторые виды рака очень хорошо реагируют на определенные методы лечения, поэтому очень важно максимально точно классифицировать рак. Лучше всего это сделать, рассмотрев опухоль под микроскопом и проведя специальные тесты в лаборатории (см.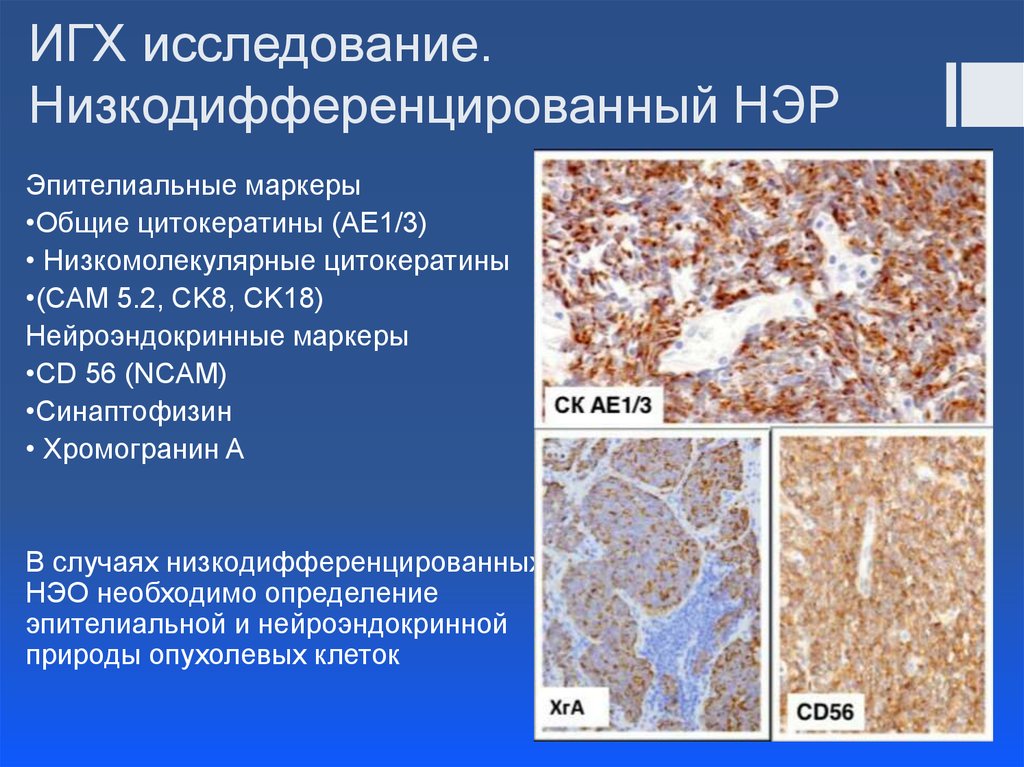 Тесты на рак неизвестного происхождения).
Тесты на рак неизвестного происхождения).
Лимфома часто не имеет четкой первичной локализации, но она не считается CUP.
Хотя первичная локализация меланомы может быть неясна, как только рак классифицируется как меланома, он больше не называется CUP.
John D. Hainsworth, MD и F. Anthony Greco, MD.
Пациенты с низкодифференцированной карциномой составляют примерно 20% пациентов с карциномой неизвестной первичной локализации; еще 10% пациентов имеют низкодифференцированную аденокарциному. Большинство ранних эмпирических исследований химиотерапии включали этих пациентов наряду с более частыми пациентами с аденокарциномой неизвестного первичного происхождения, поскольку не было выявлено никаких клинических различий между этими двумя группами. В настоящее время ясно, что у некоторых пациентов с низкодифференцированной карциномой неизвестной первичной локализации новообразования чрезвычайно чувствительны, а некоторые из них излечимы с помощью комбинированной химиотерапии. Таким образом, у пациентов с низкодифференцированной карциномой решающее значение имеют соответствующие клинические и патологоанатомические исследования, чтобы можно было назначить оптимальную терапию.
Таким образом, у пациентов с низкодифференцированной карциномой решающее значение имеют соответствующие клинические и патологоанатомические исследования, чтобы можно было назначить оптимальную терапию.
Обследование низкодифференцированной карциномы с использованием только обычной световой микроскопии недостаточно для оптимальной оценки этих опухолей. Не было выявлено никаких гистологических особенностей, которые могли бы отличить чувствительные к химиотерапии опухоли от невосприимчивых. 128 Более того, ясно, что даже при тщательном ретроспективном анализе этих случаев некоторые чувствительные опухоли четко определенных типов (например, опухоль зародышевых клеток, лимфома) не могут быть идентифицированы. 128
Таким образом, пациентам с диагнозом низкодифференцированной карциномы при световой микроскопии следует провести дополнительные патологоанатомические исследования с окрашиванием иммунопероксидазой. Электронную микроскопию следует рассмотреть, если результаты окрашивания иммунопероксидазой неубедительны. Информация, которую могут предоставить эти дополнительные исследования, была обобщена выше в разделе, посвященном низкодифференцированным новообразованиям. Поскольку первоначальный диагноз низкодифференцированной карциномы более специфичен, чем «низкодифференцированное новообразование», частота выявления непредвиденных опухолей других типов (в частности, лимфомы) в этой группе значительно ниже. Тем не менее, непредвиденные диагнозы все еще могут быть предложены; в серии из 87 пациентов с низкодифференцированной карциномой, у которых была проведена большая батарея окрашивания иммунопероксидазой, другие диагнозы были предложены у 16 пациентов (18%). 129 Эти диагнозы включали меланому (восемь пациентов), лимфому (четыре пациента), нейроэндокринную опухоль (три пациента) и карциному предстательной железы (один пациент). Диагноз низкодифференцированной карциномы подтвержден у 55 больных; у 15 пациентов картина окрашивания была неубедительной. Все четыре пациента с иммунопероксидазными признаками лимфомы (у двоих из которых ранее была диагностирована низкодифференцированная карцинома с помощью электронной микроскопии) имели клинические признаки, сходные с лимфомой, и все они долго выживали после терапии на основе цисплатина.
Информация, которую могут предоставить эти дополнительные исследования, была обобщена выше в разделе, посвященном низкодифференцированным новообразованиям. Поскольку первоначальный диагноз низкодифференцированной карциномы более специфичен, чем «низкодифференцированное новообразование», частота выявления непредвиденных опухолей других типов (в частности, лимфомы) в этой группе значительно ниже. Тем не менее, непредвиденные диагнозы все еще могут быть предложены; в серии из 87 пациентов с низкодифференцированной карциномой, у которых была проведена большая батарея окрашивания иммунопероксидазой, другие диагнозы были предложены у 16 пациентов (18%). 129 Эти диагнозы включали меланому (восемь пациентов), лимфому (четыре пациента), нейроэндокринную опухоль (три пациента) и карциному предстательной железы (один пациент). Диагноз низкодифференцированной карциномы подтвержден у 55 больных; у 15 пациентов картина окрашивания была неубедительной. Все четыре пациента с иммунопероксидазными признаками лимфомы (у двоих из которых ранее была диагностирована низкодифференцированная карцинома с помощью электронной микроскопии) имели клинические признаки, сходные с лимфомой, и все они долго выживали после терапии на основе цисплатина. Следовательно, представляется, что окрашивание иммунопероксидазой может надежно идентифицировать непредвиденные лимфомы в этой группе, а выявленные таким образом новообразования хорошо реагируют на комбинированную химиотерапию. Восемь пациентов, у которых диагноз меланомы был подтвержден окрашиванием иммунопероксидазой, необычны, потому что трое из восьми выжили в течение длительного времени после химиотерапии по поводу метастатического заболевания.
Следовательно, представляется, что окрашивание иммунопероксидазой может надежно идентифицировать непредвиденные лимфомы в этой группе, а выявленные таким образом новообразования хорошо реагируют на комбинированную химиотерапию. Восемь пациентов, у которых диагноз меланомы был подтвержден окрашиванием иммунопероксидазой, необычны, потому что трое из восьми выжили в течение длительного времени после химиотерапии по поводу метастатического заболевания.
Таким образом, тесты на иммунопероксидазу полезны при оценке низкодифференцированной карциномы, поскольку они предполагают другие диагнозы у меньшинства пациентов, некоторые из которых имеют специфические терапевтические последствия. В настоящее время не выявлено специфических паттернов окрашивания иммунопероксидазой, предсказывающих реактивность опухоли в этой группе пациентов.
Начальная диагностическая оценка этих пациентов аналогична оценке, описанной для пациентов с аденокарциномой неизвестной первичной локализации.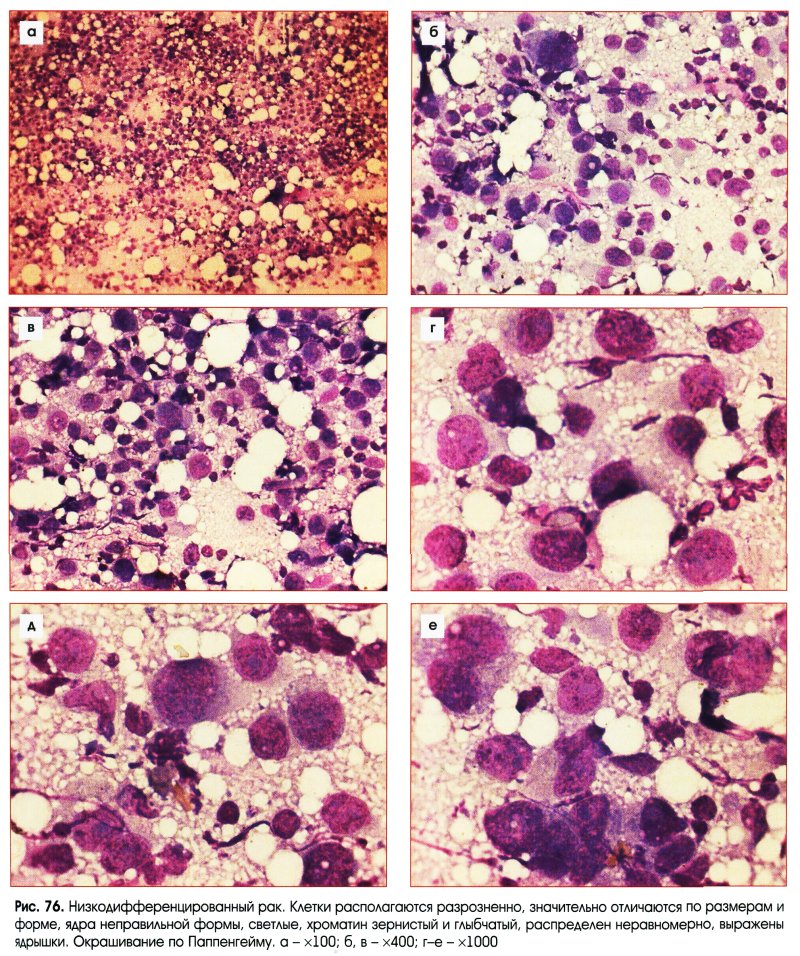 Тщательный сбор анамнеза, физикальное обследование, рутинные лабораторные анализы и рентгенограмма грудной клетки должны быть получены у всех пациентов. Компьютерная томография грудной клетки и брюшной полости должна быть выполнена у всех пациентов этой группы из-за частоты поражения средостения и забрюшинного пространства. Сывороточные уровни ХГЧ и α-фетопротеина должны быть определены у всех пациентов, поскольку значительное повышение этих маркеров свидетельствует о диагнозе герминогенной опухоли. Другие сывороточные опухолевые маркеры, такие как карциноэмбриональный антиген, CA125, CA19-9 и СА15-3 часто повышены, но не позволяют прогнозировать ответ на терапию.
Тщательный сбор анамнеза, физикальное обследование, рутинные лабораторные анализы и рентгенограмма грудной клетки должны быть получены у всех пациентов. Компьютерная томография грудной клетки и брюшной полости должна быть выполнена у всех пациентов этой группы из-за частоты поражения средостения и забрюшинного пространства. Сывороточные уровни ХГЧ и α-фетопротеина должны быть определены у всех пациентов, поскольку значительное повышение этих маркеров свидетельствует о диагнозе герминогенной опухоли. Другие сывороточные опухолевые маркеры, такие как карциноэмбриональный антиген, CA125, CA19-9 и СА15-3 часто повышены, но не позволяют прогнозировать ответ на терапию.
Когда специализированные патологоанатомические исследования выявляют излечимое новообразование, терапию следует проводить в соответствии с рекомендациями, установленными для конкретной выявленной опухоли. Примеры излечимых типов опухолей, иногда выявляемых в этой группе пациентов, включают лимфому, опухоль Юинга, нейроэндокринную карциному и различные примитивные саркомы.
В настоящее время хорошо известно, что у нескольких пациентов в этой гетерогенной группе есть внегонадные опухоли зародышевых клеток, которые не распознаются по стандартным патологическим критериям. Это, как правило, молодые мужчины с преимущественным расположением опухоли в средостении или забрюшинном пространстве. Некоторые также имеют заметное повышение сывороточных онкомаркеров ХГЧ или α-фетопротеина. У некоторых из этих пациентов молекулярно-генетический анализ позволяет поставить окончательный диагноз, выявляя хромосомную аномалию i(12p), специфичную для герминогенных опухолей. 22, 23 Большинство молодых мужчин с низкодифференцированной карциномой и клиническими признаками внегонадной герминогенной опухоли хорошо реагируют на химиотерапию, а некоторые из них излечиваются при лечении в соответствии с рекомендациями для экстрагонадных герминогенных опухолей. 101, 130–134 Таким образом, все пациенты с низкодифференцированной карциномой или низкодифференцированной аденокарциномой неизвестной первичной локализации, у которых также имеются клинические признаки, свидетельствующие о внегонадной герминогенной опухоли, должны лечиться в соответствии с рекомендациями, установленными для герминогенных опухолей с плохим прогнозом.
Лечение пациентов с низкодифференцированной карциномой неизвестной первичной локализации, у которых нет признаков внегонадной герминогенной опухоли, остается предметом споров. В группе из 220 пациентов, проспективно идентифицированных и пролеченных в период с 1978 по 1989 г., мы сообщили о частоте общего ответа 62% с полным ответом 26%. 101 Этих пациентов лечили интенсивными комбинированными схемами на основе цисплатина, используемыми при лечении распространенного рака яичка (например, цисплатин, винбластин и блеомицин [PVB] или цисплатин, этопозид и блеомицин [PEB]). У меньшинства пациентов (14%) не было опухоли после минимального периода наблюдения 8 лет. 135 Большинство пациентов в этой группе не имели клинических характеристик, сильно указывающих на внегонадную герминогенную опухоль. Однако многие пациенты были молодыми (средний возраст 39 лет), и примерно у 40% опухоль располагалась преимущественно в средостении или забрюшинном пространстве. В многофакторном анализе клинические признаки, предсказывающие благоприятный исход лечения, включали локализацию опухоли в забрюшинном пространстве или периферических лимфатических узлах, меньшее количество метастазов, более молодой возраст и отсутствие курения в анамнезе.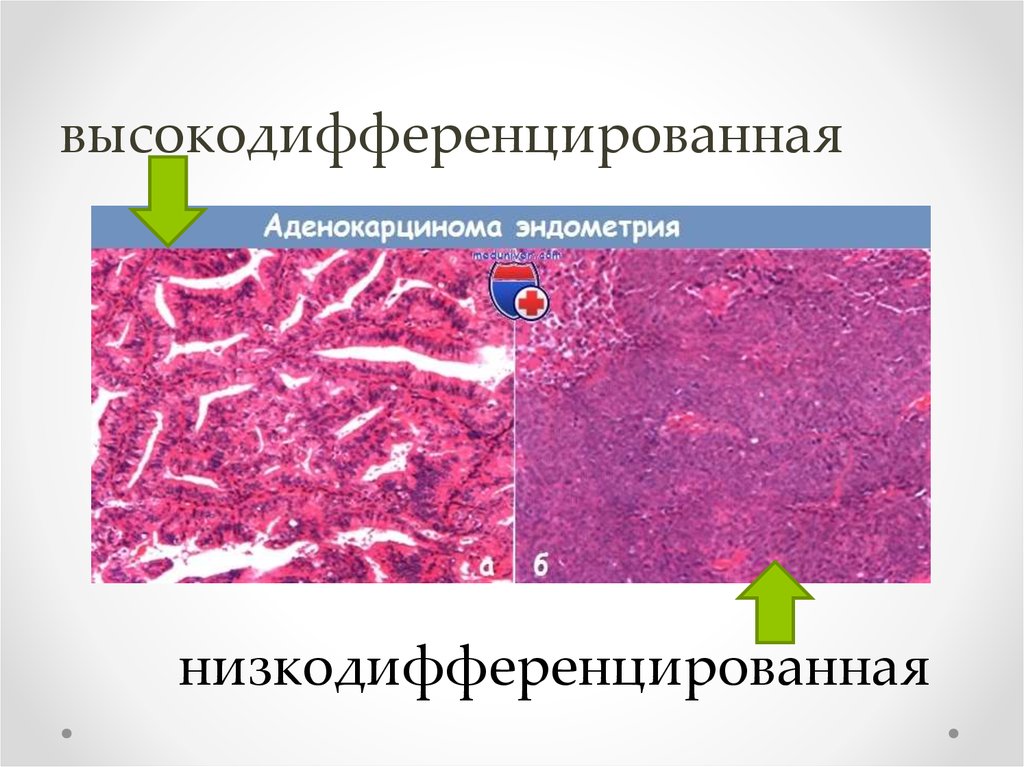
В ретроспективном анализе большой серии пациентов с неизвестным первичным раком Lenzi и его коллеги не смогли выделить подгруппу пациентов с низкодифференцированной карциномой и долгосрочной выживаемостью после химиотерапии. 136 В эту группу были исключены пациенты с клиническими признаками внегонадной герминогенной опухоли. Пациенты получали широкий спектр методов лечения, и только меньшинство пациентов с низкодифференцированной карциномой получали терапию на основе цисплатина, используемую при лечении герминогенных опухолей. Хотя долгосрочных выживших выявлено не было, было выявлено несколько одинаковых благоприятных прогностических факторов, в том числе локализация опухоли в лимфатических узлах, меньшее количество метастатических участков, более молодой возраст, женский пол и низкодифференцированная гистология карциномы (по сравнению с низкодифференцированной аденокарциномой). Другие исследователи также зафиксировали более высокие показатели ответа у пациентов с низкодифференцированной карциномой (по сравнению с аденокарциномой) при лечении химиотерапией на основе цисплатина.