2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Метод определения Бактериологический, бактериоскопический
Исследуемый материал Кал
Доступен выезд на дом
Определение этиологии ОКИЗ (острого кишечного инфекционного заболевания) и выбор рациональной антибиотикотерапии.
Рациональная терапия дизентерии основана на идентификации её возбудителя - бактерий рода Shigella.
Шигеллы (по имени японского учёного К. Шиги) грамотрицательные неподвижные неспороносные палочки длиной 23 мкм, шириной 0,6 мкм. По типу обмена аэробы и факультативные анаэробы.Они выделяют токсины, повреждающие эпителий кишечника, усиливают секрецию жидкости и солей в просвет кишки. Шигеллы быстро изменяют свою чувствительность к различным антибактериальным препаратам.
Заражение происходит фекально-оральным путём. Для возникновения заболевания достаточно инфицирование менее чем 100 микробными клетками шигелл. Инкубационный период от одних до 7 суток (в среднем 2 - 3 суток), но может сокращаться до 12 и даже до 2 часов. Заболевание начинается остро. Возникает общая интоксикация, повышается температура тела, появляются схваткообразные боли в животе (тенезмы), усиливающиеся перед дефекацией. В последние годы отмечается резкое увеличение количества больных тяжёлой дизентерией и её хроническими формами. Диагноз хронической дизентерии устанавливается в случае, если заболевание продолжается более 3 месяцев.
Лабораторное подтверждение дизентерии проводится бактериологическим и серологическим методами. Бактериологический метод (высев шигелл из испражнений) при 3-кратном исследовании обеспечивает подтверждение диагноза у большинства больных. Это обеспечивает дифференциальную диагностику с другими острыми диарейными заболеваниями - сальмонеллёзом, эшерихиозом, кишечным иерсиниозом, холерой, амёбиазом.
Сальмонеллы (по имени американского исследователя D. Salmon) – возбудители энтероколитов или пищевой токсикоинфекции, а также генерализованных тифопаратифозных инфекций. Мелкие грамотрицательные палочки, подвижны за счет жгутиков. По типу метаболизма – факультативные анаэробы. Факторы патогенности – термостабильные эндотоксины, термолабильный энтеротоксин, микрокапсулы, белки наружной мембраны клеточной стенки (способствуют адгезии на энтероцитах тонкой кишки). Сальмонеллезы – зоонозно-антропонозные инфекции, могут быть причиной внутрибольничных инфекций. Сальмонеллы могут размножаться при 4-6 град. С и длительно сохраняться в замороженных продуктах. Брюшной тиф и др. сальмонеллезы являются инфекциями с фекально-оральным механизмом передачи, основной путь передачи - пищевой, главным образом через продукты животного происхождения. Заболевание протекает в форме гастроэнтерита, гастроэнтероколита, гастрита (без диареи), тифоподобной форме и септической форме. После перенесенного заболевания в 20% случаев возникает бактерионосительство, которое может продолжаться пожизненно. Лабораторная диагностика сальмонеллеза основана на выделении возбудителя при посеве различных видов биоматериала от больного (фекалии, рвотные массы, желчь, кровь при септических формах) при микробиологическом исследовании.
Мелкие грамотрицательные палочки, подвижны за счет жгутиков. По типу метаболизма – факультативные анаэробы. Факторы патогенности – термостабильные эндотоксины, термолабильный энтеротоксин, микрокапсулы, белки наружной мембраны клеточной стенки (способствуют адгезии на энтероцитах тонкой кишки). Сальмонеллезы – зоонозно-антропонозные инфекции, могут быть причиной внутрибольничных инфекций. Сальмонеллы могут размножаться при 4-6 град. С и длительно сохраняться в замороженных продуктах. Брюшной тиф и др. сальмонеллезы являются инфекциями с фекально-оральным механизмом передачи, основной путь передачи - пищевой, главным образом через продукты животного происхождения. Заболевание протекает в форме гастроэнтерита, гастроэнтероколита, гастрита (без диареи), тифоподобной форме и септической форме. После перенесенного заболевания в 20% случаев возникает бактерионосительство, которое может продолжаться пожизненно. Лабораторная диагностика сальмонеллеза основана на выделении возбудителя при посеве различных видов биоматериала от больного (фекалии, рвотные массы, желчь, кровь при септических формах) при микробиологическом исследовании.
Выделяемые возбудители: шигеллы, сальмонеллы.
Обращаем внимание на необходимость предварительного приобретения стерильной пробирки с питательной средой, используемой при взятии биоматериала, в любом медицинском офисе ИНВИТРО.
При невозможности собрать кал на исследование можно сдать ректальный мазок. Взятие ректального мазка выполняется подготовленным медицинским персоналом, оплачивается дополнительно- стоимость указана
Микробиологическое исследование, позволяющее выявить в кале патогенную флору: возбудителей бактериальной дизентерии (шигеллеза), сальмонеллезов, в том числе брюшного тифа и паратифа, а также патогенные группы кишечной палочки (E. coli) – возбудителей эшерихиозов.
Синонимы русские
Посев кала на патогены.
Синонимы английские
Stool сulture, Salmonella sp. , Shigella sp., Escherichia coli, bacteria identification and susceptibility, Stool culture, routine.
, Shigella sp., Escherichia coli, bacteria identification and susceptibility, Stool culture, routine.
Метод исследования
Микробиологический метод.
Какой биоматериал можно использовать для исследования?
Кал, ректальный мазок.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Патогенные микроорганизмы не входят в состав нормальной микрофлоры и в норме у человека отсутствуют. При попадании в организм они, как правило, приводят к инфекционным заболеваниям.
Бактерии дизентерийной группы вызывают дизентерию (шигеллез) – острое инфекционное заболевание с фекально-оральным механизмом передачи возбудителя. Она сопровождается преимущественным поражением толстой кишки с диареей, лихорадкой и болями в животе. В стуле пациента зачастую обнаруживается кровь, слизь или гной.
К бактериям тифо-паратифозной группы относятся Salmonella typhi (возбудитель брюшного тифа), Salmonella paratyphi A, B, C (возбудитель паратифа A, B, C соответственно), а также возбудители других сальмонеллезов. Сальмонеллез передается фекально-оральным путем и характеризуется преимущественным поражением желудочно-кишечного тракта, а его симптомы похожи на симптомы гастроэнтерита или энтерита: тошнота, рвота, спазмы в животе, диарея, лихорадка и головные боли.
Брюшной тиф – это острое инфекционное заболевание с фекально-оральным путем передачи, протекающее с постепенным развитием общего недомогания, бессонницы и головной боли, к которым присоединяются лихорадка, симптомы поражения центральной нервной системы в виде заторможенности, нарушений сознания и бреда, а также нарушения стула и сыпь в области живота и грудной клетки. Паратиф А и В по клинической картине и эпидемиологическим особенностям схожи с брюшным тифом, а паратиф С напоминает пищевую токсикоинфекцию.
Паратиф А и В по клинической картине и эпидемиологическим особенностям схожи с брюшным тифом, а паратиф С напоминает пищевую токсикоинфекцию.
Патогенные кишечные палочки являются причиной эшерихиозов – острых кишечных инфекций, которым в большей степени подвержены дети. Эшерихии делят на серогруппы по О-антигену. Среди патогенных эшерихий (кишечных палочек) выделяют:
1) энтеротоксигенные, приводящие к холероподобной диарее,
2) энтеропатогенные, вызывающие диарею главным образом у детей,
3) энтероинвазивные кишечные палочки, сходные по своим свойствам с возбудителями бактериальной дизентерии,
4) энтерогеморрагические, приводящие к дизентериеподобной диарее и гемоколиту.
Для всех перечисленных заболеваний характерно бактерионосительство – транзиторное (случайно выявленное), острое (в период выздоровления после острой дизентерии) или хроническое.
Идентифицировать патогенные микроорганизмы и определить их чувствительность к антибиотикам возможно только при помощи микробиологических методов, таких как культивирование на питательных средах (посев) с определением чувствительности выделенного микроорганизма к антибиотикам.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения: не обнаружены.
Положительный результат посева, то есть выявление возбудителей дизентерии, сальмонеллезов или эшерихиозов свидетельствует о соответствующем заболевании в острой форме (при наличии клинической картины) или в форме бессимптомного бактерионосительства (транзиторного – при однократном положительном результате посева, острого – при положительном результате посева в течение периода выздоровления, хронического – при неоднократных положительных результатах посева).
В случае сомнительного результата следует провести повторное исследование.
При отрицательном результате посева наличие заболевания маловероятно.
Что может влиять на результат?
К ложноотрицательному результату ведет предшествующая антибактериальная терапия или химиотерапия.
Также рекомендуется
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики, педиатр, гастроэнтеролог.
Литература
Шервуд Л. Горбач.
Микрофлора кишечника представляет собой сложную экосистему, содержащую более 400 видов бактерий. разновидность. Анаэробы преобладают над факультативными анаэробами. Флора скудна в желудок и верхний отдел кишечника, но обильный в нижнем отделе кишечника. Бактерии происходят как в просвете, так и прикреплены к слизистой оболочке, но в норме не проникают в стенка кишечника.
разновидность. Анаэробы преобладают над факультативными анаэробами. Флора скудна в желудок и верхний отдел кишечника, но обильный в нижнем отделе кишечника. Бактерии происходят как в просвете, так и прикреплены к слизистой оболочке, но в норме не проникают в стенка кишечника.
Кишечные бактерии являются важнейшим компонентом кишечно-печеночной циркуляции в метаболиты, которые конъюгируются в печени и выделяются с желчью. деконъюгируется в кишечнике бактериальными ферментами, затем всасывается через слизистой оболочки и возвращаются в печень по портальному кровообращению. Многие лекарства и эндогенные соединения подвергаются энтерогепатической циркуляции. Антибиотики, которые подавление флоры может изменить экскрецию фекалий и, следовательно, уровень в крови эти соединения. Флора также играет роль в переваривании клетчатки и синтезе определенные витамины.
Кишечная микрофлора может предотвращать инфекцию, воздействуя на патогены. Флора включает небольшие популяции потенциально патогенных организмов, таких как Clostridium difficile . Антибиотики, нарушающие баланс нормальной флоры может способствовать как заражению экзогенными возбудителями, так и обрастание эндогенными возбудителями. Если стенка кишечника повреждена, кишечная бактерии могут попасть в брюшину и вызвать перитонит и абсцессы.
Флора включает небольшие популяции потенциально патогенных организмов, таких как Clostridium difficile . Антибиотики, нарушающие баланс нормальной флоры может способствовать как заражению экзогенными возбудителями, так и обрастание эндогенными возбудителями. Если стенка кишечника повреждена, кишечная бактерии могут попасть в брюшину и вызвать перитонит и абсцессы.
Диареи, опосредованные энтеротоксинами : Энтеротоксигенные бактерии, такие как Vibrio cholerae и энтеротоксигенные Escherichia coli , колонизируют верхние отделы кишечника и вызывают водянистую диарею. вырабатывает энтеротоксин, который стимулирует клетки слизистой оболочки выделять жидкость через повышение внутриклеточного АМФ.
Инвазивные диареи : Инвазивные бактерии, такие как Шигеллы и Кампилобактеры , проникнуть в слизистая кишечника. Кровянистый, слизистый диарейный стул с воспалительным экссудатом произведено.
Ротавирус и калицивирус (ранее Норуолкский вирус) являются основными возбудителями диареи болезнь. Ротавирусная диарея поражает в основном детей раннего возраста; Калицивирус вызывает заболевание во всех возрастных группах
Некоторые простейшие (особенно Entamoeba histolytica и Giardia lamblia ), а также некоторые кишечные гельминты могут вызывают диарейные заболевания.
Обычно энтеротоксигенные бактерии и вирусы поражают верхний отдел кишечника, вызывая водянистый понос и боль в околопупочной области. Инвазивные бактерии действуют преимущественно в толстой кишки ( Shigella и Campylobacter ) или нижняя часть подвздошной кишки ( Salmonella ). Стул при этих заболеваниях может содержать кровь. Для колита характерны болезненные потуги при дефекации (тенезмы).
Бактериальные обитатели желудочно-кишечного тракта человека составляют комплекс экосистема. В фекалиях человека обнаружено более 400 видов бактерий. один человек. Преобладают анаэробные бактерии. Верхний отдел желудочно-кишечного тракта (т. желудок, двенадцатиперстная кишка, тощая кишка и верхние отделы подвздошной кишки) в норме содержат скудную микрофлору; бактериальная концентрация менее 10 4 организмов/мл кишечной выделения (). Большинство из них микроорганизмы выводятся из ротоглотки и проходят через кишечник с каждым приемом пищи. Колонизация верхних отделов кишечника колиформными организмами является патологическим явлением и характерен для некоторых инфекционных патогенов, таких как Vibrio cholerae и энтеротоксигенные Escherichia coli . В Напротив, толстая кишка обычно содержит обильную микрофлору с общим концентрации 10 11 бактерий/г стула (). Анаэробы, такие как Бактероиды , анаэробных стрептококков и клостридий больше, чем факультативных анаэробов, таких как E coli в 1000 раз.
В фекалиях человека обнаружено более 400 видов бактерий. один человек. Преобладают анаэробные бактерии. Верхний отдел желудочно-кишечного тракта (т. желудок, двенадцатиперстная кишка, тощая кишка и верхние отделы подвздошной кишки) в норме содержат скудную микрофлору; бактериальная концентрация менее 10 4 организмов/мл кишечной выделения (). Большинство из них микроорганизмы выводятся из ротоглотки и проходят через кишечник с каждым приемом пищи. Колонизация верхних отделов кишечника колиформными организмами является патологическим явлением и характерен для некоторых инфекционных патогенов, таких как Vibrio cholerae и энтеротоксигенные Escherichia coli . В Напротив, толстая кишка обычно содержит обильную микрофлору с общим концентрации 10 11 бактерий/г стула (). Анаэробы, такие как Бактероиды , анаэробных стрептококков и клостридий больше, чем факультативных анаэробов, таких как E coli в 1000 раз.
Концентрация бактериальной флоры в регионах желудочно-кишечный тракт.
Характер бактериальной флоры изменяется не только по длине желудочно-кишечного тракта, но и в поперечном сечении относительно слизистой оболочки поверхность. Бактерии занимают просвет, покрывают эпителиальные клетки и прилипают к слизистая оболочка. Проникновение бактерий через поверхность слизистой оболочки является патологическим явлением; патогены, такие как Шигелла , Сальмонелла и Campylobacter внедряются таким образом.
Те же самые механизмы, которые контролируют нормальную флору, также защищают кишечник от инвазия возбудителей. Желудочная кислота в желудке убивает большинство микроорганизмов, проглотил. Лица со сниженной или отсутствующей желудочной кислотой имеют высокую частоту бактериальная колонизация в верхних отделах тонкой кишки и более восприимчивы к бактериальная диарейная болезнь. Желчь обладает антибактериальными свойствами и поэтому может быть еще один фактор контроля над флорой. Передняя пропульсивная моторика (перистальтика) является ключевым элементом подавления флоры верхних отделов кишечника. Наконец, сама микрофлора, вырабатывая собственные антибактериальные вещества (например, бактериоцины и жирные кислоты), стабилизирует нормальные популяции и предотвращает имплантацию патогены.
Наконец, сама микрофлора, вырабатывая собственные антибактериальные вещества (например, бактериоцины и жирные кислоты), стабилизирует нормальные популяции и предотвращает имплантацию патогены.
Метаболические возможности кишечных бактерий чрезвычайно разнообразны. Бактериальный ферменты могут использовать в качестве субстрата практически любое соединение в просвете кишечника, будь то принимаемые перорально или попадающие в кишечник путем секреции через желчные пути или непосредственно через слизистую оболочку.
Ферменты, продуцируемые кишечными бактериями, играют центральную роль в энтерогепатической циркуляции. обращение. Вещества, которые подвергаются энтерогепатической циркуляции, метаболизируются в печени, выделяется с желчью и попадает в просвет кишечника, где реабсорбируются через слизистую оболочку кишечника и возвращаются в печень через портальное кровообращение. Энтерогепатическая циркуляция обычно включает соединения, которые конъюгируются в печени с полярной группой, такой как глюкуроновая кислота, сульфат, таурин, глицин или глутатион.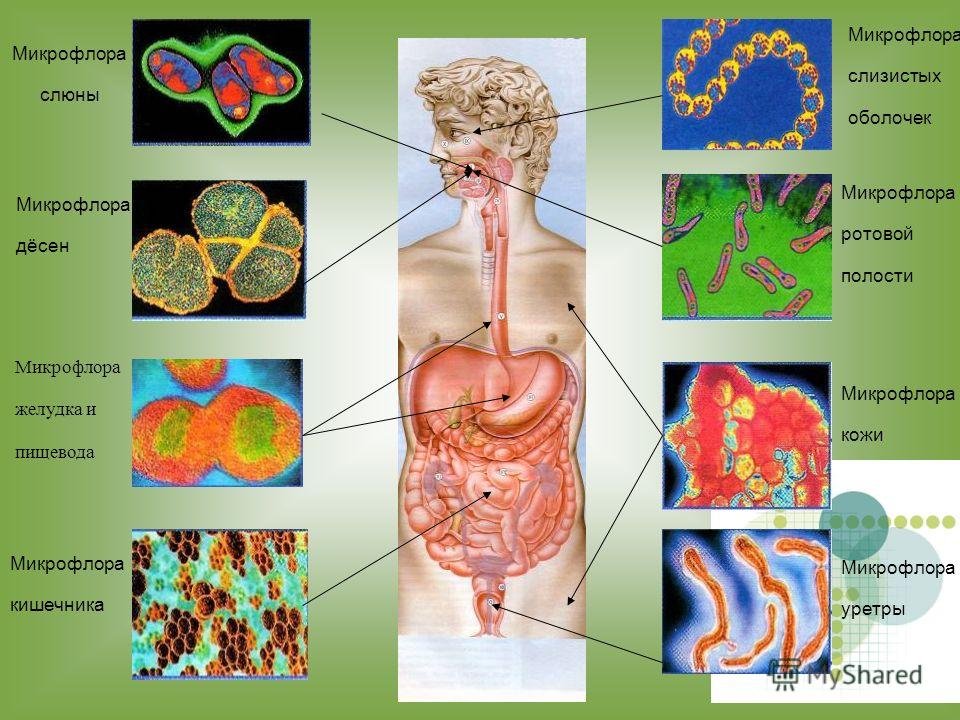 Конъюгация увеличивает растворимость метаболита в желчи, но конъюгированные соединения плохо всасывается слизистой оболочкой кишечника. Ферменты, вырабатываемые кишечником бактерии, такие как ß-глюкуронидаза, сульфатаза и различные гликозидазы - деконъюгируют эти соединения, высвобождая родительские соединения, которые легко всасываются через стенку кишечника. Многие эндогенные соединения подвергаются кишечно-печеночной циркуляции, в том числе билирубин, желчные кислоты, холестерина, эстрогенов и метаболитов витамина D. Кроме того, многие препараты которые выделяются печенью, включая наперстянку, диэтилстилбестрол, морфин, колхицин, рифампицин и хлорамфеникол входят в этот путь.
Конъюгация увеличивает растворимость метаболита в желчи, но конъюгированные соединения плохо всасывается слизистой оболочкой кишечника. Ферменты, вырабатываемые кишечником бактерии, такие как ß-глюкуронидаза, сульфатаза и различные гликозидазы - деконъюгируют эти соединения, высвобождая родительские соединения, которые легко всасываются через стенку кишечника. Многие эндогенные соединения подвергаются кишечно-печеночной циркуляции, в том числе билирубин, желчные кислоты, холестерина, эстрогенов и метаболитов витамина D. Кроме того, многие препараты которые выделяются печенью, включая наперстянку, диэтилстилбестрол, морфин, колхицин, рифампицин и хлорамфеникол входят в этот путь.
Антибиотики блокируют кишечно-печеночную циркуляцию, подавляя кишечную флоры и тем самым снижая уровень деконъюгирующих ферментов. Если антибиотик назначается пациенту, который также принимает лекарство, подвергающееся энтерогепатическому циркуляции, возникающее в результате угнетение энтерогепатической циркуляции будет увеличивают экскрецию препарата с калом и тем самым снижают его уровень в плазме крови и период полураспада. Например, уровни в крови и период полувыведения эстрогена при рождении. контрольные таблетки уменьшаются при приеме антибиотиков.
Например, уровни в крови и период полувыведения эстрогена при рождении. контрольные таблетки уменьшаются при приеме антибиотиков.
Ферменты, вырабатываемые кишечными бактериями, играют важную роль в метаболизме несколько витаминов. Кишечная микрофлора синтезирует витамин К, являющийся необходимый кофактор в производстве протромбина и других факторов свертывания крови факторы. Лечение антибиотиками, особенно у лиц, соблюдающих диету низким содержанием витамина К, может привести к снижению уровня протромбина в плазме и склонности к кровоточить. Кишечные бактерии также синтезируют биотин, витамин В 12 , фолиевая кислота и тиамин.
Кишечная флора способна ферментировать неперевариваемые углеводы (пищевые волокна) до жирных кислот с короткой цепью, таких как ацетат, пропионат и бутират. Основным источником таких ферментируемых углеводов в толстой кишке человека являются растительные клетки. стеновые полисахариды, такие как пектины, целлюлоза и гемицеллюлоза. кислоты продуцируемые бактериями из этих волокнистых субстратов, могут быть важным источником энергии. источник для хоста.
кислоты продуцируемые бактериями из этих волокнистых субстратов, могут быть важным источником энергии. источник для хоста.
У некоторых людей наблюдается дефицит кишечной лактазы, фермента слизистой оболочки, отвечающего за для гидролиза дисахарида лактозы в молоке. У этих людей лактоза плохо переваривается и всасывается в кишечнике. лактоза, которая достигает толстая кишка подвергается интенсивному бактериальному брожению. Результат может быть вздутие живота, метеоризм и диарея.
Как и другие сложные экосистемы, микрофлора кишечника относительно стабильна с течением времени, поддерживая примерно постоянное количество и типы бактерий в каждом область кишечника. Стабильность нормальной флоры препятствует инфицированию экзогенных патогенов и предотвращает чрезмерный рост потенциально патогенных членов. Новые организмы, которые попадают в систему с зараженной пищей или водой, обычно подавляется установленной флорой.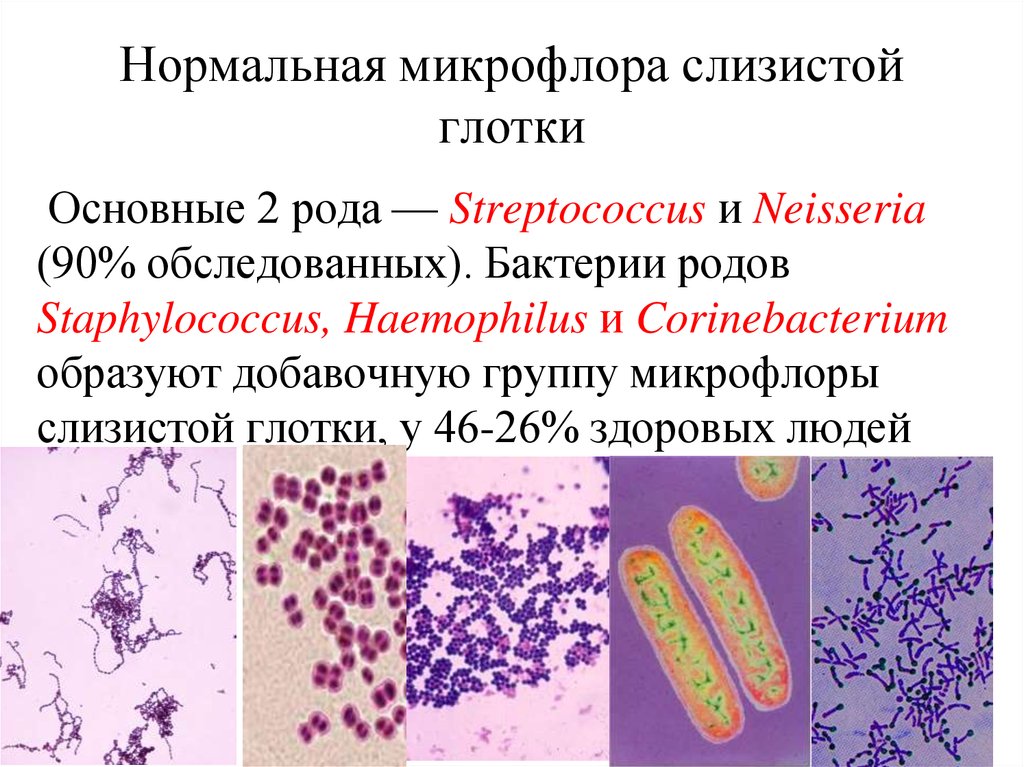 Это подавление связано с производством представителями резидентной флоры противомикробных веществ, таких как бактериоцины или короткоцепочечные жирные кислоты, подавляющие рост чужеродных микроорганизмы. Антибиотики, убивающие часть кишечной флоры, могут вызвать расстройство его баланс и может открыть дверь для инфекции или патологического разрастания.
Это подавление связано с производством представителями резидентной флоры противомикробных веществ, таких как бактериоцины или короткоцепочечные жирные кислоты, подавляющие рост чужеродных микроорганизмы. Антибиотики, убивающие часть кишечной флоры, могут вызвать расстройство его баланс и может открыть дверь для инфекции или патологического разрастания.
Патогенез пищевого отравления Salmonella иллюстрирует это явление. Нормальные люди довольно устойчивы к Salmonella , и для инициировать заражение. Если кишечная флора подавлена антибиотиками, однако человек становится гораздо более восприимчивым и может быть инфицирован относительно небольшой инокулят.
Нормальная кишечная флора включает небольшие популяции микроорганизмов, вызывающих болезни, если они перерастают. Например, разрастание Клостридиум difficile вызывает тяжелое воспаление толстой кишки с диареей. (псевдомембранозный колит). Введение антибиотиков запускает процесс путем подавления нормальной флоры.
Введение антибиотиков запускает процесс путем подавления нормальной флоры.
Бактерии кишечной флоры являются основной причиной инфекции в брюшной полости при нарушении нормальных барьеров кишечной стенки. Стенка кишки может быть перфорирована при травмах (ножевые ранения, огнестрельные ранения, тупой травмой), заболеванием (аппендицит, проникающий рак кишечника) или хирургические процедуры. При нарушении слизистого барьера бактерии проникают внутрь. через кишечную стенку в обычно стерильную брюшную полость и ее окружающие конструкции. Нарушение кровообращения, снижение снабжения кислородом и отмершие ткани вблизи перфорации способствуют формированию абсцесса и особенно способствуют росту анаэробных бактерий. Культуры брюшины абсцесс обычно дают несколько типов бактерий из кишечника микрофлора, особенно виды Бактероиды , Clostridium и Peptostreptococcus и Кишечная палочка .
Некоторые энтеротоксин-продуцирующие бактерии вызывают диарейные заболевания (). Диарейная болезнь вызванные Vibrio cholerae и энтеротоксигенными штаммами E coli имеет три основные характеристики. Во-первых, есть потеря кишечной жидкости, связанная с действием энтеротоксина на эпителиальные клетки тонкой кишки. Во-вторых, сам организм не вторгается в поверхность слизистой оболочки; скорее, он колонизирует верхний отдел тонкой кишки, прикрепляясь к эпителиальные клетки и вырабатывающие энтеротоксин. Архитектура слизистой оболочки остается интактным без признаков разрушения клеток. Бактериемия не происходить. В-третьих, фекальные выделения водянистые и часто объемные, так что диарея может привести к клиническому обезвоживанию. Жидкость берет свое начало в верхнем тонкая кишка. где энтеротоксин наиболее активен.
Диарейная болезнь вызванные Vibrio cholerae и энтеротоксигенными штаммами E coli имеет три основные характеристики. Во-первых, есть потеря кишечной жидкости, связанная с действием энтеротоксина на эпителиальные клетки тонкой кишки. Во-вторых, сам организм не вторгается в поверхность слизистой оболочки; скорее, он колонизирует верхний отдел тонкой кишки, прикрепляясь к эпителиальные клетки и вырабатывающие энтеротоксин. Архитектура слизистой оболочки остается интактным без признаков разрушения клеток. Бактериемия не происходить. В-третьих, фекальные выделения водянистые и часто объемные, так что диарея может привести к клиническому обезвоживанию. Жидкость берет свое начало в верхнем тонкая кишка. где энтеротоксин наиболее активен.
Бактерии, продуцирующие токсины, вызывающие диарею.
Парадигмой энтеротоксигенных диарейных болезней является холера (см. гл. 24), при которой объем стула может превышают 1 л/ч, с суточным дефекацией от 15 до 20 л, если пациент находится на гидратированный.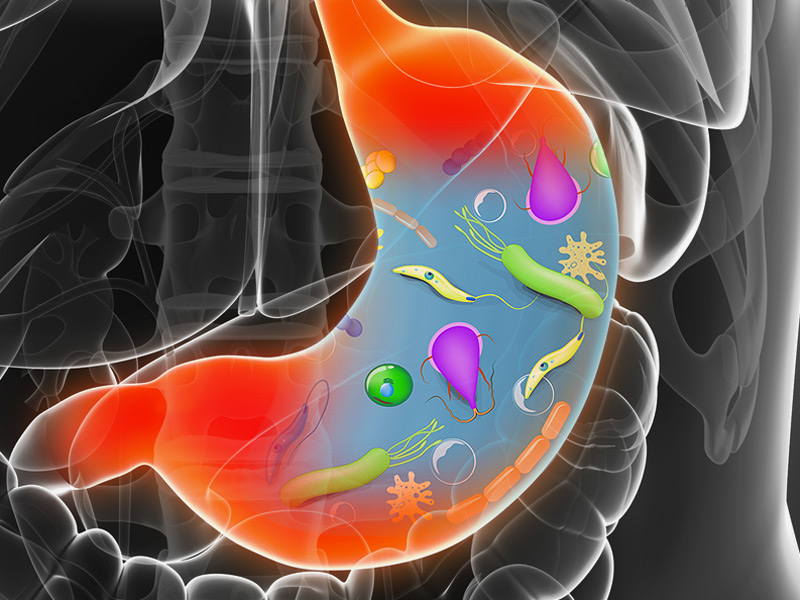 Холера вызывается штаммом V cholerae , который обычно попадает в зараженную воду. Вибрионы, пережившие прохождение через желудок колонизируют поверхность тонкой кишки, размножаются и вырабатывают энтеротоксин. Холерный токсин действует через аденилатциклазу, стимулируя секрецию воды и электролитов из эпителиальных клеток в просвет кишки. двенадцатиперстная кишка и верхний отдел тощей кишки более чувствительны к токсину, чем подвздошная кишка. Толстая кишка относительно нечувствительна к токсину и все еще может поглощать воду и электролиты в норме. Таким образом, холера – это «переполнение диарея», при которой большие объемы жидкости вырабатываются в верхних кишечника подавляют резорбтивную способность нижних отделов кишечника.
Холера вызывается штаммом V cholerae , который обычно попадает в зараженную воду. Вибрионы, пережившие прохождение через желудок колонизируют поверхность тонкой кишки, размножаются и вырабатывают энтеротоксин. Холерный токсин действует через аденилатциклазу, стимулируя секрецию воды и электролитов из эпителиальных клеток в просвет кишки. двенадцатиперстная кишка и верхний отдел тощей кишки более чувствительны к токсину, чем подвздошная кишка. Толстая кишка относительно нечувствительна к токсину и все еще может поглощать воду и электролиты в норме. Таким образом, холера – это «переполнение диарея», при которой большие объемы жидкости вырабатываются в верхних кишечника подавляют резорбтивную способность нижних отделов кишечника.
Стул при холере описывается как напоминающий рисовый отвар — прозрачная жидкость испещрен слизью и изотоничен плазме. микроскопия не выявляет воспалительные клетки в фекальных выделениях; все, что можно увидеть, это маленькие цифры отслоившихся клеток слизистой оболочки.
Некоторые штаммы E. coli вызывают диарею путем выработки энтеротоксины (см. гл. 25). Эти штаммы продуцируют два типа энтеротоксина. Одним из них является термолабильный токсин. сходен по структуре и механизму действия с холерным токсином. Другой, называется термостабильным токсином, по-видимому, действует через гуанилатциклазу. Энтеротоксигенный Штаммы кишечной палочки являются наиболее частой причиной диарея
Многие штаммы Shigella продуцируют энтеротоксин, называемый Shiga токсин, вызывающий выделение жидкости из тонкой кишки (см. гл. 22). Шига-токсин имеет деструктивное, цитотоксическое действие на эпителий тонкой кишки, вызывающее макроскопические повреждение поверхности кишечника. Не активирует аденилатциклазу. Э coli 0157:H7, микроорганизм, связанный с потреблением недоваренное рубленое мясо также производит шигаподобный токсин; это вызывает кровавый диарея и колит. Организм, продуцирующий другой тип цитотоксина, Vibrio parahaemolyticus , бактерия, вызывающая морепродукты. Штаммы пищевого отравления Staphylococcus aureus и Clostridium perfringens продуцируют энтеротоксины, цитотоксический. Стафилококковый энтеротоксин также оказывает прямое действие на рвотный центр в головном мозге.
Организм, продуцирующий другой тип цитотоксина, Vibrio parahaemolyticus , бактерия, вызывающая морепродукты. Штаммы пищевого отравления Staphylococcus aureus и Clostridium perfringens продуцируют энтеротоксины, цитотоксический. Стафилококковый энтеротоксин также оказывает прямое действие на рвотный центр в головном мозге.
В отличие от энтеротоксигенных организмов основное воздействие оказывают инвазивные бактерии на хозяина, вызывая грубое разрушение эпителиальной архитектуры; гистологические данные включают изъязвление слизистой оболочки и воспалительную реакцию в собственная пластинка. Основными возбудителями этой группы являются Salmonella, Shigella, Campylobacter , инвазивный E coli и Yersinia . Энтеровирусы также проникают в эпителиальные клетки кишечника, но степень разрушения слизистой оболочки значительно меньше, чем вызываемые инвазивными бактериальными патогенами.
Salmonella видов являются частой причиной пищевых отравлений. Основным местом поражения является нижняя часть подвздошной кишки, где сальмонеллы вызывают поражение слизистой оболочки. изъязвление. Они быстро проникают через поверхность эпителия в lamina propria и попадают в лимфатические и кровеносные сосуды. Минимум две вирулентности факторы, связанные с кишечной инфекцией: один отвечает за слизистую оболочку инвазия, а другая вызывает секрецию жидкости и электролитов в кишечник.
Shigella микроорганизмы вызывают бациллярную дизентерию, инвазивный диарейное заболевание нижних отделов кишечника, при котором стул содержит воспалительные экссудат, состоящий из полиморфноядерных лейкоцитов. Бациллы проникают в эпителия толстой кишки и вызывают поверхностные изъязвления. Этот инвазивный процесс зависит от наличия двух факторов вирулентности. Первый опосредует первоначальный проникновение на поверхность слизистой за счет разрушения щеточной каймы; бактерии впоследствии поглощаются инвагинацией плазматической мембраны. Секунда Фактор вирулентности позволяет микроорганизму размножаться в слизистой оболочке. Возникают изъязвления слизистой оболочки, сопровождающиеся интенсивной воспалительной реакцией в собственная пластинка. Инфекция обычно ограничивается слизистой оболочкой; лимфа поражение лимфатических узлов и бактериемия встречаются редко.
Секунда Фактор вирулентности позволяет микроорганизму размножаться в слизистой оболочке. Возникают изъязвления слизистой оболочки, сопровождающиеся интенсивной воспалительной реакцией в собственная пластинка. Инфекция обычно ограничивается слизистой оболочкой; лимфа поражение лимфатических узлов и бактериемия встречаются редко.
Механизм(ы), с помощью которого жидкость, вызывающая водянистую диарею, вырабатывается в инвазивные диарейные заболевания обсуждаются. Было три механизма предложенный. Во-первых, Шигелла и, возможно, Штаммы Salmonella , по-видимому, продуцируют энтеротоксин, который стимулирует слизистую оболочку к секреции воды и электролитов. Во-вторых, есть доказательства того, что инвазивные организмы стимулируют синтез простагландинов в этом месте воспаления и что простагландины вызывают секрецию жидкости. В у экспериментальных животных секрецию жидкости можно блокировать ингибиторами простагландинов такие как индометацин и аспирин. В-третьих, некоторые данные свидетельствуют о том, что повреждение эпителий толстой кишки вызывает диарею, препятствуя нормальной резорбции жидкость.
В-третьих, некоторые данные свидетельствуют о том, что повреждение эпителий толстой кишки вызывает диарею, препятствуя нормальной резорбции жидкость.
Два вируса — ротавирус (см. 63) и калицивирус (вирус Норуолк) (см. гл. 65) — были идентифицированы как основные кишечные инфекции. возбудителей у человека. Ротавирусы являются очень важной причиной младенческой диарея, которая в неразвитых странах может привести к летальному исходу. Заразиться могут и взрослые выделяют вирус, но клиническая форма заболевания проявляется почти исключительно у детей младше 2 года. Калицивирус, напротив, может вызывать гастроэнтерит во всех возрастных группах и во всех возрастных группах. является причиной крупных эпидемий. Начальное поражение формируется в проксимальном отделе тонкой кишки. Архитектура слизистой оболочки повреждена, с укорочением ворсинок и гиперплазией склепы. Затем в собственной пластинке появляется воспалительный экссудат.
Механизмы, ответственные за секрецию жидкости при вирусных диареях, не установлены. разъяснено. Известно, что заражение калицивирусом может вызывать стеаторею и мальабсорбции ксилозы и вызывает прямое повреждение ферментов щеточной каемки. Активность аденилатциклазы в эпителиальных клетках не изменяется при остром болезнь.
разъяснено. Известно, что заражение калицивирусом может вызывать стеаторею и мальабсорбции ксилозы и вызывает прямое повреждение ферментов щеточной каемки. Активность аденилатциклазы в эпителиальных клетках не изменяется при остром болезнь.
Некоторые виды простейших и гельминтов могут вызывать диарейные заболевания. Что-нибудь из этого инфекциями можно заразиться в Соединенных Штатах, хотя контакт с кишечными паразиты гораздо чаще встречаются в тропических и развивающихся странах. Некоторые из более распространенными причинами паразитарной диареи являются Entamoeba histolytica , Giardia lamblia , Strongyloides stercoralis , и кишечные сосальщики.
Понимание патофизиологии может быть использовано для постановки предварительного диагноза при больных инфекционной диареей (). Возможно, наиболее удобный подход заключается в разделении патогенов, вовлекают тонкую кишку из тех, которые атакуют толстую кишку. Энтеротоксигенный бактерии ( E coli, V cholerae ), вирусы и паразит Giardia являются примерами патогенов тонкого кишечника. Эти организмы вызывают водянистую диарею, которая может привести к обезвоживанию. Боль в животе, хотя часто диффузный и плохо очерченный, обычно околопупочный. микроскопический исследование кала не выявляет сформированных клеточных элементов, таких как эритроциты и лейкоциты.
Энтеротоксигенный бактерии ( E coli, V cholerae ), вирусы и паразит Giardia являются примерами патогенов тонкого кишечника. Эти организмы вызывают водянистую диарею, которая может привести к обезвоживанию. Боль в животе, хотя часто диффузный и плохо очерченный, обычно околопупочный. микроскопический исследование кала не выявляет сформированных клеточных элементов, таких как эритроциты и лейкоциты.
Клинические признаки диарейных заболеваний.
Патогены толстого кишечника (основные из них Шигелла и Campylobacter ) являются инвазивными микроорганизмами и вызывают клинические синдром, известный как дизентерия. Вовлечение толстой кишки настоятельно рекомендуется характерная ректальная боль, известная как тенезмы. Хотя фекальные выделения могут быть сначала водянистый, ко второму-третьему дню болезни стул скудный и частый кровянистые или мукоидные. Микроскопическое исследование почти всегда выявляет обильные эритроциты и лейкоциты. При ректоскопии определяется диффузно изъязвленная, геморрагическая и рыхлая слизистая оболочка толстой кишки.
При ректоскопии определяется диффузно изъязвленная, геморрагическая и рыхлая слизистая оболочка толстой кишки.
Пищевое отравление сальмонеллезом не укладывается в эту простую схему, т.к. могут проявляться признаки, характерные как для тонкой, так и для толстой кишки. Организм инвазивно для слизистой оболочки тонкой кишки, особенно нижнего отдела подвздошной кишки, и может вызвать обильное выделение жидкости. Кроме того, септицемия и метастатическое иногда происходит распространение возбудителя на другие органы.
Finegold S (ed): Столетний симпозиум по анаэробам: Памятник Андре Вейону. Clin Infect Dis 18: 5–245, 1994 . [PubMed: 8086570]
Голдин Б.Р., Лихтенштейн А.Х., Горбач С.Л.: Роль кишечная флора. п. 500. In Shils ME, Young VR (eds): Modern Nutrition in Здоровье и болезнь. Леа и Фебригер, Филадельфия, 1994 г.
Горбач С.Л.: Инфекционная диарея и бактериальная пища отравление. п. 1128 In Sleisenger MH, Fordtran JS (ред.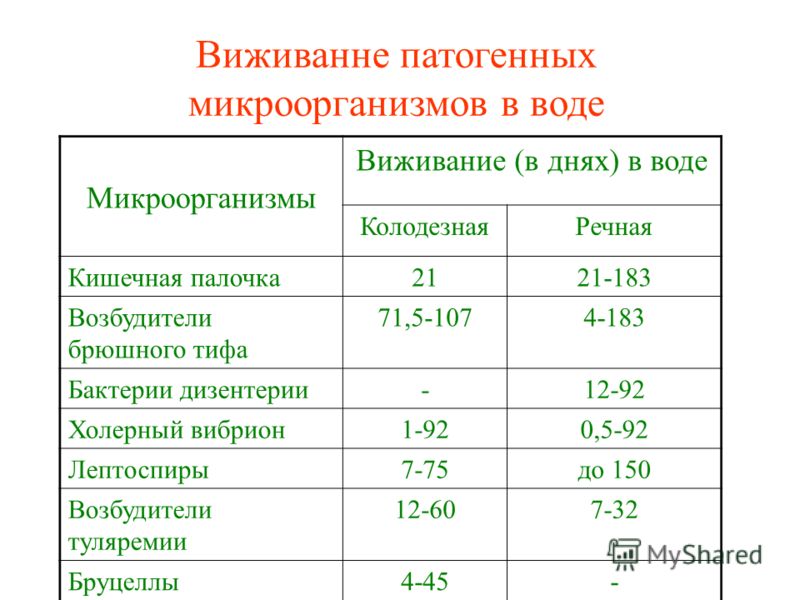 ): Желудочно-кишечный тракт Болезни. WB Saunders, Philadelphia, 1993.
): Желудочно-кишечный тракт Болезни. WB Saunders, Philadelphia, 1993.
Simon GL, Gorbach SL: Нормальный пищеварительный тракт микрофлора. п. 53. В Blaser MJ, Smith PD, Ravdin JI, Greenberg HB, Guerrant RL. (ред.): Инфекции желудочно-кишечного тракта, Raven Press, Нью-Йорк, стр. 19.95 .
1. Раунд Ю.Л., Мазманян С.К. 2009. Кишечная микробиота формирует кишечные иммунные реакции во время здоровья и болезни. Нац. Преподобный Иммунол. 9, 313–323. ( 10.1038/nri2515) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Flint HJ, Scott KP, Louis P, Duncan SH. 2012. Роль микробиоты кишечника в питании и здоровье. Нац. Преподобный Гастроэнтерол. Гепатол. 9, 577–589. ( 10.1038/nrgastro.2012.156) [PubMed] [CrossRef] [Google Scholar]
3. Маккенни П.Т., Памер Э.Г. 2015. От шумихи к надежде: микробиота кишечника при кишечных инфекционных заболеваниях. Клетка 163, 1326–1332. ( 10.1016/j.cell.2015.11.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
( 10.1016/j.cell.2015.11.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Камада Н., Чен Г.Ю., Инохара Н., Нуньес Г. 2013. Контроль патогенов и патобионтов кишечной микробиотой. Нац. Иммунол. 14, 685–690. ( 10.1038/ni.2608) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
5. Chow J, Tang H, Mazmanian SK. 2011. Патобионты микробиоты желудочно-кишечного тракта и воспалительные заболевания. Курс. мнение Иммунол. 23, 473–480. ( 10.1016/j.coi.2011.07.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Дюклюзо Р., Рейлбо П. 1989. Бактериальные взаимодействия в желудочно-кишечном тракте. преподобный наук. Тех. Выключенный. Междунар. Эпизод. 8, 313–332. ( 10.20506/rst.8.2.410) [CrossRef] [Google Scholar]
7. Theriot CM, Young VB. 2015. Взаимодействия между желудочно-кишечным микробиомом и Clostridium difficile . Анну. Преподобный Микробиолог. 69, 445–461. ( 10.1146/annurev-micro-091014-104115) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Osawa N, Mitsuhashi S. 1964. Заражение мышей germeree Shigella Flexneri 3a. Япония. Дж. Эксп. Мед. 34, 77–80. [PubMed] [Google Scholar]
Osawa N, Mitsuhashi S. 1964. Заражение мышей germeree Shigella Flexneri 3a. Япония. Дж. Эксп. Мед. 34, 77–80. [PubMed] [Google Scholar]
9. Фукуда С., Тох Х., Тейлор Т.Д., Оно Х., Хаттори М. 2012. Бифидобактерии, продуцирующие ацетат, защищают хозяина от энтеропатогенной инфекции через переносчики углеводов. Кишечные микробы 3, 449–454. (10.4161/gmic.21214) [PubMed] [CrossRef] [Google Scholar]
10. Fukuda S, et al. 2011. Бифидобактерии могут защищать от энтеропатогенной инфекции за счет продукции ацетата. Природа 469, 543–547. ( 10.1038/nature09646) [PubMed] [CrossRef] [Google Scholar]
11. Бонхофф М., Дрейк Б.Л., Миллер С.П. 1954. Влияние стрептомицина на восприимчивость кишечного тракта к экспериментальной сальмонеллезной инфекции. проц. соц. Эксп. биол. Мед. 86, 132–137. ( 10.3181/00379727-86-21030) [PubMed] [CrossRef] [Google Scholar]
12. Lawley TD, et al. 2009. Лечение антибиотиками мышей-носителей Clostridium difficile вызывает состояние супершеддера, спороопосредованную передачу и тяжелое заболевание у хозяев с ослабленным иммунитетом. Заразить. Иммун. 77, 3661–3669. ( 10.1128/IAI.00558-09) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Заразить. Иммун. 77, 3661–3669. ( 10.1128/IAI.00558-09) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Buffie CG, Pamer EG. 2013. Опосредованная микробиотой колонизационная резистентность к кишечным патогенам. Нац. Преподобный Иммунол. 13, 790–801. ( 10.1038/nri3535) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Камада Н., Ким Ю.Г., Шам Х.П., Валланс Б.А., Пуэнте Дж.Л., Мартенс Э.К., Нуньес Г. 2012. Регулируемая вирулентность контролирует способность патогена конкурировать с микробиотой кишечника. Наука 336, 1325–1329 гг.. ( 10.1126/science.1222195) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Gantois I, Ducatelle R, Pasmans F, Haesebrouck F, Hautefort I, Thompson A, Hinton JC, Van Immerseel F . 2006. Бутират специфически подавляет экспрессию гена острова 1 патогенности Salmonella . заявл. Окружающая среда. микробиол. 72, 946–949. (10.1128/AEM.72.1.946-949.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Shin R, Suzuki M, Morishita Y. 2002. Влияние кишечных анаэробов и органических кислот на рост энтерогеморрагических Escherichia coli O157:H7. Дж. Мед. микробиол. 51, 201–206. ( 10.1099/0022-1317-51-3-201) [PubMed] [CrossRef] [Google Scholar]
Shin R, Suzuki M, Morishita Y. 2002. Влияние кишечных анаэробов и органических кислот на рост энтерогеморрагических Escherichia coli O157:H7. Дж. Мед. микробиол. 51, 201–206. ( 10.1099/0022-1317-51-3-201) [PubMed] [CrossRef] [Google Scholar]
17. Kommineni S, et al. 2015. Продукция бактериоцина усиливает конкуренцию энтерококков в желудочно-кишечном тракте млекопитающих. Природа 526, 719–722. ( 10.1038/nature15524) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Rea MC, Sit CS, Clayton E, O'Connor PM, Whittal RM, Zheng J, Vederas JC, Ross RP, Хилл С. 2010. Турицин CD, посттрансляционно модифицированный бактериоцин с узким спектром активности против Clostridium difficile . проц. Натл акад. науч. США 107, 9352–9357. ( 10.1073/pnas.0913554107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Schamberger GP, Diez-Gonzalez F. 2002. Отбор недавно выделенных колициногенных штаммов Escherichia coli , ингибирующих Escherichia coli O157:H7. Дж. Пищевая защита. 65, 1381–1387. [PubMed] [Google Scholar]
Дж. Пищевая защита. 65, 1381–1387. [PubMed] [Google Scholar]
20. Пинто А.Л., Фернандес М., Пинто С., Альбано Х., Кастильо Ф., Тейшейра П., Гиббс П.А. 2009 г.. Характеристика бактериоцинов против Listeria , выделенных из моллюсков: потенциальные противомикробные препараты для борьбы с неферментированными морепродуктами. Междунар. Дж. Пищевая микробиология. 129, 50–58. ( 10.1016/j.ijfoodmicro.2008.11.005) [PubMed] [CrossRef] [Google Scholar]
21. Chanos P, Williams DR. 2011. Бактерии, продуцирующие бактериоцин против Listeria , из сырого овечьего молока в северной Греции. Дж. Заявл. микробиол. 110, 757–768. ( 10.1111/j.1365-2672.2010.04932.x) [PubMed] [CrossRef] [Google Scholar]
22. Дония М.С., Цимерманчич П., Шульце С.Дж., Виланд Браун Л.С., Мартин Дж., Митрева М., Кларди Дж., Линингтон Р.Г., Фишбах М.А. 2014. Систематический анализ кластеров биосинтетических генов в микробиоме человека выявляет общее семейство антибиотиков. Клетка 158, 1402–1414. ( 10.1016/j.cell.2014.08.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
( 10.1016/j.cell.2014.08.032) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Walsh CJ, Guinane CM, Hill C, Ross RP, O'Toole PW, Cotter PD. 2015. Идентификация in silico кластеров генов бактериоцинов в желудочно-кишечном тракте на основе базы данных эталонного генома Human Microbiome Project. БМС микробиол. 15, 183 ( 10.1186/s12866-015-0515-4) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Проект микробиома человека C. 2012. Структура, функции и разнообразие микробиома здорового человека. Природа 486, 207–214. ( 10.1038/nature11234) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, Gewirtz AT. 2015. Пищевые эмульгаторы влияют на микробиоту кишечника мышей, вызывая колит и метаболический синдром. Природа 519, 92–96. ( 10.1038/nature14232) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Theriot CM, Bowman AA, Young VB. 2016. Вызванные антибиотиками изменения кишечной микробиоты изменяют вторичную продукцию желчных кислот и позволяют спорам Clostridium difficile прорастать и расти в толстой кишке. мсфера 1, e00045-15. ( 10.1128/mSphere.00045-15) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вызванные антибиотиками изменения кишечной микробиоты изменяют вторичную продукцию желчных кислот и позволяют спорам Clostridium difficile прорастать и расти в толстой кишке. мсфера 1, e00045-15. ( 10.1128/mSphere.00045-15) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Бриттон Р.А., Янг В.Б. 2014. Роль кишечной микробиоты в устойчивости к колонизации Clostridium difficile . Гастроэнтерология 146, 1547–1553. ( 10.1053/j.gastro.2014.01.059) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Зорг Ю.А., Соненшайн А.Л. 2010. Ингибирование инициации прорастания спор Clostridium difficile с использованием аналогов хенодезоксихолевой кислоты, желчной кислоты. Дж. Бактериол. 192, 4983–4990. ( 10.1128/JB.00610-10) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Buffie CG, et al. 2015. Прецизионная реконструкция микробиома восстанавливает опосредованную желчными кислотами резистентность к Clostridium difficile . Природа 517, 205–208. ( 10.1038/nature13828) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Природа 517, 205–208. ( 10.1038/nature13828) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Weingarden AR, Chen C, Bobr A, Yao D, Lu Y, Nelson VM, Sadowsky MJ, Khoruts A. 2014. Трансплантация микробиоты восстанавливает нормальный состав желчных кислот в фекалиях при рецидивирующей инфекции Clostridium difficile . Являюсь. Дж. Физиол. Гастроинтест. Физиол печени. 306, Г310–Г319. ( 10.1152/ajpgi.00282.2013) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Карлссон Дж., Пуцеп К., Чу Х., Кейс Р.Дж., Бевинс С.Л., Андерссон М. 2008. Региональные вариации экспрессии противомикробного пептида в клетках Панета в кишечном тракте мыши. БМС Иммунол. 9, 37 (10.1186/1471-2172-9-37) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Rios D, Wood MB, Li J, Chassaing B, Gewirtz AT, Williams IR . 2015. Отбор проб антигена кишечными М-клетками является основным путем, инициирующим продукцию IgA слизистой оболочки к комменсальным кишечным бактериям. Иммунол слизистых оболочек. 9, 907–916. ( 10.1038/mi.2015.121) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Иммунол слизистых оболочек. 9, 907–916. ( 10.1038/mi.2015.121) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Bevins CL, Salzman NH. 2011. Клетки Панета, антимикробные пептиды и поддержание гомеостаза кишечника. Нац. Преподобный Микробиолог. 9, 356–368. ( 10.1038/nrmicro2546) [PubMed] [CrossRef] [Google Scholar]
34. Cash HL, Whitham CV, Behrendt CL, Hooper LV. 2006. Симбиотические бактерии непосредственно экспрессируют кишечный бактерицидный лектин. Наука 313, 1126–1130. ( 10.1126/наука.1127119) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. Fransen F, et al. 2015. Мыши BALB/c и C57BL/6 отличаются содержанием полиреактивных IgA, что влияет на образование антиген-специфических IgA и разнообразие микробиоты. Иммунитет 43, 527–540. ( 10.1016/j.immuni.2015.08.011) [PubMed] [CrossRef] [Google Scholar]
36. Долле Л., штаб-квартира Тран, Этьен-Месмин Л., Чессейн Б. 2016. Контроль микробиоты кишечника адаптивной иммунной системой. БМС Мед. 14, 27 ( 10.1186/s12916-016-0573-y) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
БМС Мед. 14, 27 ( 10.1186/s12916-016-0573-y) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. Мазманян С.К., Лю С.Х., Цианабос А.О., Каспер Д.Л. 2005. Иммуномодулирующая молекула симбиотических бактерий управляет созреванием иммунной системы хозяина. Клетка 122, 107–118. ( 10.1016/j.cell.2005.05.007) [PubMed] [CrossRef] [Google Scholar]
38. Иванов И.И., Фрутос Р.Д., Манел Н., Йошинага К., Рифкин Д.Б., Сартор Р.Б., Финлей Б.Б., Литтман Д.Р. 2008. Специфическая микробиота управляет дифференцировкой Т-хелперов, продуцирующих ИЛ-17, в слизистой оболочке тонкой кишки. Клеточный микроб-хозяин 4, 337–349. ( 10.1016/j.chom.2008.09.009) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Иванов И.И., и соавт. 2009. Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Клетка 139, 485–498. ( 10.1016/j.cell.2009.09.033) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Gaboriau-Routhiau V, et al. 2009. Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов кишечных хелперов Т-клеток. Иммунитет 31, 677–689. ( 10.1016/j.immuni.2009.08.020) [PubMed] [CrossRef] [Google Scholar]
Ключевая роль сегментированных нитчатых бактерий в скоординированном созревании ответов кишечных хелперов Т-клеток. Иммунитет 31, 677–689. ( 10.1016/j.immuni.2009.08.020) [PubMed] [CrossRef] [Google Scholar]
41. Lecuyer E, et al. 2014. Сегментированная нитчатая бактерия использует вторичные и третичные лимфоидные ткани, чтобы индуцировать кишечный IgA и специфические реакции Т-хелперов 17. Иммунитет 40, 608–620. ( 10.1016/j.immuni.2014.03.009) [PubMed] [CrossRef] [Google Scholar]
42. Ракофф-Нахум С., Паглино Дж., Эслами-Варзане Ф., Эдберг С., Меджитов Р. 2004. Распознавание комменсальной микрофлоры толл-подобными рецепторами необходимо для гомеостаза кишечника. Клетка 118, 229–241. (10.1016/j.cell.2004.07.002) [PubMed] [CrossRef] [Google Scholar]
43. Araki A, et al. 2005. У мышей с дефицитом MyD88 развивается тяжелое воспаление кишечника при колите, вызванном декстрансульфатом натрия. Дж. Гастроэнтерол. 40, 16–23. ( 10.1007/s00535-004-1492-9) [PubMed] [CrossRef] [Google Scholar]
44. Zhang B, et al. 2014. Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством опосредованной TLR5/NLRC4 продукции IL-22 и IL-18. Наука 346, 861–865. ( 10.1126/наука.1256999) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Zhang B, et al. 2014. Вирусная инфекция. Профилактика и лечение ротавирусной инфекции посредством опосредованной TLR5/NLRC4 продукции IL-22 и IL-18. Наука 346, 861–865. ( 10.1126/наука.1256999) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Atarashi K, et al. 2013. Индукция Treg рационально подобранной смесью штаммов Clostridia из микробиоты человека. Природа 500, 232–236. ( 10.1038/nature12331) [PubMed] [CrossRef] [Google Scholar]
46. Arpaia N, et al. 2013. Метаболиты, продуцируемые комменсальными бактериями, способствуют образованию периферических регуляторных Т-клеток. Природа 504, 451–455. ( 10.1038/nature12726) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Ким Ч., Пак Дж., Ким М. 2014. Короткоцепочечные жирные кислоты кишечной микробиоты, Т-клетки и воспаление. Иммунная сеть 14, 277–288. ( 10.4110/in.2014.14.6.277) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Furusawa Y, et al. 2013. Бутират комменсального микробного происхождения индуцирует дифференцировку регуляторных Т-клеток толстой кишки. Природа 504, 446–450. ( 10.1038/nature12721) [PubMed] [CrossRef] [Google Scholar]
Природа 504, 446–450. ( 10.1038/nature12721) [PubMed] [CrossRef] [Google Scholar]
49. Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly YM, Glickman JN, Garrett WS. 2013. Микробные метаболиты, жирные кислоты с короткой цепью, регулируют гомеостаз Treg-клеток толстой кишки. Наука 341, 569–573. ( 10.1126/science.1241165) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Bates JM, Akerlund J, Mittge E, Guillemin K. 2007. Кишечная щелочная фосфатаза детоксифицирует липополисахарид и предотвращает воспаление у рыбок данио в ответ на микробиоту кишечника. Клеточный микроб-хозяин 2, 371–382. ( 10.1016/j.chom.2007.10.010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Beumer C, Wulferink M, Raaben W, Fiechter D, Brands R, Seinen W. 2003. Щелочная фосфатаза кишечника телят, новый терапевтический препарат для лечения заболеваний, опосредованных липополисахаридами (ЛПС), ослабляет токсичность ЛПС у мышей и поросят. Дж. Фармакол. Эксп. тер. 307, 737–744. ( 10.1124/jpet.103.056606) [PubMed] [CrossRef] [Google Scholar]
Эксп. тер. 307, 737–744. ( 10.1124/jpet.103.056606) [PubMed] [CrossRef] [Google Scholar]
52. Кояма И., Мацунага Т., Харада Т., Хокари С., Комода Т. 2002. Щелочные фосфатазы снижают токсичность липополисахаридов in vivo и in vitro посредством дефосфорилирования. клин. Биохим. 35, 455–461. ( 10.1016/S0009-9120(02)00330-2) [PubMed] [CrossRef] [Google Scholar]
53. Chassaing B, Gewirtz AT. 2016. Спровоцировала ли провоцирование агрессии микробиоты эпидемию ожирения? Биоэссе 38, 122–128. ( 10.1002/bies.201500116) [PubMed] [CrossRef] [Google Scholar]
54. Влодарска М., Уиллинг Б., Кини К.М., Менендес А., Бергстром К.С., Гилл Н., Рассел С.Л., Валланс Б.А., Финлей Б.Б. 2011. Лечение антибиотиками изменяет слой слизистой оболочки толстой кишки и предрасполагает хозяина к обострению колита, вызванного Citrobacter rodentium . Заразить. Иммун. 79, 1536–1545. ( 10.1128/IAI.01104-10) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Willemsen LE, Koetsier MA, van Deventer SJ, van Tol EA. 2003. Короткоцепочечные жирные кислоты стимулируют экспрессию эпителиального муцина 2 за счет различных эффектов на продукцию простагландинов E(1) и E(2) кишечными миофибробластами. кишки 52, 1442–1447. ( 10.1136/gut.52.10.1442) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Willemsen LE, Koetsier MA, van Deventer SJ, van Tol EA. 2003. Короткоцепочечные жирные кислоты стимулируют экспрессию эпителиального муцина 2 за счет различных эффектов на продукцию простагландинов E(1) и E(2) кишечными миофибробластами. кишки 52, 1442–1447. ( 10.1136/gut.52.10.1442) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Симотоёдомэ А., Мегуро С., Хасэ Т., Токимицу И., Саката Т. 2000. Жирные кислоты с короткой цепью, но не лактат или сукцинат, стимулируют выделение слизи в толстой кишке крысы. Комп. Биохим. Физиол. Мол. интегр. Физиол. 125, 525–531. ( 10.1016/S1095-6433(00)00183-5) [PubMed] [CrossRef] [Google Scholar]
57. Cameron EA, Sperandio V. 2015. Заклятые враги: интеграция сигналов и питания во взаимодействиях патоген-микробиота-хозяин. Клеточный микроб-хозяин 18, 275–284. ( 10.1016/j.chom.2015.08.007) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Нг К.М. и др. 2013. Освобождаемые микробиотой сахара-хозяева способствуют постантибиотической экспансии кишечных патогенов.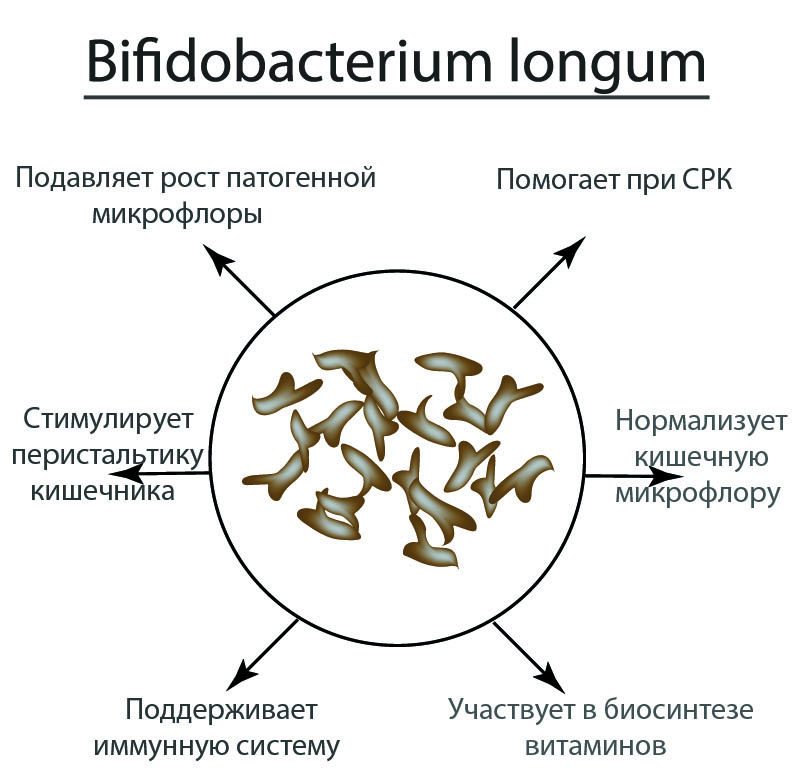 Природа 502, 96–99. ( 10.1038/nature12503) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Природа 502, 96–99. ( 10.1038/nature12503) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Ferreyra JA, Wu KJ, Hryckowian AJ, Bouley DM, Weimer BC, Sonnenburg JL. 2014. Сукцинат, продуцируемый кишечной микробиотой, способствует инфицированию C. difficile после лечения антибиотиками или нарушения моторики. Клеточный микроб-хозяин 16, 770–777. ( 10.1016/j.chom.2014.11.003) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
60. Кертис М.М., Ху З., Климко С., Нараянан С., Деберардинис Р., Сперандио В. 2014. Комменсал кишечника Bacteroides thetaiotaomicron усугубляет кишечную инфекцию за счет изменения метаболического ландшафта. Клеточный микроб-хозяин 16, 759–769. (10.1016/j.chom.2014.11.005) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Pham NT, Lawley TD. 2014. Использование патогенами кишечной пищевой сети. Клеточный микроб-хозяин 16, 703–705. ( 10.1016/j.chom.2014.11.012) [PubMed] [CrossRef] [Google Scholar]
62. Пачеко А.Р., Кертис М.М., Ричи Дж.М., Мунера Д., Уолдор М.К., Морейра К.Г., Сперандио В. 2012. Восприятие фукозы регулирует бактериальную колонизацию кишечника. Природа 492, 113–117. ( 10.1038/nature11623) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Пачеко А.Р., Кертис М.М., Ричи Дж.М., Мунера Д., Уолдор М.К., Морейра К.Г., Сперандио В. 2012. Восприятие фукозы регулирует бактериальную колонизацию кишечника. Природа 492, 113–117. ( 10.1038/nature11623) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Гил Дж.Л., Зорг Дж.А., Соненшайн А.Л., Чжу Дж. 2010. Метаболизм солей желчных кислот у мышей влияет на прорастание спор у Clostridium difficile . ПЛОС ОДИН 5, e8740 ( 10.1371/journal.pone.0008740) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Maier L, Barthel M, Stecher B, Maier RJ, Gunn JS, Hardt WD. 2014. Salmonella Typhimurium штамму ATCC14028 требуются h3-гидрогеназы для роста в кишечнике, но не в системных участках. ПЛОС ОДИН 9, e110187 (10.1371/journal.pone.0110187) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Bertin Y, Girardeau JP, Chaucheyras-Durand F, Lyan B, Pujos-Guillot E, Харел Дж., Мартин С. 2011. Энтерогеморрагическая Escherichia coli получает конкурентное преимущество за счет использования этаноламина в качестве источника азота в содержимом кишечника крупного рогатого скота. Окружающая среда. микробиол. 13, 365–377. ( 10.1111/j.1462-2920.2010.02334.x) [PubMed] [CrossRef] [Google Scholar]
Окружающая среда. микробиол. 13, 365–377. ( 10.1111/j.1462-2920.2010.02334.x) [PubMed] [CrossRef] [Google Scholar]
66. Kendall MM, Gruber CC, Parker CT, Sperandio V. 2012. Этаноламин контролирует экспрессию генов, кодирующих компоненты, участвующие в межцарственной передаче сигналов и вирулентности в энтерогеморрагической Escherichia coli O157:H7. mBio 3, e00050-12. ( 10.1128/mBio.00050-12) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Thiennimitr P, et al. 2011. Воспаление кишечника позволяет Salmonella использовать этаноламин для конкуренции с микробиотой. проц. Натл акад. науч. США 108, 17 480–17 485. ( 10.1073/pnas.1107857108) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Джозеф Б., Пжибилла К., Штулер С., Шауэр К., Слагуис Дж., Фукс Т.М., Гебель В. 2006. Идентификация генов Listeria monocytogenes , способствующих внутриклеточной репликации, путем определения профиля экспрессии и скрининга мутантов. Дж. Бактериол. 188, 556–568. (10.1128/JB.188.2.556-568.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Бактериол. 188, 556–568. (10.1128/JB.188.2.556-568.2006) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Everard A, et al. 2013. Взаимодействия между Akkermansia muciniphila и кишечным эпителием контролируют вызванное диетой ожирение. проц. Натл акад. науч. США 110, 9066–9071. ( 10.1073/pnas.1219451110) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Schneeberger M, Everard A, Gomez-Valades AG, Matamoros S, Ramirez S, Delzenne NM, Gomis R, Claret М, Кани ПД. 2015. Akkermansia muciniphila обратно коррелирует с началом воспаления, изменением метаболизма жировой ткани и метаболическими нарушениями при ожирении у мышей. науч. Респ. 5, 16643 ( 10.1038/srep16643) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Ганеш Б.П., Клопфляйш Р., Ло Г., Блаут М. 2013. Комменсал Akkermansia muciniphila усугубляет воспаление кишечника у гнотобиотических мышей, инфицированных Salmonella Typhimurium. ПЛОС ОДИН 8, e74963 (10.1371/journal.pone.0074963) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ПЛОС ОДИН 8, e74963 (10.1371/journal.pone.0074963) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Carvalho FA, et al. 2012. Временная неспособность управлять протеобактериями способствует хроническому воспалению кишечника у мышей с дефицитом TLR5. Клеточный микроб-хозяин 12, 139–152. ( 10.1016/j.chom.2012.07.004) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Chassaing B, Koren O, Carvalho FA, Ley RE, Gewirtz AT. 2014. Патобионт AIEC вызывает хронический колит у восприимчивых хозяев, изменяя состав микробиоты. кишки 63, 1069–1080. ( 10.1136/gutjnl-2013-304909) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Vayssier-Taussat M, et al. 2014. Сдвиг парадигмы с патогенов на патобиом: новые концепции в свете метаомики. Фронт. Заражение клетки. микробиол. 4, 29 ( 10.3389/fcimb.2014.00029) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
75. Камдар К. и др. 2016. Генетические и метаболические сигналы во время острой кишечной бактериальной инфекции изменяют микробиоту и приводят к прогрессированию хронического воспалительного заболевания.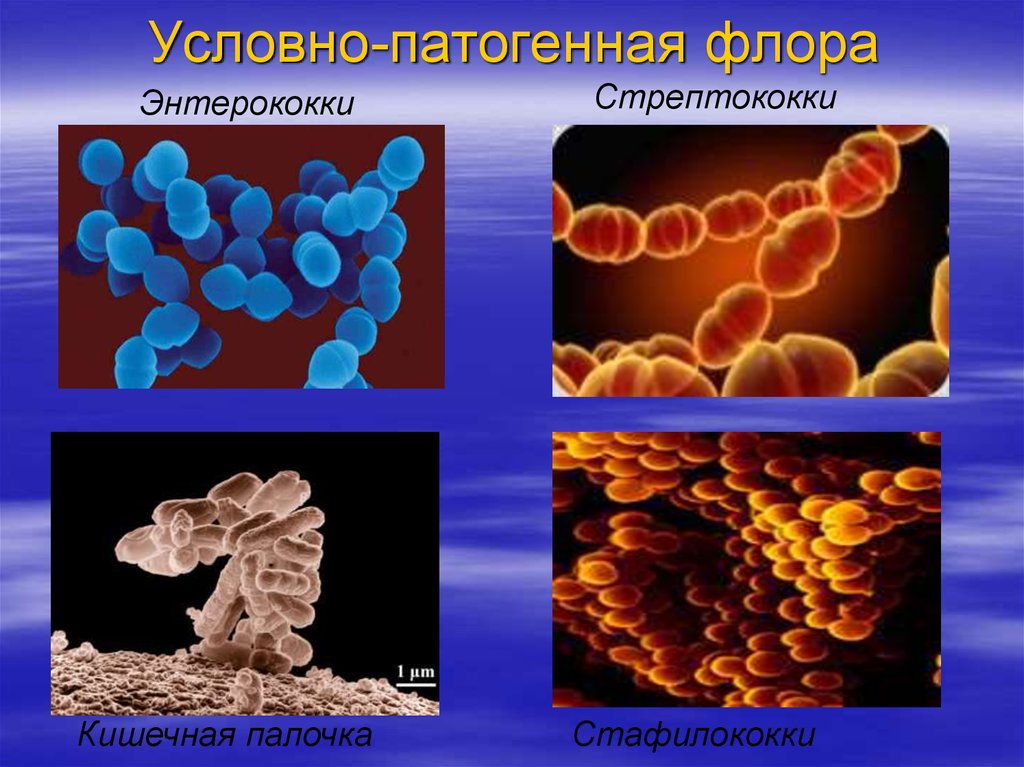 Клеточный микроб-хозяин 19, 21–31. ( 10.1016/j.chom.2015.12.006) [бесплатная статья PMC][PubMed][CrossRef][Google Scholar]
Клеточный микроб-хозяин 19, 21–31. ( 10.1016/j.chom.2015.12.006) [бесплатная статья PMC][PubMed][CrossRef][Google Scholar]
76. Гарсин Д.А. 2010. Утилизация этаноламина бактериальными патогенами: роль и регуляция. Нац. Преподобный Микробиолог. 8, 290–295. ( 10.1038/nrmicro2334) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
77. Корбел Дж.О., Доеркс Т., Дженсен Л.Дж., Перес-Иратксета С., Качановски С., Хупер С.Д., Андраде М.А., Борк П. 2005. Систематическая ассоциация генов с фенотипами путем анализа генома и литературы. PLoS биол. 3, e134 (10.1371/journal.pbio.0030134) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Fabich AJ, et al. 2008. Сравнение углеродного питания патогенных и комменсальных штаммов Escherichia coli в кишечнике мышей. Заразить. Иммун. 76, 1143–1152. ( 10.1128/IAI.01386-07) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Ле Бугенек К., Шулер К. 2011. Сахарный обмен, дополнительный фактор вирулентности энтеробактерий. Междунар. Дж. Мед. микробиол. 301, 1–6. ( 10.1016/j.ijmm.2010.04.021) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Междунар. Дж. Мед. микробиол. 301, 1–6. ( 10.1016/j.ijmm.2010.04.021) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Саха Р., Саха Н., Донофрио Р.С., Бестервельт Л.Л. 2013. Микробные сидерофоры: мини-обзор. J. Основная микробиол. 53, 303–317. ( 10.1002/jobm.201100552) [PubMed] [CrossRef] [Google Scholar]
81. Fischbach MA, Lin H, Liu DR, Walsh CT. 2006. Как патогенные бактерии избегают саботажа млекопитающих в битве за железо. Нац. хим. биол. 2, 132–138. ( 10.1038/nchembio771) [PubMed] [CrossRef] [Google Scholar]
82. Сингх В., Йеох Б.С., Сяо Х., Кумар М., Бахман М., Боррегаард Н., Джо Б., Виджай-Кумар М. 2015. Взаимодействие между энтеробактином, миелопероксидазой и липокалином 2 регулирует выживание E. coli в воспаленном кишечнике. Нац. коммун. 6, 7113 (10.1038/ncomms8113) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Rivera-Chavez F, et al. 2013. Salmonella использует энергетические такси, чтобы помочь при воспалении кишечника. PLoS Патог. 9, e1003267 ( 10.1371/journal.ppat.1003267) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS Патог. 9, e1003267 ( 10.1371/journal.ppat.1003267) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Винтер С.Э. и др. 2010. Воспаление кишечника обеспечивает дыхательный акцептор электронов для Salmonella . Природа 467, 426–429. ( 10.1038/nature09415) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Winter SE, et al. 2013. Нитраты хозяина стимулируют рост E. coli в воспаленном кишечнике. Наука 339, 708–711. ( 10.1126/science.1232467) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Lupp C, Robertson ML, Wickham ME, Sekirov I, Champion OL, Gaynor EC, Finlay BB. 2007. Опосредованное хозяином воспаление нарушает кишечную микробиоту и способствует чрезмерному росту Enterobacteriaceae. Клеточный микроб-хозяин 2, 204 (10.1016/j.chom.2007.08.002) [PubMed] [CrossRef] [Google Scholar]
87. Darfeuille-Michaud A, et al. 2004. Высокая распространенность адгезивно-инвазивной Escherichia coli , связанная со слизистой оболочкой подвздошной кишки при болезни Крона. Гастроэнтерология 127, 412–421. ( 10.1053/j.gastro.2004.04.061) [PubMed] [CrossRef] [Google Scholar]
Гастроэнтерология 127, 412–421. ( 10.1053/j.gastro.2004.04.061) [PubMed] [CrossRef] [Google Scholar]
88. Chassaing B, Darfeuille-Michaud A. 2011. Комменсальная микробиота и энтеропатогены в патогенезе воспалительных заболеваний кишечника. Гастроэнтерология 140, 1720–1728 гг. ( 10.1053/j.gastro.2011.01.054) [PubMed] [CrossRef] [Google Scholar]
89. Nash JH, et al. 2010. Последовательность генома адгезивно-инвазивной Escherichia coli и сравнительный геномный анализ с другими патотипами E. coli . Геномика BMC 11, 667 (10.1186/1471-2164-11-667) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
90. Miquel S, et al. 2010. Полная последовательность генома ассоциированного с болезнью Крона адгезивно-инвазивного штамма E. coli LF82. ПЛОС ОДИН 5, e12714 ( 10.1371/journal.pone.0012714) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Wu L, et al. 2005. Распознавание иммунной активации хозяина Pseudomonas aeruginosa . Наука 309, 774–777. ( 10.1126/science.1112422) [PubMed] [CrossRef] [Google Scholar]
Наука 309, 774–777. ( 10.1126/science.1112422) [PubMed] [CrossRef] [Google Scholar]
92. Unterweger D, Miyata ST, Bachmann V, Brooks TM, Mullins T, Kostiuk B, Provenzano D, Pukatzki S. 2014. Система секреции Vibrio cholerae типа VI использует различные эффекторные модули для внутривидовой конкуренции. Нац. коммун. 5, 3549 ( 10.1038/ncomms4549) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Макинтайр Д.Л., Мията С.Т., Китаока М., Пукатцки С. 2010. Система секреции Vibrio cholerae типа VI обладает антимикробными свойствами. проц. Натл акад. науч. США 107, 19 520–19 524. (10.1073/pnas.1012931107) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Patankar CV, Joshi LM. 1985. Производство бактериоцина у Salmonella . Дж. Постград. Мед. 31, 46–51. [PubMed] [Google Scholar]
95. Sousa MA, Mendes EN, Apolonio AC, Farias Lde M, Magalhaes PP. 2010. Производство бактериоцина на Shigella sonnei , выделенная из фекалий детей с острой диареей. АПМИС 118, 125–135. ( 10.1111/j.1600-0463.2009.02570.x) [PubMed] [CrossRef] [Google Scholar]
АПМИС 118, 125–135. ( 10.1111/j.1600-0463.2009.02570.x) [PubMed] [CrossRef] [Google Scholar]
96. Хорак В. 1994. Семьдесят типов колицинов Shigella sonnei и индикаторная система для их определения. Центральный бл. Бактериол. 281, 24–29. ( 10.1016/S0934-8840(11)80633-X) [PubMed] [CrossRef] [Google Scholar]
97. Kaewklom S, Samosornsuk S, Pipatsatitpong D, Aunpad R. 2013. Колицин типа 7 вырабатывается большинством из Shigella sonnei , выделенная от тайских пациентов с диареей. Браз. Дж. Микробиол. 44, 731–736. ( 10.1590/S1517-83822013000300010) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
98. Smajs D, Pilsl H, Braun V. 1997. Колицин U, новый колицин, продуцируемый Shigella boydii . Дж. Бактериол. 179, 4919–4928. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Padilla C, Lobos O, Brevis P, Abaca P, Hubert E. 2006. Плазмид-опосредованная продукция бактериоцина Shigella flexneri , выделенные из дизентерийной диареи, и их трансформация в Escherichia coli .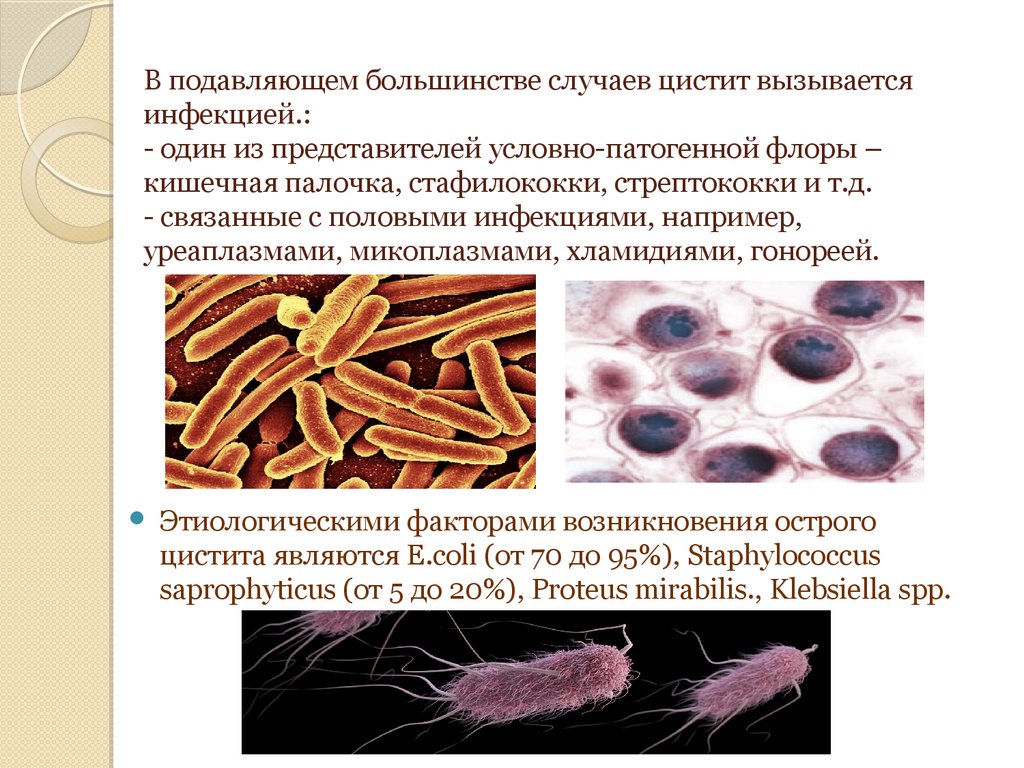 лат. заявл. микробиол. 42, 300–303. ( 10.1111/j.1472-765X.2005.01829.x) [PubMed] [CrossRef] [Google Scholar]
лат. заявл. микробиол. 42, 300–303. ( 10.1111/j.1472-765X.2005.01829.x) [PubMed] [CrossRef] [Google Scholar]
100. Belizario JE, Napolitano M. 2015. Микробиомы человека и их роль в дисбактериозе, распространенных заболеваниях и новых терапевтических подходах. Фронт. микробиол. 6, 1050 ( 10.3389/fmicb.2015.01050) [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
101. van Nood E, et al. 2013. Дуоденальное вливание донорского кала при рецидивах Clostridium difficile . Н. англ. Дж. Мед. 368, 407–415. (10.1056/NEJMoa1205037) [PubMed] [CrossRef] [Google Scholar]
102. Cotter PD, Ross RP, Hill C. 2013. Бактериоцины — жизнеспособная альтернатива антибиотикам? Нац. Преподобный Микробиолог. 11, 95–105. (10.1038/nrmicro2937) [PubMed] [CrossRef] [Google Scholar]
103. Rea MC, et al. 2011. Влияние противомикробных препаратов широкого и узкого спектра действия на Clostridium difficile и микробное разнообразие в модели дистального отдела толстой кишки.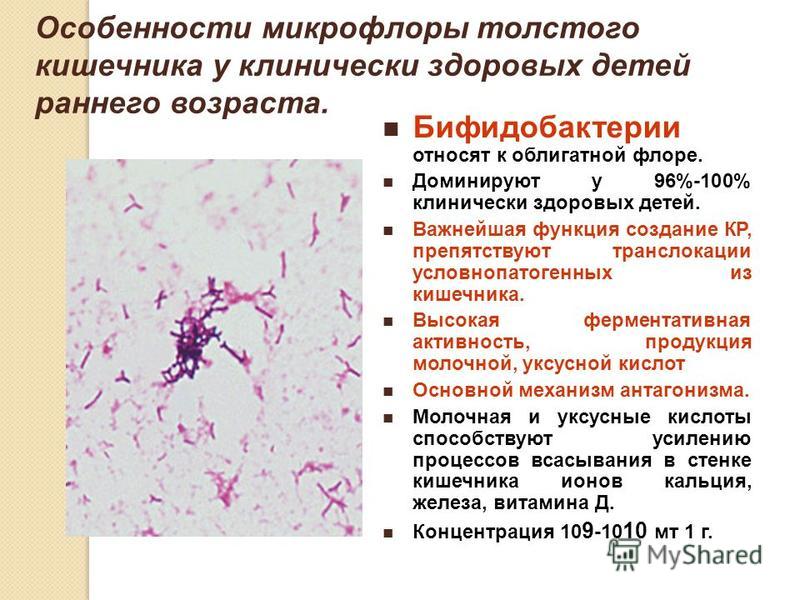 проц. Натл акад. науч. США 108 (Приложение 1), 4639–4644. ( 10.1073/pnas.1001224107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл акад. науч. США 108 (Приложение 1), 4639–4644. ( 10.1073/pnas.1001224107) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
104. Corr SC, Li Y, Riedel CU, O'Toole PW, Hill C, Gahan CG. 2007. Продукция бактериоцина как механизм противоинфекционной активности Lactobacillus salivarius UCC118. проц. Натл акад. науч. США 104, 7617–7621. ( 10.1073/pnas.0700440104) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
105. Коскелла Б., Миден С. 2013. Понимание специфичности бактериофагов в природных микробных сообществах. Вирусы 5, 806–823. ( 10.3390/v5030806) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
106. Сулаквелидзе А., Алавидзе З., Моррис Дж. Г. мл. 2001. Бактериофаговая терапия. Антимикроб. Агенты Чемотер. 45, 649–659. (10.1128/AAC.45.3.649-659.2001) [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
107. Abedon ST. 2014. Фаготерапия: экофизиологическая фармакология. Научная 2014, 581639( 10.