2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
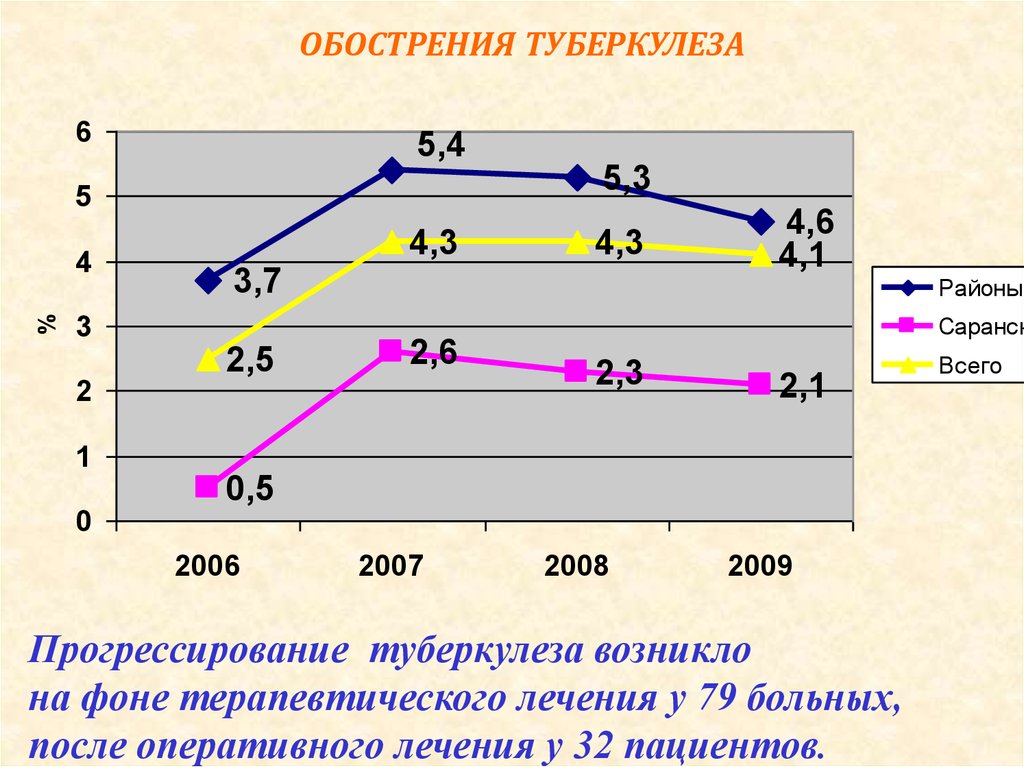
Характерной особенностью последних десятилетий является увеличение частоты рецидивов туберкулеза как после терапевтического, так и после хирургического лечения [1, 2, 5, 8, 13]. Многие хирурги связывали это в первую очередь с увеличением частоты лекарственной устойчивости микобактерий туберкулеза [3, 6, 20, 21].
Несмотря на все возрастающую роль хирургии в лечении легочного туберкулеза и ее высокую непосредственную эффективность, проблема послеоперационных рецидивов туберкулеза остается серьезным сдерживающим фактором на пути ее широкого применения. Частота послеоперационных рецидивов, по данным изученной нами литературы, составляет в среднем 5,7% и имеет в последние годы тенденцию к увеличению.
Эффективность консервативного лечения послеоперационных реактиваций туберкулеза, по данным большинства авторов, невелика [6-8, 13-15, 18, 25, 26]. Согласно публикации В.Д. Ямпольской [26], интенсивным консервативным лечением удалось излечить только 7 из 23 послеоперационных реактиваций туберкулеза (30%). По данным В.А. Краснова [13], успешным консервативное лечение было лишь у 36% из 590 больных с послеоперационными рецидивами. Из опыта А.В. Елькина и соавт. [8] при лечении 241 пациента с послеоперационными реактивациями лишь в 78 (32%) случаях достигнут клинический эффект.
Закономерным следствием низкой эффективности химиотерапии послеоперационных рецидивов туберкулеза является высокая хирургическая активность (до 94,8%) у этой категории больных [16]. Проанализировав данные 9 публикаций [4-6, 8, 10, 16, 21, 26, 28] о частоте использования хирургических методов в лечении послеоперационных реактиваций туберкулеза (1684 случая), мы подсчитали, что повторное хирургическое лечение проведено 903 (53,6%) больным из их числа.
Чаще всего в лечении послеоперационных рецидивов туберкулеза используются такие оперативные вмешательства, как пневмонэктомия (удаление ранее резецированного легкого) и экстраплевральная торакопластика (табл. 1). Обобщив литературные публикации 18 авторов о хирургическом лечении 1723 пациентов с рецидивами туберкулеза, мы подсчитали, что до удаления легкого у половины оперированных (50%) были выполнены экстраплевральная торакопластика - у 371 (21,5%), резекции ранее оперированного или противоположного легкого - у 275 (15,9%) и кавернопластики - у 230 (13,3%) [3, 5-9, 11-13, 15, 18, 21-23, 26, 28], другие виды операций - лишь в 6,6% случаев.
1). Обобщив литературные публикации 18 авторов о хирургическом лечении 1723 пациентов с рецидивами туберкулеза, мы подсчитали, что до удаления легкого у половины оперированных (50%) были выполнены экстраплевральная торакопластика - у 371 (21,5%), резекции ранее оперированного или противоположного легкого - у 275 (15,9%) и кавернопластики - у 230 (13,3%) [3, 5-9, 11-13, 15, 18, 21-23, 26, 28], другие виды операций - лишь в 6,6% случаев.
В целом ререзекции применяются по поводу рецидивов туберкулеза крайне редко. Нами найдено лишь 6 публикаций [8, 11, 13, 18, 22, 27] за последние три десятилетия, в которых приводились результаты этих операций раздельно от других повторных операций (табл. 2) и описывались в общей сложности последствия 70 ререзекций. Однако суммарное число этих вмешательств, скорее всего, еще меньше, поскольку при описании наибольших групп этих операций в разные годы сотрудниками Санкт-Петербургского НИИ фтизиопульмонологии (Ю.М. Репин - 30 случаев [18], А. В. Елькин и соавт. - 26 случаев [8]) в последней публикации, обобщающей материал с 1989 по 2001 г., по видимому, частично включены и больные, описанные в 1994 г. [18].
В. Елькин и соавт. - 26 случаев [8]) в последней публикации, обобщающей материал с 1989 по 2001 г., по видимому, частично включены и больные, описанные в 1994 г. [18].
Частота послеоперационных осложнений повторных резекций легких у больных туберкулезом, по данным доступной литературы, составляет в среднем 43%, а послеоперационная летальность - 4,3%, что намного превышает уровень осложнений и летальности первичных резекций легких по поводу туберкулеза.
Непосредственная эффективность всех хирургических методов лечения послеоперационных рецидивов туберкулеза в большинстве статистик остается невысокой (от 60 до 88%, а в отдаленном периоде она снижается до 50-72%) [8, 11, 13, 17, 18] при большой послеоперационной летальности (в среднем 9%) и летальности в отдаленный период до 25% и более [5-8, 12].
В литературе подчеркивается высокий травматизм повторных радикальных операций (большая кровопотеря, длительность операции), высокий риск интраоперационных осложнений (до 58%) [14] и, в частности, ранений крупных сосудов (в среднем 13,7% случаев). Радикальные резекционные операции, в том числе и ререзекции, сопровождаются высоким риском смерти во время операции от кровотечения (до 16%) [14].
Радикальные резекционные операции, в том числе и ререзекции, сопровождаются высоким риском смерти во время операции от кровотечения (до 16%) [14].
Материалом для настоящего исследования послужили повторные резекции легких по поводу послеоперационного рецидива туберкулеза в оперированном легком у 50 больных, выполненные первым автором этой статьи c 2004 по 2011 г. в клинике фтизиопульмонологии ГБОУ ВПО "Первый МГМУ им. И.М. Сеченова" и ФГБУ ЦНИИТ РАН. Были прооперированы 28 мужчин и 22 женщины в возрасте от 15 до 67 лет: 10% из них в возрасте до 18 лет,
30% - от 19 до 29 лет, 32% - от 30 до 39 лет и
28% - старше 40 лет. У всех больных до операции был установлен рецидив туберкулеза легких.
Анализ распространенности основного процесса в легком по сегментам показал, что при деструктивных процессах чаще всего поражалось 5 и более сегментов. Размеры каверн в большинстве случаев составляли от 2 до 4 см. Лишь у 8% пациентов размеры деструкции в легком превышали 6 см. Двустороннее поражение легких было у 24 (48%) больных, в том числе деструктивные формы - у 6 (12%).
Двустороннее поражение легких было у 24 (48%) больных, в том числе деструктивные формы - у 6 (12%).
Бациллярным на момент операции был 41 (82%) пациент. Данные о лекарственной чувствительности микобактерий туберкулеза (МБТ) к антибактериальным препаратам были получены в 34 (68%) случаях, о множественной и экстремальной лекарственной устойчивости - в 21 (42%) и 8 (16%) случаях соответственно.
Легочный процесс осложнялся у 40 (80%) больных. Самым частым осложнением была дыхательная недостаточность (35 случаев), реже отмечались эмпиема плевры (9), легочное кровотечение (4), кахексия (7). У 39 (78%) пациентов имелись сопутствующие заболевания (101 случай различной патологии), наиболее частыми среди них были: сердечно-сосудистая патология (а именно легочное сердце), нарушения сердечного ритма и миокардиодистрофия, хронические обструктивные заболевания легких.
При фибробронхоскопии изменения выявлены в 11 (22%) случаях: дренажный гнойный эндобронхит и рубцовый стеноз главного бронха (по одному случаю), туберкулез бронхов (2), диффузный хронический эндобронхит (6), микрофистула культи бронха после первичной операции (1).
После резекций легкого в отдаленный период показания к повторной резекции на стороне предшествующей операции чаще всего возникают при послеоперационных рецидивах деструктивного туберкулеза легких ограниченной распространенности без очаговой диссеминации и вне основной зоны поражения, не имеющих тенденции к закрытию полостей распада и абациллированию на фоне достаточно длительной (4-6 мес) химиотерапии. Дополнительными доводами в пользу операции в подобной ситуации является наличие множественной или широкой лекарственной устойчивости МБТ, а также непереносимости химиотерапии.
Наиболее частым показанием к ререзекции у наших больных был фиброзно-кавернозный туберкулез оперированного легкого (48%), причем часто при наличии очагового обсеменения остающихся отделов легкого к ререзекции приходилось прибегать вынужденно из-за низких функциональных резервов организма и поражения контралатерального легкого. Объемом ререзекций у больных ФКТ являются комбинированные резекции, лоб- и билобэктомии, требующие в послеоперационном периоде применения методов коррекции гемиторакса из-за малого объема остающейся легочной ткани и наличия очаговых изменений.
Более редким показанием для ререзекции легкого у наших больных служил кавернозный туберкулез оперированного легкого (16% оперированных). Все пациенты с этой формой туберкулеза лечились по поводу послеоперационного рецидива в терапевтических отделениях от 5 мес до 8 лет, в том числе четверо (50%) - с применением пневмоперитонеума, в 7 из 8 случаев срок консервативного лечения превысил 8 мес. Наиболее часто при рецидиве кавернозного туберкулеза выполнялись анатомические резекции легких.
На нашем опыте туберкулемы с распадом послужили показанием к выполнению ререзекций легкого у 24% больных. При этой форме туберкулеза во многих случаях оказались возможны атипичные ререзекции легкого небольшого объема, однако при множественных туберкулемах объем операции мог доходить до обширных комбинированных ререзекций. Более редким показанием к ререзекции явился цирротический туберкулез (1 случай, 2%) и эмпиема плевры или ложная каверна (5 случаев, 10%). При наличии эмпиемы плевры этим больным чаще
выполняются комбинированные ререзекции легких с плеврэктомией, плевролоб- и плевробилобэктомия, реже плеврэктомия с частичной ререзекцией легкого.
Особо следует подчеркнуть, что подавляющее большинство наших больных (66%) получали консервативное лечение по поводу послеоперационного рецидива в течение 12 и более месяцев без положительной клинико-рентгенологической динамики, а большинство даже с отрицательной динамикой. Столь длительная химиотерапия при резектабельном процессе только ухудшает прогноз хирургического лечения за счет усиления лекарственной устойчивости.
Среди первичных операций, после которых были выполнены ререзекции, отмечены атипичные (29 случаев), сегментарные анатомические (4) и комбинированные (7) резекции легкого, а также лоб- и билобэктомия (9 и 1 случай соответственно).
Авторами статьи было выполнено 85 операций 50 пациентам, включая резекции противоположного легкого при двусторонних процессах (2 случая), отсроченные корригирующие торакопластики (29) и повторные операции по поводу послеоперационных осложнений ререзекций (4). У 13 больных повторная резекция легкого сочеталась с плеврэктомией и декортикацией легкого.
Объем повторной резекции легкого в большинстве случаев был значительным. У 24 больных
выполнены комбинированные резекции, в том числе объемом более доли у 11 оперированных. Лобэктомия произведена в 1 случае, анатомические полисегментарные ререзекции - в 8, а частичные атипичные ререзекции - только в 17 (34%) случаях.
У 47 (94%) пациентов, с учетом большого объема произведенных резекций и высокого риска повторного рецидива, применены различные способы коррекции объема гемиторакса, в том числе торакопластика отсроченная (у 29), предшествующая (у 4), на противоположной стороне (у 1), а также одномоментное перемещение диафрагмы с ререзекцией (у 1), одномоментный экстраплевральный пневмолиз с пломбировкой (у 1), френикотрипсия (у 3) и пневмоперитонеум у 39, причем последний часто сочетался с другими методами уменьшения объема плевральной полости.
Из 85 операций, выполненных 50 нашим пациентам, 61 произведена из минидоступа с применением видеоторакоскопии. При этом для прошивания легочной ткани использовался сшиватель органов для малоинвазивной хирургии, разработанный проф. Д.Б. Гиллером совместно с фирмой "Уникон" (Россия). Примером подобной операции может служить наблюдение повторной резекции после ранее произведенной нижней лобэктомии слева (рис. 1-4).
При этом для прошивания легочной ткани использовался сшиватель органов для малоинвазивной хирургии, разработанный проф. Д.Б. Гиллером совместно с фирмой "Уникон" (Россия). Примером подобной операции может служить наблюдение повторной резекции после ранее произведенной нижней лобэктомии слева (рис. 1-4).
При выполнении 50 повторных резекций легкого у 50 пациентов мы обнаружили плевральные сращения во всех случаях, при этом в 2 (4%) они были ограниченными, в 13 (26%) субтотальными (более 1/2 поверхности плевральной полости) и в 35 (70%) тотальными. Длительность операции составила в среднем 220,7 мин, средняя интраоперационная кровопотеря - 346,6 мл. Гемотрансфузий удалось избежать у всех больных.
Интраоперационные осложнения отмечены у
7 (14%) пациентов, в том числе вскрытие полости эмпиемы и скальпированные ранения легкого по
2 случая, вскрытие прикультевого абсцесса, ранение v. azygas и разрыв мембранозной части трахеи перераздутой манжеткой интубационной трубки - по
1 случаю.
В послеоперационном периоде у 5 (10%) больных развились осложнения, в том числе (по одному случаю) раннее, позднее интраплевральные кровотечения, эмпиема с бронхиальным свищом, остаточная плевральная полость и раневое осложнение. Эти послеоперационные осложнения были ликвидированы и послеоперационной летальности не отмечено. Все пациенты на момент выписки не выделяли МБТ в мокроте. Полный клинический эффект был достигнут в 48 (96%) случаях, 2 пациента были выписаны с кавернами в противоположном легком, отказавшись от операции на второй стороне.
Отдаленные результаты удалось проследить у
36 пациентов. Полный клинический эффект сохранялся в 35 (97,3%) случаях, реактивация туберкулеза отмечена в 1 (2,8%). Работали или учились в вузах
29 (80,6%) оперированных.
В доступной литературе нами найдено лишь
одно исследование, приводящее подробный анализ отдаленных результатов ререзекций легких у больных с рецидивами туберкулеза, с данными которого мы могли бы сравнить полученные нами результаты.
Согласно публикации А.В. Елькина и соавт. [8], после 26 ререзекций послеоперационные осложнения возникли в 11 (43,7%) случаях, умерли в стационаре 2 (7,7%) пациента. Непосредственная эффективность (87,5%) в отдаленном периоде снизилась до 50%. Реактивация туберкулеза произошла после ререзекций в 43% случаев, 2% оперированных умерли от туберкулеза в отдаленном периоде, а всего в срок до 5 лет погибли более 20% оперированных. Пятилетняя выживаемость у всей группы больных, по данным А.В. Елькина и соавт.,
составила 78,6% [8]. Сравнительно высокую эффективность операций в нашей серии больных
мы связываем с более частым использованием
различных методов уменьшения объема плевральной полости после повторных резекций легкого.
Коррекция объема гемиторакса при такого рода вмешательствах, по нашему мнению, показана во всех случаях и не была нами применена только у 3 пациентов, отказавшихся от корригирующей операции и имевших противопоказания (спаечный процесс в брюшной полости после абдоминальных операций) к наложению пневмоперитонеума. При резекции верхних отделов легких мы отдавали предпочтение отсроченным экстраплевральным торакопластикам, при резекции нижних отделов - френикотрипсии, перемещению диафрагмы или пневмоперитонеуму.
При резекции верхних отделов легких мы отдавали предпочтение отсроченным экстраплевральным торакопластикам, при резекции нижних отделов - френикотрипсии, перемещению диафрагмы или пневмоперитонеуму.
Таким образом, несмотря на большую тяжесть состояния пациентов, техническую сложность и более высокий хирургический риск повторных резекций, чем у коллапсохирургических и органоуносящих вмешательств, хорошие отдаленные результаты и высокая частота трудовой реабилитации оперированных убедительно доказывают преимущество выполнения повторных резекций легких при рецидивах туберкулеза в ранее резецированном легком.
24 марта в мире отмечают День борьбы с туберкулезом. Главный внештатный фтизиатр Минздрава России Ирина Васильева и главный фтизиатр департамента здравоохранения Москвы Михаил Синицын рассказали ТАСС о том, как заражаются инфекцией, как ее лечат и что делать, чтобы не заболеть.
"На самом деле туберкулез может поражать абсолютно любой орган, включая кожу. Исключение — волосы и ногти, — объясняет главный внештатный фтизиатр Минздрава России Ирина Васильева. — Но именно легочная форма — самая распространенная и самая опасная из-за своей заразности. На втором месте — лимфатические узлы, на третьем — костно-суставная система".
Туберкулез — это инфекционное заболевание. Туберкулезная палочка попадает в организм, начинает размножаться в одном из органов, поражая и разрушая его. Если не лечить болезнь, человек может прожить от нескольких месяцев до нескольких лет — все зависит от иммунитета больного.
Еще 100 лет назад от чахотки (именно так туберкулез называли в России) умирали и бедняки, и аристократы, и члены царской семьи. Среди жертв болезни великий князь Георгий Александрович — родной брат Николая II, Федор Достоевский, Антон Чехов, Франц Кафка, Борис Кустодиев, Илья Ильф и Вивьен Ли.
Сегодня, даже когда туберкулез научились лечить, им по-прежнему может заболеть каждый, но гораздо чаще он возникает у людей из неблагополучной среды, потому что низкое качество жизни и вредные привычки ослабляют иммунитет, который борется с туберкулезом.
Правда.
"Прививка БЦЖ (аббревиатура образована от имен создавших противотуберкулезную вакцину французских врачей Альбера Кальмета и Камиля Герена: Bacillus Calmette — Guérin, BCG), которую делают детям в роддоме после рождения и в семь лет, не защищает от инфицирования в общем, а позволяет не заболеть детям тяжелыми, смертельными формами туберкулеза, — говорит главный фтизиатр департамента здравоохранения Москвы Михаил Синицын. — Благодаря вакцинации дети в России болеют малыми формами, которые легко поддаются лечению, детская смертность от туберкулеза чрезвычайно низкая, а если и есть, то у непривитых детей. БЦЖ в настоящее время — единственная вакцина, которая позволяет обезопасить детей от туберкулеза, в том числе от смертельных его форм, таких как менингит".
Однако вакцины, которая защищала бы от болезни на 100% и позволяла вообще не заразиться ни одной из форм туберкулеза взрослым и детям, к сожалению, пока не существует.
Заражение в транспорте или другом общественном месте возможно.
"Туберкулез — это преимущественно воздушно-капельная инфекция, поэтому, например, если рядом кашляет больной человек, есть шанс подхватить инфекцию, — рассказывает Ирина Васильева. — Заразиться через посуду, предметы, контакты с вещами, которые трогал больной туберкулезом, нельзя".
Однако существует низкий риск при употреблении в пищу молока, взятого от больной коровы. Это случается очень редко, однако на всякий случай лучше кипятить домашнее молоко — кипячение убивает инфекцию.
Главная защита — это собственный иммунитет. Если он в хорошем состоянии, то вы можете даже не знать, что в организм попала микробактерия, — иммунная система просто заставит пройти ее "транзитом", не вызвав даже инфицирования. Если иммунитет слабый, инфекция может обосноваться в любом органе. Но и после этого только у одного из десяти заразившихся она будет развиваться, у девяти сработает иммунитет, и возбудитель будет находиться в спящем состоянии. Он может проснуться через 10, 20, 30 лет — когда организм будет ослаблен, а ослаблен он может быть разными факторами: стрессом, заболеваниями, длительной химиотерапией.
Так что главная защита — это здоровый образ жизни, отказ от вредных привычек, качественный полноценный сон и отдых, минимализация стрессов, правильное питание.
"Фактором риска заболеваемости туберкулезом служит алиментарная недостаточность, или — по-простому — голодание, — рассказывает Михаил Синицын. — Этот момент не учитывают люди, подвергающие себя изнурительным диетам без должного на то основания, осознанно доводя себя до крайней степени истощения".
Поначалу симптомов может и не быть, они начинают появляться постепенно.
"Сначала это ничем не объяснимая слабость, снижение аппетита, небольшая потеря веса, периодически возникающая ночная потливость и незначительно повышающаяся температура, — объясняет Ирина Васильева. — Потом может присоединиться кашель. Если он не проходит более трех недель, это повод обратиться к врачу и обследоваться, чтобы исключить туберкулез.
Легочное кровотечение или легочное кровохарканье — это уже симптом туберкулеза на поздней стадии; заметив его, нужно срочно обратиться к врачу для диагностики, поскольку кровохарканье — симптом и других серьезных заболеваний, и неотложного купирования кровохарканья и лечения ".
Больного заразной формой туберкулеза госпитализируют, чтобы у него не было контакта с домочадцами, а контактировавших с ним членов семьи, коллег по работе обследуют и при необходимости проводят им профилактическое лечение. Лиц из контакта — как правило это члены семьи — с признаками инфицированности (или латентного туберкулеза) наблюдают не менее года.
Туберкулез излечим. Но лечение длительное, сложное, требует четкого следования схеме.
"Самый современный метод — это противотуберкулезная лекарственная терапия, — рассказывает Ирина Васильева. — В самом простом случае лечение длится шесть месяцев, а в случае мультирезистентного туберкулеза — 24 месяца; больной в течении всего периода (20-24 месяца) ежедневно, без перерывов, должен принимать минимум четыре препарата, а при устойчивом туберкулезе шесть и семь (противотуберкулезные, антибактериальные препараты с противотуберкулезной активностью) — это большое количество таблеток, которые нередко вызывают побочные реакции, но лучшего метода лечения пока нет нигде в мире. Есть методы, дополняющие лекарственную терапию. В 10–15% случаев нужно хирургическое вмешательство, но все же основной метод — это лечение препаратами.
Есть методы, дополняющие лекарственную терапию. В 10–15% случаев нужно хирургическое вмешательство, но все же основной метод — это лечение препаратами.
После полного выздоровления риск рецидива туберкулезом высок лишь в первые два года. Однако туберкулез — это инфекционное заболевание, и возможность нового заражения сохраняется.
Беременность может вызвать развитие активного заболевания у инфицированной туберкулезом женщины, ухудшить состояние ее здоровья, но она не заражает ребенка, так как инфекция практически никогда не передается через плаценту (исключение — чрезвычайно редкая генерализированная форма туберкулеза у матери).
"Однако важно, отмечает Ирина Васильева, чтобы малыша оградили от прямого контакта с мамой, больной заразной формой туберкулеза ".
Профилактические обследования взрослого населения России проводят с разной частотой в зависимости от эпидемической ситуации в регионе.
Если она благополучная, как, например, в Центральном федеральном округе, тогда флюорографию проводят один раз в два года.
"Москва — один из самых безопасных по туберкулезу субъектов Российской Федерации, — говорит Михаил Синицын. — В 2018 году заболеваемость туберкулезом постоянных жителей достигла исторического минимума: 10 на 100 тыс. населения".
В тех регионах, где ситуация напряженная, например в Сибири, на Дальнем Востоке, Урале, флюорографию делают раз в год.
Этот вид обследования выявляет локальные формы туберкулеза.
В настоящее время в Москве начали применять также метод низкодозной компьютерной томографии вместо стандартной флюорографии. Этот метод несет низкую лучевую, то есть радиационную нагрузку, в отличие от обычной КТ, и является более точным, чем флюорография.
Для обследования наиболее подверженных заболеванию туберкулезом пациентов применяют иммунологические тесты: пробу Манту, диаскинтест (также безопасная кожная проба).
К таким группам относятся люди, контактировавшие с больным туберкулезом, ВИЧ-инфицированные лица, пациенты, получающие иммуносупрессорную терапию, страдающие хроническими заболеваниями легких.
Инфографика Статистика заболеваемости туберкулезом в России
Карина Салтыкова, Инна Финочка, Константин Крашенинников
Легкие Индия. 2015 ноябрь-декабрь; 32(6): 557–560.
doi: 10.4103/0970-2113.168113
, , 1 , 2 и 3
туберкулез легких (ТБ) — удобный способ оценить эффективность программ борьбы с ТБ и выявить уязвимых пациентов. В настоящем исследовании частота рецидивов туберкулеза и его предикторы определялись в Иране.
Это когортное ретроспективное исследование. Подходящими людьми были пациенты с положительным мазком ТБ, у которых был диагностирован с 2002 по 2011 год. Конец времени наблюдения был декабрь 2013 года. Количество людей, вошедших в когорту, составило 1271 человек. Для определения предикторов рецидива использовали многомерную логистическую регрессию. Анализ выполнен с использованием SPSS 20.
Для определения предикторов рецидива использовали многомерную логистическую регрессию. Анализ выполнен с использованием SPSS 20.
Частота рецидивов составила 8,3% и у 85,9% этих больных возникла в интервале времени 1-5 лет после успешного лечения. Частота рецидивов не была существенно связана с полом, возрастной группой и диабетом. Но она была значительно выше у пациентов, у которых оценка мазка мокроты до лечения была 2+ и выше, у пациентов с положительным мазком мокроты в конце второго месяца лечения, у пациентов, завершивших лечение, и у пациентов, которые были курильщиками (9).0029 P < 0,05).
Наше исследование показало, что у значительного процента больных туберкулезом легких с положительным мазком наблюдается рецидив, а у некоторых пациентов риск рецидива выше.
КЛЮЧЕВЫЕ СЛОВА: Заболеваемость, рецидив, рецидив, туберкулез
Туберкулез (ТБ) является одной из основных проблем здравоохранения во многих странах. Это заболевание остается основным источником заболеваемости и смертности во всем мире.[1,2,3,4] Рецидив ТБ относится к ситуации, когда пациент, который получал противотуберкулезные препараты в течение не менее 6 месяцев и у которого был проведен посев мазка или мокроты отрицательный результат в конце лечения, после успешного лечения снова развивается активный ТБ.[5,6,7]0029 Mycobacterium tuberculosis , вызванный тем же штаммом, что и при предыдущем эпизоде туберкулеза, известен как рецидив. Если рецидив ТБ не вызван тем же штаммом, что и предыдущий эпизод ТБ, это называется реинфекцией другим штаммом Mycobacterium tuberculosis . Исследования показали, что частота рецидивов в странах с низкой или средней заболеваемостью ТБ в основном связана с рецидивом того же штамма ТБ, которым больной был ранее инфицирован.[5,8,9]
Это заболевание остается основным источником заболеваемости и смертности во всем мире.[1,2,3,4] Рецидив ТБ относится к ситуации, когда пациент, который получал противотуберкулезные препараты в течение не менее 6 месяцев и у которого был проведен посев мазка или мокроты отрицательный результат в конце лечения, после успешного лечения снова развивается активный ТБ.[5,6,7]0029 Mycobacterium tuberculosis , вызванный тем же штаммом, что и при предыдущем эпизоде туберкулеза, известен как рецидив. Если рецидив ТБ не вызван тем же штаммом, что и предыдущий эпизод ТБ, это называется реинфекцией другим штаммом Mycobacterium tuberculosis . Исследования показали, что частота рецидивов в странах с низкой или средней заболеваемостью ТБ в основном связана с рецидивом того же штамма ТБ, которым больной был ранее инфицирован.[5,8,9]
Среди исследований, проведенных в разных странах. в мире сообщалось о различной частоте рецидивов. Врее и др. . во Вьетнаме показали, что у 21 из 244 (8,6%) пациентов возник рецидив заболевания через 1-2 года после успешного лечения [10]. Исследование, проведенное в южной части Эфиопии, показало, что у 15 из 368 (4,1%) больных туберкулезом с положительным мазком после успешного лечения возник рецидив заболевания.[11] В другом исследовании, проведенном Crofts и др. . в Англии и Уэльсе частота рецидивов составила 4,1 на 1000 человеко-лет [12].
Исследование, проведенное в южной части Эфиопии, показало, что у 15 из 368 (4,1%) больных туберкулезом с положительным мазком после успешного лечения возник рецидив заболевания.[11] В другом исследовании, проведенном Crofts и др. . в Англии и Уэльсе частота рецидивов составила 4,1 на 1000 человеко-лет [12].
Заболеваемость туберкулезом с положительным мазком в Иране составила 6,9-7,6 на 100 000 человек в период с 2005 по 2011 год. Заболеваемость легочным туберкулезом с положительным мазком в Мазандаране в 2009 году составила 4,3 на 100 000 человек [13,14]. В исследовании, проведенном Velayati et al . у пациентов с множественной лекарственной устойчивостью (МЛУ) ТБ у 23 из 65 пациентов с МЛУ ТБ (35%) возник рецидив.[15]
Изучение рецидивов ТБ у пациентов является удобным способом оценки эффективности программ борьбы с ТБ и выявления наиболее уязвимых пациентов. в Иране. Поэтому в этом исследовании частота рецидивов туберкулеза после успешного лечения и его предикторы определялись у больных туберкулезом с положительным мазком в провинции Мазандаран на севере Ирана.
Это исследование было ретроспективным когортным. Источником данных был отдел регистрации туберкулеза Министерства здравоохранения и медицинского образования, Шахрак-и-Гарб, Тегеран, Иран. Пациенты, за которыми наблюдали в этом исследовании, были больными ТБ с положительным мазком, гражданами Ирана, которые прошли 6-месячный период лечения противотуберкулезными препаратами и были зарегистрированы как пролеченные (которые либо вылечились, либо завершили лечение). Эти пациенты были диагностированы в период с 2002 по 2011 год. Конец наблюдения был в декабре 2013 года. В когорту были включены образцы из 1271 субъекта.
Чтобы сравнить демографические характеристики и переменные, изучаемые между группой с рецидивом и группой, у которой не было рецидива, для категориальных переменных использовали критерий хи-квадрат или точный критерий Фишера, а для непрерывные нормальные переменные. После однофакторного анализа для корректировки вмешивающихся факторов была использована многомерная логистическая регрессия. Все тесты были двусторонними, и учитывался значимый уровень менее 0,05. Анализ проводили с использованием SPSS 20 (SPSS Inc., Чикаго, Иллинойс).
Все тесты были двусторонними, и учитывался значимый уровень менее 0,05. Анализ проводили с использованием SPSS 20 (SPSS Inc., Чикаго, Иллинойс).
Настоящий проект одобрен заместителем по научной работе Керманского университета медицинских наук (шифр № 92-136). Имя и фамилия пациентов не были записаны в контрольном списке, и каждый пациент был идентифицирован по номеру.
Количество пациентов, наблюдавшихся в этом исследовании, составило 1271 человек, и большинство из них были мужчинами (56,2%). Средний возраст всех больных туберкулезом легких с положительным мазком в когорте составил 48,4 ± 20,7 года, средний возраст в группе с рецидивом — 48,2 ± 20,1 года, а средний возраст в группе без рецидива — 48,5 ± 20,7 года. Разница в возрасте между двумя группами не была статистически значимой ( Р = 0,9).
Из этих пациентов у 106 пациентов (8,3%) возник рецидив, из которых у 59 пациентов (55,7%) возник рецидив в течение 1-2 лет, у 32 пациентов (30,2%) в течение 3-5 лет и у 15 пациентов (14,2%). %) более чем через 5 лет после успешного лечения.
%) более чем через 5 лет после успешного лечения.
показывает, что частота рецидивов была выше у мужчин, чем у женщин (8,7% против 7,9%), а рецидивы в возрастной группе 15-34 лет были выше, чем в возрастной группе 35-54 лет (9,1% против 7,8%). и возрастная группа старше 55 лет (90,1% против 8,1%), а рецидивы у пациентов с диабетом были выше, чем у пациентов без диабета (9,2% против 8,2%). Но наблюдаемые различия не были значимыми при однофакторном анализе.
Распределение клинико-демографических характеристик больных туберкулезом с рецидивом и без рецидива
Открыть в отдельном окне
Частота рецидивов выше у больных с оценкой мазка мокроты 2+, 3+ и выше до лечения по сравнению с 1+ и 1-9бациллы (10,6% против 4,6%) у пациентов с положительным мазком мокроты в конце второго месяца лечения по сравнению с пациентами с отрицательным результатом мазка мокроты в конце второго месяца лечения (17,9% против 7,1%) , у пациентов с завершенным лечением по сравнению с вылеченными пациентами (17,4% против 6,8%) и у курильщиков по сравнению с некурящими (13,4% против 7,2%). Эти различия были статистически значимы при одномерном анализе [].
Эти различия были статистически значимы при одномерном анализе [].
Результаты многомерной логистической регрессии показали, что частота рецидивов выше у мужчин, чем у женщин, и выше у больных диабетом, чем у здоровых. Результаты для других переменных показаны на рис.
Многофакторная логистическая регрессия факторов, связанных с рецидивом, среди больных ТБ
Открыть в отдельном окне
Из 102 (8%) случаев легочного ТБ с положительным мазком и установленным статусом вируса иммунодефицита человека (ВИЧ) , только 12 (0,9%) были ВИЧ-позитивными. Эта переменная не использовалась в анализе из-за неизвестного ВИЧ-статуса большинства пациентов, вошедших в когорту.
Это исследование определило частоту рецидивов у больных легочным туберкулезом с положительным мазком и некоторые из его эффективных факторов. В этом исследовании 8,3% случаев легочного ТБ с положительным мазком имели рецидивы, и более половины рецидивов возникали в течение 1 года или 2 лет после успешного лечения. Частота рецидивов была выше у мужчин, в возрастной группе 15-34 лет, больных сахарным диабетом, курильщиков, пациентов с оценкой мазка мокроты 2+ или 3+ до лечения, пациентов с положительным мазком мокроты в конце второго месяца лечения. лечение, и пациенты с завершенным лечением (неизлеченные).
Частота рецидивов была выше у мужчин, в возрастной группе 15-34 лет, больных сахарным диабетом, курильщиков, пациентов с оценкой мазка мокроты 2+ или 3+ до лечения, пациентов с положительным мазком мокроты в конце второго месяца лечения. лечение, и пациенты с завершенным лечением (неизлеченные).
В ходе исследования в Кейптауне, Западный Кейп, Южная Африка, которое проводилось с целью изучения частоты рецидивов туберкулеза у пациентов после лечения, было обнаружено, что из 612 пациентов у 18% возник рецидив.[16] Частота рецидивов в вышеупомянутом исследовании была выше, чем в настоящей когорте. Одной из причин более высокой частоты рецидивов является более высокая заболеваемость туберкулезом легких с положительным мазком в Кейптауне (300 на 100 000 человек) по сравнению с 4,3 случая на 100 000 человек на севере Ирана [13,16] 9.0003
Другое исследование, проведенное в Каракалпакстане в Узбекистане на 118 больных туберкулезом легких, показало, что у 42 (36%) возник рецидив туберкулеза, а частота рецидивов у вылеченных больных составила 31%, а в группе, завершившей лечение, - 47%. [17 ] В ретроспективном когортном исследовании, проведенном во Вьетнаме, 1068 больных туберкулезом легких с положительным мазком наблюдались в течение 18 месяцев, и у 23 (2,1%) из них развился рецидив [18]. Зарегистрированная частота рецидивов ниже, чем в настоящем исследовании, и причина этой разницы, вероятно, связана с более коротким периодом наблюдения, чем в опубликованных исследованиях.
[17 ] В ретроспективном когортном исследовании, проведенном во Вьетнаме, 1068 больных туберкулезом легких с положительным мазком наблюдались в течение 18 месяцев, и у 23 (2,1%) из них развился рецидив [18]. Зарегистрированная частота рецидивов ниже, чем в настоящем исследовании, и причина этой разницы, вероятно, связана с более коротким периодом наблюдения, чем в опубликованных исследованиях.
В исследовании, проведенном в Йемене на 774 пациентах с легочным туберкулезом с положительным мазком, частота рецидивов составила 5,7%, или 44 случая, что больше, чем в настоящем исследовании. Многофакторная логистическая регрессия показала, что курение, наличие кариеса и диабета были связаны с рецидивом, но возраст и пол не имели значимой связи.[19] В исследовании, проведенном в Индии, в 2012 г. было обследовано 458 больных туберкулезом легких. Сообщалось, что у 66 (14,5%) пациентов был диабет, а частота рецидивов у пациентов с диабетом была выше, чем у пациентов без диабета.[20] Гондер и др. . показали, что у больных ТБ с диабетом наблюдались более неблагоприятные исходы лечения по сравнению с пациентами без диабета, а диабет увеличивает риск рецидива ТБ и смерти.[21]
. показали, что у больных ТБ с диабетом наблюдались более неблагоприятные исходы лечения по сравнению с пациентами без диабета, а диабет увеличивает риск рецидива ТБ и смерти.[21]
Курение считается одной из основных проблем общественного здравоохранения и известно как фактор риска легочного ТБ. В исследовании приняли участие 2025 больных туберкулезом легких (69,3% курящих и 30,3% некурящих). Частота рецидивов ТБ у курильщиков была выше, чем у некурящих (5% против 1%), и этот результат согласуется с результатами настоящего исследования.[22]
Одним из ограничений этого исследования было то, что тест на чувствительность к лекарственным средствам для выявления лекарственной устойчивости не проводился. Кроме того, мы не смогли отличить повторное заражение от рецидива. Но следует отметить, что около 86% повторных случаев имели рецидив в течение 1-5 лет после успешного лечения. Другим ограничением настоящего исследования было то, что оно не изучало взаимосвязь между частотой рецидивов и коинфекцией ВИЧ.
Это исследование показало, что у значительного процента пациентов с легочным ТБ с положительным мазком после успешного лечения возник рецидив ТБ. Кроме того, самыми сильными предикторами рецидива были курение, оценка мазка мокроты 2+ и 3+ до лечения, положительный результат мазка мокроты в конце второго месяца лечения и завершение лечения.
По результатам настоящего исследования рекомендуется исследовать мазок мокроты всех больных туберкулезом легких с положительным мазком в конце периода лечения, чтобы обеспечить излечение больных. Кроме того, необходимо более эффективно внедрять краткосрочный курс лечения под непосредственным наблюдением (ДОТС) у больных туберкулезом путем выбора мотивированных и преданных своему делу руководителей из числа медицинских работников. Также в случаях, когда результат мазка мокроты был положительным в конце второго месяца лечения, необходимо сделать антибиотикограмму противотуберкулезных препаратов с целью скорейшего применения соответствующих лечебных мероприятий.
Авторы выражают благодарность Керманскому университету медицинских наук за финансовую поддержку этого исследования.
Источник поддержки: Настоящее исследование было поддержано Керманским университетом медицинских наук (грант №: 92/136).
Конфликт интересов: Не заявлено.
1. Мусазаде М., Насехи М., Бахрампур А., Ханджани Н., Шарафи С., Ахмади С. Прогноз заболеваемости туберкулезом в Иране с использованием моделей Бокса-Дженкинса. Медицинский журнал Красного Полумесяца Ирана J. 2014;16:e11779. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Baker MA, Harries AD, Jeon CY, Hart JE, Kapur A, Lönnroth K, et al. Влияние диабета на результаты лечения туберкулеза: систематический обзор. БМС Мед. 2011;9:81. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Jimenez-Corona ME, Cruz-Hervert LP, García-García L, Ferreyra-Reyes L, Delgado-Sanchez, Bobadilla-del-Valle M, et al. Ассоциация диабета и туберкулеза: влияние на результаты лечения и после лечения. грудная клетка. 2013;68:214–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
грудная клетка. 2013;68:214–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Мусазаде М., Ханджани Н., Бахрампур А. Сезонность и временные колебания туберкулеза на севере Ирана. Танафос. 2013;12:35–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Millet JP, Shaw E, Orcau A, Casals M, Miró JM, Caylà JA. Барселонская рабочая группа по рецидивам туберкулеза. Рецидив туберкулеза после завершения лечения в европейском городе: реинфекция или рецидив? ПЛОС Один. 2013;8:e64898. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Kim L, Moonan PK, Yelk Woodruff RS, Kammerer JS, Haddad MB. Эпидемиология рецидивирующего туберкулеза в США, 1993-2010. Int J Tuberc Lung Dis. 2013;17:357–60. [PubMed] [Google Scholar]
7. Luzze H, Johnson DF, Dickman K, Mayanja-Kizza H, Okwera A, Eisenach K, et al. Туберкулезный научно-исследовательский отдел. Рецидив чаще, чем реинфекция, при рецидивирующем туберкулезе через 1-2 года после лечения в городах Уганды. Int J Tuberc Lung Dis. 2013;17:361–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2013;17:361–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Chang KC, Leung CC, Yew WW, Ho SC, Tam CM. Гнездовое исследование случай-контроль факторов риска раннего рецидива туберкулеза, связанных с лечением. Am J Respir Crit Care Med. 2004; 170:1124–30. [PubMed] [Академия Google]
9. Чанг К.С., Леунг К.С., Ю В.В., Чан С.Л., Там К.М. Схемы дозирования 6-месячных схем и рецидивов туберкулеза легких. Am J Respir Crit Care Med. 2006;15(174):1153–8. [PubMed] [Google Scholar]
10. Vree M, Huong NT, Duong BD, Sy DN, Van LN, Hung NV, et al. Выживаемость и частота рецидивов больных туберкулезом, успешно завершивших лечение во Вьетнаме. Int J Tuberc Lung Dis. 2007; 11: 392–7. [PubMed] [Google Scholar]
11. Датико Д.Г., Линдтьорн Б. Рецидив туберкулеза у пациентов с положительным мазком, вылеченных с помощью ДОТС в южной Эфиопии: ретроспективное когортное исследование. Общественное здравоохранение BMC. 2009 г.;9:348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Crofts JP, Andrews NJ, Barker RD, Delpech V, Abubakar I. Факторы риска рецидивирующего туберкулеза в Англии и Уэльсе, 1998–2005 гг. грудная клетка. 2010;65:310–4. [PubMed] [Google Scholar]
Crofts JP, Andrews NJ, Barker RD, Delpech V, Abubakar I. Факторы риска рецидивирующего туберкулеза в Англии и Уэльсе, 1998–2005 гг. грудная клетка. 2010;65:310–4. [PubMed] [Google Scholar]
13. Мусазаде М., Ханджани Н., Бахрампур А., Насехи М. Имеет ли туберкулез сезонный характер среди мигрантов, въезжающих в Иран? Int J Health Policy Manag. 2014;2:181–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Мусазаде М., Джамшиди М., Амиресмаили М., Незаммахаллех А. Сравнение стратегий терапии под непосредственным наблюдением и самостоятельного лечения туберкулеза легких: когортное исследование в к северу от Ирана. Ближний Восток J Sci Res. 2012; 11: 873–80. [Академия Google]
15. Велаяти А.А., Фарния П., Масджеди М.Р. Рецидив после успешного лечения туберкулеза легких с множественной лекарственной устойчивостью: предикация постоянным положительным результатом ПЦР. Int J Clin Exp Med. 2012;5:271–2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Verver S, Warren RM, Beyers N, Richardson M, van der Spuy GD, Borgdorff MW, et al. Частота повторного заражения туберкулезом после успешного лечения выше, чем частота нового туберкулеза. Am J Respir Crit Care Med. 2005; 171:1430–5. [PubMed] [Академия Google]
Verver S, Warren RM, Beyers N, Richardson M, van der Spuy GD, Borgdorff MW, et al. Частота повторного заражения туберкулезом после успешного лечения выше, чем частота нового туберкулеза. Am J Respir Crit Care Med. 2005; 171:1430–5. [PubMed] [Академия Google]
17. Cox H, Kebede Y, Allamuratov S, Ismailov G, Davletmuratova Z, Byrnes G, et al. Рецидив туберкулеза и смертность после успешного лечения: влияние лекарственной устойчивости. ПЛОС Мед. 2006;3:e384. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Huyen MN, Buu TN, Tiemersma E, Lan NT, Dung NH, Kremer K, et al. Рецидивы туберкулеза во Вьетнаме в значительной степени связаны с инфицированием микобактериями туберкулеза пекинского генотипа. J заразить дис. 2013; 207:1516–24. [PubMed] [Академия Google]
19. Anaam MS, Ibrahim MIM, Serouri AWA, Bassili A, Aldobhani A. Гнездовое исследование случай-контроль предикторов рецидива среди больных туберкулезом, получавших лечение в йеменской программе NTCP. ПОА. 2012;2:168–73. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Khanna A, Lohya S, Sharath BN, Harries AD. Характеристики и ответ на лечение у пациентов с туберкулезом и сахарным диабетом в Нью-Дели, Индия. ПОА. 2013; 3 (Приложение 1): S48–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Gounder S, Harries AD. Скрининг больных туберкулезом на сахарный диабет на Фиджи: заметки с мест. ПОА. 2012;2:145–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Przybylski G, Dabrowska A, Głda R, Gadzińska A, Trzcinska H. Анализ курительного табака больных туберкулезом – данные десятилетнего наблюдения в Областном центре пульмонологии в Быдгоще. Пшегль Лек. 2012;69:953–7. [PubMed] [Google Scholar]
5
8 2 и BMC Инфекционные заболевания том 20 , Номер статьи: 789 (2020) Процитировать эту статью
16 тыс. обращений
6 цитирований
3 Альтметрика
Сведения о показателях
Люди, успешно завершившие лечение от туберкулеза, по-прежнему подвержены повышенному риску рецидива заболевания в результате рецидива или повторного заражения.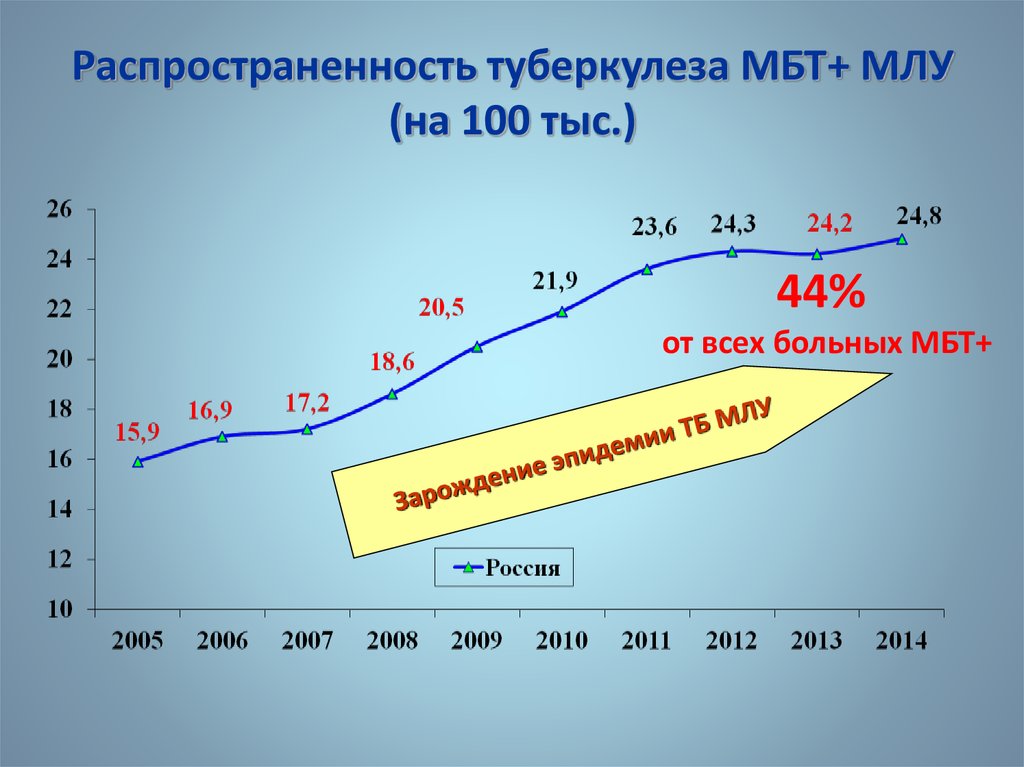 Выявление факторов риска рецидива туберкулеза может помочь нацелить посттуберкулезный скрининг и лечение.
Выявление факторов риска рецидива туберкулеза может помочь нацелить посттуберкулезный скрининг и лечение.
Мы зарегистрировали 500 пациентов с туберкулезом легких с положительным мазком в Южной Африке и собрали исходные данные о демографических характеристиках, клинической картине и культурах микобактерий мокроты для типирования микобактерий с вкраплениями из 24 локусов с повторяющимися единицами и переменным числом тандемных повторов (MIRU-VNTR). . Мы использовали регулярно собираемые административные данные для выявления рецидивов туберкулеза, возникающих в среднем в течение шести лет после успешного завершения лечения.
Из 500 первоначально включенных пациентов 333 (79%) успешно завершили лечение туберкулеза. В отдаленном периоде у 35 пациентов с успешным лечением (11%) возник бактериологически подтвержденный рецидив туберкулеза. В нашей модели пропорциональных рисков Кокса степень 3+ по КУМ в мазке мокроты была достоверно связана с рецидивом туберкулеза с коэффициентом риска 3,33 (95% ДИ 1,44–7,7). Присутствие поликлональной инфекции M.tuberculosis на исходном уровне имело коэффициент риска рецидива 1,9.6 (95% ДИ 0,86–4,48).
Присутствие поликлональной инфекции M.tuberculosis на исходном уровне имело коэффициент риска рецидива 1,9.6 (95% ДИ 0,86–4,48).
Наши результаты показывают, что степень мазка КУМ независимо связана с рецидивом туберкулеза после успешного лечения начального эпизода, в то время как связь между поликлональной инфекцией M. tuberculosis и повышенным риском рецидива представляется возможной.
Отчеты экспертной оценки
Пациенты, недавно завершившие лечение туберкулеза (ТБ), подвергаются повышенному риску рецидива туберкулеза в результате рецидива или повторного заражения [1, 2]. Когда у людей диагностирован рецидивирующий ТБ, у них меньше шансов завершить лечение и смертность выше, чем у людей с первыми эпизодами ТБ [3]. Несмотря на растущее понимание рисков, связанных с рецидивирующим ТБ, более четкая картина того, какие ковариаты подвергают людей большему риску рецидива заболевания, может дать информацию для более целенаправленного посттуберкулезного лечения и мониторинга.
Было обнаружено, что несколько ковариант связаны с рецидивом ТБ после завершения лечения. Лекарственная устойчивость [4], курение [5], ВИЧ-инфекция с низким количеством лимфоцитов CD4 [6], употребление психоактивных веществ [7], хроническое заболевание легких [8], заболевание с положительным результатом мазка мокроты [9] и полостное заболевание легких. 10], каждый из которых был связан с повышенным риском рецидива туберкулеза. Эти факторы могут повышать риск рецидива, поскольку они делают более вероятным сохранение небольшого количества микобактерий после лечения или потому, что они связаны с иммунологической недостаточностью, которая подвергает людей большему риску заболевания после повторного заражения [11].
За последние несколько лет методы молекулярной генетики позволили по-новому взглянуть на степень гетерогенности генотипа внутри хозяина при инфекциях, вызванных Mycobacterium tuberculosis . Эти «смешанные штаммы» или «гетерогенные» инфекции возникают либо в результате спорадических мутаций (клональная гетерогенность), либо в результате приобретения хозяином более чем одного штамма M. tuberculosis (поликлональная гетерогенность), либо во время заражения, либо в результате серийных повторных заражений. инфекции [12]. В то время как обнаружение инфекции смешанного штамма ограничено собранными биологическими образцами, а также лабораторными процессами и чувствительностью секвенирования, частота, с которой сообщается о клональной гетерогенности и поликлональной гетерогенности, в некоторых условиях составляет почти 20% [13]. В то время как несколько исследований показали, что гетерогенность внутри хозяина, особенно поликлональные инфекции, связаны с более слабым ответом на лечение [14], влияние на риск рецидива менее ясно [13].
tuberculosis (поликлональная гетерогенность), либо во время заражения, либо в результате серийных повторных заражений. инфекции [12]. В то время как обнаружение инфекции смешанного штамма ограничено собранными биологическими образцами, а также лабораторными процессами и чувствительностью секвенирования, частота, с которой сообщается о клональной гетерогенности и поликлональной гетерогенности, в некоторых условиях составляет почти 20% [13]. В то время как несколько исследований показали, что гетерогенность внутри хозяина, особенно поликлональные инфекции, связаны с более слабым ответом на лечение [14], влияние на риск рецидива менее ясно [13].
Исследования рецидивирующего ТБ проводить сложно, поскольку риск рецидива ТБ может оставаться повышенным до десяти лет [2]. В этом анализе мы объединили исследовательскую базу данных с электронными регистрационными записями для изучения долгосрочного риска рецидива туберкулеза среди когорты амбулаторных больных туберкулезом легких с высокой распространенностью коинфекции ВИЧ после успешного завершения противотуберкулезной терапии.
Медицинский округ Умгунгундлову в Квазулу-Натале (KZN), Южная Африка, в начальный период исследования в 2011 г. уровень заболеваемости туберкулезом составлял 880 случаев на 100 000 человек. Местная распространенность ВИЧ составляла 16,9.% и примерно 70% людей с активным туберкулезом были коинфицированы ВИЧ [15].
Все взрослые с недавно диагностированным туберкулезом легких и положительным мазком мокроты на кислотоустойчивые бациллы (КУБ) из пяти клиник первичной медико-санитарной помощи медицинского округа Умгунгундлову имели право на участие в исследовании. В период с июня 2011 г. по ноябрь 2012 г. мы зарегистрировали 500 участников и собрали два образца мокроты до лечения. Сразу после регистрации участникам была начата противотуберкулезная терапия в соответствии с рекомендациями Министерства здравоохранения Южной Африки. Более подробная информация о дизайне исследования доступна в предыдущей публикации [16].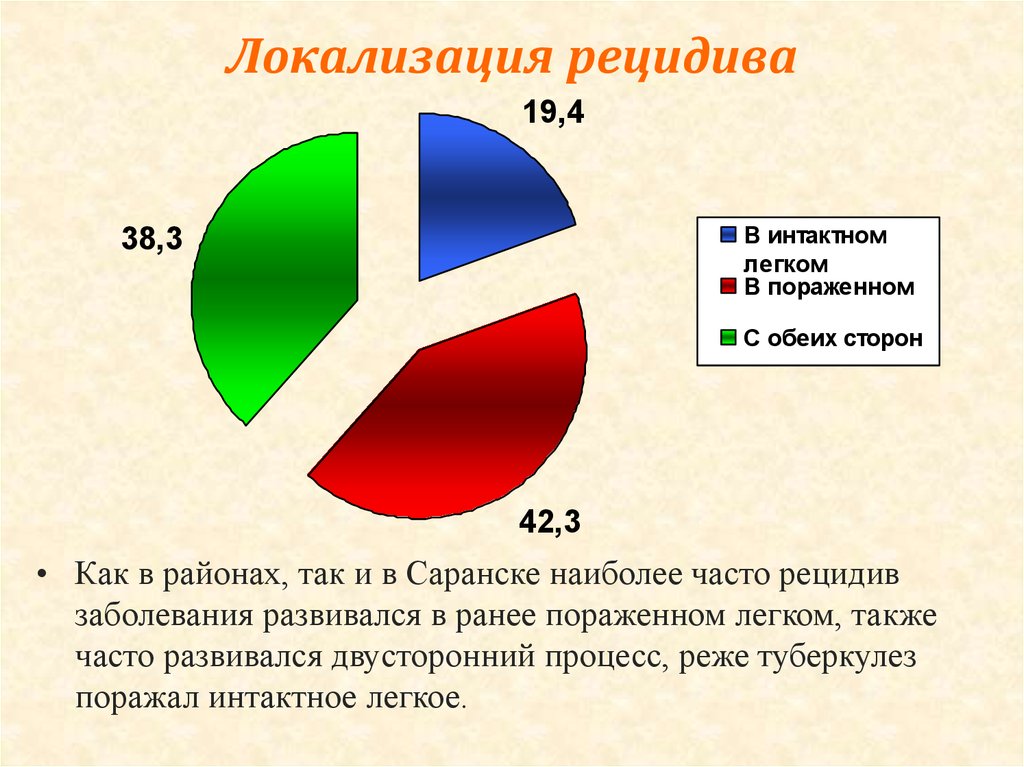
Образцы мокроты до лечения были культивированы, а образцы, положительные на M.tuberculosis , были генотипированы с помощью 24-локусного микобактериального вкрапленного повторяющегося тандемного повтора с переменным числом единиц (MIRU-VNTR), типированного в Genoscreen (Institute Pasteur, Lille, Франция) [17]. Детали лабораторных процедур были опубликованы ранее [16]. Для образцов с множественными повторами в любых локусах MIRU-VNTR, указывающими более чем на генотип, был использован алгоритм ClassTR [18] для различения клональных M.tuberculosis инфекция от поликлональной M.tuberculosis инфекции.
После завершения противотуберкулезной терапии мы отслеживали исходы с помощью регулярно собираемых данных электронного регистра лечения (ETR) [19]. Данные ETR медицинского округа Умгунгундлову включают 50 клиник, обслуживающих население более 1 000 000 человек, а также охватывают исходные 5 мест, из которых были набраны участники [20].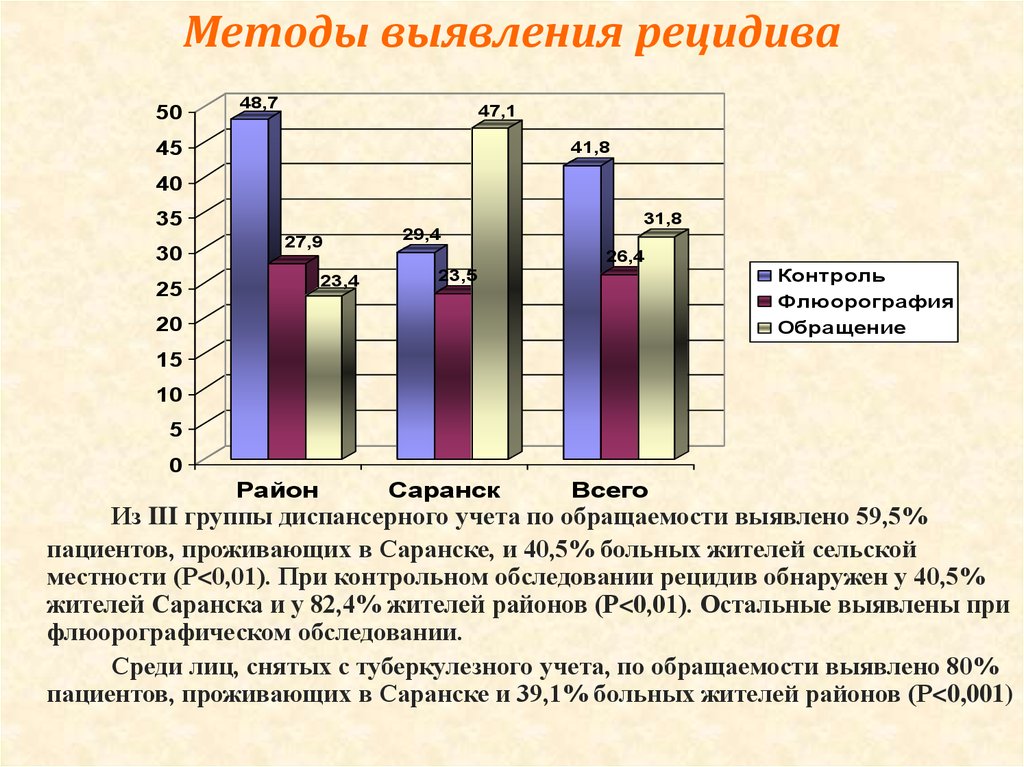 Каждое учреждение в районе регистрирует информацию о случаях туберкулеза, включая окончательные результаты лечения, в стандартном бумажном регистре туберкулеза. Медицинский округ собирает регистры туберкулеза в местных учреждениях и вводит их в районную ETR.
Каждое учреждение в районе регистрирует информацию о случаях туберкулеза, включая окончательные результаты лечения, в стандартном бумажном регистре туберкулеза. Медицинский округ собирает регистры туберкулеза в местных учреждениях и вводит их в районную ETR.
Мы сопоставили участников исследования с районными данными в ETR путем точного сопоставления идентификаторов (например, имени, пола, даты рождения, даты начала лечения). Поскольку в Южной Африке нет уникального идентификатора пациента, а при сборе административных данных есть несколько возможностей для ошибок транскрипции, мы провели нечеткое сопоставление для участников исследования, которые не были обнаружены с помощью точного сопоставления. Мы разрешили замену числовых переменных и использовали расстояние Джаро-Винклера [21] для сопоставления строковых переменных. Автор исследования (ПК) рассмотрел все возможные совпадения. Мы записали окончательный результат лечения для каждого участника. Для участников, которые были указаны в ETR как потерянные для последующего наблюдения или которые передали свое лечение во время лечения, были проведены дальнейшие точные и нечеткие поиски, чтобы попытаться связать эпизоды ухода и установить окончательный результат лечения.
Для участников исследования с документально подтвержденным успешным лечением (по определению Всемирной организации здравоохранения [22] излечение или завершение лечения) первоначального эпизода туберкулеза в электронном реестре проводился поиск вторичных эпизодов туберкулеза в течение периода после первоначального исследования регистрации до 30 марта 2019 г. Для любых вторичных эпизодов туберкулеза, обнаруженных в электронном регистре, мы записывали время до рецидива от первоначального диагноза, а также метод диагностики туберкулеза (эмпирический, микроскопия мазка, Gene Xpert MTB/Rif или посев). ), и лечебная клиника.
Мы построили модели пропорциональных рисков Кокса с исходом рецидивирующего туберкулеза. Участники подвергались цензуре в день проведения поиска ETR. Для модели с несколькими переменными мы включили ковариаты для гетерогенности внутри хозяина (простая, клональная и поликлональная), поскольку это было в центре внимания исследования, а также ВИЧ-статус, учитывая его сильную связь с рецидивирующим туберкулезом и случайные эффекты гауссовой неустойчивости для медицинского центра, чтобы скорректировать кластеризацию. Кроме того, ковариации с p - значение < 0,20 (возраст, образование, семейное положение и степень мазка мокроты по КУМ) были включены в однофакторные модели.
Кроме того, ковариации с p - значение < 0,20 (возраст, образование, семейное положение и степень мазка мокроты по КУМ) были включены в однофакторные модели.
Статистическое программное обеспечение R использовалось для проведения статистического анализа [23]. Модели пропорциональных рисков Кокса были построены с использованием пакетов выживания [24] версии 2.42–6, survminer [25] версии 0.4.3 и prodlim [26] версии 2018.04.18 для оценки того, связаны ли какие-либо факторы с рецидивом туберкулеза после завершения лечения для начальный эпизод. Пропорциональность оценивалась с помощью корреляции между остатками Шенфельда и логарифмом (временем) для каждой ковариаты и глобальной модели. Мультиколлинеарность оценивалась с использованием коэффициента инфляции дисперсии.
За время включения в исследование и периода наблюдения в Умгунгундловском медицинском округе ETR было зарегистрировано 110 859 случаев туберкулеза. Из 500 первоначально зарегистрированных пациентов мы сопоставили 478 (96%) в пределах ETR (рис. 1). 135 (28%) имели результат лечения «не оценен» из-за перевода в клинику или потери для последующего наблюдения. Дальнейшие поиски позволили обнаружить лечащую клинику 89 из этих 135 (66%) для определения окончательного результата лечения. У 421 (88%) подобранных участников была положительная исходная культура микобактерий с успешным генотипированием MIRU-VNTR.
Из 500 первоначально зарегистрированных пациентов мы сопоставили 478 (96%) в пределах ETR (рис. 1). 135 (28%) имели результат лечения «не оценен» из-за перевода в клинику или потери для последующего наблюдения. Дальнейшие поиски позволили обнаружить лечащую клинику 89 из этих 135 (66%) для определения окончательного результата лечения. У 421 (88%) подобранных участников была положительная исходная культура микобактерий с успешным генотипированием MIRU-VNTR.
Блок-схема участников
Полноразмерное изображение
333 (79%) участников первоначального исследования с генотипом MIRU-VNTR были зарегистрированы как достигшие завершения лечения или излечения от начального эпизода туберкулеза (таблица 1) . Те, у кого был успешный результат лечения, с меньшей вероятностью жили с ВИЧ (65,8 против 79%) и с меньшей вероятностью имели отрицательный результат мокроты на КУМ (40,8% против 56,3%) (дополнительная таблица 1). В этой когорте средний возраст составлял 35 лет, и 57% были мужчинами.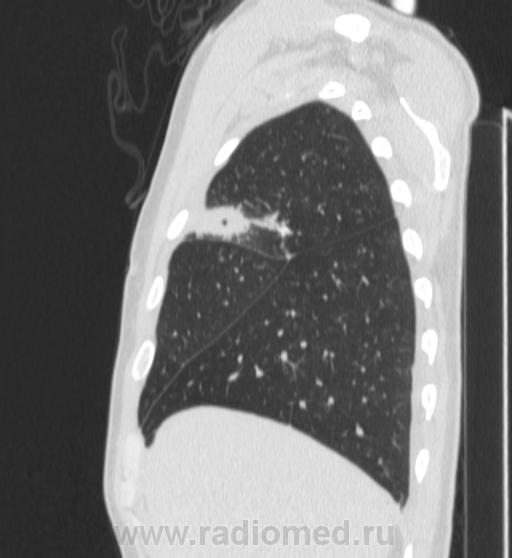 228 (69%) были ВИЧ-позитивными, а 77 (23%) имели признаки гетерогенной инфекции M. tuberculosis при генотипировании MIRU-VNTR. При использовании алгоритма ClassTR для интерпретации результатов MIRU-VNTR 30 (9%) имели клонально-гетерогенное заболевание M.tuberculosis , а 47 (14%) имели поликлональное гетерогенное заболевание M.tuberculosis . 59 (18%) имели в анамнезе туберкулез до включения в исследование. 7 (2%) имели туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ).
228 (69%) были ВИЧ-позитивными, а 77 (23%) имели признаки гетерогенной инфекции M. tuberculosis при генотипировании MIRU-VNTR. При использовании алгоритма ClassTR для интерпретации результатов MIRU-VNTR 30 (9%) имели клонально-гетерогенное заболевание M.tuberculosis , а 47 (14%) имели поликлональное гетерогенное заболевание M.tuberculosis . 59 (18%) имели в анамнезе туберкулез до включения в исследование. 7 (2%) имели туберкулез с множественной лекарственной устойчивостью (МЛУ-ТБ).
Полноразмерная таблица
Среднее время от первоначального диагноза туберкулеза до поиска в ETR округа составляло 2125 дней (межквартильный диапазон от 2032 до 2271 дней). У 45 участников (14%) был диагностирован рецидивирующий туберкулез, из которых у 35 участников (11%) был бактериологически подтвержденный туберкулез либо с помощью мазка мокроты, либо с помощью Gene Xpert, либо с помощью посева в среднем через 504 дня.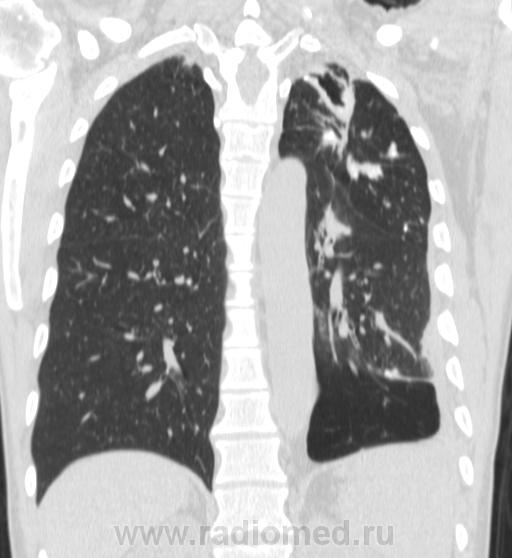 Кривые Каплана-Мейера для бактериологически подтвержденного рецидива туберкулеза после лечения простого, клонального или поликлонального туберкулеза 9Инфекция 0227 M. tuberculosis tuberculosis не отличалась статистически значимо по логарифмическому ранговому критерию (рис. 2).
Кривые Каплана-Мейера для бактериологически подтвержденного рецидива туберкулеза после лечения простого, клонального или поликлонального туберкулеза 9Инфекция 0227 M. tuberculosis tuberculosis не отличалась статистически значимо по логарифмическому ранговому критерию (рис. 2).
Оценка Каплана-Мейера для свободы от рецидива туберкулеза после завершения лечения или лечения отношение рисков 0,94 (95% доверительный интервал (ДИ) 0,91–0,98) на каждый дополнительный год возраста (табл. 2). В нашей многопараметрической модели степень мазка мокроты 3+ КУМ была в значительной степени связана с рецидивом туберкулеза с коэффициентом риска 3,33 (95% ДИ 1,44–7,7, p = 0,005) (рис. 3). Наличие клонально-гетерогенной инфекции M.tuberculosis на исходном уровне имело отношение рисков рецидива 0,92 (95% ДИ 0,27–3,1), в то время как поликлонально-гетерогенная инфекция M.tuberculosis на исходном уровне имело отношение рисков рецидива 1,9.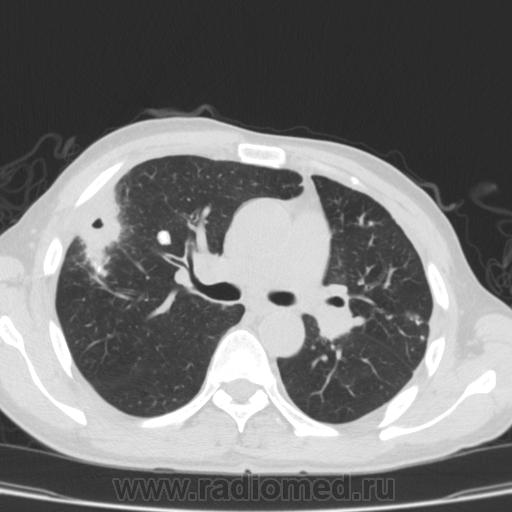 6 (95% ДИ 0,86–4,5). Ни у кого из пациентов с рецидивирующим туберкулезом исходно не было МЛУ-ТБ, что делало невозможным включение МЛУ-ТБ в наши модели.
6 (95% ДИ 0,86–4,5). Ни у кого из пациентов с рецидивирующим туберкулезом исходно не было МЛУ-ТБ, что делало невозможным включение МЛУ-ТБ в наши модели.
Полная таблица
Рис. 3Скорректированные коэффициенты риска для рецидивирующего туберкулеза
Изображение в натуральную величину лиц, успешно лечившихся от туберкулеза легких в условиях высокого бремени в среднем в течение 6 лет, мы обнаружили, что 11% (95% ДИ от 7,2 до 13,8%) имели бактериологически подтвержденный рецидив туберкулеза и еще 3% (95% ДИ от 1,2 до 4,8%) имели эмпирически диагностированный рецидив туберкулеза. Это согласуется с другими исследованиями, проведенными в условиях высокой нагрузки [2, 27].
Обнаруженная нами связь между более высоким уровнем КУМ в мазке мокроты во время первоначального эпизода туберкулеза и повторными эпизодами туберкулеза может быть связана с более высокой микобактериальной нагрузкой и кавернозным заболеванием, что приводит к более высокому риску рецидива после завершения лечения. Связь между степенью мазка и плохими результатами лечения, включая рецидив заболевания, наблюдалась в других исследованиях [28].
Связь между степенью мазка и плохими результатами лечения, включая рецидив заболевания, наблюдалась в других исследованиях [28].
В этом долгосрочном наблюдении точечная оценка вероятности рецидива для лиц с поликлональной инфекцией M. tuberculosis составила 1,96, но 95% доверительный интервал не исключал 1. Относительно небольшое количество зарегистрированных исходов ограничивает нашу способность делать убедительные заявления о том, повышают ли такие поликлональные инфекции вероятность рецидива у пациентов после успешного лечения. Ассоциация рецидивирующего туберкулеза и гетерогенного M.tuberculosis вполне вероятно, поскольку гетерогенная инфекция может привести к гетерорезистентности. Кроме того, Шин и его коллеги недавно обнаружили связь между гетерогенной инфекцией M. tuberculosis и неэффективностью лечения в Ботсване, которая не зависела от гетерорезистентности [14]. Другими механизмами ассоциации гетерогенных 9 могут быть высокая микобактериальная нагрузка у хозяина или повторяющиеся контакты с туберкулезом в среде с высокой распространенностью туберкулеза. 0227 M.tuberculosis инфекция и плохие результаты лечения или рецидив.
0227 M.tuberculosis инфекция и плохие результаты лечения или рецидив.
Коинфекция ВИЧ не была связана с риском рецидива в однофакторном или многопараметрическом анализе. Это может отражать растущие показатели антиретровирусной терапии в наших условиях, а также то, что в южноафриканских руководствах во время нашего первоначального исследования рекомендовалось назначать антиретровирусные препараты пациентам, живущим с сочетанной инфекцией ВИЧ и туберкулезом. Антиретровирусные препараты снижают риск развития активного туберкулеза, но насколько этот риск соотносится с неинфицированным ВИЧ населением, в настоящее время неизвестно [6, 29]., 30]. В качестве альтернативы участники, живущие с ВИЧ, могли страдать более высокими показателями смертности в последующие годы, что могло повлиять на наши результаты, учитывая, что у нас не было доступа к статистике естественного движения населения.
Связывание набора данных нашего исследования с данными ETR для выявления рецидивирующих случаев туберкулеза имело ограничения, поскольку в настоящее время в Южной Африке нет национального идентификатора здоровья. Нечеткое сопоставление идентификаторов пациентов выявило множество случаев вероятных совпадений, которые изначально были пропущены из-за орфографических ошибок и транспозиций, но мы не знаем, были ли пропущены другие совпадения из-за больших расхождений и внесло ли это погрешность в наши выводы. Если факторы риска рецидива также связаны со смертью, отсутствие доступа к статистике естественного движения населения может привести к искажению результатов из-за отсутствия надлежащей цензуры участников, умерших в период последующего наблюдения.
Нечеткое сопоставление идентификаторов пациентов выявило множество случаев вероятных совпадений, которые изначально были пропущены из-за орфографических ошибок и транспозиций, но мы не знаем, были ли пропущены другие совпадения из-за больших расхождений и внесло ли это погрешность в наши выводы. Если факторы риска рецидива также связаны со смертью, отсутствие доступа к статистике естественного движения населения может привести к искажению результатов из-за отсутствия надлежащей цензуры участников, умерших в период последующего наблюдения.
Это ограничение приводит к нашему выводу о 11% рецидивов как нижней границе бремени рецидивирующего туберкулеза. Кроме того, несмотря на то, что ETR включает район здравоохранения, который обслуживает более 1 000 000 человек, население KZN очень мобильно [31], и база данных ETR не фиксирует рецидивы за пределами района здравоохранения. 135 (28%) участников этого исследования перешли в клинику или были потеряны для последующего наблюдения во время их первоначального лечения ТБ, и мы смогли определить местонахождение 66% из них в их окончательной лечащей клинике в районе здравоохранения. Вполне возможно, что миграция за пределы медицинского округа могла внести некоторую погрешность в наше исследование.
Вполне возможно, что миграция за пределы медицинского округа могла внести некоторую погрешность в наше исследование.
Другим ограничением является то, что наши образцы были взяты в один момент времени из одного анатомического источника (мокроты). Работа нашей группы с патологоанатомическими исследованиями в той же популяции, которая представлена в этом исследовании, выявила значительную долю полиорганного диссеминированного туберкулеза с гетерогенностью штамма, который не был обнаружен при взятии одного образца мокроты [32]. Генотипирование с помощью MIRU-VNTR также имеет ограниченную чувствительность для определения разнообразия штаммов M.tuberculosis и, возможно, недооценивает истинную долю гетерогенной инфекции [12]. Мы также не смогли генотипировать Штаммы M. tuberculosis из рецидивирующих эпизодов, чтобы отличить реинфекцию от рецидива. В других исследованиях с сопоставлением дактилоскопии начальных и рецидивирующих эпизодов туберкулеза реинфекция составляла не менее половины рецидивов заболевания, отражая гиперэндемичные сообщества, в которые возвращаются люди, живущие с туберкулезом, после завершения лечения. Мы подозреваем, что такие же высокие показатели реинфекции имели место и в нашей популяции, но у нас нет генотипов от рецидивирующих эпизодов туберкулеза, чтобы проверить эту гипотезу.
Мы подозреваем, что такие же высокие показатели реинфекции имели место и в нашей популяции, но у нас нет генотипов от рецидивирующих эпизодов туберкулеза, чтобы проверить эту гипотезу.
Наши результаты показывают, что степень мазка КУМ независимо связана с рецидивом туберкулеза после успешного лечения начального эпизода, в то время как связь между поликлональной инфекцией M. tuberculosis и повышенным риском рецидива представляется возможной, но необходимы дальнейшие исследования лучше установить эту связь.
Наборы данных, собранные и проанализированные для настоящего исследования, можно получить у соответствующего автора по обоснованному запросу.
Кислотоустойчивые палочки
Доверительный интервал
Электронный журнал лечения
Квазулу-Натал
Туберкулез с множественной лекарственной устойчивостью
Микобактериальные вкрапленные повторяющиеся единицы с переменным числом тандемных повторов
Туберкулез
Marx FM, Floyd S, Ayles H, Godfrey-Faussett P, Beyers N, Cohen T. Высокое бремя распространенного туберкулеза среди ранее леченных людей в южной части Африки указывает на потенциал для целенаправленных мер контроля. Eur Respir J. 2016;48(4):1227–30.
Артикул Google ученый
Уйс П., Брэнд Х., Уоррен Р., ван дер Спуй Г., Хоал Э.Г., ван Хелден П.Д. Риск повторного заражения туберкулезом вскоре после излечения от первого эпизода заболевания чрезвычайно высок в гиперэндемическом сообществе. ПЛОС Один. 2015;10(12):e0144487.
Артикул Google ученый
Murray J, Sonnenberg P, Shearer SC, Godfrey-Faussett P. Вирус иммунодефицита человека и результаты лечения нового и рецидивирующего туберкулеза легких у африканских пациентов. Am J Respir Crit Care Med. 1999;159(3):733–40.
Артикул КАС Google ученый
Sun Y, Harley D, Vally H, Sleigh A. Влияние множественной лекарственной устойчивости на рецидив туберкулеза и отдаленные результаты в Китае. ПЛОС Один. 2017;12(1): e0168865. https://doi.org/10.1371/journal.pone.0168865.
Yen Y-F, Yen M-Y, Lin Y-S, Lin Y-P, Shih H-C, Li L-H и др. Курение увеличивает риск рецидива после успешного противотуберкулезного лечения: популяционное исследование. Int J Tuberc Lung Dis. 2014;18(4):492–8.
Артикул Google ученый
Голуб Дж. Э., Дуровни Б., Кинг Б. С., Кавалаканте СК, Пачеко АГ, Моултон Л. Х. и др. Рецидивирующий туберкулез у ВИЧ-инфицированных в Рио-де-Жанейро. Бразилия AIDS Lond Engl. 2008;22(18):2527–33.
Артикул Google ученый
Ким Л., Мунан П.К., Хейлиг К.М., Йелк Вудрафф Р.С., Каммерер Дж.С., Хаддад М.Б. Факторы, связанные с рецидивом туберкулеза более чем через 12 месяцев после завершения лечения. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. 2016;20(1):49–56.
Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. 2016;20(1):49–56.
Артикул КАС Google ученый
Петтит А.С., Кальтенбах Л.А., Марури Ф., Камминс Дж., Смит Т.Р., Варкентин Дж.В. и др. Хронические заболевания легких и ВИЧ-инфекция являются факторами риска рецидива туберкулеза в условиях низкой заболеваемости. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. 2011;15(7):906–11.
Артикул КАС Google ученый
Паскопелла Л., ДеРимер К., Уотт Дж.П., Флад Дж.М. Когда туберкулез возвращается: кто заболевает рецидивирующим туберкулезом в Калифорнии? ПЛОС Один. 2011;6(11): e26541. https://doi.org/10.1371/journal.pone.0026541.
Sonnenberg P, Murray J, Glynn JR, Shearer S, Kambashi B, Godfrey-Faussett P. ВИЧ-1 и рецидивы, рецидивы и повторное заражение туберкулезом после лечения: когортное исследование среди горняков Южной Африки. Ланцет. 2001;358(9294):1687–93.
Ланцет. 2001;358(9294):1687–93.
Артикул КАС Google ученый
Мирсаиди М., Садикот Р. Пациенты с высоким риском рецидива туберкулеза. Int J Микобактериология. 2018;7(1):1–6.
Артикул Google ученый
Коэн Т., ван Хелден П.Д., Уилсон Д., Колейн С., Маклафлин М.М., Абубакар И. и др. Туберкулезные инфекции смешанного штамма микобактерий и значение для лечения и контроля туберкулеза. Clin Microbiol Rev. 2012;25(4):708–19.
Артикул КАС Google ученый
МакИвор А., Коорнхоф Х., Кана Б.Д. Рецидивы, реинфекции и смешанные инфекции при туберкулезе. Патог Дис. 2017; 75(3) Доступно по ссылке: https://academic.oup.com/femspd/article/75/3/ftx020/3003284. [цитировано 19 октября 2018 г.].
Шин С.С., Модонго С. , Байк Ю., Аллендер С., Леммер Д., Колман Р.Э. и др. Смешанные Mycobacterium tuberculosis – Штаммовые инфекции связаны с плохими результатами лечения среди пациентов с впервые диагностированным туберкулезом, независимо от гетерорезистентности до лечения. J заразить дис. 2018; [цитировано 19 октября 2018 г.]. https://doi.org/10.1093/infdis/jiy480/5066433.
, Байк Ю., Аллендер С., Леммер Д., Колман Р.Э. и др. Смешанные Mycobacterium tuberculosis – Штаммовые инфекции связаны с плохими результатами лечения среди пациентов с впервые диагностированным туберкулезом, независимо от гетерорезистентности до лечения. J заразить дис. 2018; [цитировано 19 октября 2018 г.]. https://doi.org/10.1093/infdis/jiy480/5066433.
Massyn N, Day C, Dombo M, Barron P, English R, Padarath A. Окружной барометр здоровья 2012/13 [интернет]. Фонд систем здравоохранения: Дурбан; 2013. Доступно по адресу: http://www.hst.org.za/publications/District%20Health%20Barometers/CompleteDHB2012-2013.pdf.
Google ученый
Коэн Т., Чинделевич Л., Мисра Р., Кемпнер М.Е., Галеа Дж., Мудли П. и др. Гетерогенность инфекции M.tuberculosis внутри хозяина связана с плохим ранним ответом на лечение: проспективное когортное исследование. J заразить дис. 2016; 213(11):1796–9.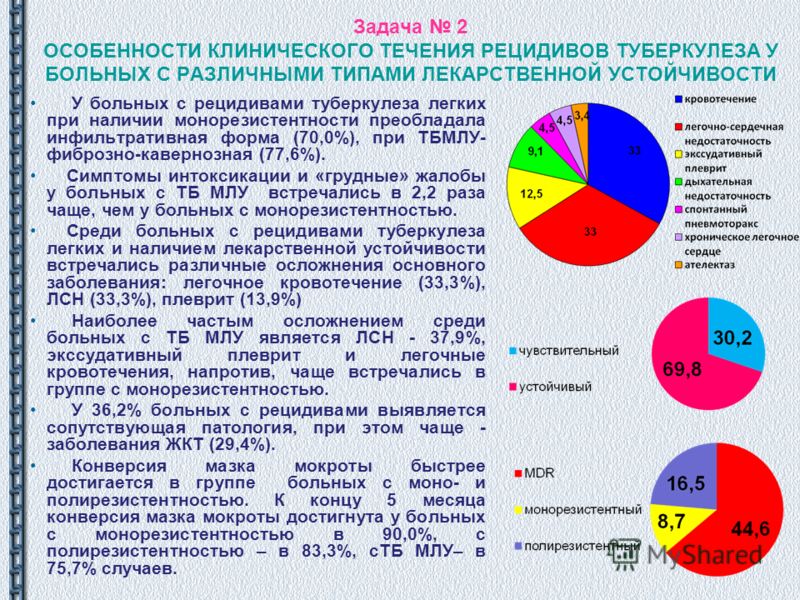
Артикул Google ученый
Oelemann MC, Diel R, Vatin V, Haas W, Rüsch-Gerdes S, Locht C, et al. Оценка оптимизированной системы типирования микобактерий с вкраплениями повторяющихся единиц с переменным числом тандемных повторов в сочетании со сполиготипированием для популяционных молекулярно-эпидемиологических исследований туберкулеза. Дж. Клин Микробиол. 2007;45(3):691–7.
Артикул КАС Google ученый
Chindelevitch L, Colijn C, Moodley P, Wilson D, Cohen T. ClassTR: классификация гетерогенности внутри хозяина на основе тандемных повторов с применением к микобактериям туберкулеза. PLoS Comput Biol. 1 февраля 2016 г .; 12 (2): e1004475.
Артикул Google ученый
ETR.Net — реализации в странах [Интернет]. 2007 [цитировано 24 февраля 2020 г. ]. Доступно по адресу: http://www.etrnet.info/CountryImplementations.aspx.
]. Доступно по адресу: http://www.etrnet.info/CountryImplementations.aspx.
Департамент здравоохранения. Медицинский округ Умгунгундлову: Годовой отчет за 2017–2018 гг. [Интернет]. 2018 [цитировано 12 октября 2018 г.]. Доступно по адресу: www.kznhealth.gov.za/2017-2018-Annual-Report.pdf.
Винклер В.Е., Тибодо Ю. Применение модели связи записей Фелледжи-Сантера к десятилетней переписи населения США 1990 года; Технический отчет Бюро переписи населения США; 1987. с. 22. Отчет №: RR91–09.
Всемирная организация здравоохранения. Глобальный отчет о туберкулезе, 2019 г.. Женева; 2019 г. Отчет №: WHO/CDS/TB/2019.15.
Google ученый
R Основная команда. R: язык и среда для статистических вычислений. Вена: R Foundation for Statistical Computing; 2019. Доступно по адресу: https://www.R-project.org.
Google ученый
Терно ТМ. Пакет для анализа выживаемости в S [интернет]. 2015. Доступно по адресу: https://www.CRAN.R-project.org/package=survival.
Google ученый
Кассамбара А., Косински М. Survminer: Анализ выживания и визуализация [Интернет]. [цитировано 29 ноября 2018 г.]. Доступно по адресу: https://www.rpkgs.datanovia.com/survminer/index.html.
Гердс Т.А. prodlim: Оценка предела продукта для анализа истории цензурированных событий [Интернет]. 2018 [цитировано 30 ноября 2018 г.]. Доступно по адресу: https://www.CRAN.R-project.org/package=prodlim.
Маркс Ф.М., Данбар Р., Энарсон Д.А., Уильямс Б.Г., Уоррен Р.М., ван дер Спуй Г.Д. и др. Временная динамика рецидива и реинфекции туберкулеза после успешного лечения: ретроспективное когортное исследование. Клин Инфекция Дис. 2014;58(12):1676–83.
Артикул КАС Google ученый
Imperial MZ, Nahid P, Phillips PPJ, Davies GR, Fielding K, Hanna D, et al. Объединенный анализ на уровне пациентов схем сокращения лечения лекарственно-чувствительного туберкулеза легких. Нат Мед. 2018;24(11):1708.
Артикул КАС Google ученый
Van Rie A, Westreich D, Sanne I. Туберкулез у пациентов, получающих антиретровирусное лечение: заболеваемость, факторы риска и стратегии профилактики. J Acquir Immune Defic Syndr 1999. 2011;56(4):349–55.
Google ученый
Бок П., Дженнингс К., Вермаак Р., Кокс Х., Мейнджес Г., Фатти Г. и др. Заболеваемость туберкулезом среди ВИЧ-позитивных лиц, начинающих антиретровирусное лечение при более высоком уровне CD4, в исследовании HPTN 071 (PopART) в Южной Африке. J Приобретение иммунодефицитного синдрома. 2018;77(1):93–101.
Camlin CS, Snow RC, Hosegood V. Гендерные модели миграции в сельских районах Южной Африки. Народное космическое место. 2014;20(6):528–51..
Гендерные модели миграции в сельских районах Южной Африки. Народное космическое место. 2014;20(6):528–51..
Артикул Google ученый
Либерман Т.Д., Уилсон Д., Мисра Р., Сюн Л.Л., Мудли П., Коэн Т. и другие. Геномное разнообразие в образцах аутопсии свидетельствует о распространении ВИЧ-ассоциированных микобактерий туберкулеза внутри хозяина. Нат Мед. 2016;22(12):1470–4.
Артикул КАС Google ученый
Скачать ссылки
Мы хотим поблагодарить Департамент здравоохранения Квазулу-Наталь и его директора по туберкулезу г-жу Жаклин Нгозо за их помощь в этом исследовании. Мы также хотим поблагодарить медперсонал и руководство поликлиник первичной медико-санитарной помощи района Умгунгундлову.
Эта работа была поддержана Международным центром Фогарти [номер гранта 1K01TW011194-01A1 для P. G.T.C] в Национальных институтах здравоохранения и стипендией Burroughs Wellcome Fund/Американского общества тропической медицины и гигиены. Заболевания P.G.T.C. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
G.T.C] в Национальных институтах здравоохранения и стипендией Burroughs Wellcome Fund/Американского общества тропической медицины и гигиены. Заболевания P.G.T.C. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Секция инфекционных заболеваний, факультет медицины, Медицинский факультет Йельского университета, Нью-Хейвен, Коннектикут, США KwaZulu-Natal, 5th Floor, Private Bag X 509, Plessislaer, KZN, Pietermaritzburg, 3216, Южная Африка
Патрик Джордж Тобиас Кудахи и Дуглас Уилсон
Департамент эпидемиологии (микробных заболеваний), Школа общественного здравоохранения Йельского университета, Нью-Хейвен, Коннектикут, США
Тед Коэн
Авторы
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
PGTC, TC и DW задумали и разработали это исследование. PGTC провела анализ данных. Все авторы внесли свой вклад в подготовку рукописи и утверждение окончательной версии.
PGTC провела анализ данных. Все авторы внесли свой вклад в подготовку рукописи и утверждение окончательной версии.
Переписка с Патрик Джордж Тобайас Кудахи или Дуглас Уилсон.
Комитет по этике биомедицинских исследований Университета Квазулу-Натал и Департамента здравоохранения Квазулу-Натал, а также Партнерский комитет по исследованиям человека (Бостон, Массачусетс), одобрено протокол исходного исследования. Комитет по этике биомедицинских исследований Университета Квазулу-Наталь, Департамент здравоохранения Квазулу-Наталь и Комитет по исследованиям на людях Йельского университета одобрили дополнительное использование данных ETR для этого анализа. От всех участников было получено письменное информированное согласие.
Неприменимо.
Авторы заявляют об отсутствии конкурирующих интересов.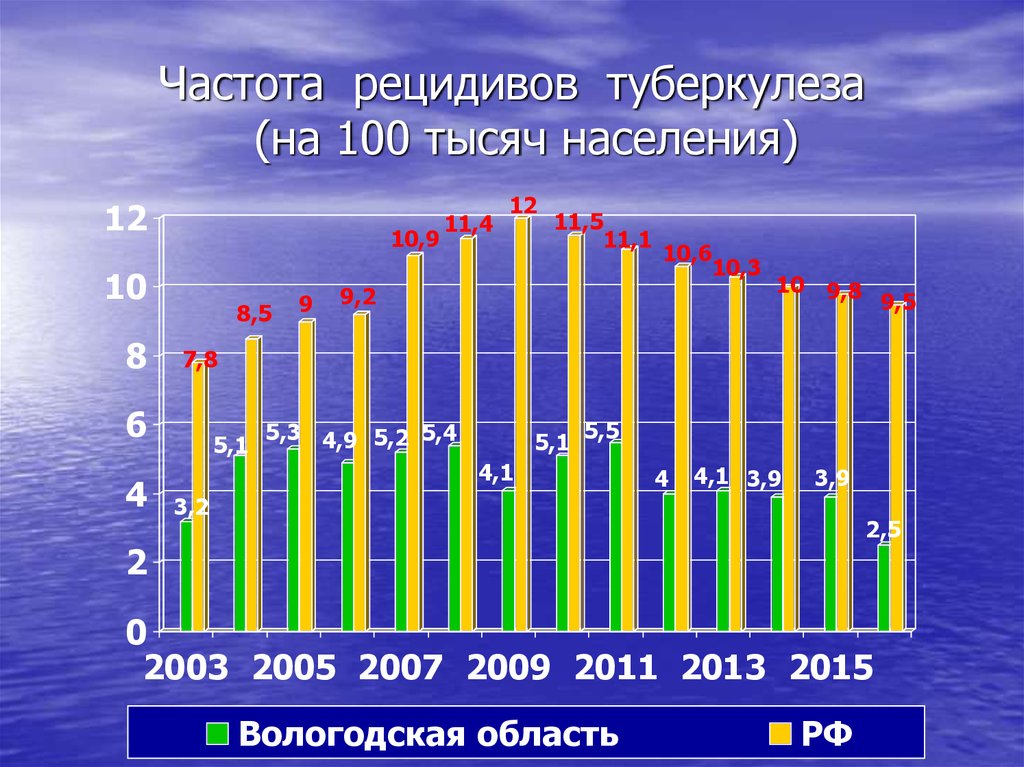
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Сравнение участников, зачисленных, но не включенных в окончательный анализ, с участниками, включенными в окончательный анализ.
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала.