2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
В зависимости от того, в каких условиях (в растворе или при сплавлении твердых веществ) протекает реакция между вышеуказанными соединениями Al(OH)3 + NaOH = ? могут образовываться различные продукты. Так, в случае протекания реакции в растворе образуется комплексная соль гексагидроксоалюминат натрия, в случае сплавления же – алюминат натрия и вода. Молекулярное уравнение реакции имеет вид:
Ионное уравнение можно записать только для реакции взаимодействия веществ в растворе:
Теперь переходим к решению задачи. Первоначально рассчитаем количество молей веществ, вступивших в реакцию (; ):
Это означает, что гидроксид натрия находится в избытке и дальнейшие расчеты производим по гидроксиду алюминия.
Согласно уравнению реакции
значит
Тогда масса алюмината натрия будет равна (молярная масса – 82 g/mole):
Алюминий (Al) , также пишется Алюминий , химический элемент, легкий, серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы. Алюминий является наиболее распространенным металлическим элементом в земной коре и наиболее широко используемым цветным металлом. Из-за его химической активности алюминий никогда не встречается в металлической форме в природе, но его соединения присутствуют в большей или меньшей степени почти во всех породах, растительности и животных.Алюминий сосредоточен во внешних 10 милях (16 км) земной коры, из которых он составляет около 8 процентов по массе; его превышают по количеству только кислород и кремний. Название алюминий происходит от латинского слова alumen , используемого для описания квасцовых квасцов или сульфата алюминия-калия, KAl (SO 4 ) 2 ∙ 12H 2 O.
 Encyclopædia Britannica, Inc.
Encyclopædia Britannica, Inc. Британика Викторина
118 символов и названия периодической таблицы викторины
Pt
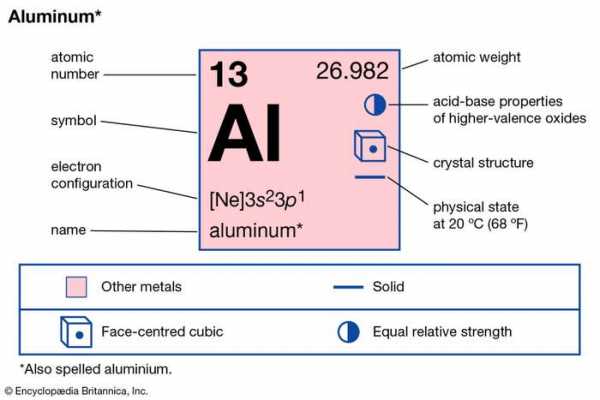
| атомный номер | 13 |
|---|---|
| атомный вес | 26.9815 |
| температура плавления | 660 ° C (1220 ° F) |
| температура кипения | 2,467 ° C (4473 ° F) |
| удельный вес | 2,70 (при 20 ° C [68 ° F]) |
| валентность | 3 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 3 с 2 3 p 1 |
Алюминий встречается в магматических породах в основном в виде алюмосиликатов в полевых шпатах, полевых шпатах и слюдах; в почве, полученной из них в виде глины; и при дальнейшем выветривании в виде бокситов и богатых железом латеритов.Боксит, смесь гидратированных оксидов алюминия, является основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), который встречается в нескольких изверженных породах, добывается как природный абразив или в его более мелких разновидностях, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других минералов алюминия, алунит и криолит имеют некоторое коммерческое значение.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Кристианом Эрстедом путем восстановления хлорида алюминия амальгамой калия.Британский химик сэр Хэмфри Дэви подготовил (1809 г.) железоалюминиевый сплав путем электролиза плавленого глинозема (оксида алюминия) и уже назвал элемент алюминием; позже слово было изменено на алюминий в Англии и некоторых других европейских странах. Немецкий химик Фридрих Вёлер, используя металлический калий в качестве восстановителя, изготовил алюминиевую пудру (1827 г.) и маленькие шарики металла (1845 г.), из которых он смог определить некоторые его свойства.
Новый металл был представлен публике (1855) на выставке в Париже примерно в то время, когда он стал доступен (в небольших количествах при больших затратах) благодаря восстановлению натрия в расплавленном хлориде алюминия.Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Чарльз Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эрульт во Франции открыли (1886) современный способ промышленного производства алюминия: электролиз очищенного глинозема (Al 2 O ). 3 ) растворяют в расплавленном криолите (Na 3 AlF 6 ). В 1960-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, переработке и производстве алюминия, см. Обработка алюминия.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняАлюминий добавляют в небольших количествах к определенным металлам, чтобы улучшить их свойства для специальных применений, как, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, умеренное количество других металлов и кремния добавляют к алюминию. Металл и его сплавы широко используются в авиастроении, строительных материалах, товарах длительного пользования (холодильники, кондиционеры, кухонные принадлежности), электрических проводниках, химическом и пищевом оборудовании.
Чистый алюминий (99,996%) довольно мягкий и слабый; коммерческий алюминий (чистота от 99 до 99,6%) с небольшим количеством кремния и железа твердый и прочный. Алюминий, пластичный и очень пластичный, может быть вытянут в проволоку или свернут в тонкую фольгу. Металл всего на треть плотнее железа или меди. Несмотря на то, что алюминий химически активен, он, тем не менее, обладает высокой устойчивостью к коррозии, поскольку на воздухе на его поверхности образуется прочная жесткая оксидная пленка.
Алюминий является отличным проводником тепла и электричества.Его теплопроводность составляет примерно половину теплопроводности меди; его электрическая проводимость, около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий является стабильным изотопом алюминия-27. Металлический алюминий и его оксид и гидроксид нетоксичны.
Алюминий медленно подвергается воздействию большинства разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Концентрированная азотная кислота, однако, может перевозиться в алюминиевых цистернах, поскольку она делает металл пассивным.Даже очень чистый алюминий активно подвергается воздействию щелочей, таких как гидроксид натрия и калия, с образованием водорода и алюминат-иона. Из-за своего высокого сродства к кислороду мелкодисперсный алюминий при его воспламенении будет гореть в монооксиде углерода или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного нагрева алюминий инертен по отношению к сере.
Алюминий может быть обнаружен в концентрациях до одной части на миллион с помощью эмиссионной спектроскопии.Алюминий может быть количественно проанализирован в виде оксида (формула Al 2 O 3 ) или в качестве производного органического соединения азота 8-гидроксихинолина. Производное имеет молекулярную формулу Al (C 9 H 6 ON) 3 .
Обычно алюминий является трехвалентным. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al , 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в нескольких соединениях (например,например, кристаллический фторид алюминия [AlF 3 ] и хлорид алюминия [AlCl 3 ]), как известно, возникает голый ион Al 3+ , образовавшийся в результате потери этих электронов. Однако энергия, необходимая для образования иона Al 3+ , очень высока, и в большинстве случаев энергетически более выгодно для атома алюминия образовывать ковалентные соединения путем гибридизации sp 2 , как и бор. Ион Al 3+ может быть стабилизирован гидратацией, а октаэдрический ион [Al (H 2 O) 6 ] 3+ встречается как в водном растворе, так и в нескольких солях.
Ряд соединений алюминия имеет важное промышленное применение. Глинозем, который встречается в природе в виде корунда, также в больших количествах готовят для использования в производстве металлического алюминия и в производстве изоляторов, свечей зажигания и различных других продуктов. При нагревании глинозем развивает пористую структуру, которая позволяет ему адсорбировать водяной пар. Эта форма оксида алюминия, коммерчески известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей.Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (AAO), обычно получаемый путем электрохимического окисления алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые предусматривают множество применений. Это термически и механически стабильное соединение, а также оптически прозрачный и электрический изолятор. Размер пор и толщину AAO можно легко адаптировать к конкретным применениям, в том числе в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Другим основным соединением является сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Коммерческая форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги в качестве связующего для красителей и поверхностного наполнителя. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием двойных гидратированных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl (SO 4 ) 2 · 12H 2 O (где M представляет собой однозарядный катион, такой как K + ), также содержат ион Al 3+ ; М может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен различными другими ионами М 3+ , т.е.например, галлий, индий, титан, ванадий, хром, марганец, железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы калия. Эти квасцы имеют множество применений, особенно в производстве лекарств, текстиля и красок.
Реакция газообразного хлора с расплавленным металлическим алюминием дает хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, то есть синтетических органических реакций, участвующих в получении широкого спектра соединений, включая ароматические кетоны и антрохинон и его производные.Гидратированный хлорид алюминия, обычно известный как хлоргидрат алюминия, AlCl 3 H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который действует, сужая поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al (OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO - 2 .С водородом алюминий образует гидрид алюминия, AlH 3 , полимерное твердое вещество, из которого получены тетрогидроалюминаты (важные восстановители). Алюминийгидрид лития (LiAlH 4 ), образованный в результате реакции хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов, соответственно.
Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном, старшим редактором.элемент группы бора
- это бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и нионий (Nh).Они характеризуются как группа, имеющая три электрона во внешних частях их атомной структуры. Бор, самый легкий…
материаловедение: алюминий
Поскольку алюминий имеет примерно одну треть плотности стали, его замена стали в автомобилях представляется разумным подходом к снижению веса и, таким образом, увеличению экономии топлива и снижению вредных выбросов.Однако такие замены не могут быть сделаны без должного учета…
химическая промышленность: рафинирование алюминия
Фторная промышленность тесно связана с производством алюминия. Оксид алюминия (оксид алюминия, Al 2 O 3 ) может быть восстановлен до металлического алюминия электролизом при сплавлении с флюсом, состоящим из фторалюмината натрия (Na 3 AlF 6 ), обычно называемым криолитом.После запуска процесса криолит становится…
Общее название: гидроксид алюминия (LOO mi num hye DROX ide)
Фирменное наименование: Amphojel, Alu-Cap, Dialume, Alu-Tab, Alternagel, Aloh-Gel
Медицински рассмотрен Drugs.com 26 февраля 2020 г. - Автор Cerner Multum
Алюминий - это природный минерал. Гидроксид алюминия является антацидом.
Гидроксид алюминия используется для лечения изжоги, расстройства желудка, кислого желудка или кислотного расстройства желудка.Гидроксид алюминия также используется для снижения уровня фосфатов у людей с определенными заболеваниями почек.
Гидроксид алюминия также может использоваться для целей, не указанных в данном руководстве лекарства.
Прежде чем принимать гидроксид алюминия, проконсультируйтесь с врачом или фармацевтом, если у вас есть проблемы с почками, тяжелые запоры, если вы обезвожены или часто пьете алкоголь.
Изжога может имитировать ранние симптомы сердечного приступа.Обратитесь за неотложной медицинской помощью, если у вас боль в груди, которая распространяется на челюсть или плечо, и вы чувствуете беспокойство или головокружение.
Спросите врача или фармацевта, безопасно ли для вас принимать это лекарство, если у вас есть:
болезни почек, история почечных камней;
тяжелые запоры;
, если вы обезвожены; или
, если вы часто пьете алкоголь.
Проконсультируйтесь с врачом перед использованием этого лекарства, если вы беременны или кормите грудью.
Используйте точно так, как указано на этикетке, или в соответствии с вашим доктором.
Гидроксид алюминия обычно принимается между приемами пищи или перед сном.
Возьмите гидроксид алюминия с полным стаканом (8 унций) воды.
Встряхните пероральная суспензия (жидкость), прежде чем измерить дозу. Используйте прилагаемый дозирующий шприц или прибор для измерения дозы лекарственного средства (не кухонную ложку).
Не принимайте гидроксид алюминия более 2 недель без консультации с врачом.
Хранить при комнатной температуре от влаги, тепла и света.
Поскольку гидроксид алюминия используется при необходимости, возможно, вы не находитесь в режиме дозирования. Пропустите любую пропущенную дозу, если пришло время для следующей дозы. Не используйте две дозы одновременно.
Обратитесь за неотложной медицинской помощью или позвоните в службу помощи по отравам по номеру 1-800-222-1222.
Симптомы передозировки могут включать в себя тяжелые запоры, потерю веса, спутанность сознания, изменения настроения или мочеиспускание меньше, чем обычно, или не совсем.
Антациды могут затруднить усвоение организмом других лекарств, которые вы принимаете внутрь. Избегайте приема других лекарств в течение 2 часов до или через 2 часа после приема гидроксида алюминия.
Обратитесь за неотложной медицинской помощью, если у вас признаков аллергической реакции : крапивница; затрудненное дыхание; отек лица, губ, языка или горла.
Прекратите использование лекарства и немедленно позвоните своему врачу, если у вас есть:
сильная боль в животе или запор, потеря аппетита;
боль при мочеиспускании;
мышечная слабость, усталость;
крайняя сонливость; или
кровавый или смолистый стул, кашляющий кровью или рвотой, похожий на кофейную гущу.
Менее серьезные побочные эффекты могут быть более вероятными, и вы можете вообще не иметь их.
Это не полный список побочных эффектов, и могут возникнуть другие. Спросите у своего доктора о побочных эффектах. Вы можете сообщить о побочных эффектах FDA в 1-800-FDA-1088.
Другие лекарства могут влиять на гидроксид алюминия, в том числе отпускаемые по рецепту и без рецепта лекарства, витамины и растительные продукты.Расскажите своему врачу обо всех ваших текущих лекарствах и любых лекарствах, которые вы начинаете или прекращаете использовать.
Помните, храните это и все другие лекарства в недоступном для детей месте, никогда не делитесь своими лекарствами с другими и используйте это лекарство только по назначению.
Всегда консультируйтесь со своим лечащим врачом, чтобы информация, отображаемая на этой странице, соответствовала вашим личным обстоятельствам.
Copyright 1996-2018 Cerner Multum, Inc.Версия: 4.04.
Медицинский отказ от ответственности
Другие бренды: Амфоджель
Натрий (Na) , химический элемент группы щелочных металлов (группа 1 [Ia]) периодической таблицы. Натрий очень мягкий серебристо-белый металл. Натрий является наиболее распространенным щелочным металлом и шестым наиболее распространенным элементом на Земле, составляя 2,8 процента земной коры. В природе он встречается в большом количестве в соединениях, особенно в поваренной соли - хлориде натрия (NaCl), которая образует минерал галит и составляет около 80 процентов растворенных компонентов морской воды.
 Encyclopædia Britannica, Inc.
Encyclopædia Britannica, Inc. Британика Викторина
118 символов и названия периодической таблицы викторины
см
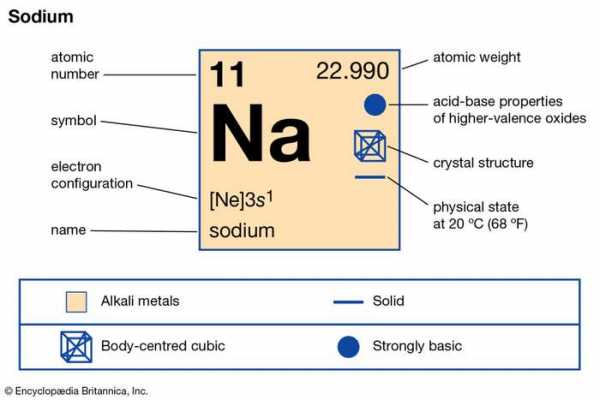
| атомный номер | 11 |
|---|---|
| атомный вес | 22.9898 |
| температура плавления | 97,81 ° C (208 ° F) |
| точка кипения | 882,9 ° C (1 621 ° F) |
| удельный вес | 0,971 (20 ° C) |
| состояний окисления | +1, -1 (редко) |
| электронная конфигурация | 2-8-1 или 1 с 2 2 с 2 2 p 6 3 s 1 |
Поскольку натрий чрезвычайно реактивен, он никогда не встречается в свободном состоянии в земной коре.В 1807 году сэр Хэмфри Дэви стал первым, кто получил натрий в его элементарной форме, применив электролиз к конденсированному гидроксиду натрия (NaOH). Натрий является важной составной частью ряда силикатных материалов, таких как полевые шпаты и слюды. В разных частях света имеются огромные залежи каменной соли, а в Чили и Перу имеются залежи нитрата натрия. Содержание натрия в море составляет приблизительно 1,05 процента, что соответствует концентрации приблизительно 3 процентов галогенидов натрия. Натрий был идентифицирован как в атомной, так и в ионной формах в спектрах звезд, включая Солнце и межзвездную среду.Анализ метеоритов показывает, что присутствующий силикатный материал имеет среднее содержание примерно 4,6 атомов натрия на каждые 100 атомов кремния.
 сэр Хэмфри Дэви сэр Хамфри Дэви, деталь картины маслом сэра Томаса Лоуренса; в Национальной портретной галерее в Лондоне. Предоставлено Национальной портретной галереей, Лондон
сэр Хэмфри Дэви сэр Хамфри Дэви, деталь картины маслом сэра Томаса Лоуренса; в Национальной портретной галерее в Лондоне. Предоставлено Национальной портретной галереей, Лондон Легче воды натрий можно разрезать ножом при комнатной температуре, но при низких температурах он ломкий. Он легко проводит тепло и электричество и в значительной степени проявляет фотоэлектрический эффект (эмиссия электронов при воздействии света).
Натрий, безусловно, самый коммерчески важный щелочной металл. Большинство процессов производства натрия включают электролиз расплавленного хлорида натрия. Недорогой и доступный в количествах цистерн, этот элемент используется для производства присадок к бензину, полимеров, таких как нейлон и синтетический каучук, фармацевтических препаратов и ряда металлов, таких как тантал, титан и кремний. Он также широко используется в качестве теплообменника и в натриевых лампах. Желтый цвет лампы с натриевым паром и пламени натрия (основа аналитического теста на натрий) обозначен двумя заметными линиями в желтой части светового спектра.
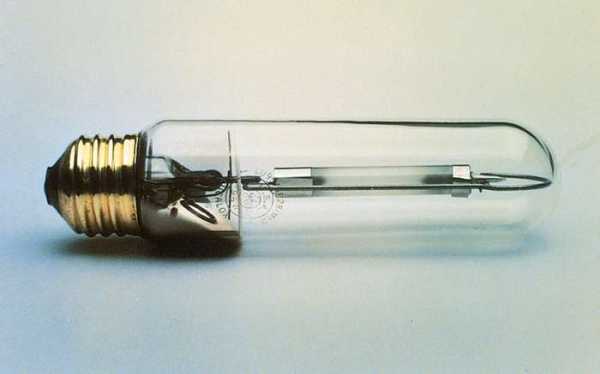 Натриевая лампа высокого давления. (сверху и по центру) W.H. Родос и Г.С. Вэй в Р. В. Кан и М. Б. Бевер (ред.), Энциклопедия материаловедения и инженерии, Дополнительный том. 3, © 1993 Pergamon Press; (внизу) Дженерал Электрик Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодня
Натриевая лампа высокого давления. (сверху и по центру) W.H. Родос и Г.С. Вэй в Р. В. Кан и М. Б. Бевер (ред.), Энциклопедия материаловедения и инженерии, Дополнительный том. 3, © 1993 Pergamon Press; (внизу) Дженерал Электрик Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодня Два из самых ранних применений металлического натрия были в производстве цианида натрия и пероксида натрия.Значительные количества были использованы при производстве тетраэтилсвинца в качестве присадки к бензину, рынок, который исчез с появлением неэтилированного бензина. Существенные количества натрия используются в производстве алкилсульфатов натрия в качестве основного ингредиента в синтетических моющих средствах.
Натрий также используется в качестве исходного материала при производстве гидрида натрия (NaH) и борогидрида натрия (NaBH 4 ). Кроме того, натрий используется в производстве красителей и промежуточных продуктов красителей, в синтезе духов и в широком разнообразии органических восстановлений.Он используется при очистке углеводородов и при полимеризации ненасыщенных углеводородов. Во многих органических применениях натрий используется в виде дисперсий в жидких углеводородных средах.
Расплавленный натрий является отличным теплоносителем, и благодаря этому свойству он нашел применение в качестве теплоносителя в жидкометаллических быстрых реакторах-размножителях. Натрий широко используется в металлургии в качестве раскислителя и восстановителя для получения кальция, циркония, титана и других переходных металлов.Коммерческое производство титана включает восстановление тетрахлорида титана (TiCl 4 ) натрием. Продукты металлические Ti и NaCl.
Натрий обладает высокой реакционной способностью, образуя широкий спектр соединений практически со всеми неорганическими и органическими анионами (отрицательно заряженными ионами). Обычно он имеет степень окисления +1, и его единственный валентный электрон теряется с большой легкостью, образуя бесцветный катион натрия (Na + ). Соединения, которые содержат анион натрия, Na - , также были синтезированы.Основными коммерческими соединениями натрия являются хлорид, карбонат и сульфат.
Наиболее важным и известным соединением натрия является хлорид натрия или поваренная соль NaCl. Большинство других соединений натрия получают прямо или косвенно из хлорида натрия, который встречается в морской воде, в природных рассолах и в виде каменной соли. Большие количества хлорида натрия используются в производстве других тяжелых (промышленных) химических веществ, а также используются непосредственно для удаления льда и снега, для кондиционирования воды и в пищевых продуктах.
 хлорид натрия Хлорид натрия. Henningklevjer
хлорид натрия Хлорид натрия. Henningklevjer Другие основные коммерческие применения хлорида натрия включают его использование в производстве хлора и гидроксида натрия путем электролитического разложения и в производстве карбоната натрия (Na 2 CO 3 ) с помощью процесса Solvay. При электролизе водного раствора хлорида натрия образуются гипохлорит натрия, NaOCl, соединение натрия, кислорода и хлора, которые в больших количествах используются в бытовом хлорном отбеливателе.Гипохлорит натрия также используется в качестве промышленного отбеливателя для бумажной массы и текстиля, для хлорирования воды и в некоторых лекарственных препаратах в качестве антисептика и фунгицида. Это нестабильное соединение, известное только в водном растворе.
Карбонаты содержат карбонат-ион (CO 3 2– ). Бикарбонат натрия, также называемый гидрокарбонатом натрия, или бикарбонат натрия, NaHCO 3 , является источником углекислого газа и поэтому используется в качестве ингредиента в разрыхлителях, в шипучих солях и напитках, а также в качестве основного компонента сухих химические огнетушители.Его небольшая щелочность делает его полезным для лечения повышенной кислотности желудка или мочи и ацидоза. Он также используется в определенных промышленных процессах, таких как дубление и подготовка шерсти. Карбонат натрия, или кальцинированная сода, Na 2 CO 3 , широко распространен в природе и встречается в составе минеральных вод и твердых минералов: натрона, троны и термонатрита. Большое количество этой щелочной соли используется для изготовления стекла, моющих средств и моющих средств. Карбонат натрия обрабатывают углекислым газом для получения бикарбоната натрия.Моногидратная форма карбоната натрия, Na 2 CO 3 · H 2 O, широко используется в фотографии как составная часть разработчиков.
 бикарбонат натрия Бикарбонат натрия (NaHCO3), также известный как пищевая сода или бикарбонат соды. © Geo-grafika / Shutterstock.com
бикарбонат натрия Бикарбонат натрия (NaHCO3), также известный как пищевая сода или бикарбонат соды. © Geo-grafika / Shutterstock.com Сульфат натрия, Na 2 SO 4 , представляет собой белое кристаллическое твердое вещество или порошок, используемый при производстве крафт-бумаги, картона, стекла и моющих средств, а также в качестве сырья для производства различных химических веществ.Его получают либо из месторождений минералов сульфата натрия, мирабилита и затемардита, либо синтетически путем обработки хлорида натрия серной кислотой. Кристаллизованный продукт представляет собой гидрат Na 2 SO 4 · 10H 2 O, широко известный как глауберова соль. Тиосульфат натрия (гипосульфит натрия), Na 2 S 2 O 3 , используется фотографами для фиксации проявленных негативов и отпечатков; он действует путем растворения части солей серебра, нанесенных на пленку, которые остаются неизменными под воздействием света.
Гидроксид натрия (NaOH) - это коррозийное белое кристаллическое вещество, которое легко впитывает влагу, пока не растворится. Обычно называемая каустическая сода, или щелочь, гидроксид натрия является наиболее широко используемой промышленной щелочью. Это очень коррозийно для животных и растительных тканей. Щелочные растворы, которые образуются при растворении в воде, нейтрализуют кислоты в различных промышленных процессах: при переработке нефти удаляют серную и органическую кислоты; в мыловарении реагирует с жирными кислотами. Растворы NaOH используются при обработке целлюлозы и при производстве многих химических веществ.
 Испаритель Испаритель с падающей пленкой для концентрирования растворов едкого натра (гидроксида натрия). Рубен Кастельнуово
Испаритель Испаритель с падающей пленкой для концентрирования растворов едкого натра (гидроксида натрия). Рубен Кастельнуово Нитрат натрия, или нитрат соды, NaNO 3 , обычно называют чилийской селитрой, после того, как ее месторождения полезных ископаемых в северной части Чили являются основным источником. Нитрат натрия используется в качестве азотного удобрения и в качестве компонента динамита.