2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Мигрень считается одним из наиболее древних и распространенных заболеваний. Судя по сохранившимся данным, можно утверждать, что мигренью страдали многие выдающиеся люди: Юлий Цезарь, Исаак Ньютон, Карл Маркс, Чарльз Дарвин, Фредерик Шопен, Зигмунд Фрейд, Эдгар По, А. П. Чехов, П. И. Чайковский. Даже в письменах шумерской цивилизации, которые датированы за 3000 лет до Рождества Христова есть первые упоминания о симптомах страдания, которое мы называем мигрень. Несмотря на это лечение мигрени все эти годы оставалось непосильной задачей и только в последние 20 лет удалось достичь явных успехов в её лечении.
Довольно часто диагностика мигрени бывает избыточной, то есть при любой головной боли пациентом, чаще самостоятельно, определяется диагноз — мигрень. Либо, наоборот, смирившись с головной болью, пациент об этом забывает даже пожаловаться. Исходя из этого, следует учитывать следующие диагностические критерии мигренозной головной боли (мигренозной цефалгии).
Чтобы заподозрить мигренозную цефалгию, головная боль должна иметь по меньшей мере 2 из перечисленных признаков:
Головная боль должна сопровождаться хотя бы одним из сопутствующих симптомов: тошнотой, рвотой, свето- и звукобоязнью и длиться от 4 до 72 часов (при отсутсвии медицинской помощи). Чтобы поставить диагноз мигрени таких атак должно развиться как минимум 5. Помогает в постановке диагноза наличие наследственного анамнеза.
Описанная клиническая картина отвечает диагнозу простой мигрени или мигрень без ауры, которая встречается в 75% случаев мигренозных пароксизмов.
Для эффективного купирования мигренозной атаки следует помнить, что мигренозный приступ протекает в 3 фазы: продромальная, во время которой происходит повышение уровня серотонина в крови и вазоспазм. При этом боли нет, могут наблюдаться предвестники в виде изменения настроения, сонливость и т.п. Вторая фаза – болевая, она связана со снижением уровня серотонина и вазодилатацией. Во время третьей фазы происходит отёк и полное расслабление сосудистой стенки с выделением брадикинина, гистамина и др. активных веществ, что клинически проявляется тошнотой, рвотой и усилением пульсации, после чего приступ угасает. Естественно, что терапевтические мероприятия для лечения мигрени наиболее эффективны в первую или в самом начале второй фазы.
При этом боли нет, могут наблюдаться предвестники в виде изменения настроения, сонливость и т.п. Вторая фаза – болевая, она связана со снижением уровня серотонина и вазодилатацией. Во время третьей фазы происходит отёк и полное расслабление сосудистой стенки с выделением брадикинина, гистамина и др. активных веществ, что клинически проявляется тошнотой, рвотой и усилением пульсации, после чего приступ угасает. Естественно, что терапевтические мероприятия для лечения мигрени наиболее эффективны в первую или в самом начале второй фазы.
Реже встречается мигрень с аурой, представляющей собой комплекс очаговых неврологических симптомов, продолжительностью не более часа, возникающих в ответ на снижение мозгового кровотока в отдельных участках мозга. Характер этих неврологических симптомов, а значит и вариант ауры, зависит от вовлечения в патологический процесс соответствующего сосудистого бассейна. Боль при мигрени с аурой развивается не позднее, чем через час или сразу же после ауры и может продолжаться от 4 до 72 часов.
Наиболее часто встречаются офтальмическая мигрень. В этом случае головную боль сопровождают фотопсии в виде мерцающих зигзагов, искр, точек, а также возможно наличие скотом или гемианопсий (выпадение участков или половины поля зрения). Офтальмическая мигрень связана с бассейном задней мозговой артерии. При ретинальной мигрени наблюдается переходящая слепота на один или оба глаза, центральная или парацентральная скотома, что связано с ишемией сетчатки.
Гемиплегическая мигрень сопровождается гемипарезами, гемипестезиями или гемипарастезиями и при первом приступе требует дефференциальной диагностики с нарушением мозгового кровообращения в средней мозговой артерии.
Неврологическими симптомами при офтальмоплегической мигрени являются односторонний птоз, мидриаз, расходящееся косоглазие, двоение, что требует дифференциальной диагностики с наличием сосудистой аневризмы в области кавернозного синуса. Базилярная мигрень диагностируется при наличии двухсторонних расстройств зрения, слепоты, системного головокружения, шума в ушах, дизартрия (нечленораздельной речи), что связано с ишемией в вертебро-базилярной сосудистом бассейне, кровоснабжающем ствол головного мозга, мозжечок и затылочную долю коры больших полушарий.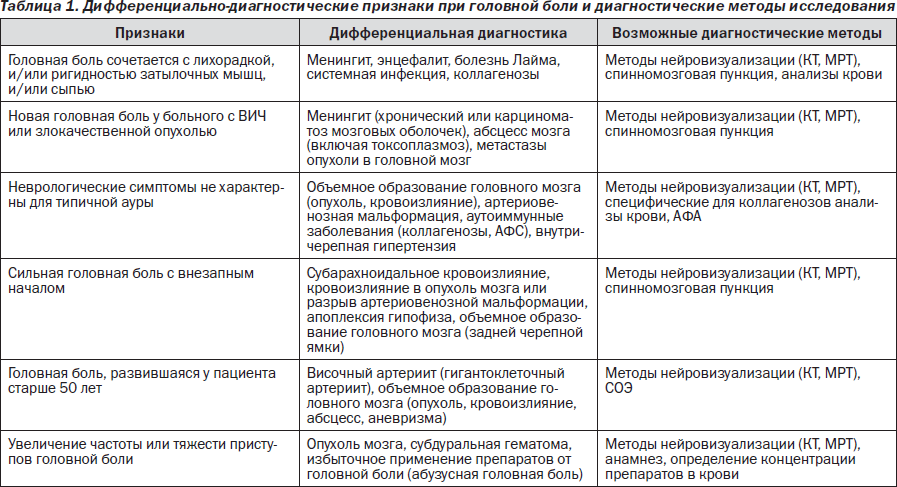
Нужно помнить об особенностях течения мигрени у детей, которая может проявляться в виде доброкачественного пароксизмального головокружения и не сопровождаться болевыми феноменами.
Очевидно, что диагноз мигрени с аурой должен ставиться при исключении признаков органического заболевания, способного имитировать мигренозный пароксизм и при наличии следующих критериев:
Наличие как минимум двух приступов, имеющих, по крайней мере, три из четырех признаков:
При анализе клинической картины приступа мигрени необходимо не пропустить наличие у пациента настораживающих симптомов:

Медикаментозное лечение мигрени делиться на купирование приступа и абортивное, направленное на предупреждение развития мигренозных пароксизмов.
Для профилактики применяются блокаторы кальциевых каналов, бетаблокаторы и антидеспрессанты.
Для купирования мигренозного пароксизма используется три группы препаратов: аспирин и его комбинации с кофеином; препараты, содержащие эрготамин и агонисты серотониновых рецепторов (триптаны). Препарат должен приниматься пациентом как можно раньше, в самом начале приступа. Индивидуально при недостаточной эффективности могут использоваться транквилизаторы и дегидратирующие препараты.
Одной из самых частых жалоб больных на амбулаторном приеме у невролога, терапевта и оториноларинголога является головокружение. Его причиной может быть базилярная мигрень (БМ) - редкая форма мигрени с аурой. В соответствии с Международной классификацией головной боли II пересмотра (2003 г.) [1] БМ определяется как мигрень с симптомами ауры, происходящими из ствола мозга и/или обоих полушарий, и не сопровождающаяся моторной слабостью. Диагностические критерии такой мигрени согласно указанной классификации приведены в табл. 1.
Распространенность мигрени в разных группах населения достигает 5-17% [2, 3], а частота ее сочетания с головокружением - 1-3% [4, 5]. По данным Т. Брандт [6], основой головокружений в 9,6% случаев служит именно БМ. Следует отметить высокий риск церебрального ангиоспазма при БМ, в связи с чем, так же как при семейной гемиплегической мигрени, не рекомендуется применение триптанов [7, 8].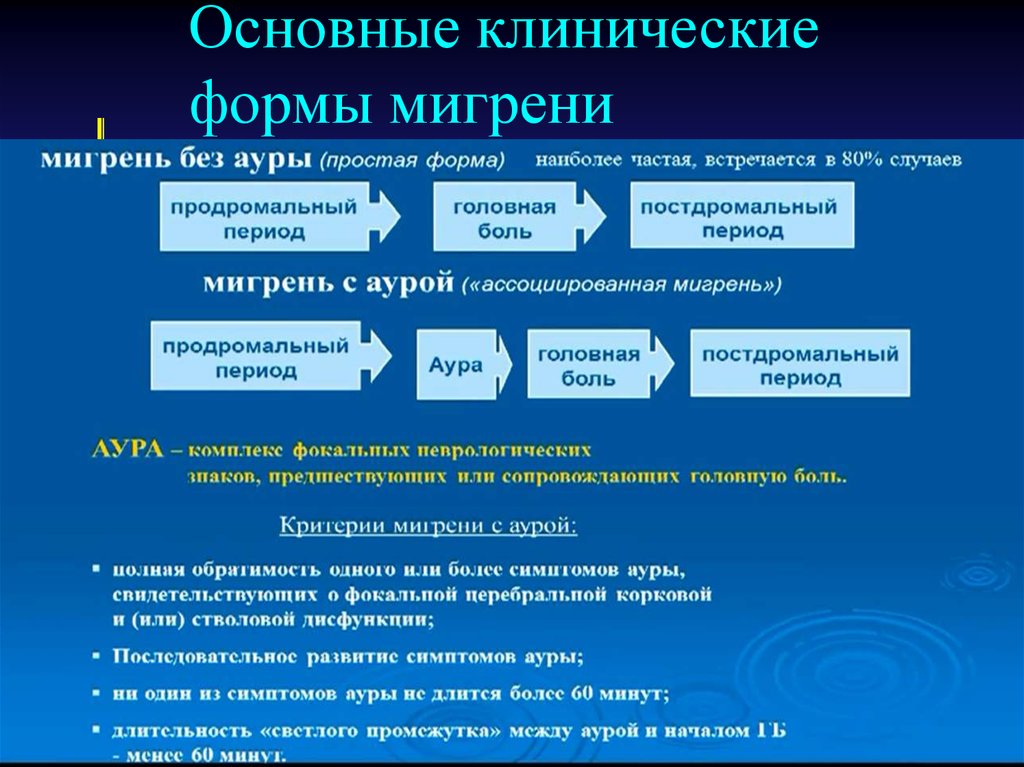
Несмотря на риск тяжелых осложнений, установление правильного диагноза БМ часто запаздывает. Причиной служит затрудненная оценка анамнеза и клинической картины: в зависимости от комплекса симптомов состояние может определяться как задний шейный симпатический синдром, болезнь Меньера, инфаркт в вертебрально-базилярной системе.
Цель настоящего исследования - разработка подходов к улучшению диагностики БМ на основе анализа особенностей клинической картины и данных дополнительных методов исследования.
Были обследованы 11 больных, госпитализированных в Московский научно-практический центр оториноларингологии им. Л.И. Свержевского в связи с тяжелыми приступами системного головокружения. Среди больных было 5 мужчин и 6 женщин в возрасте 37-68 лет (средний - 52,25±8,77 года).
Основным критерием отбора служило сочетание головокружения с головной болью. Детальный сбор анамнеза и уточнение характеристики приступов показали, что в их составе, помимо головокружения, часто присутствовали зрительные и/или слуховые, а также координаторные нарушения, синкопальные или липотимические состояния. Головная боль развивалась, как правило, через 1-1,5 ч после развития таких симптомов, которые после этого обычно регрессировали.
Головная боль развивалась, как правило, через 1-1,5 ч после развития таких симптомов, которые после этого обычно регрессировали.
Длительность периода от начала болезни до постановки диагноза колебалась в широких пределах: в 2 случаях - менее 1 года, в 2 - более 10 лет (15 и 25), в 7 - от 2 до 5 лет. Помимо неврологического и отоневрологического осмотра, во всех 11 случаях проводили аудиометрическое и комплексное вестибулологическое исследование, включавшее видеоокулографию, исследование окуломоторных реакций, пробы на равновесие и координацию, позиционные тесты, битермальную калоризацию лабиринтов, электрокохлеографию. Осуществляли также ультразвуковое ангиосканирование (УЗАС) брахиоцефальных и интракраниальных артерий с функциональными пробами.
В случае наличия жалоб на боли в шее проводилось также рентгенографическое исследование шейного отдела позвоночника с функциональными пробами (наклоны головы вперед и назад), а при выявлении очаговой неврологической симптоматики - магнитно-резонансная томография (МРТ) головного мозга.
У 8 больных из 11 субъективное восприятие ауры было настолько тяжелее мигренозной составляющей приступа, что пациенты иногда не упоминали о боли. Именно это и приводило зачастую к отсроченной диагностике БМ. В половине случаев головная боль локализовалась в затылочной области и носила пульсирующий характер (табл. 2). У 30% больных она сопровождалась фото- и/или фонофобией, тошнотой и рвотой, приносящей облегчение. У 3 больных длительность приступов достигала 24-72 ч, еще у 1 отмечали пролонгирование симптомов ауры (до 8 ч) на время болевой фазы приступа. Очаговые неврологические симптомы были выявлены у 6 из 11 человек. При МРТ очаги глиоза обнаружены в 4 случаях и еще в 2 случаях анамнестические данные указывали на острую сосудистую мозговую катастрофу во время болевого приступа в прошлом.
Обращает на себя внимание высокая частота шейной патологии в группе обследуемых: указание на травму шеи - в 5 случаях, болевые синдромы шейной локализации - в 8, рентгенологические признаки патологии шейного отдела позвоночника или краниовертебрального перехода, включающие аномалии Киммерле, Арнольда-Киари и лестничную нестабильность шейных позвоночных двигательных сегментов, - в 6 случаях.
Транзиторные подъемы артериального давления были отмечены в 7 случаях. Несмотря на частое диагностирование сосудистой патологии в изучаемой группе больных, изменение просвета или хода позвоночных артерий (ПА) встречалось редко: 1 случай гипоплазии, 1 - S-образной извитости без локального гемодинамического перепада до вхождения в канал поперечных отростков, 1 - 30% стенозирования в устье ПА.
Представляют интерес результаты вестибулологического исследования (табл. 3). Они позволили выявить высокую частоту нарушения функции вестибулярного анализатора: в той или иной форме кохлеовестибулярный синдром зарегистрирован у всех 11 пациентов с БМ.
При головных болях односторонней локализации нарушение вестибулярной функции отмечалось на стороне болей. Эпизодический или постоянный шум в ухе, аудиометрические признаки нейросенсорной тугоухости также отмечались на стороне цефалгии.
Учитывая частоту вертеброгенной патологии в рассматриваемой группе пациентов и необходимость соблюдения критерия Е (см. табл. 1) при диагностике БМ, особенно остро встает вопрос о дифференциальной диагностике базилярной и шейной мигрени. Термин «шейная мигрень», как известно, был предложен В. Бартчи-Рошен. Он может также обозначаться как синдром Барре-Льеу. В МКБ-10 данный симптомокомплекс рассматривается в рубрике G99.2 и включает в себя клинику заднешейного симпатического синдрома, повторяющиеся эпизоды вертебрально-базилярной недостаточности [9, 10], эпизоды дроп-атак и синдром Унтерхарншайдта [11, 12].
табл. 1) при диагностике БМ, особенно остро встает вопрос о дифференциальной диагностике базилярной и шейной мигрени. Термин «шейная мигрень», как известно, был предложен В. Бартчи-Рошен. Он может также обозначаться как синдром Барре-Льеу. В МКБ-10 данный симптомокомплекс рассматривается в рубрике G99.2 и включает в себя клинику заднешейного симпатического синдрома, повторяющиеся эпизоды вертебрально-базилярной недостаточности [9, 10], эпизоды дроп-атак и синдром Унтерхарншайдта [11, 12].
Основной характеристикой шейной мигрени является интенсивная боль, распространяющаяся из шейно-затылочной области на теменную и лобную. Она характеризуется как ощущение «снимания шлема» и сопровождается различными вегетативными проявлениями (табл. 4).
Таким образом, алгическая характеристика у обследованных нами пациентов, невзирая на наличие суставной и мышечной патологии в области шеи, а также аномалий развития и травм в анамнезе, соответствует БМ, а не синдрому Барре-Льеу. Какова же связь мигренозных пароксизмов и цервикальной патологии? Возможно, именно определенная интенсивность ноцицептивной импульсации, исходящей из шейных структур, провоцирует особый вариант приступа, включающий ауру с доминированием симптомов стволовой локализации и цефалгию. Для подтверждения этой гипотезы приведем одно из наших наблюдений.
Какова же связь мигренозных пароксизмов и цервикальной патологии? Возможно, именно определенная интенсивность ноцицептивной импульсации, исходящей из шейных структур, провоцирует особый вариант приступа, включающий ауру с доминированием симптомов стволовой локализации и цефалгию. Для подтверждения этой гипотезы приведем одно из наших наблюдений.
У страдающей БМ пациентки во время курса лечения мягкотканевыми техниками мануальной терапии по поводу шейного миофасциального синдрома локальным воздействием на триггерную точку в нижней косой мышце головы была спровоцирована типичная для больной аура мигренозного приступа. В данном случае важно отметить развитие именно мигренозного эквивалента, а не характерного для цервикальной патологии заднешейного симпатического синдрома.
Привлекает внимание высокая частота выявления гидропса лабиринта у пациентов с БМ; но причина их сопряженности не ясна [13-15]. Клинические проявления этих заболеваний имеют много общего при наличии и существенных различий (табл.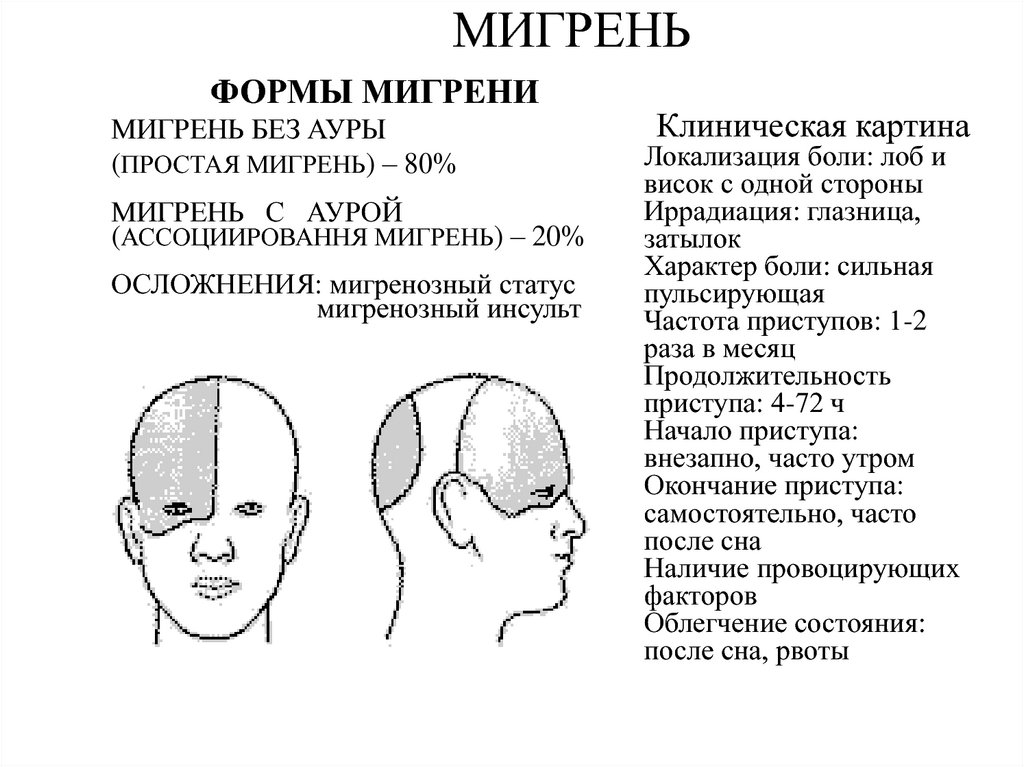 5). Теоретически можно представить три варианта: сочетание мигрени и болезни Меньера [16-18]; гидропс лабиринта как пусковой механизм БМ; вторичный гидропс лабиринта у больного с приступами БМ. На практике, вероятно, могут встречаться все три варианта. Однако есть факторы, которые, на наш взгляд, делают более обоснованным третье предположение: 1) включение системного головокружения, шума в ухе с тошнотой и рвотой в состав более обширного симптомокомплекса, за которым следует болевая фаза приступа; 2) как правило, длительный предшествующий мигренозный анамнез без соответствующей ауры; 3) эффект противомигренозных, а не противоменьеровских средств при купировании приступа БМ.
5). Теоретически можно представить три варианта: сочетание мигрени и болезни Меньера [16-18]; гидропс лабиринта как пусковой механизм БМ; вторичный гидропс лабиринта у больного с приступами БМ. На практике, вероятно, могут встречаться все три варианта. Однако есть факторы, которые, на наш взгляд, делают более обоснованным третье предположение: 1) включение системного головокружения, шума в ухе с тошнотой и рвотой в состав более обширного симптомокомплекса, за которым следует болевая фаза приступа; 2) как правило, длительный предшествующий мигренозный анамнез без соответствующей ауры; 3) эффект противомигренозных, а не противоменьеровских средств при купировании приступа БМ.
Таким образом, есть основания рассматривать гидропсис лабиринта как осложнение мигрени. По-видимому, в его происхождении существенную роль может играть сопутствующая мигрени задержка жидкости, связанная с нарушением венозного оттока из полости черепа. В свою очередь гидропс лабиринта, проявляясь специфической вестибулопатической симптоматикой и способствуя формированию характерной ауры, может провоцировать приступ БМ.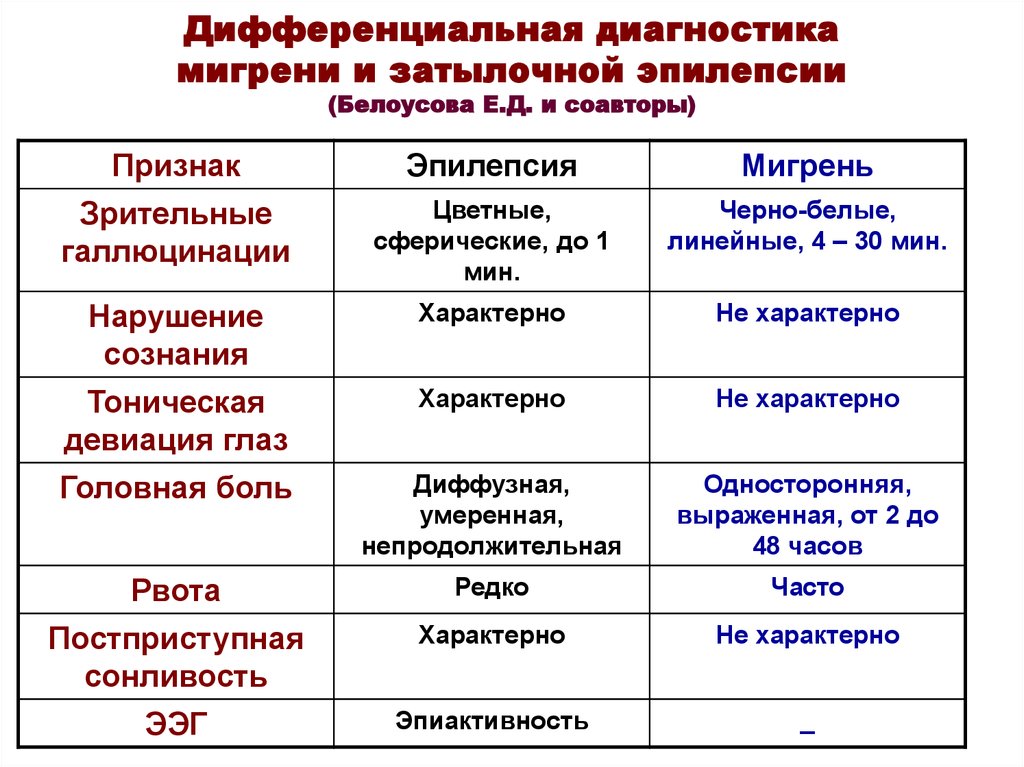 Это приводит к тому, что круг патологических событий замыкается и в дальнейшем отдельные элементы патогенеза обеспечивают взаимную провокацию. Такой взгляд на развитие заболевания совпадает с мнением В.И. Бабияк [19], который предлагает рассматривать болезнь Меньера как частный случай мигрени.
Это приводит к тому, что круг патологических событий замыкается и в дальнейшем отдельные элементы патогенеза обеспечивают взаимную провокацию. Такой взгляд на развитие заболевания совпадает с мнением В.И. Бабияк [19], который предлагает рассматривать болезнь Меньера как частный случай мигрени.
Перечисленные факты позволяют рассматривать БМ как многокомпонентную патологию, в происхождении которой имеют значение как классические мигренозные механизмы, так и патология шейных структур (аномалии развития, заболевания суставов, мышц, позвоночных артерий). Создается впечатление, что сочетание разных видов болезненных процессов шейной области ведет к утяжелению приступов БМ. Присоединение гидропса лабиринта и повреждения головного мозга, затрагивающие проводящие пути вестибулярного анализатора, могут утяжелить процесс и вести к учащению приступов.
Изложенное выше позволяет объяснить более тяжелое течение БМ по сравнению с типичными формами мигрени, а также указывает на необходимость комплексного подхода к купированию приступов и межприступному лечению. Оно должно включать наряду с традиционными антимигренозными препаратами средства воздействия на структуры шеи и лабиринта. Перспективным для купирования приступов БМ может быть блокирование триггерных пунктов шейных мышц. Роль дисциркуляторного фактора в генезе заболевания должна быть уточнена в процессе дальнейших исследований.
Оно должно включать наряду с традиционными антимигренозными препаратами средства воздействия на структуры шеи и лабиринта. Перспективным для купирования приступов БМ может быть блокирование триггерных пунктов шейных мышц. Роль дисциркуляторного фактора в генезе заболевания должна быть уточнена в процессе дальнейших исследований.
Обзор
. 2004 Апрель; 3 (4): 237-45.
doi: 10.1016/S1474-4422(04)00709-4.
Джин Шенен 1 , Питер С. Шандор
 be
be Обзор
Jean Schoenen et al. Ланцет Нейрол. 2004 Апрель
. 2004 Апрель; 3 (4): 237-45.
дои: 10.1016/S1474-4422(04)00709-4.
Жан Шенен 1 , Питер С. Шандор
 [email protected]
[email protected] Синдромы головной боли могут быть связаны с очаговыми неврологическими симптомами или признаками. Хорошее знание первичных головных болей, подробный анамнез и тщательное клиническое обследование являются предпосылками для их дифференциальной диагностики. Неврологические симптомы, вызванные мигренозной аурой, являются наиболее характерными и узнаваемыми. Однако структурные поражения, такие как сосудистые мальформации, могут вызывать симптомы, сходные с мигренью с аурой, что подчеркивает необходимость параклинических исследований у большинства пациентов с головной болью и очаговыми неврологическими симптомами. В этом обзоре мы представляем обзор дифференциальной диагностики наиболее распространенных головных болей с очаговыми неврологическими симптомами или признаками, чтобы освежить дифференциально-диагностические знания практикующего невролога в клинической ситуации и помочь в обучении резидентов-неврологов.
В этом обзоре мы представляем обзор дифференциальной диагностики наиболее распространенных головных болей с очаговыми неврологическими симптомами или признаками, чтобы освежить дифференциально-диагностические знания практикующего невролога в клинической ситуации и помочь в обучении резидентов-неврологов.
Диагностика и классификация головной боли.
Тейлор Фр. Тейлор ФР. Прим Уход. 2004 г., июнь 31 (2): 243–59, v. doi: 10.1016/j.pop.2004.02.002. Прим Уход. 2004. PMID: 15172505 Рассмотрение.
Дифференциальная диагностика головной боли в неврологическом отделении.
Джентиле С., Ло Джудиче Р., Ферреро М., Пинесси Л. Джентиле С. и др. Панминерва Мед. 2003 г., сен; 45 (3): 203-9. Панминерва Мед. 2003. PMID: 14618119 Рассмотрение.
Панминерва Мед. 2003. PMID: 14618119 Рассмотрение.
Отчет о черепно-вегетативных симптомах мигрени.
Гупта Р., Бхатия М.С. Гупта Р. и др. цефалгия. 2007 Январь; 27 (1): 22-8. doi: 10.1111/j.1468-2982.2006.01237.x. цефалгия. 2007. PMID: 17212679
Головная боль: диагностика и лечение.
Бенедек К., Тайти Дж., Вечей Л. Бенедек К. и др. Орв Хетил. 2006 г., 17 сентября; 147 (37): 1771-6. Орв Хетил. 2006. PMID: 17131796 Рассмотрение. Венгерский.
Цервикогенная головная боль у пациентов с подозрением на мигрень: пропущенный диагноз или ошибочный диагноз?
Йи X, Кук А.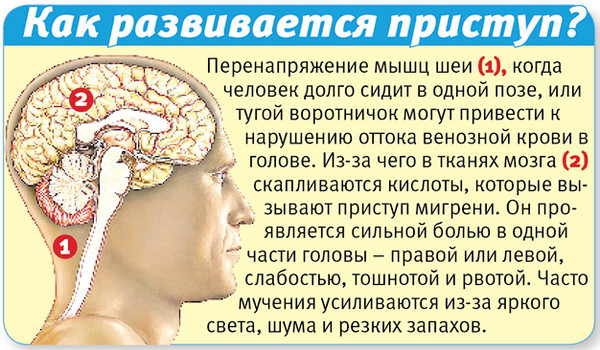 Дж., Хэмилл-Рут Р.Дж., Роулингсон Дж.К. Yi X и др. Джей Пейн. 2005 г., 6 октября (10): 700-3. doi: 10.1016/j.jpain.2005.04.005. Джей Пейн. 2005. PMID: 16202963
Дж., Хэмилл-Рут Р.Дж., Роулингсон Дж.К. Yi X и др. Джей Пейн. 2005 г., 6 октября (10): 700-3. doi: 10.1016/j.jpain.2005.04.005. Джей Пейн. 2005. PMID: 16202963
Посмотреть все похожие статьи
Воспалительные поражения и опухоли головного мозга: можно ли их дифференцировать по особенностям текстуры при магнитно-резонансной томографии?
Алвес АФФ, Миранда ХРА, Рейс Ф, де Соуза САС, Алвес ЛЛР, Фейтоза ЛМ, де Кастро ХТС, де Пина ДР. Алвес АФФ и др. J Venom Anim Toxins Incl Trop Dis. 2020 4 сентября; 26:e20200011. doi: 10.1590/1678-9199-JVATITD-2020-0011. J Venom Anim Toxins Incl Trop Dis. 2020. PMID: 32952531 Бесплатная статья ЧВК.
Лечение детской головной боли в отделении неотложной помощи. Обзор литературы.
Обзор литературы.
Рауччи У., Делла Веккья Н., Осселла С., Паолино М.С., Вилла М.П., Реале А., Паризи П. Рауччи У и др. Фронт Нейрол. 2019 авг 23;10:886. doi: 10.3389/fneur.2019.00886. Электронная коллекция 2019. Фронт Нейрол. 2019. PMID: 31507509 Бесплатная статья ЧВК. Рассмотрение.
Синдромы первичной головной боли у пожилых людей: эпидемиология, диагностика и лечение.
Ван Оостерхаут В.П.Дж., Чунг С., Хаан Дж. ван Остерхаут WPJ и др. J Clin Transl Res. 2016 15 апреля; 2(2):45-51. Электронная коллекция 2016 20 июня. J Clin Transl Res. 2016. PMID: 30873460 Бесплатная статья ЧВК. Рассмотрение.
Головная боль и ее подход в современном отделении нейрореанимации.
Dhakal LP, Harriott AM, Capobianco DJ, Freeman WD. Дхакал Л.П. и др. Нейрокрит Уход. 2016 Октябрь; 25 (2): 320-34. doi: 10.1007/s12028-016-0260-z. Нейрокрит Уход. 2016. PMID: 27000642 Рассмотрение.
Дхакал Л.П. и др. Нейрокрит Уход. 2016 Октябрь; 25 (2): 320-34. doi: 10.1007/s12028-016-0260-z. Нейрокрит Уход. 2016. PMID: 27000642 Рассмотрение.
Головные боли, связанные с нарушениями зрения.
Марзоли С.Б., Крискуоли А. Марзоли С.Б. и соавт. Неврология наук. 2015 Май; 36 Приложение 1:85-8. doi: 10.1007/s10072-015-2167-4. Неврология наук. 2015. PMID: 26017519 Рассмотрение.
Просмотреть все статьи "Цитируется по"
Абстрактный
37-летняя женщина поступила с жалобами на прогрессирующее усиление головной боли. У нее не было головной боли в анамнезе, и первоначальное обследование выявило гидроцефалию неясной этиологии. Установлен вентрикулоперитонеальный шунт с улучшением. Однако к ней вернулась головная боль, и у нее развился неврологический дефицит. Визуализирующие исследования выявили множественные кистозные образования в задней черепной ямке. Исследования сыворотки и спинномозговой жидкости не выявили, и была выполнена биопсия кистозных поражений. Обсуждаются клинический подход, дифференциальный диагноз и нейропатологические данные.
У нее не было головной боли в анамнезе, и первоначальное обследование выявило гидроцефалию неясной этиологии. Установлен вентрикулоперитонеальный шунт с улучшением. Однако к ней вернулась головная боль, и у нее развился неврологический дефицит. Визуализирующие исследования выявили множественные кистозные образования в задней черепной ямке. Исследования сыворотки и спинномозговой жидкости не выявили, и была выполнена биопсия кистозных поражений. Обсуждаются клинический подход, дифференциальный диагноз и нейропатологические данные.
37-летняя женщина без головной боли в анамнезе обратилась к своему лечащему врачу с жалобами на усиление ежедневной головной боли в течение 1 месяца. Головная боль была голоцефальной, усиливалась в положении лежа и уменьшалась в положении сидя или стоя. У нее было ассоциированное головокружение, тошнота, рвота и нарушение походки. Ее история болезни включала гипертонию, гиперлипидемию, сахарный диабет 2 типа и шизофрению. Ее текущими препаратами были лизиноприл, симвастатин, гидрохлорид метформина, гидрохлорид бупропиона и рисперидон.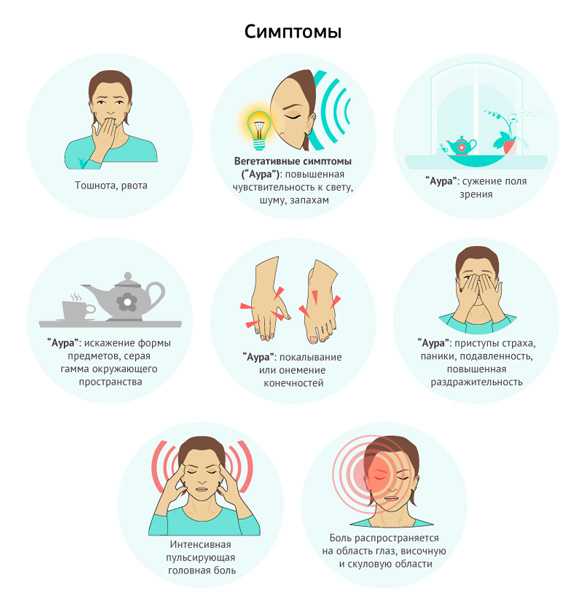 У нее не было известных аллергий. Она родилась и выросла в Калифорнии, некоторое время была бездомной и никогда не выезжала за пределы Соединенных Штатов. Она была нынешним курильщиком с историей курения 40 пачек в год. Она выпивала от 6 до 12 алкогольных напитков в неделю. Время от времени она употребляла марихуану и отрицала употребление других наркотиков, в том числе внутривенных. В семейном анамнезе неврологических расстройств не было. Общие данные медицинского осмотра в норме.
У нее не было известных аллергий. Она родилась и выросла в Калифорнии, некоторое время была бездомной и никогда не выезжала за пределы Соединенных Штатов. Она была нынешним курильщиком с историей курения 40 пачек в год. Она выпивала от 6 до 12 алкогольных напитков в неделю. Время от времени она употребляла марихуану и отрицала употребление других наркотиков, в том числе внутривенных. В семейном анамнезе неврологических расстройств не было. Общие данные медицинского осмотра в норме.
Компьютерная томография (КТ) головы без контраста выявила панвентрикулярное расширение, соответствующее гидроцефалии. Магнитно-резонансная томография (МРТ) головного мозга без усиления не выявила объемного поражения. У нее не было в анамнезе факторов риска развития гидроцефалии, включая предшествующую травму головы, внутричерепное кровоизлияние или инфекцию центральной нервной системы (ЦНС).
Вентрикулоперитонеальный (ВП) шунт был установлен с клиническим исчезновением ее симптомов и улучшением рентгенологических показателей. Анализ спинномозговой жидкости (ЦСЖ) во время процедуры не выявил клеток, нормальные уровни белка и глюкозы и отрицательные бактериальные культуры.
Анализ спинномозговой жидкости (ЦСЖ) во время процедуры не выявил клеток, нормальные уровни белка и глюкозы и отрицательные бактериальные культуры.
Симптомы у пациентки разрешились до тех пор, пока через 6 месяцев у нее не развилась головная боль. Она не сообщила об отсутствии визуальных симптомов, тошноты или рвоты. Ее головная боль была голоцефальной, без позиционных эффектов и легко купировалась ибупрофеном. КТ головы без контраста не выявила внутричерепной патологии, стабильной декомпрессии желудочков и адекватного размещения шунта VP. В течение следующих 4 месяцев ее головная боль усилилась, возникала ежедневно и сопровождалась светобоязнью, тошнотой и рвотой. Имелась перемежающаяся диплопия в нескольких направлениях взгляда. Головная боль усиливалась по утрам и временами будила ее ото сна. Она не сообщала о лихорадке, ознобе, сыпи, потере веса или боли в животе. Дисфункции кишечника и мочевого пузыря не было. Она обратилась в отделение неотложной помощи через 1 неделю после появления ригидности затылочных мышц.
При общем осмотре: лихорадки нет, артериальное давление 145/83 мм рт.ст. Ее частота сердечных сокращений, дыхание и насыщение кислородом воздуха в помещении были в норме. Она была потогонной. Она подтверждала боль при пассивных движениях шеи, но имела полный диапазон движений. Сердечно-сосудистые, легочные, абдоминальные и кожные исследования были в норме.
При неврологическом осмотре она казалась сонливой, но могла говорить с нормальной ориентацией. Зрачковые рефлексы на свет и результаты осмотра глазного дна были нормальными. Произошел скачкообразный срыв плавного преследования. Экстраокулярные движения сохранены. У нее была двусторонняя слабость и спастическая дизартрия. Отмечалась легкая слабость сгибателей шеи. Тонус спастический в верхних конечностях с обеих сторон, полной силы на всем протяжении. Рефлексы были диффузно оживленными с двусторонними симптомами Хоффмана, отсутствием подергиваний нижней челюсти и подошвенными рефлексами сгибателей. Результаты сенсорного обследования и аппендикулярная координация были нормальными. Ее походка была широкой и атаксической.
Ее походка была широкой и атаксической.
Лабораторные и радиологические данные
Метаболический профиль сыворотки пациента и полный анализ крови с дифференциалом были нормальными. На КТ головы без контраста выявлено множественное кистозное поражение задней черепной ямки. МРТ головного мозга с усилением гадолинием продемонстрировала локальные, экстрааксиальные и внутрипаренхиматозные скопления жидкости с неравномерным узловатым усилением вдоль их границ в полушариях мозжечка и вдоль структур задней черепной ямки (рис. 1А). Масс-эффект с выраженной компрессией нижних отделов мозжечка и червя, четвертого желудочка, продолговатого мозга и верхних отделов шейного отдела спинного мозга. Кистозная жидкость имела ту же интенсивность сигнала, что и ЦСЖ. Признаков ограничения диффузии не было (рис. 1В). Одна киста показала изоинтенсивную T2 внутреннюю узловую структуру (рис. 1C). МРТ позвоночника с усилением гадолинием выявила выраженную компрессию верхнего шейного отдела спинного мозга от С1 до С4 экстрамедуллярными кистозными скоплениями (рис. 1D). Обширное, диффузное, узловатое лептоменингеальное усиление вдоль всего спинного мозга. Отсутствовала внутренняя аномалия сигнала шнура.
1D). Обширное, диффузное, узловатое лептоменингеальное усиление вдоль всего спинного мозга. Отсутствовала внутренняя аномалия сигнала шнура.
Выполнена люмбальная пункция, первоначальные результаты СМЖ представлены в Таблице 1. Сыворотка и СМЖ иммуноферментного анализа на Taenia solium , среди других исследований, были отправлены на анализ. Результаты дополнительных исследований ЦСЖ и сыворотки представлены в таблице 2.
Пациенту в течение дня была назначена премедикация дексаметазоном, а затем начато лечение альбендазолом по поводу предполагаемого нейроцистицеркоза (НЦЦ). Через шесть часов после получения первой дозы альбендазола у нее резко ухудшилось психическое состояние, и она была переведена в отделение интенсивной терапии. Повторная КТ головы выявила интервальное развитие гидроцефалии по сравнению с визуализацией 5 днями ранее, и был установлен наружный вентрикулярный дренаж. Альбендазол был отменен, а дексаметазон был продолжен. МРТ с усилением гадолинием продемонстрировало развитие нового кистозного паренхиматозного поражения с усилением обода в левом полушарии мозжечка (рис.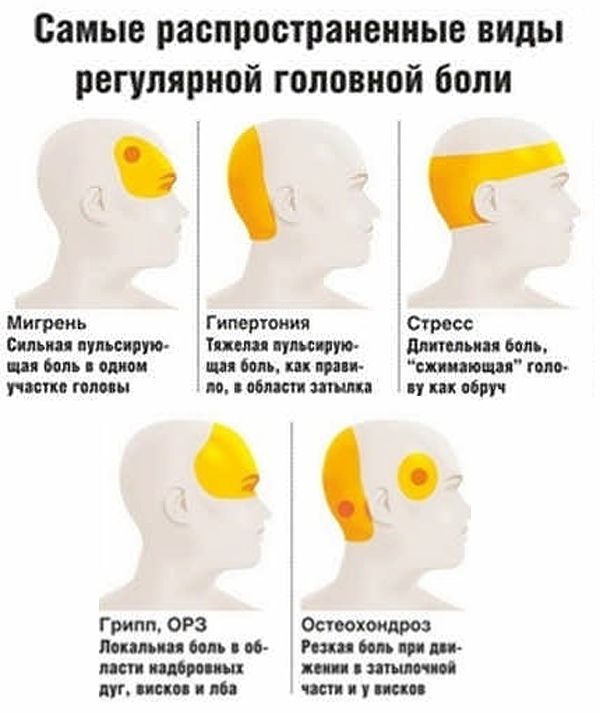 1E и F).
1E и F).
Несмотря на установку наружного вентрикулярного дренажа, в течение следующих 4 дней клиническое состояние пациента ухудшилось с признаками усугубления компрессии ствола мозга. Иммуноферментный анализ сыворотки и спинномозговой жидкости на T solium дал отрицательный результат. Учитывая ухудшение компрессии ствола головного мозга и недиагностические исследования сыворотки и спинномозговой жидкости (таблица 2), ей была выполнена субокципитальная трепанация черепа с биопсией лептоменингеальной кисты.
Клиническое обсуждение
Представление этой женщины с впервые появившейся ежедневной головной болью, которая усиливалась в положении лежа и сопровождалась головокружением, тошнотой, рвотой и нарушением походки, предполагает повышенное внутричерепное давление. Временное течение болезни предполагает подострый процесс. Ее первоначальная нейровизуализация выявила гидроцефалию с панвентрикулярным расширением без каких-либо признаков обструктивного объемного поражения, что предполагает процесс, поражающий субарахноидальные пространства или поверхности, всасывающие спинномозговую жидкость. Это может наблюдаться при состояниях, вызывающих острое воспаление или отсроченное рубцевание или фиброз (например, травма, инфекция или кровоизлияние), а также при лептоменингиальной инфильтрации гранулематозной болезни или лептоменингеальных метастазах системного рака. 1 ,2 Визуализация с усилением гадолинием может выявить аномальное усиление твердой мозговой оболочки при некоторых из этих состояний. 2
Это может наблюдаться при состояниях, вызывающих острое воспаление или отсроченное рубцевание или фиброз (например, травма, инфекция или кровоизлияние), а также при лептоменингиальной инфильтрации гранулематозной болезни или лептоменингеальных метастазах системного рака. 1 ,2 Визуализация с усилением гадолинием может выявить аномальное усиление твердой мозговой оболочки при некоторых из этих состояний. 2
Несмотря на установку шунта VP, ее головные боли постепенно усиливались. Возникновение сопутствующей ригидности затылочных мышц свидетельствует о раздражении мозговых оболочек. У нее также развились диплопия, дизартрия, двусторонняя слабость и угнетение сознания, что свидетельствует о дисфункции на уровне моста, включая ядра лица и, возможно, ретикулярную активирующую систему. Слабость сгибателей шеи с гиперрефлексией и повышенным тонусом в руках свидетельствует о дисфункции корково-спинномозгового тракта в стволе мозга или верхнем шейном отделе позвоночника. Также была возможна дисфункция средней линии мозжечка, учитывая ее атаксическую походку с широким основанием, которая не была связана с аномальными сенсорными данными. Ее результаты МРТ подтверждают эту клиническую картину и выявили кистозные поражения, поражающие мозжечок, ствол мозга и верхнюю часть шейного отдела спинного мозга.
Также была возможна дисфункция средней линии мозжечка, учитывая ее атаксическую походку с широким основанием, которая не была связана с аномальными сенсорными данными. Ее результаты МРТ подтверждают эту клиническую картину и выявили кистозные поражения, поражающие мозжечок, ствол мозга и верхнюю часть шейного отдела спинного мозга.
Дифференциальный диагноз кистозных поражений головного мозга широк и включает доброкачественные, воспалительные, опухолевые и инфекционные процессы. Здесь МРТ, выявляющая как экстрааксиальные, так и интрапаренхиматозные поражения, фокусирует внимание на неопластической и инфекционной этиологии, поскольку они чаще могут иметь широкое лептоменингеальное распространение одновременно с интрапаренхиматозным поражением.
Первичные опухоли ЦНС обычно представляют собой одиночные поражения. Те, которые обычно имеют кистозный вид, включают пилоцитарную астроцитому, ганглиоглиому, эпендимому и гемангиобластому. 3 ,4 Кистозные метастазы в головной мозг были описаны при первичном раке легких, молочной железы, предстательной железы и поджелудочной железы. 4
4
Инфекционная этиология включает множественные абсцессы, которые могут быть вызваны тяжелыми бактериальными, микобактериальными или грибковыми инфекциями. Кроме того, различные паразитарные инфекции (например, NCC, эхинококкоз, амебиаз) также могут проявляться в виде кистозных поражений ЦНС. 5
Анализ спинномозговой жидкости позже показал плеоцитоз с преобладанием мононуклеаров и лимфоцитов, соответствующий хроническому раздражению мозговых оболочек. В то время как доля эозинофилов не достигала 10%, необходимых для эозинофильного менингита, обнаружение любых эозинофилов в спинномозговой жидкости является ненормальным. Причины эозинофилии ЦСЖ включают паразитарные и грибковые инфекции, поражение мозговых оболочек некоторыми злокачественными новообразованиями (т. е. болезнь Ходжкина, неходжкинскую лимфому, эозинофильный лейкоз) или, наконец, реакцию на инородное тело, например, на VP-шунт. 6 Заметно повышенный уровень белка в спинномозговой жидкости (>1 г/дл; для перевода в граммы на литр умножьте на 10,0) можно наблюдать при любом гнойном менингите или внутримозговом кровоизлиянии или при спинальном блоке циркуляции спинномозговой жидкости. 7 Низкий уровень глюкозы в спинномозговой жидкости (<60% в сыворотке крови) указывает на острый бактериальный, грибковый или туберкулезный менингит, лимфоматозный или карциноматозный менингит, нейросаркоидоз или NCC. 7 Выявление на МРТ кисты с внутренней узловой структурой, изоинтенсивной на Т2, в сочетании с профилем ЦСЖ вызывает подозрение на NCC.
7 Низкий уровень глюкозы в спинномозговой жидкости (<60% в сыворотке крови) указывает на острый бактериальный, грибковый или туберкулезный менингит, лимфоматозный или карциноматозный менингит, нейросаркоидоз или NCC. 7 Выявление на МРТ кисты с внутренней узловой структурой, изоинтенсивной на Т2, в сочетании с профилем ЦСЖ вызывает подозрение на NCC.
Нейроцистицеркоз возникает при заражении личиночной кистозной формой свиного цепня T solium . Результаты МРТ здесь указывают на везикулярную и рацемозную формы NCC, которые могут сосуществовать у одного и того же пациента. Отличительным признаком везикулярной формы NCC является МРТ, выявляющая интрапаренхиматозные, тонкомембранные кистозные структуры с жидкостью ликвороподобной интенсивности вместе с пристеночным узлом, который является от T2-изоинтенсивного до T2-гиперинтенсивного узелкового образования вдоль стенки кисты, представляющего собой жизнеспособную личинку. сколекс. 8 При рацемозном NCC субарахноидальная инфильтрация вызывает кистозные поражения в базальных цистернах, которые деформируют соседние структуры, видимые на МРТ. Стенка кисты при везикулярном и рацемозном NCC обычно не увеличивается. 8
Стенка кисты при везикулярном и рацемозном NCC обычно не увеличивается. 8
Нейроцистицеркоз может быть окончательно диагностирован только при патоморфологическом анализе удаленных кист. Менее инвазивными тестами для определения наличия в сыворотке или ЦСЖ антител к T solium являются иммуноферментный анализ и иммуноэлектротрансферный блот. Соответствующее лечение NCC зависит от клинической картины, локализации и тяжести заболевания. Свою роль играют противоэпилептические препараты, антигельминтные препараты (чаще всего альбендазол и празиквантел), кортикостероиды и хирургические вмешательства. 9 ,10 Противогельминтная терапия у пациентов с большим бременем субарахноидального/цистернального или внутрижелудочкового поражения вызывает споры, поскольку острая деструкция паразита может вызвать воспалительную реакцию, приводящую к клиническому ухудшению из-за отека и повышения внутричерепного давления. Премедикация кортикостероидами или стабилизация с помощью хирургической декомпрессии и/или установки шунта перед антигельминтным лечением обсуждается. 10 В этом случае быстрое клиническое ухудшение во время лечения NCC было связано с реактивным отеком вокруг кисты по сравнению с прогрессированием ее заболевания, и была выполнена декомпрессивная субокципитальная трепанация черепа с диагностической биопсией кисты.
10 В этом случае быстрое клиническое ухудшение во время лечения NCC было связано с реактивным отеком вокруг кисты по сравнению с прогрессированием ее заболевания, и была выполнена декомпрессивная субокципитальная трепанация черепа с диагностической биопсией кисты.
нейропатология
Микроскопическое исследование хирургических образцов выявило цилиндрический эпителий с рассеянными бокаловидными клетками и повышенной митотической активностью, что соответствует хорошо дифференцированной аденокарциноме (рис. 2А). Иммуногистохимическое окрашивание показало, что опухолевые клетки были диффузно положительными по гомеобоксу каудального типа 2 (CDX-2) (рис. 2B), цитокератину (CK) 7 (рис. 2C) и CK19 (рис. 2D) и фокально положительными по CK20 (рис. 2E). ). Двойная экспрессия CK7 и CK20 согласуется с метастатической аденокарциномой, возникающей из верхних отделов желудочно-кишечного тракта или панкреатобилиарной системы. 11
Результат пациента
Патологоанатомический диагноз: метастатическая аденокарцинома, соответствующая первичному новообразованию верхних отделов желудочно-кишечного тракта. Поэтапная КТ органов грудной клетки, брюшной полости и таза, а также позитронно-эмиссионная томография всего тела не выявили первичной или дополнительной опухоли. Сывороточные раковые маркеры карциноэмбрионального антигена и раковых антигенов 125, 19-9 и 15-3 не были повышены. Несмотря на субокципитальную декомпрессию, показатели неврологического осмотра пациентки продолжали ухудшаться, у нее развились прогрессирующая шейная миелопатия и квадрипарез. Пациент и семья решили продолжить паллиативную лучевую терапию, после чего она была переведена в хоспис и умерла через 3 недели от прогрессирующих метастазов в ЦНС.
Выводы
Метастазы в ЦНС гораздо чаще встречаются у пациентов с установленным распространенным системным раком и, по оценкам, встречаются примерно у 15% пациентов с раком. 12 Опухоли желудочно-кишечного тракта редко имеют метастазы в ЦНС. Инфратенториальное обсеменение, как видно в этом случае, происходит примерно в 20% желудочно-кишечных метастазов в ЦНС. 13 Такая непропорционально высокая частота метастазов в заднюю черепную ямку предполагает, что эти первичные злокачественные новообразования чаще попадают в ЦНС через задний кровоток. 14
Описаны мультикистозные метастазы ЦНС от аденокарциномы легкого, молочной железы и, редко, органов желудочно-кишечного тракта (например, желудка, поджелудочной железы). 3 ,4,15 Характеристики кистозных метастатических аденокарцином ЦНС на МРТ аналогичны таковым в этом случае с изоинтенсивностью к гипоинтенсивности на Т1-взвешенных последовательностях, изоинтенсивностью к гиперинтенсивности на Т2-взвешенных последовательностях и узловым усилением на постгадолиниевых последовательностях. 15
Этот случай также необычен тем, что у нашего пациента были обнаружены метастазы в ЦНС в качестве начального проявления, и эволюция в течение 11 месяцев была намного медленнее, чем ожидалось для нелеченных метастазов в ЦНС, особенно с диффузным лептоменингеальным поражением. У нее также развилась гидроцефалия без признаков объемного поражения при визуализации головного мозга. Ее первоначальная гидроцефалия, возможно, была результатом небольшой кисты, обтурирующей центральный канал, или лептоменингеальной инфильтрации опухолевыми клетками. Ее профиль спинномозговой жидкости было трудно интерпретировать, и, вероятно, он отражал блокаду спинномозговой жидкости (повышенный уровень белка) и хроническое воспаление в присутствии инородного тела, то есть шунт VP (эозинофилия). Лептоменингиальный карциноматоз мог объяснить низкий уровень глюкозы в спинномозговой жидкости, хотя ее цитологические данные в спинномозговой жидкости были отрицательными.
Выявление на МРТ как экстрааксиальных, так и интрапаренхиматозных кистозных образований было важно для дифференциальной диагностики опухолевой и инфекционной этиологии, поскольку они могут иметь обе локализации. Этот случай еще раз подчеркивает необходимость рассмотрения метастазов в ЦНС даже у тех, у кого в анамнезе не было злокачественных новообразований. Тщательное обследование должно включать определение иммунного статуса, визуализацию головного мозга и/или позвоночника с контрастным усилением, а также цитологические, бактериальные, микобактериальные и грибковые исследования спинномозговой жидкости в соответствующем клиническом контексте. В конечном итоге для постановки диагноза может потребоваться подтверждение биопсии. В будущем биомаркеры спинномозговой жидкости могут оказаться более чувствительными, чем цитология, для раннего выявления неопластического менингита. 16 Хотя состояние этого пациента неумолимо прогрессировало, ранняя диагностика и своевременное лечение могут улучшить клинический исход для других.
Наверх
Информация о статье
Автор, ответственный за переписку: Брайан Дж. Скотт, доктор медицинских наук, отделение неврологии, больница и медицинский центр Лахи, 41 Mall Rd, Берлингтон, Массачусетс, 01805 (brian. [email protected]).
Принято к публикации: 6 августа 2013 г.
Опубликовано в Интернете: 30 сентября 2013 г. doi:10.1001/jamaneurol.2013.3933.
Вклад авторов: Д-р Скотт имел полный доступ ко всем данным исследования и берет на себя ответственность за целостность данных и точность анализа данных.
Концепция и дизайн исследования: Аги, Скотт.
Получение данных: Айоделе, Пекмеджи, Аги.
Анализ и интерпретация данных: Пекмеджи, Аги.
Составление рукописи: Айоделе, Скотт.
Критическая проверка рукописи на предмет важного интеллектуального содержания: Пекмезчи, Аги, Скотт.
Административная, техническая или материальная поддержка: Айоделе, Пекмеджи, Аги.
Руководитель исследования: Аги, Скотт.
Раскрытие информации о конфликте интересов: Не сообщалось.
использованная литература
1.
Паттисапу СП. Этиология и клиническое течение гидроцефалии. Нейрохирург Клиника N Am . 2001;12(4):651-659, vii.PubMedGoogle Scholar
2.
Скарроу АМ, Сигал Р, Медсгер ТА младший, Васко МС. Сообщающаяся гидроцефалия, вторичная по отношению к диффузному менингеальному распространению гранулематоза Вегенера: клинический случай и обзор литературы. Нейрохирургия . 1998;43(6):1470-1473. PubMedGoogle Scholar
3.
Трояни С, Лопес CC, Скардовелли Калифорния, Най Г.А. Кистозные метастазы в головной мозг рентгенологически симулируют нейроцистицеркоз. Сан-Паулу Мед J . 2011;129(5):352-356.PubMedGoogle ScholarCrossref
4.
Hernandez О, Загзаг Д, Келли П, Гольфинос Дж, Левин РН. Цитологическая диагностика кистозных опухолей головного мозга: ретроспективное исследование 88 случаев. Диагностика цитопатола . 2004;31(4):221-228.PubMedGoogle ScholarCrossref
5.
Osborn АГ, Прис МТ. Внутричерепные кисты: рентгенопатологическая корреляция и подход к визуализации. Радиология . 2006;239(3):650-664.PubMedGoogle ScholarCrossref
6.
Lo Re В III, Глюкман СЖ. Эозинофильный менингит. Am J Med . 2003;114(3):217-223.PubMedGoogle ScholarCrossref
7.
Хурадо Р, Уокер ХК. Спинномозговая жидкость. Вышел: Уокер Гонконг, Холл В. Д., Херст JW, ред. Клинические методы: анамнез, физические и лабораторные исследования. 3-е изд. Бостон, Массачусетс: Баттерворт; 1990.
8.
Кимура-Хаяма ET, Игера JA, Корона-Седильо Р, и другие. Нейроцистицеркоз: рентгенопатологическая корреляция. Рентгенография . 2010;30(6):1705-1719.PubMedGoogle ScholarCrossref
9.
Carpio A. Нейроцистицеркоз: обновление. Ланцет Infect Dis . 2002;2(12):751-762.PubMedGoogle ScholarCrossref
10.
Нэш TE, Гарсия ХХ. Диагностика и лечение нейроцистицеркоза. Nat Rev Neurol . 2011;7(10):584-594.PubMedGoogle ScholarCrossref
11.
Pekmezci М, Перри A. Нейропатология метастазов в головной мозг. Surg Neurol Int . 2013;4(приложение 4):S245-S255.PubMedGoogle Scholar
12.
Barnholtz-Sloan Дж. С., Слоан АЭ, Дэвис ФГ, Виньо ФД, Лай П, Савайя РЕ. Доля заболеваемости метастазами в головной мозг у пациентов, диагностированных (с 1973 по 2001 год) в системе наблюдения за раком в столичном Детройте. J Clin Oncol . 2004;22(14):2865-2872.PubMedGoogle ScholarCrossref
13.
Патчел РА. Лечение метастазов в головной мозг. Ред. для лечения рака. 2003;29(6):533-540.PubMedGoogle ScholarCrossref
14.
Delattre Джей, Крол Г, Талер ХТ, Познер Дж.Б. Распространение метастазов в головной мозг. Арка Нейрол . 1988;45(7):741-744.PubMedGoogle ScholarCrossref
15.