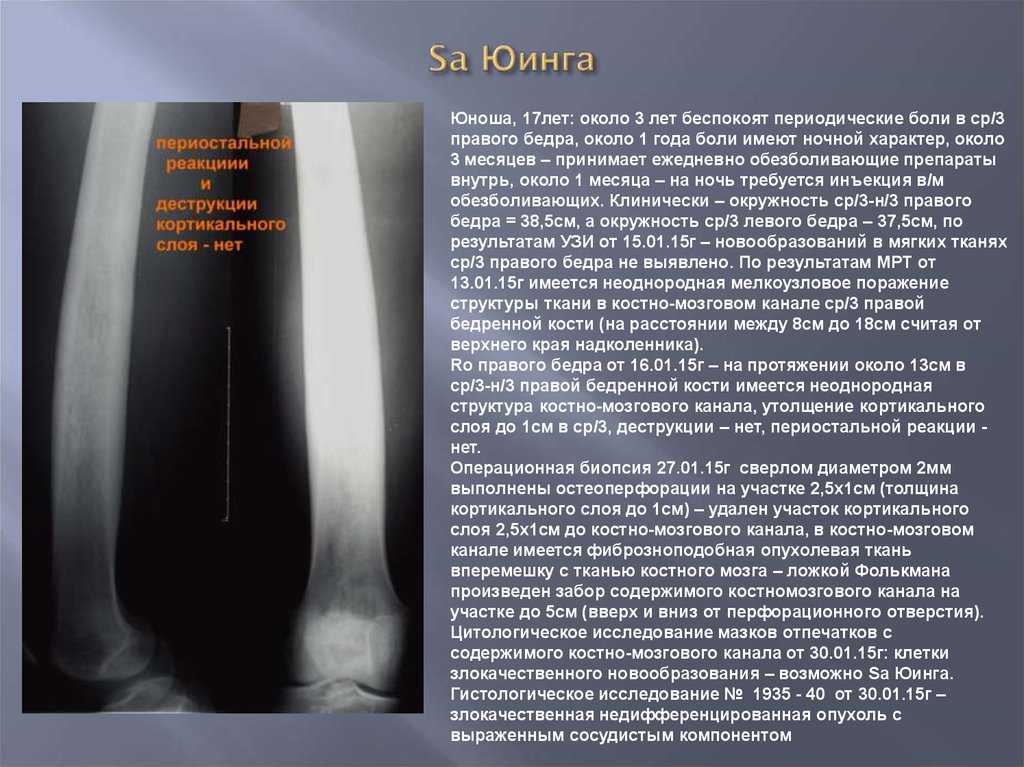
2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
И. К. Луцкая
д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО
А. О. Коржев
врач стоматолог-хирург УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска
А. А. Есьман
главный врач УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска
Основной объем работы хирурга-стоматолога на амбулаторном приеме занимают операции удаления зуба. На следующем месте по частоте стоят хирургические вмешательства на пародонте, цистотомия. В настоящее время расширяются показания к установке внутрикостных имплантатов с последующим протезированием. При этом одной из серьезных проблем, с которыми сталкиваются специалисты, является резорбция костной ткани на фоне воспалительного процесса, осложнений ранее выполненного лечения зубов или после оперативного вмешательства [3, 7].
В качестве примера можно рассматривать первичное образование кистозной полости в области корня или вторичное рассасывание альвеолярной кости после удаления зуба.
Одним из наиболее распространенных методов диагностики большинства заболеваний зубов и челюстей человека является рентгенологическое обследование пациента. Достижения стоматологии в последнее десятилетие ознаменовались не только появлением новых способов лечения и профилактики, но и развитием рентгеновской техники, разработкой новых методик рентгенографии [6]. Это закономерно вызвало повышение частоты использования и расширение спектра рентгенологических исследований зубочелюстной системы.
При осложненном кариесе рентгенологические исследования необходимы для определения характера и распространенности поражения периапикальных тканей, осуществляется точная диагностика заболеваний тканей пародонта. При травматических повреждениях, опухолях, опухолеподобных заболеваниях, кистах, деформациях и системных поражениях костей черепа рентгенологическое исследование является ведущим способом первичной диагностики и оценки эффективности лечебных мероприятий, своевременного выявления осложнений [3, 4].
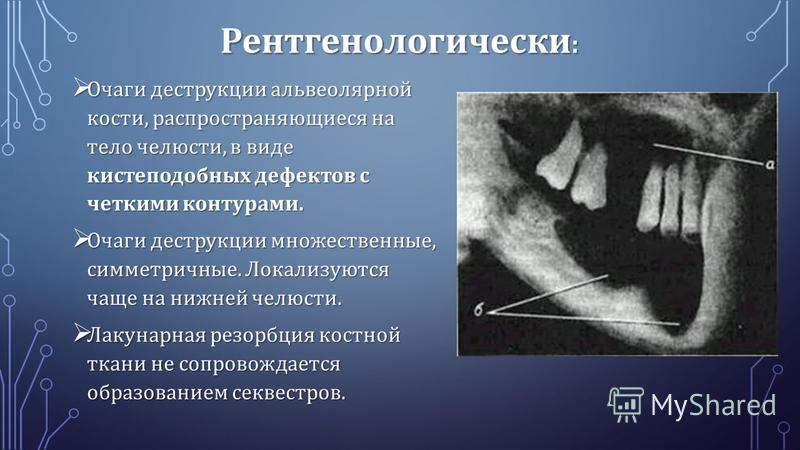
На рентгенограммах кости лицевого скелета, челюстей имеют характерную структуру, так называемый костный рисунок, который отображает особенности функции и анатомического строения. Патологические процессы приводят к изменению костного рисунка, что позволяет врачу-стоматологу диагностировать различные заболевания.
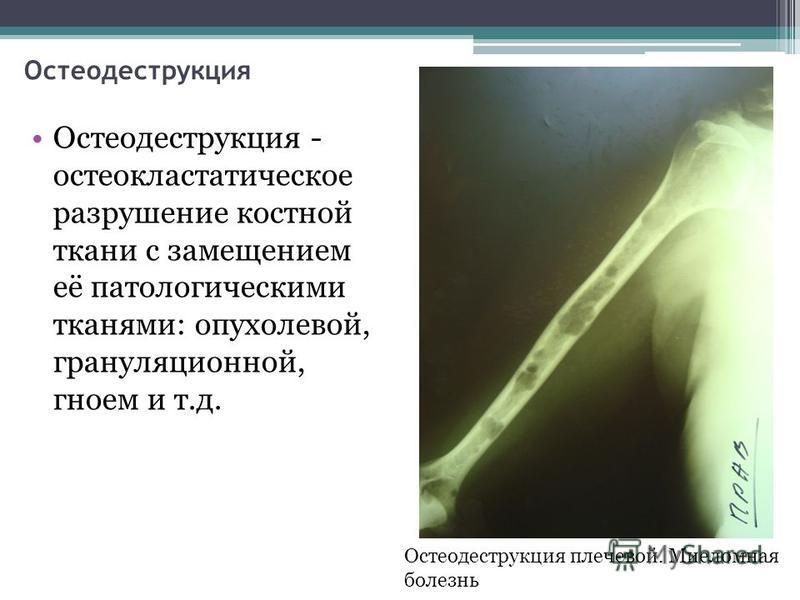
Так, остеопороз — дистрофический процесс, в основе которого лежит уменьшение и замещение костной ткани остеоидным веществом, жировой тканью, кровью. При остеопорозе снижается количество костных балочек в единице объема кости, они истончаются, костномозговые пространства расширяются.
По характеру теней на рентгенограмме остеопороз делят на очаговый и диффузный. Первый представлен отдельными, размером от 1 до 5 мм, очагами разрежения костной ткани с четкими или нечеткими контурами и предшествует секвестрации при остеомиелите кости. Для диффузного остеопороза характерно равномерное разрежение костной ткани, кортикальный слой кости истончен, иногда разволокнен, костномозговые пространства расширены. Такой вид остеопороза встречается после утраты зубов.
Такой вид остеопороза встречается после утраты зубов.
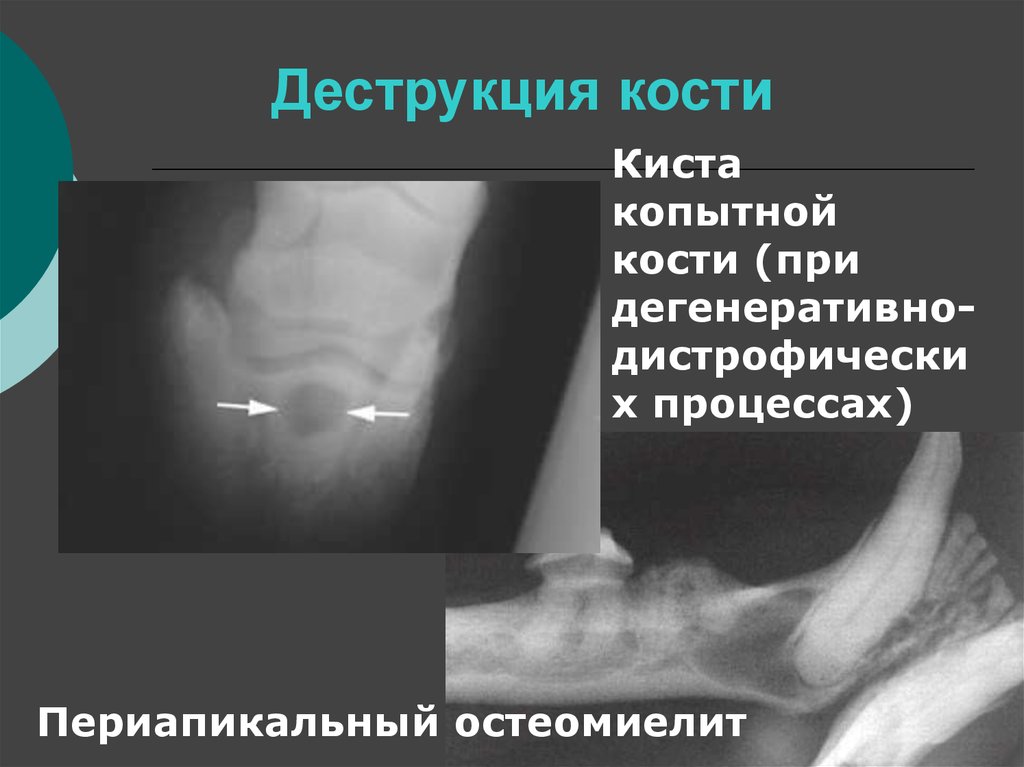
Деструкция — разрушение кости и замещение ее патологической тканью (гноем, грануляциями и т. д.). На рентгенограмме очаг деструкции имеет меньшую плотность по сравнению с рядом расположенными неизмененными участками.
Деструктивные изменения костного вещества чаще всего наблюдаются при воспалительных и опухолевых поражениях костей. Разрушение идет, с одной стороны, путем рассасывания костных балок и трабекул в результате непосредственного воздействия патологического процесса (гнойное воспаление, распад, некроз, прорастание опухолевой тканью и др.), а с другой — рефлекторным нейрогуморальным путем. При этом костномозговые пространства сливаются и увеличиваются в объеме.
Резорбция — рассасывание костных структур или дентина, в том числе верхушек корней, которое может носить физиологический характер (корни временных зубов) или являться следствием патологического процесса. Если на рентгенограмме в области верхушки корня обнаруживается деструктивный очаг с лучше или хуже очерченными контурами, это может быть обусловлено различными стадиями гранулирующего, гранулематозного и фиброзного периодонтита. Рентгеновское изображение кисты, находящейся в процессе формирования, вначале может не отличаться от других стадий развития хронического периодонтита. Дальнейшее формирование кисты приводит к увеличению размеров. При рентгенологическом исследовании в области верхушки корня зуба обнаруживается очаг просветления, имеющий шаровидную форму. Границы этой полости гладкие и четко очерченные. Нередко вокруг полости образуется тонкий склеротический ободок.
Рентгеновское изображение кисты, находящейся в процессе формирования, вначале может не отличаться от других стадий развития хронического периодонтита. Дальнейшее формирование кисты приводит к увеличению размеров. При рентгенологическом исследовании в области верхушки корня зуба обнаруживается очаг просветления, имеющий шаровидную форму. Границы этой полости гладкие и четко очерченные. Нередко вокруг полости образуется тонкий склеротический ободок.
При тяжелом течении пародонтита на рентгенограмме определяются значительные по площади участки просветления, характеризующие убыль костной ткани более 1/2 длины корня у многих зубов, иногда полное рассасывание межзубной перегородки и выраженные изменения в области фуркации корней. Вертикальная резорбция приводит к образованию глубоких костных карманов вдоль зубного ряда [3, 6].
Среди оперативных методов лечения особое место занимает реконструктивная хирургия с использованием остеозамещающих материалов, которые способствуют восстановлению костной ткани и активизируют процессы регенерации тканей живого организма [1, 2, 5].
Репаративная регенерация костной ткани как биологический процесс генетически предрасположенна, процесс нельзя ускорить [5]. Однако существуют факторы регенерации, на которые можно оказывать оптимизирующее воздействие, поэтому возрастает роль средств, обладающих положительным влиянием на остеогенез. Термин «направленная регенерация кости», предложенный Д. Басером, определяет принцип создания благоприятных условий для развития костных клеток между дефектом кости и окружающими мягкими тканями для предотвращения проникновения в область остеорепарации эпителия. По данным литературы, при обеспечении наиболее благоприятных условий особого внимания заслуживают средства, способствующие образованию костной ткани и ее обызвествлению. С этой целью используют барьерные мембраны в сочетании с остеопластическим материалом, что должно обеспечивать реализацию тех способностей, которыми изначально обладает костная ткань [5, 7].
Большой интерес вызывают кальцийфосфатные соединения (гидроксиапатит), как материал, наиболее близкий по составу костной ткани, минеральному компоненту и твердым тканям зуба.
В настоящее время выпуск препаратов на основе гидроксиапатита освоен многими производителями: в России («Остим-100», «Колапол», «Гидроксиапол» и «Коллапан»), в Республике Беларусь («КАФАМ», гель гидроксиапатита). Материалы применяются с различными типами антибиотиков и антисептиков, не требуют специального инструментария и оборудования, изготавливаются в различных формах (блоки, пластины, гранулы, порошки, суспензии). Все типы гидроксиапатита используются при хирургическом лечении различных стоматологических заболеваний.
Средство на основе нанокристаллического гидроксиапатита (кальция фосфата) предназначено для имплантации в костную ткань с целью активации остеорепаративных процессов, обладает повышенной способностью трансформироваться в биологических средах в ионы кальция и фосфаты, что обеспечивает лучшее усвоение указанных ионов непосредственно в «зоне интереса» — костной ране (зона между отломками при переломах, костный дефект, секвестральная полость и т. д.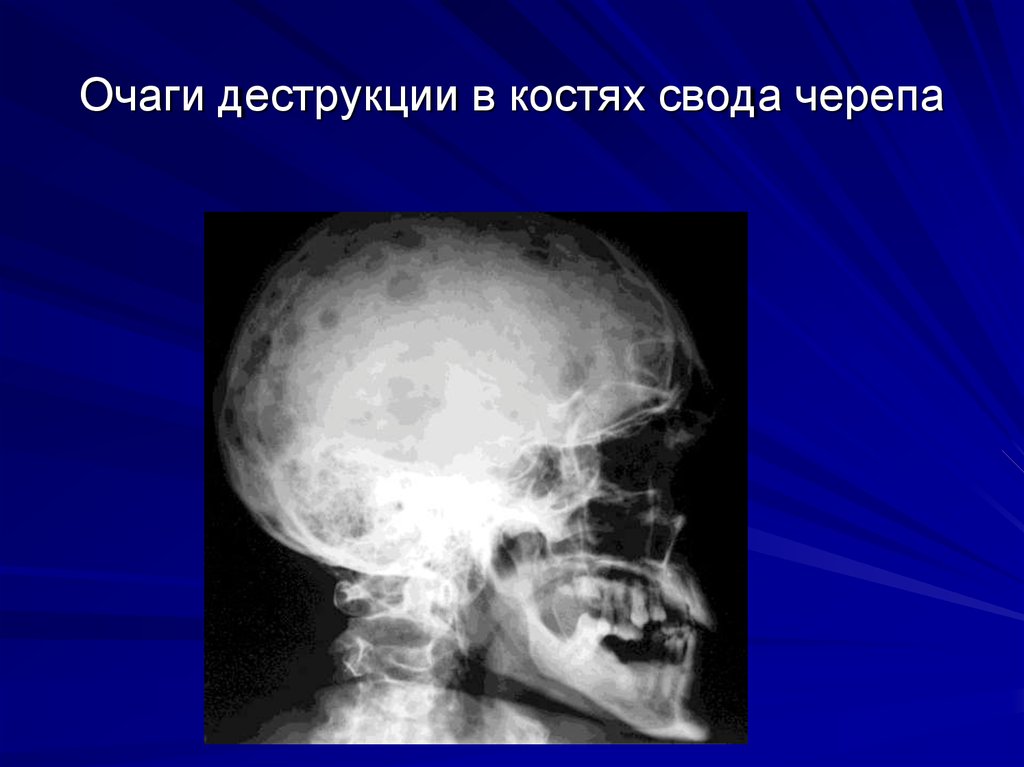 ).
).
Кальций снижает проницаемость клеточных мембран и сосудистой стенки, предотвращает развитие воспалительных реакций. Ионы кальция участвуют в передаче нервных импульсов, в свертывании крови и других физиологических процессах.
Гидроксиапатит способствует оптимизации заживления костной раны, формированию функционально и структурно полноценного остеорегенерата по типу первичного заживления костной раны. Применение препарата позволяет уменьшить длительность болевого периода у пациентов после операции и способствует скорейшей ликвидации отека мягких тканей в этой зоне. Гидроксиапатит характеризуется низкой растворимостью в биологических средах и медленным поступлением ионов кальция в межуточную среду и кровь.
Применение в стоматологии:

Рис. 1. Радикулярная киста верхней челюсти. КЛКТ-исследование.
Рис. 2. Рентгенограмма моляра после резекции верхушки корня.
Примером препаратов на основе гидроксиапатита может служить «Коллапан» — препарат, применяемый для восстановления костной ткани, профилактики и лечения гнойных осложнений. Состоит из гидроксилапатита и коллагена. Полностью замещается костной тканью, сохраняет антимикробную активность в ране до 20 суток, в течение которых происходит равномерное выделение антибиотика в костной полости [2].
Выпускается в виде гранул, геля, пластин: различный вид материала обусловлен удобством заполнения костных дефектов различной формы и расположения.
Выбор вида препарата зависит от возбудителя заболевания. Наличие в материале антимикробных средств различного спектра действия позволяет целенаправленно выбрать вид «Коллапана», соответствующий возбудителю заболевания, что значительно повышает эффективность лечения.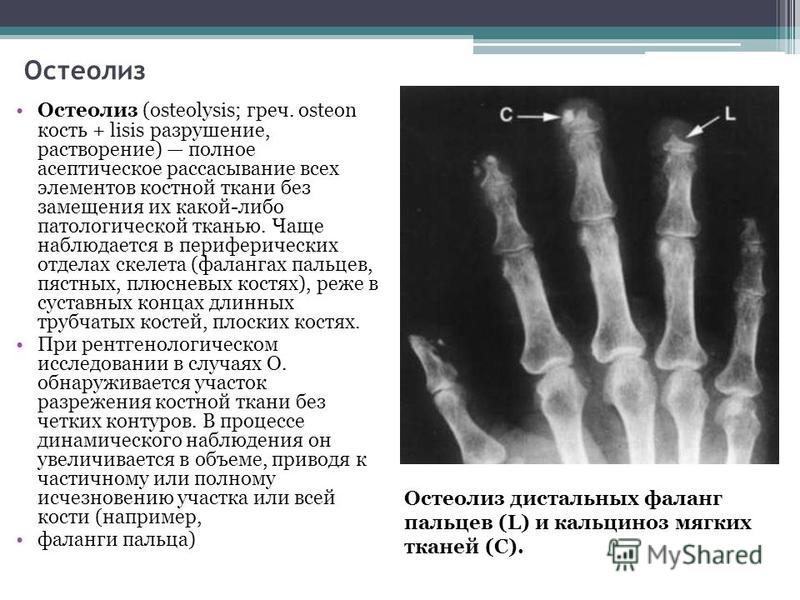
«Коллапан» не вызывает отторжения, нагноения, аллергических реакций. Противопоказанием к применению является индивидуальная непереносимость антибиотика, входящего в состав препарата.
В зависимости от формы заполняемого дефекта возможно как изолированное, так и сочетанное применение гранул, пластин, геля. Пластины легко режутся ножницами, скальпелем. Гель вводится при необходимости создания более полного контакта гранул и пластин с костной тканью. Применяют при пародонтите, удалении зуба, резекции верхушки корня, дентальной имплантации, периимплантитах, софт-синус-лифтинге, хронических периодонтитах, перфорациях зоны бифуркации, альвеолитах.
Операция удаления зубов с предварительным иссечением эпителиального края десны.
При помощи глазного скальпеля производили разрезы вдоль маргинальной десны с вестибулярной и оральной поверхности таким образом, чтобы со стороны костных карманов разрез проходил ниже маргинальной части десны на 1—2 мм; со стороны сохранившейся альвеолярной кости разрез выполнялся максимально близко к краю десны.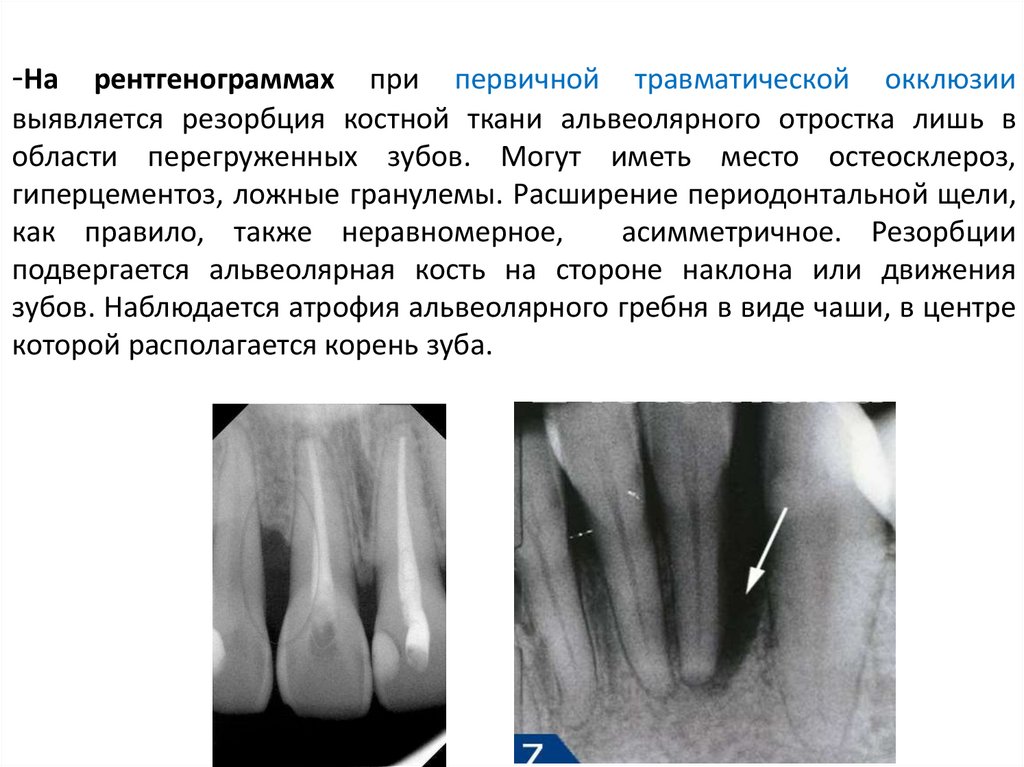
Вглубь тканей разрез выполнялся под углом от края десны до уровня дна зубодесневого кармана и распространялся вплоть до цемента корня, что позволяло произвести иссечение эпителия вдоль края десны, патологических грануляций в кармане и поддесневых зубных отложений.
Осуществлялся гемостаз, и сразу же выполнялась операция удаления подвижных зубов. При наложении щипцов захватывались ткани, иссеченные с оральной и язычной сторон зуба (рис. 3, 4). Костный дефект заполнялся препаратом, содержащим остеопластическую основу и отвечающим основным требованиям: химически устойчив в физиологической среде организма, проявляет стойкость к окислению, не допускает накопления вредных продуктов взаимодействия, не вызывает гальваноэлектрических явлений. Указанным требованиям в значительной степени удовлетворяют препараты, содержащие гидроксиапатит [Са10(РО4)6(ОН)2] с соотношением Са/Р 1,67, который является аналогом неорганической составляющей костной и зубной тканей организма.
Рис. 3. Лунка удаленного зуба заполнена остеопластическим материалом.
Рис. 4. Раневая поверхность после удаления группы зубов.
Рана ушивалась таким образом, чтобы более подвижный лоскут перекрывал лунку зуба. После завершения регенерации в челюстную кость были установлены имплантаты (рис. 5, 6).
Рис. 5. Внутрикостные имплантаты.
Рис. 6. Нормальная структура кости в области имплантатов. Рентгенограмма.
Органосберегающая операция с цементотомией при локализованном пародонтите.
Осуществлялось обезболивание соответствующего участка челюсти, выполнялся разрез в межзубном пространстве параллельно основанию сосочка между проксимальными сторонами зубов. Рассечение межзубных мягких тканей производили на участке зубного ряда, превышающем область намеченного вмешательства на 1—2 зуба с каждой стороны, и дополняли разрезом, позволяющим углубить преддверие полости рта. Затем поочередно с каждой стороны отслаивали лоскуты с обеих сторон альвеолярного отростка и отводили на расстояние, обеспечивающее свободное манипулирование в операционном поле.
Удаление грануляций и вегетации эпителия скальпелем начинали с апикальных частей поверхности лоскутов. Далее приступали к удалению грануляций, прилежащих к зубу и альвеолярной кости, инструментами для снятия зубного камня и малыми кюретажными ложками. Острые костные выступы на альвеолярном отростке сошлифовывали алмазной головкой.
Обработку корней недепульпированных зубов проводили, соскабливая острыми инструментами (экскаватор, различные по форме острые крючки) поверхностные отложения зубного камня вместе с грануляциями и некротизированными тканями на поверхности цемента. Корни депульпированных зубов подвергали цементотомии удлиненным бором с затупленной и отполированной торцевой частью, удерживая его под различными углами относительно поверхности корня зуба.
Рану тщательно промывали растворами антисептиков. Костные карманы заполняли препаратом гидроксиапатита с коллагеном. Швы накладывали из кетгута с удлиненным сроком рассасывания. Даны рекомендации по уходу за раной. Осуществляется послеоперационное наблюдение.
Осуществляется послеоперационное наблюдение.
Пациент Ш., 34 лет. Диагноз: радикулярная киста верхней челюсти слева в области зубов 22 и 23 (рис. 7). Под местной анестезией проведено удаление зубов с цистэктомией (рис. 8). Тщательно обработаны стенки полости, выполнен гемостаз (рис. 9). Полость кисты рыхло заполнена препаратом на основе гидроксиапатита. Рана ушита кетгутом, сделаны назначения для выполнения в домашних условиях. Послеоперационный период протекает без осложнений.
Рис. 7. КЛКТ-снимок. Киста в области верхней челюсти слева.
Рис. 8. Удалены зубы. Сделана цистэктомия.
Рис. 9. Гемостаз после операции цистэктомии.
Воспалительные процессы в челюстно-лицевой области нередко сопровождаются деструкцией костной ткани, выражающейся рассасыванием костных балочек и замещением их продуктами патологического распада или вновь образованной грануляционной тканью. Диагностика подобных изменений осуществляется (или уточняется) на основании рентгенологического исследования костей лицевого черепа.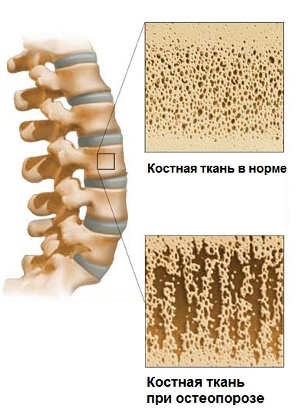 На рентгеновском снимке обнаруживаются участки просветления, соответствующие определенной клинической картине. Эффективность лечения заболеваний, проявляющихся резорбцией костных структур, существенно повышается при местном использовании препаратов, обладающих остеотропным воздействием, прежде всего, на основе гидроксиапатита.
На рентгеновском снимке обнаруживаются участки просветления, соответствующие определенной клинической картине. Эффективность лечения заболеваний, проявляющихся резорбцией костных структур, существенно повышается при местном использовании препаратов, обладающих остеотропным воздействием, прежде всего, на основе гидроксиапатита.
З. Р. Галеева
соискатель кафедры терапевтической стоматологии ГБОУВПО «Казанский государственный медицинский университет» Минздравсоцразвития РФ
Л. Р. Мухамеджанова
д. м. н., доцент, научный консультант учебно-методического центра «Эксклюзив Дент» (Казань)
Оценка степени тяжести воспалительно-деструктивных поражений костной ткани периапикальной области, зоны фуркации и межзубных/межкорневых перегородок имеет ключевое значение при планировании этапов диагностики, лечения и реабилитации пациентов врачами-стоматологами любого профиля.
Особенно много споров поставленная проблема вызывает при выборе ортопедических/ортодонтических конструкций, ограничении дизруптивной нагрузки, консервативной/хирургической тактике ведения пациентов, отягощенных эндопародонтальными очагами инфекции (ЭПО).
Эндопародонтальный очаг одонтогенной инфекции представляет собой сочетание воспалительно-деструктивных процессов в верхушечном периодонте и маргинальном пародонте. Учитывая агрессивность таких очагов хронической инфекции, уместно упомянуть о так называемом эндопародонтальном синдроме, при котором имеют место системные проявления микробной сенсибилизации организма: септический эндокардит, ревматизм, хронический пиелонефрит.
Вопросы этиопатогенеза ЭПО обсуждаются отечественными и зарубежными исследователями в течение нескольких десятилетий, однако вопрос первичности/вторичности вовлечения в воспалительный процесс тканей эндодонта/пародонта остается нерешенным.
На сегодняшний день постулировано, что пенетрация инфекционных агентов — микробов и их токсинов в системе эндодонт/пародонт происходит по сосудистой системе (васкулярным путем) и по основным корневым каналам, их ответвлениям, а также дентинным канальцам (тубулярным путем).
Сочетанные заболевания пульпы и пародонта являются причиной потери зубов более чем в 50 % случаев. Диагностика затрудняется тем, что эти заболевания ранее изучались как самостоятельные, а схожесть клинических симптомов зачастую выпадала из поля зрения специалистов при дифференцировании, что является одним из факторов неуспешного лечения пациентов с такой патологией.
Целью настоящего исследования явилась разработка алгоритма оценки степени тяжести поражений костной ткани у пациентов с эндопародонтальными очагами инфекции.
Нами было обследовано 98 пациентов с ЭПО (40 мужчин и 58 женщин в возрасте 22—72 лет), обратившихся в лечебно-хирургическое отделение стоматологической поликлиники Казанского медицинского университета с целью санации полости рта и последующего протезирования. Полный комплекс дифференциально-диагностических мероприятий включал в себя: анализ анамнестических данных, клинический осмотр пациента, рентгенологическое исследование (прицельная дентальная рентгенограмма, ортопантомограмма).
При сборе анамнеза выясняли жалобы, связанные с возникшими в полости рта изменениями (отек), время их появления, динамику развития, возможные причины и частоту обострений.
При осмотре полости рта обращали внимание на сохранность/нарушение целостности зубодесневого прикрепления, глубину кармана, характер над- и поддесневых зубных отложений, наличие/отсутствие грануляций в пародонтальном кармане и их характер (вялые, цианотичные/сочные, пролабирующие, кровоточащие), подвижность зуба, наличие свищей (периапикального или пародонтального генеза), выраженность/сглаженность феномена стиплинга, наличие/отсутствие экссудата (гнойный, серозный, геморрагический или их сочетания).
При анализе данных лучевого метода исследования оценивали степень тяжести деструктивного процесса в пародонте: при пародонтите легкой степени отмечалась начальная степень деструкции костной ткани межзубных перегородок (значительное разволокнение или исчезновение замыкательных пластинок, явления интракортикального, субкортикального и трабекулярного остеопороза, снижение высоты межзубных перегородок — менее 1/3 длины корня), для пародонтита средней степени характерна резорбция костной ткани межзубных перегородок от 1/3 до ½ длины корня, для тяжелого пародонтита — резорбция костной ткани на величину более 1/2 высоты межзубных перегородок (до полного рассасывания альвеолярной перегородки).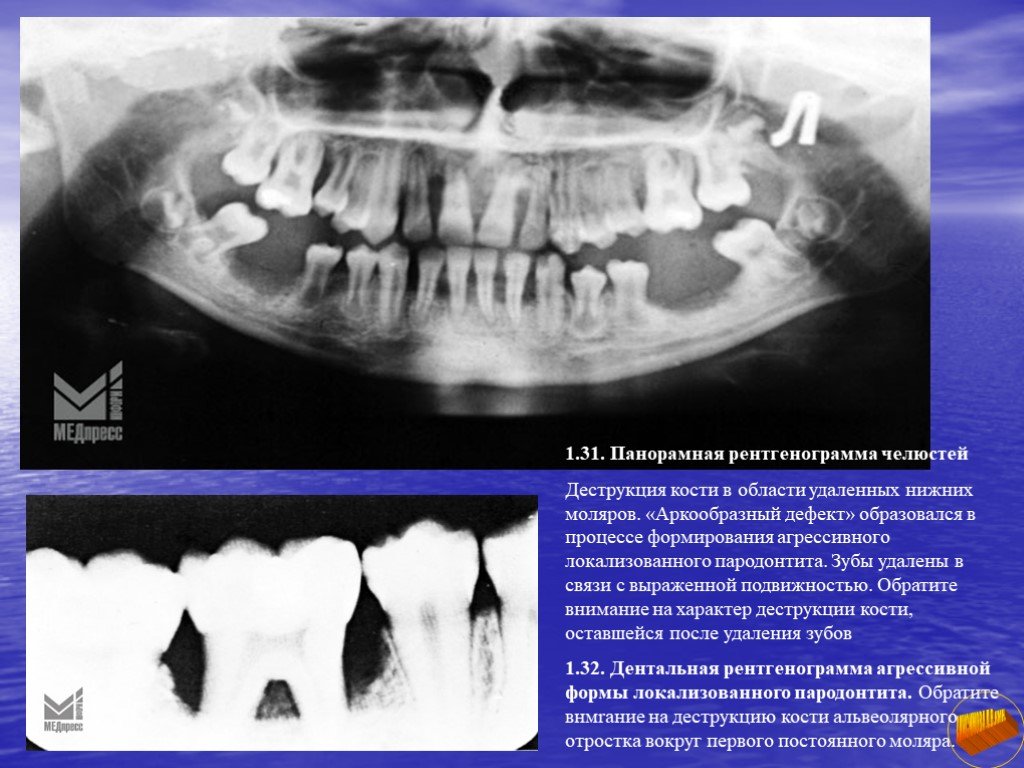
При анализе прицельных дентальных рентгенограмм оценивали степень деструктивного процесса в периапикальной области: размеры очага (продольный и поперечный), контуры (четкие/нечеткие), тенденцию к слиянию пародонтального и периапикального очагов деструкции.
В ходе проведенных исследований нами были выделены наиболее часто встречающиеся типы эндопародонтальных поражений (иллюстрация прицельными дентальными снимками или фрагментами ортопантомограмм) (рис. 1).
Рис. 1. Сочетание хронического гранулирующего/гранулематозного периодонтита с двусторонней вертикальной деструкцией костной ткани.
Тип эндопародонтального очага, для которого характерны расширение периодонтальной щели на всем протяжении, вертикальная деструкция костной ткани альвеолы. Кортикальная пластинка частично сохранена, с явлениями субкортикального остеопороза; по периферии очага наблюдается истончение трабекул, расширение межтрабекулярных промежутков. Функциональная ориентация трабекул (вертикальная) частично сохранена.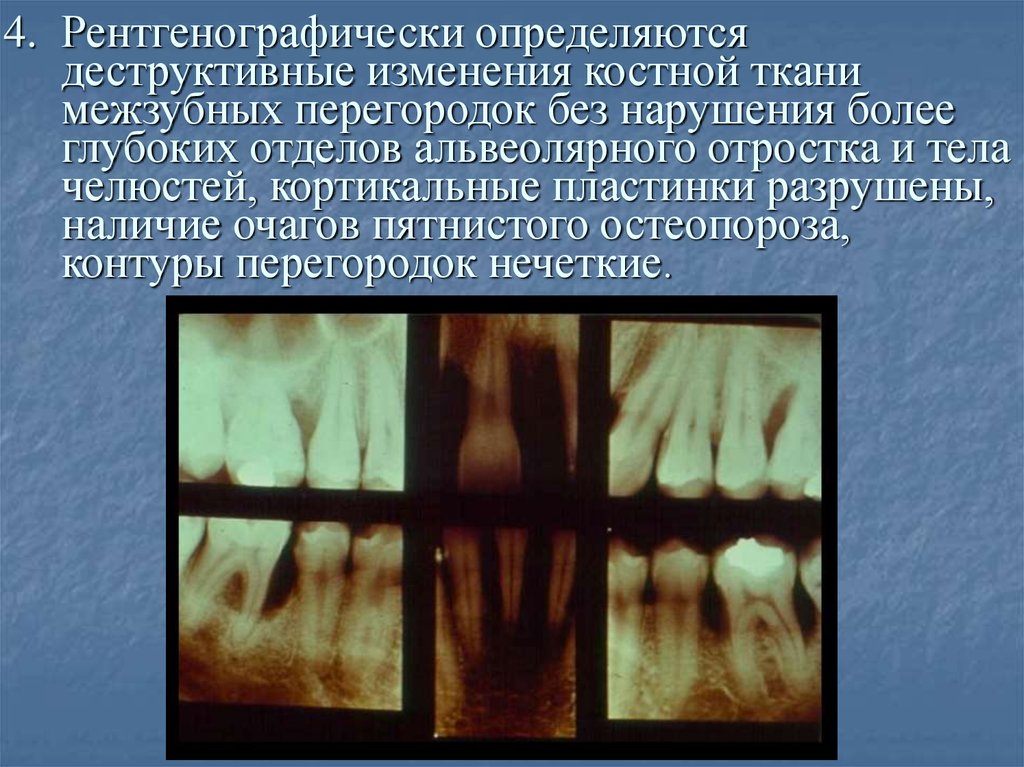 Высота альвеолярного гребня снижается.
Высота альвеолярного гребня снижается.
Как правило, пародонтальные карманы узкие и глубокие (до 6—8 мм), выполнены сочными (часто пролабирующими) грануляциями. Подвижность 1—2-й степени. Изменение оси наклона зуба. Полагаем, что изменение направления дизруптивной нагрузки имеет существенное значение в формировании данного типа очага деструкции (рис. 2).
Рис. 2. Сочетание хронического гранулематозного периодонтита (кистогранулемы) с вертикальным и горизонтальным типом деструкции кости межзубных/межкорневых перегородок.
Для данного типа эндопародонтального поражения характерно наличие очага деструкции кости в периапикальной области с четкими ровными контурами, округлой или овальной формы. Целостность кортикальной пластинки нарушена. Костные трабекулы по периферии очага сохраняют функциональную ориентацию (горизонтальную), отмечаются признаки снижения минеральной плотности кости. Высота альвеолярного отростка снижается за счет резорбции (по смешанному типу) трабекулярной кости альвеолы.
Наиболее часто встречается у многокорневых зубов. Фуркационные дефекты кости (не связанные с осложнениями эндодонтического вмешательства) расцениваются как прогностически неблагоприятные факторы. Как правило, изменения положения зуба в зубном ряду не изменяется. Пародонтальные карманы глубиной не более 5 мм, выполнены вялыми цианотичными грануляциями. В 25 % случаев выявляются свищи пародонтального и периапикального генеза (дифференциальная диагностика последних затруднена) (рис. 3).
Рис. 3. Сочетание хронического гранулематозного периодонтита (кистогранулемы) с горизонтальным типом деструкции кости межзубных/межкорневых перегородок.
Характеризуется наличием очага деструкции кости с четкими ровными контурами; нередко по периферии очага наблюдаются явления усиления минеральной плотности кости. Классический горизонтальный тип деструкции кости формирует «широкие» пародонтальные карманы, глубина которых зависит от степени убыли кости. Карманы часто выполнены вялыми грануляциями.
На более поздних стадиях заболевания может измениться ось наклона зуба и усилиться подвижность. Усиление дизруптивной нагрузки может спровоцировать обострение заболевания. При преобладании внекостного рычага над внутрикостным прогноз неблагоприятный (рис. 4).
Рис. 4. Сочетание хронического гранулирующего периодонтита с вертикальным типом деструкции кости межзубных/межкорневых перегородок.
Этот тип эндопародонтального очага характеризуется наличием деструктивных изменений кости с нечеткими неровными контурами; по периферии очага наблюдаются выраженные явления снижения минеральной плотности костной ткани. Часто при таком сочетании формируются фуркационные дефекты.
На более поздних стадиях заболевания очаг деструкции костной ткани в области септы, распространяющийся вдоль периодонтальной щели, сливается с очагом деструкции в периапикальной области, возможна резорбция цемента корня зуба, в более тяжелых случаях — дентина, чем обусловлена неровность контуров корня зуба. Изменяется ось наклона зуба, возможно усиление подвижности зуба даже на ранних стадиях заболевания. Пародонтальные карманы глубокие, достигающие верхушки корня зуба, выполнены обильными грануляциями. Усиление дизруптивной нагрузки ухудшает прогноз течения заболевания.
Изменяется ось наклона зуба, возможно усиление подвижности зуба даже на ранних стадиях заболевания. Пародонтальные карманы глубокие, достигающие верхушки корня зуба, выполнены обильными грануляциями. Усиление дизруптивной нагрузки ухудшает прогноз течения заболевания.
Сочетание хронического гранулирующего периодонтита со смешанным типом деструкции. Характеризуется наличием очага деструкции кости в периапикальной области с нечеткими неровными контурами; трабекулы по периферии очага истончены, функциональная ориентация их нарушена. Резорбция кости альвеолярного гребня по смешанному типу, однако в большинстве наблюдаемых случаев преобладает вертикальное направление. Прослеживается тенденция к слиянию пародонтального и периапикального очагов. Возможна резорбция цемента корня зуба. Пародонтальные карманы глубокие, часто широкие. Высота альвеолярного отростка снижается, подвижность зуба и изменение оси наклона возникают на ранних стадиях заболевания.
Для сочетания хронического гранулирующего периодонтита с горизонтальным типом деструкции кости межзубных/межкорневых перегородок характерно наличие очага резорбции в периапикальной области с неровными нечеткими контурами. По периферии костные трабекулы несколько истончены, функциональная ориентация не нарушена.
По периферии костные трабекулы несколько истончены, функциональная ориентация не нарушена.
Контуры корня могут быть изменены за счет гиперцементоза (редко). Деструкция альвеолярного гребня по горизонтальному типу, периодонтальная щель расширена на всем протяжении (влияние функциональной перегрузки). Пародонтальные карманы широкие, на более поздних стадиях возможно слияние пародонтального и периапикального очагов деструкции. Высота альвеолярного отростка снижается, изменение положения оси зуба и усиление подвижности возможны на продвинутых стадиях заболевания (рис. 5).
Рис. 5а. Сливной очаг пародонтальной и периапикальной деструкции костной ткани.
Рис. 5б. Сливной очаг пародонтальной и периапикальной деструкции костной ткани.
Рис. 5в. Сливной очаг пародонтальной и периапикальной деструкции костной ткани.
Рис. 5г. Сливной очаг пародонтальной и периапикальной деструкции костной ткани.]
Рис. 5д. Сливной очаг пародонтальной и периапикальной деструкции костной ткани.
Наиболее тяжелый и часто встречающийся вариант эндопародонтальных поражений представляет собой сливной очаг пародонтальной и периапикальной деструкции. В большинстве случаев возникает в условиях длительно действующей повышенной дизруптивной нагрузки (очаг травматической окклюзии). Характеризуется наличием значительного по объему очага деструкции, захватывающего костную ткань периапикальной области и костную ткань межзубных перегородок; последние часто полностью резорбируются. Неровность контуров корня обусловлена рассасыванием цемента (дентина). Пародонтальные карманы глубокие, достигающие апикальной части корня, подвижность зуба во всех направлениях.
Таким образом, маркерной рентгенологической особенностью эндопародонтального очага хронической инфекции является очаг деструкции костной ткани в перирадикулярной области однокорневых и многокорневых зубов в сочетании с вертикальным типом деструкции губчатой кости межкорневых перегородок.
Также возможно сочетание деструкции костной ткани в перирадикулярной области однокорневых и многокорневых зубов с горизонтальным типом деструкции губчатой кости межкорневых перегородок.
Слияние двух очагов инфекции в прогностическом плане является крайне неблагоприятным и определяет показания к удалению зуба.
Обзор
. 2021 ноябрь;57:201-208.
doi: 10.1016/j.jdsr.2021.09.005. Epub 2021 13 октября.
Мичихико Усуи 1 , Сатору Онидзука 1 , Цуёси Сато 2 , Шойчиро Кокабу 3 , Ватару Ариёси 4 , Кейсуке Накашима 1
 1016/j.jdsr.2021.09.005
1016/j.jdsr.2021.09.005 Бесплатная статья ЧВК
Обзор
Мичихико Усуи и др. Jpn Dent Sci Rev. 2021 9 ноября0003
Бесплатная статья ЧВК
. 2021 ноябрь;57:201-208.
doi: 10.1016/j.jdsr.2021.09.005. Epub 2021 13 октября.
Мичихико Усуи 1 , Сатору Онидзука 1 , Цуёси Сато 2 , Шойчиро Кокабу 3 , Ватару Ариёси 4 , Кейсуке Накашима 1

 1016/j.jdsr.2021.09.005
1016/j.jdsr.2021.09.005 Заболевание пародонта — это воспалительное заболевание, вызываемое пародонтопатогенными бактериями, которое в конечном итоге приводит к разрушению костной ткани (альвеолярной кости) по мере сохранения воспаления. Ткани пародонта имеют иммунную систему против инвазии этих бактерий, однако вследствие персистирующей инфекции пародонтопатогенными бактериями нарушается врожденный и приобретенный иммунитет хозяина, происходит деструкция тканей, в том числе деструкция костной ткани. Остеокласты необходимы для разрушения костей. Клетки-предшественники остеокластов, полученные из гемопоэтических стволовых клеток, дифференцируются в остеокласты. Кроме того, потеря костной массы происходит, когда резорбция кости остеокластами превышает образование кости остеобластами. При воспалительном заболевании костей воспалительные цитокины действуют на остеобласты и клетки, продуцирующие активатор рецептора лиганда ядерного фактора-κB (RANKL), что приводит к дифференцировке и активации остеокластов. В дополнение к этому механизму патогенные факторы пародонтальных бактерий и механический стресс активируют остеокласты и разрушают альвеолярную кость при пародонтите. В этом обзоре мы сосредоточились на механизме активации остеокластов при пародонтите и представляем обзор, основанный на последних данных.
В дополнение к этому механизму патогенные факторы пародонтальных бактерий и механический стресс активируют остеокласты и разрушают альвеолярную кость при пародонтите. В этом обзоре мы сосредоточились на механизме активации остеокластов при пародонтите и представляем обзор, основанный на последних данных.
Ключевые слова: Воспаление; Гипотеза краеугольного возбудителя; остеокласт; пародонтальные бактерии; пародонтит; РАНКЛ.
© 2021 Авторы.
Рис. 1
Дисбактериоз поддесневой микробиоты…
Рис. 1
Дисбактериоз поддесневой микробиоты. Воспалительные заболевания слизистой оболочки, такие как пародонтоз,…
рисунок 1 Дисбактериоз поддесневой микробиоты. Воспалительные заболевания слизистых оболочек, такие как заболевания пародонта, индуцируются при определенных условиях полимикробным сообществом, в котором разные члены играют различные и синергетические роли, способствующие деструктивному воспалению. Краеугольный возбудитель (например, P. gingivalis ), с помощью вспомогательных патогенов с точки зрения питания и образования колоний, первоначально подрывает иммунитет хозяина, что приводит к появлению дисбиотической микробиоты, в которой комменсальные бактерии, ставшие патобионтами, сверхактивируют воспалительную реакцию и вызывают разрушение тканей. Патобионты - это организмы, которые обычно доброкачественные в коренном сообществе, но становятся патогенными, когда гомеостаз между хозяином и микробом нарушается при определенных условиях, например, при лечении антибиотиками и повреждении тканей, особенно у хозяев с ослабленным иммунитетом. Эти условия потенциально могут способствовать росту патобионтов и нарушать симбиотическую микробиоту, что приводит к дисбактериозу и воспалению.
Воспалительные заболевания слизистых оболочек, такие как заболевания пародонта, индуцируются при определенных условиях полимикробным сообществом, в котором разные члены играют различные и синергетические роли, способствующие деструктивному воспалению. Краеугольный возбудитель (например, P. gingivalis ), с помощью вспомогательных патогенов с точки зрения питания и образования колоний, первоначально подрывает иммунитет хозяина, что приводит к появлению дисбиотической микробиоты, в которой комменсальные бактерии, ставшие патобионтами, сверхактивируют воспалительную реакцию и вызывают разрушение тканей. Патобионты - это организмы, которые обычно доброкачественные в коренном сообществе, но становятся патогенными, когда гомеостаз между хозяином и микробом нарушается при определенных условиях, например, при лечении антибиотиками и повреждении тканей, особенно у хозяев с ослабленным иммунитетом. Эти условия потенциально могут способствовать росту патобионтов и нарушать симбиотическую микробиоту, что приводит к дисбактериозу и воспалению.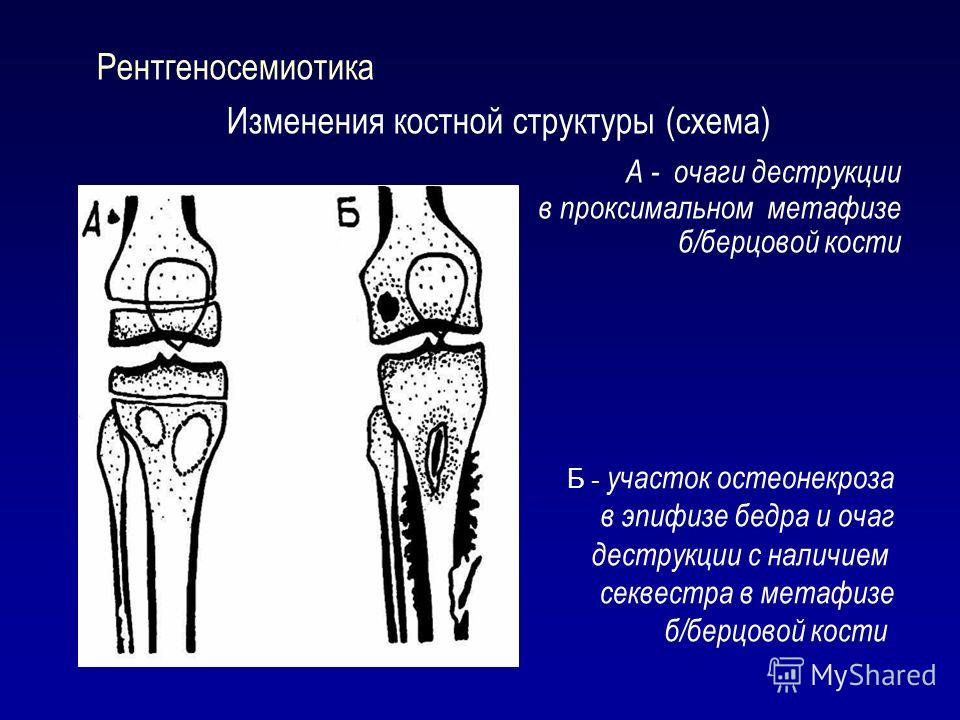 Эти факторы могут способствовать дисбактериозу как по отдельности, так и в сочетании. Плохо контролируемый иммунный ответ хозяина, в свою очередь, может генерировать самоподдерживающийся патогенный цикл, в котором дисбактериоз и воспаление усиливают друг друга, образуя петлю положительной обратной связи. Этот рисунок изменен из Ref. [108].
Эти факторы могут способствовать дисбактериозу как по отдельности, так и в сочетании. Плохо контролируемый иммунный ответ хозяина, в свою очередь, может генерировать самоподдерживающийся патогенный цикл, в котором дисбактериоз и воспаление усиливают друг друга, образуя петлю положительной обратной связи. Этот рисунок изменен из Ref. [108].
Рис. 2
Молекулярный механизм образования остеокластов…
Рис. 2
Молекулярный механизм образования и активации остеокластов пародонтальными бактериями. При пародонтите остеокласты…
Рис. 2 Молекулярный механизм образования и активации остеокластов пародонтальными бактериями. При пародонтите остеокласты образуются в результате прямого действия пародонтальных бактерий и иммунной системы.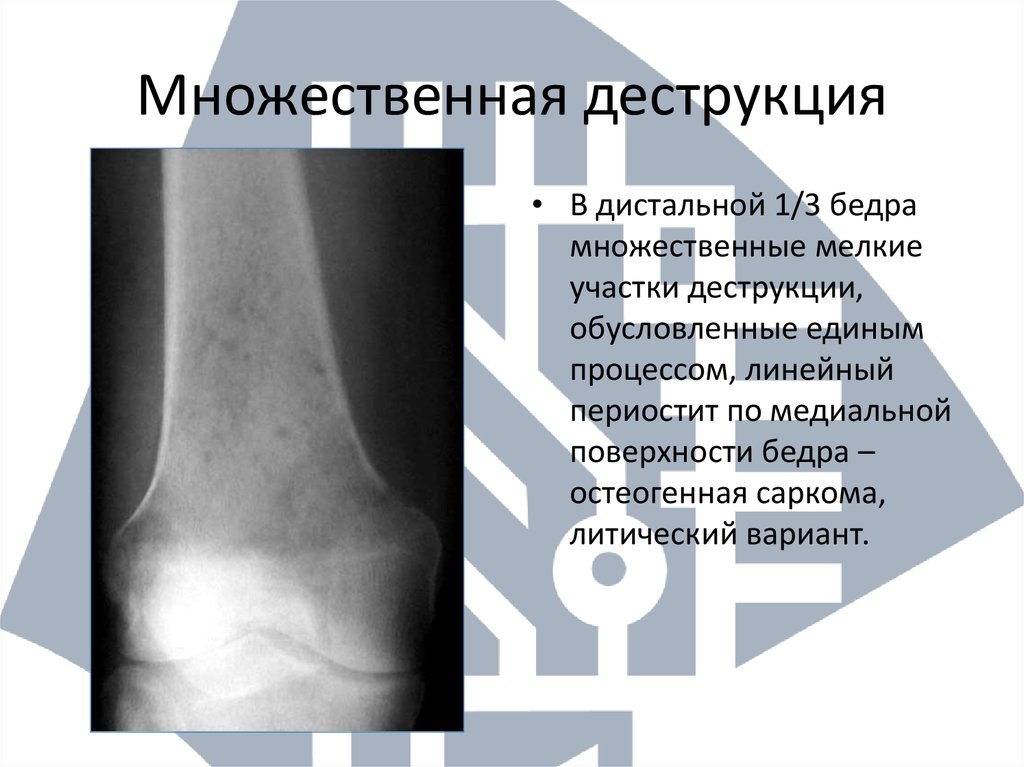
См. это изображение и информацию об авторских правах в PMC
Пародонтоз как фактор риска ревматоидного артрита: систематический обзор.
Каур С., Уайт С., Бартольд М. Каур С. и др. JBI Libr Syst Rev. 2012;10(42 Suppl):1-12. doi: 10.11124/jbisrir-2012-288. JBI Libr Syst, версия 2012. PMID: 27820156
Системное введение цитотоксического антигена 4 (CTLA-4)-Ig, ассоциированного с Т-лимфоцитами, предотвращает резорбцию альвеолярной кости при индуцированном пародонтите за счет ингибирования дифференцировки и активации остеокластов: экспериментальное исследование.
Накане С., Имамура К., Хисанага Р., Исихара К., Сайто А. Накане С. и др. J Периодонтальная Рез. 2021 окт;56(5):972-981. doi: 10.1111/jre.12909. Epub 2021 15 июня. J Периодонтальная Рез. 2021. PMID: 34129238
doi: 10.1111/jre.12909. Epub 2021 15 июня. J Периодонтальная Рез. 2021. PMID: 34129238
Воспаление и потеря костной массы при заболеваниях пародонта.
Кокран Д.Л. Кокрэн ДЛ. J Пародонтол. 2008 авг; 79 (8 Дополнение): 1569-76. doi: 10.1902/jop.2008.080233. J Пародонтол. 2008. PMID: 18673012 Рассмотрение.
Porphyromonas gingivalis стимулирует резорбцию кости за счет усиления RANKL (рецептор-активатор лиганда NF-κB) посредством активации Toll-подобного рецептора 2 в остеобластах.
Кассем А., Хеннинг П., Лундберг П., Соуза П.П., Линдхольм С., Лернер У.Х. Кассем А. и др. Дж. Биол. Хим. 2015 14 августа; 290(33):20147-58. doi: 10.1074/jbc.M115.655787. Epub 2015 17 июня. Дж. Биол. Хим. 2015. PMID: 26085099 Бесплатная статья ЧВК.
PMID: 26085099 Бесплатная статья ЧВК.
Экспрессия RANKL при заболеваниях пародонта: откуда берется RANKL?
Чен Б., Ву В, Сунь В., Чжан Ц., Ян Ф., Сяо Ю. Чен Б. и др. Биомед Рез Инт. 2014;2014:731039. дои: 10.1155/2014/731039. Epub 2014 27 февраля. Биомед Рез Инт. 2014. PMID: 24719884 Бесплатная статья ЧВК. Рассмотрение.
Посмотреть все похожие статьи
Характеристика наддесневого микробиома здоровых беременных женщин.
Чжан И, У З, Ли Л, Ван С, Фань В, Чжао Дж. Чжан И и др. Front Cell Infect Microbiol. 2022 17 ноя; 12:1016523. дои: 10.3389/fcimb.2022.1016523. Электронная коллекция 2022. Front Cell Infect Microbiol. 2022.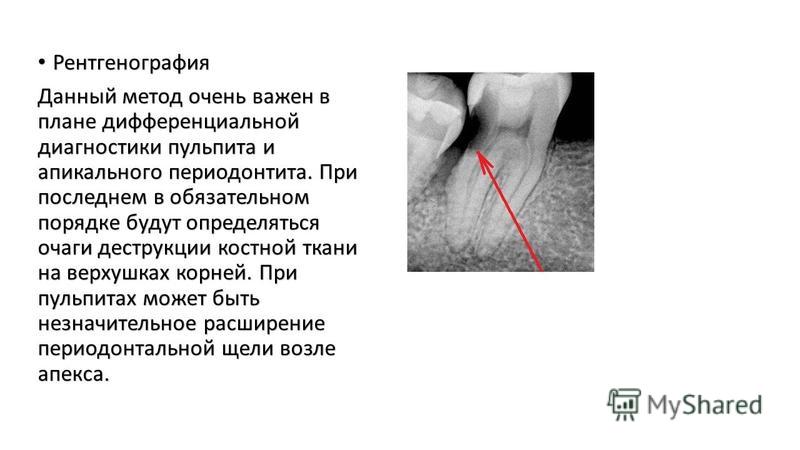 PMID: 36467732 Бесплатная статья ЧВК. Клиническое испытание.
PMID: 36467732 Бесплатная статья ЧВК. Клиническое испытание.
Исследования in vitro графена для лечения кариеса зубов и заболеваний пародонта: краткий обзор.
Низами МЗИ, Инь IX, Лунг CYK, Ню ДЖИ, Мэй МЛ, Чу Ч. Низами МЗИ и др. Фармацевтика. 2022 21 сентября; 14 (10): 1997. doi: 10.3390/фармацевтика14101997. Фармацевтика. 2022. PMID: 36297434 Бесплатная статья ЧВК. Рассмотрение.
Является ли ожирение фактором риска заболеваний пародонта у взрослых? Систематический обзор.
Абу-Шавиш Г., Бетси Дж., Анил С. Абу-Шавиш Г. и др. Общественное здравоохранение Int J Environ Res. 2022 4 октября; 19 (19): 12684. дои: 10.3390/ijerph291912684. Общественное здравоохранение Int J Environ Res. 2022. PMID: 36231983 Бесплатная статья ЧВК. Рассмотрение.
2022. PMID: 36231983 Бесплатная статья ЧВК. Рассмотрение.
Способность нового набора для анализа активности трипсиноподобной пептидазы обнаруживать виды с красным комплексом.
Усуи М., Ивасаки М., Ариёси В., Кобаяши К., Касаи С., Яманака Р., Накашима К., Нишихара Т. Усуи М. и др. Диагностика (Базель). 2022 8 сентября; 12 (9): 2172. doi: 10.3390/диагностика12092172. Диагностика (Базель). 2022. PMID: 36140573 Бесплатная статья ЧВК.
Исследование in vitro и in vivo патогенной роли PPARα при экспериментальном пародонтите.
Чен И, Цзян Зи, Кеохане А, Ху И. Чен Ю и др. J Appl Oral Sci. 2022 8 июля; 30:e20220076. дои: 10.1590/1678-7757-2022-0076. Электронная коллекция 2022. J Appl Oral Sci. 2022. PMID: 35830121 Бесплатная статья ЧВК.
2022. PMID: 35830121 Бесплатная статья ЧВК.
Просмотреть все статьи "Цитируется по"
 К., Шредер Х.Е. Патогенез воспалительных заболеваний пародонта. Итог текущей работы. Лаборатория Инвест. 1976; 34: 235–249. - пабмед
К., Шредер Х.Е. Патогенез воспалительных заболеваний пародонта. Итог текущей работы. Лаборатория Инвест. 1976; 34: 235–249. - пабмед Остеопороз, или слабость костей, — это заболевание, при котором кости становятся хрупкими и с большей вероятностью ломаются.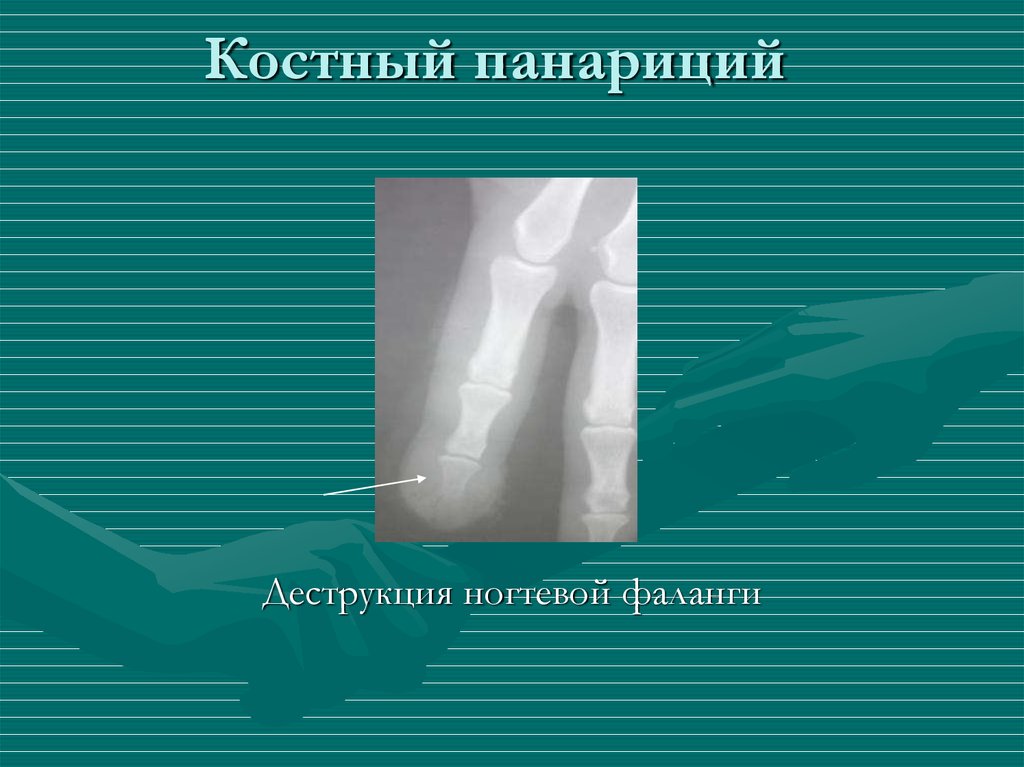 При остеопорозе кости теряют плотность. Плотность костей — это количество кальцинированной костной ткани, которая находится в ваших костях.
При остеопорозе кости теряют плотность. Плотность костей — это количество кальцинированной костной ткани, которая находится в ваших костях.
Диагноз остеопороза означает, что вы подвержены риску переломов костей даже при повседневной деятельности, незначительных несчастных случаях или падениях.
Ваше тело нуждается в минералах кальция и фосфата, чтобы создавать и поддерживать здоровье костей.
Иногда потеря костной массы происходит без какой-либо известной причины. Некоторая потеря костной массы с возрастом нормальна для всех. В других случаях потеря костной массы и низкая плотность костной ткани передаются по наследству.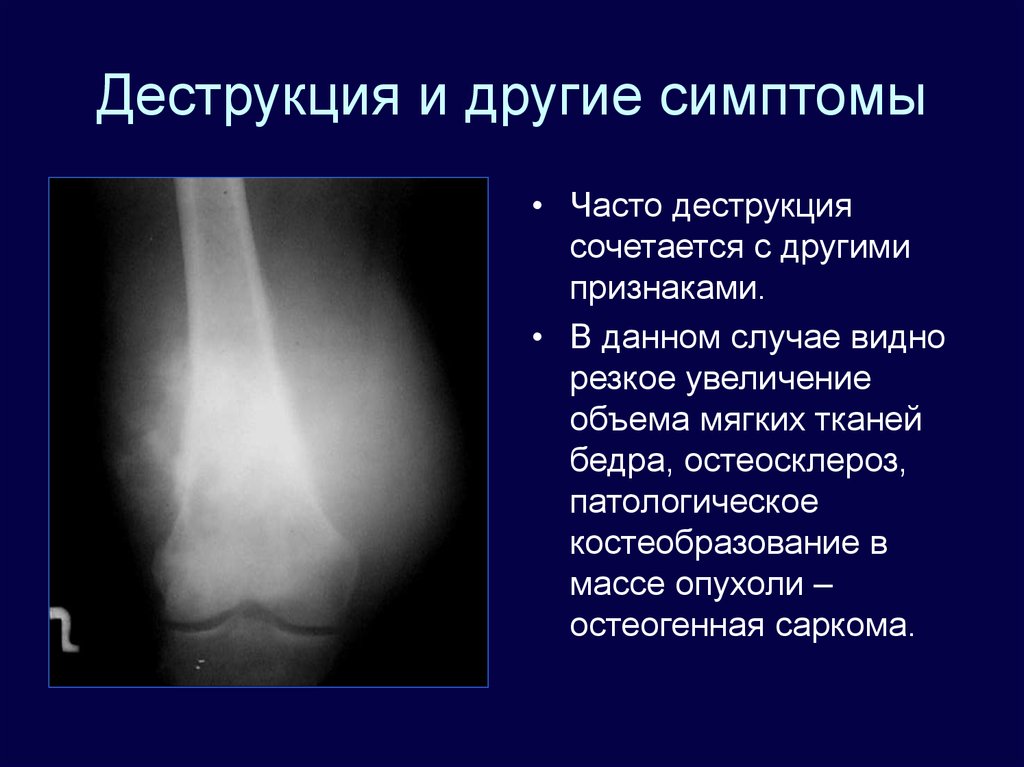 В целом белые пожилые женщины чаще всего страдают от потери костной массы. Это увеличивает риск перелома кости.
В целом белые пожилые женщины чаще всего страдают от потери костной массы. Это увеличивает риск перелома кости.
Хрупкие, хрупкие кости могут быть вызваны чем угодно, что заставляет ваше тело разрушать слишком много костей или мешает вашему телу производить достаточное количество костей.
Слабые кости могут легко сломаться даже без видимой травмы.
Минеральная плотность костей — не единственный показатель хрупкости ваших костей. Употребление алкоголя, курение и малоподвижный образ жизни увеличивают риск хрупкости костей. Существуют и другие неизвестные факторы, связанные с качеством костей, которые так же важны, как и количество костей. Большинство тестов плотности кости измеряют только количество кости.
С возрастом ваше тело может реабсорбировать кальций и фосфат из костей вместо того, чтобы сохранять эти минералы в костях. Это делает ваши кости слабее. Когда этот процесс достигает определенной стадии, его называют остеопорозом.
Посмотрите это видео об остеопорозе
Во многих случаях человек ломает кость еще до того, как узнает, что у него потеря костной массы.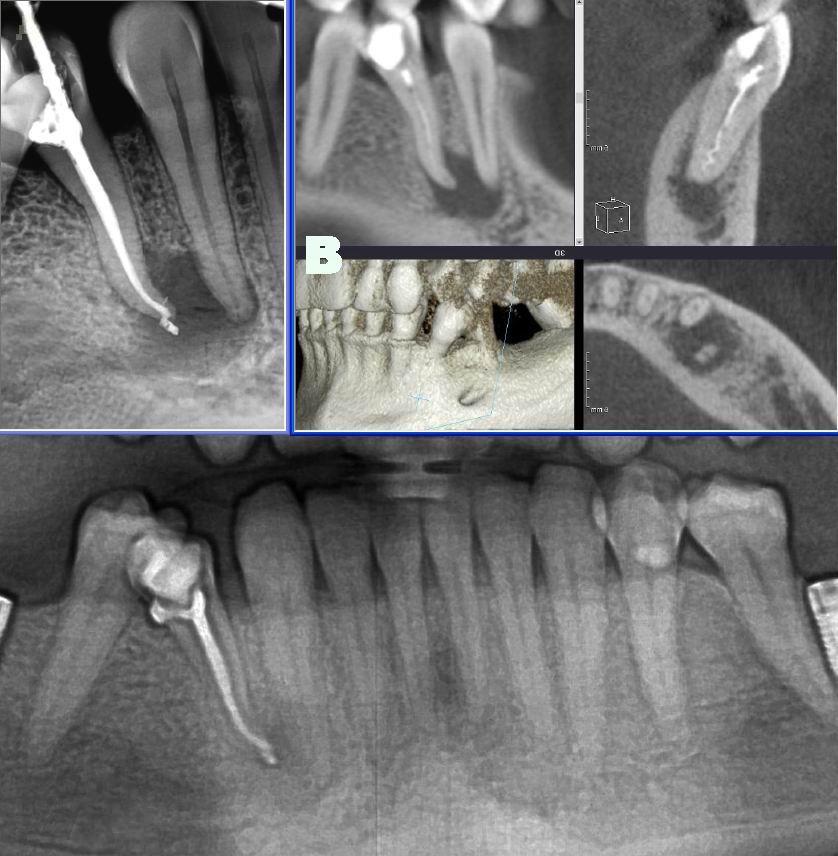 К моменту перелома потеря костной массы может быть серьезной.
К моменту перелома потеря костной массы может быть серьезной.
Женщины в возрасте 50 лет и старше и мужчины в возрасте 70 лет и старше имеют более высокий риск развития остеопороза, чем молодые женщины и мужчины.
Ваше тело нуждается в кальции и витамине D, а также в достаточном количестве упражнений, чтобы построить и сохранить крепкие кости.
Ваш организм может не производить достаточно новых костей, если:
Определенные привычки могут повлиять на ваши кости.
 Слишком много алкоголя может повредить ваши кости. Кроме того, вы можете упасть и сломать кость.
Слишком много алкоголя может повредить ваши кости. Кроме того, вы можете упасть и сломать кость. Молодые женщины, у которых нет менструаций в течение длительного времени, также имеют более высокий риск потери костной массы и остеопороза.
Низкая масса тела связана с меньшей костной массой и более слабыми костями.
Упражнения, особенно упражнения с отягощениями, связаны с увеличением костной массы и укреплением костей.
Многие долгосрочные (хронические) заболевания могут приковывать людей к кровати или стулу.
Другие заболевания, которые также могут привести к потере костной массы:
Иногда лекарства для лечения определенных заболеваний могут вызывать остеопороз.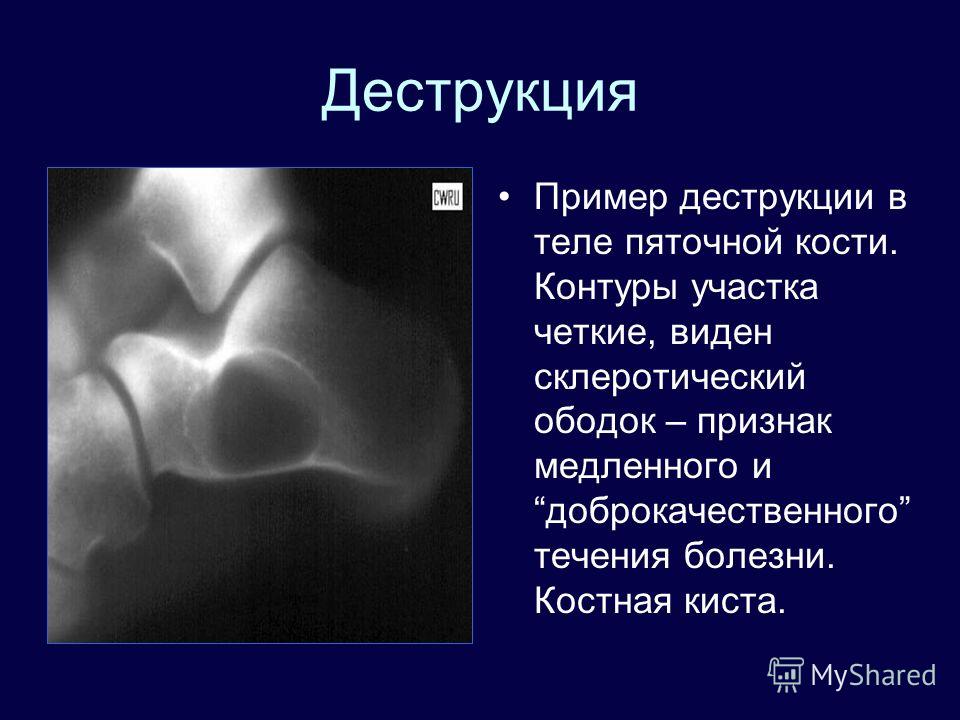 Некоторые из них:
Некоторые из них:
Любое лечение или состояние, при котором кальций или витамин D плохо усваиваются, также может привести к слабости костей. Вот некоторые из них:
Люди с расстройствами пищевого поведения, такими как анорексия или булимия, также подвержены повышенному риску развития остеопороза.
Поговорите со своим лечащим врачом о риске потери костной массы и остеопороза. Узнайте, как получить нужное количество кальция и витамина D, какие упражнения или изменения образа жизни вам подходят и какие лекарства вам могут понадобиться.
Остеопороз - причины; Низкая плотность костной ткани – причины
Де Паула FJA, Черный DM, Розен CJ.