2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
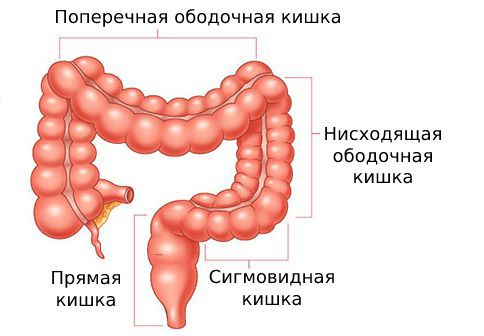
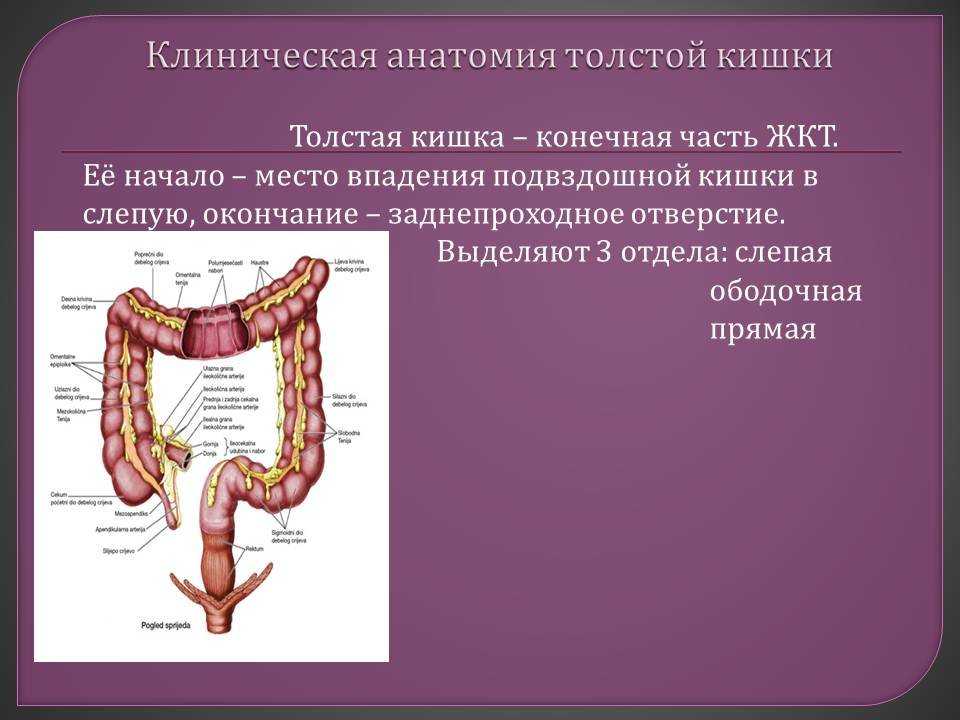
Ободочная кишка – часть толстой кишки, начинающаяся от окончания тонкой кишки (это место называется илеоцекальный или подвздошно-слепокишечный угол) и продолжающаяся до перехода в прямую кишку, которая, в свою очередь, является конечной частью кишечника и переходит в анальный канал. Ободочная кишка проецируется на правую боковую область, средне-верхнюю часть живота и левую боковую область, представляет собой полую трубку, в которой происходит всасывание жидкости и происходит постепенное формирование каловых масс. Стенка толстой кишки состоит из четырех слоев, ближе к просвету кишки находится слизистая, далее изнутри кнаружи идут подслизистая, мышечная и серозная оболочки. Толстая кишка имеет брыжейку, в которой проходят кровеносные и лимфатические сосуды. Ободочную кишку разделяют на правую и левую половины, каждая из которых развивается из отдельной эмбриональной структуры и имеет собственное кровоснабжение.
Как известно, у человека есть два круга кровообращения – малый (легочный), где происходит получение кислорода и отдача углекислого газа, и большой, в ходе которого кровоснабжаются все органы, а центром, где объединяются эти круги, является сердце. По артериям большого круга кровообращения течет кровь, получившая в легких кислород, от сердца к органам. Правая половина ободочной кишки, как и тонкая кишка, получает кровь из верхней брыжеечной артерии, а левая половина ободочной кишки и верхний отдел прямой кишки – из нижней брыжеечной артерии. Эти артерии являются крупными сосудами, их диаметр может достигать 5-10 мм. Венозная кровь, несущая углекислый газ и продукты обмена веществ, оттекает от толстой кишки по верхней брыжеечной и нижней брыжеечной венам и, прежде чем попасть в сердце и легкие, проходит через печень.
Лимфатическая система в периоде внутриутробного развития закладывается вместе с артериальной, поэтому лимфатические узлы располагаются у человека вдоль артерий. Для ободочной кишки существует три уровня, или порядка, лимфатических узлов. Лимфоузлы первого порядка находятся у самого края кишки, ближе других к кишечной стенке. Узлы второго и третьего порядка находятся чуть дальше второго порядка – вдоль сосудов среднего калибра, кровоснабжающих кишку, а апикальные (от слова apex (лат.) – верхушка, вершина, apicalis (лат.)
— верхушечный), или по-другому лимфатические узлы третьего порядка – у самых крупных сосудов, питающих ободочную кишку. Лимфатические узлы являются «сторожами» организма, защищающими его от распространения чужеродных инфекционных агентов и опухолевых клеток.
Для ободочной кишки существует три уровня, или порядка, лимфатических узлов. Лимфоузлы первого порядка находятся у самого края кишки, ближе других к кишечной стенке. Узлы второго и третьего порядка находятся чуть дальше второго порядка – вдоль сосудов среднего калибра, кровоснабжающих кишку, а апикальные (от слова apex (лат.) – верхушка, вершина, apicalis (лат.)
— верхушечный), или по-другому лимфатические узлы третьего порядка – у самых крупных сосудов, питающих ободочную кишку. Лимфатические узлы являются «сторожами» организма, защищающими его от распространения чужеродных инфекционных агентов и опухолевых клеток.
Рак (cancer (лат.), c-r) – злокачественная опухоль из эпителиальных клеток, обладающая способностью прорастать в орган и окружающие структуры и распространяться (метастазировать) в лимфатические узлы и другие, расположенные далеко от опухоли, органы. Пациенты нередко называют раком все злокачественные опухоли, хотя это некорректно с точки зрения онкологии.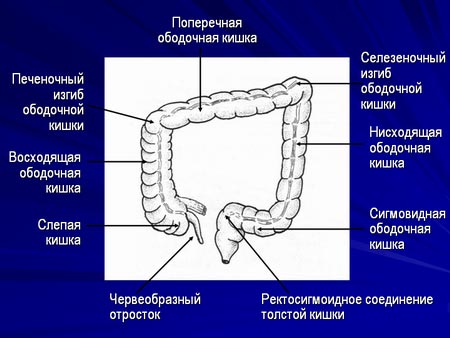
Рак ободочной кишки развивается из слизистой оболочки стенки кишки, которая и является железистым эпителием. Такая опухоль называется «аденокарцинома» (от aden (лат.) железа и carcinoma (лат.) рак, раковая опухоль). Лечением этого заболевания занимаются врачи-онкологи, колопроктологи, хирурги, химиотерапевты. Опухоли другой природы (карциноид, гастро-интестинальные стромальные опухоли) в толстой кишке встречаются намного реже (3-5% от всех злокачественных новообразований толстой кишки).
В Клинике колопроктологии и малоинвазивной хирургии возможно лечение любых опухолей толстой кишки.
Рак ободочной кишки возникает и начинает расти со стороны слизистой (внутренней оболочки кишки), постепенно прорастая остальные слои кишечной стенки и соседние органы. Для всех злокачественных опухолей характерна способность распространяться не только путем роста первичной опухоли, но и путем «отсева» отдельных клеток — метастазирования. Выше были описаны группы лимфатических узлов. В большинстве случает лимфоузлы являются первой мишенью для метастазов опухоли, поражаются те лимфоузлы, которые являются регионарными для данного участка кишки (соответствуют кровоснабжающим этот участок сосудам). Отдаленные метастазы распространяются с током крови. Как было сказано выше, кровь от органов брюшной полости оттекает по венам, ведущим к печени, и именно в печени чаще всего возникают отдаленные метастазы. Вторым по частоте органом, где происходит отдаленное метастазирование рака толстой кишки, являются легкие, куда кровь от всех органов попадает для осуществления газообмена. Другие органы поражаются намного реже. Еще одним путем метастазирования опухоли является появление опухолевых отсевов на брюшине (оболочке, покрывающей брюшную полость изнутри). Такое поражение называется канцероматозом. Степень распространенности опухоли определяет стадию рака, а также, напрямую зависящую от стадии, тактику лечения и прогноз.
В большинстве случает лимфоузлы являются первой мишенью для метастазов опухоли, поражаются те лимфоузлы, которые являются регионарными для данного участка кишки (соответствуют кровоснабжающим этот участок сосудам). Отдаленные метастазы распространяются с током крови. Как было сказано выше, кровь от органов брюшной полости оттекает по венам, ведущим к печени, и именно в печени чаще всего возникают отдаленные метастазы. Вторым по частоте органом, где происходит отдаленное метастазирование рака толстой кишки, являются легкие, куда кровь от всех органов попадает для осуществления газообмена. Другие органы поражаются намного реже. Еще одним путем метастазирования опухоли является появление опухолевых отсевов на брюшине (оболочке, покрывающей брюшную полость изнутри). Такое поражение называется канцероматозом. Степень распространенности опухоли определяет стадию рака, а также, напрямую зависящую от стадии, тактику лечения и прогноз.
Основным путем развития рака ободочной кишки является злокачественное перерождение полипов – доброкачественных образований слизистой ободочной кишки. Также к факторам риска можно отнести воспалительные заболевания кишечника, нарушения диеты, курение, отягощенный по онкологическим заболеваниям наследственный анамнез.
Также к факторам риска можно отнести воспалительные заболевания кишечника, нарушения диеты, курение, отягощенный по онкологическим заболеваниям наследственный анамнез.
Большую роль в развитии рака может играть наследственность, так как каждый десятый носитель колоректального рака имеет наследственную предрасположенность к этому заболеванию. Если в вашем роду были родственники с заболеванием колоректальный рак, то следует быть особенно настороженным относительно своего здоровья. Наследственные формы рака могут проявляться даже в раннем возрасте. В такой ситуации особенно важно тщательно и своевременно обследоваться.
Самым эффективным методом профилактики рака ободочной кишки является своевременное удаление полипов. Это малоинвазивная хирургическая операция, выполняющаяся во время колоноскопии – эндоскопического обследования толстой кишки. Для того, чтобы вовремя выявить полипы, зачастую не проявляющие себя никакими симптомами, необходимо, начиная с 45-50-летнего возраста, каждые 5 лет проходить колоноскопию.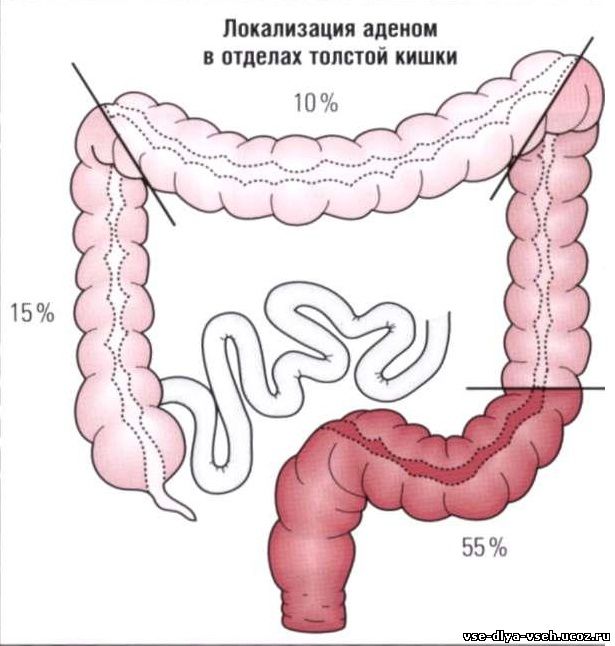 Людям, чьи родственники болели раком ободочной или прямой кишки, обследование надо начинать проходить в более раннем возрасте, а при установлении диагноза «наследственный колоректальный рак» родственникам пациента необходимо начинать обследование в возрасте на 5 лет младше возраста установки диагноза у заболевшего родственника. Никакие другие методы (онкомаркеры, анализ кала на скрытую кровь, виртуальная колоноскопия) не обладают такой результативностью, как проведение колоноскопии в качестве метода профилактики рака ободочной кишки.
Людям, чьи родственники болели раком ободочной или прямой кишки, обследование надо начинать проходить в более раннем возрасте, а при установлении диагноза «наследственный колоректальный рак» родственникам пациента необходимо начинать обследование в возрасте на 5 лет младше возраста установки диагноза у заболевшего родственника. Никакие другие методы (онкомаркеры, анализ кала на скрытую кровь, виртуальная колоноскопия) не обладают такой результативностью, как проведение колоноскопии в качестве метода профилактики рака ободочной кишки.
К другим способам профилактики рака ободочной кишки относят диету с ограничением красного мяса и сильно жареной пищи, ограничение употребления алкоголя и курения, поддержание нормального веса тела и активный образ жизни.
Рак ободочной кишки может проявляться разными симптомами, в некоторых случаях до определенного момента возможно скрытое, бессимптомное течение этого заболевания. Можно разделить все симптомы на «острые» — требующие экстренной медицинской помощи, и «хронические» — позволяющие проводить обследование и подбирать тактику лечения в плановом порядке.
«Острые» симптомы рака ободочной кишки являются жизнеугрожающими, вызываются осложнениями рака ободочной кишки и зачастую приводят к экстренной госпитализации в хирургическое отделение на карете скорой медицинской помощи. Следует сказать, что симптомы, о которых пойдет речь в этом разделе, являются характерными не только для осложнений рака ободочной кишки, но и для других экстренных хирургических заболеваний, вызывающих клиническую картину «катастрофы в животе».
Выделение крови при дефекации, следы крови на туалетной бумаге и на стенках унитаза сопровождают многие другие, в том числе доброкачественные, колопроктологические заболевания. Поступление из анального отверстия большого количества свежей крови, темных кровяных сгустков или стула, смешанного с кровью, является причиной для экстренного обращения в медицинское учреждение. Причиной кровотечения может быть рак ободочной кишки.
Кишка, как уже говорилось выше, представляет собой полую трубку. Если в каком-либо отделе появляется препятствие (как внутри просвета, так и сдавливание извне), прохождение каловых масс по кишке прекращается и развивается картина непроходимости кишечника. Проявлением этого состояния будут схваткообразные боли в животе, вздутие живота, отсутствие стула и газов, сухость во рту, тошнота, повышение температуры тела. Одной из причин кишечной непроходимости может быть опухоль толстой кишки. Это состояние является поводом для экстренной госпитализации в хирургическое отделение.
Если в каком-либо отделе появляется препятствие (как внутри просвета, так и сдавливание извне), прохождение каловых масс по кишке прекращается и развивается картина непроходимости кишечника. Проявлением этого состояния будут схваткообразные боли в животе, вздутие живота, отсутствие стула и газов, сухость во рту, тошнота, повышение температуры тела. Одной из причин кишечной непроходимости может быть опухоль толстой кишки. Это состояние является поводом для экстренной госпитализации в хирургическое отделение.
Перфорация – нарушение целостности кишечной стенки, образование в ней отверстия — также является экстренным хирургическим заболеванием. В момент перфорации человек ощущает резкие, будто удар кинжалом, боли, затем разливающиеся по всему животу, повышение температуры тела, сухость во рту, тошноту. Поступление в брюшную полость кишечного содержимого приводит к перитониту и сепсису, поэтому эта ситуация требует экстренного хирургического вмешательства. Одной из причин перфорации толстой кишки может быть колоректальный рак.
Одной из причин перфорации толстой кишки может быть колоректальный рак.
Симптомы, позволяющие заподозрить рак ободочной кишки, весьма разнообразны. Они отличаются для рака правых и левых отделов ободочной кишки, порой не оказывают на жизнь человека особого влияния и могут быть проигнорированы или вовсе незамечены. Если говорить не только о раке ободочной кишки, но об онкологических заболеваниях в целом, можно разделить все симптомы на «общие» и «частные». Частные являются проявлением роста опухоли и отражают нарушение функции вовлеченного в опухолевый процесс органа или структуры. Общие симптомы неспецифичны, характерны для множества заболеваний, но как сами по себе, так и в сочетании с другими симптомами должны насторожить и заставить провести обследование.
Самым частым общим симптомом является слабость и утомляемость. Если вы заметили у себя непривычную усталость при обычной нагрузке, это уже является поводом задуматься о своем здоровье и обратиться к специалистам. Головокружение, бледность кожных покровов обычно свидетельствуют об анемии, которая является вечной спутницей онкологических заболеваний. Насторожить должна и потеря веса, которая тоже часто сопровождает злокачественный процесс в организме.
Головокружение, бледность кожных покровов обычно свидетельствуют об анемии, которая является вечной спутницей онкологических заболеваний. Насторожить должна и потеря веса, которая тоже часто сопровождает злокачественный процесс в организме.
Опухоль ободочной кишки может проявлять себя нарушениями пищеварения, ощущением дискомфорта в животе, вздутием живота, изменением характера стула, появлением примесей крови и слизи к стулу, небольшим повышением температуры тела. Вопреки распространенному среди пациентов мнению, боли являются не самым частым и не самым характерным признаком рака и могут появляться только на поздних стадиях заболевания. Любые из перечисленных симптомов являются поводом для обращения к врачу-колопроктологу и проведения обследования для выявления заболевания, вызвавшего эти симптомы.
Основным методом, позволяющим со стопроцентной уверенностью сказать, что у пациента рак ободочной кишки, является гистологическое исследование фрагмента опухоли. Чтобы подтвердить злокачественный характер опухолевого роста, необходимо исследовать опухолевую ткань под микроскопом. Это исследование проводится после получения материала во время колоноскопии с биопсией.
Чтобы подтвердить злокачественный характер опухолевого роста, необходимо исследовать опухолевую ткань под микроскопом. Это исследование проводится после получения материала во время колоноскопии с биопсией.
Всем пациентам с жалобами, которые могут указывать на болезни толстой кишки, мы рекомендуем выполнить эндоскопичесний осмотр толстой кишки – колоноскопию. Колоноскопия — инструментальное исследование просвета кишки изнутри специальным инструментом с камерой, введенным через задний проход. Данное исследование может выполняться как во сне (под наркозом), так и без него. Для проведения колоноскопии крайне важна подготовка кишки, поскольку это исследование требует визуальной трактовки врачом–эндоскопистом. Необходимо создать все условия для полного обзора толстой кишки, иными словами, очистить ее от содержимого. Существуют специальные препараты для очистки кишки, подробно о способе и схеме подготовки рассказывает врач, отправляющий пациента на исследование. При нарушении кишечной проходимости необходим индивидуальный выбор метода подготовки к колоноскопии.
Ректороманоскопия — метод диагностики, при котором производится визуальный осмотр прямой кишки, ректосигмоидного перехода и дистальных отделов сигмовидной кишки. Исследование осуществляется с помощью специального прибора, представляющего собой трубку с источником света. Недостатком этого исследования является то, что остальные отделы кишки остаются неосмотренными. Именно поэтому, не сегодняшний день этот метод диагностики использовать для первичной диагностики нецелесообразно. История складывалась таким образом, что во времена когда не были доступны современные гибкие колоноскопы, применялись такие ригидные трубки. Более того, нужно признать, что для диагностики рака ободочной кишки этот метод никогда не применялся. Его удел теперь — повторное исследование опухолей прямой кишки (например, при необходимости выполнения повторной биопсии или определения расстояния до опухоли от ануса).
Ирригоскопия – рентгенологическое исследование, в ходе которого выполняют несколько снимков ободочной кишки.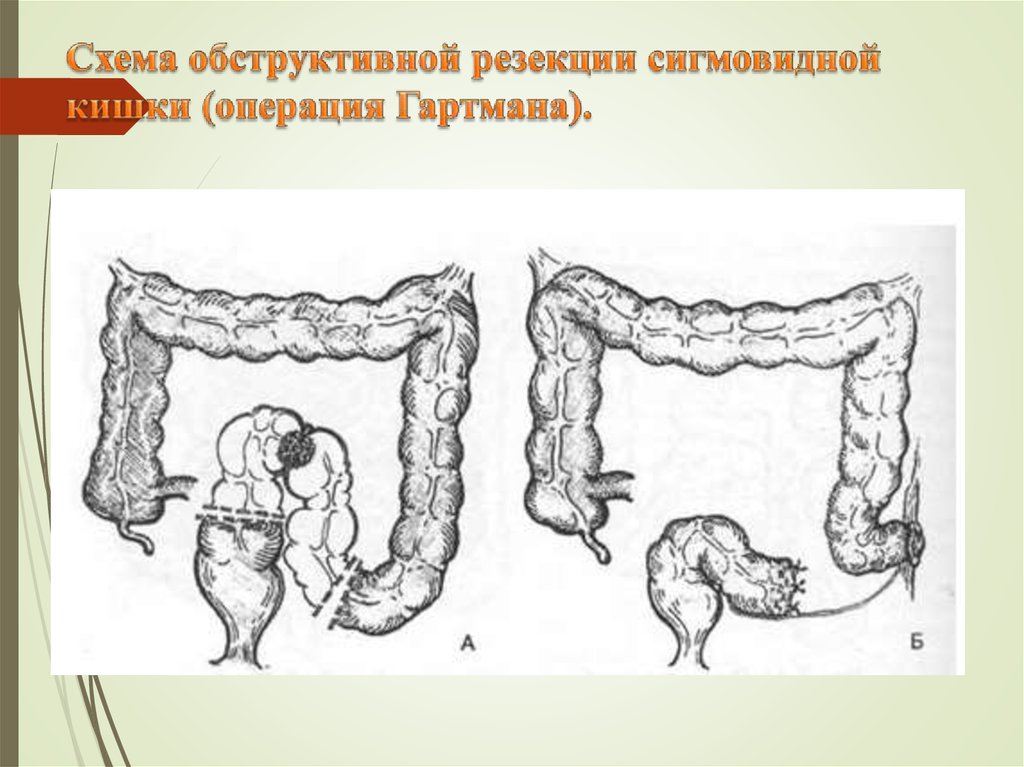 Для того, чтобы кишку было видно на рентгеновском снимке, ее заполняют рентгенконтрастным веществом (вводят при помощи клизмы). Первый снимок делается при наполненной кишке. После опорожнения кишки ее раздувают воздухом и повторяют снимки. Это исследование позволяет выявить и достоверно определить локализацию опухоли.
Для того, чтобы кишку было видно на рентгеновском снимке, ее заполняют рентгенконтрастным веществом (вводят при помощи клизмы). Первый снимок делается при наполненной кишке. После опорожнения кишки ее раздувают воздухом и повторяют снимки. Это исследование позволяет выявить и достоверно определить локализацию опухоли.
КТ – рентгеновское сканирование какой–либо анатомической области, в результате которого делается множество снимков с небольшим интервалом. Пациентам с опухолью ободочной кишки показано выполнение компьютерной томографии двух областей – брюшной полости и грудной клетки, причем исследование брюшной полости обязательно должно быть выполнено с внутривенным контрастированием. Это исследование является золотым стандартом диагностики рака ободочной кишки, позволяет определить распространение опухоли, заподозрить наличие пораженных опухолевыми клетками лимфатических узлов, выявить отдаленные метастазы. Кроме того, выполненная на основе КТ 3D-реконструкция строения сосудов позволяет запланировать ход операции с учетом индивидуальных особенностей пациента. Компьютерная томография проводится в отделении лучевой диагностики, во время проведения исследования пациенту предложат лечь на специальную каталку, проезжающую через большую круглую катушку. Перед исследованием устанавливают венозный катетер, через который будет вводиться контрастный препарат. Очень важно получить от специалистов лучевой диагностики не только письменное заключение, но и диск с записанным исследованием. Компьютерная томография позволяет ответить на многие вопросы, определяющие тактику лечения. После исследования Вы должны предоставить заключение лучевого диагноста и диск с файлами врачу-колопроктологу для ознакомления с заключением и изучением диска. В Клинике колопроктологиии и малоинвазивной хирургии все специалисты владеют знаниями и умениями по изучению КТ-исследования.
Компьютерная томография проводится в отделении лучевой диагностики, во время проведения исследования пациенту предложат лечь на специальную каталку, проезжающую через большую круглую катушку. Перед исследованием устанавливают венозный катетер, через который будет вводиться контрастный препарат. Очень важно получить от специалистов лучевой диагностики не только письменное заключение, но и диск с записанным исследованием. Компьютерная томография позволяет ответить на многие вопросы, определяющие тактику лечения. После исследования Вы должны предоставить заключение лучевого диагноста и диск с файлами врачу-колопроктологу для ознакомления с заключением и изучением диска. В Клинике колопроктологиии и малоинвазивной хирургии все специалисты владеют знаниями и умениями по изучению КТ-исследования.
В некоторых случаях для уточнения распространенности опухолевого процесса может понадобиться выполнение позитронно-эмиссионной томографии (ПЭТ-КТ). Это исследование похоже на обычную томографию, но проводится с использованием особого контрастного вещества, которое будет видно на снимках в тех тканях, в которых происходит усиленный обмен веществ. Некоторые органы в норме накапливают контраст, например, мочевой пузырь, почки и головной мозг, но для опухолевых клеток особенно характерен ускоренный обмен веществ, поэтому данное исследование позволяет увидеть даже самые маленькие опухолевые отсевы – как в лимфатические узлы, так и в другие органы.
Некоторые органы в норме накапливают контраст, например, мочевой пузырь, почки и головной мозг, но для опухолевых клеток особенно характерен ускоренный обмен веществ, поэтому данное исследование позволяет увидеть даже самые маленькие опухолевые отсевы – как в лимфатические узлы, так и в другие органы.
Ультразвуковое исследование и рентгенография не являются золотым стандартом для диагностики опухолей ободочной кишки и определения стадии опухолевого процесса, но применяется для диагностики острых осложнений рака ободочной кишки.
Магнитно-резонансная томография брюшной полости не является стандартным исследованием для опухолей ободочной кишки, но в случае метастатического поражения печени (или на его подозрения) необходима для определения характеристик очаговых образований в печени и решения вопроса о дальнейшей тактике лечения.
Общий и биохимический анализы крови, коагулограмма (исследование свертываемости крови) и общий анализ мочи являются обязательными при обследовании пациентов с онкологическими заболеваниями и позволяют оценить общее состояние организма.
Исследования крови на онкомаркеры (особые вещества, вырабатываемые опухолью) выполняются всем пациентам с колоректальным раком. Положительные результаты не являются основанием для постановки диагноза, но указывают на необходимость дообследования. При установленном диагнозе «колоректальный рак» значения этих анализов позволяют косвенно оценить прогноз. Наиболее информативными для колоректального рака являются онкомаркеры: CA19-9 и РЭА.
Исследование кала на скрытую кровь является простым и быстрым методом скрининга колоректального рака, но, к сожалению, не самым достоверным. Вероятность ложноположительного результата высока, может быть связана с особенностями питания, любыми другими причинами скрытых кровотечений в ЖКТ, даже с травмой десны при чистке зубов в день исследования. Для того, чтобы выяснить причину положительного результата теста на скрытую кровь, необходимо более полное обследование.
Виртуальная колоноскопия – это метод, объединяющий компьютерную томографию и ирригоскопию, но не обладающий преимуществами обычной колоноскопии.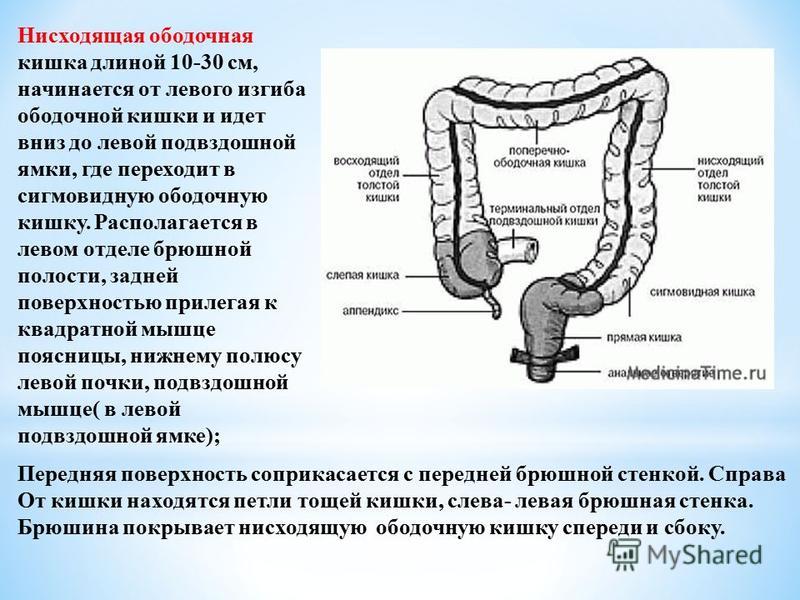 После подготовки кишки проводится компьютерная томография, при этом толстую кишку раздувают воздухом. После исследования специалисты по лучевой диагностике выполняют 3Д-реконструкцию просвета кишечника, что позволяет осмотреть всю толстую кишку «изнутри», однако при подозрении на какие-либо изменения необходимо проведение колоноскопии и биопсии.
После подготовки кишки проводится компьютерная томография, при этом толстую кишку раздувают воздухом. После исследования специалисты по лучевой диагностике выполняют 3Д-реконструкцию просвета кишечника, что позволяет осмотреть всю толстую кишку «изнутри», однако при подозрении на какие-либо изменения необходимо проведение колоноскопии и биопсии.
Гастроскопия должна выполняться всем пациентам с колоректальным раком не только для исключения синхронного поражения желудка, но и для выявления (и при необходимости последующего лечения) гастрита и язвенной болезни пациентам в рамках предоперационной подготовки и лечения.
С точки зрения психологов, человек, столкнувшийся со сложной ситуацией в жизни, в том числе с выявлением тяжелого заболевания, проходит через 5 стадий:
Переживать, волноваться, расстраиваться после установки диагноза «рак» — абсолютно нормальная человеческая реакция, но чем быстрее вы сможете принять сложившиеся обстоятельства и взять собственную судьбу в свои руки, тем лучше. Чем раньше будет проведено обследование и лечение, тем больше шансов на благоприятный прогноз. Современные способы лечения позволяют добиться хороших результатов лечения без потери качества жизни. После установки диагноза следует встать на учет в онкологический диспансер, провести дообследование и получить направление на лечение, но следует знать, что пациенту можно самому выбрать учреждение, в котором он будет проходить лечение и обратиться туда на консультацию. Поэтому, с точки зрения колопроктологов, пациенту с установленным диагнозом «рак ободочной кишки», следует пройти следующие 5 стадий:
Единственным радикальным методом лечения рака ободочной кишки является хирургический метод. Только выполнение операции по удалению опухоли и лимфатических узлов позволяет полностью удалить все проявления злокачественного процесса (при резектабельном раке). Дополнением к операции является химиотерапия, которая может проводиться как до операции, так и после при наличии определенных показаний. Прежде чем подробно говорить о лечении, следует разобраться в стадиях колоректального рака. Выше были описаны особенности роста первичной опухоли и пути метастазирования колоректального рака, и именно они определяют стадию заболевания.
Только выполнение операции по удалению опухоли и лимфатических узлов позволяет полностью удалить все проявления злокачественного процесса (при резектабельном раке). Дополнением к операции является химиотерапия, которая может проводиться как до операции, так и после при наличии определенных показаний. Прежде чем подробно говорить о лечении, следует разобраться в стадиях колоректального рака. Выше были описаны особенности роста первичной опухоли и пути метастазирования колоректального рака, и именно они определяют стадию заболевания.
Существует классификация TNM, обозначающая распространение первичной опухоли (Т), наличие пораженных лимфатических узлов (N) и отдаленных метастазов (М). Кроме этих существуют дополнительные индексы, которые могут использоваться при формулировке диагноза, однако именно значения названных выше трех индексов обозначают клиническую стадию. Всего выделяют четыре стадии колоректального рака, чем выше порядковый номер стадии, тем выраженнее распространение опухоли.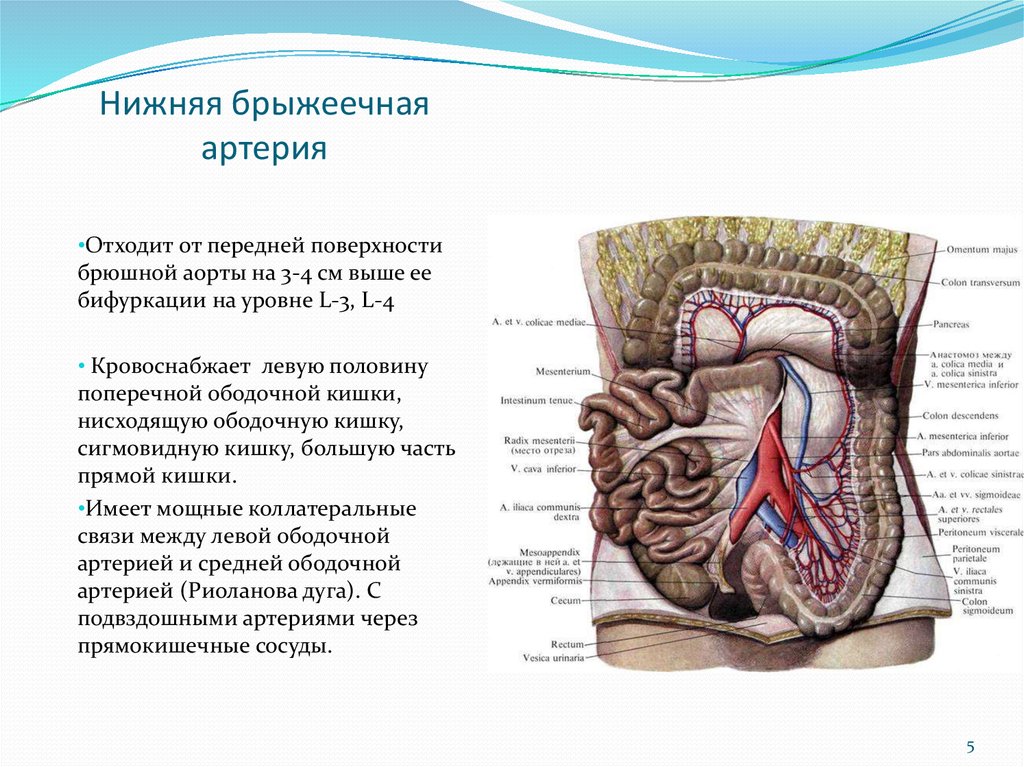
Стадия может быть установлена клинически (то есть только при использовании инструментальных методов обследования) и морфологически (после исследования удаленной кишки и лимфатических узлов под микроскопом), это обозначается индексами «с» и «р» соответственно. Морфологическое исследование обладает наибольшей достоверностью, чем все инструментальные методы диагностики вместе взятые, и поэтому стадия может измениться после операции как в меньшую, так и в большую сторону, и это не является ошибкой диагностики.
При лечении опухолей 0 и I стадии возможно местное иссечение опухоли – малоинвазиваная эндоскопическая операция. Она выполняется при колоноскопии под наркозом, разрезы на передней брюшной стенке не выполняются. После операции необходимо наблюдаться несколько дней в стационаре и соблюдать щадящую диету. После получения результатов морфологического (иными словами – гистологического) исследования возможны два варианта дальнейшей тактики. На основании заключения морфолога определяются факторы прогноза. При отсутствии неблагоприятных факторов возможно ограничиться только наблюдением по программе послеоперационного мониторинга, однако при наличии неблагоприятных факторов пациенту будет предложена операция по удалению участка кишки и лимфатических узлов. Окончательное решение принимается на онкологическом консилиуме, где также учитывается мнение пациента.
Лечение опухолей II-III стадии заключается в удалении участка кишки с опухолью и всех регионарных лимфатических узлов, такая операция может быть выполнена любым способом – роботическим, лапароскопическим или открытым.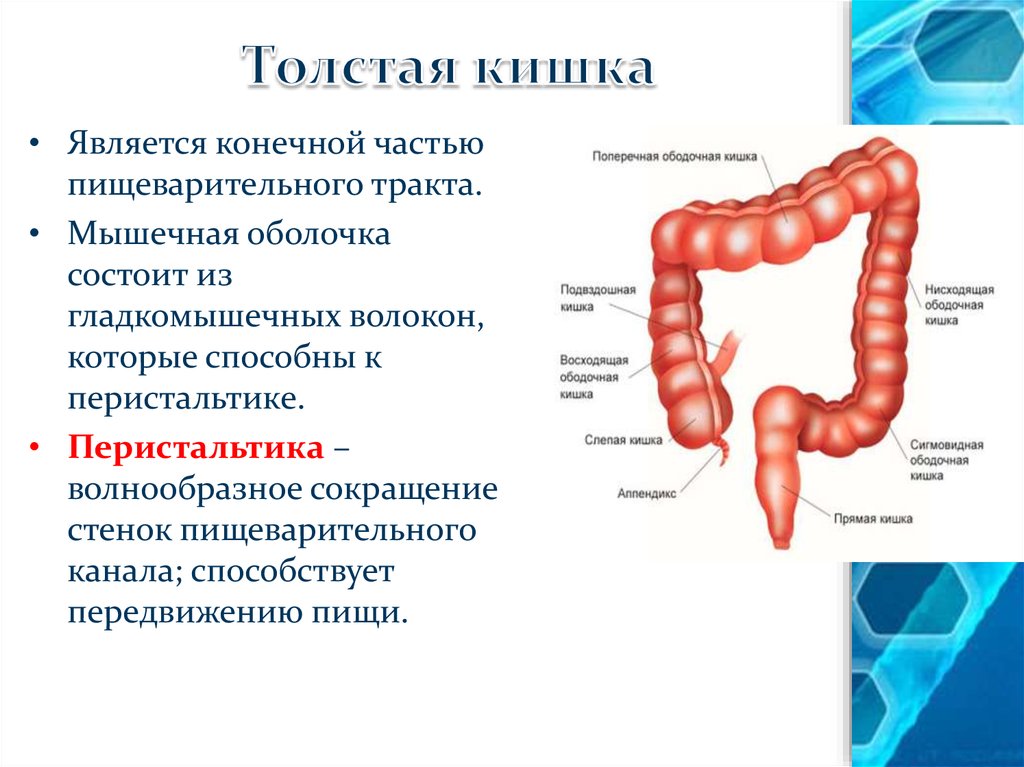 Иногда до операции назначается проведение нескольких курсов химиотерапии для улучшения результатов оперативного лечения. Количество удаленных лимфатических узлов – важнейший фактор прогноза, даже при отсутствии их поражения, это еще одно из преимуществ выполнения расширенной лимфодиссекции. Удаление и обнаружение в препарате менее 12 лимфатических узлов по современным стандартам является неприемлемым в лечении колоректального рака.
Иногда до операции назначается проведение нескольких курсов химиотерапии для улучшения результатов оперативного лечения. Количество удаленных лимфатических узлов – важнейший фактор прогноза, даже при отсутствии их поражения, это еще одно из преимуществ выполнения расширенной лимфодиссекции. Удаление и обнаружение в препарате менее 12 лимфатических узлов по современным стандартам является неприемлемым в лечении колоректального рака.
После операции препарат (кишка и лимфоузлы) направляются в морфологическую лабораторию, исследуются под микроскопом. После получения результата возможны следующие варианты лечения:
В некоторых случаях необходимо дообследование – проведение иммуногистохимического и/или генетического исследования (определение микросателлитной нестабильности), позволяющего предсказать прогноз и ответ на химиотерапию.
Лечение колоректального рака IV стадии – наиболее неблагоприятной по отдаленным результатам, является спорным и дискутабельным вопросом. Пациенты с IV стадией составляют разнородную группу, отличающуюся по многим факторам, которые могут определять прогноз – количество и размеры метастазов, их локализация, размеры и локализация первичной опухоли, степень проявления симптомов опухоли и метастазов, наличие пораженных лимфатических узлов, наличие генетических мутаций в опухоли. В данной группе возможно химиотерапевтическое, хирургическое (в том числе эндоскопическое) лечение, воздействие на метастазы высокотехнологическими способами и, конечно, комбинации этих методов лечения. В современных рекомендациях для данной стадии прописано следующее: показано проведение химиотерапии, но возможно и хирургическое лечение. Учитывая разнообразные проявления заболевания и разные факторы прогноза, при лечении рака ободочной кишки IV стадии необходим индивидуальный подход, а решение о лечении должно приниматься коллегиально, на онкологическом консилиуме.
В первую очередь пациентов с раком ободочной кишки IV стадии следует разделить на следующие группы: пациенты с резектабельными, условно-резектабельными и нерезектабельными метастазами. Первая из этих групп имеет наиболее благоприятный прогноз, в данном случае возможно как удаление опухоли ободочной кишки с лимфатическими узлами и метастазов во время одной операции, так и разделение этих этапов на две операции.
Пациентам с условно-резектабельными метастазами показано проведение химиотерапевтического лечения с последующей оценкой динамики изменения метастазов, и при достижении резектабельного состояния метастазов – операция по удалению всех проявлений опухолевого процесса. После операции всем пациентам с IV стадией показано проведение химиотерапии при отсутствии противопоказаний. Схематично можно разбить все лечение пациентов с условно-резектабельными и резектабельными метастазами на блоки: «химиотерапии до операции», «операция по поводу опухоли толстой кишки», «операция по поводу отдаленных метастазов», «химиотерапия после операции», и, комбинируя эти блоки, можно представить, сколько последовательностей этапов лечения возможно в этой группе пациентов. Только командный подход, оценка всех факторов рисков, привлечение врачей разных специальностей к обсуждению каждой клинической ситуации позволяет выбрать правильную стратегию лечения.
Только командный подход, оценка всех факторов рисков, привлечение врачей разных специальностей к обсуждению каждой клинической ситуации позволяет выбрать правильную стратегию лечения.
Для пациентов с нерезектабельными метастазами возможны две опции лечения – комбинация хирургической операции по поводу опухоли кишки с химиотерапией или только химиотерапевтическое лечение. Согласно данным исследований многих зарубежных авторов, при IV стадии колоректального рака с нерезектабельными метастазами операция по удалению первичной опухоли в комбинации с химиотерапевтическим лечением улучшает результаты по сравнению с проведением только химиотерапии.
К сожалению, бывают такие ситуации, когда и метастазы, и первичная опухоль являются неудаляемыми хирургически. В таком случае возможно проведение химиотерапии с последующей оценкой возможности выполнения хирургического лечения, а так же выполнение операций, облегчающих состояние пациента и улучшающих качество жизни.
Все радикальные и условно-радикальные операции при раке ободочной кишки можно схематично представить следующим образом:
1. Доступ (открытый, лапароскопический, роботический)
Доступ (открытый, лапароскопический, роботический)
2. Оперативный прием:
3. Ушивание раны или ран передней брюшной стенки.
Прочитать подробно про роботические, лапароскопические и открытые операции возможно в соответствующих разделах нашего сайта.
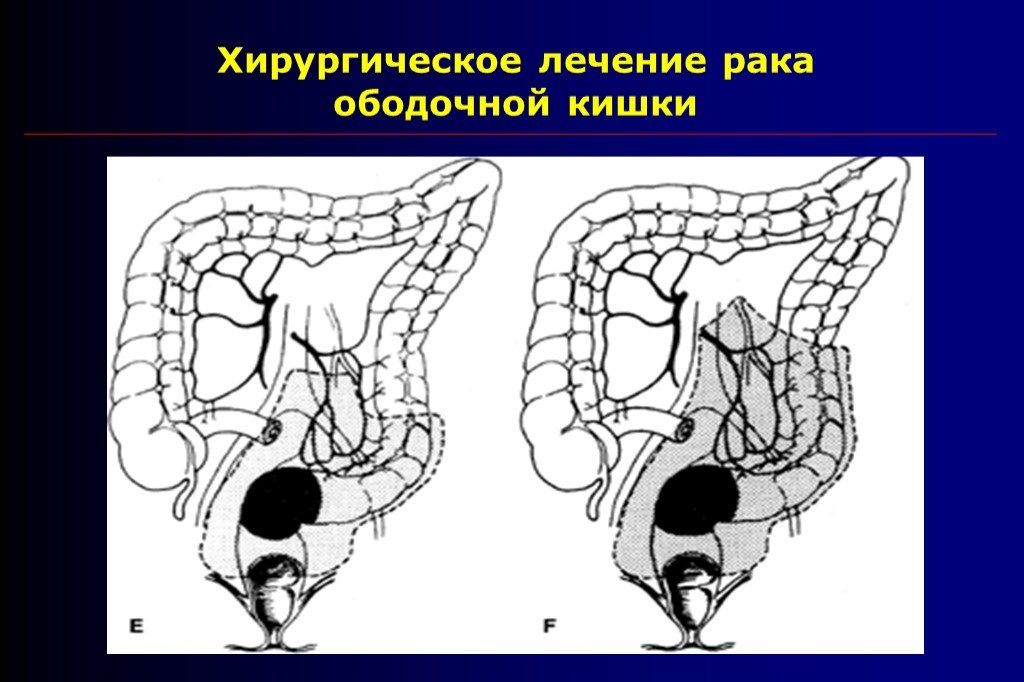
Правосторонняя гемиколэктомия – удаление правой половины ободочной кишки с конечным участком тонкой кишки. Выполняется при раке восходящей ободочной кишки, локализации опухоли в слепой кишке, печеночном изгибе ободочной кишки, раке изгиба ободочной кишки.
Резекция поперечно-ободочной кишки выполняется при раке поперечной ободочной кишки, может сопровождаться лимфодиссекцией вдоль двух систем сосудов, поскольку кровоснабжается поперечно-ободочная кишка за счет ветвей и верхней, и нижней брыжеечной артерии.
Левосторонняя гемиколэктомия – удаление левой половины ободочной кишки, в настоящее время выполняется редко, преимущество отдается резекции левых отделов, причем длина удаленного участка кишки определяется локализацией опухоли и строением сосудов. Левосторонняя гемиколэктомия в современном мире используется при синхронном поражении левых отделов ободочной кишки несколькими опухолями.
Резекция левых отделов ободочной кишки выполняется при локализации опухоли в селезеночном изгибе, нисходящей ободочной кишке и проксимальной трети сигмовидной кишки.
Резекция сигмовидной кишки выполняется при опухолевом поражении средней трети сигмовидной кишки.
Передняя резекция прямой кишки выполняется не только при раке прямой кишки, но и при раке ободочной — при поражении дистальной трети сигмовидной кишки и ректосигмоидного соединения. При такой локализации опухоли приходится удалять небольшой участок прямой кишки, чтобы не нарушить кровоснабжение будущего анастомоза.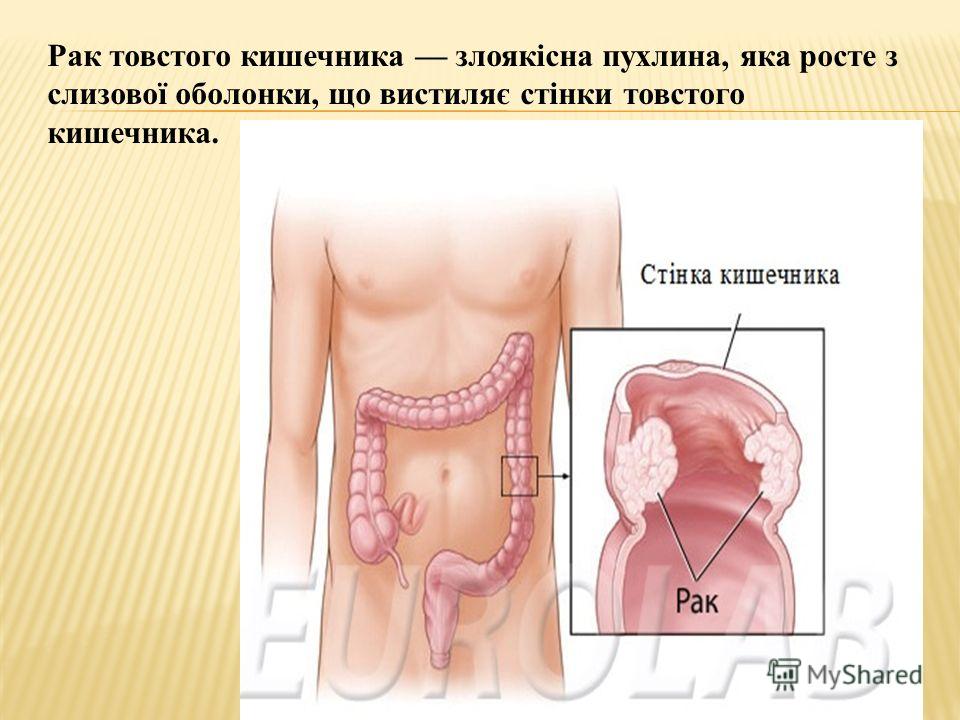
Все операции по поводу колоректального рака в нашей клинике выполняются с расширенной лимфодиссекцией, то есть с удалением лимфатических узлов всех трех порядков. Такой подход заимствован нами из Японской онкологии, страны, являющейся лидером по лечению онкологических заболеваний. Расширенная лимфодиссекция позволяет улучшить результаты лечения по сравнению с обычной и тем более неопределенной лимфодиссекцией, к сожалению, до сих пор выполняемой в отечественных учреждениях. Удаление большего количества лимфатических узлов позволяет достоверно определить стадию и улучшить прогноз лечения колоректального рака.
Реконструктивный этап – формирование анастомоза – может выполняться как вручную (участки кишки сшиваются нитками), так и механически – с использованием специальных сшивающих аппаратов (участки кишки скрепляются скобками). В тех случаях, когда существуют риски несостоятельности анастомоза (системные заболевания, связанные с нарушением микроциркуляции, плохая подготовка толстой кишки при частичном нарушении кишечной проходимости) формируется превентивная стома – на переднюю брюшную стенку выводится петля кишки. Это позволяет отключить пассаж по кишке и дать анастомозу время зажить, а после – выполнить реконструктивную операцию и вернуть естественный ход кишечному содержимому. Надо отметить, что при раке ободочной кишки превентивная стома формируется значительно реже, чем при раке прямой кишки, когда ее формирование при определенных локализациях опухоли запланировано заранее.
Это позволяет отключить пассаж по кишке и дать анастомозу время зажить, а после – выполнить реконструктивную операцию и вернуть естественный ход кишечному содержимому. Надо отметить, что при раке ободочной кишки превентивная стома формируется значительно реже, чем при раке прямой кишки, когда ее формирование при определенных локализациях опухоли запланировано заранее.
При невозможности выполнения операций вышеуказанного объема (например, в экстренной ситуации при осложненном течении заболевания или при нерезектабельной первичной опухоли) выполняются симптоматические операции, которые могут стать «мостом» к проведению более радикального лечения. К таким операциям относится:
Если одна из таких операций была выполнена, не стоит считать, что на этом лечение окончено. Возможности хирургического лечения зависят не только от распространенности опухолевого процесса и наличия осложнений, но и от оснащения операционной и уровня подготовки хирургов, причем последние два аспекта в хирургическом отделении городской больницы, к сожалению, могут отличаться от оснащенной по последнему слову техники клиники, сотрудники которого ежедневно сталкиваются с онкологическим заболеванием. После восстановительного периода следует обратиться к онкологу или колопроктологу для дообследования, решения вопроса о дальнейшем лечении и никогда не стоит пренебрегать возможностью обратиться за еще одним мнением специалистов.
После восстановительного периода следует обратиться к онкологу или колопроктологу для дообследования, решения вопроса о дальнейшем лечении и никогда не стоит пренебрегать возможностью обратиться за еще одним мнением специалистов.
После того, как завершено обследование, установлена стадия, принято решение о хирургическом вмешательстве, наступает основной этап лечения – операция. Это волнительное и даже пугающее событие, и каждый человек переживает перед операцией, но понимание самого процесса лечения и, главное, его необходимости обычно способствует улучшению эмоционального фона. Подготовка к операции может начинаться задолго до госпитализации, если необходима компенсация проявлений сопутствующих заболеваний. На данном этапе подготовку контролируют анестезиологи и терапевты. Не стоит скрывать наличие хронических заболеваний и бояться, что это может стать причиной отказа в операции. Плановые операции, даже по поводу онкологических заболеваний, в большинстве случаев можно перенести на некоторое время, необходимое для лечения сопутствующих заболеваний, обострение которых может привести к осложнениям во время или после операции. После операции по поводу рака ободочной кишки требуется ношение компрессионных чулок и бандажа на переднюю брюшную стенку, об их наличии лучше позаботиться до операции. После госпитализации, уже в стационаре, осуществляются последние этапы подготовки – очистка кишки и бритье области операции.
После операции по поводу рака ободочной кишки требуется ношение компрессионных чулок и бандажа на переднюю брюшную стенку, об их наличии лучше позаботиться до операции. После госпитализации, уже в стационаре, осуществляются последние этапы подготовки – очистка кишки и бритье области операции.
В день операции следует быть натощак, а утром – не забыть надеть компрессионные чулки. В операционную пациентов привозит на каталке персонал отделения, там пациента встречает анестезиолог и сестра-анестезистка, которые начинают выполнять свои манипуляции — установку венозного катетера, эпидурального катетера, интубацию трахеи (установка трубки в дыхательные пути), установку мочевого катетера и желудочного зонда, пункцию подключичной вены. Подробно о предстоящих процедурах расскажет анестезиолог накануне операции. Большая часть этих процедур выполняется под наркозом, в сознании пациент находится только при установке венозного катетера (процедура не более болезненная, чем обычное взятие крови из вены) и установке эпидурального катетера (чувствуется укол в кожу спины – местная анестезия перед пункцией).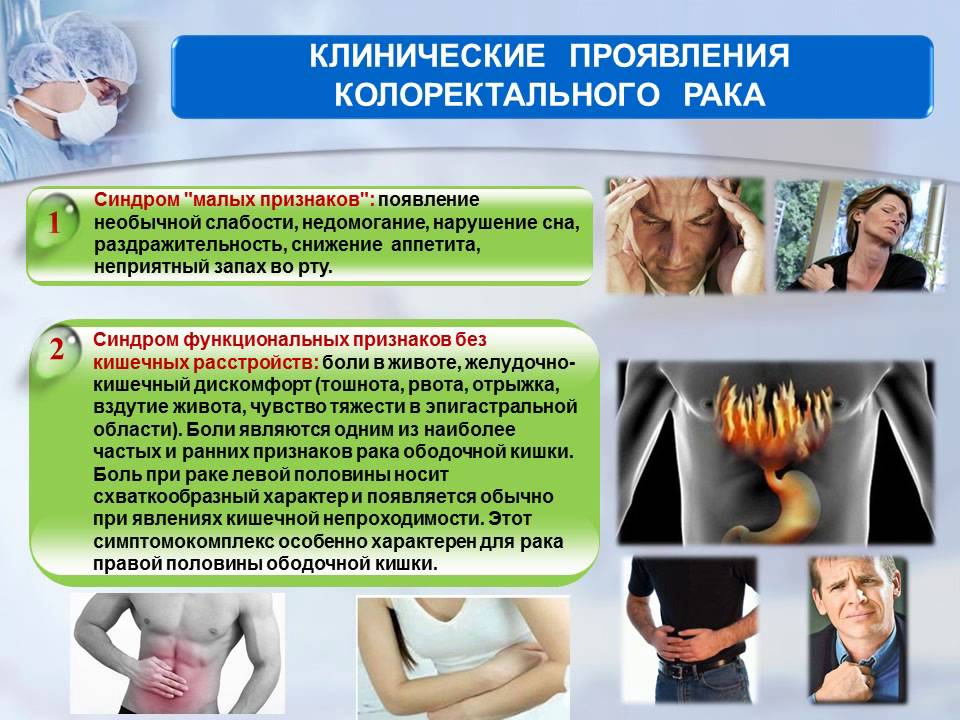 Кроме того, подключаются датчики содержания кислорода в крови (пластиковая прищепка на палец руки), артериального давления (манжетка на плечо) и датчики для снятия электрокардиограммы. Хирургическая операция начинается после завершения манипуляций анестезиологов, которые, в свою очередь, во время всей операции будут наблюдать за состоянием пациента и течением анестезии. После окончания операции пациента будят в операционной или транспортируют в реанимационное отделение и будят уже там. Обычно первые сутки все пациенты после операций по поводу рака ободочной кишки наблюдаются в реанимационном отделении, при этом осуществляется контроль за жизненными функциями (мочевой катетер, прищепка на пальце, манжетка и датчики для снятия ЭКГ остаются с пациентом на весь период нахождения в отделении реанимации), а также проводится интенсивная терапия. При гладком течении послеоперационного периода осуществляется перевод в палату отделения.
Кроме того, подключаются датчики содержания кислорода в крови (пластиковая прищепка на палец руки), артериального давления (манжетка на плечо) и датчики для снятия электрокардиограммы. Хирургическая операция начинается после завершения манипуляций анестезиологов, которые, в свою очередь, во время всей операции будут наблюдать за состоянием пациента и течением анестезии. После окончания операции пациента будят в операционной или транспортируют в реанимационное отделение и будят уже там. Обычно первые сутки все пациенты после операций по поводу рака ободочной кишки наблюдаются в реанимационном отделении, при этом осуществляется контроль за жизненными функциями (мочевой катетер, прищепка на пальце, манжетка и датчики для снятия ЭКГ остаются с пациентом на весь период нахождения в отделении реанимации), а также проводится интенсивная терапия. При гладком течении послеоперационного периода осуществляется перевод в палату отделения.
Самое главное правило послеоперационного периода – ранняя активизация.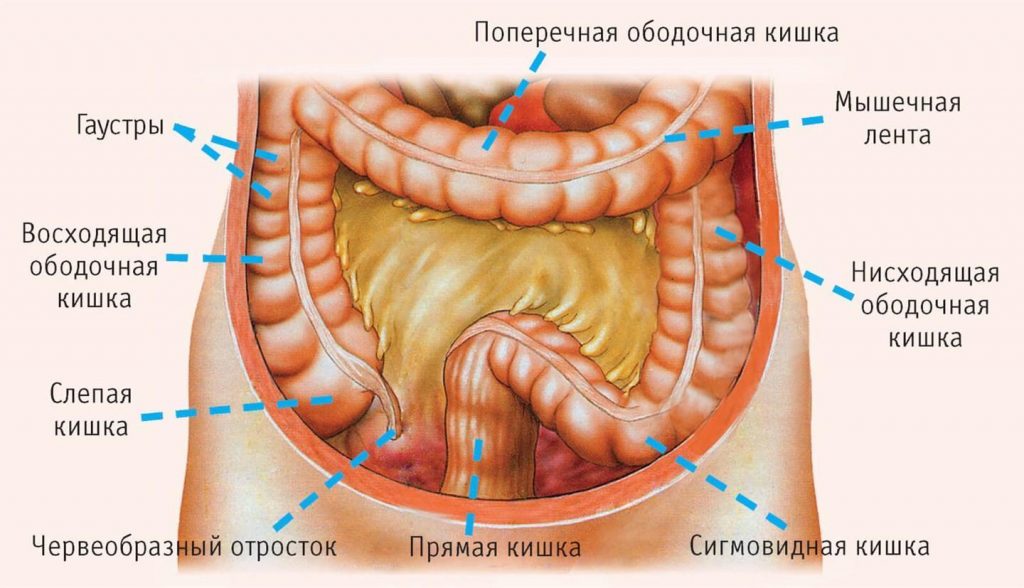 После перевода в палату нужно обязательно садиться в постели, делать дыхательную гимнастику, вставать, ходить по палате и по отделению – как можно больше двигаться. Это способствует восстановлению перистальтики кишечника, а также является профилактикой осложнений со стороны дыхательной системы и тромбоэмболических осложнений. Особенности питания после операции достаточно индивидуальны, диету в послеоперационном периоде назначает и контролирует лечащий врач. Обычно первое время следует употреблять в пищу все жидкое и перетертое, затем можно расширять рацион. В послеоперационном периоде остается подключичный и эпидуральный катетер, установленный до операции, через него будут вводиться лекарственные вещества. Мочевой катетер убирается при переводе в отделение, если нет показаний для его более длительного применения. Обычно после операции устанавливается дренаж – полая трубка – через отверстие в правом или левом боку, который убирается через несколько дней после операции при отсутствии показаний к его более длительному стоянию.
После перевода в палату нужно обязательно садиться в постели, делать дыхательную гимнастику, вставать, ходить по палате и по отделению – как можно больше двигаться. Это способствует восстановлению перистальтики кишечника, а также является профилактикой осложнений со стороны дыхательной системы и тромбоэмболических осложнений. Особенности питания после операции достаточно индивидуальны, диету в послеоперационном периоде назначает и контролирует лечащий врач. Обычно первое время следует употреблять в пищу все жидкое и перетертое, затем можно расширять рацион. В послеоперационном периоде остается подключичный и эпидуральный катетер, установленный до операции, через него будут вводиться лекарственные вещества. Мочевой катетер убирается при переводе в отделение, если нет показаний для его более длительного применения. Обычно после операции устанавливается дренаж – полая трубка – через отверстие в правом или левом боку, который убирается через несколько дней после операции при отсутствии показаний к его более длительному стоянию.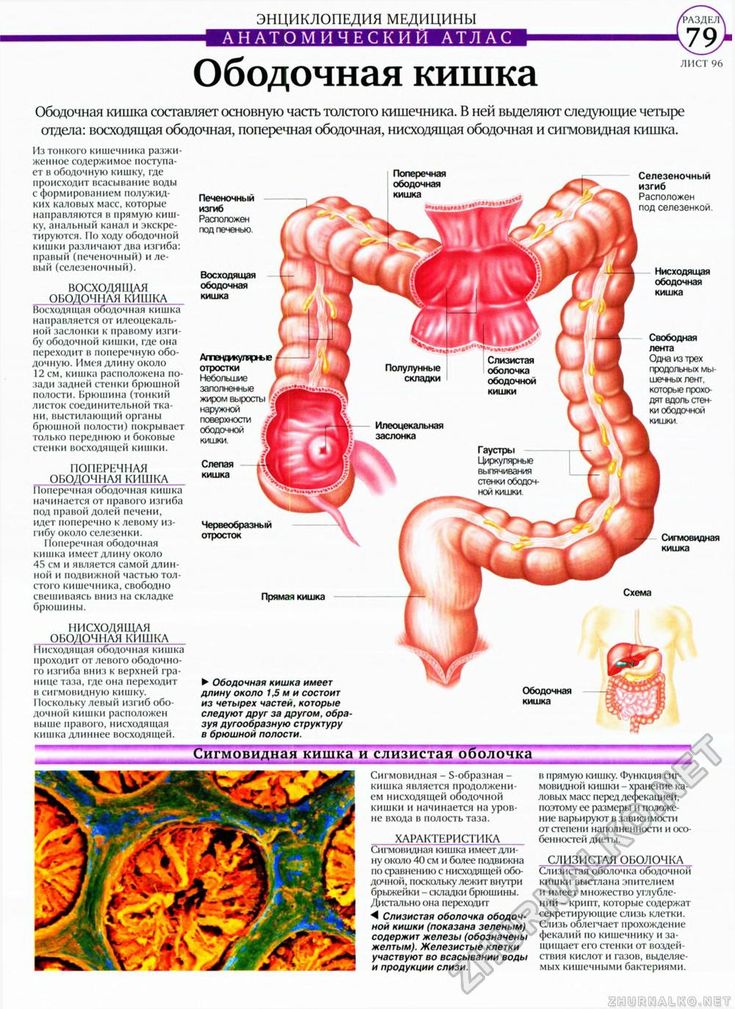 В отделении выполняются перевязки, проводится лекарственная терапия. Постепенно все катетеры и дренажи убираются и пациент готовится к выписке. Сроки госпитализации индивидуальны, определяются особенностями операции и течением послеоперационного периода.
В отделении выполняются перевязки, проводится лекарственная терапия. Постепенно все катетеры и дренажи убираются и пациент готовится к выписке. Сроки госпитализации индивидуальны, определяются особенностями операции и течением послеоперационного периода.
После выписки из стационара и получения результатов гистологического исследования определяется дальнейшая тактика лечения. Несмотря на то, что пациенты возвращаются к привычному ритму жизни или сразу после операции, или после проведения послеоперационной химиотерапии, забывать об этом заболевании не следует. Всем пациентам, оперированным по поводу рака ободочной кишки, необходимо проходить контрольные обследования по программе мониторинга, которые необходимо учитывать при планировании своего расписания и проходить регулярно.
Разработанная в нашей клинике программа предусматривает прохождение обследований каждые три месяца и направлена на раннее выявление возможной прогрессии или рецидива рака ободочной кишки. Мы стремимся поддерживать контакт со всеми нашими пациентами после операции, поэтому не стоит удивляться, если ваш лечащий врач или сотрудник отдела послеоперационного мониторинга будет звонить или писать вам письма на электронную почту и интересоваться результатами обследований после операции. Своевременное прохождение послеоперационного мониторинга под контролем вашего лечащего врача – залог успешного лечения.
Мы стремимся поддерживать контакт со всеми нашими пациентами после операции, поэтому не стоит удивляться, если ваш лечащий врач или сотрудник отдела послеоперационного мониторинга будет звонить или писать вам письма на электронную почту и интересоваться результатами обследований после операции. Своевременное прохождение послеоперационного мониторинга под контролем вашего лечащего врача – залог успешного лечения.
Главная
Клиника и отделения
Абдоминальное хирургическое отделение
Рак толстой кишки, или колоректальный, (рак ободочной и прямой кишки ссылка) занимает 4-е место в мире в структуре онкологической заболеваемости. В экономически развитых странах занимает 2-е место. На сегодняшний день статистические данные свидетельствуют о том, что в России рак толстой кишки занимает одну из ведущих позиций и уступает лишь раку легкого, желудка и молочной железы. Каждый год в России раком ободочной кишки заболевает более 15 000 человек.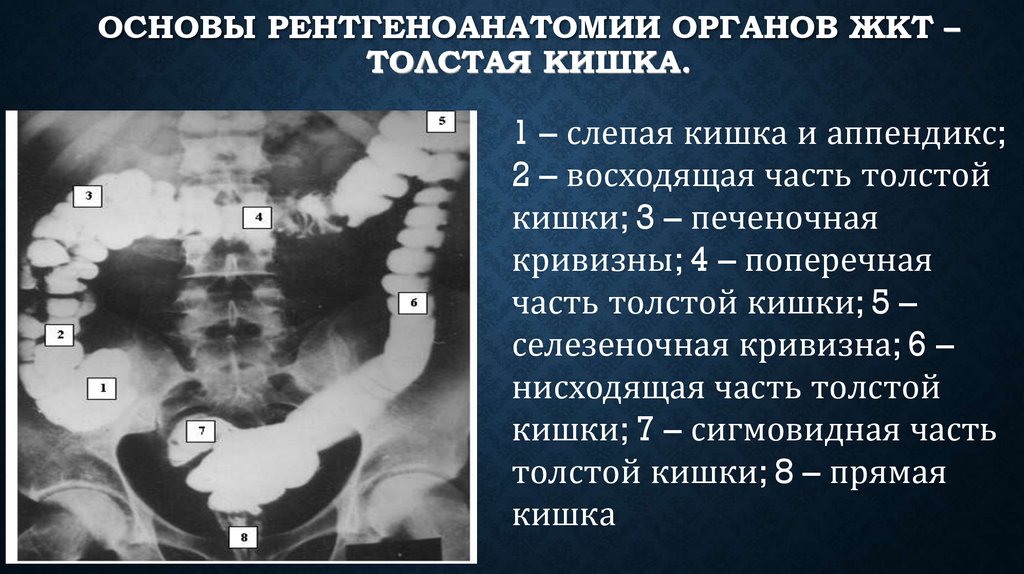
Скудные симптомы (диспепсические расстройства, метеоризм…) на ранних стадиях заболевания пациенты обычно не связывают с опухолевым заболеванием, что приводит к позднему обращению за квалифицированной медицинской помощью. Более чем у 40 % больных опухоль выводит за пределы кишки и поражает лимфатическую систему, что требует выполнения комбинированных и расширенных оперативных вмешательств и проведения длительного комбинированного лечения . Не менее 15 % пациентов обращается за помощью с 4 стадией заболевания, т.е. с наличием отсевов в брюшной полости или отдаленных метастазов (наиболее часто в печени). Во многих онкологических клиниках при такой распространенности опухолевого процесса больным просто отказывают в лечении. Однако, и в этих случаях прогноз небезнадежный, – требуется индивидуальный подход и проведение еще более сложного многоэтапного лечения.
Основным методом лечения рака ободочной кишки является хирургический. В отделении абдоминальной онкологии МНИОИ им.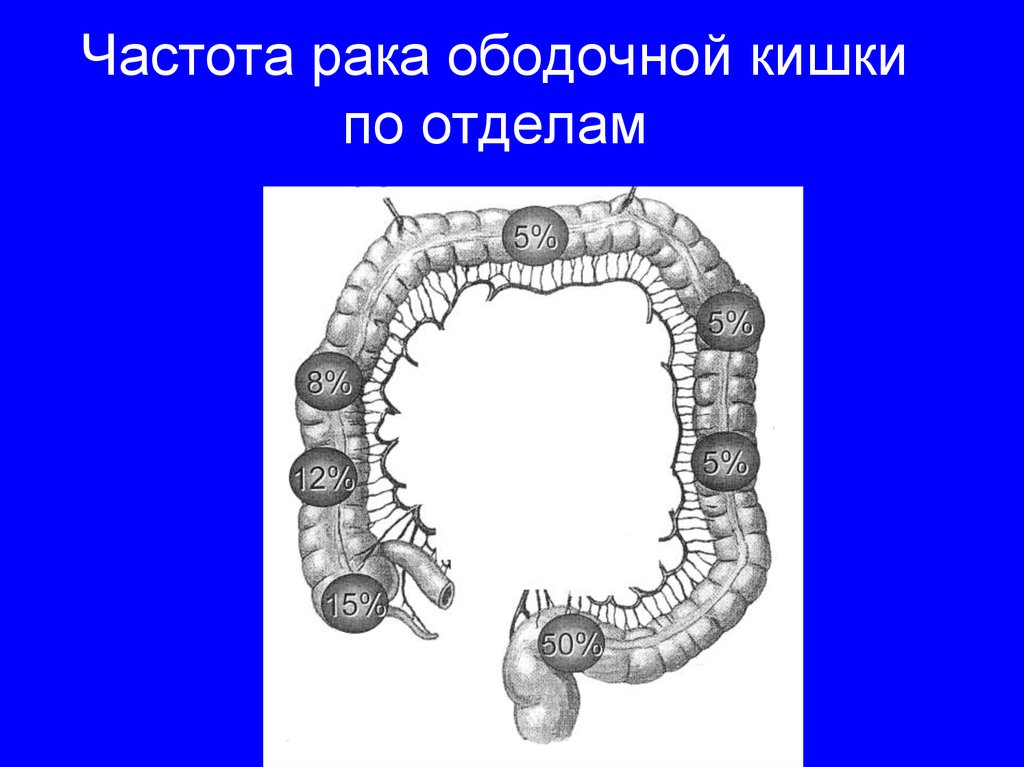 П.А. Герцена выполняется полный спектр оперативных вмешательств при всех локализациях опухолей в ободочной кишке.
П.А. Герцена выполняется полный спектр оперативных вмешательств при всех локализациях опухолей в ободочной кишке.
Правосторонняя гемиколэктомия. Операцию выполняют при локализации опухоли в слепой кишке, червеобразном отростке, восходящем отделе ободочной кишки. При этом, удаляются все правые отделы ободочной кишки единым блоком с окружающей клетчаткой и лимфатическими узлами, правой половиной большого сальника.
Резекция поперечной ободочной кишки. Операцию выполняют при локализации опухоли в средних отделах поперечной ободочной кишки. Всю поперечную ободочную кишку удаляют вместе с ее брыжейкой, в которой расположены кровеносные сосуды и лимфатические коллекторы, полностью удаляют большой сальник.
Левосторонняя гемиколэктомия. Операцию выполняют при локализации опухоли в нисходящей ободочной кишке, начальных отделах сигмовидной кишки. Удаляется левая половина ободочной кишки вместе с сигмовидной кишкой, единым блоком с лимфатическими узлами и левой половиной большого сальника.
Резекция сигмовидной кишки. Выполняют операцию при наличии опухоли в средней трети сигмовидной кишки.
Удаляется вся сигмовидная кишка в едином блоке с окружающей клетчаткой, лимфатическими узлами.
Данные операции могут быть выполнены как «открытым» способом – выполняется разрез передней брюшной стенки, так и при помощи лапароскопической методики. Такой метод применим при локализованных (ограниченных) опухолях I-II ст. Через отдельные «проколы» в брюшной стенки вводят эндоскопические инструменты и видеокамеру. Операция проводится под большим оптическим увеличением, что позволяет прецизионно удалить опухоль вместе с лимфатическими узлами, полностью соблюдая онкологические принципы радикализма хирургического вмешательства. Минимальная хирургическая травма обеспечивает быстрое полное восстановление после операции.
Наибольшие трудности представляет лечение местнораспространенных опухолей ободочной кишки, когда имеется прорастание в соседние органы. Наиболее часто речь идет о поражении мочевыделительной системы (почки, мочеточники, мочевой пузырь), реже матка, яичники, печень, желудок, тонкая кишка.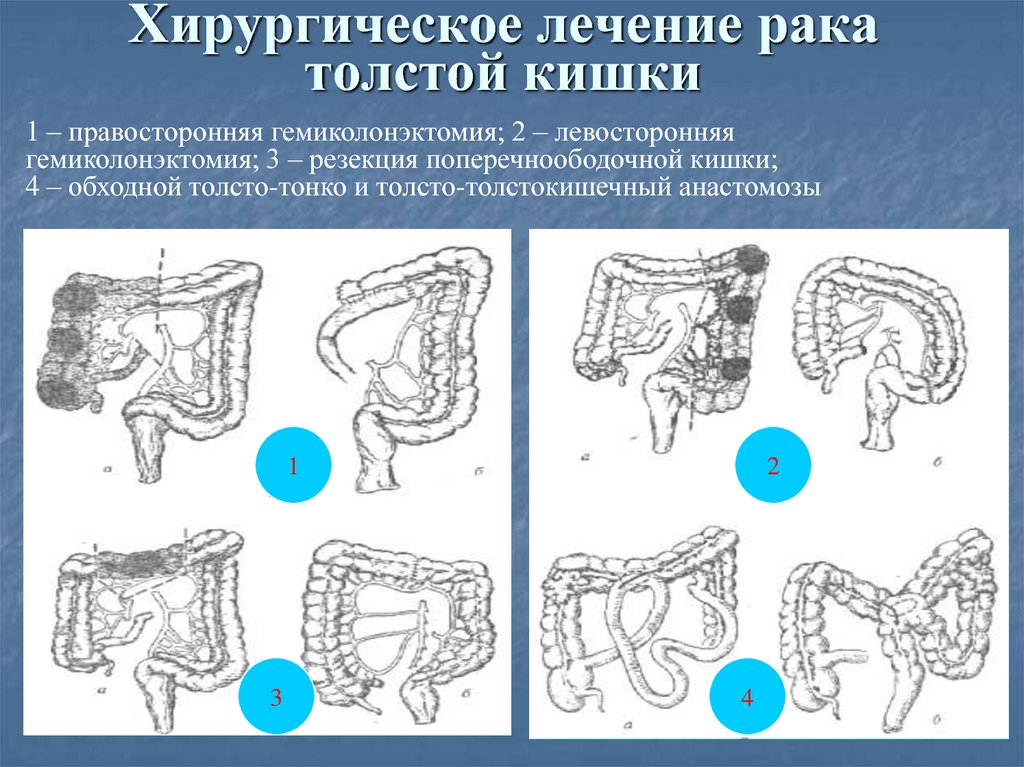 Хирургическое лечение таких пациентов подразумевает выполнение так называемых расширенных и комбинированных резекций.При лечении этой тяжелой группы необходимо участие хирургов-онкологов различных специальностей – абдоминальных онкологов, онкоурологов, онкогинекологов. Отделение абдоминальной онкологии МНИОИ им. П.А. Герцена активно сотрудничает с другими хирургическими подразделениями института – Онкоурология, Онкогинекология.
Хирургическое лечение таких пациентов подразумевает выполнение так называемых расширенных и комбинированных резекций.При лечении этой тяжелой группы необходимо участие хирургов-онкологов различных специальностей – абдоминальных онкологов, онкоурологов, онкогинекологов. Отделение абдоминальной онкологии МНИОИ им. П.А. Герцена активно сотрудничает с другими хирургическими подразделениями института – Онкоурология, Онкогинекология.
Еще более сложной проблемой является лечение больных с наличием так называемой перитонеальной диссеминации (канцероматоз брюшины). Таким больным хирурги-онкологи в большинстве медицинских учреждениях (в том числе и специализированных) либо сразу отказывают в лечении, или столкнувшись с этой проблемой во время операции, завершают ее пробным разрезом и осмотром брюшной полости. В клинике в последние годы в этих случаях прибегают к выполнению расширенных циторедуктивных вмешательств, подразумевающих удаление первичной опухоли и максимально возможное удаление отсевов по брюшине. Оперативные вмешательства дополняют по показаниям фотодинамической терапией или интраоперационной внутрибрюшной гипертермической химиотерапией, что дает надежду на улучшение отдаленных результатов лечения.
Оперативные вмешательства дополняют по показаниям фотодинамической терапией или интраоперационной внутрибрюшной гипертермической химиотерапией, что дает надежду на улучшение отдаленных результатов лечения.
К сожалению, только хирургическое лечение не может обеспечить полное выздоровление при запущенных стадиях заболевания. Причинами этого является поздняя обращаемость пациентов за квалифицированной медицинской помощью, несвоевременное, и проведенное не полном объеме, обследование. В таких случаях приходится прибегать к комбинации хирургического и лекарственного лечения. Показаниями для проведения комбинированного лечения является III стадия опухолевого процесса, наличие метастазов в удаленных лимфатических узлах, низко- и недифференцированные опухоли. Выбор схемы лечения определяется в зависимости от степени распространенности опухолевого процесса, результатов морфологического исследования, наличия факторов прогноза (опухолевые непроходимость, перфорация, абсцедирование), возраста больного, общего состояния и сопутствующей патологии.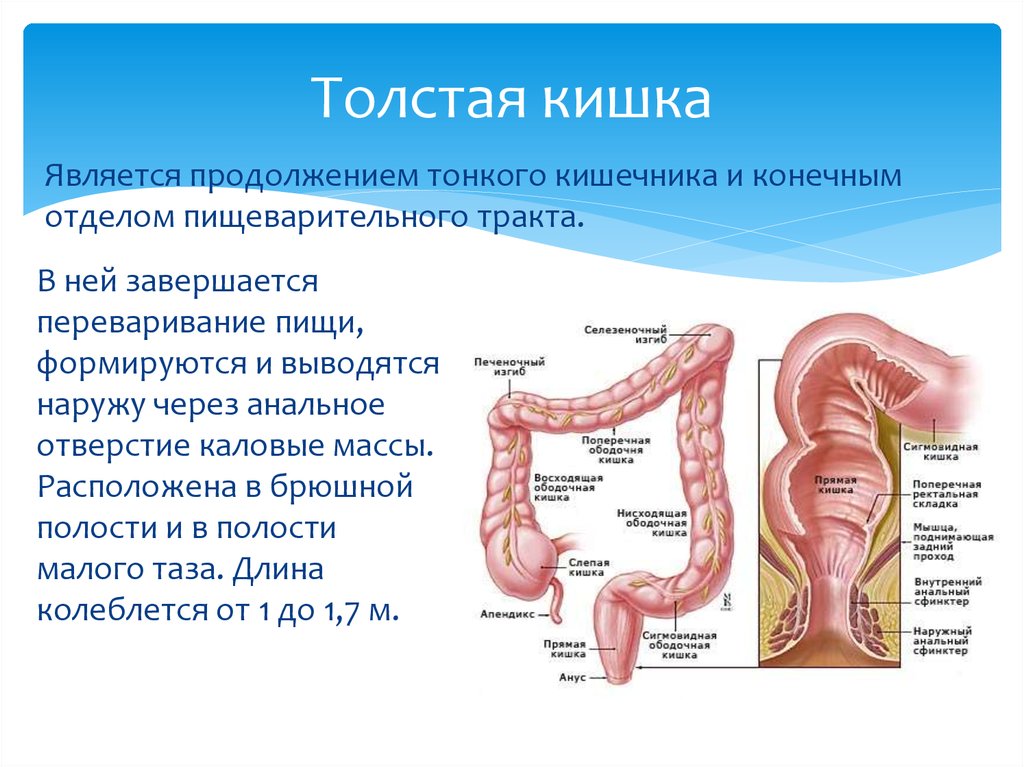 Современные схемы химиотерапии позволяют значительно улучшить результаты хирургического лечения, а в ряде случаев достигнуть полного выздоровления.
Современные схемы химиотерапии позволяют значительно улучшить результаты хирургического лечения, а в ряде случаев достигнуть полного выздоровления.
Реконструктивные операции.
При выполнении любого варианта операции на ободочной кишке, при отсутствии полноценного кровоснабжения толстой кишки, особенно при срочных операциях на неподготовленной кишке, при наличии кишечной непроходимости хирургам приходится формировать временную колостому. В абдоминальном отделении МНИОИ им. П.А.Герцена возможно выполнение практически всех восстановительных операций (закрытие колостомы, восстановление непрерывности кишечного тракта после операции Гартмана и т.п.). Данные операции позволяют достичь полной социальной реабилитации и возвращают пациентов к нормальной жизни.
COVID
19
COVID
19
+7(800)444-31-02
Энтони Даквар, новый хирург толстой кишки и прямой кишки из Розуэлл Парк, доктор медицинских наук, объясняет различия между раком толстой кишки, возникающим в правой части толстой кишки, по сравнению с раком левой стороны.
Да, это так. Некоторые различия можно увидеть в раке толстой кишки, который начинается с левой стороны, в нисходящей и сигмовидной частях толстой кишки, по сравнению с теми, которые возникают на правой стороне, в 0005 восходящие и слепая кишка части толстой кишки, объясняет новый хирург толстой и прямой кишки Энтони Даквар, доктор медицинских наук, Энтони Даквар, новый хирург толстой и прямой кишки Центра комплексного лечения рака Розуэлл-Парк. (Рак также может развиваться в среднем, поперечном отделе толстой кишки, хотя и реже.)
Место в толстой кишке, где развивается рак, является одним из факторов, которые учитываются при разработке индивидуального плана лечения. Различия между левосторонним и правосторонним раком толстой кишки заключаются в том, почему и как развился рак, вызывает ли он заметные симптомы, а также агрессивность рака и то, насколько хорошо он реагирует на обычные схемы химиотерапии. «Хотя полипы могут возникать в любом месте толстой кишки, их частота и предрасположенность к превращению в рак могут различаться в зависимости от того, где в толстой кишке они возникают», — говорит д-р Даквар 9.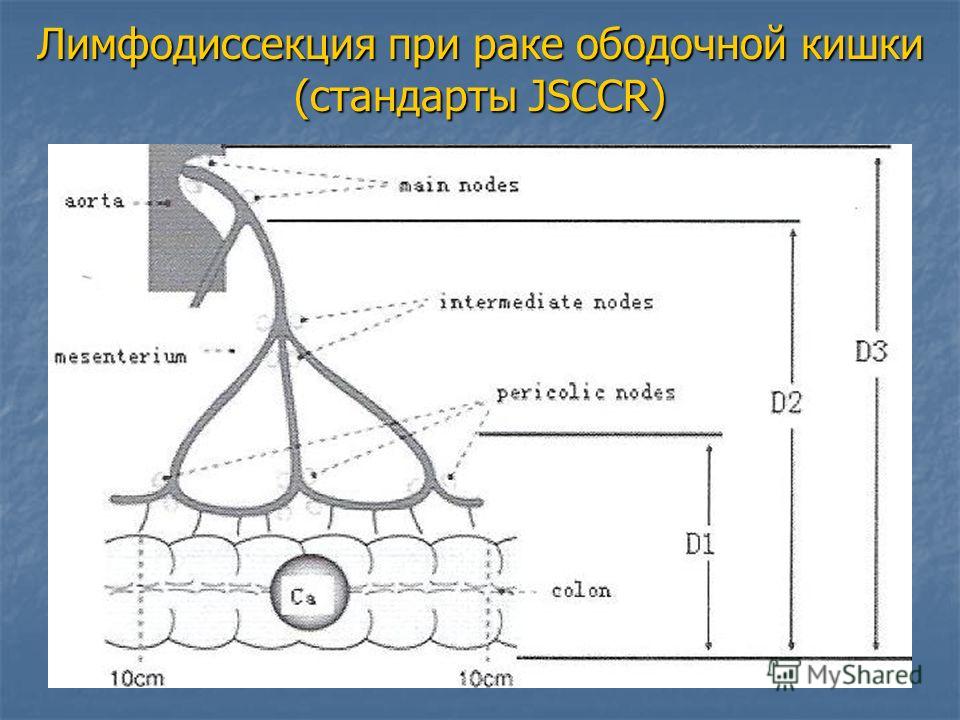 0003
0003
Рак, который развивается на левой стороне толстой кишки, скорее всего, будет ничем не примечательным колоректальным раком. Они, как правило, развиваются традиционным путем, объясняет доктор Даквар. «Простые полипы толстой кишки, аномальные разрастания ткани, испытывают спорадические хромосомные изменения в своих клетках, которые со временем могут превратиться в раковую опухоль. Этот процесс медленный и может занять несколько лет, поэтому скрининг с помощью колоноскопии можно проводить с интервалом в несколько лет».
Полипы, развивающиеся в правой части толстой кишки, чаще возникают у людей с генетической предрасположенностью к развитию рака, например, синдромом Линча и микросателлитной нестабильностью. Правосторонние полипы с большей вероятностью перерастут в рак, который часто быстро растет и имеет более высокий риск метастазирования, распространяясь на отдаленные участки тела.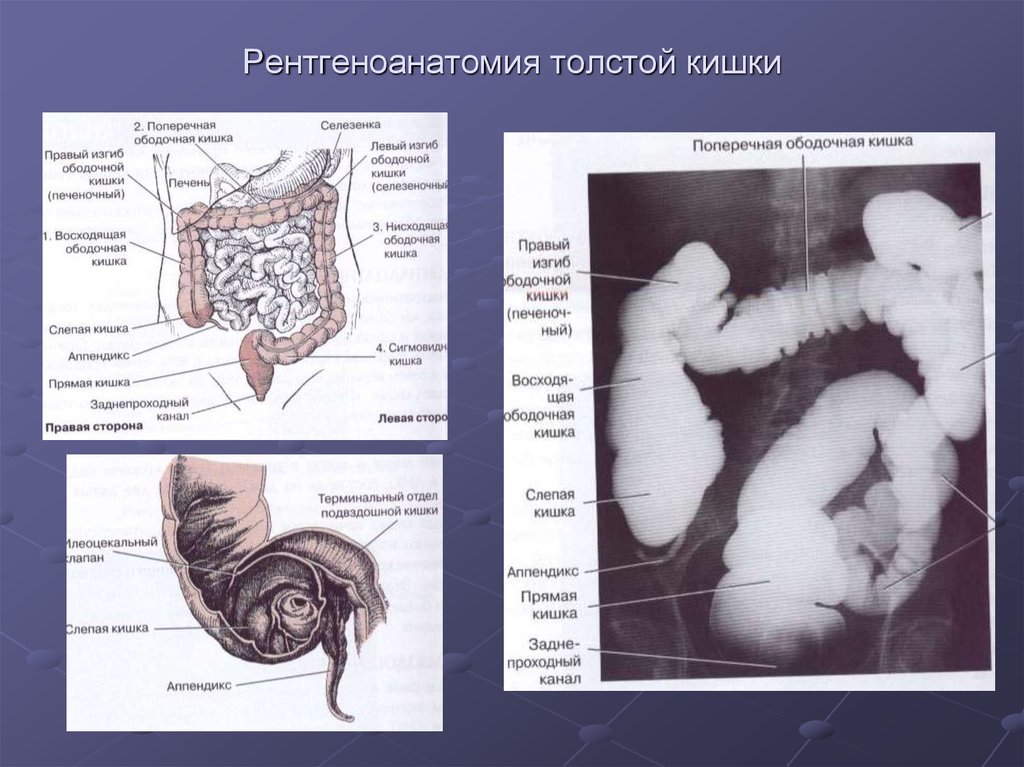
Рак правой половины толстой кишки также имеет тенденцию развиваться из плоских полипов, а не из обычных полипов грибовидной формы, и также является генетически атипичным. «Различия в генетическом составе этих опухолей часто означают, что эти виды рака более агрессивны и могут быть устойчивыми к текущим схемам химиотерапии», — говорит он.
Местоположение вашего рака — это лишь один из аспектов, который рассматривается при разработке вашего плана лечения. «Как для левостороннего, так и для правостороннего рака толстой кишки, если он не является метастатическим, типичным лечением первой линии является предварительное хирургическое вмешательство», — говорит доктор Даквар. «Однако ключом к успешному лечению является междисциплинарный подход к получению персонализированной и индивидуальной помощи при раке». В Roswell Park в вашу команду по уходу будут входить врачи различных медицинских специальностей — хирурги, терапевты и онкологи-радиологи, а также гастроэнтерологи и патологоанатомы, — каждый из которых поделится своим опытом.
«Наша команда обеспечивает систематическое обследование каждого пациента и составление индивидуального плана лечения. Мы можем привлечь пациентов к передовым клиническим испытаниям, чтобы улучшить их план лечения и предоставить возможность избавиться от рака».
Скрининг-тесты выявляют признаки рака до того, как он прогрессирует до такой степени, что могут появиться симптомы. Абдоминальные симптомы, такие как боль, вздутие живота или ректальное кровотечение, часто являются признаками аномального процесса в левой части толстой кишки. «Правосторонний рак толстой кишки, как правило, протекает бессимптомно или вызывает эти симптомы только тогда, когда он находится на поздней стадии и достаточно велик. Правосторонний рак с большей вероятностью будет диагностирован на более поздних стадиях, и уже одно это ухудшает прогноз», — говорит доктор Даквар.
Хорошей новостью является то, что скрининг с помощью колоноскопии может выявить полипы и рак на ранних стадиях в любом месте толстой кишки.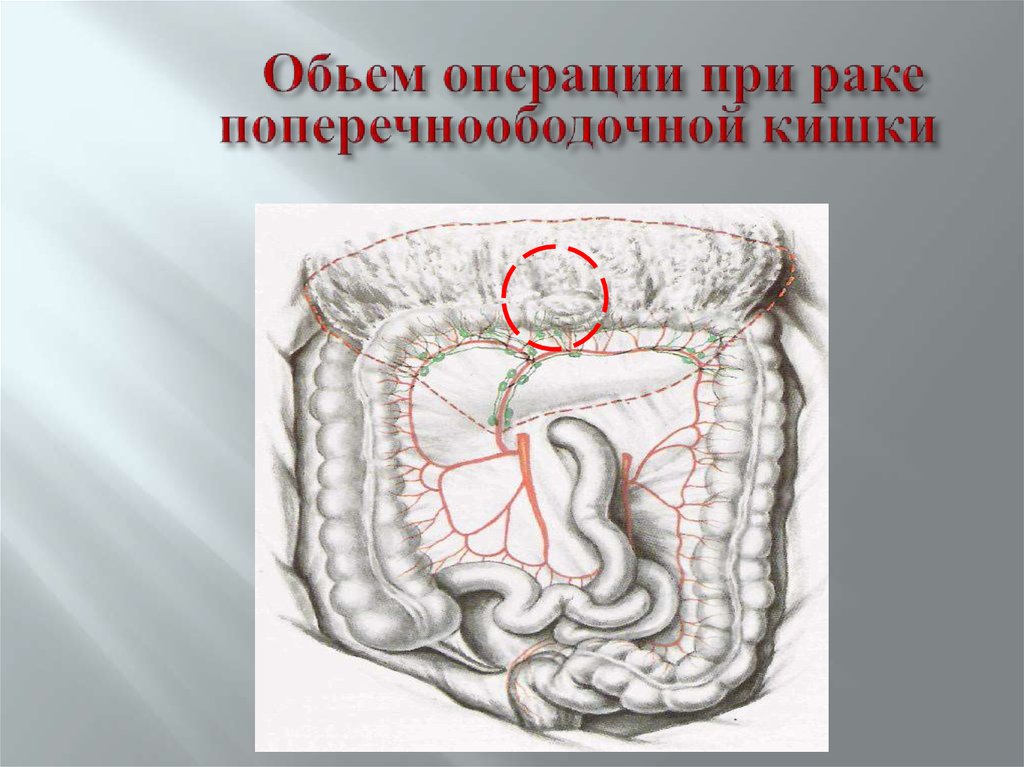 Своевременное проведение колоноскопии в соответствии с рекомендуемыми рекомендациями может помочь обнаружить и вылечить предраковые полипы и предотвратить формирование рака. «Нет другого скринингового теста, который мог бы заменить колоноскопию, — говорит доктор Даквар.
Своевременное проведение колоноскопии в соответствии с рекомендуемыми рекомендациями может помочь обнаружить и вылечить предраковые полипы и предотвратить формирование рака. «Нет другого скринингового теста, который мог бы заменить колоноскопию, — говорит доктор Даквар.
Что значит «вовремя» для колоноскопии? Большинству людей со средним риском следует начинать регулярный скрининг толстой и прямой кишки в возрасте 45 лет. Но несколько факторов означают, что вы должны начать раньше, например, афроамериканец или семейный анамнез рака желудочно-кишечного тракта. Поговорите со своим поставщиком медицинских услуг, чтобы узнать, когда вам нужно запланировать обследование.
Скрининг рака толстой кишки
Вы подвержены риску рака толстой кишки? Пройдите обследование сегодня.
Подробнее
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM. и другие. Заболеваемость раком и смертность во всем мире: источники, методы и основные закономерности в GLOBOCAN 2012. Int J Cancer. 2015; 136(5):E359–386. doi: 10.1002/ijc.29210. [PubMed] [CrossRef] [Академия Google]
и другие. Заболеваемость раком и смертность во всем мире: источники, методы и основные закономерности в GLOBOCAN 2012. Int J Cancer. 2015; 136(5):E359–386. doi: 10.1002/ijc.29210. [PubMed] [CrossRef] [Академия Google]
2. Thelin C, Sikka S. In: Скрининг колоректального рака с помощью колоноскопии. Эттарх Р., редактор. Интех Открытый; 2015. Эпидемиология колоректального рака - заболеваемость, статистика факторов риска в течение жизни и временные тенденции; стр. 1–18. [CrossRef] [Google Scholar]
3. Brenner H, Kloor M, Pox CP. Колоректальный рак. Ланцет. 2014;383(9927):1490–1502. doi: 10.1016/S0140-6736(13)61649-9. [PubMed] [CrossRef] [Google Scholar]
4. Глебов О.К., Родригес Л.М., Накахара К., Дженкинс Дж., Клиатт Дж., Хамберд С.Дж., ДеНобиле Дж. и соавт. Различение правого и левого отделов толстой кишки по характеру экспрессии генов. Эпидемиологические биомаркеры рака Prev. 2003;12(8):755–762. [PubMed] [Академия Google]
5. Якопетта Б. Есть ли две стороны колоректального рака? Инт Джей Рак.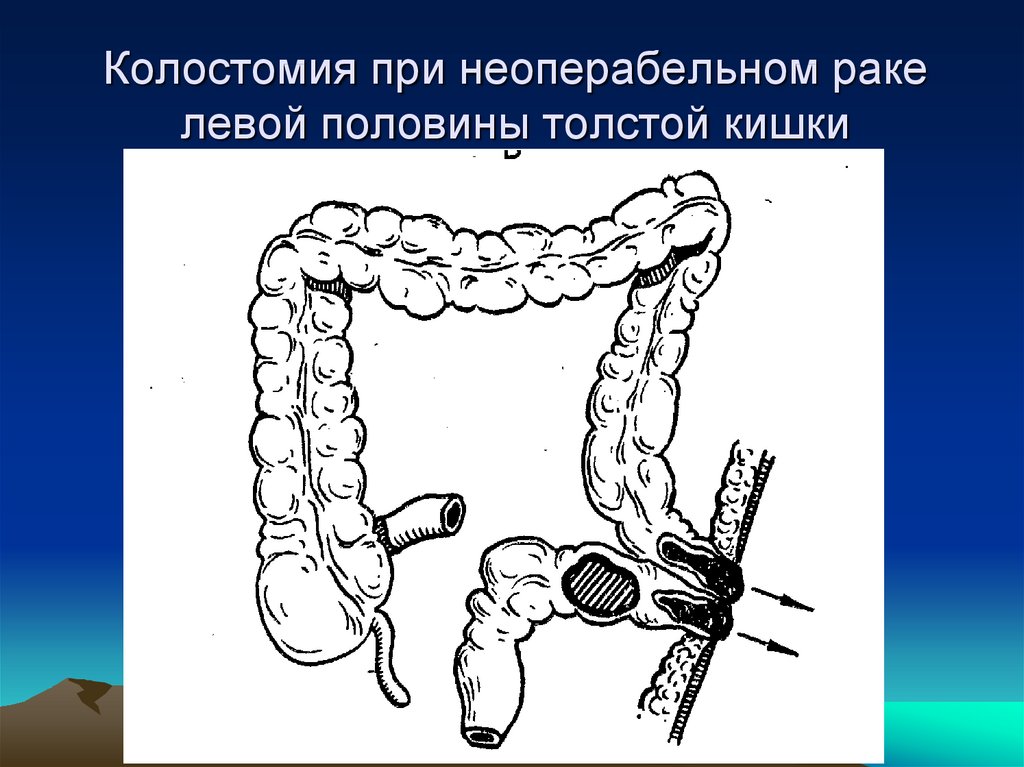 2002;101(5):403–408. doi: 10.1002/ijc.10635. [PubMed] [CrossRef] [Google Scholar]
2002;101(5):403–408. doi: 10.1002/ijc.10635. [PubMed] [CrossRef] [Google Scholar]
6. Марзук О., Шофилд Дж. Обзор гистопатологических и молекулярных прогностических признаков колоректального рака. Раки (Базель) 2011;3(2):2767–2810. doi: 10.3390/cancers3022767. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Gualco G, Reissenweber N, Cliche I, Bacchi CE. Плоские приподнятые поражения толстой и прямой кишки: спектр неопластических и неопухолевых образований. Энн Диагн Патол. 2006;10(6):333–338. doi: 10.1016/j.anndiagpath.2006.03.003. [PubMed] [CrossRef] [Академия Google]
8. Nawa T, Kato J, Kawamoto H, Okada H, Yamamoto H, Kohno H, Endo H. et al. Различия между правосторонним и левосторонним раком толстой кишки в характеристиках пациентов, морфологии рака и гистологии. J Гастроэнтерол Гепатол. 2008;23(3):418–423. doi: 10.1111/j.1440-1746.2007.04923.x. [PubMed] [CrossRef] [Google Scholar]
9. Carethers JM. Один просвет толстой кишки, но два органа. Гастроэнтерология. 2011;141(2):411–412. doi: 10.1053/j.gastro.2011.06.029. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Гастроэнтерология. 2011;141(2):411–412. doi: 10.1053/j.gastro.2011.06.029. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Bordacahar B, Barret M, Terris B, Dhooge M, Dreanic J, Prat F, Coriat R. et al. Квадратно-зубчатая аденома: от выявления до резекции. Копать печень Dis. 2015;47(2):95–102. doi: 10.1016/j.dld.2014.09.006. [PubMed] [CrossRef] [Google Scholar]
11. Hugen N, Brown G, Glynne-Jones R, de Wilt JH, Nagtegaal ID. Достижения в лечении больных муцинозным колоректальным раком. Nat Rev Clin Oncol. 2016;13(6):361–369. doi: 10.1038/nrclinonc.2015.140. [PubMed] [CrossRef] [Академия Google]
12. Galon J, Costes A, Sanchez-Cabo F, Kirilovsky A, Mlecnik B, Lagorce-Pages C, Tosolini M. et al. Тип, плотность и расположение иммунных клеток в колоректальных опухолях человека предсказывают клинический исход. Наука. 2006;313(5795):1960–1964. doi: 10.1126/science.1129139. [PubMed] [CrossRef] [Google Scholar]
13. Ogino S, Nosho K, Irahara N, Meyerhardt JA, Baba Y, Shima K, Glickman JN. и другие. Лимфоцитарная реакция на колоректальный рак связана с более длительной выживаемостью, независимо от количества лимфатических узлов, микросателлитной нестабильности и фенотипа метилатора CpG-островков. Клин Рак Рез. 2009 г.;15(20):6412–6420. doi: 10.1158/1078-0432.CCR-09-1438. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
и другие. Лимфоцитарная реакция на колоректальный рак связана с более длительной выживаемостью, независимо от количества лимфатических узлов, микросателлитной нестабильности и фенотипа метилатора CpG-островков. Клин Рак Рез. 2009 г.;15(20):6412–6420. doi: 10.1158/1078-0432.CCR-09-1438. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Vatandoust S, Price TJ, Karapetis CS. Колоректальный рак: метастазы в один орган. Мир J Гастроэнтерол. 2015;21(41):11767–11776. doi: 10.3748/wjg.v21.i41.11767. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Benedix F, Kube R, Meyer F, Schmidt U, Gastinger I, Lippert H, Colon/Rectum Carcinomas Study G. Сравнение 17 641 пациента с правой - и левосторонний рак толстой кишки: различия в эпидемиологии, периоперационном течении, гистологии и выживаемости. Расстройство прямой кишки. 2010;53(1):57–64. doi: 10.1007/DCR.0b013e3181c703a4. [PubMed] [CrossRef] [Академия Google]
16. Хаггар Ф.А., Боуши Р.П. Эпидемиология колоректального рака: заболеваемость, смертность, выживаемость и факторы риска. Clin Colon Rectal Surg. 2009;22(4):191–197. doi: 10.1055/s-0029-1242458. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Clin Colon Rectal Surg. 2009;22(4):191–197. doi: 10.1055/s-0029-1242458. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Мегуид Р.А., Слайделл М.Б., Вольфганг С.Л., Чанг Д.К., Ахуджа Н. Есть ли разница в выживаемости при правостороннем и левостороннем раке толстой кишки? Энн Сург Онкол. 2008;15(9):2388–2394. doi: 10.1245/s10434-008-0015-y. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Moritani K, Hasegawa H, Okabayashi K, Ishii Y, Endo T, Kitagawa Y. Разница в частоте рецидивов между правосторонним и левосторонним раком толстой кишки: 17-летний опыт работы в одном учреждении. Серж сегодня. 2014;44(9):1685–1691. doi: 10.1007/s00595-013-0748-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Ribic CM, Sargent DJ, Moore MJ, Thibodeau SN, French AJ, Goldberg RM, Hamilton SR. и другие. Статус микросателлитной нестабильности опухоли как предиктор пользы адъювантной химиотерапии на основе фторурацила при раке толстой кишки. N Engl J Med. 2003;349(3): 247–257. doi: 10.1056/NEJMoa022289. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
N Engl J Med. 2003;349(3): 247–257. doi: 10.1056/NEJMoa022289. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Пассарди А., Канале М., Валджусти М., Уливи П. Иммунные контрольные точки как мишень для лечения колоректального рака. Int J Mol Sci. 2017;18(6):1324. doi: 10.3390/ijms18061324. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Герваз П., Бухер П., Морел П. Две кишки — два рака: сдвиг парадигмы и клинические последствия. Дж. Хирург Онкол. 2004;88(4):261–266. doi: 10.1002/jso.20156. [PubMed] [CrossRef] [Академия Google]
22. Мик М., Берут М., Дзики Л., Тжчински Р., Дзики А. Рак правой и левой ободочной кишки – клинические и патологоанатомические различия нозологической формы в одном органе. Arch Med Sci. 2017;13(1):157–162. doi: 10.5114/aoms.2016.58596. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Boland CR, Thibodeau SN, Hamilton SR, Sidransky D, Eshleman JR, Burt RW, Meltzer SJ. и другие. Семинар Национального института рака по микросателлитной нестабильности для выявления рака и семейной предрасположенности: разработка международных критериев для определения микросателлитной нестабильности при колоректальном раке.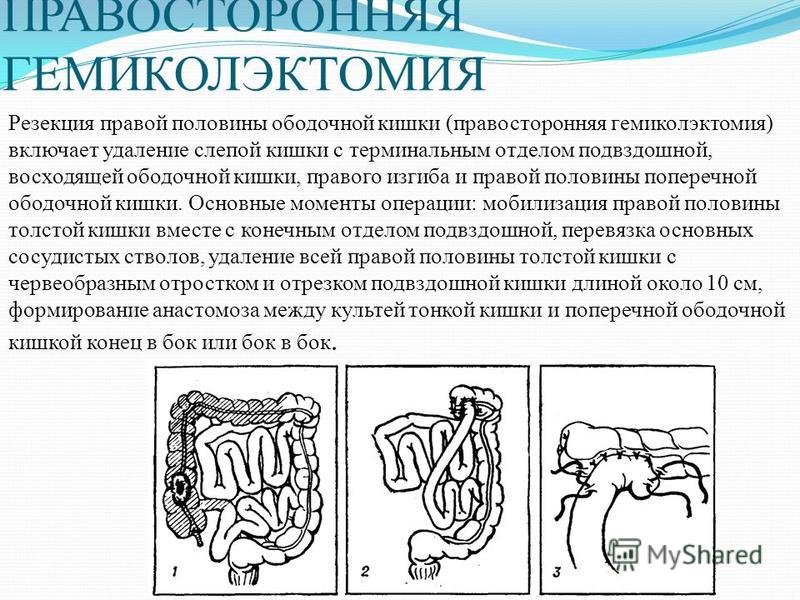 Рак рез. 1998;58(22):5248–5257. [PubMed] [Google Scholar]
Рак рез. 1998;58(22):5248–5257. [PubMed] [Google Scholar]
24. Giannakis M, Mu XJ, Shukla SA, Qian ZR, Cohen O, Nishihara R, Bahl S. et al. Геномные корреляты инфильтратов иммунных клеток при колоректальной карциноме. Cell Rep. 2016;17(4):1206. doi: 10.1016/j.celrep.2016.10.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Pino MS, Chung DC. Путь хромосомной нестабильности при раке толстой кишки. Гастроэнтерология. 2010;138(6):2059–2072. doi: 10.1053/j.gastro.2009.12.065. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Амерси Ф., Агустин М., Ко С.И. Колоректальный рак: эпидемиология, факторы риска и службы здравоохранения. Clin Colon Rectal Surg. 2005;18(3):133–140. doi: 10.1055/s-2005-916274. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Roper J, Huang KE. В: Молекулярный патогенез колоректального рака. Хайгис К.М., редактор. Springer Science & Business Media; Нью-Йорк; 2013. Молекулярные механизмы колоректального канцерогенеза; стр. 1–42. [CrossRef] [Google Scholar]
1–42. [CrossRef] [Google Scholar]
28. Verwaal VJ, Bruin S, Boot H, van Slooten G, van Tinteren H. 8-летнее наблюдение за рандомизированным исследованием: циторедукция и гипертермическая внутрибрюшинная химиотерапия по сравнению с системной химиотерапией у пациентов с перитонеальной карциноматоз колоректального рака. Энн Сург Онкол. 2008;15(9): 2426–2432. doi: 10.1245/s10434-008-9966-2. [PubMed] [CrossRef] [Google Scholar]
29. Petrelli F, Tomasello G, Borgonovo K, Ghidini M, Turati L, Dallera P, Passalacqua R. et al. Прогностическая выживаемость, связанная с левосторонним и правосторонним раком толстой кишки: систематический обзор и метаанализ. JAMA Онкол. 2017;3(2):211–219. doi: 10.1001/jamaoncol.2016.4227. [PubMed] [CrossRef] [Google Scholar]
30. Loupakis F, Yang D, Yau L, Feng S, Cremolini C, Zhang W, Maus MK. и другие. Локализация первичной опухоли как прогностический фактор при метастатическом колоректальном раке. J Natl Cancer Inst. 2015;107(3):dju427. дои: 10.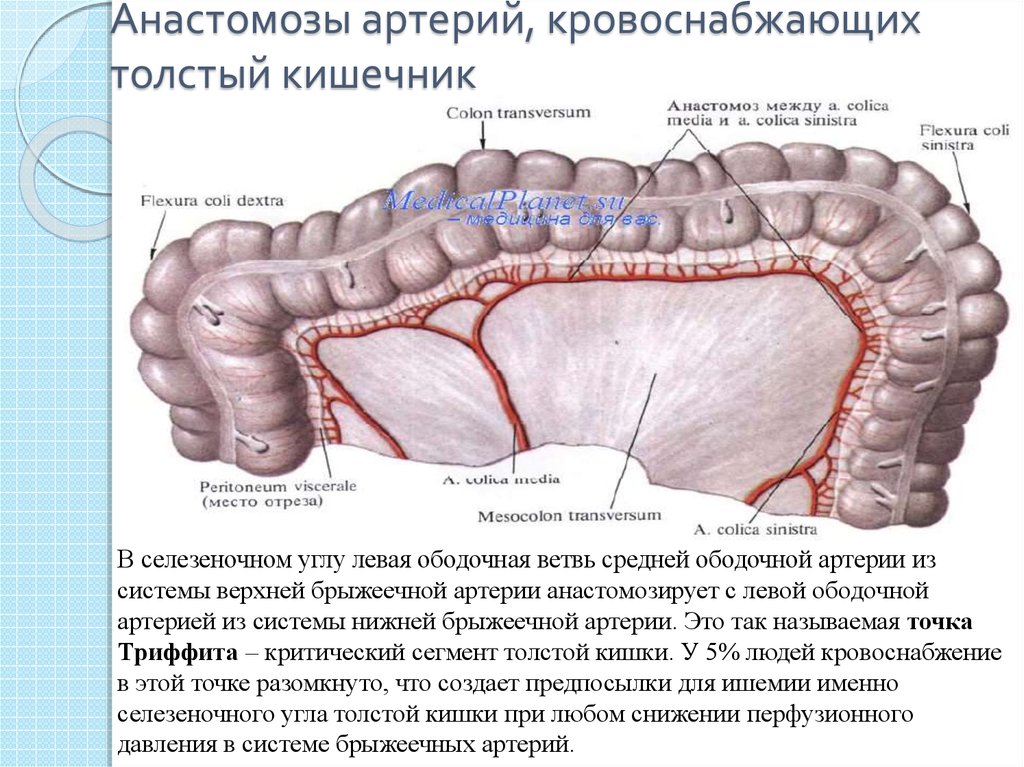 1093/jnci/dju427. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1093/jnci/dju427. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. Boisen MK, Johansen JS, Dehlendorff C, Larsen JS, Osterlind K, Hansen J, Nielsen SE. и другие. Локализация первичной опухоли и эффективность бевацизумаба у пациентов с метастатическим колоректальным раком. Энн Онкол. 2013;24(10):2554–2559. doi: 10.1093/annonc/mdt253. [PubMed] [CrossRef] [Google Scholar]
32. Weiss JM, Schumacher J, Allen GO, Neuman H, Lange EO, Loconte NK, Greenberg CC. и другие. Адъювантная химиотерапия при правостороннем и левостороннем раке толстой кишки II стадии: анализ данных SEER-medicare. Энн Сург Онкол. 2014; 21(6):1781–179.1. doi: 10.1245/s10434-014-3631-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Lee JJ, Chu E. Адъювантная химиотерапия при раке толстой кишки II стадии: споры продолжаются. Дж Онкол Практ. 2017;13(4):245–246. doi: 10.1200/JOP.2017.022178. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Bibeau F.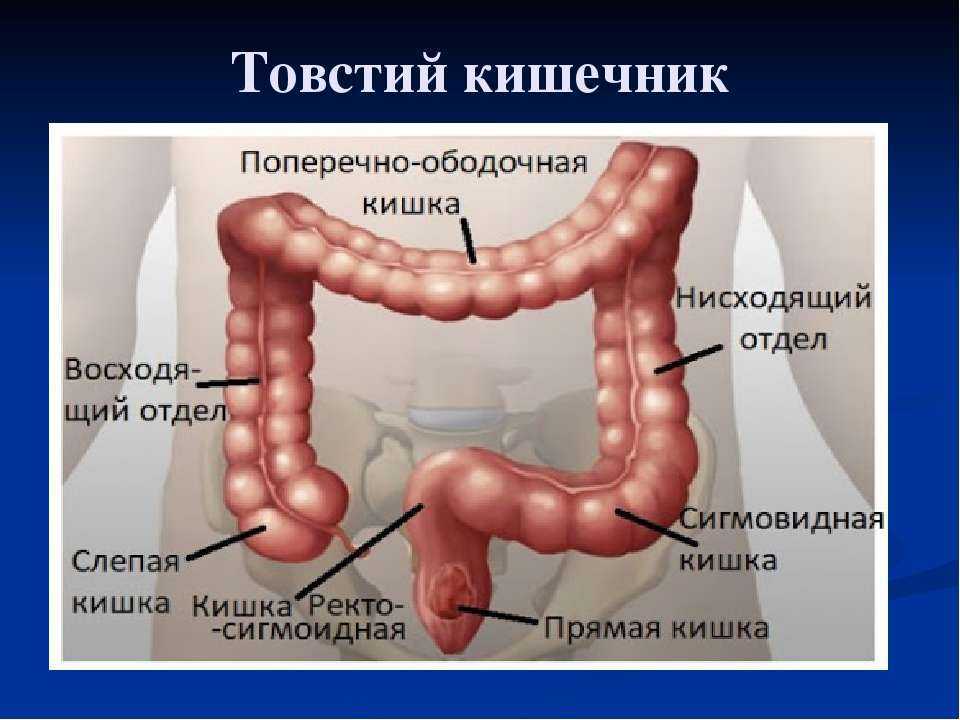 Galon J, Mlecnik B, Marliot F, et al (2016) Проверка иммуноскорости (IM) в качестве прогностического маркера на стадии I /II/III рак толстой кишки: результаты анализа 1336 пациентов, основанного на всемирном консорциуме. J Clin Oncol 34 (приложение): абстр. 3500. Толстая и прямая кишка. 2016;10(3):197–199. doi: 10.1007/s11725-016-0664-4. [CrossRef] [Google Scholar]
Galon J, Mlecnik B, Marliot F, et al (2016) Проверка иммуноскорости (IM) в качестве прогностического маркера на стадии I /II/III рак толстой кишки: результаты анализа 1336 пациентов, основанного на всемирном консорциуме. J Clin Oncol 34 (приложение): абстр. 3500. Толстая и прямая кишка. 2016;10(3):197–199. doi: 10.1007/s11725-016-0664-4. [CrossRef] [Google Scholar]
35. Sasaki K, Andreatos N, Margonis GA, He J, Weiss M, Johnston F, Wolfgang C. et al. Прогностические последствия локализации первичной колоректальной опухоли на рецидив и общую выживаемость у пациентов, перенесших резекцию по поводу метастазов колоректального рака в печень. Дж. Хирург Онкол. 2016;114(7):803–809. doi: 10.1002/jso.24425. [PubMed] [CrossRef] [Google Scholar]
36. Holch JW, Ricard I, Stintzing S, Modest DP, Heinemann V. Актуальность локализации первичной опухоли у пациентов с метастатическим колоректальным раком. Евр Джей Рак. 2017;70:87–98. doi: 10.1016/j.ejca.2016.10.007. [PubMed] [CrossRef] [Google Scholar]
37. Джесс П., Хансен И.О., Гамборг М., Джесс Т., Датский колоректальный рак Г. Общенациональное датское когортное исследование, в котором ставится задача разделить рак толстой кишки на правосторонний и левосторонний. Открытый БМЖ. 2013;3(5):e002608. doi: 10.1136/bmjopen-2013-002608. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Джесс П., Хансен И.О., Гамборг М., Джесс Т., Датский колоректальный рак Г. Общенациональное датское когортное исследование, в котором ставится задача разделить рак толстой кишки на правосторонний и левосторонний. Открытый БМЖ. 2013;3(5):e002608. doi: 10.1136/bmjopen-2013-002608. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Half E, Bercovich D, Rozen P. Семейный аденоматозный полипоз. Orphanet J Rare Dis. 2009; 4:22. дои: 10.1186/1750-1172-4-22. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Эллис КН. Синдромы аденоматозного полипоза толстой кишки: клиническое ведение. Clin Colon Rectal Surg. 2008;21(4):256–262. doi: 10.1055/s-0028-1089940. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Galon J, Mlecnik B, Bindea G, Angell HK, Berger A, Lagorce C, Lugli A. et al. К введению «Иммуноскоры» в классификацию злокачественных опухолей. Джей Патол. 2014;232(2):199–209. doi: 10.1002/путь.4287. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Мюллер М.Ф., Ибрагим А.Е., Арендс М.Дж. Молекулярно-патологическая классификация колоректального рака. Арка Вирхова. 2016;469(2):125–134. doi: 10.1007/s00428-016-1956-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мюллер М.Ф., Ибрагим А.Е., Арендс М.Дж. Молекулярно-патологическая классификация колоректального рака. Арка Вирхова. 2016;469(2):125–134. doi: 10.1007/s00428-016-1956-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
42. Камбара Т., Симмс Л.А., Уайтхолл В.Л., Спринг К.Дж., Винтер К.В., Уолш М.Д., Баркер М.А. и другие. Мутация BRAF связана с метилированием ДНК в зубчатых полипах и раке толстой кишки. Кишка. 2004;53(8):1137–1144. doi: 10.1136/gut.2003.037671. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Исса Дж.П. Фенотип метилатора CpG-островков при раке. Нат Рев Рак. 2004;4(12):988–993. doi: 10.1038/nrc1507. [PubMed] [CrossRef] [Google Scholar]
44. Атлас генома рака N. Комплексная молекулярная характеристика рака толстой и прямой кишки человека. Природа. 2012; 487(7407):330–337. doi: 10.1038/nature11252. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Fearon ER. Молекулярная генетика колоректального рака.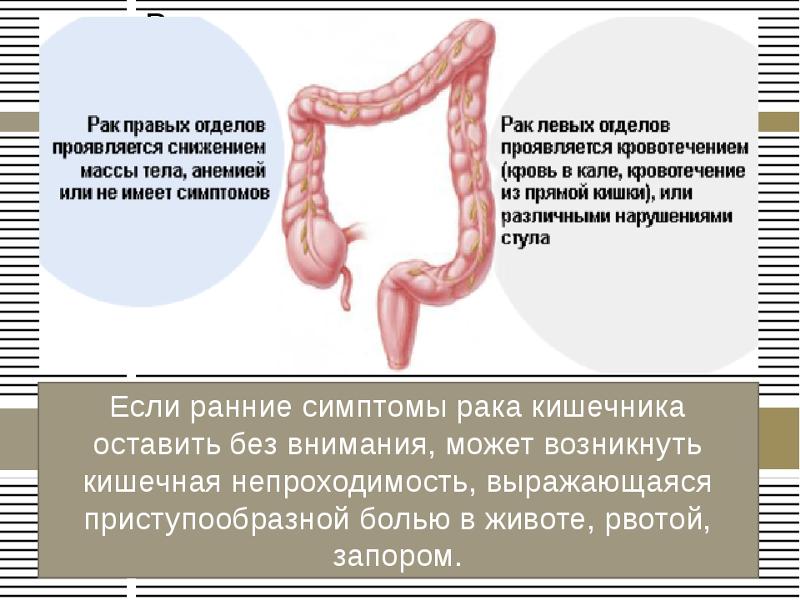 Анну Рев Патол. 2011; 6: 479–507. doi: 10.1146/annurev-pathol-011110-130235. [PubMed] [CrossRef] [Академия Google]
Анну Рев Патол. 2011; 6: 479–507. doi: 10.1146/annurev-pathol-011110-130235. [PubMed] [CrossRef] [Академия Google]
46. Peltomaki P, Vasen H. Мутации, связанные с предрасположенностью к HNPCC - Обновление базы данных мутаций ICG-HNPCC/INSiGHT. Дис маркеры. 2004;20(4-5):269–276. doi: 10.1155/2004/305058. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Fearon ER, Vogelstein B. Генетическая модель колоректального онкогенеза. Клетка. 1990;61(5):759–767. doi: 10.1016/0092-8674(90)
-I. [PubMed] [CrossRef] [Google Scholar]
48. Vogelstein B, Fearon ER, Hamilton SR, Kern SE, Preisinger AC, Leppert M, Nakamura Y. et al. Генетические изменения при развитии колоректальной опухоли. N Engl J Med. 1988;319(9):525–532. doi: 10.1056/NEJM19880
90901. [PubMed] [CrossRef] [Google Scholar] 49. Katayama H, Ota T, Jisaki F, Ueda Y, Tanaka T, Odashima S, Suzuki F. et al. Экспрессия митотической киназы и прогрессирование колоректального рака. J Natl Cancer Inst. 1999;91(13):1160–1162. doi: 10.1093/jnci/91.13.1160. [PubMed] [CrossRef] [Google Scholar]
1999;91(13):1160–1162. doi: 10.1093/jnci/91.13.1160. [PubMed] [CrossRef] [Google Scholar]
50. Macurek L, Lindqvist A, Lim D, Lampson MA, Klompmaker R, Freire R, Clouin C. et al. Полоподобная киназа-1 активируется авророй А, чтобы способствовать восстановлению контрольной точки. Природа. 2008;455(7209): 119–123. doi: 10.1038/nature07185. [PubMed] [CrossRef] [Google Scholar]
51. Takahashi T, Sano B, Nagata T, Kato H, Sugiyama Y, Kunieda K, Kimura M. et al. Полоподобная киназа 1 (PLK1) сверхэкспрессируется при первичном колоректальном раке. Онкологические науки. 2003;94(2):148–152. doi: 10.1111/j.1349-7006.2003.tb01411.x. [PubMed] [CrossRef] [Google Scholar]
52. Аль-Мулла Ф., Милнер-Уайт Э.Дж., Гоинг Дж.Дж., Бирни Г.Д. Структурные различия между белками Ras валином-12 и аспартатом-12 могут модифицировать агрессивность карциномы. Джей Патол. 1999;187(4):433–438. doi: 10.1002/(SICI)1096-9896(199903)187:4<433::AID-PATh373>3.0.CO;2-E. [PubMed] [CrossRef] [Google Scholar]
53. Tan C, Du X. Тестирование мутации KRAS при метастатическом колоректальном раке. Мир J Гастроэнтерол. 2012;18(37):5171–5180. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Tan C, Du X. Тестирование мутации KRAS при метастатическом колоректальном раке. Мир J Гастроэнтерол. 2012;18(37):5171–5180. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Имамура Ю., Морикава Т., Ляо Х., Лоххед П., Кучиба А., Ямаути М., Цянь З.Р. и другие. Специфические мутации в кодонах 12 и 13 KRAS и прогноз пациента при 1075 колоректальных раках дикого типа BRAF. Клин Рак Рез. 2012;18(17):4753–4763. doi: 10.1158/1078-0432.CCR-11-3210. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Андреев Х.Дж., Норман А.Р., Каннингем Д., Оутс Дж.Р., Кларк П.А. Мутации Kirsten ras у больных колоректальным раком: многоцентровое исследование «RASCAL». J Natl Cancer Inst. 1998;90(9):675–684. doi: 10.1093/jnci/90.9.675. [PubMed] [CrossRef] [Google Scholar]
56. Андреев Х.Дж., Норман А.Р., Каннингем Д., Оутс Дж., Дикс Б.Р., Якопетта Б.Дж., Янг Дж. и соавт. Мутации Kirsten ras у пациентов с колоректальным раком: исследование «RASCAL II». Бр Дж Рак. 2001;85(5):692–696. doi: 10.1054/bjoc.2001.1964. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.1054/bjoc.2001.1964. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Roth AD, Tejpar S, Delorenzi M, Yan P, Fiocca R, Klingbiel D, Dietrich D. et al. Прогностическая роль KRAS и BRAF при резецированном раке толстой кишки II и III стадии: результаты трансляционного исследования исследований PETACC-3, EORTC 40993, SAKK 60-00. Дж. Клин Онкол. 2010;28(3):466–474. doi: 10.1200/JCO.2009.23.3452. [PubMed] [CrossRef] [Google Scholar]
58. Адельштейн Б.А., Доббинс Т.А., Харрис К.А., Маршнер И.С., Уорд Р.Л. Систематический обзор и метаанализ статуса KRAS как детерминанты ответа на антитела против EGFR и влияние химиотерапии партнера на метастатический колоректальный рак. Евр Джей Рак. 2011;47(9): 1343–1354. doi: 10.1016/j.ejca.2011.03.031. [PubMed] [CrossRef] [Google Scholar]
59. Boland CR, Goel A. Микросателлитная нестабильность при колоректальном раке. Гастроэнтерология. 2010;138(6):2073–2087. е22073. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Domingo E, Laiho P, Ollikainen M, Pinto M, Wang L, French AJ, Westra J. et al. Скрининг BRAF как недорогостоящая стратегия упрощения генетического тестирования HNPCC. J Med Genet. 2004;41(9):664–668. doi: 10.1136/jmg.2004.020651. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Domingo E, Laiho P, Ollikainen M, Pinto M, Wang L, French AJ, Westra J. et al. Скрининг BRAF как недорогостоящая стратегия упрощения генетического тестирования HNPCC. J Med Genet. 2004;41(9):664–668. doi: 10.1136/jmg.2004.020651. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
61. Наземалхоссейни Моджарад Э., Фарахани Р.К., Хагиги М.М., Агдаи Х.А., Куппен П.Дж., Зали М.Р. Клинические последствия теста на мутацию BRAF при колоректальном раке. Gastroenterol Hepatol Bed Bench. 2013;6(1):6–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Guerra J, Pinto C, Pinto D, Pinheiro M, Silva R, Peixoto A, Rocha P. et al. Соматические мутации POLE при распространенном колоректальном раке. Рак Мед. 2017;6(12):2966–2971. doi: 10.1002/cam4.1245. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Principe DR, Doll JA, Bauer J, Jung B, Munshi HG, Bartholin L, Pasche B. et al. TGF-бета: двойственность функций между профилактикой опухолей и канцерогенезом. J Natl Cancer Inst. 2014;106(2):djt369. doi: 10.1093/jnci/djt369. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
J Natl Cancer Inst. 2014;106(2):djt369. doi: 10.1093/jnci/djt369. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Massague J. TGFbeta in Cancer. Клетка. 2008;134(2):215–230. doi: 10.1016/j.cell.2008.07.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Чжан Б., Гальдер С.К., Кашикар Н.Д., Чо Ю.Дж., Датта А., Горден Д.Л., Датта П.К. Антиметастатическая роль передачи сигналов Smad4 при колоректальном раке. Гастроэнтерология. 2010;138(3):969–980. е961-963. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Lee YJ, Hong KH, Yun J, Oh SP. Генерация гипоморфных аллелей, специфичных для изоформы рецептора активина типа IIB. Бытие. 2006;44(10):487–494. doi: 10.1002/dvg.20238. [PubMed] [CrossRef] [Google Scholar]
67. Staudacher JJ, Bauer J, Jana A, Tian J, Carroll T, Mancinelli G, Ozden O. et al. Передача сигналов активина является важным компонентом прометастатического фенотипа, индуцированного TGF-бета, при колоректальном раке. Научный доклад 2017; 7 (1): 5569. doi: 10.1038/s41598-017-05907-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Научный доклад 2017; 7 (1): 5569. doi: 10.1038/s41598-017-05907-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Bauer J, Sporn JC, Cabral J, Gomez J, Jung B. Влияние активина и TGFbeta на p21 при раке толстой кишки. ПЛОС Один. 2012;7(6):e39381. doi: 10.1371/journal.pone.0039381. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Ohhara Y, Fukuda N, Takeuchi S, Honma R, Shimizu Y, Kinoshita I, Dosaka-Akita H. Роль таргетной терапии при метастатическом колоректальном раке . World J Gastrointest Oncol. 2016;8(9): 642–655. doi: 10.4251/wjgo.v8.i9.642. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Sobrero A, Guglielmi A, Grossi F, Puglisi F, Aschele C. Механизм действия фторпиримидинов: отношение к новым разработкам в химиотерапии колоректального рака. Семин Онкол. 2000;27(5 Приложение 10):72–77. [PubMed] [Google Scholar]
71. Thirion P, Michiels S, Pignon JP, Buyse M, Braud AC, Carlson RW, O'Connell M. et al. Модуляция фторурацила лейковорином у пациентов с распространенным колоректальным раком: обновленный метаанализ. Дж. Клин Онкол. 2004;22(18):3766–3775. doi: 10.1200/JCO.2004.03.104. [PubMed] [CrossRef] [Академия Google]
Модуляция фторурацила лейковорином у пациентов с распространенным колоректальным раком: обновленный метаанализ. Дж. Клин Онкол. 2004;22(18):3766–3775. doi: 10.1200/JCO.2004.03.104. [PubMed] [CrossRef] [Академия Google]
72. Вольпин Б.М., Майер Р.Дж. Систематическое лечение колоректального рака. Гастроэнтерол. 2008;134(5):1296–1310. doi: 10.1053/j.gastro.2008.02.098. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
73. Moertel CG, Fleming TR, Macdonald JS, Haller DG, Laurie JA, Tangen CM, Ungerleider JS. и другие. Фторурацил плюс левамизол как эффективная адъювантная терапия после резекции рака толстой кишки III стадии: окончательный отчет. Энн Интерн Мед. 1995;122(5):321–326. дои: 10.7326/0003-4819-122-5-199503010-00001. [PubMed] [CrossRef] [Google Scholar]
74. Сибер А., Гастл Г. Таргетная терапия колоректального рака. Онкол Рес Лечить. 2016;39(12):796–802. doi: 10.1159/000453027. [PubMed] [CrossRef] [Google Scholar]
75. Venook AP, Niedzwiecki D, Innocenti F. et al. Влияние локализации первичной опухоли на общую выживаемость и выживаемость без прогрессирования у пациентов с метастатическим колоректальным раком: анализ CALGB/SWOG 80405 (Alliance) J Clin Oncol. 2016;34:3504. [Академия Google]
et al. Влияние локализации первичной опухоли на общую выживаемость и выживаемость без прогрессирования у пациентов с метастатическим колоректальным раком: анализ CALGB/SWOG 80405 (Alliance) J Clin Oncol. 2016;34:3504. [Академия Google]
76. Брюле С.Ю., Джонкер Д.Дж., Карапетис С.С., О'Каллаган С.Дж., Мур М.Дж., Вонг Р., Теббатт Н.К. и другие. Расположение рака толстой кишки (правосторонний или левосторонний) как прогностический фактор и предиктор пользы от цетуксимаба в NCIC CO.17. Евр Джей Рак. 2015;51(11):1405–1414. doi: 10.1016/j.ejca.2015.03.015. [PubMed] [CrossRef] [Google Scholar]
77. Tejpar S, Stintzing S, Ciardiello F, Tabernero J, Van Cutsem E, Beier F, Esser R. et al. Прогностическая и прогностическая значимость локализации первичной опухоли у пациентов с метастатическим колоректальным раком RAS дикого типа: ретроспективный анализ исследований CRYSTAL и FIRE-3. JAMA Онкол. 2017;3(2):194–201. doi: 10.1001/jamaoncol.2016.3797. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Boeckx N, Koukakis R, Op de Beeck K, Rolfo C, Van Camp G, Siena S, Tabernero J. et al. Односторонность первичной опухоли влияет на прогноз и исход лечения метастатического колоректального рака: результаты двух рандомизированных исследований панитумумаба первой линии. Энн Онкол. 2017; 28(8):1862–1868. doi: 10.1093/annonc/mdx119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Boeckx N, Koukakis R, Op de Beeck K, Rolfo C, Van Camp G, Siena S, Tabernero J. et al. Односторонность первичной опухоли влияет на прогноз и исход лечения метастатического колоректального рака: результаты двух рандомизированных исследований панитумумаба первой линии. Энн Онкол. 2017; 28(8):1862–1868. doi: 10.1093/annonc/mdx119. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Salem ME, Weinberg BA, Xiu J, El-Deiry WS, Hwang JJ, Gatalica Z, Philip PA. и другие. Сравнительный молекулярный анализ рака левой, правой и прямой кишки. Онкотаргет. 2017;8(49):86356–86368. doi: 10.18632/oncotarget.21169. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
80. Aljehani MA, Morgan JW, Guthrie LA, Jabo B, Ramadan M, Bahjri K, Lum SS. и другие. Связь локализации первичной опухоли со смертностью у пациентов, получающих бевацизумаб и цетуксимаб по поводу метастатического колоректального рака. JAMA Surg. 2018;153(1):60–67. doi: 10.1001/jamasurg.2017.3466. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
81.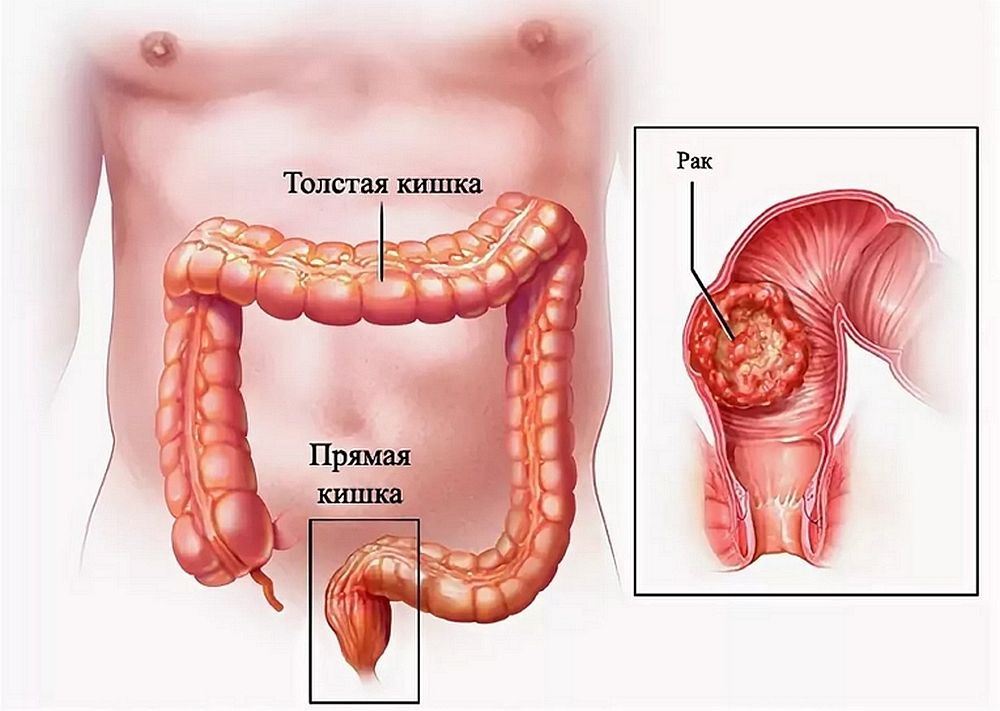 Kloor M, von Knebel Doeberitz M. Иммунная биология микросателлитно-нестабильного рака. Тенденции Рак. 2016;2(3):121–133. doi: 10.1016/j.trecan.2016.02.004. [PubMed] [CrossRef] [Академия Google]
Kloor M, von Knebel Doeberitz M. Иммунная биология микросателлитно-нестабильного рака. Тенденции Рак. 2016;2(3):121–133. doi: 10.1016/j.trecan.2016.02.004. [PubMed] [CrossRef] [Академия Google]
82. Пардолл Д.М. Блокада иммунных контрольных точек при иммунотерапии рака. Нат Рев Рак. 2012;12(4):252–264. doi: 10.1038/nrc3239. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Gatalica Z, Vranic S, Xiu J, Swensen J, Reddy S. Колоректальная карцинома с высокой микросателлитной нестабильностью (MSI-H): краткий обзор прогностических биомаркеры в эпоху персонализированной медицины. Фам Рак. 2016;15(3):405–412. doi: 10.1007/s10689-016-9884-6. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Дженкинс Р.В., Барби Д.А., Флаэрти К.Т. Механизмы резистентности к ингибиторам иммунных контрольных точек. Бр Дж Рак. 2018;118(1):9–16. doi: 10.1038/bjc.2017.434. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
85. Topalian SL, Taube JM, Anders RA, Pardoll DM.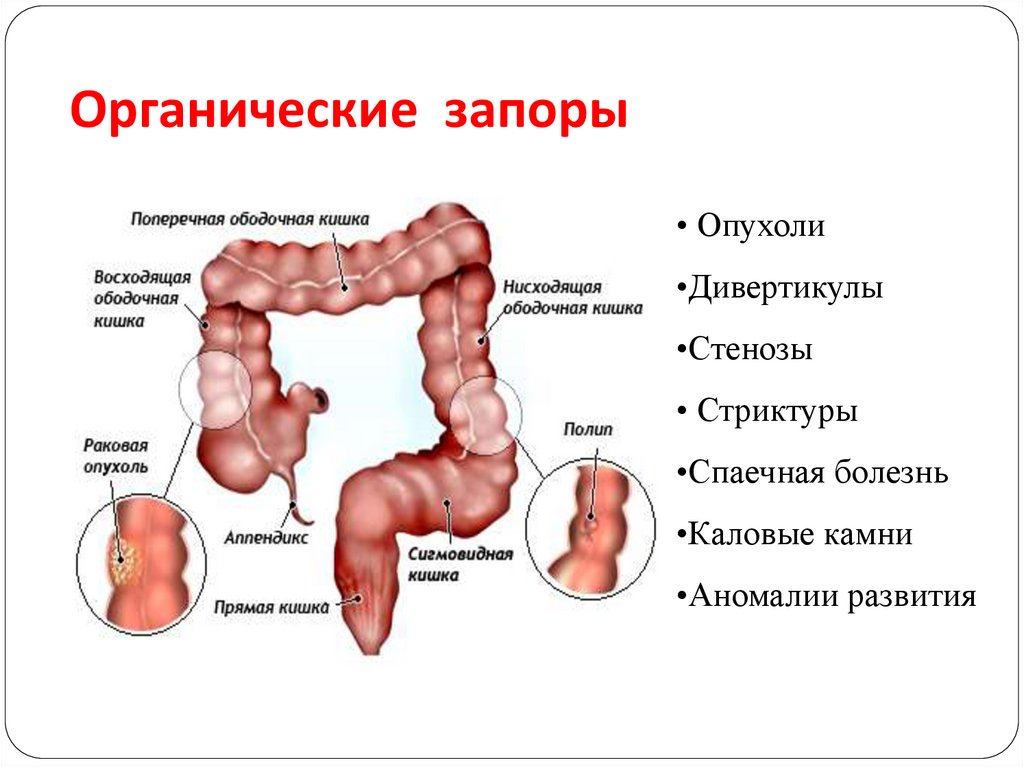 Биомаркеры, управляемые механизмом, для управления блокадой иммунных контрольных точек при лечении рака. Нат Рев Рак. 2016;16(5):275–287. doi: 10.1038/nrc.2016.36. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Биомаркеры, управляемые механизмом, для управления блокадой иммунных контрольных точек при лечении рака. Нат Рев Рак. 2016;16(5):275–287. doi: 10.1038/nrc.2016.36. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Topalian SL, Drake CG, Pardoll DM. Блокада иммунных контрольных точек: общий подход к терапии рака. Раковая клетка. 2015;27(4):450–461. doi: 10.1016/j.ccell.2015.03.001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Van Allen EM, Miao D, Schilling B, Shukla SA, Blank C, Zimmer L, Sucker A. et al. Геномные корреляты ответа на блокаду CTLA-4 при метастатической меланоме. Наука. 2015;350(6257):207–211. doi: 10.1126/science.aad0095. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
88. Brahmer JR, Tykodi SS, Chow LQ, Hwu WJ, Topalian SL, Hwu P, Drake CG. и другие. Безопасность и активность антитела против PD-L1 у пациентов с распространенным раком. N Engl J Med. 2012;366(26):2455–2465. дои: 10.1056/NEJMoa1200694.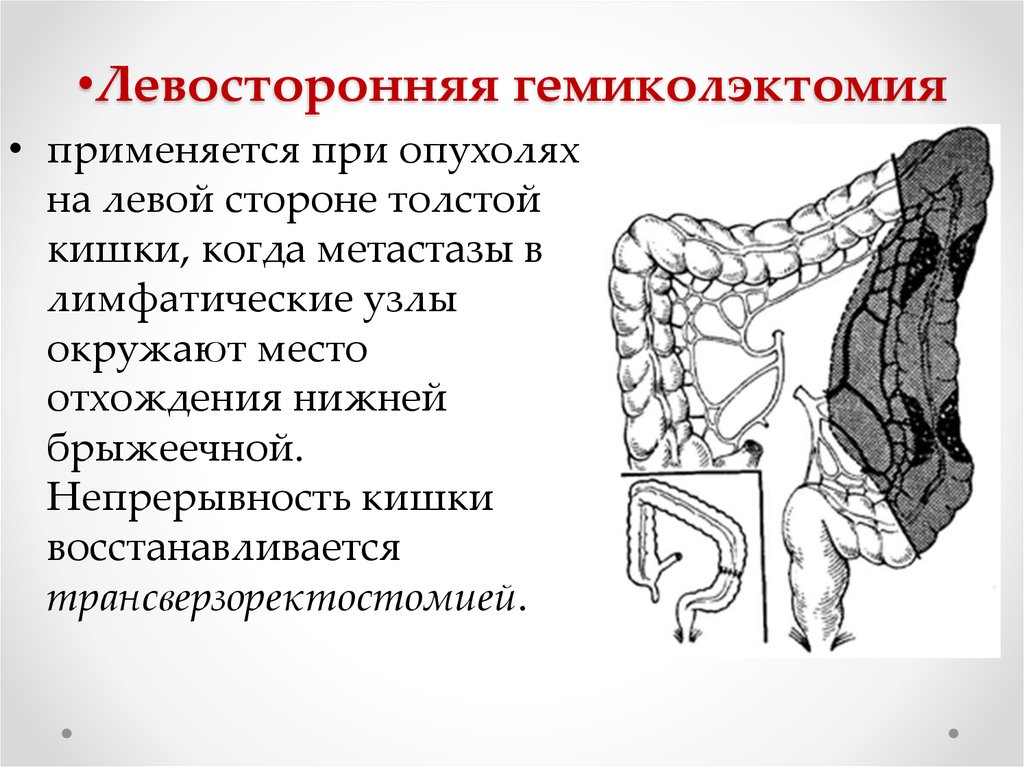 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
89. Chung KY, Gore I, Fong L, Venook A, Beck SB, Dorazio P, Criscitiello PJ. и другие. Исследование фазы II моноклонального антитела против цитотоксического Т-лимфоцит-ассоциированного антигена 4, тремелимумаба, у пациентов с рефрактерным метастатическим колоректальным раком. Дж. Клин Онкол. 2010;28(21):3485–3490. doi: 10.1200/JCO.2010.28.3994. [PubMed] [CrossRef] [Google Scholar]
90. Le DT, Uram JN, Wang H, Bartlett BR, Kemberling H, Eyring AD, Skora AD. и другие. Блокада PD-1 в опухолях с дефицитом Mismatch-Repair. N Engl J Med. 2015;372(26):2509–2520. doi: 10.1056/NEJMoa1500596. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Diaz L, Marabelle A, Delord J. et al. Терапия пембролизумабом при микросателлитной нестабильности с высокой степенью (MSI-H), колоректальном раке (КРР) и не-КРР. Дж. Клин Онкол. 2017;35:3071. [Google Scholar]
92. Канг С.П., Гергич К., Лубинецкий Г.М.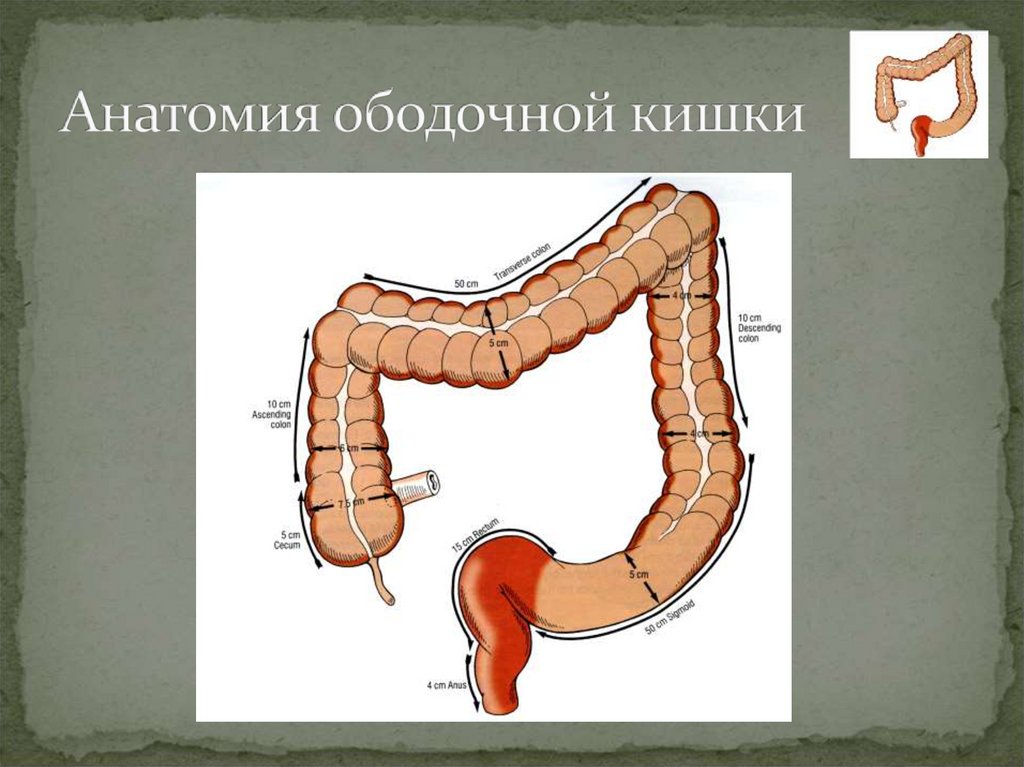 , де Алвис Д.П., Чен С., Тайс М.А.Б., Рубин Э.Х. Пембролизумаб KEYNOTE-001: адаптивное исследование, ведущее к ускоренному одобрению для двух показаний и сопутствующей диагностики. Энн Онкол. 2017;28(6):1388–1398. doi: 10.1093/annonc/mdx076. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, де Алвис Д.П., Чен С., Тайс М.А.Б., Рубин Э.Х. Пембролизумаб KEYNOTE-001: адаптивное исследование, ведущее к ускоренному одобрению для двух показаний и сопутствующей диагностики. Энн Онкол. 2017;28(6):1388–1398. doi: 10.1093/annonc/mdx076. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
93. Overman MJ, McDermott R, Leach JL, Lonardi S, Lenz HJ, Morse MA, Desai J. et al. Ниволумаб у пациентов с метастатическим несоответствием ДНК, недостаточной репарацией или микросателлитной нестабильностью, колоректальным раком с высокой степенью (CheckMate 142): открытое многоцентровое исследование фазы 2. Ланцет Онкол. 2017;18(9):1182–1191. doi: 10.1016/S1470-2045(17)30422-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Андре Т., Лонарди С., Вонг КИМ. и другие. Комбинация ниволумаба (nivo) + ипилумумаба (ipi) в лечении пациентов (pts) с недостаточной репарацией несоответствия ДНК (dMMR)/высокой микросателлитной нестабильностью (MSI-H) метастатическим колоректальным раком (mCRC): исследование Checkmate 142.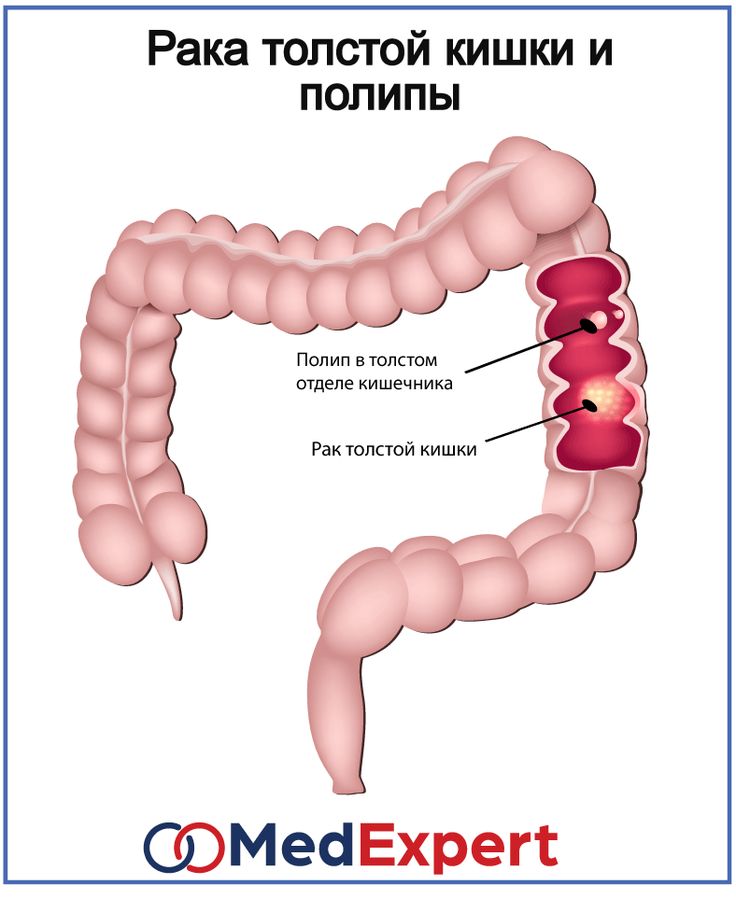 Proc Am Soc Clin Oncol. 2017;35:353. [Google Scholar]
Proc Am Soc Clin Oncol. 2017;35:353. [Google Scholar]
95. Джейкоб Б.Дж., Мойнеддин Р., Сутрадхар Р., Бакстер Н.Н., Урбах Д.Р. Влияние колоноскопии на заболеваемость и смертность от колоректального рака: анализ инструментальных переменных. Гастроинтест Эндоск. 2012;76(2):355–364. е351. [PubMed] [Академия Google]
96. Бишехсари Ф., Махдавиния М., Вакка М., Малекзаде Р., Мариани-Константини Р. Эпидемиологический переход колоректального рака в развивающихся странах: факторы окружающей среды, молекулярные пути и возможности профилактики. Мир J Гастроэнтерол. 2014;20(20):6055–6072. doi: 10.3748/wjg.v20.i20.6055. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97. Хансен И.О., Джесс П. Возможное улучшение долгосрочной выживаемости при раке левой и правой толстой кишки — систематический обзор. Дэн Мед Дж. 2012; 59(6): А4444. [PubMed] [Google Scholar]
98. Nitsche U, Stogbauer F, Spath C, Haller B, Wilhelm D, Friess H, Bader FG. Правосторонний рак толстой кишки как отдельный гистопатологический подтип с неблагоприятным прогнозом. Копать сург. 2016;33(2):157–163. doi: 10.1159/000443644. [PubMed] [CrossRef] [Google Scholar]
Копать сург. 2016;33(2):157–163. doi: 10.1159/000443644. [PubMed] [CrossRef] [Google Scholar]
99. Brenner H, Hoffmeister M, Arndt V, Stegmaier C, Altenhofen L, Haug U. Защита от право- и левосторонних колоректальных новообразований после колоноскопии: популяционное исследование. J Natl Cancer Inst. 2010;102(2):89–95. doi: 10.1093/jnci/djp436. [PubMed] [CrossRef] [Google Scholar]
100. Schrag D, Rifas-Shiman S, Saltz L, Bach PB, Begg CB. Использование адъювантной химиотерапии для получателей Medicare с раком толстой кишки II стадии. Дж. Клин Онкол. 2002;20(19):3999–4005. doi: 10.1200/JCO.2002.11.084. [PubMed] [CrossRef] [Google Scholar]
101. Gill S, Loprinzi CL, Sargent DJ, Thome SD, Alberts SR, Haller DG, Benedetti J. et al. Объединенный анализ адъювантной терапии на основе фторурацила при раке толстой кишки II и III стадии: кому и в какой степени? Дж. Клин Онкол. 2004;22(10):1797–1806. doi: 10.1200/JCO.2004.09.059. [PubMed] [CrossRef] [Google Scholar]
102.