2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Содержание
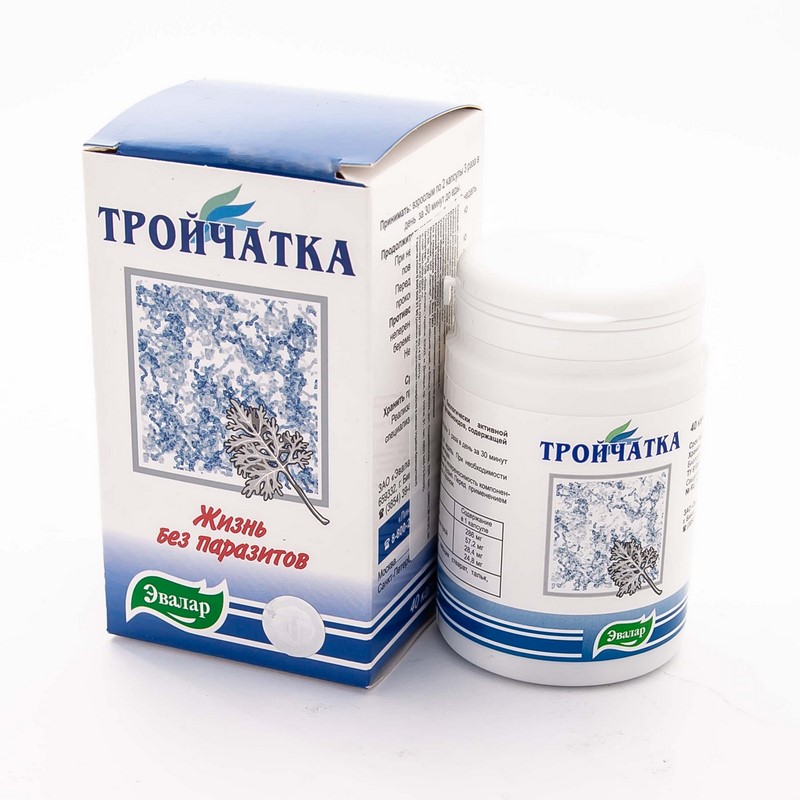
Тройчатка или, как ее нередко называют в медицине, литическая смесь является действенным лекарством, которое нередко применяется врачами для снижения температуры. Ее назначают и детям, и взрослым при различных патологиях.
Изначально в составе данной смеси присутствовали анальгин, дротаверин и димедрол. Однако сегодня эти ингредиенты нередко меняют на более безопасные. Итак, что входит в состав средства?
Содержание статьи
Средство отличается комбинированным составом, ведь в него входит три медикамента. Однако ни один не относится к категории жаропонижающих лекарств. Если же собрать их вместе, удастся добиться быстрого и стойкого снижения температуры.
Итак, сегодня в состав тройчатки принято включать такие компоненты:
В первоначальный состав тройчатки входит димедрол. Это достаточно серьезное вещество, которое не удастся купить без рецепта. Потому данное лекарство нередко меняют на другие препараты, имеющие похожий принцип действия. Помимо диазолина, к ним относят супрастин и тавегил.
Жаропонижающий укол можно выполнить и при отсутствии но-шпы. Данное вещество вполне можно сменить на другие спазмолитики – к примеру, папаверин.
Таким образом, тройчатка обеспечивает одновременно несколько действий – уменьшает болевой синдром, способствует расширению и расслаблению сосудов, устраняет отеки тканей и слизистых оболочек.
Не все компоненты тройчатки обладают жаропонижающим действием.
Читайте также на нашем сайте: Температура после Манту у ребенка – что делать, когда сбивать
Данные вещества способствуют увеличению теплопередачи. Это помогает усилить действие анальгина на организм. Применение тройчатки существенно улучшает состояние пациента даже при наличии большой температуры.
Несомненным преимуществом смеси является возможность применения в том случае, если больной не способен выпить таблетку. Данная необходимость появляется при сильных позывах к рвоте. Также она может быть связана с обморочным состоянием или отказом пациента принимать лекарства.
Инъекционное введение тройчатки применяется исключительно при высокой температуре – более 38 градусов. Применять состав больше 2 раз в сутки категорически запрещено. Важно учитывать, что тройчатка считается достаточно сильным веществом. Потому использовать ее следует предельно аккуратно.
Применение лекарств, которые присутствуют в составе тройчатки, способствует быстрому снижению температуры. Если же воспаление только начинает развиваться, состав уменьшит температурные показатели на несколько часов, после чего они снова увеличатся. Именно поэтому тройчатку можно использовать исключительно как часть комплексной терапии.
Несмотря на действенность тройчатки при температуре, многие врачи подвергают сомнению необходимость использования вещества. Прежде всего специалисты не советуют снижать температуру менее 38,5 градусов. Такие показатели подтверждают тот факт, что организм пытается самостоятельно справиться с недугом. Потому вмешиваться в данный процесс не рекомендуется.
Прежде всего специалисты не советуют снижать температуру менее 38,5 градусов. Такие показатели подтверждают тот факт, что организм пытается самостоятельно справиться с недугом. Потому вмешиваться в данный процесс не рекомендуется.
Хотя тройчатка и отличается высокой эффективностью, она является причиной серьезного медикаментозного удара по организму человека. Это особенно важно при лечении детей.
Тем не менее, существуют определенные показания к применению такой смеси. К ним относят следующее:
Литическая смесь чаще всего вводится инъекционным способом. Однако вполне возможно сделать состав и из таблетированных форм лекарственных препаратов.
Однако вполне возможно сделать состав и из таблетированных форм лекарственных препаратов.
Комбинация перечисленных ингредиентов обладает явными жаропонижающими свойствами. Благодаря ее применению удастся быстро сбить температуру и улучшить состояние пациента.
Перед тем как сделать тройчатку, обязательно нужно ознакомиться с пропорциями. Это достаточно серьезное средство, при изготовлении которого нужно соблюдать основные рекомендации.
Читайте также на нашем сайте: Уколы от температуры – какие использовать, дозировки, состав
Чтобы приготовить эффективный состав, нужно придерживаться такой последовательности действий:
 Тройчатку всегда вводят в одно и то же место – верхний сектор ягодицы слева или справа.
Тройчатку всегда вводят в одно и то же место – верхний сектор ягодицы слева или справа.Дозировка в таблетках соблюдается намного проще. Взрослым пациентам рекомендуется принять по 1 штуке каждого препарата, запивая большим объемом чистой воды. Детям количество лекарств подбирают в зависимости от веса и возрастной категории.
Важно учитывать, что укол литической смеси строго запрещено выполнять после применения анальгина. При передозировке данного вещества есть риск появления тошноты, рвоты, судорожного синдрома. Иногда люди теряют сознание и даже впадают в кому.
Патологии, которые провоцируют увеличение температуры, очень часто встречаются и у детей. Малыши значительно хуже переносят лихорадку. Чтобы улучшить самочувствие, нередко используется литическая смесь.
Тройчатка от температуры для детей обычно не отличается от стандартного состава. В нее входят антигистаминное средство, анальгин, но-шпа. Многие родители интересуются, в каких ситуациях допустимо пользоваться данным составом.
Специалисты обычно выписывают внутримышечные инъекции тройчатки для снижения высокой температуры. Причем это можно делать вне зависимости от причин ее увеличения. Такое средство применяют и при вирусных, и при бактериальных инфекциях. При условии правильного соблюдения пропорций удастся быстро стабилизировать температурные показатели, устранить дискомфорт в суставах, справиться с головной болью.
 Ключевая опасность кроется в неправильном выборе дозировки. Поэтому при увеличении температуры так важно незамедлительно вызывать врача, избегая самолечения.
Ключевая опасность кроется в неправильном выборе дозировки. Поэтому при увеличении температуры так важно незамедлительно вызывать врача, избегая самолечения.Читайте также на нашем сайте: Антибиотики от высокой температуры – можно ли пить, какие лучше
Тем не менее, встречаются ситуации, когда у ребенка долгое время присутствует высокая температура, а обратиться к врачу нет возможности. Чтобы избежать появления судорожного синдрома, в аптечке обязательно следует держать тройчатку или средства для ее изготовления.
Подобно остальным медикаментозным веществам, тройчатка имеет целый ряд противопоказаний. Прежде всего ее запрещено использовать в таких ситуациях:

Нежелательно применять тройчатку, если после однократного использования средства у человека появились болевые ощущения, тошнота или дискомфорт в желудке. Это обусловлено особенностями организма. В такой ситуации лучше подобрать другой препарат.
Тройчатка считается эффективным средством, которое быстро снижает температурные показатели. Благодаря его применению удастся в короткие сроки улучшить самочувствие человека. Однако это вещество должно быть частью комплексной терапии.
Высокая температура может сопровождать самые разные болезни и патологические состояния. Повыситься температура может как у взрослого, так и ребенка.
Врачи рекомендуют сбивать исключительно температуру в 39 и 40 градусов.
Сегодня существует большое количество медикаментов, способствующих снижению температуры. Однако самым эффективным препаратом для снижения температуры является укол тройчатка.
Однако самым эффективным препаратом для снижения температуры является укол тройчатка.
Препарат, как видно из названия, оказывает несколько воздействий. Это уникальное средство помогает в борьбе с воспалительными недугами, а также такими патологиями, как грипп или ОРВИ. Лекарство намного эффективнее различных таблеток, так как его действие по сравнению с иными медикаментами комбинированное.
Тройчатка (Анальгин, Димедрол, Папаверин) еще называется литической смесью. Зачастую средство используется для уколов. Это средство является комбинированным, оно способствует не только понижению температуры, но и устранению боли.
Зачастую тройчатку для снижения температуры используют врачи скорой помощи при вызове на дом, а также для устранения недомогания у людей, которые проходят лечение в стационаре. Состав препарата: Анальгин, Димедрол и Папаверин (Дротаверин).
В некоторых случаях Дротаверин заменяют Но-шпой. А так как Димедрол отпускается исключительно по рецепту врача, вместо него применяют Тавегил или Диазолин. Зачастую делают уколы тройчатки, так как именно благодаря внутримышечному введению средства лечебный эффект наступает примерно через 15 минут.
Зачастую делают уколы тройчатки, так как именно благодаря внутримышечному введению средства лечебный эффект наступает примерно через 15 минут.
Терапевтические свойства медикамента обусловливаются его компонентами. Анальгин обладает обезболивающим воздействием и помогает в снижении температуры. Что относительно Димедрола, то это средство способствует блокировке гистаминовых рецепторов, и к тому же обладает седативным действием. Что касательно Папаверина, этот препарат оказывает положительное воздействие на гладкую мускулатуру сосудов, способствует устранению спазмов.
Благодаря такому сочетанию препарат является настоящим спасением, способным оказать неотложную помощь людям, страдающим от различных патологий, а также способствующий снижению температуры.
Помимо этого укол тройчатка применяется довольно часто при гипертоническом кризе, так как помогает в понижении давления, при депрессивных и тревожных расстройствах, при болезненных ощущениях, обусловленных спазмом кишечника или мочеполовой системы, эффективен препарат и от болей в спине.
Тройчатка в уколах, безусловно, эффективна и поможет в снижении температуры, как у взрослых, так и детей. Однако использовать эту комбинацию препаратов без ведома специалиста не рекомендуется. К тому же, очень важно в момент приготовления раствора соблюдать пропорции, а в момент применения — дозировки.
В состав тройчатки от температуры входят: Дротаверин (Но-шпа или Папаверин), Димедрол (Диазолин или Тавегил) и Анальгин. Это весьма эффективное средство против воспалительных недугов, гриппа, ОРВИ.
Тройчатка (укол от температуры) может быть назначена только квалифицированным специалистом.
Самолечение, так же как применение состава с неправильными пропорциями, чревато плачевными последствиями.
Доктора часто назначают применение литической смеси с целью понижения температуры, в независимости от того, что спровоцировало ее повышение. Грамотное сочетание трех отдельных лекарств способствует быстрой стабилизации температуры, устранению суставных болезненных и устранению головных болей.
Однако, при уколах тройчатки от температуры ребенку, не стоит забывать, что при заболеваниях воспалительной природы продолжительность воздействия препарата — 3-4 часа. После этого лихорадка может появиться снова. Из-за большой нагрузки на детский организм, средство рекомендуется вводить не более трех раз на день.
Не стоит также забывать, особенно в том случае, если от высокой температуры страдает маленький ребенок, что использование литической смеси может назначить исключительно специалист.
Однако если у ребенка не снижается температура, а вызвать доктора на дом по каким-то причинам невозможно, с целью предупреждения судорог, которые могут привести к плаченым последствиям, в частности летальному исходу, нужно держать дома препараты, чтобы вовремя сделать укол тройчатки от температуры.
Рецепт приготовления смеси довольно прост, главное четко соблюдать пропорции составляющих. Литическая смесь состоит их трех основных лекарств. Если под рукой нет нужного препарата, его можно заменить другим, но с таким же действием.
Тройчатка (Анальгин, Парацетамол, Супрастин) эффективна в борьбе с повышенной температурой, как у ребенка, так и взрослого. Парацетамол идентичен по свойствам Папаверину и Дротаверину, а Супрастин — Димедролу. Анальгин, если дома его нет в наличии, можно заменить любым медикаментом, обладающим обезболивающим воздействием.
Доза смеси зависит от массы тела пациента. Если вес менее 60 кг, средство готовится следующим образом: 1 мл Анальгина, 1 мл Папаверина и 1 мл антигистаминного препарата, к примеру, Диазолина. Подействует препарат по истечении примерно четверти часа.
Чтобы получить от лекарства максимальную пользу, важно знать, как его применять. Прежде чем наполнить шприц средством, ампулы трех медикаментов необходимо сжать в руках, чтобы согреть. Не стоит также забывать о дезинфекции ампул перед введением укола. Следующий этап — наполнение шприца составляющими тройчатки. Сначала необходимо набрать два миллилитра Анальгина, затем столько же Парацетамола, и один миллилитр антигистаминного препарата.
Место для внутримышечного введения литической смеси — верхний внешний квадрат ягодицы. Прежде чем сделать укол необходимо обработать дерму спиртом. Затем необходимо ввести иглу на 2/3 длины (перпендикулярно поверхности ягодицы), а затем медленно вести раствор. Если на месте укола образовалось уплотнение, необходимо наложить йодную сетку.
Тройчатка (укол от температуры), не рекомендована к применению при режущих, острых или блуждающих болезненных ощущениях в животе.
Эти проявления могут свидетельствовать об аппендиците. Противопоказано применение средства людям с индивидуальной непереносимостью. Не стоит использовать подобную комбинацию беременным и кормящим грудью женщинам.
Литическая смесь — довольно серьезное лекарство, которое при нецелесообразном применении может стать причиной плачевных последствий.
Применяться она может исключительно в крайних случаях и только тогда, когда к ее использованию нет противопоказаний: при сильной интоксикации организма, сопровождающейся тошнотой, рвотой и диарей, критическом увеличении температуры и невозможности сбить ее при помощи жаропонижающих средств.
Нецелесообразное применение комбинированного медикамента, так же как несоблюдение дозировок и пропорций и злоупотребление чревато обезвоживанием, появлением судорог, головокружением и потерей сознания.
С целью предупреждения появления побочных действий и ухудшения состояния, прежде чем сделать укол, необходимо проконсультироваться у специалиста.
1. Orr HT, Zoghbi HY. Нарушения тринуклеотидных повторов. Анну. Преподобный Нейроски. 2007; 30: 575–621. [PubMed] [Google Scholar]
2. Ли Л.Б., Бонини Н.М. Роль тринуклеотидных повторов РНК в неврологических заболеваниях и дегенерации. Тренды Нейроси. 2010; 33: 292–298. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Ranum LP, Cooper TA. РНК-опосредованные нервно-мышечные расстройства. Анну. Преподобный Нейроски. 2006;29: 259–277. [PubMed] [Google Scholar]
2006;29: 259–277. [PubMed] [Google Scholar]
4. Тодд П.К., Полсон Х.Л. РНК-опосредованная нейродегенерация при нарушениях повторной экспансии. Энн. Нейрол. 2010;67:291–300. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. La Spada AR, Wilson EM, Lubahn DB, Harding AE, Fischbeck KH. Мутации гена андрогенового рецептора при Х-сцепленной спинальной и бульбарной мышечной атрофии. Природа. 1991; 352:77–79. [PubMed] [Google Scholar]
6. Verkerk AJ, Pieretti M, Sutcliffe JS, Fu YH, Kuhl DP, Pizzuti A, Reiner O, Richards S, Victoria MF, Zhang FP, et al. Идентификация гена (FMR-1), содержащего повтор CGG, совпадающий с кластерной областью точки разрыва, демонстрирующей вариацию длины при синдроме ломкой Х-хромосомы. Клетка. 1991;65:905–914. [PubMed] [Google Scholar]
7. Брук Дж. Д., МакКаррах М. Е., Харли Х. Г., Баклер А. Дж., Черч Д., Абуратани Х., Хантер К., Стэнтон В. П., Тирион Дж. П., Хадсон Т. и др. Молекулярная основа миотонической дистрофии: расширение тринуклеотидного (CTG) повтора на 3'-конце транскрипта, кодирующего члена семейства протеинкиназ. Клетка. 1992; 68: 799–808. [PubMed] [Google Scholar]
Клетка. 1992; 68: 799–808. [PubMed] [Google Scholar]
8. Новый ген, содержащий тринуклеотидный повтор, который расширяется и нестабилен на хромосомах болезни Хантингтона. Совместная исследовательская группа по болезни Гентингтона. Клетка. 1993;72:971–983. [PubMed] [Google Scholar]
9. Кавагути Ю., Окамото Т., Таниваки М., Айзава М., Иноуэ М., Катаяма С., Каваками Х., Накамура С., Нисимура М., Акигути И. и др. Экспансия CAG в новом гене болезни Мачадо-Джозефа на хромосоме 14q32.1. Нац. Жене. 1994; 8: 221–228. [PubMed] [Google Scholar]
10. Orr HT, Chung MY, Banfi S, Kwiatkowski TJ, Jr, Servadio A, Beaudet AL, McCall AE, Duvick LA, Ranum LP, Zoghbi HY. Экспансия нестабильного тринуклеотидного повтора CAG при спиноцеребеллярной атаксии 1 типа. Nat. Жене. 1993;4:221–226. [PubMed] [Google Scholar]
11. Hsu RJ, Hsiao KM, Lin MJ, Li CY, Wang LC, Chen LK, Pan H. Длинные участки нетранслируемых повторов CAG вредны для трансгенных мышей. ПЛОС Один. 2011;6:e16417. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Mykowska A, Sobczak K, Wojciechowska M, Kozlowski P, Krzyzosiak WJ. Повторы CAG имитируют повторы CUG при неправильной регуляции альтернативного сплайсинга. Нуклеиновые Кислоты Res. 2011 (doi: 10.1093/nar/gkr1608; epub перед печатью; 27 июля 2011 г.) [бесплатная статья PMC] [PubMed] [Google Scholar]
Mykowska A, Sobczak K, Wojciechowska M, Kozlowski P, Krzyzosiak WJ. Повторы CAG имитируют повторы CUG при неправильной регуляции альтернативного сплайсинга. Нуклеиновые Кислоты Res. 2011 (doi: 10.1093/nar/gkr1608; epub перед печатью; 27 июля 2011 г.) [бесплатная статья PMC] [PubMed] [Google Scholar]
13. Zu T, Gibbens B, Doty NS, Gomes-Pereira M, Huguet A, Stone MD, Margolis J, Peterson M, Markowski TW, Ingram MA, et al. Трансляция, не инициируемая ATG, направляется микросателлитными расширениями. проц. Натл акад. науч. США. 2011; 108: 260–265. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Boudreau RL, Rodriguez-Lebron E, Davidson BL. Медицина РНК-интерференции для мозга: прогресс и проблемы. Гум. Мол. Жене. 2011; 20: Р21–27. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15. Денован-Райт Э.М., Дэвидсон Б.Л. РНК-интерференция: потенциальная терапия заболеваний с доминантно наследуемым нуклеотидным повтором. Джин Тер. 2006; 13: 525–531. [PubMed] [Академия Google]
16. Шолефилд Дж., Вуд М.Дж. Стратегии терапевтического молчания генов при полиглутаминовых расстройствах. Тенденции Жене. 2010;26:29–38. [PubMed] [Google Scholar]
Шолефилд Дж., Вуд М.Дж. Стратегии терапевтического молчания генов при полиглутаминовых расстройствах. Тенденции Жене. 2010;26:29–38. [PubMed] [Google Scholar]
17. Тот Г., Гаспари З., Юрка Дж. Микросателлиты в различных эукариотических геномах: обзор и анализ. Геном Res. 2000; 10:967–981. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Эллегрен Х. Микросателлиты: простые последовательности со сложной эволюцией. Нац. Преподобный Жене. 2004; 5: 435–445. [PubMed] [Академия Google]
19. Маттик Дж.С. Функциональная геномика некодирующих РНК. Наука. 2005; 309:1527–1528. [PubMed] [Google Scholar]
20. Dinger ME, Pang KC, Mercer TR, Crowe ML, Grimmond SM, Mattick JS. NRED: база данных экспрессии длинных некодирующих РНК. Нуклеиновые Кислоты Res. 2009; 37: Д122–Д126. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Jasinska A, Krzyzosiak WJ. Повторяющиеся последовательности, формирующие транскриптом человека. ФЭБС лат. 2004; 567: 136–141. [PubMed] [Google Scholar]
22. Krzyzosiak WJ, Sobczak K, Napierala M. In: Генетическая нестабильность и неврологические заболевания. Уэллс Р.Д., Ашизава Т., редакторы. 2006. 2-е изд. Elsevier Academic Press, Сан-Диего, Калифорния, стр. 705–713. [Академия Google]
Krzyzosiak WJ, Sobczak K, Napierala M. In: Генетическая нестабильность и неврологические заболевания. Уэллс Р.Д., Ашизава Т., редакторы. 2006. 2-е изд. Elsevier Academic Press, Сан-Диего, Калифорния, стр. 705–713. [Академия Google]
23. Ясинска А., Михлевски Г., де Мезер М., Собчак К., Козловски П., Напьерала М., Кржизосяк В.Я. Структуры тринуклеотидных повторов в транскриптах человека и их функциональное значение. Нуклеиновые Кислоты Res. 2003; 31: 5463–5468. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Kashi Y, King DG. Простые последовательности повторяются как выгодные мутаторы в эволюции. Тенденции Жене. 2006; 22: 253–259. [PubMed] [Google Scholar]
25. Субраманиан С., Мишра Р.К., Сингх Л. Полногеномный анализ микросателлитных повторов у человека: их изобилие и плотность в определенных областях генома. Геном биол. 2003;4:R13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Astolfi P, Bellizzi D, Sgaramella V. Частота и охват тринуклеотидных повторов у эукариот. Ген. 2003; 317: 117–125. [PubMed] [Google Scholar]
Ген. 2003; 317: 117–125. [PubMed] [Google Scholar]
27. Bacolla A, Larson JE, Collins JR, Li J, Milosavljevic A, Stenson PD, Cooper DN, Wells RD. Обилие и длина простых повторов в геномах позвоночных определяются их структурными свойствами. Геном Res. 2008;18:1545–1553. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Борстник Б., Пумперник Д. Тандемные повторы в кодирующих белок участках генов приматов. Геном Res. 2002;12:909–915. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Kozlowski P, de Mezer M, Krzyzosiak WJ. Тринуклеотидные повторы в геноме и экзоме человека. Нуклеиновые Кислоты Res. 2010;38:4027–4039. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Madsen BE, Villesen P, Wiuf C. Короткие тандемные повторы в экзонах человека: мишень для патологических мутаций. Геномика BMC. 2008;9:410. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Молла М., Делчер А., Сюняев С., Кантор С., Касиф С. Смещение длины триплетных повторов и вариации в транскриптоме человека. проц. Натл акад. науч. США. 2009 г.;106:17095–17100. [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл акад. науч. США. 2009 г.;106:17095–17100. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Пумперник Д., Облак Б., Борстник Б. Проскальзывание репликации в сравнении со скоростью точечных мутаций в коротких тандемных повторах генома человека. Мол. Жене. Геномика. 2008; 279: 53–61. [PubMed] [Google Scholar]
33. Stallings RL. Распределение тринуклеотидных микросателлитов в различных категориях геномной последовательности млекопитающих: последствия для генетических заболеваний человека. Геномика. 1994; 21:116–121. [PubMed] [Академия Google]
34. Кларк Р.М., Бхаскар С.С., Мияхара М., Далглиш Г.Л., Бидичандани С.И. Расширение тринуклеотидных повторов GAA у млекопитающих. Геномика. 2006; 87: 57–67. [PubMed] [Google Scholar]
35. Рен Д.Д., Форгакс Э., Фондон Д.В., III, Перцемлидис А., Ченг С.Ю., Галлардо Т., Уильямс Р.С., Шохет Р.В., Минна Д.Д., Гарнер Х.Р. Повторяющиеся полиморфизмы в областях генов: фенотипические и эволюционные последствия. Являюсь. Дж. Хам. Жене. 2000;67:345–356. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Являюсь. Дж. Хам. Жене. 2000;67:345–356. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Розанска М., Собчак К., Ясинска А., Напьерала М., Качинская Д., Черни А., Козель М., Козловски П., Олейничак М., Кржизосяк В.Я. Полиморфизм CAG- и CTG-повторов в экзонах генов человека демонстрирует отчетливые особенности в расширяемых локусах. Гум. Мутат. 2007; 28: 451–458. [PubMed] [Академия Google]
37. Батленд С.Л., Девон Р.С., Хуанг И., Мид С.Л., Мейнерт А.М., Нил С.Дж., Ли С.С., Уилкинсон А., Ян Г.С., Юэн М.М. и др. CAG-кодируемый полиморфизм длины полиглутамина в геноме человека. Геномика BMC. 2007; 8:126. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Sobczak K, Krzyzosiak WJ. Паттерны прерываний повторов CAG в генах SCA1 и SCA2 в связи с нестабильностью повторов. Гум. Мутат. 2004; 24: 236–247. [PubMed] [Google Scholar]
39. Fondon JW, III, Hammock EA, Hannan AJ, King DG. Простые повторы последовательности: генетические модуляторы функций и поведения мозга. Тренды Нейроси. 2008; 31: 328–334. [PubMed] [Академия Google]
Тренды Нейроси. 2008; 31: 328–334. [PubMed] [Академия Google]
40. Fondon JW, III, Garner HR. Молекулярные истоки быстрой и непрерывной морфологической эволюции. проц. Натл акад. науч. США. 2004; 101:18058–18063. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Ричардс Р.И., Холман К., Ю С., Сазерленд Г.Р. Нестабильный элемент синдрома ломкой Х-хромосомы, p(CCG)n и другие последовательности простых тандемных повторов являются сайтами связывания для специфических ядерных белков. Гум. Мол. Жене. 1993; 2: 1429–1435. [PubMed] [Google Scholar]
42. Raca G, Siyanova EY, McMurray CT, Mirkin SM. Расширение повтора (CTG)(n) в 5'-UTR репортерного гена препятствует трансляции. Нуклеиновые Кислоты Res. 2000;28:3943–3949. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Li YC, Korol AB, Fahima T, Nevo E. Микросателлиты в генах: структура, функция и эволюция. Мол. биол. Эвол. 2004; 21: 991–1007. [PubMed] [Google Scholar]
44. Собчак К., де Мезер М. , Михлевски Г., Крол Дж., Кржизосяк В.Дж. Структура РНК тринуклеотидных повторов, связанных с неврологическими заболеваниями человека. Нуклеиновые Кислоты Res. 2003; 31: 5469–5482. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Михлевски Г., Крол Дж., Кржизосяк В.Дж. Структура РНК тринуклеотидных повторов, связанных с неврологическими заболеваниями человека. Нуклеиновые Кислоты Res. 2003; 31: 5469–5482. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Собчак К., Михлевски Г., де Мезер М., Кержек Э., Крол Дж., Олейничак М., Кержек Р., Кржизосяк В.Дж. Структурное разнообразие триплетных повторов РНК. Дж. Биол. хим. 2010; 285:12755–12764. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Мацугами А., Масима Т., Нишикава Ф., Мураками К., Нисикава С., Нода К., Йокояма Т., Катахира М. Структурный анализ r(GGA)4, обнаруженного в РНК-аптамере бычьего прионного белка. Симптом нуклеиновых кислот. сер. 2008: 179–180. [PubMed] [Google Scholar]
47. Нисикава Ф., Мураками К., Мацугами А., Катахира М., Нисикава С. Структурные исследования РНК-аптамера, содержащего повторы GGA, в ионных условиях с использованием микрочипового электрофореза, кругового дихроизма и 1D-ЯМР. Олигонуклеотиды. 2009 г. ;19:179–190. [PubMed] [Google Scholar]
;19:179–190. [PubMed] [Google Scholar]
48. Broda M, Kierzek E, Gdaniec Z, Kulinski T, Kierzek R. Термодинамическая стабильность структур РНК, образованных тринуклеотидными повторами CNG. Значение для предсказания структуры РНК. Биохимия. 2005;44:10873–10882. [PubMed] [Google Scholar]
49. Пинейро П., Скарлетт Дж., Роджер А., Роджер П.М., Мюррей А., Браун Т., Ньюбери С.Ф., Макклеллан Дж.А. Структуры повторов CUG в РНК. Возможные последствия для генетических заболеваний человека. Дж. Биол. хим. 2002; 277:35183–35190. [PubMed] [Google Scholar]
50. Khateb S, Weisman-Shomer P, Hershco I, Loeb LA, Fry M. Дестабилизация тетраплексных структур ломкой последовательности повторов X (CGG)n опосредована гомолог-консервативными домены у трех членов семейства hnRNP. Нуклеиновые Кислоты Res. 2004; 32:4145–4154. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Ofer N, Weisman-Shomer P, Shklover J, Fry M. Квадруплекс r(CGG)n, дестабилизирующий катионный порфирин TMPyP4, взаимодействует с hnRNP для повышения эффективности трансляции мРНК ломкой Х-премутации. Нуклеиновые Кислоты Res. 2009 г.;37:2712–2722. [PMC free article] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2009 г.;37:2712–2722. [PMC free article] [PubMed] [Google Scholar]
52. Zumwalt M, Ludwig A, Hagerman PJ, Dieckmann T. Вторичная структура и динамика повтора r(CGG) в мРНК ломкой X умственной отсталости 1 ( ген FMR1). РНК биол. 2007; 4: 93–100. [PubMed] [Google Scholar]
53. Kiliszek A, Kierzek R, Krzyzosiak WJ, Rypniewski W. Структурное понимание повторов CUG, содержащих «растянутое колебание U-U»: значение для миотонической дистрофии. Нуклеиновые Кислоты Res. 2009;37:4149–4156. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Mooers BH, Logue JS, Berglund JA. Структурная основа миотонической дистрофии из кристаллической структуры ХУГ повторяется. проц. Натл акад. науч. США. 2005; 102:16626–16631. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Kiliszek A, Kierzek R, Krzyzosiak WJ, Rypniewski W. Структура CAG РНК с атомарным разрешением: понимание структуры и значение для заболеваний, связанных с экспансией тринуклеотидных повторов. Нуклеиновые Кислоты Res. 2010; 38:8370–8376. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2010; 38:8370–8376. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Kiliszek A, Kierzek R, Krzyzosiak WJ, Rypniewski W. Кристаллические структуры повторов РНК CGG с последствиями для синдрома ломкой Х-ассоциированной треморатаксии. Нуклеиновые Кислоты Res. 2011 (doi: 10.1093/nar/gkr1368; epub перед печатью; 19 мая 2011 г.) [бесплатная статья PMC] [PubMed] [Google Scholar]
57. Davis BM, McCurrach ME, Taneja KL, Singer RH, Housman DE. Экспансия тринуклеотидного повтора CUG в 3'-нетранслируемой области транскриптов протеинкиназы миотонической дистрофии приводит к удержанию транскриптов в ядре. проц. Натл акад. науч. США. 1997;94:7388–7393. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Танея К.Л., МакКаррах М., Шаллинг М., Хаусман Д., Сингер Р.Х. Очаги транскриптов тринуклеотидных повторов в ядрах клеток и тканей миотонической дистрофии. Дж. Клеточная биология. 1995; 128:995–1002. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Tassone F, Beilina A, Carosi C, Albertosi S, Bagni C, Li L, Glover K, Bentley D, Hagerman PJ. Повышенный уровень мРНК FMR1 у носителей премутации обусловлен повышенной транскрипцией. РНК. 2007; 13: 555–562. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Tassone F, Beilina A, Carosi C, Albertosi S, Bagni C, Li L, Glover K, Bentley D, Hagerman PJ. Повышенный уровень мРНК FMR1 у носителей премутации обусловлен повышенной транскрипцией. РНК. 2007; 13: 555–562. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Тассоне Ф., Ивахаши С., Хагерман П.Дж. РНК FMR1 во внутриядерных включениях синдрома ломкой Х-ассоциированной тремор/атаксия (FXTAS) РНК Biol. 2004; 1:103–105. [PubMed] [Google Scholar]
61. Jin P, Zarnescu DC, Zhang F, Pearson CE, Lucchesi JC, Moses K, Warren ST. РНК-опосредованная нейродегенерация, вызванная премутацией ломкой Х-премутации rCGG, повторяется у дрозофилы. Нейрон. 2003; 39: 739–747. [PubMed] [Google Scholar]
62. Li LB, Yu Z, Teng X, Bonini NM. Токсичность РНК является компонентом дегенерации атаксина-3 у дрозофилы. Природа. 2008; 453:1107–1111. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Campuzano V, Montermini L, Lutz Y, Cova L, Hindelang C, Jiralerspong S, Trottier Y, Kish SJ, Faucheux B, Trouillas P, et al. Фратаксин снижен у пациентов с атаксией Фридрейха и связан с митохондриальными мембранами. Гум. Мол. Жене. 1997; 6: 1771–1780. [PubMed] [Google Scholar]
Фратаксин снижен у пациентов с атаксией Фридрейха и связан с митохондриальными мембранами. Гум. Мол. Жене. 1997; 6: 1771–1780. [PubMed] [Google Scholar]
64. Kim E, Napierala M, Dent SY. Гиперэкспансия повторов GAA влияет на этапы транскрипции FXN после инициации при атаксии Фридрейха. Нуклеиновые Кислоты Res. 2011 (doi: 10.1093/nar/gkr1542; epub перед печатью; 10 июля 2011 г.) [бесплатная статья PMC] [PubMed] [Google Scholar]
65. Kumari D, Biacsi RE, Usdin K. Экспансия повторов влияет как на инициацию транскрипции, так и на удлинение в клетках атаксии Фридрейха. Дж. Биол. хим. 2011; 286:4209–4215. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Punga T, Buhler M. Длинные интронные повторы GAA, вызывающие атаксию Фридрейха, препятствуют удлинению транскрипции. EMBO Мол. Мед. 2010;2:120–129. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Sutcliffe JS, Nelson DL, Zhang F, Pieretti M, Caskey CT, Saxe D, Warren ST. Метилирование ДНК подавляет транскрипцию FMR-1 при синдроме ломкой Х-хромосомы. Гум. Мол. Жене. 1992;1:397–400. [PubMed] [Google Scholar]
Гум. Мол. Жене. 1992;1:397–400. [PubMed] [Google Scholar]
68. Jiang H, Mankodi A, Swanson MS, Moxley RT, Thornton CA. Миотоническая дистрофия 1 типа связана с ядерными очагами мутантной РНК, секвестрацией мышечно-слепых белков и нарушением регуляции альтернативного сплайсинга в нейронах. Гум. Мол. Жене. 2004; 13:3079–3088. [PubMed] [Google Scholar]
69. Дочери RS, Tuttle DL, Gao W, Ikeda Y, Moseley ML, Ebner TJ, Swanson MS, Ranum LP. Увеличение функции РНК при спиноцеребеллярной атаксии 8 типа. PLoS Genet. 2009 г.;5:e1000600. [бесплатная статья PMC] [PubMed] [Google Scholar]
70. Миркин С.М. Расширяемые повторы ДНК и болезни человека. Природа. 2007; 447: 932–940. [PubMed] [Google Scholar]
71. Cooper JK, Schilling G, Peters MF, Herring WJ, Sharp AH, Kaminsky Z, Masone J, Khan FA, Delanoy M, Borchelt DR, et al. Укороченные N-концевые фрагменты хантингтина с расширенными глутаминовыми повторами образуют ядерные и цитоплазматические агрегаты в культуре клеток. Гум. Мол. Жене. 1998; 7: 783–790. [PubMed] [Академия Google]
Гум. Мол. Жене. 1998; 7: 783–790. [PubMed] [Академия Google]
72. Марш Дж.Л., Уокер Х., Тейсен Х., Чжу Ю.З., Филдер Т., Перселл Дж., Томпсон Л.М. Экспансированные полиглутаминовые пептиды сами по себе цитотоксичны по своей природе и вызывают нейродегенерацию у дрозофилы. Гум. Мол. Жене. 2000; 9:13–25. [PubMed] [Google Scholar]
73. Pearson CE. Повторите связанную инициацию трансляции, не связанную с ATG: одна ДНК, два транскрипта, семь рамок считывания, потенциально девять токсичных объектов! Генетика PLoS. 2011;7:e1002018. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74. Батра Р., Чаризанис К., Суонсон М.С. Соучастники преступления: двунаправленная транскрипция при нестабильной микросателлитной болезни. Гум. Мол. Жене. 2010;19:R77–R82. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Wilburn B, Rudnicki DD, Zhao J, Weitz TM, Cheng Y, Gu X, Greiner E, Park CS, Wang N, Sopher BL, et al. Транскрипт антисмыслового CAG-повтора в локусе JPh4 опосредует расширенную токсичность полиглутаминового белка у мышей с болезнью Хантингтона 2. Нейрон. 2011;70:427–440. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нейрон. 2011;70:427–440. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Chung DW, Rudnicki DD, Yu L, Margolis RL. Природный антисмысловой транскрипт в локусе повторов болезни Гентингтона регулирует экспрессию HTT. Гум. Мол. Жене. 2011;20:3467–3477. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Ю З., Тенг С., Бонини Н.М. siРНК, полученные из триплетных повторов, усиливают РНК-опосредованную токсичность в модели миотонической дистрофии у дрозофилы. Генетика PLoS. 2011;7:e1001340. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Lawlor KT, O'Keefe LV, Samaraweera SE, van Eyk CL, McLeod CJ, Maloney CA, Dang TH, Suter CM, Richards RI. Двухцепочечная РНК является патогенной в моделях нейродегенеративных заболеваний с расширенными повторами у дрозофилы. Гум. Мол. Жене. 2011 г. (doi: 10.1093/hmg/ddr1292; epub перед печатью; 15 июля 2011 г.) [PubMed] [Google Scholar]
79. Напьерала М., Кржизосяк В.Дж. Повторы CUG, присутствующие в РНК миотонинкиназы, образуют метастабильные «скользкие» шпильки. Дж. Биол. хим. 1997; 272:31079–31085. [PubMed] [Google Scholar]
Дж. Биол. хим. 1997; 272:31079–31085. [PubMed] [Google Scholar]
80. Эресманн С., Баудин Ф., Мугель М., Ромби П., Эбель Дж. П., Эресманн Б. Исследование структуры РНК в растворе. Нуклеиновые Кислоты Res. 1987; 15:9109–9128. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Krzyzosiak WJ, Marciniec T, Wiewiorowski M, Romby P, Ebel JP, Giege R. Характеристика индуцированного свинцом (II) расщепления тРНК в растворе и эффект удаления Y-основания в тРНК дрожжей. Биохимия. 1988;27:5771–5777. [PubMed] [Google Scholar]
82. Ciesiolka J, Michalowski D, Wrzesinski J, Krajewski J, Krzyzosiak WJ. Паттерны расщеплений, индуцированных ионами свинца, в определенных мотивах вторичной структуры РНК. Дж. Мол. биол. 1998; 275: 211–220. [PubMed] [Google Scholar]
83. Miller JW, Urbinati CR, Teng-Umnuay P, Stenberg MG, Byrne BJ, Thornton CA, Swanson MS. Рекрутирование мышечно-слепых белков человека в (CUG)(n) экспансию, связанную с миотонической дистрофией. EMBO J. 2000; 19: 4439–4448. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Собчак К., Кржизосяк В.Я. Несовершенные повторы CAG образуют разнообразные структуры в транскриптах SCA1. Дж. Биол. хим. 2004; 279:41563–41572. [PubMed] [Google Scholar]
85. Michlewski G, Krzyzosiak WJ. Молекулярная архитектура CAG повторяется в транскриптах, связанных с заболеваниями человека. Дж. Мол. биол. 2004; 340: 665–679. [PubMed] [Google Scholar]
86. Napierala M, Michalowski D, de Mezer M, Krzyzosiak WJ. Легкая регуляция структуры мРНК FMR1 за счет прерываний в повторах CGG. Нуклеиновые Кислоты Res. 2005; 33: 451–463. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Собчак К., Кржизосяк В.Я. CAG-повторы, содержащие CAA-прерывания, образуют разветвленные структуры шпилек в транскриптах спиноцеребеллярной атаксии 2 типа. Дж. Биол. хим. 2005; 280:3898–3910. [PubMed] [Google Scholar]
88. де Мезер М., Войцеховска М., Напьерала М., Собчак К., Кржизосяк В.Дж. Мутантные повторы CAG транскрипта Huntingtin сворачиваются в шпильки, образуют ядерные очаги и являются мишенями для РНК-интерференции. Нуклеиновые Кислоты Res. 2011;39:3852–3863. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2011;39:3852–3863. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Каргинов Ф.В., Челуфи С., Чонг М.М., Старк А., Смит А.Д., Хэннон Г.Дж. Разнообразные сайты эндонуклеолитического расщепления в транскриптоме млекопитающих зависят от микроРНК, Drosha и дополнительных нуклеаз. Мол. Клетка. 2010; 38: 781–788. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Андервуд Дж. Г., Узилов А. В., Кацман С., Онодера С. С., Майнцер Дж. Э., Мэтьюз Д. Х., Лоу Т. М., Салама С. Р., Хаусслер Д. FragSeq: структура РНК в масштабе всего транскриптома зондирование с использованием высокопроизводительного секвенирования. Нац. Методы. 2010;7:995–1001. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Licatalosi DD, Mele A, Fak JJ, Ule J, Kayikci M, Chi SW, Clark TA, Schweitzer AC, Blume JE, Wang X, et al. HITS-CLIP позволяет получить полное представление об альтернативном процессинге РНК в мозге по всему геному. Природа. 2008; 456: 464–469. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Pearson CE, Eichler EE, Lorenzetti D, Kramer SF, Zoghbi HY, Nelson DL, Sinden RR. Прерывания в триплетных повторах SCA1 и FRAXA снижают склонность и сложность образования ДНК с выскальзыванием (S-DNA). Биохимия. 1998;37:2701–2708. [PubMed] [Google Scholar]
Pearson CE, Eichler EE, Lorenzetti D, Kramer SF, Zoghbi HY, Nelson DL, Sinden RR. Прерывания в триплетных повторах SCA1 и FRAXA снижают склонность и сложность образования ДНК с выскальзыванием (S-DNA). Биохимия. 1998;37:2701–2708. [PubMed] [Google Scholar]
93. Kino Y, Mori D, Oma Y, Takeshita Y, Sasagawa N, Ishiura S. Мышечно-слепой белок, MBNL1/EXP, специфически связывается с повторами CHHG. Гум. Мол. Жене. 2004; 13: 495–507. [PubMed] [Google Scholar]
94. Jin P, Duan R, Qurashi A, Qin Y, Tian D, Rosser TC, Liu H, Feng Y, Warren ST. Pur alpha связывается с повторами rCGG и модулирует опосредованную повторами нейродегенерацию в модели дрозофилы с синдромом ломкого Х-тремора/атаксия. Нейрон. 2007; 55: 556–564. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Тимченко Л.Т., Миллер Дж.В., Тимченко Н.А., Девор Д.Р., Датар К.В., Лин Л., Робертс Р., Каски КТ, Суонсон М.С. Идентификация РНК-связывающего белка (CUG) n триплетных повторов и его экспрессия при миотонической дистрофии. Нуклеиновые Кислоты Res. 1996; 24:4407–4414. [PMC бесплатная статья] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 1996; 24:4407–4414. [PMC бесплатная статья] [PubMed] [Google Scholar]
96. Тимченко Н.А., Цай З.Дж., Велм А.Л., Редди С., Ашизава Т., Тимченко Л.Т. РНК CUG повторяет секвестр CUGBP1 и изменяет уровни белка и активность CUGBP1. Дж. Биол. хим. 2001; 276:7820–7826. [PubMed] [Академия Google]
97. de Haro M, Al-Ramahi I, De Gouyon B, Ukani L, Rosa A, Faustino NA, Ashizawa T, Cooper TA, Botas J. MBNL1 и CUGBP1 модифицируют расширенную CUG-индуцированную токсичность в модели миотонического дистрофия 1 типа. Гум. Мол. Жене. 2006;15:2138–2145. [PubMed] [Google Scholar]
98. Michalowski S, Miller JW, Urbinati CR, Paliouras M, Swanson MS, Griffith J. Визуализация двухцепочечных РНК из гена протеинкиназы миотонической дистрофии и взаимодействия с CUG-связывающим белком. Нуклеиновые Кислоты Res. 1999;27:3534–3542. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Fardaei M, Larkin K, Brook JD, Hamshere MG. In vivo совместная локализация белка MBNL с транскриптами расширенных повторов DMPK.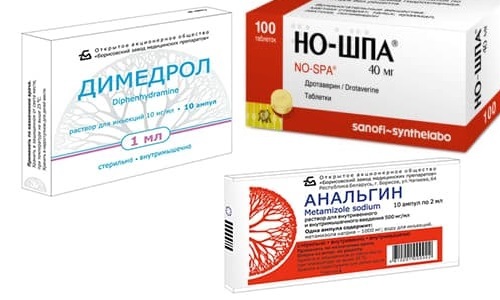 Нуклеиновые Кислоты Res. 2001; 29: 2766–2771. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2001; 29: 2766–2771. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. Lin X, Miller JW, Mankodi A, Kanadia RN, Yuan Y, Moxley RT, Swanson MS, Thornton CA. Нарушение MBNL1-зависимых постнатальных переходов сплайсинга при миотонической дистрофии. Гум. Мол. Жене. 2006; 15: 2087–209.7. [PubMed] [Google Scholar]
101. Cardani R, Mancinelli E, Rotondo G, Sansone V, Meola G. Ядерная секвестрация белка 1, подобного мышечной слепоте, является маркером молекулярной патологии СД1 и СД2. Евро. Дж. Гистохим. 2006; 50: 177–182. [PubMed] [Google Scholar]
102. Канадия Р.Н., Джонстон К.А., Манкоди А., Лунгу С., Торнтон К.А., Эссон Д., Тиммерс А.М., Хаусвирт В.В., Суонсон М.С. Модель нокаута мышечной слепоты для миотонической дистрофии. Наука. 2003; 302:1978–1980. [PubMed] [Академия Google]
103. Юань Ю, Комптон С.А., Собчак К., Стенберг М.Г., Торнтон К.А., Гриффит Д.Д., Суонсон М.С. Muscleblind-like 1 взаимодействует со шпильками РНК при сплайсинге РНК-мишени и патогенной РНК. Нуклеиновые Кислоты Res. 2007; 35: 5474–5486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res. 2007; 35: 5474–5486. [Бесплатная статья PMC] [PubMed] [Google Scholar]
104. Ho TH, Savkur RS, Poulos MG, Mancini MA, Swanson MS, Cooper TA. Колокализация мышечной слепоты с очагами РНК отлична от неправильной регуляции альтернативного сплайсинга при миотонической дистрофии. Дж. Клеточные науки. 2005; 118: 2923–2933. [PubMed] [Академия Google]
105. Тянь Б., Уайт Р.Дж., Ся Т., Уэлле С., Тернер Д.Х., Мэтьюз М.Б., Торнтон КА. Расширенные РНК с повторами CUG образуют шпильки, которые активируют двухцепочечную РНК-зависимую протеинкиназу PKR. РНК. 2000; 6: 79–87. [Бесплатная статья PMC] [PubMed] [Google Scholar]
106. Пил А.Л., Рао Р.В., Коттрелл Б.А., Хайден М.Р., Эллерби Л.М., Бредесен Д.Э. Двухцепочечная РНК-зависимая протеинкиназа, PKR, преимущественно связывается с транскриптами болезни Гентингтона (БХ) и активируется в ткани БГ. Гум. Мол. Жене. 2001; 10:1531–1538. [PubMed] [Академия Google]
107. Теплова М., Патель Д.Дж. Структурное понимание распознавания РНК регулятором альтернативного сплайсинга, подобным мышечной слепоте, MBNL1. Нац. Структура Мол. биол. 2008; 15:1343–1351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нац. Структура Мол. биол. 2008; 15:1343–1351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Sellier C, Rau F, Liu Y, Tassone F, Hukema RK, Gattoni R, Schneider A, Richard S, Willemsen R, Elliott DJ, et al. Секвестрация Sam68 и частичная потеря функции связаны с изменениями сплайсинга у пациентов с FXTAS. EMBO J. 2010; 29: 1248–1261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Ивахаши К.К., Ясуи Д.Х., Ан Х.Дж., Греко К.М., Тассоне Ф., Наннен К., Бабино Б., Лебрилла К.Б., Хагерман Р.Дж., Хагерман П.Дж. Белковый состав внутриядерных включений FXTAS. Мозг. 2006; 129: 256–271. [PubMed] [Google Scholar]
110. Sofola OA, Jin P, Qin Y, Duan R, Liu H, de Haro M, Nelson DL, Botas J. РНК-связывающие белки hnRNP A2/B1 и CUGBP1 подавляют ломкие X CGG индуцированная премутационными повторами нейродегенерация в модели FXTAS у дрозофилы. Нейрон. 2007; 55: 565–571. [Бесплатная статья PMC] [PubMed] [Google Scholar]
111. Войцеховска М., Кржизосяк В.Я.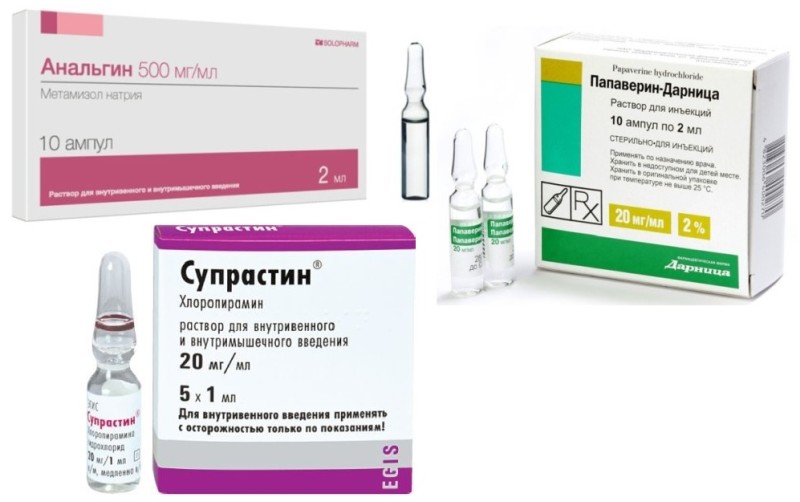 Клеточная токсичность расширенных повторов РНК: фокус на очагах РНК. Гум. Мол. Жене. 2011 (doi: 10.1093/hmg/ddr1299; epub перед печатью; 16 июля 2011 г.) [бесплатная статья PMC] [PubMed] [Google Scholar]
Клеточная токсичность расширенных повторов РНК: фокус на очагах РНК. Гум. Мол. Жене. 2011 (doi: 10.1093/hmg/ddr1299; epub перед печатью; 16 июля 2011 г.) [бесплатная статья PMC] [PubMed] [Google Scholar]
112. Савкур Р.С., Филипс А.В., Купер Т.А. Аберрантная регуляция альтернативного сплайсинга рецепторов инсулина связана с резистентностью к инсулину при миотонической дистрофии. Нац. Жене. 2001; 29:40–47. [PubMed] [Google Scholar]
113. Mankodi A, Takahashi MP, Jiang H, Beck CL, Bowers WJ, Moxley RT, Cannon SC, Thornton CA. Расширенные повторы CUG запускают аберрантный сплайсинг пре-мРНК хлоридного канала ClC-1 и повышенную возбудимость скелетных мышц при миотонической дистрофии. Мол. Клетка. 2002; 10:35–44. [PubMed] [Академия Google]
114. Ohsawa N, Koebis M, Suo S, Nishino I, Ishiura S. Альтернативный сплайсинг PDLIM3/ALP для альфа-актинин-ассоциированного белка LIM 3 является аберрантным у людей с миотонической дистрофией. Биохим. Биофиз. Рез. коммун. 2011; 409:64–69.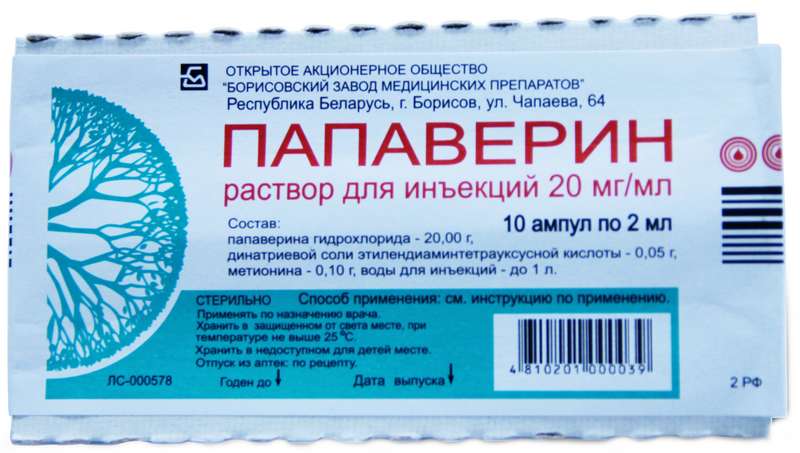 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
115. Frisch R, Singleton KR, Moses PA, Gonzalez IL, Carango P, Marks HG, Funanage VL. Влияние экспансии триплетных повторов на структуру хроматина и экспрессию DMPK и соседних генов, SIX5 и DMWD, при миотонической дистрофии. Мол. Жене. Метаб. 2001; 74: 281–29.1. [PubMed] [Google Scholar]
116. Mankodi A, Logigian E, Callahan L, McClain C, White R, Henderson D, Krym M, Thornton CA. Миотоническая дистрофия у трансгенных мышей, экспрессирующих расширенный повтор CUG. Наука. 2000; 289:1769–1773. [PubMed] [Google Scholar]
117. Seznec H, Agbulut O, Sergeant N, Savouret C, Ghestem A, Tabti N, Willer JC, Ourth L, Duros C, Brisson E, et al. Мыши, трансгенные по области миотонической дистрофии человека с расширенными повторами CTG, демонстрируют мышечные и мозговые аномалии. Гум. Мол. Жене. 2001; 10: 2717–2726. [PubMed] [Академия Google]
118. Lueck JD, Mankodi A, Swanson MS, Thornton CA, Dirksen RT. Дисфункция хлоридных каналов мышц в двух моделях миотонической дистрофии у мышей. J. Gen. Physiol. 2007; 129:79–94. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J. Gen. Physiol. 2007; 129:79–94. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Шарле Б.Н., Савкур Р.С., Сингх Г., Филипс А.В., Грайс Э.А., Купер Т.А. Потеря специфического для мышц хлоридного канала при миотонической дистрофии 1 типа из-за неправильной регуляции альтернативного сплайсинга. Мол. Клетка. 2002; 10:45–53. [PubMed] [Google Scholar]
120. Wheeler TM, Lueck JD, Swanson MS, Dirksen RT, Thornton CA. Коррекция сплайсинга ClC-1 устраняет хлоридную каналопатию и миотонию в мышиных моделях миотонической дистрофии. Дж. Клин. Инвестировать. 2007;117:3952–3957. [Бесплатная статья PMC] [PubMed] [Google Scholar]
121. Fugier C, Klein AF, Hammer C, Vassilopoulos S, Ivarsson Y, Toussaint A, Tosch V, Vignaud A, Ferry A, Messaddeq N, et al. Нарушение регуляции альтернативного сплайсинга BIN1 связано с изменениями Т-трубочек и мышечной слабостью при миотонической дистрофии. Нац. Мед. 2011;17:720–725. [PubMed] [Google Scholar]
122. Савкур Р.С., Филипс А. В., Купер Т.А., Далтон Дж.К., Мозли М.Л., Ранум Л.П., Дэй Дж.В. Изменение сплайсинга рецепторов инсулина при миотонической дистрофии 2 типа. Am. Дж. Хам. Жене. 2004;74:1309–1313. [PMC бесплатная статья] [PubMed] [Google Scholar]
В., Купер Т.А., Далтон Дж.К., Мозли М.Л., Ранум Л.П., Дэй Дж.В. Изменение сплайсинга рецепторов инсулина при миотонической дистрофии 2 типа. Am. Дж. Хам. Жене. 2004;74:1309–1313. [PMC бесплатная статья] [PubMed] [Google Scholar]
123. Филипс А.В., Тимченко Л.Т., Купер Т.А. Нарушение сплайсинга, регулируемого CUG-связывающим белком, при миотонической дистрофии. Наука. 1998; 280:737–741. [PubMed] [Google Scholar]
124. Warf MB, Berglund JA. MBNL связывает сходные РНК-структуры в CUG-повторах миотонической дистрофии и его пре-мРНК-субстрат сердечный тропонин Т. РНК. 2007; 13: 2238–2251. [Бесплатная статья PMC] [PubMed] [Google Scholar]
125. Warf MB, Diegel JV, von Hippel PH, Berglund JA. Белковые факторы MBNL1 и U2AF65 связываются с альтернативными структурами РНК, чтобы регулировать сплайсинг. проц. Натл акад. науч. США. 2009 г.;106:9203–9208. [Бесплатная статья PMC] [PubMed] [Google Scholar]
126. Dhaenens CM, Schraen-Maschke S, Tran H, Vingtdeux V, Ghanem D, Leroy O, Delplanque J, Vanbrussel E, Delacourte A, Vermersch P, et al. . Сверхэкспрессия фетальных изоформ MBNL1 и модифицированный сплайсинг тау в мозге DM1: два отдельных следствия тринуклеотидных повторов CUG. Эксп. Нейрол. 2008; 210:467–478. [PubMed] [Google Scholar]
. Сверхэкспрессия фетальных изоформ MBNL1 и модифицированный сплайсинг тау в мозге DM1: два отдельных следствия тринуклеотидных повторов CUG. Эксп. Нейрол. 2008; 210:467–478. [PubMed] [Google Scholar]
127. Уорд А.Дж., Раймер М., Киллиан Дж.М., Даулинг Дж.Дж., Купер Т.А. Сверхэкспрессия CUGBP1 в скелетных мышцах мышей воспроизводит признаки миотонической дистрофии 1 типа. Hum. Мол. Жене. 2010;19: 3614–3622. [Бесплатная статья PMC] [PubMed] [Google Scholar]
128. Machuca-Tzili L, Thorpe H, Robinson TE, Sewry C, Brook JD. Мухи с дефицитом белка Muscleblind моделируют признаки миотонической дистрофии с измененными формами сплайсинга транскриптов, связанных с Z-диапазоном. Гум. Жене. 2006; 120:487–499. [PubMed] [Google Scholar]
129. Гарсия-Лопес А., Монферрер Л., Гарсия-Альковер И., Висенте-Креспо М., Альварес-Абриль М.С., Артеро Р.Д. Генетические и химические модификаторы модели токсичности CUG у дрозофилы. ПЛОС Один. 2008;3:e1595. [Бесплатная статья PMC] [PubMed] [Google Scholar]
130. Тимченко Н.А., Патель Р., Якова П., Цай З.Дж., Цюань Л., Тимченко Л.Т. Сверхэкспрессия белка, связывающего триплетные повторы CUG, CUGBP1, у мышей ингибирует миогенез. Дж. Биол. хим. 2004; 279:13129–13139. [PubMed] [Google Scholar]
Тимченко Н.А., Патель Р., Якова П., Цай З.Дж., Цюань Л., Тимченко Л.Т. Сверхэкспрессия белка, связывающего триплетные повторы CUG, CUGBP1, у мышей ингибирует миогенез. Дж. Биол. хим. 2004; 279:13129–13139. [PubMed] [Google Scholar]
131. Кошелев М., Сарма С., Прайс Р.Е., Веренс Х.Х., Купер Т.А. Специфическая для сердца сверхэкспрессия CUGBP1 воспроизводит функциональные и молекулярные аномалии миотонической дистрофии 1 типа. Hum. Мол. Жене. 2010;19:1066–1075. [Бесплатная статья PMC] [PubMed] [Google Scholar]
132. Войцеховска М., Кржизосяк В.Я. CAG-повторы РНК как вспомогательный токсический агент при полиглутаминовых расстройствах. РНК биол. 2011; 8: 565–571. [Бесплатная статья PMC] [PubMed] [Google Scholar]
133. Wang LC, Chen KY, Pan H, Wu CC, Chen PH, Liao YT, Li C, Huang ML, Hsiao KM. Muscleblind участвует в токсичности РНК экспансированных CAG и CUG повторов у Caenorhabditis elegans. Ячейка Мол. Жизнь наук. 2011;68:1255–1267. [PubMed] [Google Scholar]
134. Caplen NJ, Taylor JP, Statham VS, Tanaka F, Fire A, Morgan RA. Спасение полиглутамин-опосредованной цитотоксичности с помощью двухцепочечной РНК-опосредованной РНК-интерференции. Гум. Мол. Жене. 2002; 11: 175–184. [PubMed] [Академия Google]
Caplen NJ, Taylor JP, Statham VS, Tanaka F, Fire A, Morgan RA. Спасение полиглутамин-опосредованной цитотоксичности с помощью двухцепочечной РНК-опосредованной РНК-интерференции. Гум. Мол. Жене. 2002; 11: 175–184. [PubMed] [Академия Google]
135. Миллер В.М., Ся Х., Маррс Г.Л., Гувион К.М., Ли Г., Дэвидсон Б.Л., Полсон Х.Л. Аллель-специфическое подавление генов доминантных болезней. проц. Натл акад. науч. США. 2003; 100:7195–7200. [Бесплатная статья PMC] [PubMed] [Google Scholar]
136. Hu J, Matsui M, Gagnon KT, Schwartz JC, Gabillet S, Arar K, Wu J, Bezprozvanny I, Corey DR. Аллель-специфическое подавление мутантных генов хантингтина и атаксина-3 путем нацеливания на расширенные повторы CAG в мРНК. Нац. Биотехнолог. 2009; 27: 478–484. [Бесплатная статья PMC] [PubMed] [Google Scholar]
137. Фишер А., Мыковска А., Кржизосяк В.Дж. Ингибирование экспрессии мутантного хантингтина с помощью дуплекса РНК, нацеленного на расширенные повторы CAG. Нуклеиновые Кислоты Res. 2011; 39: 5578–5585. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011; 39: 5578–5585. [Бесплатная статья PMC] [PubMed] [Google Scholar]
138. Xia H, Mao Q, Eliason SL, Harper SQ, Martins IH, Orr HT, Paulson HL, Yang L, Kotin RM, Davidson BL. РНКи подавляет индуцированную полиглутамином нейродегенерацию в модели спиноцеребеллярной атаксии. Нац. Мед. 2004; 10: 816–820. [PubMed] [Академия Google]
139. Крол Дж., Фишер А., Мыковска А., Собчак К., де Мезер М., Кржизосяк В.Дж. Рибонуклеаза дайсер расщепляет шпильки триплетных повторов на более короткие повторы, которые заглушают определенные мишени. Мол. Клетка. 2007; 25: 575–586. [PubMed] [Google Scholar]
140. Furling D, Doucet G, Langlois MA, Timchenko L, Belanger E, Cossette L, Puymirat J. Вирусный вектор, продуцирующий антисмысловую РНК, восстанавливает функции миотонической дистрофии миобластов. Джин Тер. 2003; 10: 795–802. [PubMed] [Google Scholar]
141. Francois V, Klein AF, Beley C, Jollet A, Lemercier C, Garcia L, Furling D. Селективное замалчивание мутировавших мРНК при DM1 с использованием модифицированных hU7-snRNAs. Нац. Структура Мол. биол. 2011;18:85–87. [PubMed] [Академия Google]
Нац. Структура Мол. биол. 2011;18:85–87. [PubMed] [Академия Google]
142. Mulders SA, van den Broek WJ, Wheeler TM, Croes HJ, van Kuik-Romeijn P, de Kimpe SJ, Furling D, Platenburg GJ, Gourdon G, Thornton CA, et al. Опосредованное триплетными повторами олигонуклеотидное обращение токсичности РНК при миотонической дистрофии. проц. Натл акад. науч. США. 2009;106:13915–13920. [Бесплатная статья PMC] [PubMed] [Google Scholar]
143. Gagnon KT, Pendergraff HM, Deleavey GF, Swayze EE, Potier P, Randolph J, Roesch EB, Chattopadhyaya J, Damha MJ, Bennett CF, et al. Аллель-селективное ингибирование экспрессии мутантного хантингтина антисмысловыми олигонуклеотидами, нацеленными на расширенный повтор CAG. Биохимия. 2010;49: 10166–10178. [Бесплатная статья PMC] [PubMed] [Google Scholar]
144. Hu J, Liu J, Corey DR. Аллель-селективное ингибирование экспрессии гентингтина путем переключения на miRNA-подобный механизм RNAi. хим. биол. 2010;17:1183–1188. [Бесплатная статья PMC] [PubMed] [Google Scholar]
145. Hu J, Gagnon KT, Liu J, Watts JK, Syeda-Nawaz J, Bennett CF, Swayze EE, Randolph J, Chattopadhyaya J, Corey DR. Аллель-селективное ингибирование экспрессии атаксина-3 (АТХ3) антисмысловыми олигомерами и дуплексными РНК. биол. хим. 2011;392: 315–325. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Hu J, Gagnon KT, Liu J, Watts JK, Syeda-Nawaz J, Bennett CF, Swayze EE, Randolph J, Chattopadhyaya J, Corey DR. Аллель-селективное ингибирование экспрессии атаксина-3 (АТХ3) антисмысловыми олигомерами и дуплексными РНК. биол. хим. 2011;392: 315–325. [Бесплатная статья PMC] [PubMed] [Google Scholar]
146. Kanadia RN, Shin J, Yuan Y, Beattie SG, Wheeler TM, Thornton CA, Swanson MS. Реверсия неправильного сплайсинга РНК и миотонии после сверхэкспрессии мышечной слепоты в мышиной поли(CUG) модели миотонической дистрофии. проц. Натл акад. науч. США. 2006; 103:11748–11753. [Бесплатная статья PMC] [PubMed] [Google Scholar]
147. Wheeler TM, Sobczak K, Lueck JD, Osborne RJ, Lin X, Dirksen RT, Thornton CA. Изменение доминирования РНК замещением белка, секвестрированного на триплетных повторах РНК. Наука. 2009 г.;325:336–339. [Бесплатная статья PMC] [PubMed] [Google Scholar]
148. Gareiss PC, Sobczak K, McNaughton BR, Palde PB, Thornton CA, Miller BL. Динамическая комбинаторная селекция молекул, способных ингибировать (CUG) повтор взаимодействия РНК-MBNL1 in vitro: открытие ведущих соединений, нацеленных на миотоническую дистрофию (DM1) J. Am. хим. соц. 2008; 130:16254–16261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Am. хим. соц. 2008; 130:16254–16261. [Бесплатная статья PMC] [PubMed] [Google Scholar]
149. Arambula JF, Ramisetty SR, Baranger AM, Zimmerman SC. Простой лиганд, который избирательно нацеливается на тринуклеотидные повторы CUG и ингибирует связывание белка MBNL. проц. Натл акад. науч. США. 2009 г.;106:16068–16073. [Бесплатная статья PMC] [PubMed] [Google Scholar]
150. Lee MM, Childs-Disney JL, Pushechnikov A, French JM, Sobczak K, Thornton CA, Disney MD. Контроль специфичности модульно собранных малых молекул для РНК с помощью расстояния между лигандными модулями: нацеливание на РНК, вызывающие миотоническую мышечную дистрофию. Варенье. хим. соц. 2009; 131:17464–17472. [Бесплатная статья PMC] [PubMed] [Google Scholar]
151. Disney MD, Lee MM, Pushechnikov A, Childs-Disney JL. Роль гибкости в рациональном дизайне модульно собранных лигандов, нацеленных на РНК, вызывающие миотонические дистрофии. Химбиохим. 2010; 11: 375–382. [Бесплатная статья PMC] [PubMed] [Google Scholar]
152. Варф М.Б., Накамори М., Маттис К.М., Торнтон К.А., Берглунд Дж.А. Пентамидин устраняет дефекты сплайсинга, связанные с миотонической дистрофией. проц. Натл акад. науч. США. 2009;106:18551–18556. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Варф М.Б., Накамори М., Маттис К.М., Торнтон К.А., Берглунд Дж.А. Пентамидин устраняет дефекты сплайсинга, связанные с миотонической дистрофией. проц. Натл акад. науч. США. 2009;106:18551–18556. [Бесплатная статья PMC] [PubMed] [Google Scholar]
153. Гарсия-Лопес А., Лламуси Б., Орзаез М., Перес-Пайя Э., Артеро Р.Д. Открытие in vivo пептида, который предотвращает образование шпильки CUG-РНК и обращает токсичность РНК в моделях миотонической дистрофии. проц. Натл акад. науч. США. 2011; 108:11866–11871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
154. Пушечников А., Ли М.М., Чайлдс-Дисней Дж.Л., Собчак К., Френч Дж.М., Торнтон К.А., Дисней М.Д. Рациональный дизайн лигандов, нацеленных на триплетные повторяющиеся транскрипты, вызывающие РНК-доминантное заболевание: применение при миотонической мышечной дистрофии 1 типа и спиноцеребеллярной атаксии 3 типа. J. Am. хим. соц. 2009; 131:9767–9779. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эндрю Дж. Кэррод, и Виктор Серый * б и Карл Берьессон * и
Кэррод, и Виктор Серый * б и Карл Берьессон * и
Принадлежности автора
* Соответствующие авторы
и Гетеборгский университет, кафедра химии и молекулярной биологии, Кемивэген 10, Гетеборг, Швеция
Электронная почта: [email protected]
б Кафедра химии - Лаборатория Ангстрема, Упсальский университет, Box 523, Уппсала, Швеция
Электронная почта: victor. [email protected]
[email protected]
Солнечная энергия — это обширный возобновляемый источник энергии, а фотогальваническая (PV) технология обеспечивает прямой путь от света к электричеству. В настоящее время PV имеют ограниченную эффективность преобразования фотонов, в основном из-за спектральных потерь. Поэтому снижение этих потерь важно с экономической и экологической точек зрения. Здесь описаны два процесса, направленные на увеличение использования солнечного света. Первый - это преобразование с повышением частоты триплет-триплетной аннигиляции (TTA-UC), посредством которого два некогерентных фотона с низкой энергией могут производить один с более высокой энергией, уменьшая потери ниже ширины запрещенной зоны. Во-вторых, синглетное деление (SF), посредством которого два триплетных состояния могут быть получены из одного начального синглетного возбужденного состояния, что теоретически позволяет два электрона на фотон в PV, уменьшая термальные потери. Эти поля часто рассматриваются отдельно, несмотря на то, что они являются обратными процессами друг друга. Эта работа направлена на объединение исследований в двух областях и выявление их сходства и общих проблем, особенно тех, которые относятся к фотоэлектрическим приложениям. Здесь мы рассматриваем системы, в основном основанные на органических малых молекулах (антрацен, рубрен, тетрацен, пентацен), и подробно описываем изготовление функциональных материалов, содержащих их (MOF, гели, SAM на TiO 9).0349 2 , тонкие напыляемые и отлитые из раствора пленки и полости). Мы также предлагаем наши рекомендации для будущей работы как в области TTA, так и в области SF, и обсуждаем необходимость устранения существующих ограничений, таких как плохая диффузия триплетов, ограниченная инжекция заряда в фотоэлектрические элементы и стабильность материала. В частности, это можно было бы сделать, выбрав идеи из других областей исследований, например, фотосенсибилизаторы для фотодинамической терапии можно было бы использовать в качестве сенсибилизаторов ТТА, а молекулы, обладающие значительной ароматичностью в возбужденном состоянии, можно было бы рассматривать как материалы SF.
Эти поля часто рассматриваются отдельно, несмотря на то, что они являются обратными процессами друг друга. Эта работа направлена на объединение исследований в двух областях и выявление их сходства и общих проблем, особенно тех, которые относятся к фотоэлектрическим приложениям. Здесь мы рассматриваем системы, в основном основанные на органических малых молекулах (антрацен, рубрен, тетрацен, пентацен), и подробно описываем изготовление функциональных материалов, содержащих их (MOF, гели, SAM на TiO 9).0349 2 , тонкие напыляемые и отлитые из раствора пленки и полости). Мы также предлагаем наши рекомендации для будущей работы как в области TTA, так и в области SF, и обсуждаем необходимость устранения существующих ограничений, таких как плохая диффузия триплетов, ограниченная инжекция заряда в фотоэлектрические элементы и стабильность материала. В частности, это можно было бы сделать, выбрав идеи из других областей исследований, например, фотосенсибилизаторы для фотодинамической терапии можно было бы использовать в качестве сенсибилизаторов ТТА, а молекулы, обладающие значительной ароматичностью в возбужденном состоянии, можно было бы рассматривать как материалы SF.