2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Российские ученые назвали привкус железа одним из возможных симптомов заболевания коронавирусом.
Как сообщает Дальневосточный Федеральный Университет, ученые ДВФУ совместно с коллегами Научно-исследовательских центров России и Японии исследовали механизм развития коронавируса, связанный с повреждением эритроцитов, которые являются главной мишенью COVID-19.
В статье, опубликованной в авторитетном немецком медицинском журнале Archiv EuroMedica, исследователи сообщают, что вирус SARS-CoV-2 может атаковать красный костный мозг, не только повреждая эритроциты, уже находящиеся в крови, но и мешая сформироваться новым.
"Ключевая мишень для вируса - эритроциты, красные кровяные тельца, отвечающие в организме за перенос насыщенного железом белка гемоглобина и связанного с ним кислорода", - говорится в сообщении.
По данным ученых, "погибшие эритроциты могут стать причиной поражения нейронов мозга, сосудов и внутренних органов, которым перестает хватать кислорода". "В тяжелых случаях может наступить полиорганная недостаточность (отказ органов), человек фактически остается без собственных эритроцитов и начинает задыхаться. Аппараты ИВЛ не помогают, поскольку кислород некому транспортировать. Для более эффективной терапии таких пациентов необходимо вводить эритроцитарную массу и витамин B12", - говорится в сообщении.
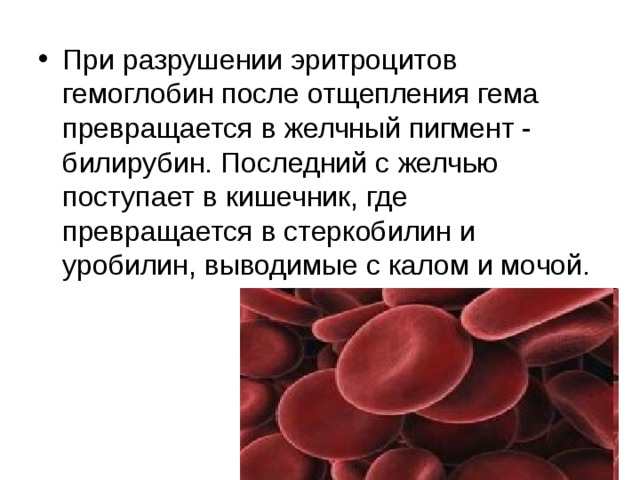
Отмечается, что "механизм восстановления поврежденных эритроцитов пока не изучен". "Преждевременный распад эритроцитов - первичная реакция на вирус SARS-CoV-2, которая постепенно приобретает каскадный характер. Пациент может узнать о патологии, почувствовав привкус железа, так как гемоглобин, высвободившийся из эритроцитов в кровотоке, выделяется со слюной", - говорится в тексте.
По словам ученых, которые приводятся в сообщении, в группе риска находятся все, у кого понижен гемоглобин. Прежде всего, это люди пожилого возраста, гипертоники, с ожирением и страдающие сахарным диабетом, беременные женщины, пациенты с первичным и приобретенным иммунодефицитом, с угнетением функции кроветворения, ВИЧ-инфицированные и онкобольные.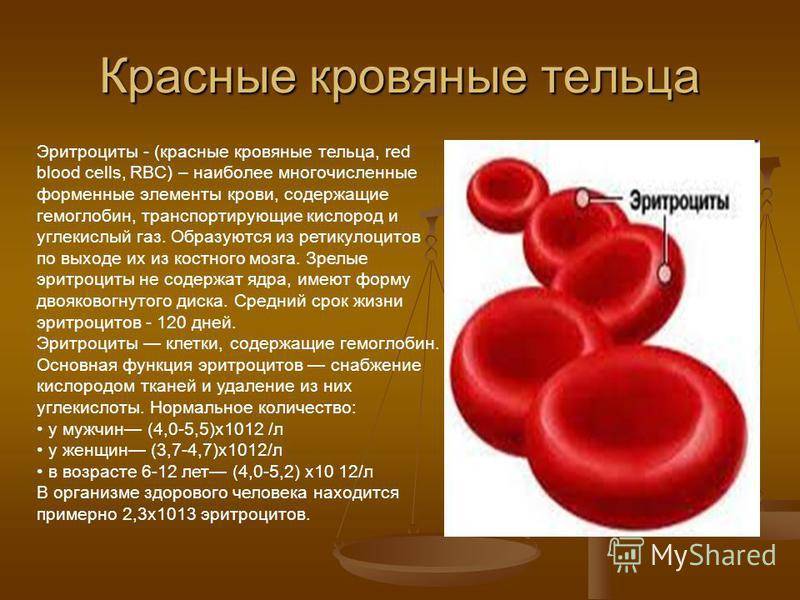
"Вирус попадает на эпителий, где размножается, а потом выходит в кровь и атакует мишени, которыми может выступать как внутренний эпителий (ЖКТ, легкие, мочеполовая система), так и эритроциты", — рассказала профессор кафедры фундаментальной медицины Школы биомедицины ДВФУ Галина Рева, слова которой приводятся в сообщении.
Она добавила, что чаще всего видна патология органов дыхания, эпителиальная клетка вирусу нужна только для размножения.
"Мы предполагаем, что главной целью для вируса становится красный костный мозг, где он повреждает эндотелий, в норме регулирующий миграцию созревающих клеток в кровь. Именно по этой причине с клетками иммунитета происходят странные вещи, а в тканях различных органов были найдены мегакариоциты – очень крупные клетки костного мозга. Мегакариоциты в норме становятся источниками тромбоцитов, отвечающих за свертываемость крови, но при COVID-19 сгущают кровь в сосудах без необходимости", - сказала профессор Рева.
По ее словам, самое очевидное проявление COVID-19 - фиброз легких, причиной которого становятся "выброшенные" в кровь мегакариоциты. Аналогичные явления могут происходить в тканях всех паренхиматозных (плотных) органов: легких, печени, селезенки, почек, поджелудочной и щитовидной железы.
Аналогичные явления могут происходить в тканях всех паренхиматозных (плотных) органов: легких, печени, селезенки, почек, поджелудочной и щитовидной железы.
"Это процесс агрессивный, хотя может быть медленным и протекать относительно доброкачественно, без клинических проявлений на фоне анемии, одышки, тахикардии (учащения пульса). При этом уменьшается количество функционально-активных клеток органов, нарастают стромальные элементы, выполняющие функции мягкого скелета. Иногда локальные изменения принимают вид крупного фиброзного образования — опухолевидного. Патология очень опасна, поскольку клинические признаки могут появиться, когда эти необратимые процессы занимают значительный объем органа", — говорит профессор Рева.
Отмечается, что в работе ученые проанализировали результаты собственных исследований образцов легких 79 скончавшихся пациентов с COVID-19 с подтверждением PCR. Группу контроля составили 14 погибших в результате травм, несовместимых с жизнью.
На следующем этапе исследований ученые проверят межклеточные связи и взаимодействия, чтобы пройти по цепочке действия вируса до конца. Это даст возможность понять, какие клетки в организме нужно стимулировать при тяжелом течении заболевания, а на что пытаться воздействовать просто бесполезно, информирует университет.
Это даст возможность понять, какие клетки в организме нужно стимулировать при тяжелом течении заболевания, а на что пытаться воздействовать просто бесполезно, информирует университет.
1. World Health Organization. [Internet]. Coronavirus disease (COVID-2019) situation reports. [cited 2020 May 30]. Доступно по ссылке: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports.
2. Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. 2020;181(2):271-280.e8. doi: 10.1016/j.cell.2020.02.052
3. Singh AK, Gupta R, Ghosh A, Misra A. Diabetes in COVID-19: Prevalence, pathophysiology, prognosis and practical considerations. Diabetes Metab Syndr Clin Res Rev. 2020;14(4):303-310. doi: 10.1016/j.dsx.2020.04.004
doi: 10.1016/j.dsx.2020.04.004
4. Bode B, Garrett V, Messler J, et al. Glycemic Characteristics and Clinical Outcomes of COVID-19 Patients Hospitalized in the United States. J Diabetes Sci Technol. 2020;14(4):813-821. doi: 10.1177/1932296820924469
5. Thaweerat W. Current evidence on pancreatic involvement in SARS-CoV-2 infection. Pancreatology. 2020;20(5):1013-1014. doi: 10.1016/j.pan.2020.05.015
6. Liao W-I, Wang J-C, Chang W-C, et al. Usefulness of Glycemic Gap to Predict ICU Mortality in Critically Ill Patients With Diabetes. Medicine (Baltimore). 2015;94(36):e1525. doi: 10.1097/MD.0000000000001525
7. Falciglia M, Freyberg RW, Almenoff PL, et al. Hyperglycemia–related mortality in critically ill patients varies with admission diagnosis. Crit Care Med. 2009;37(12):3001-3009. doi: 10.1097/CCM.0b013e3181b083f7
8. Cormio M, Barile L, Citerio G, et al. Feasibility and advantages of normothermia in patients with acute cerebral damage: preliminary results of a prospective randomised study. Crit Care. 2001;5(Suppl 1):P184. doi: 10.1186/cc1251
Crit Care. 2001;5(Suppl 1):P184. doi: 10.1186/cc1251
9. National Health Service (NHS) England. [Internet] Resources to support the safe adoption of the revised National Early Warning Score (NEWS2). [cited 2020 May 5]. Доступно по ссылке: www.england.nhs.uk/wp-content/uploads/2019/12/Patient_Safety_Alert_-_adoption_of_NEWS2.pdf
10. American diabetes association: diabetes statistics. [Internet] [cited 2020 May 5]. Доступно по ссылке: https://www.diabetes.org/resources/statistics/statistics-about-diabetes
11. Greci LS, Kailasam M, Malkani S, et al. Utility of HbA1c Levels for Diabetes Case Finding in Hospitalized Patients With Hyperglycemia. Diabetes Care. 2003;26(4):1064-1068. doi: 10.2337/diacare.26.4.1064
12. Rau C-S, Wu S-C, Chen Y-C, et al. Stress-Induced Hyperglycemia in Diabetes: A Cross-Sectional Analysis to Explore the Definition Based on the Trauma Registry Data. Int J Environ Res Public Health. 2017;14(12):1527. doi: 10.3390/ijerph24121527
13. Глыбочко П. В., Фомин В.В., Авдеев С.Н., и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке // Клин Фармакол Тер. — 2020. — Т. 29. — No2. — С. 21-29. doi: 10.32756/0869-5490-2020-2-21-29
В., Фомин В.В., Авдеев С.Н., и др. Клиническая характеристика 1007 больных тяжелой SARS-CoV-2 пневмонией, нуждавшихся в респираторной поддержке // Клин Фармакол Тер. — 2020. — Т. 29. — No2. — С. 21-29. doi: 10.32756/0869-5490-2020-2-21-29
14. Шестакова М.В., Дедов И.И. Сахарный диабет в Российской Федерации: аргументы и факты // Терапевтический архив. — 2016. — Т. 88. — No10. — С. 4-8. doi: 10.17116/terarkh301688104-8
15. Li X, Xu S, Yu M, et al. Risk factors for severity and mortality in adult COVID-19 inpatients in Wuhan. J Allergy Clin Immunol. 2020;146(1):110-118. doi: 10.1016/j.jaci.2020.04.006
16. Ceriello A. Hyperglycemia and COVID-19: What was known and what is really new? Diabetes Res Clin Pract. 2020;167(1):108383. doi: 10.1016/j.diabres.2020.108383
17. Chee YJ, Ng SJH, Yeoh E. Diabetic ketoacidosis precipitated by Covid-19 in a patient with newly diagnosed diabetes mellitus. Diabetes Res Clin Pract. 2020;164(1):108166. doi: 10.1016/j.diabres.2020.108166
18. Chee YJ, Ng SJH, Yeoh E. International Expert Committee Report on the Role of the A1C Assay in the Diagnosis of Diabetes. Diabetes Care. 2009;32(7):1327-1334. doi: h20.2337/dc09-9033
Chee YJ, Ng SJH, Yeoh E. International Expert Committee Report on the Role of the A1C Assay in the Diagnosis of Diabetes. Diabetes Care. 2009;32(7):1327-1334. doi: h20.2337/dc09-9033
19. Umpierrez GE, Hellman R, Korytkowski MT, et al. Management of Hyperglycemia in Hospitalized Patients in Non-Critical Care Setting: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2012;97(1):16-38. doi: 10.1210/jc.2011-2098
20. Kosiborod M, Inzucchi SE, Spertus JA, et al. Elevated Admission Glucose and Mortality in Elderly Patients Hospitalized With Heart Failure. Circulation. 2009;119(14):1899-1907. doi: 10.1161/CIRCULATIONAHA.108.821843
21. Singh AK, Singh R. Hyperglycemia without diabetes and new-onset diabetes are both associated with poorer outcomes in COVID-19. Diabetes Res Clin Pract. 2020;167(14):108382. doi: 10.1016/j.diabres.2020.108382
22. Mohan V, Unnikrishnan R, Anjana R. Drugs affecting HbA1c levels. Indian J Endocrinol Metab. 2012;16(4):528. doi: 10.4103/2230-8210.98004
doi: 10.4103/2230-8210.98004
23. Giugliano D. Increased glycosylated haemoglobin A1 in opiate addicts: Evidence for a hyperglycaemic effect of morphine. Diabetologia. 1982;22(5):528. doi: 10.1007/BF00253587
24. Marcovecchio ML. Complications of Acute and Chronic Hyperglycemia. US Endocrinol. 2017;13(01):17. doi: 10.17925/USE.2017.13.01.17
25. Wang Z, Du Z, Zhu F. Glycosylated hemoglobin is associated with systemic inflammation, hypercoagulability, and prognosis of COVID-19 patients. Diabetes Res Clin Pract. 2020;164(01):108214. doi: 10.1016/j.diabres.2020.108214
26. Smith SM, Boppana A, Traupman JA, et al. Impaired glucose metabolism in patients with diabetes, prediabetes, and obesity is associated with severe COVID‐19. J Med Virol. 2021;93(1):409-415. doi: 10.1002/jmv.26227
27. Bode B, Garrett V, Messler J, et al. Glycemic Characteristics and Clinical Outcomes of COVID-19 Patients Hospitalized in the United States. J Diabetes Sci Technol. 2020;14(4):813-821. doi: 10.1177/1932296820924469
doi: 10.1177/1932296820924469
28. Wenzhong L, Hualan L. COVID-19: Attacks the 1-Beta Chain of Hemoglobin and Captures the Porphyrin to Inhibit Human Heme Metabolism. ChemRxiv. 2020. doi: 10.26434/chemrxiv.11938173.v4.
29. Арутюнов Г.П., Козиолова Н.А., Тарловская Е.И., и др. Согласованная позиция экспертов Евразийской ассоциации терапевтов по некоторым новым механизмам патогенеза COVID-19: фокус на гемостаз, вопросы гемотрансфузии и систему транспорта газов крови // Кардиология. — 2020. — Т. 60. — No5. — С. 9-19. doi: 10.18087/cardio.2020.5.n1132
30. Cosic I, Cosic D, Loncarevic I. RRM Prediction of Erythrocyte Band3 Protein as Alternative Receptor for SARS-CoV-2 Virus. Appl Sci. 2020;10(11):4053. doi: 10.3390/app10114053
31. Sathish T, Mello GT, Cao Y. Is newly diagnosed diabetes a stronger risk factor then pre-existing diabetes for COVID-19 severity? J Diabetes. 2021;13(2):177-178. doi: 10.1111/1753-0407.13125
 Мол. биол. 1965; 12:118. doi: 10.1016/S0022-2836(65)80285-6. [PubMed] [CrossRef] [Google Scholar]
Мол. биол. 1965; 12:118. doi: 10.1016/S0022-2836(65)80285-6. [PubMed] [CrossRef] [Google Scholar] 2. Abdalla S., Farsaci F., Tellone E., Shirbeeny W., Hassan Aziza M., Bahabri F., Kandil S. Гликирование гемоглобина увеличивает электрические заряды на красном клетки крови: эффекты диэлектрической поляризации. Матер. хим. физ. 2022;276:125348. doi: 10.1016/j.matchemphys.2021.125348. [Перекрестная ссылка] [Академия Google]
3. Farsaci F., Tellone E., Galtieri A., Ficarra S. Термодинамическая характеристика феноменов, развивающихся при онкологической патологии путем диэлектрической релаксации в крови: новый подход путем построения TTM (Thermodynamic Tumor Matrix) J. Mol . жидкость 2020;316:113839. doi: 10.1016/j.molliq.2020.113839. [CrossRef] [Google Scholar]
4. Farsaci F., Tellone E., Galtieri A., Ficarra S. Феноменологический подход к распространению электромагнитных волн в нормальной и диабетической крови, влияние относительных макромолекулярных структур. Дж. Мол. жидкость 2019;274:577–583. doi: 10.1016/j.molliq.2018.11.003. [CrossRef] [Google Scholar]
жидкость 2019;274:577–583. doi: 10.1016/j.molliq.2018.11.003. [CrossRef] [Google Scholar]
5. Farsaci F., Ficarra S., Russo A., Galtieri A., Tellone E. Диэлектрические свойства крови больных сахарным диабетом: термодинамическая характеристика и новые перспективы альтернативных методов диагностики. Дж. Адв. Диэлектр. 2015;5:1550021. doi: 10.1142/S2010135X15500216. [CrossRef] [Google Scholar]
6. Carelli-Alinovi C., Ficarra S., Russo A., Giunta E., Barreca D., Galtieri A., Misiti F., Tellone E. Участие ацетилхолинэстеразы и протеинкиназы C в защитном действии кофеина против вызванных β-амилоидом изменений в красных кровяных тельцах. Биохимия. 2016; 121:52–59. doi: 10.1016/j.biochi.2015.11.022. [PubMed] [CrossRef] [Google Scholar]
7. Misiti F., Orsini F., Clementi M.E., Masala D., Tellone E., Galtieri A., Giardina B. Амилоидный пептид ингибирует высвобождение АТФ из эритроцитов человека. Биохим. Клеточная биол. 2008; 86: 501–508. doi: 10.1139/O08-139. [PubMed] [CrossRef] [Google Scholar]
8. Ficarra S., Tellone E., Giardina B., Scatena R., Russo A., Misiti F., Clementi M.E., Colucci D., Bellocco E., Laganà Г. и др. Нарушение эритроцитарного AE1 при бета-талассемии каспазой 3: патогенетические механизмы и последствия старения эритроцитов. Дж. Член. биол. 2009 г.;228:43–49. doi: 10.1007/s00232-009-9157-5. [PubMed] [CrossRef] [Google Scholar]
Ficarra S., Tellone E., Giardina B., Scatena R., Russo A., Misiti F., Clementi M.E., Colucci D., Bellocco E., Laganà Г. и др. Нарушение эритроцитарного AE1 при бета-талассемии каспазой 3: патогенетические механизмы и последствия старения эритроцитов. Дж. Член. биол. 2009 г.;228:43–49. doi: 10.1007/s00232-009-9157-5. [PubMed] [CrossRef] [Google Scholar]
9. Корман В.М., Мут Д., Нимейер Д., Дростен С. Хозяева и источники эндемичных коронавирусов человека. Доп. Вирус Рез. 2018;100:163–188. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Paules C.I., Marston H.D., Fauci A.S. Коронавирусные инфекции – больше, чем просто простуда. ДЖАМА. 2020; 323: 707–708. doi: 10.1001/jama.2020.0757. [PubMed] [CrossRef] [Google Scholar]
11. Wu F., Zhao S., Yu B., Chen Y.M., Wang W., Song Z.G., Hu Y., Tao Z.W., Tian J.H., Pei Y.Y., et др. Новый коронавирус, связанный с респираторным заболеванием человека в Китае. Природа. 2020;579: 265–269. doi: 10.1038/s41586-020-2008-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Gu J., Han B., Wang J. COVID-19: желудочно-кишечные проявления и потенциальная фекально-оральная передача. Гастроэнтерология. 2020;158:1518–1519. doi: 10.1053/j.gastro.2020.02.054. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Gu J., Han B., Wang J. COVID-19: желудочно-кишечные проявления и потенциальная фекально-оральная передача. Гастроэнтерология. 2020;158:1518–1519. doi: 10.1053/j.gastro.2020.02.054. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
13. Хоффманн М., Кляйне-Вебер Х., Шредер С., Крюгер Н., Херрлер Т., Эриксен С., Ширгенс Т.С., Херрлер Г. ., Wu N.H., Nitsche A., et al. Проникновение клеток SARS-CoV-2 зависит от ACE2 и TMPRSS2 и блокируется клинически доказанным ингибитором протеазы. Клетка. 2020; 181: 271–280. doi: 10.1016/j.cell.2020.02.052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Бар-Он Ю.М., Фламхольц А., Филлипс Р., Майло Р. SARS-CoV-2 (COVID-19) по номерам. Элиф. 2020;9:e57309. doi: 10.7554/eLife.57309. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
15. Нишига М., Ван Д.В., Хан Ю., Льюис Д.Б., Ву Дж.К. COVID-19 и сердечно-сосудистые заболевания: от основных механизмов к клиническим перспективам. Нац. Преподобный Кардиол. 2020;17:543. doi: 10.1038/s41569-020-0413-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2020;17:543. doi: 10.1038/s41569-020-0413-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Tay M.Z., Poh C.M., Renia L., MacAry P.A., Ng L.F.P. Троица COVID-19: Иммунитет, воспаление и вмешательство. Нац. Преподобный Иммунол. 2020; 20: 363–374. doi: 10.1038/s41577-020-0311-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Рагаб Д., Элдин Х.С., Тайма М., Хаттаб Р., Салем Р. Цитокиновый шторм COVID-19; что мы знаем до сих пор. Фронт. Иммунол. 2020;11:1446. doi: 10.3389/fimmu.2020.01446. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Бикдели Б., Мадхаван М.В., Хименес Д., Чуич Т., Дрейфус И., Дриггин Э., Нигогосян К.Д., Агено В., Маджид М., Го Ю. и др. COVID-19и тромботическая или тромбоэмболическая болезнь: последствия для профилактики, антитромботической терапии и последующего наблюдения: обзор состояния дел JACC. Варенье. Сб. Кардиол. 2020;75:2950–2973. doi: 10.1016/j.jacc.2020.04.031. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Юки К., Фудзиоги М., Кутсогианнаки С. Патофизиология COVID-19: обзор. клин. Иммунол. 2020;215:108427. doi: 10.1016/j.clim.2020.108427. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Юки К., Фудзиоги М., Кутсогианнаки С. Патофизиология COVID-19: обзор. клин. Иммунол. 2020;215:108427. doi: 10.1016/j.clim.2020.108427. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Хаваджа У.А., Шамсоддин Э., Дезидери Л.Ф., Товани-Палоне М.Р. Заражение эритроцитов SARS-CoV-2: новые доказательства [письмо] Эйнштейн. 2021;19:eCE6285. doi: 10.31744/einstein_journal/2021CE6285. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
21. Косич И., Косич Д., Лонкаревич И. Предсказание RRM белка полосы 3 эритроцитов как альтернативного рецептора для вируса SARS-CoV-2. заявл. науч. 2020;11:4053. doi: 10.3390/app10114053. [CrossRef] [Google Scholar]
22. Взлом С.М. Обмен эритроцитами на SARS-CoV-2: Близнецы терапевтических возможностей. Мед. Гипотезы. 2020;144:110227. doi: 10.1016/j.mehy.2020.110227. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Baldwin M., Russo C., Li X., Chishti A.H. Сигнальный пептидазный пептид Plasmodium falciparum расщепляет малярийный белок теплового шока 101 (HSP101). Последствия для гаметоцитогенеза. Биохим. Биофиз. Рез. коммун. 2014; 450:1427–1432. doi: 10.1016/j.bbrc.2014.07.013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Последствия для гаметоцитогенеза. Биохим. Биофиз. Рез. коммун. 2014; 450:1427–1432. doi: 10.1016/j.bbrc.2014.07.013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Томас Т., Стефанони Д., Дзецятковска М., Иссаян А., Немков Т., Хилл Р.К., Фрэнсис Р.О., Хадсон К.Е., Бюлер П.В. , Zimring J.C., et al. Доказательства повреждения структурных белков и ремоделирования мембранных липидов в эритроцитах при COVID-19пациенты. Дж. Протеом Рез. 2020;19:4455–4469. doi: 10.1021/acs.jproteome.0c00606. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Beale D., Shah R., Karpe A., Hillyer K., McAuley A., Au G., Marsh G., Vasan S. Метаболическое профилирование на бессимптомной хорьковой модели инфекции SARS-CoV-2. Метаболиты. 2021;11:327. doi: 10.3390/metabo11050327. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Божкова Д., Коста Р., Реус П., Бехтель М., Яборек М.С., Олмер Р., Мартин У., Цисек С., Михаэлис М., Чинатл Дж. Младший. Нацеливание на пентозофосфатный путь для терапии SARS-CoV-2. Метаболиты. 2021;11:699. doi: 10.3390/metabo11100699. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Метаболиты. 2021;11:699. doi: 10.3390/metabo11100699. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Бартолини Д., Стабиле А.М., Бастианелли С., Джустарини Д., Пьеруччи С., Бусти С., Вакка С., Гидари А., Франциски Д., Кастронари Р. и др. Инфекция SARSCoV2 нарушает метаболизм и окислительно-восстановительную функцию клеточного глутатиона. Редокс Биол. 2021;45:102041. doi: 10.1016/j.redox.2021.102041. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Kumar P., Osahon O., Vides D.B., Hanania N., Minard C.G., Sekhar R.V. Тяжелый дефицит глутатиона, окислительный стресс и окислительное повреждение у взрослых, госпитализированных с COVID-19: последствия применения добавок GlyNAC (глицин и N-ацетилцистеин). Антиоксиданты. 2022;11:50. doi: 10.3390/antiox11010050. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Мухаммад Ю., Кани Ю.А., Илия С., Мухаммад Дж.Б., Бинджи А., Ахмад А.Е.-Ф., Кабир М.Б., Биндава К.У., Ахмед А. Ю. Дефицит антиоксидантов и повышенный окислительный стресс у пациентов с COVID-19: поперечное сравнительное исследование в Джигава, Северо-Западная Нигерия. SAGE Open Med. 2021;9:2050312121991246. дои: 10.1177/2050312121991246. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Ю. Дефицит антиоксидантов и повышенный окислительный стресс у пациентов с COVID-19: поперечное сравнительное исследование в Джигава, Северо-Западная Нигерия. SAGE Open Med. 2021;9:2050312121991246. дои: 10.1177/2050312121991246. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Galtieri A., Tellone E., Romano L., Misiti F., Bellocco E., Ficarra S., Russo A., Di Роза Д., Кастаньола М., Джардина Б. и др. Функция белка Band-3 в эритроцитах человека: эффект оксигенации-деоксигенации. Биохим. Биофиз. Acta (BBA) Биомембрана. 2002; 1564: 214–218. doi: 10.1016/S0005-2736(02)00454-6. [PubMed] [CrossRef] [Google Scholar]
31. Tellone E., Ficarra S., Giardina B., Scatena R., Russo A., Clementi M.E., Misiti F., Bellocco E., Galtieri A. Окислительные эффекты гемфиброзила на приток анионов и метаболизм в нормальных и бета-талассемических эритроцитах, физиологические последствия. Дж. Член. биол. 2008; 224:1–8. doi: 10.1007/s00232-008-9122-8. [PubMed] [CrossRef] [Google Scholar]
32. De Rosa M.C., Carelli Alinovi C., Galtieri A., Russo A., Giardina B. Аллостерические свойства гемоглобина и плазматической мембраны эритроцита: новые взгляды на газ Транспортная и метаболическая модуляция. Жизнь ИУБМБ. 2008; 60:87–93. doi: 10.1002/iub.15. [PubMed] [CrossRef] [Google Scholar]
De Rosa M.C., Carelli Alinovi C., Galtieri A., Russo A., Giardina B. Аллостерические свойства гемоглобина и плазматической мембраны эритроцита: новые взгляды на газ Транспортная и метаболическая модуляция. Жизнь ИУБМБ. 2008; 60:87–93. doi: 10.1002/iub.15. [PubMed] [CrossRef] [Google Scholar]
33. Лю В., Ли Х. COVID-19: атакует 1-бета-цепь гемоглобина и захватывает порфирин, чтобы ингибировать метаболизм человеческого гема. биол. Мед. хим. 2020: 17–21. [Академия Google]
34. Lechuga G.C., Souza-Silva F., Sacramento C.Q., Trugilho M.R., Valente R.H., Napoleão-Pêgo P., Dias S.S., Fintelman-Rodrigues N., Temerozo J.R., Carels N., et al. Белки SARS-CoV-2 связываются с гемоглобином и его метаболитами. Междунар. Дж. Мол. науч. 2021;22:9035. doi: 10.3390/ijms22169035. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
35. Взоров А.Н., Диксон Д.В., Троммель Дж.С., Марзилли Л.Г., Компанс Р.В. Инактивация вируса иммунодефицита человека типа 1 порфиринами. Антимикроб. Агенты Чемотер. 2002;46:3917–3925. doi: 10.1128/AAC.46.12.3917-3925.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Агенты Чемотер. 2002;46:3917–3925. doi: 10.1128/AAC.46.12.3917-3925.2002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Мотта И., Бу-Фахредин Р., Тахер А.Т., Каппеллини М.Д. Бета-талассемия: новые терапевтические возможности помимо переливания и хелирования железа. Наркотики. 2020; 80: 1053–1063. doi: 10.1007/s40265-020-01341-9. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
37. Абдельзахер М.А., Ибрагим А.Е., Негм Э.М. Повышение фетального гемоглобина как возможный ключ к улучшению гипоксии и сохранению последнего дыхания при COVID-19пациент: «Постулирование гипотезы» Египет. Дж. Бронч. 2021;15:33. doi: 10.1186/s43168-021-00078-7. [CrossRef] [Google Scholar]
38. Маджид А., Шаджар М.А. Является ли гемоглобин недостающим звеном в патогенезе COVID-19? Анаст. Интенсивная терапия боли. 2020; 24:9–12. doi: 10.35975/apic.v24i1.1216. [CrossRef] [Google Scholar]
39. Хуан И.С., Бруццоне С., Бизкаргенага М., Бернардо-Сейсдедос Г., Лаин А. , Хиль-Редондо Р., Диркс Т., Хиль-Мартинес Х., Уркиса П. ., Арана Э. и др. Аномальная концентрация порфиринов в сыворотке от COVID-19пациенты. бр. Дж. Гематол. 2020;190:e265. doi: 10.1111/bjh.17060. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Хиль-Редондо Р., Диркс Т., Хиль-Мартинес Х., Уркиса П. ., Арана Э. и др. Аномальная концентрация порфиринов в сыворотке от COVID-19пациенты. бр. Дж. Гематол. 2020;190:e265. doi: 10.1111/bjh.17060. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Shoenfeld Y. Corona (COVID-19) размышления о времени: наше участие в патогенезе COVID-19, диагностике, лечении и планировании вакцин. Аутоиммун. Ред. 2020; 19:102538. doi: 10.1016/j.autrev.2020.102538. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
41. Cavezzi A., Troiani E., Corrao S. COVID-19: гемоглобин, железо и гипоксия помимо воспаления. Повествовательный обзор. клин. Практика. 2020;10:1271. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Da Costa X.J., Morrison L.A., Knipe D.M. Сравнение различных форм мутантных вирусов с дефектом репликации простого герпеса в качестве вакцин на мышиной модели генитальной инфекции ВПГ-2. Вирусология. 2001; 288: 256–263. doi: 10.1006/viro.2001. 1094. [PubMed] [CrossRef] [Google Scholar]
1094. [PubMed] [CrossRef] [Google Scholar]
43. Де Доменико И., Уорд Д.М., Каплан Дж. Регулирование гепсидина: уточнение деталей. Дж. Клин. расследование 2007; 117: 1755–1758. doi: 10.1172/JCI32701. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Анаи М., Акаике К., Ивагоэ Х., Акасака Т., Хигучи Т., Миядзаки А., Найто Д., Тадзима Ю., Такахаси Х., Комацу Т. и др. Снижение уровня гемоглобина предсказывает повышенный риск тяжелой дыхательной недостаточности у пациентов с COVID-19 с пневмонией. Дыхание расследование 2021; 59: 187–193. doi: 10.1016/j.resinv.2020.10.009. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
45. Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., Zhang L., Fan G. , Сюй Дж., Гу С. и др. Клинические особенности пациентов, инфицированных 2019 г.Новый коронавирус в Ухане, Китай. Ланцет. 2020; 395: 497–506. doi: 10.1016/S0140-6736(20)30183-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Guan W. -J., Ni Z.-Y., Hu Y., Liang W.-H., Ou C.-Q. , He J.-X., Liu L., Shan H., Lei C.-L., Hui D.S. Клинические характеристики коронавирусной болезни 2019 года в Китае. Н. англ. Дж. Мед. 2020; 382: 1708–1720. doi: 10.1056/NEJMoa2002032. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
-J., Ni Z.-Y., Hu Y., Liang W.-H., Ou C.-Q. , He J.-X., Liu L., Shan H., Lei C.-L., Hui D.S. Клинические характеристики коронавирусной болезни 2019 года в Китае. Н. англ. Дж. Мед. 2020; 382: 1708–1720. doi: 10.1056/NEJMoa2002032. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
47. Tao Z., Liu M., Wu J., Xu J., Chen W., Yang Z., Xu X., Liu L. , Чен Р., Се Дж. Анемия связана с тяжелым заболеванием при COVID-19.: ретроспективное когортное исследование. Дж. Мед. Вирол. 2020;19:1478–1488. doi: 10.1002/jmv.26444. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
48. Янг Б., Онг С., Калимуддин С., Лоу Дж., Тан С., Ло Дж., Нг О., Маримуту К. , Энг Л., Мак Т. и др. Эпидемиологические особенности и клиническое течение пациентов, инфицированных SARS-CoV-2, в Сингапуре. ДЖАМА. 2020; 323: 1488–1494. doi: 10.1001/jama.2020.3204. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
49. Де Мартино А.В., Роуз Дж.Дж., Амдал М.Б., Дент М.Р., Шах Ф. А., Бэйн В., Макверри Б.Дж., Кициос Г.Д., Техеро Дж., Гладвин М.Т. Нет доказательств повреждения гемоглобина инфекцией SARS-CoV-2. Гематология. 2020;105:2769–2773. doi: 10.3324/гематол.2020.264267. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
А., Бэйн В., Макверри Б.Дж., Кициос Г.Д., Техеро Дж., Гладвин М.Т. Нет доказательств повреждения гемоглобина инфекцией SARS-CoV-2. Гематология. 2020;105:2769–2773. doi: 10.3324/гематол.2020.264267. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Ларедо М., Курис Э., Массон-Фрон Э., Войку С., Мегарбан Б. Изменяет ли COVID-19 кривую диссоциации оксигемоглобина? Обсервационное когортное исследование с использованием моделирования смешанного эффекта. клин. хим. лаборатория Мед. (CCLM) 2021; 59: e416–e419. doi: 10.1515/cclm-2021-0387. [PubMed] [CrossRef] [Google Scholar]
51. Gille T., Sesé L., Aubourg E., Fabre E.E., Cymbalista F., Ratnam K.C., Valeyre D., Nunes H., Richalet J.P., Planès C. , и другие. Сродство гемоглобина к кислороду не изменяется во время COVID-19.. Фронт. Физиол. 2021;12:578708. doi: 10.3389/fphys.2021.578708. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Ван Д., Ху Б., Ху С., Чжу Ф., Лю С., Чжан Дж., Ван Б., Сян Х. , Ченг З., Сюн Ю. и др. Клинические характеристики 138 госпитализированных пациентов с новой коронавирусной пневмонией 2019 года в Ухане, Китай. ДЖАМА. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Ченг З., Сюн Ю. и др. Клинические характеристики 138 госпитализированных пациентов с новой коронавирусной пневмонией 2019 года в Ухане, Китай. ДЖАМА. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Zhou Z., Qiu Y., Ge X. Таксономия, диапазон хозяев и патогенность коронавирусов и других вирусов отряда Nidovirales. Аним. Дис. 2021;1:5. дои: 10.1186/s44149-021-00005-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Шолкманн Ф., Рестин Т., Феррари М., Куарезима В. Роль метгемоглобина и карбоксигемоглобина в COVID-19: обзор. Дж. Клин. Мед. 2021;10:50. doi: 10.3390/jcm10010050. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
55. Наймагон Л., Бервик С., Кесслер А., Ланкман Г., Гидвани У., Трой К. 19 пандемия. Являюсь. Дж. Гематол. 2020;95:E196–E197. doi: 10.1002/ajh.25868. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Палмер К., Дик Дж., Френч В. , Флоро Л., Форд М. Метгемоглобинемия у пациента с дефицитом G6PD и SARS-CoV-2 Инфекционное заболевание. Эмердж. Заразить. Дис. 2020;26:2279–2281. doi: 10.3201/eid2609.202353. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Флоро Л., Форд М. Метгемоглобинемия у пациента с дефицитом G6PD и SARS-CoV-2 Инфекционное заболевание. Эмердж. Заразить. Дис. 2020;26:2279–2281. doi: 10.3201/eid2609.202353. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
57. Hare GMT, Tsui AKY, Crawford JH, Patel R.P. Является ли метгемоглобин инертным свидетелем, биомаркером или медиатором окислительного стресса — пример анемии? Редокс Биол. 2013; 1:65–69. doi: 10.1016/j.redox.2012.12.003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Хурадо Р.Л. Железо, инфекции и воспалительная анемия. клин. Заразить. Дис. 1997; 25: 888–895. дои: 10.1086/515549. [PubMed] [CrossRef] [Google Scholar]
59. Ганц Т., Лонго Д.Л. Воспалительная анемия. Н. англ. Дж. Мед. 2019; 381:1148–1157. doi: 10.1056/NEJMra1804281. [PubMed] [CrossRef] [Google Scholar]
60. Мортаз Э., Малкмохаммад М., Джамаати Х., Наган П.А., Хашемиан С.М., Табарси П., Варахрам М., Захери Х., Чузин Э.Г., Фолкертс Г. , и другие. Тихая гипоксия: более высокий уровень NO в эритроцитах при COVID-19пациенты. BMC Пульм Мед. 2020;20:269. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Тихая гипоксия: более высокий уровень NO в эритроцитах при COVID-19пациенты. BMC Пульм Мед. 2020;20:269. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Лазарян Г., Кинкенель А., Беллал М., Сиавеллис Дж., Жаки К., Ре Д., Мерабет Ф., Мекинян А., Браун Т. ., Дамадж Г. и др. Аутоиммунная гемолитическая анемия, связанная с инфекцией COVID-19. бр. Дж. Гематол. 2020;190:29–31. doi: 10.1111/bjh.16794. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
62. Taneri P.E., Gómez-Ochoa S.A., Llanaj E., Raguindin P.F., Rojas L.Z., Roa-Díaz Z.M., Salvador D., Groothof D., Миндер Б., Копп-Хейм Д. и соавт. Анемия и метаболизм железа при COVID-19: систематический обзор и метаанализ. Евро. Дж. Эпидемиол. 2020; 35: 763–773. doi: 10.1007/s10654-020-00678-5. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
63. Lanser L., Burkert F.R., Bellmann-Weiler R., Schroll A., Wildner S., Fritsche G., Weiss G. Dynamics in Anemia Развитие и нарушение регуляции гомеостаза железа у госпитализированных пациентов с COVID-19. Метаболиты. 2021;11:653. doi: 10.3390/metabo11100653. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Метаболиты. 2021;11:653. doi: 10.3390/metabo11100653. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Sonnweber T., Boehm A., Sahanic S., Pizzini A., Aichner M., Sonnweber B., Kurz K., Koppelstätter S., Haschka D., Petzer V., et al. Сохраняющиеся изменения гомеостаза железа при COVID-19 связаны с неизлечимыми патологиями легких и плохой работоспособностью пациентов: проспективное обсервационное когортное исследование. Дыхание Рез. 2020;21:276. doi: 10.1186/s12931-020-01546-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
65. Zhao K., Huang J., Dai D., Feng Y., Liu L., Nie S. Уровень железа в сыворотке как потенциальный предиктор коронавирус заболевание 2019тяжесть и смертность: ретроспективное исследование. Откройте форум Infect. Дис. 2020;7:1–8. doi: 10.1093/ofid/ofaa250. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Bagnato G., Rosa D.L., Ioppolo C., Gaetano A.D., Chiappalone M., Zirilli N., Viapiana V., Tringali M. C., Tomeo S. ., Aragona C.O., et al. Индекс COVID-19 для оценки выживаемости при поступлении (CASA): 12-месячное обсервационное исследование. Фронт. Мед. 2021;8:719976. doi: 10.3389/fmed.2021.719976. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
C., Tomeo S. ., Aragona C.O., et al. Индекс COVID-19 для оценки выживаемости при поступлении (CASA): 12-месячное обсервационное исследование. Фронт. Мед. 2021;8:719976. doi: 10.3389/fmed.2021.719976. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
67. Шмидт С.М. Роль железа при вирусных инфекциях. Фронт. Бионауч. Ориентир. 2020; 25: 893–911. дои: 10.2741/4839. [PubMed] [CrossRef] [Google Scholar]
68. Рабаан А.А., Аль-Ахмед С.Х., Мухаммад Дж., Хан А., Суле А.А., Тирупати Р., Мутаир А.А., Альхумаид С., Аль-Омари А., Дхаван М. и др. Роль воспалительных цитокинов у пациентов с COVID-19: обзор молекулярных механизмов, иммунных функций, иммунопатологии и иммуномодулирующих препаратов для борьбы с цитокиновым штормом. Вакцина. 2021;9:436. doi: 10.3390/vaccines36. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
69. Camaschella C., Nai A., Silvestri L. Метаболизм железа и нарушения железа в эпоху гепсидина. Гематология. 2020;105:260–272. doi: 10.3324/гематол.2019.232124. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
doi: 10.3324/гематол.2019.232124. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
70. Эхсани С. COVID-19 и дисрегуляция железа: отдаленное сходство последовательностей между гепсидином и гликопротеином шипа нового коронавируса. биол. Прямой. 2020;15:19. doi: 10.1186/s13062-020-00275-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
71. Bellmann-Weiler R., Lanser L., Barket R., Rangger L., Schapfl A., Schaber M., Fritsche G., Wöll E., Weiss G. Распространенность и прогностическая ценность анемии и нарушения регуляции гомеостаза железа у пациентов с инфекцией COVID-19. Дж. Клин. Мед. 2020;9:2429. doi: 10.3390/jcm9082429. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Mancilha E.M.B., de Oliveira J.S.R. Ассоциация SARS-CoV-2 с метаболизмом гемоглобина и железа. Преподобный доц. Мед. Бюстгальтеры. 2021;67:1349–1352. doi: 10.1590/1806-9282.20210555. [PubMed] [CrossRef] [Google Scholar]
73. Шах А., Фрост Дж. Н., Аарон Л. , Донован К., Дрейксмит Х. Системная гипоферремия и тяжесть гипоксической дыхательной недостаточности при COVID-19. крит. Забота. 2020;24:320. doi: 10.1186/s13054-020-03051-w. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
, Донован К., Дрейксмит Х. Системная гипоферремия и тяжесть гипоксической дыхательной недостаточности при COVID-19. крит. Забота. 2020;24:320. doi: 10.1186/s13054-020-03051-w. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
74. Ян Ю., Бажин А.В., Вернер Дж., Караханова С. Активные формы кислорода в иммунной системе. Междунар. Преподобный Иммунол. 2013; 32: 249–270. дои: 10.3109/08830185.2012.755176. [PubMed] [CrossRef] [Google Scholar]
75. Виоли Ф., Олива А., Кангеми Р., Чеккарелли Г., Пиньятелли П., Карневале Р., Каммисотто В., Лихтнер М., Алессандри Ф., Де Анджелис М. и др. Активация Nox2 при COVID-19. Редокс Биол. 2020;36:101655. doi: 10.1016/j.redox.2020.101655. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Damiano S., Sozio C., La Rosa G., Santillo M. NOX-зависимая сигнальная дисрегуляция при тяжелой форме COVID-19: ключи к эффективному лечению . Фронт. Клетка. Заразить. микробиол. 2020;10:608435. дои: 10.3389/fcimb.2020.608435. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
[PMC free article] [PubMed] [CrossRef] [Google Scholar]
77. Klok F.A., Kruip MJHA, van der Meer NJM, Arbous M.S., Gommers D.A.M.P.J., Kant K.M., Kaptein F.H.J., van Paassen J., Stals, M.A. Хуисман М.В. и соавт. Частота тромботических осложнений у пациентов в критическом состоянии с COVID-19 в отделении интенсивной терапии. Рез. Тромб. 2020;191:145–147. doi: 10.1016/j.thromres.2020.04.013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
78. Varga Z., Flammer A.J., Steiger P., Haberecker M., Andermatt R., Zinkernagel A.S., Mehra M.R., Schuepbach R.A., Ruschitzka F. , Мок Х. и др. Инфекция эндотелиальных клеток и эндотелиит при COVID-19. Ланцет. 2020;395:1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
79. Дельгадо-Рош Л., Места Ф. Окислительный стресс как ключевой фактор в развитии тяжелого острого респираторного синдрома коронавирусной инфекции (SARS-CoV). Арка Мед. Рез. 2020; 51: 384–387. doi: 10. 1016/j.arcmed.2020.04.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
1016/j.arcmed.2020.04.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
80. Fratta Pasini A.M., Stranieri C., Girelli D., Busti F., Cominacini L. Является ли ферроптоз ключевым компонентом процесса, приводящего к полиорганному повреждению в COVID-19? Антиоксиданты. 2021;10:1677. doi: 10.3390/antiox10111677. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
81. Хомич О.А., Кочетков С.Н., Бартош Б., Иванов А.В. Редокс-биология респираторных вирусных инфекций. Вирусы. 2018;10:392. doi: 10.3390/v10080392. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
82. Аматоре Д., Сгарбанти Р., Аквилано К., Бальделли С., Лимонги Д., Чивителли Л., Ненсиони Л., Гарачи Э. , Чириоло М.Р., Паламара А.Т. Репликация вируса гриппа в эпителиальных клетках легких зависит от окислительно-восстановительных путей, активируемых АФК, производными NOX4. Клеточная микробиология. 2015;17:131–145. doi: 10.1111/cmi.12343. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
83. Абухашем А.С., Сингх К., Аззази Х.М.Э., Сен С.К. Связаны ли низкоальвеолярные клетки SOD3 типа II в легких пожилых людей с наблюдаемой тяжестью COVID-19? Антиоксидный окислительно-восстановительный сигнал. 2020; 33: 59–65. doi: 10.1089/ars.2020.8111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Абухашем А.С., Сингх К., Аззази Х.М.Э., Сен С.К. Связаны ли низкоальвеолярные клетки SOD3 типа II в легких пожилых людей с наблюдаемой тяжестью COVID-19? Антиоксидный окислительно-восстановительный сигнал. 2020; 33: 59–65. doi: 10.1089/ars.2020.8111. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
84. Suhail S., Zajac J., Fossum C., Lowater H., McCracken C., Severson N., Laatsch B., Narkiewicz-Jodko А., Джонсон Б., Либау Дж. и др. Роль окислительного стресса в отношении SARS-CoV (ТОРС) и SARS-CoV-2 (COVID-19).) инфекции: Обзор. Протеин Дж. 2020; 39: 644–656. doi: 10.1007/s10930-020-09935-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
85. Полоников А. Эндогенный дефицит глутатиона как наиболее вероятная причина тяжелых проявлений и смерти у больных COVID-19. Заражение АКС. Дис. 2020; 6: 1558–1562. doi: 10.1021/acsinfecdis.0c00288. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
86. Horowitz R.I., Freeman P.R., Bruzzese J. Эффективность терапии глутатионом в облегчении одышки, связанной с COVID-19пневмония: отчет о двух случаях. Дыхание Мед. Отчет по делу 2020; 30:101063. doi: 10.1016/j.rmcr.2020.101063. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дыхание Мед. Отчет по делу 2020; 30:101063. doi: 10.1016/j.rmcr.2020.101063. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
87. Доган С., Бал Т., Чабалак М., Дикмен Н., Якуби Х., Озджан О. Индекс окислительного стресса может быть новым маркером связаны с тяжестью заболевания при COVID-19. Турок. Дж. Биохим. 2021; 46: 349–357. doi: 10.1515/tjb-2021-0013. [CrossRef] [Google Scholar]
88. Renoux C., Fort R., Nader E., Boisson C., Joly P., Stauffer E., Robert M., Girard S., Cibiel A., Gauthier A. , и другие. Влияние COVID-19на реологию эритроцитов. бр. Дж. Гематол. 2021;192:e108–e111. doi: 10.1111/bjh.17306. [PubMed] [CrossRef] [Google Scholar]
89. Ней П.А., Кристофер М.М., Хеббель Р.П. Синергические эффекты окисления и деформации на утечку одновалентных катионов эритроцитов. Кровь. 1990; 75: 1192–1198. doi: 10.1182/кровь.V75.5.1192.1192. [PubMed] [CrossRef] [Google Scholar]
90. Wang Q., Zennadi R. Окислительный стресс и тромбоз при старении: роль окислительного стресса в эритроцитах при венозном тромбозе, Интервал . Дж. Мол. науч. 2020;21:4259. doi: 10.3390/ijms21124259. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж. Мол. науч. 2020;21:4259. doi: 10.3390/ijms21124259. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Griffith O.W., Stuehr D.J. Синтазы оксида азота: свойства и каталитический механизм. Анну. Преподобный Физиол. 1995; 57: 707–734. doi: 10.1146/annurev.ph.57.030195.003423. [PubMed] [CrossRef] [Google Scholar]
92. Wennmalm A., Benthin G., Petersson A.S. Зависимость метаболизма оксида азота (NO) в цельной крови здорового человека от оксигенации ее гемоглобина эритроцитов. бр. Дж. Фармакол. 1992;106:507–508. doi: 10.1111/j.1476-5381.1992.tb14365.x. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
93. Оздемир Б., Язичи А. Может ли снижение выработки эндотелиального оксида азота (NO) и биодоступности NO быть важнейшей причиной, связанной с COVID-19? летальные исходы? Мед. Гипотезы. 2020;144:109970. doi: 10.1016/j.mehy.2020.109970. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
94. Fang W., Jiang J., Su L., Shu T. , Liu H., Lai S., Ghiladi R.A., Wang J. роль NO в COVID-19и возможные терапевтические стратегии. Свободный радикал биол. Мед. 2021; 163: 153–162. doi: 10.1016/j.freeradbiomed.2020.12.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Liu H., Lai S., Ghiladi R.A., Wang J. роль NO в COVID-19и возможные терапевтические стратегии. Свободный радикал биол. Мед. 2021; 163: 153–162. doi: 10.1016/j.freeradbiomed.2020.12.008. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
95. Вилкерсон Р.Г., Адлер Дж.Д., Шах Н.Г., Браун Р. Тихая гипоксия: предвестник клинического ухудшения у пациентов с COVID-19. Являюсь. Дж. Эмерг. Мед. 2020;38:2243.e5–2243.e6. doi: 10.1016/j.ajem.2020.05.044. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
96. Тобин М.Дж., Лаги Ф., Джубран А. Почему COVID-19Тихая гипоксемия сбивает с толку врачей. Являюсь. Дж. Дыхание. крит. Уход Мед. 2020; 202: 356–360. doi: 10.1164/rccm.202006-2157CP. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
97. Connors J.M., Levy J.H. COVID-19 и его влияние на тромбоз и антикоагулянтную терапию. Кровь. 2020;135:2033–2040. doi: 10.1182/blod.2020006000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
98. Мисбах В., Макрис М. COVID-19: коагулопатия, риск тромбоза и обоснование антикоагулянтной терапии. клин. Приложение Тромб. Хемост. 2020;26:1076029620938149. doi: 10.1177/1076029620938149. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мисбах В., Макрис М. COVID-19: коагулопатия, риск тромбоза и обоснование антикоагулянтной терапии. клин. Приложение Тромб. Хемост. 2020;26:1076029620938149. doi: 10.1177/1076029620938149. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
99. Teixeira CFS, Soares C.M., Souza EA, Lisboa E.S., Pinto ICM, Andrade LR, Espiridião MA Здоровье медицинских работников, борющихся с COVID-19 пандемия. Сьен Сауд Коле. 2020;25:3465–3474. doi: 10.1590/1413-81232020259.19562020. [PubMed] [CrossRef] [Google Scholar]
100. Болен Х. Г. Оксид азота и сердечно-сосудистая система. Компр. Физиол. 2015;5:808–823. [PubMed] [Академия Google]
101. Хуан С., Хуан Л., Ван Ю., Ли С., Рен Л., Гу С., Кан Л., Го Л., Лю М., Чжоу С. и др. 6-месячные последствия COVID-19 у пациентов, выписанных из больницы: когортное исследование. Ланцет. 2021; 397: 220–232. doi: 10.1016/S0140-6736(20)32656-8. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
102. Карфи А., Бернабей Р. , Ланди Ф. Стойкие симптомы у пациентов после острого COVID-19. ДЖАМА. 2020; 324: 603–605. doi: 10.1001/jama.2020.12603. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Ланди Ф. Стойкие симптомы у пациентов после острого COVID-19. ДЖАМА. 2020; 324: 603–605. doi: 10.1001/jama.2020.12603. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
103. Маршалл М. Продолжительные страдания дальнобойщиков коронавируса. Природа. 2020; 585: 339–341. doi: 10.1038/d41586-020-02598-6. [PubMed] [CrossRef] [Google Scholar]
104. Pasini E., Corsetti G., Romano C., Scarabelli T.M., Chen-Scarabelli C., Saravolatz L., Dioguardi F.S. Метаболический профиль сыворотки у пациентов с синдромом длительного COVID (PASC): клинические последствия. Фронт. Мед. 2021;22:714426. doi: 10.3389/fmed.2021.714426. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
105. Кубанкова М., Хохбергер Б., Хоффманнс Дж., Фурст Дж., Херрманн М., Гак Дж., Кратер М. Физический фенотип клеток крови изменяется при COVID-19. Биофиз. Дж. 2021; 120: 2838–2847. doi: 10.1016/j.bpj.2021.05.025. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
106. Мисити Ф. Инфекция SARS-CoV-2 и эритроциты: последствия длительных симптомов во время упражнений. Спорт Мед. наук о здоровье. 2021; 3: 181–182. doi: 10.1016/j.smhs.2021.07.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Мисити Ф. Инфекция SARS-CoV-2 и эритроциты: последствия длительных симптомов во время упражнений. Спорт Мед. наук о здоровье. 2021; 3: 181–182. doi: 10.1016/j.smhs.2021.07.002. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
107. Дхината К. Общие изменения параметров полного анализа крови при COVID-19: обзор литературы. Дж. Мед. Здоровье. 2021; 3: 198–207. дои: 10.28932/jmh.v3i2.3097. [CrossRef] [Google Scholar]
108. Salvagno G.L., Sanchis-Gomar F., Picanza A., Lippi G. Ширина распределения эритроцитов: простой параметр с многочисленными клиническими приложениями. крит. Преподобный Клин. лаборатория науч. 2015; 52:86–105. doi: 10.3109/10408363.2014.992064. [PubMed] [CrossRef] [Google Scholar]
109. Липпи Г., Маттиуцци К., Червеллин Г. Учиться больше и тратить меньше с пренебрежением лабораторными параметрами: Парадигматический случай ширины распределения эритроцитов. Акта Биомед. 2016; 87: 323–328. [PubMed] [Академия Google]
110. Forhecz Z. , Gombos T., Borgulya G., Pozsonyi Z., Prohaszka Z., Janoskuti L. Широта распределения эритроцитов при сердечной недостаточности: прогнозирование клинических событий и взаимосвязь с маркерами неэффективного эритропоэза, воспаления, почек функции и состояния питания. Являюсь. Харт Дж. 2009; 158: 659–666. doi: 10.1016/j.ahj.2009.07.024. [PubMed] [CrossRef] [Google Scholar]
, Gombos T., Borgulya G., Pozsonyi Z., Prohaszka Z., Janoskuti L. Широта распределения эритроцитов при сердечной недостаточности: прогнозирование клинических событий и взаимосвязь с маркерами неэффективного эритропоэза, воспаления, почек функции и состояния питания. Являюсь. Харт Дж. 2009; 158: 659–666. doi: 10.1016/j.ahj.2009.07.024. [PubMed] [CrossRef] [Google Scholar]
111. О Х.Дж., Пак Дж.Т., Ким Дж.К., Ю Д.Э., Ким С.Дж., Хан С.Х., Кан С.В., Чой К.Х., Ю Т.Х. Широта распределения эритроцитов является независимым предиктором смертности у пациентов с острым повреждением почек, получающих непрерывную заместительную почечную терапию. Нефрол. Набирать номер. Пересадка. 2012;27:589–594. doi: 10.1093/ndt/gfr307. [PubMed] [CrossRef] [Google Scholar]
112. Сейхан Э.К., Озгуль М.А., Тутар Н., Омур И., Уйсал А., Алтин С. Распределение эритроцитов и выживаемость у пациентов с хронической обструктивной болезнью легких. J. Хронический Обстр. Пульм. Болезнь. 2013;10:416–424. doi: 10. 3109/15412555.2012.758697. [PubMed] [CrossRef] [Google Scholar]
3109/15412555.2012.758697. [PubMed] [CrossRef] [Google Scholar]
113. Fava C., Cattazzo F., Hu Z.D., Lippi G., Montagnana M. Роль ширины распределения эритроцитов (RDW) в оценке сердечно-сосудистого риска: полезная или шумиха? Энн. Перевод Мед. 2019;7:581. doi: 10.21037/атм.2019.09.58. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
114. Генри Б.М.л., Бенуа Дж.Л., Бенуа С., Пульвино К., Бергер Б.А., Сантос де Оливера М.Х., Кратчфилд К.А., Липпи Г. Красные кровяные тельца Ширина распространения (RDW) предсказывает тяжесть COVID-19: проспективное обсервационное исследование когорты отделения неотложной помощи SARS-CoV-2 в Цинциннати. Диагностика. 2020;10:618. doi: 10.3390/diagnostics100
. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
115. Yan B., Chu H., Yang D., Sze K.H., Lai P.M., Yuan S., Shuai H., Wang Y., Kao R.Y., Chan J.F., et al. Характеристика липидомного профиля клеток, инфицированных коронавирусом человека: значение ремоделирования липидного метаболизма при репликации коронавируса. Вирусы. 2019;11:73. doi: 10.3390/v11010073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вирусы. 2019;11:73. doi: 10.3390/v11010073. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
116. Adams K.K., Baker W.L., Sobieraj D.M. Разрушители мифов: пищевые добавки и COVID-19. Энн. фарм. 2020; 54: 820–826. дои: 10.1177/1060028020928052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
117. Quiles J.L., Rivas-García L., Varela-López A., Llopis J., Battino M., Sánchez-Gonzalez C. Do питательные вещества и другие биологически активные молекулы из пищевых продуктов могут что-то сказать в лечении COVID-19? Энвион. Рез. 2020;191:110053. doi: 10.1016/j.envres.2020.110053. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
118. Bagnato C., Perfetto C., Labanca F., Caregaro Negrin L. Средиземноморская диета: здоровое и устойчивое питание во время атипичной пневмонии. КоВ-2. Мед. Дж. Нутр. Встретились. 2021; 14: 365–381. дои: 10.3233/MNM-200597. [CrossRef] [Google Scholar]
119. Cena H., Maffoni S., Braschi V., Brazzo S. , Pallavicini C., Vietti I., Portale S., Corra E. Позиционный документ Итальянской ассоциации медицинских специалистов в области диетологии и клинического питания (ANSISA) по вопросам управления питанием пациентов с болезнью COVID-19. Мед. Дж. Нутр. Встретились. 2020;13:113–117. doi: 10.3233/MNM-200425. [CrossRef] [Google Scholar]
, Pallavicini C., Vietti I., Portale S., Corra E. Позиционный документ Итальянской ассоциации медицинских специалистов в области диетологии и клинического питания (ANSISA) по вопросам управления питанием пациентов с болезнью COVID-19. Мед. Дж. Нутр. Встретились. 2020;13:113–117. doi: 10.3233/MNM-200425. [CrossRef] [Google Scholar]
120. Нур Н., Гани А., Гани А., Шах А., Ашраф З.У. Использование полифенолов и белков с использованием наноинкапсуляции для противовирусных и стимулирующих работу мозга свойств — создание синергетической стратегии для борьбы с COVID-19пандемия. Междунар. Дж. Биол. макромол. 2021; 180: 375–384. doi: 10.1016/j.ijbiomac.2021.03.028. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
121. Gervasi T., Calderaro A., Barreca D., Tellone E., Trombetta D., Ficarra S., Smeriglio A., Mandalari G. , Гаттузо Г. Биотехнологические применения и полезные для здоровья свойства флавонолов: обновленный взгляд. Междунар. Дж. Мол. науч. 2022;23:1710. doi: 10. 3390/ijms23031710. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3390/ijms23031710. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
122. Ficarra S., Tellone E., Pirolli D., Russo A., Barreca D., Galtieri A., Giardina B., Gavezzotti P. , Рива С., Де Роса М.К. Взгляд на свойства двух энантиомеров транс-δ-виниферина, производного ресвератрола: антиоксидантная активность, исследования биохимического и молекулярного моделирования его взаимодействия с гемоглобином. Мол. Био Сист. 2016;12:1276–1286. дои: 10.1039/C5MB00897B. [PubMed] [CrossRef] [Google Scholar]
123. Tellone E., De Rosa M.C., Pirolli D., Russo A., Giardina B., Galtieri A., Ficarra S. Молекулярные взаимодействия гемоглобина с ресвератролом: потенциальное защитное действие антиоксидантная роль и метаболические адаптации эритроцитов. биол. хим. 2014; 395:347–354. doi: 10.1515/hsz-2013-0257. [PubMed] [CrossRef] [Google Scholar]
124. Tellone E., Ficarra S., Russo A., Bellocco E., Barreca D., Laganà G., Leuzzi U., Pirolli D., De Rosa M.C., Джардина Б. и др. Кофеин ингибирует нарушение мембран эритроцитов за счет антиоксидантной активности и блокирования активации каспазы 3. Биохимия. 2012;94: 393–402. doi: 10.1016/j.biochi.2011.08.007. [PubMed] [CrossRef] [Google Scholar]
Биохимия. 2012;94: 393–402. doi: 10.1016/j.biochi.2011.08.007. [PubMed] [CrossRef] [Google Scholar]
Графический абстрактный | Инфекция SARS-CoV-2 оказывает значительное влияние на эритроциты, что, по-видимому, связано с тяжестью заболевания у этих пациентов. (A) В это исследование были включены пациенты, госпитализированные не из отделений интенсивной терапии из-за тяжелого заболевания COVID-19 ( п = 36). (B) В контрольную группу вошли здоровые лица без почечной или печеночной недостаточности, без диагноза анемии или миелоидного рака, без гемотрансфузий в течение последних 3 месяцев ( n = 18). (C) Демографические данные, клинические, лабораторные данные и результаты компьютерной томографии (КТ) органов грудной клетки регистрировались при поступлении. Как у больного, так и в контрольной группе проводили гематологические исследования, стандартный биохимический анализ компонентов сыворотки крови, в группе больных оценивали коагуляционный анализ. Исследование мазка периферической крови также выполняли у всех пациентов и контрольных образцов. (D) Свободный гемоглобин плазмы и осмотическая хрупкость эритроцитов (RBC) и свободный гемоглобин (Free-Hb) после механического стресса (MECH) путем механического гемолиза оценивали как у пациентов, так и у контрольной группы. Уровни внутриклеточного (i) кальция (iCa2+), воздействие фосфатидилсерина (PS) на эритроциты, мембраносвязанные иммуноглобулины G (IgG) на эритроциты и уровни активации каспазы-3 в эритроцитах по мере клеточного клиренса и маркеров апоптоза измеряли с помощью проточной цитометрии. Для количественной оценки активности фермента G6PD использовали спектрофотометрический анализ. Внутриклеточные активные окислительные виды эритроцитов (iROS) оценивали как у пациентов, так и у контрольной группы. (E) У пациентов наблюдались повышенные маркеры гемолиза (Free-Hb) и лактатдегидрогеназы (LDH) по сравнению с контрольной группой. Эритроциты пациентов были более уязвимы к механическому стрессу и имели значительно повышенные маркеры апоптоза (iCa2+ и RBC-PS+).
Исследование мазка периферической крови также выполняли у всех пациентов и контрольных образцов. (D) Свободный гемоглобин плазмы и осмотическая хрупкость эритроцитов (RBC) и свободный гемоглобин (Free-Hb) после механического стресса (MECH) путем механического гемолиза оценивали как у пациентов, так и у контрольной группы. Уровни внутриклеточного (i) кальция (iCa2+), воздействие фосфатидилсерина (PS) на эритроциты, мембраносвязанные иммуноглобулины G (IgG) на эритроциты и уровни активации каспазы-3 в эритроцитах по мере клеточного клиренса и маркеров апоптоза измеряли с помощью проточной цитометрии. Для количественной оценки активности фермента G6PD использовали спектрофотометрический анализ. Внутриклеточные активные окислительные виды эритроцитов (iROS) оценивали как у пациентов, так и у контрольной группы. (E) У пациентов наблюдались повышенные маркеры гемолиза (Free-Hb) и лактатдегидрогеназы (LDH) по сравнению с контрольной группой. Эритроциты пациентов были более уязвимы к механическому стрессу и имели значительно повышенные маркеры апоптоза (iCa2+ и RBC-PS+). Уровни iROS в эритроцитах были значительно ниже в группе пациентов по сравнению со здоровым контролем. Это открытие, возможно, коррелирует с повышенным уровнем активности G6PDH в этой группе, что предполагает компенсаторный механизм против вируса. (F) D-димеры пациентов коррелировали с RBC-PS+, что указывает на возможный вклад эритроцитов в тромботический диатез, связанный с заболеванием SARS-CoV-2. (G) Уровни свободного Hb коррелировали с распространением легочных инфильтратов на КТ органов грудной клетки у пациентов с COVID-19. RBC-IgGs+ коррелировали с тяжестью признаков легочной КТ, а также с нарушением функции легких, выраженным отношением PO2/FiO2. Это открытие предполагает, что гипоксия может привести к старению эритроцитов.
Уровни iROS в эритроцитах были значительно ниже в группе пациентов по сравнению со здоровым контролем. Это открытие, возможно, коррелирует с повышенным уровнем активности G6PDH в этой группе, что предполагает компенсаторный механизм против вируса. (F) D-димеры пациентов коррелировали с RBC-PS+, что указывает на возможный вклад эритроцитов в тромботический диатез, связанный с заболеванием SARS-CoV-2. (G) Уровни свободного Hb коррелировали с распространением легочных инфильтратов на КТ органов грудной клетки у пациентов с COVID-19. RBC-IgGs+ коррелировали с тяжестью признаков легочной КТ, а также с нарушением функции легких, выраженным отношением PO2/FiO2. Это открытие предполагает, что гипоксия может привести к старению эритроцитов.
Пандемия SARS-CoV-2 продемонстрировала разрушительное воздействие на человечество с момента ее вспышки в 2019 году. Были предприняты серьезные усилия для описания ее патофизиологии, чтобы разработать более эффективные методы лечения. Было признано воздействие вируса на различные системы, помимо легких, включая сердце, желудочно-кишечный тракт, нервную систему, почки, свертывание крови и эндотелий (Iba et al., 2020; Puelles et al., 2020; Su et al., 2020). ). У пациентов с COVID-19 можно наблюдать различные гематологические параметры, включая лимфопению и повышенный уровень D-димеров.инфекции (Rahi et al., 2021). Сообщалось, что анемия является независимым прогностическим фактором тяжести заболевания при COVID-19 (Bellmann-Weiler et al., 2020), при этом ряд исследований неизменно показывает, что увеличение ширины распределения клеток крови Reb (RDW) предсказывает худший исход при COVID-19. пациентов (Foy et al., 2020; Banon et al., 2021; Soni and Gopalakrishnan, 2021).
Было признано воздействие вируса на различные системы, помимо легких, включая сердце, желудочно-кишечный тракт, нервную систему, почки, свертывание крови и эндотелий (Iba et al., 2020; Puelles et al., 2020; Su et al., 2020). ). У пациентов с COVID-19 можно наблюдать различные гематологические параметры, включая лимфопению и повышенный уровень D-димеров.инфекции (Rahi et al., 2021). Сообщалось, что анемия является независимым прогностическим фактором тяжести заболевания при COVID-19 (Bellmann-Weiler et al., 2020), при этом ряд исследований неизменно показывает, что увеличение ширины распределения клеток крови Reb (RDW) предсказывает худший исход при COVID-19. пациентов (Foy et al., 2020; Banon et al., 2021; Soni and Gopalakrishnan, 2021).
Эритроциты (эритроциты) являются переносчиками O 2 по всему организму и, как известно, лизируются при инфекциях, особенно при осложнении сепсисом (Bateman et al., 2017). Предыдущие исследования показали, что вирус может проникать в эритроциты посредством взаимодействия его шиповидного белка S1 с CD147 эритроцитов (Wang et al. , 2020) и белком полосы 3 (Cosic et al., 2020). Вирусный шиповидный белок и продукты активации комплемента были обнаружены на поверхности эритроцитов COVID-19.пациентов, и считается, что они влияют на реологию эритроцитов, что приводит к внутрисосудистому тромбозу и связанному с ним повреждению легких (Lam et al., 2021).
, 2020) и белком полосы 3 (Cosic et al., 2020). Вирусный шиповидный белок и продукты активации комплемента были обнаружены на поверхности эритроцитов COVID-19.пациентов, и считается, что они влияют на реологию эритроцитов, что приводит к внутрисосудистому тромбозу и связанному с ним повреждению легких (Lam et al., 2021).
Кроме того, было высказано предположение, что при инфекции COVID-19 гиперкоагуляция и воспалительное состояние могут влиять на эритроциты, делая их мембраны более хрупкими и менее эластичными (Grobler et al., 2020). Наконец, было показано, что повышенный уровень ферритина в сыворотке может вызывать гиперактивированные взаимодействия между эритроцитами и тромбоцитами при COVID-19.пациентов, что предполагает связь между изменениями эритроцитов и тромбозом при заболевании COVID-19 (Venter et al., 2020).
Целью настоящего исследования является изучение влияния SARS-CoV-2 на физиологию эритроцитов, а также их связь с тяжестью заболевания. Кроме того, это исследование направлено на выяснение возможных механизмов этой ассоциации.
Пациенты, госпитализированные в отделение интенсивной терапии (ОИТ) из-за тяжелой формы COVID-19заболевание были включены в это исследование с марта 2021 года по май 2021 года. В контрольную группу вошли пациенты без COVID-19 без почечной или печеночной недостаточности, без диагноза анемии или миелоидного злокачественного новообразования и без переливания крови за последние 3 месяца. Образцы ЭДТА и сыворотки были получены от всех участников в соответствии с протоколом исследования (пациенты с COVID-19 и контрольная группа). Корреляции лабораторных результатов с тяжестью заболевания, оцененной с помощью КТ грудной клетки, и соотношением PaO 2 /FiO 2 были выполнены при COVID-19.пациенты. КТ и определение соотношения PaO2/FiO2 выполняли при поступлении пациента. Все остальные лабораторные измерения проводились в один и тот же день в различные моменты времени госпитализации пациента. Исследование было проведено в соответствии с рекомендациями Хельсинкской декларации и одобрено Институциональным наблюдательным советом (или Комитетом по этике) Афинского национального и Каподистрийского университета (номер решения: 145/8-3-2021 от 04. 08.2021). ).
08.2021). ).
Гематологические анализы [включая количество лейкоцитов (лейкоцитов), нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов, количество эритроцитов (эритроцитов), гемоглобин (Hb), гематокрит (Hct), MCV (средний объем клеток), MCH (средний корпускулярный гемоглобин), MCHC (средняя концентрация корпускулярного гемоглобина), RDW (ширина распределения эритроцитов), PLT (количество тромбоцитов) и MPV (средний объем тромбоцитов)] и стандартный биохимический анализ компонентов сыворотки [глюкоза, мочевина, креатинин, мочевая кислота, кальций, фосфор, калий, натрий, хлор, магний, железо, ферритин, белки, альбумин, сывороточная глутамилоксалаттрансаминаза, сывороточная глутамилпируваттрансаминаза, гамма-глутамилтрансфераза, щелочная фосфатаза, общий билирубин, непрямой билирубин, прямой билирубин, амилазы, лактатдегидрогеназы (ЛДГ), высокочувствительного С-реактивного белка (СРБ) и интерлейкина-6 (ИЛ-6)] определяли как у пациента, так и в контрольной группе, а также уровни продуктов деградации поперечно-сшитого фибрина в плазме ( D-димеры) d фибриноген оценивали в группе пациентов. Исследование мазка периферической крови также проводили у всех пациентов и здоровых контрольных образцов. Образец 10 мкл крови с ЭДТА использовали для приготовления мазков крови с последующим окрашиванием по Май-Грюнвальду-Гимзе. В частности, после приготовления мазка крови его оставляли сушиться на воздухе, а затем погружали в чистый метанол для фиксации на 5 мин. Затем предметное стекло замачивали в растворе красителя по Май-Грюнвальду на 4 мин с последующим окрашиванием по Гимзе на 15 мин. Избыток красителя удаляли промыванием водой.
Исследование мазка периферической крови также проводили у всех пациентов и здоровых контрольных образцов. Образец 10 мкл крови с ЭДТА использовали для приготовления мазков крови с последующим окрашиванием по Май-Грюнвальду-Гимзе. В частности, после приготовления мазка крови его оставляли сушиться на воздухе, а затем погружали в чистый метанол для фиксации на 5 мин. Затем предметное стекло замачивали в растворе красителя по Май-Грюнвальду на 4 мин с последующим окрашиванием по Гимзе на 15 мин. Избыток красителя удаляли промыванием водой.
В группе пациентов функцию легких определяли путем измерения соотношения PO 2 /FiO 2 и процента инфильтрации грудной клетки при компьютерной томографии (КТ) (в квартилях: 1–25, 25–50, 50–75 и 75–100%). Количественную оценку распространенности легочных инфильтратов проводили с использованием шкалы визуальной оценки Covid (Arkoudis et al., 2021).
Уровни внутриклеточных АФК (iROS) и кальция (iCa 2+ ) измеряли с помощью проточной цитометрии, как описано ранее (Pavlou et al. , 2021). Для обнаружения расщепленной каспазы-3 (RBC caspase-3) эритроциты трижды промывали фосфатно-солевым буфером (PBS) и ресуспендировали в PBS с концентрацией 4% Hct. Для фиксации клеток клетки инкубировали в 0,05% растворе глутарового альдегида в течение 10 мин при комнатной температуре. Затем суспензию эритроцитов инкубировали в 0,5% растворе PBS/Tween вместе с антителом PE Rabbit против активной каспазы-3 в течение 20 минут при комнатной температуре. Реакцию останавливали добавлением раствора PBS. Антитела, используемые для проточной цитометрии, были получены от BD Biosciences (Сан-Хосе, Калифорния, США). Процент активированных каспаз-3 положительных клеток определяли с помощью проточной цитометрии на цитометре FACSCanto II (BD Biosciences, Сан-Хосе, Калифорния, США). Анализ данных был выполнен с использованием программного обеспечения BD FACSDiva™. Для каждого образца было получено не менее 30 000 событий для эритроцитов.
, 2021). Для обнаружения расщепленной каспазы-3 (RBC caspase-3) эритроциты трижды промывали фосфатно-солевым буфером (PBS) и ресуспендировали в PBS с концентрацией 4% Hct. Для фиксации клеток клетки инкубировали в 0,05% растворе глутарового альдегида в течение 10 мин при комнатной температуре. Затем суспензию эритроцитов инкубировали в 0,5% растворе PBS/Tween вместе с антителом PE Rabbit против активной каспазы-3 в течение 20 минут при комнатной температуре. Реакцию останавливали добавлением раствора PBS. Антитела, используемые для проточной цитометрии, были получены от BD Biosciences (Сан-Хосе, Калифорния, США). Процент активированных каспаз-3 положительных клеток определяли с помощью проточной цитометрии на цитометре FACSCanto II (BD Biosciences, Сан-Хосе, Калифорния, США). Анализ данных был выполнен с использованием программного обеспечения BD FACSDiva™. Для каждого образца было получено не менее 30 000 событий для эритроцитов.
Воздействие фосфатидилсерина на эритроциты (PS + эритроциты) проводили с использованием набора для апоптоза фикоэритрин (PE)-аннексин V и маркера апоптоза RBC, флуоресцеина изотиоцианата )-конъюгированное анти-CD235 (BD Biosciences, Сан-Хосе, Калифорния, США) и определяли с помощью проточной цитометрии в цитометре FACSCanto II, как описано ранее (Tzounakas et al. , 2021).
, 2021).
Для обнаружения стареющего неоантигена на поверхности эритроцитов процент эритроцитов, положительных на мембраносвязанные (иммуноглобулины G) IgG (IgG + эритроцитов). Эритроциты, ресуспендированные в растворе PBS/0,1% BSA при концентрации 0,1% Hct, инкубировали с анти-IgG, конъюгированным с флуоресцеин-изотиоцианатом (FITC) (BD Biosciences, Сан-Хосе, Калифорния, США) вместе с маркером активации эритроцитов, анти-CD235, конъюгированное с аллофикоцианином (APC), в течение 40 мин при комнатной температуре. Реакцию останавливали добавлением раствора PBS. Для каждого образца было получено не менее 30 000 событий для эритроцитов.
Свободный гемоглобин плазмы (свободный гемоглобин плазмы) рассчитывали по методу Harboe (1959). Более конкретно, после центрифугирования общей крови при 1500 g супернатант плазмы дважды центрифугировали при 1000 g в течение 10 мин. Супернатанты разводили дистиллированной водой и инкубировали при комнатной температуре в течение 30 мин.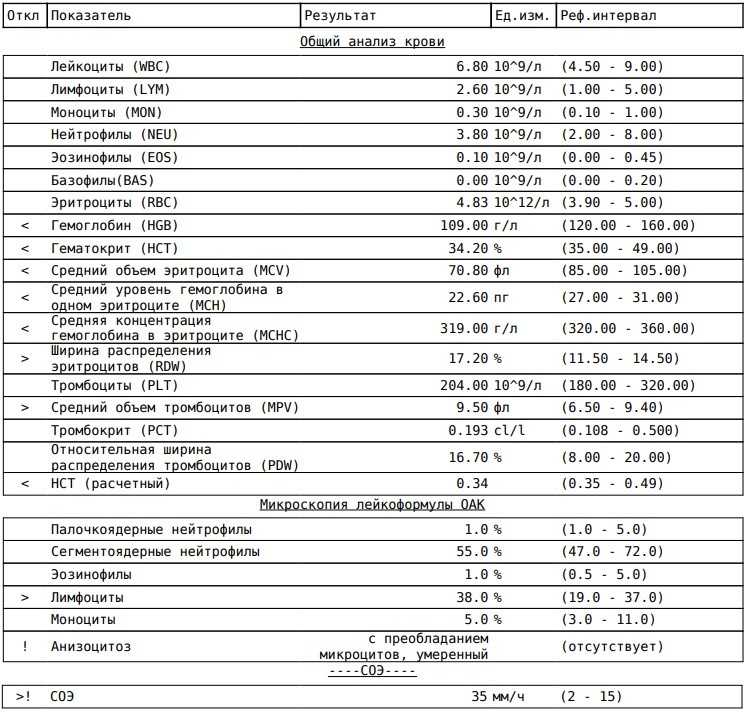 Поглощение измеряли при 380, 415 и 450 нм. Для расчета мг Hb/100 мл использовали формулу 2*OD415 - (D380 + D450)* разведение * 1000/1,655*8,60 =. Испытание на осмотическую хрупкость проводили, как описано ранее (Tzounakas et al., 2017).
Поглощение измеряли при 380, 415 и 450 нм. Для расчета мг Hb/100 мл использовали формулу 2*OD415 - (D380 + D450)* разведение * 1000/1,655*8,60 =. Испытание на осмотическую хрупкость проводили, как описано ранее (Tzounakas et al., 2017).
Механический гемолиз, относящийся к проценту гемолиза эритроцитов после воздействия механического стресса (Free-Hb-MECH), рассчитывали следующим образом: ] × (коэффициент разбавления, необходимый для достижения 20% Hct)
где PFHb контроль — средняя концентрация свободного гемоглобина в плазме в супернатантах контрольных (некачанных) образцов, а Hb аликвота — средняя концентрация гемоглобина в аликвотах эритроцитов при гематокрите 20% (Harm et al., 2012).
Для количественного определения активности фермента G6PD использовали спектрофотометрический анализ (Ben Srl Biochemical Enterprise, Милан, Италия).
Тест хи-квадрат был проведен для проверки дисбаланса между пациентами и контрольной группой в отношении пола участников. Предполагая ненормальность исследуемых параметров, были проведены тесты Крускала-Уоллиса для двух групп для оценки различий параметров между группами субъектов. Для выявления различий параметров между различными классами инфильтратов КТ органов грудной клетки в группе пациентов были проведены тесты Крускала-Уоллиса с тестом Данна для множественных сравнений. Наконец, был рассчитан Rho Спирмена, чтобы найти связь между параметрами эритроцитов и PaO 9 .0281 2 /FiO 2 в группе пациентов. Все значения выражены как медиана (25–75% межквартильный размах-IQR), если не указано иное. Значимость принималась при значениях р менее 0,05. Статистический анализ проводили с использованием STATA MP-64 16.0.
Предполагая ненормальность исследуемых параметров, были проведены тесты Крускала-Уоллиса для двух групп для оценки различий параметров между группами субъектов. Для выявления различий параметров между различными классами инфильтратов КТ органов грудной клетки в группе пациентов были проведены тесты Крускала-Уоллиса с тестом Данна для множественных сравнений. Наконец, был рассчитан Rho Спирмена, чтобы найти связь между параметрами эритроцитов и PaO 9 .0281 2 /FiO 2 в группе пациентов. Все значения выражены как медиана (25–75% межквартильный размах-IQR), если не указано иное. Значимость принималась при значениях р менее 0,05. Статистический анализ проводили с использованием STATA MP-64 16.0.
В это исследование были включены госпитализированные пациенты с SARS-CoV-2 ( N = 36), а также здоровая контрольная группа соответствующего возраста и пола ( N = 18). Что касается их демографических характеристик, то группа больных на 50 % состояла из мужчин, тогда как в контрольной группе доля мужчин составляла 66 % (9). 0259 р = 0,245). Средний возраст составил 66,33 ± 13,48 года у пациентов и 65,16 ± 14,24 года у здоровых (среднее значение ± стандартное отклонение, p = 0,78). Лекарства, назначаемые госпитализированным пациентам с SARS-CoV-2, включали ремдесивир, дексаметазон, низкомолекулярный гепарин и антибиотики широкого спектра действия на основании решения врача. Сообщений о медикаментозном гемолизе в историях болезни не было. Согласно их медицинским записям, ни пациенты, ни контрольная группа не получали сопутствующих препаратов, которые могли повлиять на свободный гемоглобин.
0259 р = 0,245). Средний возраст составил 66,33 ± 13,48 года у пациентов и 65,16 ± 14,24 года у здоровых (среднее значение ± стандартное отклонение, p = 0,78). Лекарства, назначаемые госпитализированным пациентам с SARS-CoV-2, включали ремдесивир, дексаметазон, низкомолекулярный гепарин и антибиотики широкого спектра действия на основании решения врача. Сообщений о медикаментозном гемолизе в историях болезни не было. Согласно их медицинским записям, ни пациенты, ни контрольная группа не получали сопутствующих препаратов, которые могли повлиять на свободный гемоглобин.
Основной гематологический профиль и связанный с ним биохимический и коагуляционный анализы сыворотки пациентов при поступлении в стационар и здоровых лиц, а также оценка состояния дыхания пациентов представлены в таблице 1. Характеристики эритроцитов у пациентов с SARS-CoV-2 и у здоровых лиц представлены в таблице 2. У пациентов с SARS-CoV-2 наблюдалась лимфопения наряду с повышением маркеров воспаления, включая уровни ферритина, СРБ и ИЛ-6. Кроме того, у пациентов наблюдалось повышение уровня ЛДГ в отличие от здоровых лиц, у которых значения ЛДГ были нормальными. Связи между уровнем ЛДГ в сыворотке, числом лимфоцитов, уровнем ферритина и D-димеров и тяжестью заболевания не наблюдалось, однако была выявлена связь между уровнем фибриногена и высокочувствительным СРБ (вч-СРБ) в группе больных (r = 0,662, р = 0,003). Никаких морфологических аномалий эритроцитов не наблюдалось ни у здоровых людей, ни у образцов периферической крови SARS-CoV-2 с помощью световой микроскопии (данные не показаны).
Кроме того, у пациентов наблюдалось повышение уровня ЛДГ в отличие от здоровых лиц, у которых значения ЛДГ были нормальными. Связи между уровнем ЛДГ в сыворотке, числом лимфоцитов, уровнем ферритина и D-димеров и тяжестью заболевания не наблюдалось, однако была выявлена связь между уровнем фибриногена и высокочувствительным СРБ (вч-СРБ) в группе больных (r = 0,662, р = 0,003). Никаких морфологических аномалий эритроцитов не наблюдалось ни у здоровых людей, ни у образцов периферической крови SARS-CoV-2 с помощью световой микроскопии (данные не показаны).
Таблица 1. Гематологические и биохимические характеристики сыворотки крови и маркеры гемолиза эритроцитов больных SARS-CoV-2 при поступлении в стационар и здоровых лиц.
Таблица 2. Характеристики эритроцитов у пациентов с SARS-CoV-2 и у здоровых людей.
Что касается исследования маркеров гемолиза, наиболее поразительным результатом было заметное повышение уровня свободного гемоглобина в плазме: 28,1 г/дл (23,1–42,5) против 0,42 г/дл (0–11,8) (медиана IQR) у пациентов по сравнению с контрольной группой, хотя и не сопровождаются различиями в Hb или непрямом билирубине. Однако это сопровождалось повышением уровня ЛДГ и свободного Hb-MECH по сравнению со здоровым контролем (таблица 1 и рисунок 1). Репрезентативные КТ-изображения пациентов с 0–25, 25–50 и 50–75% КТ-инфильтраций грудной клетки представлены на дополнительном рисунке 1.
Однако это сопровождалось повышением уровня ЛДГ и свободного Hb-MECH по сравнению со здоровым контролем (таблица 1 и рисунок 1). Репрезентативные КТ-изображения пациентов с 0–25, 25–50 и 50–75% КТ-инфильтраций грудной клетки представлены на дополнительном рисунке 1.
Рисунок 1. Представление маркеров гемолиза у пациентов (ПТ) по сравнению с контрольной группой (ЦТЛ). (A) На гистограмме показан процент средней хрупкости клеток (MCF) в двух группах (пациенты по сравнению с контрольной группой). График с прямоугольниками и усами [с использованием метода Тьюки], иллюстрирующий: (B) свободного гемоглобина (Hb) в плазме в мг/дл у пациентов по сравнению с контрольной группой и (C) свободного гемоглобина после воздействия на клетки механического стресса (Free- Hb-MECH). ** р < 0,01.
Уровни внутриклеточных ионов кальция (iCa 2+ ) были повышены у пациентов с SARS-CoV-2 по сравнению со здоровым контролем в нашем исследовании. В отличие от равного процента IgG + и каспаза-3-положительных эритроцитов, указывающих на наличие стареющего неоантигена и маркера эриптоза соответственно, процент эритроцитов, экспонирующих PS, был значительно увеличен у пациентов по сравнению с контрольной группой. Кроме того, также наблюдалось значительное и заметное повышение уровня активности G6PDH в эритроцитах пациентов. Кроме того, iROS были значительно снижены в связи с COVID-19.больных (табл. 2).
В отличие от равного процента IgG + и каспаза-3-положительных эритроцитов, указывающих на наличие стареющего неоантигена и маркера эриптоза соответственно, процент эритроцитов, экспонирующих PS, был значительно увеличен у пациентов по сравнению с контрольной группой. Кроме того, также наблюдалось значительное и заметное повышение уровня активности G6PDH в эритроцитах пациентов. Кроме того, iROS были значительно снижены в связи с COVID-19.больных (табл. 2).
Уровень свободного гемоглобина в плазме = 26,5 г/дл (18,8–36,8) был отмечен у пациентов с 0–25% инфильтратов на КТ грудной клетки при поступлении, тогда как 46,4 г/дл (39,5–56,4) и 25,3 г/дл (22,1– 36.3) значения наблюдались для инфильтратов КТ 25–50 и 50–75% соответственно ( p = 0,033). Уровни iROS в эритроцитах показали тенденцию к ассоциации с инфильтратами КТ органов грудной клетки [443 (403–527) по сравнению с 421 (371–425) по сравнению с 535 (412–582) для инфильтратов 0–25, 25–50 и 50–10. 75% соответственно ( p = 0,056)] (рис. 2А,Б).
2А,Б).
Рисунок 2. Характеристики гемолиза и эритроцитов у пациентов с SARS-CoV-2, сгруппированные по инфильтратам на КТ органов грудной клетки. График с прямоугольниками и усами [с использованием метода Тьюки], иллюстрирующий: (A) Плазма без Hb, (B) iROS и (C) IgG + RBCs. * р < 0,05, ** р < 0,01.
Достоверная корреляция IgG + эритроцитов и PO 2 /FiO 2 9Также наблюдалось отношение 0282 (рис. 3А, Rho Спирмена = -0,62, p = 0,018). Процент эритроцитов IgG + был заметно повышен у пациентов с 50-75% инфильтратов грудной клетки по сравнению с пациентами с 0-25% [0,79 (0,68-0,90) против 0,54 (0,46-0,72) соответственно], p = 0,028. Из-за небольшого количества измерений RBC-IgG ( N = 14) не было пациентов с измеренными RBC-IgG и 25–50% инфильтратов КТ органов грудной клетки (рис. 2C). Кроме того, было обнаружено, что D-димеры пациентов связаны с PS 9. 0311 + эритроцитов (рис. 3C, p = 0,01, Rho Спирмена = 0,46, N = 32), но не с инфильтратами грудной клетки ( p = 0,17). Кроме того, количество эритроцитов PS + было незначительно связано с соотношением PaO 2 / FiO 2 (R Спирмена = -0,32, p = 0,06) (рис. 3B). Все ассоциации маркеров эритроцитов с тяжестью заболевания (определяемые соотношением PaO 2 / FiO 2 ) изображены на рисунке 3.
0311 + эритроцитов (рис. 3C, p = 0,01, Rho Спирмена = 0,46, N = 32), но не с инфильтратами грудной клетки ( p = 0,17). Кроме того, количество эритроцитов PS + было незначительно связано с соотношением PaO 2 / FiO 2 (R Спирмена = -0,32, p = 0,06) (рис. 3B). Все ассоциации маркеров эритроцитов с тяжестью заболевания (определяемые соотношением PaO 2 / FiO 2 ) изображены на рисунке 3.
Рис. 3. Выявлены значимые корреляционные связи маркеров гемолиза и эритроцитов с тяжестью заболевания, определяемой по соотношению PaO2/FiO2. (А) Корреляция IgG + эритроцитов с соотношением ПО 2 /FiO 2 , (Б) Корреляция ФС + эритроцитов с соотношением ПО 2 /FiO 2 9028 и (C) Корреляция между D-димерами и PS + RBC.
В этом пилотном исследовании представлены новые данные, свидетельствующие о связи между SARS-CoV-2 и физиологией эритроцитов, а также связь маркеров эритроцитов с тяжестью заболевания.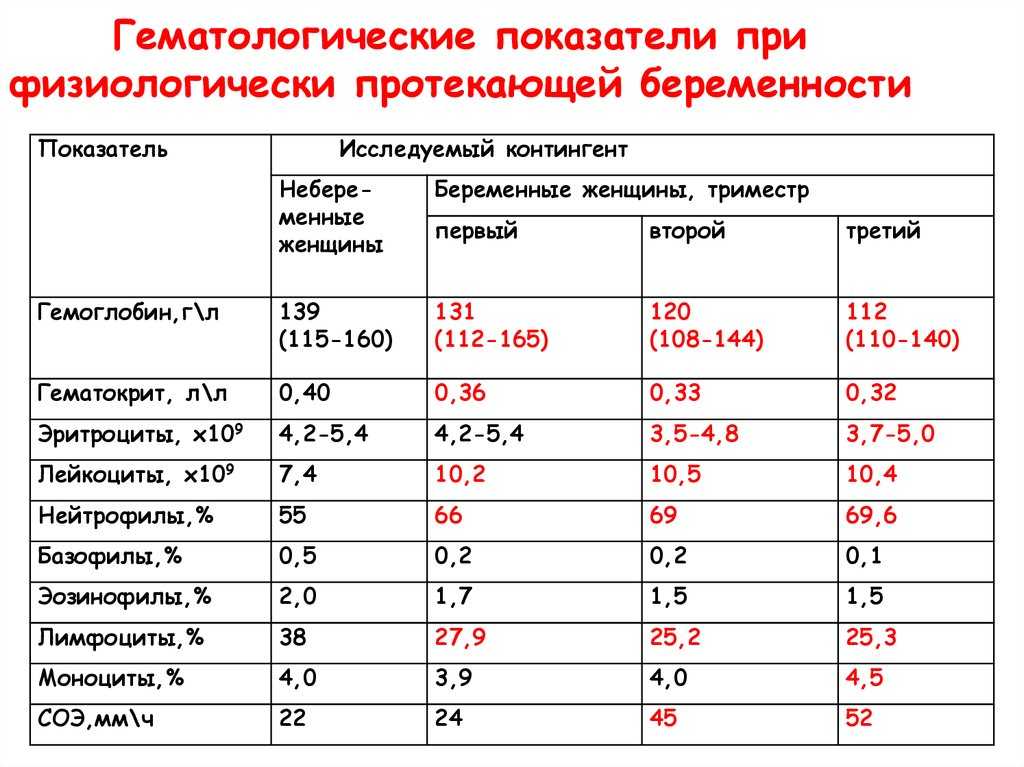
В настоящем исследовании пациенты с SARS-CoV-2 не имеют различий по большинству изученных гематологических и биохимических параметров по сравнению с контрольной группой (таблица 1), однако у них наблюдается повышенный уровень ЛДГ. Предполагается, что повышенный уровень ЛДГ в этой группе пациентов является признаком прогрессирования заболевания и, вероятно, может использоваться для прогнозирования наихудшего исхода (Henry et al., 2020; Szarpak et al., 2021). Лимфопения и повышенные уровни ферритина и D-димеров также были предложены в качестве прогностических маркеров тяжести заболевания и смертности (Gomez-Pastora et al., 2020; Tavakolpour et al., 2020; Lee et al., 2021; Poudel et al., 2021). Группа пациентов с SARS-CoV-2 в нашем исследовании действительно демонстрирует все вышеперечисленные характеристики. Однако корреляции между этими маркерами и тяжестью заболевания не наблюдалось, вероятно, из-за малого числа пациентов. Повышенные уровни фибриногена, вероятно, отражают воспалительное состояние пациентов, на что указывает положительная корреляция между фибриногеном и СРБ в нашем исследовании (данные не представлены).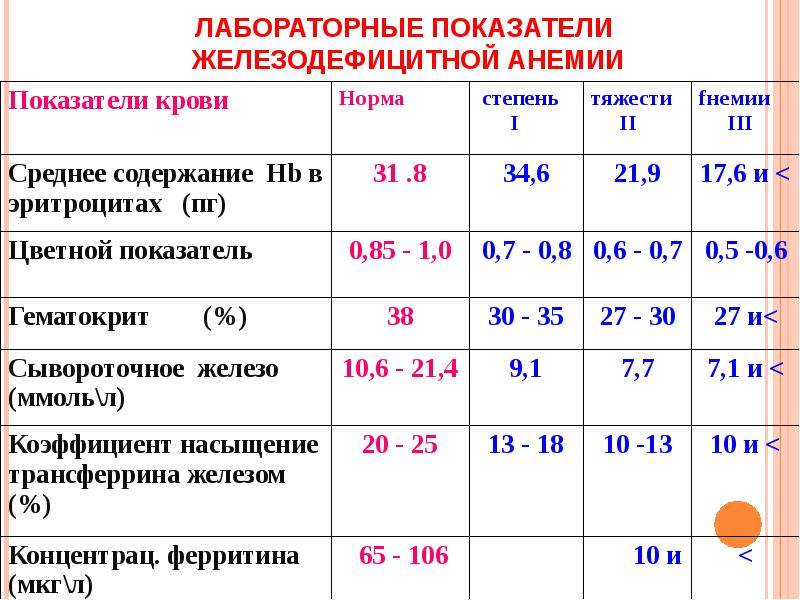 Наличие избытка железа, о чем свидетельствует повышенный уровень ферритина в сыворотке в нашем исследовании, может способствовать дальнейшему развитию тромбоза при COVID-19.пациентов, повышая устойчивость тромба к фибринолизу (Kell and Pretorius, 2015).
Наличие избытка железа, о чем свидетельствует повышенный уровень ферритина в сыворотке в нашем исследовании, может способствовать дальнейшему развитию тромбоза при COVID-19.пациентов, повышая устойчивость тромба к фибринолизу (Kell and Pretorius, 2015).
Наши результаты показали, что уровни свободного гемоглобина в плазме пациентов с SARS-CoV-2 были заметно повышены в группе пациентов. Уровень свободного гемоглобина в плазме, маркер внутрисосудистого гемолиза, обычно не используется в клинической практике, и этот факт может объяснить, почему гемолиз эритроцитов не был описан у пациентов с SARS-CoV-2. Однако ранее сообщалось о повышении уровня свободного гемоглобина в плазме при SARS-CoV-2 (Lancman et al., 2021). Существует мнение, что повышенный уровень свободного гемоглобина в плазме может быть связан с неоптимальной венепункцией. Повышение уровня свободного гемоглобина в плазме иногда может наблюдаться у госпитализированных пациентов, поскольку считается, что значения от 5 до 15 мг/дл являются результатом субоптимальной венепункции (Lancman et al. , 2021). Однако в нашем исследовании только у 2 из 36 пациентов уровень свободного гемоглобина в плазме был ниже 15 (между 10 и 15), что позволяет предположить, что этот маркер, вероятно, является результатом воздействия вируса на эритроциты, а не неоптимальная венепункция.
, 2021). Однако в нашем исследовании только у 2 из 36 пациентов уровень свободного гемоглобина в плазме был ниже 15 (между 10 и 15), что позволяет предположить, что этот маркер, вероятно, является результатом воздействия вируса на эритроциты, а не неоптимальная венепункция.
Наше исследование предполагает, что вирус вызывает окислительный стресс эритроцитов, увеличивает внутриклеточный Ca 2+ и хрупкость клеток к механическому стрессу. Точную последовательность событий установить невозможно. Однако известно, что повышенный iROS в эритроцитах, вторичный по отношению к сепсису, приводит к снижению деформируемости эритроцитов, которая состоит из усадки клеток, вздутия мембраны и скремблирования клеточной мембраны, процесса, называемого эриптозом (Pretorius, 2018). Это может выражаться в повышенной механической хрупкости и лизисе эритроцитов, как это наблюдалось в нашем случае (Machiedo et al., 19).89).
D-димеры представляют собой фрагменты деградации фибрина, и их значения связаны с тромбозом и фибринолизом. В нашем исследовании была выявлена связь между эритроцитами PS + и D-димерами (рис. 3B) в популяции пациентов, что позволяет предположить, что эритроциты могут быть вовлечены в тромботические механизмы, связанные с COVID-19. Известно, что повышение внутриклеточного уровня Ca 2+ вызывает транслокацию мембранного фосфатидилсерина во внешнее пространство мембраны эритроцитов (Seignuret and Devaux, 19).84; Bucki et al., 1998), известный эффект стимуляции тромбоза посредством образования микрочастиц и сборки протромбиназного комплекса (Kamp et al., 2001). Другой возможный тромботический механизм, управляемый эритроцитами, может заключаться в потреблении эндотелиального оксида азота свободным гемоглобином плазмы, как описано ранее, что приводит к нарушению эндотелийзависимой вазолидации (Loscalzo, 2001).
В нашем исследовании была выявлена связь между эритроцитами PS + и D-димерами (рис. 3B) в популяции пациентов, что позволяет предположить, что эритроциты могут быть вовлечены в тромботические механизмы, связанные с COVID-19. Известно, что повышение внутриклеточного уровня Ca 2+ вызывает транслокацию мембранного фосфатидилсерина во внешнее пространство мембраны эритроцитов (Seignuret and Devaux, 19).84; Bucki et al., 1998), известный эффект стимуляции тромбоза посредством образования микрочастиц и сборки протромбиназного комплекса (Kamp et al., 2001). Другой возможный тромботический механизм, управляемый эритроцитами, может заключаться в потреблении эндотелиального оксида азота свободным гемоглобином плазмы, как описано ранее, что приводит к нарушению эндотелийзависимой вазолидации (Loscalzo, 2001).
Удивительно, но внутриклеточные уровни АФК в эритроцитах были значительно ниже в группе пациентов по сравнению со здоровыми людьми. Это открытие, возможно, коррелирует с повышенным уровнем активности G6PDH в этой группе, что предполагает компенсаторный механизм против вируса. Этот компенсаторный механизм, по-видимому, ослабевает по мере увеличения инфильтрации шахматной КТ, как показано на рис. 2.9.0003
Этот компенсаторный механизм, по-видимому, ослабевает по мере увеличения инфильтрации шахматной КТ, как показано на рис. 2.9.0003
Другим интригующим открытием является корреляция RBC-IgG и отношения PO 2 / FiO 2 (рис. 3A), что указывает на то, что увеличение IgG на поверхности эритроцитов связано со снижением дыхательной способности пациентов. Основные механизмы могут заключаться либо в том, что состарившиеся эритроциты не могут очень эффективно транспортировать O 2 , либо в том, что недостаток кислорода может вызвать окислительное повреждение эритроцитов, что приводит к старению эритроцитов. В пользу второго механизма говорит увеличение процентного содержания эритроцитов + IgG у пациентов с 50–75% по сравнению с 0–25% инфильтратов грудной клетки при КТ. В любом случае Берзуини и соавт. предложили это. (2020), что поверхность эритроцитов у пациентов с COVID-19 модифицируется из-за гипервоспаления, тем самым увеличивая отложение IgG.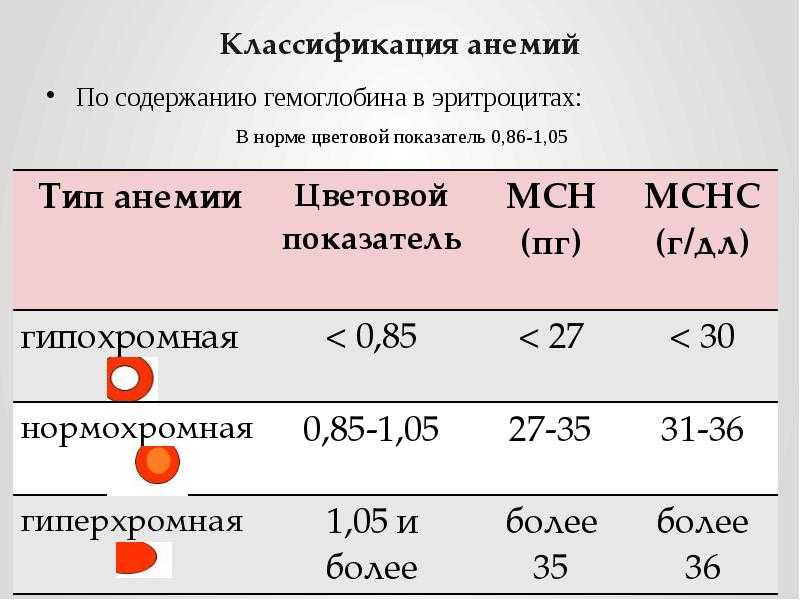 Наше обнаружение увеличения RBC-IgG с тяжестью заболевания подтверждает это предположение.
Наше обнаружение увеличения RBC-IgG с тяжестью заболевания подтверждает это предположение.
Связь между свободным гемоглобином в плазме и инфильтрацией грудной клетки при КТ (рис. 2А) не совсем ясна, так как представляется, что свободный гемоглобин в плазме у пациентов с 50–75% инфильтратов возвращается к уровням, наблюдаемым у пациентов с 0–25% инфильтратов. Известно, что свободный гемоглобин в альвеолярном пространстве увеличивает iROS, что, вероятно, приводит к острому респираторному дистресс-синдрому (ОРДС), тогда как его присоединение к альвеолярному эпителию вызывает воспаление (Janz and Ware, 2015). Повышенная механическая хрупкость, как в группе наших пациентов, может вызвать лизис эритроцитов по мере их перемещения по легочным капиллярам и последующее повреждение альвеол. Однако для подтверждения этого предположения необходимы дальнейшие исследования.
Это исследование имеет два ограничения. Небольшое количество участников и случайные моменты времени выборки. Таким образом, тяжесть заболевания, оцененная на исходном уровне, была связана с маркерами эритроцитов, полученными в различные моменты времени во время госпитализации. Тем не менее, были обнаружены ассоциации, которые нуждаются в дальнейшей эксплуатации.
Таким образом, тяжесть заболевания, оцененная на исходном уровне, была связана с маркерами эритроцитов, полученными в различные моменты времени во время госпитализации. Тем не менее, были обнаружены ассоциации, которые нуждаются в дальнейшей эксплуатации.
Это экспериментальное исследование предполагает, что инфекция SARS-CoV-2 влияет на эритроциты, и, по-видимому, существует связь между маркерами эритроцитов и тяжестью заболевания у этих пациентов. Эти эффекты необходимо дополнительно подтвердить в будущих исследованиях, и необходимо выяснить причинные механизмы, лежащие в основе ассоциаций.
Необработанные данные, подтверждающие выводы этой статьи, будут предоставлены авторами без неоправданных оговорок.
Это исследование было проведено в соответствии с рекомендациями Хельсинкской декларации и одобрено Институциональным наблюдательным советом (или Комитетом по этике) Афинского национального и Каподистрийского университета (номер решения: 145/8-3-2021). от 04.08.2021). Пациенты/участники предоставили письменное информированное согласие на участие в этом исследовании.
от 04.08.2021). Пациенты/участники предоставили письменное информированное согласие на участие в этом исследовании.
AK, VP и SV: методология, надзор и управление проектом. AB, AK, HG и SF: формальный анализ. АБ, АК, ВП и СВ: расследование. АК, ВП, СВ и КС: ресурсы. АК и АБ: написание – подготовка первоначального проекта. ТТ, ЛЛ, КМ, ДГ, АПа и СП: сбор данных. AB, APo и EP: статистика. Все авторы прочитали, рассмотрели, отредактировали и согласились с опубликованной версией рукописи.
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Все претензии, изложенные в этой статье, принадлежат исключительно авторам и не обязательно представляют претензии их дочерних организаций, издателя, редакторов и рецензентов. Любой продукт, который может быть оценен в этой статье, или претензии, которые могут быть сделаны его производителем, не гарантируются и не поддерживаются издателем.
Авторы хотели бы поблагодарить всех доноров крови, пациентов и здоровых лиц, принявших участие в настоящем исследовании. Особая благодарность Athina Mountzouri, Ph.D. кандидат Университета Западной Аттики за редактирование графического реферата ([email protected]).
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fphys.2021.825055/full#supplementary-material
Аркудис, Н. Цохатзис А., Аргентос С., Контопулу С., Мадемли М., Спилиопулос С. и соавт. (2021). КТ у пациентов с COVID-19: модели визуализации, степень заболевания и эволюция; наш опыт работы в греческой университетской больнице. Hellenic J. Radiol. 6, 2–12.
Google Scholar
Банон Т., Вортсман Дж., Бен Моше С., Газит С., Перец А., Бен Тов А. и др. (2021). Оценка ширины распределения эритроцитов по анализам крови в качестве предиктора госпитализации и смертности у взрослых с SARS-CoV-2: когортное исследование.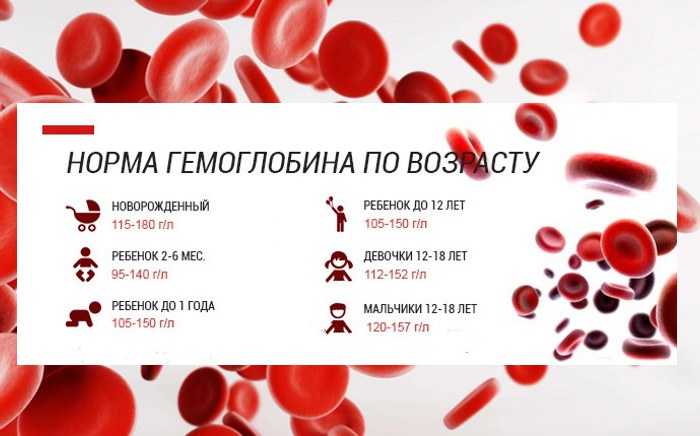 Энн. Мед. 53, 1410–1418. doi: 10.1080/07853890.2021.1968484
Энн. Мед. 53, 1410–1418. doi: 10.1080/07853890.2021.1968484
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бейтман Р. М., Шарп М. Д., Сингер М. и Эллис К. Г. (2017). Влияние сепсиса на эритроциты. Междунар. Дж. Мол. науч. 18:1932.
Google Scholar
Bellmann-Weiler, R., Lanser, L., Barket, R., Rangger, L., Schapfl, A., Schaber, M., et al. (2020). Распространенность и прогностическое значение анемии и нарушения регуляции гомеостаза железа у пациентов с инфекцией COVID-19. Дж. Клин. Мед. 9:2429. doi: 10.3390/jcm9082429
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Берзуини А., Бьянко К., Паккапело К., Бертолини Ф., Грегато Г., Каттанео А. и др. (2020). Антитела, связанные с эритроцитами, и требования к переливанию крови у госпитализированных пациентов с COVID-19. Кровь 136, 766–768. doi: 10.1182/blood.2020006695
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Bucki, R. , Bachelot-Loza, C., Zachowski, A., Giraud, F., and Sulpice, JC (1998). Кальций индуцирует перераспределение фосфолипидов и высвобождение микровезикул в мембранах эритроцитов человека независимыми путями. Биохимия 37, 15383–15391. doi: 10.1021/bi9805238
, Bachelot-Loza, C., Zachowski, A., Giraud, F., and Sulpice, JC (1998). Кальций индуцирует перераспределение фосфолипидов и высвобождение микровезикул в мембранах эритроцитов человека независимыми путями. Биохимия 37, 15383–15391. doi: 10.1021/bi9805238
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Косич И., Косич Д. и Лонкаревич И. (2020). RRM-предсказание белка band3 эритроцитов как альтернативного рецептора вируса SARS-CoV-2. Заявл. науч. 10:4053.
Google Scholar
Фой, Б. Х., Карлсон, Дж. К. Т., Рейнертсен, Э., Падрос, И. В. Р., Палларес Лопес, Р., Паланкес-Тост, Э., и др. (2020). Связь ширины распределения эритроцитов с риском смертности у госпитализированных взрослых с инфекцией SARS-CoV-2. Сеть JAMA. Откройте 3:e2022058. doi: 10.1001/jamanetworkopen.2020.22058
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гомес-Пастора Дж., Вейганд М., Ким Дж., Ву X., Страйер Дж. , Палмер А.Ф. и др. (2020). Гиперферритинемия у тяжелобольных COVID-19пациенты - Является ли ферритин продуктом воспаления или патогенным медиатором? клин. Чим. Acta 509, 249–251. doi: 10.1016/j.cca.2020.06.033
, Палмер А.Ф. и др. (2020). Гиперферритинемия у тяжелобольных COVID-19пациенты - Является ли ферритин продуктом воспаления или патогенным медиатором? клин. Чим. Acta 509, 249–251. doi: 10.1016/j.cca.2020.06.033
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Grobler, C., Maphumulo, S.C., Grobbelaar, L.M., Bredenkamp, JC, Laubscher, G.J., Lourens, P.J., et al. (2020). Covid-19: американские горки фибрина (огена), D-димера, фактора фон Виллебранда, P-селектина и их взаимодействия с эндотелиальными клетками, тромбоцитами и эритроцитами. Междунар. Дж. Мол. науч. 21:5168. doi: 10.3390/ijms21145168
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Harboe, M. (1959). Метод определения гемоглобина в плазме методом спектрофотометрии в ближнем ультрафиолете. Скан. Дж. Клин. лаборатория Инвестировать. 11, 66–70. doi: 10.3109/003655159010
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Харм С. К., Уотерс Дж. Х., Линн П., Дайга Р., Раваль Дж. С., Димарко Р. Ф. и др. (2012). Изменения механической хрупкости и уровня свободного гемоглобина после обработки спасенной крови контура искусственного кровообращения модифицированным устройством для ультрафильтрации. Дж. Экстра Корпорейшн. Технол. 44, 21–25.
К., Уотерс Дж. Х., Линн П., Дайга Р., Раваль Дж. С., Димарко Р. Ф. и др. (2012). Изменения механической хрупкости и уровня свободного гемоглобина после обработки спасенной крови контура искусственного кровообращения модифицированным устройством для ультрафильтрации. Дж. Экстра Корпорейшн. Технол. 44, 21–25.
Google Scholar
Генри Б. М., Аггарвал Г., Вонг Дж., Бенуа С., Виксе Дж., Плебани М. и др. (2020). Уровни лактатдегидрогеназы предсказывают тяжесть и смертность от коронавирусной болезни 2019 (COVID-19): объединенный анализ. утра. Дж. Эмерг. Мед. 38, 1722–1726 гг. doi: 10.1016/j.ajem.2020.05.073
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Иба Т., Леви Дж. Х., Леви М. и Тачил Дж. (2020). Коагулопатия при COVID-19. Дж. Тромб. Гемост. 18, 2103–2109.
Google Scholar
Янц, Д. Р., и Уэр, Л. Б. (2015). Роль эритроцитов и внеклеточного гемоглобина в патогенезе ОРДС. Дж. Интенсивная терапия 3:20.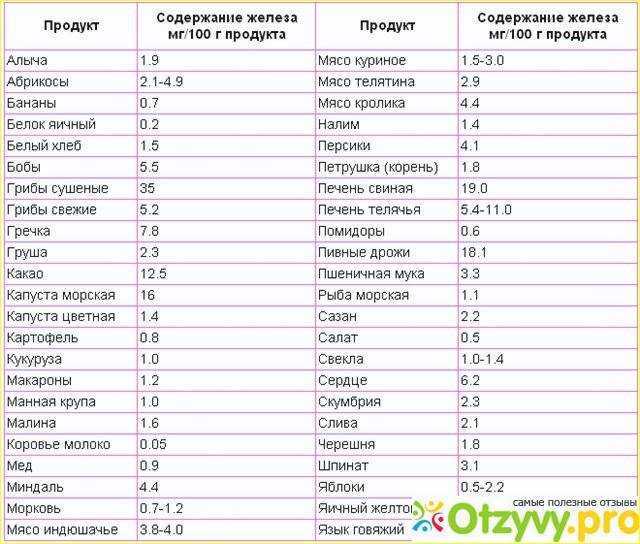 doi: 10.1186/s40560-015-0086-3
doi: 10.1186/s40560-015-0086-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Камп, Д., Сиберг, Т., и Хест, К.В. (2001). Ингибирование и стимуляция активности скремблирования фосфолипидов. Последствия липидной асимметрии, эхиноцитоза и микровезикуляции эритроцитов. Биохимия 40, 9438–9446. doi: 10.1021/bi0107492
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Келл Д. Б. и Преториус Э. (2015). Одновременное возникновение как гиперкоагуляции, так и гипофибринолиза в крови и сыворотке при системном воспалении, роль железа и фибрин(огена). Интегр. биол. 7, 24–52. doi: 10.1039/c4ib00173g
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лам Л.К.М., Рейли Дж.П., Ракс А.Х., Мерфи С.Дж., Кури-Сервантес Л., Вейсман А.Р. и др. (2021). Эритроциты определяют активацию комплемента у пациентов с COVID-19. утра. Дж. Физиол. Легкое. Ячейка Мол. Физиол. 321, Л485–Л489.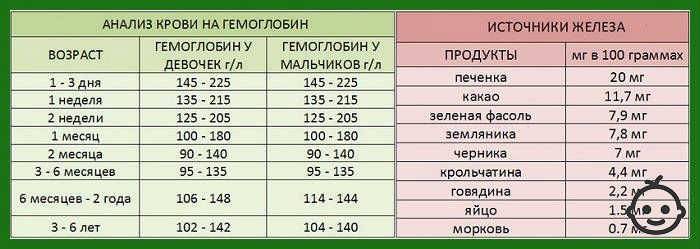 doi: 10.1152/ajplung.00231.2021
doi: 10.1152/ajplung.00231.2021
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ланкман Г., Марчеллино Б. К., Тибо С. и Трой К. (2021). Кумбс-отрицательная гемолитическая анемия и повышенный уровень гемоглобина в плазме при COVID-19. Энн. Гематол. 100, 833–835. doi: 10.1007/s00277-020-04202-3
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Ли Дж., Пак С.С., Ким Т.Ю., Ли Д.Г. и Ким Д.В. (2021). Лимфопения как биологический предиктор исходов при COVID-19пациенты: общенациональное когортное исследование. Раки 13:471. doi: 10.3390/cancers13030471
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Лоскальцо, Дж. (2001). Недостаточность оксида азота, активация тромбоцитов и артериальный тромбоз. Обр. Рез. 88, 756–762. doi: 10.1161/hh0801.089861
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Machiedo, G. W., Powell, R.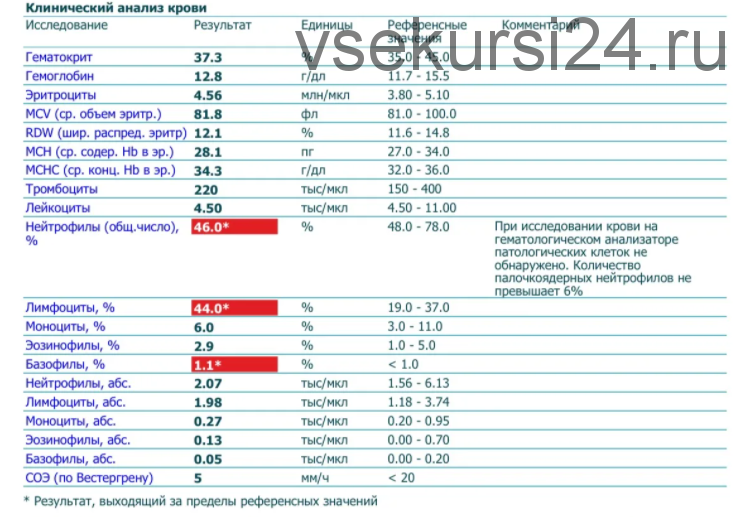 J., Rush, B. F. Jr., Swislocki, N. I., and Dikdan, G. (1989). Частота снижения деформируемости эритроцитов при сепсисе и связь с повреждением свободными радикалами кислорода и полиорганной недостаточностью. Арх. Surg. 124, 1386–1389. doi: 10.1001/archsurg.1989.01410120032007
J., Rush, B. F. Jr., Swislocki, N. I., and Dikdan, G. (1989). Частота снижения деформируемости эритроцитов при сепсисе и связь с повреждением свободными радикалами кислорода и полиорганной недостаточностью. Арх. Surg. 124, 1386–1389. doi: 10.1001/archsurg.1989.01410120032007
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Павлоу Э. Г., Георгацаку Х. Т., Фортис С. П., Цанте К. А., Цантес А. Г., Номику Э. Г. и др. (2021). Коагуляционные нарушения при почечной патологии при хронической болезни почек: взаимодействие между клетками крови и растворимыми факторами. Биомолекулы 11:1309. doi: 10.3390/biom11091309
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пудель А., Пудель Ю., Адхикари А., Арьял Б. Б., Дангол Д., Баджрачарья Т. и др. (2021). D-димер как биомаркер для оценки прогноза COVID-19: уровни D-димера при поступлении и его роль в прогнозировании исхода заболевания у госпитализированных пациентов с COVID-19. PLoS One 16:e0256744. doi: 10.1371/journal.pone.0256744
PLoS One 16:e0256744. doi: 10.1371/journal.pone.0256744
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
Преториус, Э. (2018). Деформируемость эритроцитов и эриптоз при воспалении, нарушение реологических свойств крови. клин. гемореол. Микроциркуляр. 69, 545–550. doi: 10.3233/CH-189205
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Puelles, V.G., Lutgehetmann, M., Lindenmeyer, M.T., Sperhake, J.P., Wong, M.N., Allweiss, L., et al. (2020). Мультиорганный и почечный тропизм SARS-CoV-2. Н. англ. Дж. Мед. 383, 590–592. дои: 10.1056/NEJMc2011400
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Рахи, М.С., Джиндал, В., Рейес, С.П., Гунасекаран, К., Гупта, Р. и Джайесими, И. (2021). Гематологические нарушения, связанные с COVID-19: обзор. Энн. Гематол. 100, 309–320. doi: 10.1007/s00277-020-04366-y
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сеньере, М. , и Дево, П. Ф. (1984). АТФ-зависимое асимметричное распределение спин-меченых фосфолипидов в мембране эритроцитов: связь с изменением формы. Проц. Натл. акад. науч. США 81, 3751–3755. doi: 10.1073/pnas.81.12.3751
, и Дево, П. Ф. (1984). АТФ-зависимое асимметричное распределение спин-меченых фосфолипидов в мембране эритроцитов: связь с изменением формы. Проц. Натл. акад. науч. США 81, 3751–3755. doi: 10.1073/pnas.81.12.3751
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Сони, М., и Гопалакришнан, Р. (2021). Значение RDW в прогнозировании смертности при COVID-19. Анализ 622 случаев. Междунар. Дж. Лаб. Гематол. 43, О221–О223. doi: 10.1111/ijlh.13526
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Su, Y., Chen, D., Yuan, D., Lausted, C., Choi, J., Dai, C.L., et al. (2020). Мультиомикс устраняет резкий сдвиг состояния болезни между легкой и средней степенью тяжести COVID-19. сотовый 183, 1479–1495. doi: 10.1016/j.cell.2020.10.037
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Шарпак Л., Рютцлер К., Сафейко К., Хампель М., Прук М., Канчуга-Кода Л. и др. (2021). Уровень лактатдегидрогеназы как маркер тяжести COVID-19. утра. Дж. Эмерг. Мед. 45, 638–639. doi: 10.1016/j.ajem.2020.11.025
Уровень лактатдегидрогеназы как маркер тяжести COVID-19. утра. Дж. Эмерг. Мед. 45, 638–639. doi: 10.1016/j.ajem.2020.11.025
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Таваколпур С., Рахшандехру Т., Вэй Э. К. и Рашидиан М. (2020). Лимфопения во время COVID-19инфекция: что она показывает и что можно узнать. Иммунол. лат. 225, 31–32. doi: 10.1016/j.imlet.2020.06.013
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Цунакас В. Л., Анастасиади А. Т., Карадимас Д. Г., Зеко Р. А., Георгацаку Х. Т., Паппа О. Д. и др. (2017). Температурно-зависимая гемолитическая склонность хранимых CPDA-1 эритроцитов по сравнению с цельной кровью - Хрупкость эритроцитов как донорский признак на единицах крови. Переливание крови. 15, 447–455. дои: 10.2450/2017.0332-16
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Цунакас В. Л., Анастасиади А. Т., Стефанони Д., Сендали Ф.