2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Подобрать препарат можно с помощью фильтров. Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Полужирным начертанием выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
Сбросить фильтры
включить препараты подгрупп
Фармгруппа* Все фармгруппы Антисептики и дезинфицирующие средства Антисептики и дезинфицирующие средства в комбинациях Дерматотропные средства
Действующее вещество* Фенол
Лек. форма Все лек. формы бальзам для наружного применения раствор для наружного применения
Дозировка Без дозировки
Производитель Все производители Зеленая Дубрава ЗАО Ретиноиды ЗАО
 Что такое Мозоль?
Что такое Мозоль?ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
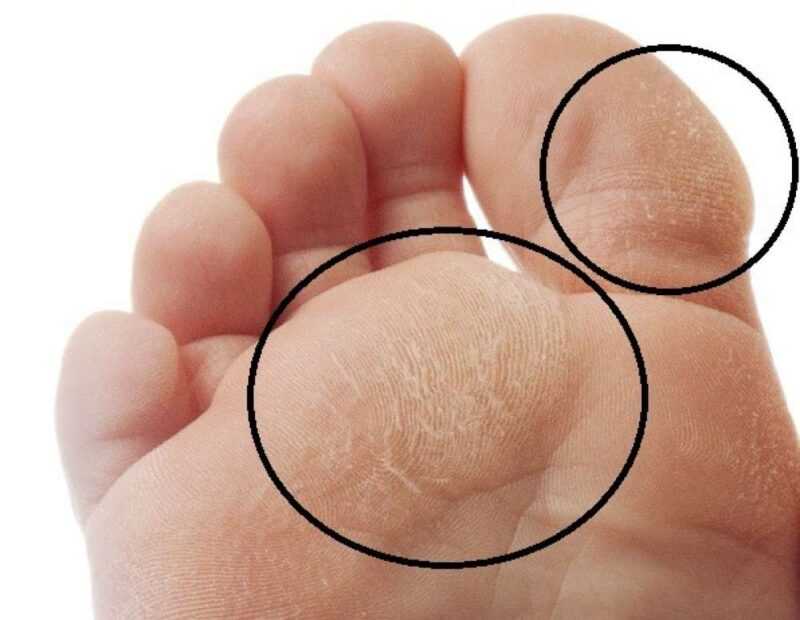
Мозоль — это локальное утолщение поверхностных слоев кожи, возникающее под воздействием давления или трения чаще всего на кистях и ступнях. Различают сухие и мокрые мозоли. Последние выглядят как обычные ранки и требуют соответствующего лечения. Сухие мозоли представляют собой плотные ограниченные участки омертвевшей кожи. Регулярная обработка сухой мозоли при проведении педикюра или маникюра и ношение специальных защитных средств, как правило, приводит к ее постепенному уменьшению и исчезновению. Лишь в некоторых случаях необходимо хирургическое лечение мозоли.
L84 Мозоли и омозолелости
Обычно дерматология сталкивается с проблемой мозоли при развитии осложнений в виде инфицирования или в случаях, когда длительные попытки пациента избавиться от мозоли не привели к желаемым результатам. Большинство мозолей проходят при регулярном удалении слоев огрубевшей кожи с их поверхности. Эту процедуру обычно проводят в кабинетах маникюра и педикюра.
Большинство мозолей проходят при регулярном удалении слоев огрубевшей кожи с их поверхности. Эту процедуру обычно проводят в кабинетах маникюра и педикюра.
Мозоль
При постоянном трении или давлении на определенном участке кожи происходит интенсивное омертвение ее поверхностных слоев. При этом отмершие клетки эпидермиса не успевают отслаиваться и удаляться с поверхности кожи. В результате происходит наслоение и уплотнение омертвевшего эпидермиса с образованием мозоли. При повышенной потливости пот размягчает омертвевшую кожу и образуется мягкая мозоль. Под слоем утолщенного эпидермиса может скапливаться лимфа, что приводит к появлению водяной мозоли.
Образование мозоли на кистях связано с постоянным трением кожи рук о рукоятку инструмента (молоток, стамеска), садового инвентаря (тяпка, секатор), спортивного снаряда (перекладина, брусья, теннисная ракетка) или музыкального инструмента (у скрипачей, гитаристов и др. ). Мозоль может возникать на коже локтей и коленей.
). Мозоль может возникать на коже локтей и коленей.
На ступнях мозоль чаще всего возникает из-за неудобной и слишком узкой обуви. Так туфли на высоком каблуке вызывают сдавление переднего отдела стопы, слишком тонкая подошва увеличивает нагрузку на свод стопы, а грубые внутренние швы обуви могут оказывать дополнительное трение. Постоянное трение определенных участков кожи стопы с образованием мозоли может быть обусловлено неправильной походкой или занятием спортом (бегуны, лыжники). Часто мозоли бывают связаны с различными заболеваниями и деформациями стопы: бурсит или артрит суставов стопы, деформирующий остеоартроз, плоскостопие, молоткообразные пальцы стопы, пяточная шпора.
Твердая мозоль представляет собой плотное ограниченное утолщение кожи желтоватого или желто-серого цвета немного возвышающееся над поверхностью кожного покрова. Твердая мозоль отличается малой чувствительностью и сама по себе обычно не вызывает боли. Болевой синдром обусловлен надавливанием на мозоль при работе с инструментом или ходьбе, при сдавлении тесной обувью.
Болевой синдром обусловлен надавливанием на мозоль при работе с инструментом или ходьбе, при сдавлении тесной обувью.
Мягкая мозоль имеет вид открытой ранки и характеризуется выраженной болезненностью. Водяная мозоль или водянка представляет собой содержащий серозную жидкость пузырь. При вскрытии пузыря образуется ранка, прикрытая сверху остатками омертвевшей кожи пузыря.
Отдельно выделяют стержневую мозоль. Чаще всего такие мозоли образуются на коже подушечек в области III и IV межпальцевых промежутков. Они могут встречаться на тыльной стороне пальцев и изредка на подошве. Стержневая мозоль — это сухая мозоль, имеющая глубоко уходящий под кожу корень. В центре мозоли имеется отверстие, из которого видна его «шляпка». Обычно образование стержневой мозоли происходит на месте проникновения под кожу мелкого камешка или занозы.
При неправильном лечении мозоли, ее срезании, образовании на ее поверхности трещин может произойти инфицирование.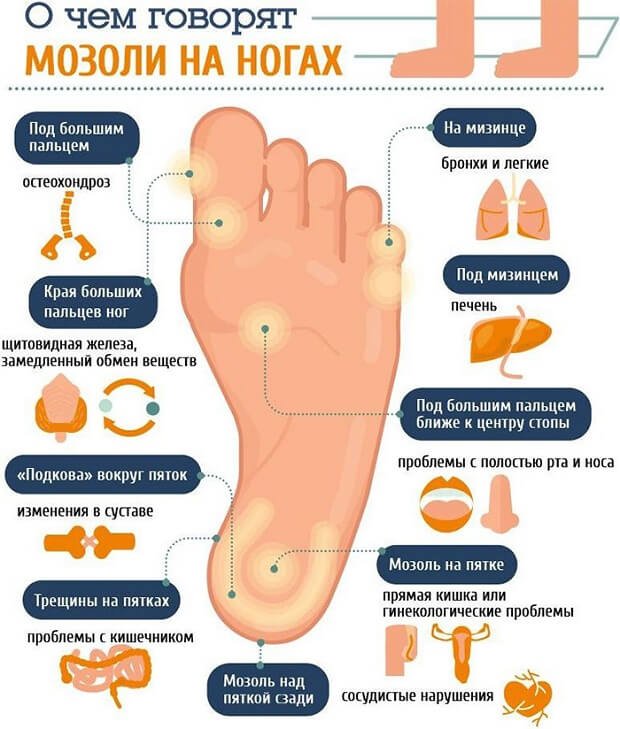 Проникающие при этом в мозоль микроорганизмы вызывают ее воспаление, что проявляется покраснением, отеком и выраженной болезненностью мозоли. Без должного лечения происходит размягчение мозоли и при надавливании на нее начинает выделяться гной. Воспалительный процесс с мозоли может распространяться на окружающие ткани с развитием мозольного абсцесса или флегмоны, на кости стопы с возникновением остеомиелита, на синовиальные оболочки и суставы стопы.
Проникающие при этом в мозоль микроорганизмы вызывают ее воспаление, что проявляется покраснением, отеком и выраженной болезненностью мозоли. Без должного лечения происходит размягчение мозоли и при надавливании на нее начинает выделяться гной. Воспалительный процесс с мозоли может распространяться на окружающие ткани с развитием мозольного абсцесса или флегмоны, на кости стопы с возникновением остеомиелита, на синовиальные оболочки и суставы стопы.
Диагностировать мозоль по характерному внешнему виду совсем не трудно. Необходимо отличать мозоль от заусенец, воспалительных изменений в суставах плюсневых костей, болезни Мортона, генетически обусловленного повышенного ороговения кожи. Некоторые бородавки, особенно подошвенные, по внешнему виду могут напоминать мозоль. Отличительным признаком является большая чувствительность бородавки и возникновение болезненности при ее прокручивании, в то время как мозоль болит при надавливании.
Если пациент обратился на консультацию дерматолога, то врач обязательно должен выяснить, с чем связано образование мозоли.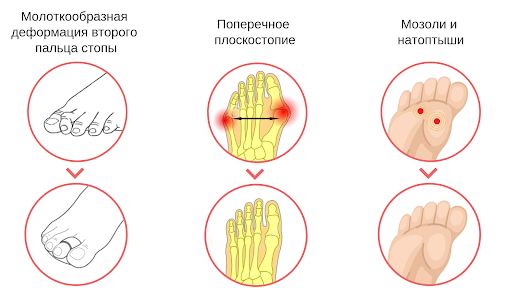 Для этого он будет расспрашивать пациента про его работу, хобби, спортивные и другие увлечения, характер обуви, которую он обычно носит. При локализации мозоли на стопе врач проведет осмотр, направленный на выявление деформаций и заболеваний стопы, при необходимости направит пациента к подологу, ревматологу или ортопеду. Важное значение имеет наличие у пациента таких заболеваний как сахарный диабет, неврит, облитерирующий эндартериит, варикозная болезнь с хронической венозной недостаточностью. При выявлении в анамнезе таких заболеваний для определения наиболее адекватной тактики лечения мозоли требуется консультация соответственно эндокринолога, невролога, сосудистого хирурга или флеболога.
Для этого он будет расспрашивать пациента про его работу, хобби, спортивные и другие увлечения, характер обуви, которую он обычно носит. При локализации мозоли на стопе врач проведет осмотр, направленный на выявление деформаций и заболеваний стопы, при необходимости направит пациента к подологу, ревматологу или ортопеду. Важное значение имеет наличие у пациента таких заболеваний как сахарный диабет, неврит, облитерирующий эндартериит, варикозная болезнь с хронической венозной недостаточностью. При выявлении в анамнезе таких заболеваний для определения наиболее адекватной тактики лечения мозоли требуется консультация соответственно эндокринолога, невролога, сосудистого хирурга или флеболога.
Как правило, не сопровождающаяся болевым синдромом мозоль не требует лечения. При возникновении боли необходимо устранить фактор ее вызывающий: узкую обувь, трение о рукоятку инструмента и т. п. Смягчить трение и давление на мозоль, возникающие при ходьбе, помогают специальные защитные подкладки для мозоли.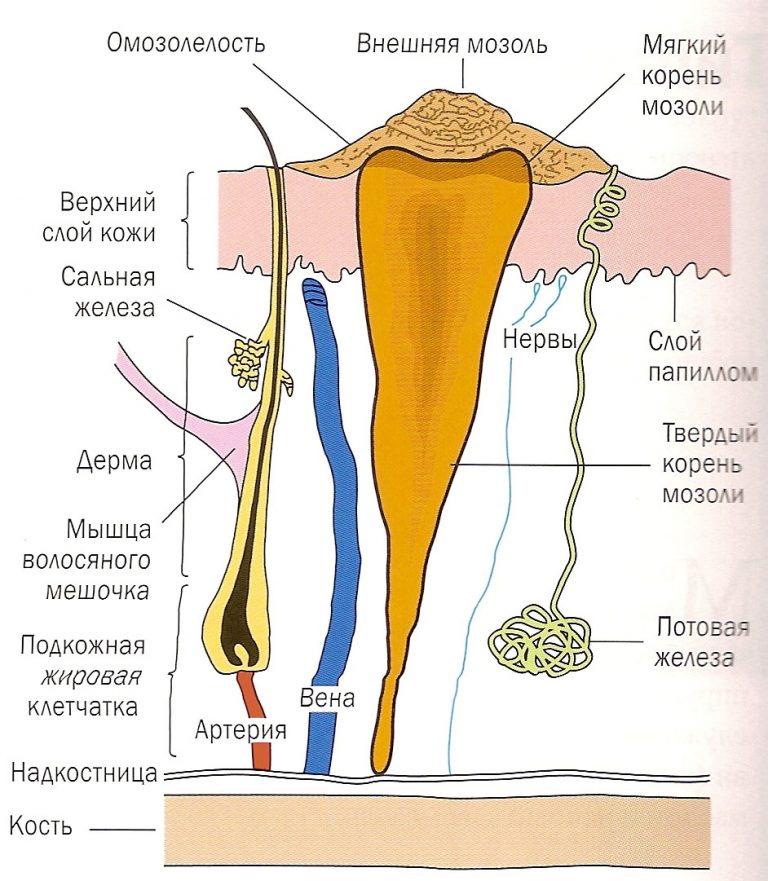 Такую подкладку можно сделать самостоятельно. Из мягкой и достаточно толстой ткани вырезают круг с отверстием в центре. Круг прикладывают так, чтобы в центральном отверстии была мозоль. Если мозоли находятся под пальцами ног, используют специальную плюсневую подкладку, изготовленную из войлока, резины или мягкого пластика. При расположении мозоли на пальцах применяют прокладоки между пальцами, рукава и чехлы для пальцев. Разделяющие пальцы прокладки устраняют их трение друг о друга. Рукава и чехлы, которые одеваются на пальцы, защищают их боковую поверхность и кончики.
Такую подкладку можно сделать самостоятельно. Из мягкой и достаточно толстой ткани вырезают круг с отверстием в центре. Круг прикладывают так, чтобы в центральном отверстии была мозоль. Если мозоли находятся под пальцами ног, используют специальную плюсневую подкладку, изготовленную из войлока, резины или мягкого пластика. При расположении мозоли на пальцах применяют прокладоки между пальцами, рукава и чехлы для пальцев. Разделяющие пальцы прокладки устраняют их трение друг о друга. Рукава и чехлы, которые одеваются на пальцы, защищают их боковую поверхность и кончики.
В случае сухой мозоли обработку мозоли проводят в салонах красоты как отдельную процедуру или в ходе выполнения педикюра или маникюра. Для этого применяют специальные размягчающие мозоль составы, салициловую кислоту, аппаратный педикюр. Мягкие мозоли и вскрывшиеся водянки обязательно обрабатывают антисептиками с наложением защитной повязки, которую фиксируют пластырем.
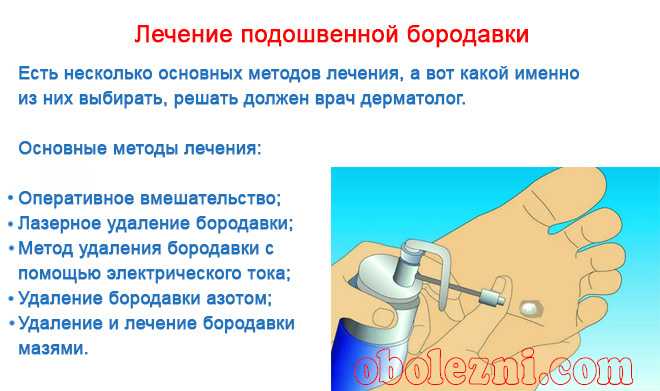
При выявлении деформаций стопы по возможности проводится ортопедическое лечение. В случае сопутствующей патологии, приводящей к нарушению иннервации или кровоснабжения в области мозоли, лечение должно проводиться совместно с соответствующим специалистом. Если консервативные методы лечения мозоли не приносят результата, необходимо ее удаление. Может быть проведена криодеструкция мозоли, ее удаление лазером, электрокоагуляция, удаление радиоволновым методом или хирургическое иссечение.
В случае сопутствующей патологии, приводящей к нарушению иннервации или кровоснабжения в области мозоли, лечение должно проводиться совместно с соответствующим специалистом. Если консервативные методы лечения мозоли не приносят результата, необходимо ее удаление. Может быть проведена криодеструкция мозоли, ее удаление лазером, электрокоагуляция, удаление радиоволновым методом или хирургическое иссечение.
Профилактические мероприятия, направленные на предупреждение образования мозоли, состоят в ношении мягкой, достаточно свободной обуви с хорошей подошвой; применении защитных перчаток при работе с инструментами, наколенников и других защитных средств на места, подвергающиеся постоянному трению. Правильный уход за кожей кистей и стоп, регулярное применение смягчающих кремов, обработка пемзой участков повышенного ороговения кожи также способствует предупреждению образования мозолей.
Вы можете поделиться своей историей болезни, что Вам помогло при лечении мозоли.
Источники
ВАЖНО
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
1. Zanakis GN, Mariolis NA, Rodiatos AJ, Kesoglou AP, Paraskevakos EP, Dimou KN, et al. Химическая борьба с вредителями кукурузы Ostrinia nubilalis (Lepidoptera: Crambidae) и Sesamia nonagrioides (Lepidoptera: Noctuidae) в Греции. В: Андреадис С.С., Савопулу-Султани М., Иоаннидис П. (ред.) Труды 13-го Всегреческого энтомологического конгресса. Copycity, Салоники; 2009 г.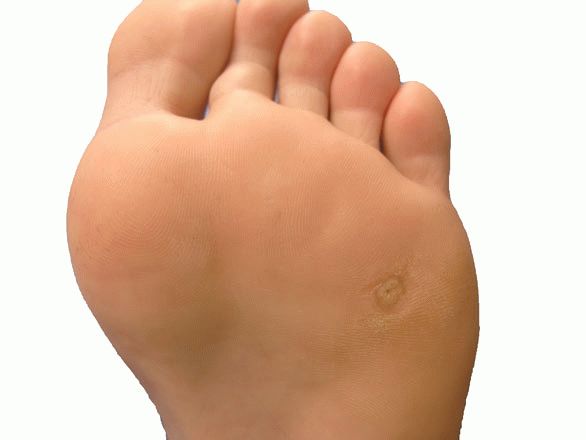 . стр. 302–303.
. стр. 302–303.
2. Галише П-Ф. Спячка популяции Sesamia nonagrioides Lef. (Lep., Noctuidae) в меридиональной Франции. Агрономия. 1982; 2: 561–566. 10.1051/agro:19820609 [CrossRef] [Google Scholar]
3. Руссо Д. Майс: Сезамия прогресса, шапка на севере, данс л'эйр-марин и анжеванский душ: Прогресс сезами в Пэи-де-ла- Луара: город в регионе, а также медитер во Франции. Phytoma-La Défense des Végétaux. 2009; 622–623: 38–41. [Академия Google]
4. Сантьяго Р., Цао А., Малвар Р.А., Бутрон А. Можно ли контролировать загрязнение фумонизином зерен кукурузы с помощью генотипов, устойчивых к средиземноморскому кукурузному мотыльку? Дж Экон Энтомол. Нарния; 2013; 106: 2241–2246. 10.1603/ec13084 [PubMed] [CrossRef] [Google Scholar]
5. Eizaguirre M, Fantinou AA. Обилие Sesamia nonagrioides (Lef.) (Lepidoptera: Noctuidae) на окраинах Средиземноморского бассейна. Психея. хиндави; 2012. С. 1–7. 10.1155/2012/854045 [CrossRef] [Академия Google]
6. Гемси Г. Камали К. Биология, круг хозяев и повреждение стеблевой мотылька в Хузестане. Прикладная энтомология и фитопатология. 1992; 1–2: 31–33. [Google Scholar]
Гемси Г. Камали К. Биология, круг хозяев и повреждение стеблевой мотылька в Хузестане. Прикладная энтомология и фитопатология. 1992; 1–2: 31–33. [Google Scholar]
7. Мойал П., Токро П., Байрам А., Савопулу-Султани М., Конти Э., Эйзагирре М. и др. Происхождение и таксономический статус палеарктической популяции стеблевого мотылька Sesamia nonagrioides (Lefèbvre) (Lepidoptera: Noctuidae). Biol J Linn Soc. 2011; 103: 904–922. [Google Scholar]
8. Buès R, Eizaguirre M, Toubon JF, Albages R. Ферментативные и экофизиологические различия между популяциями С . nonagrioides Lefèbre (Lépidoptere: Noctuidae) originaires de l’ouest du bassin Méditérranéen. Можно Энтомол. 1996; 128: 849–858. 10.4039/Ent128849-5 [CrossRef] [Google Scholar]
9. Margaritopoulos J, Gotosopoulos B, Mamuris Z, Skouras PJ, Voudouris KC, Bacandritsos N, et al. Генетическая изменчивость среди средиземноморских популяций Sesamia nonagrioides (Lepidoptera: Noctuidae), выявленная с помощью RFLP-анализа мтДНК.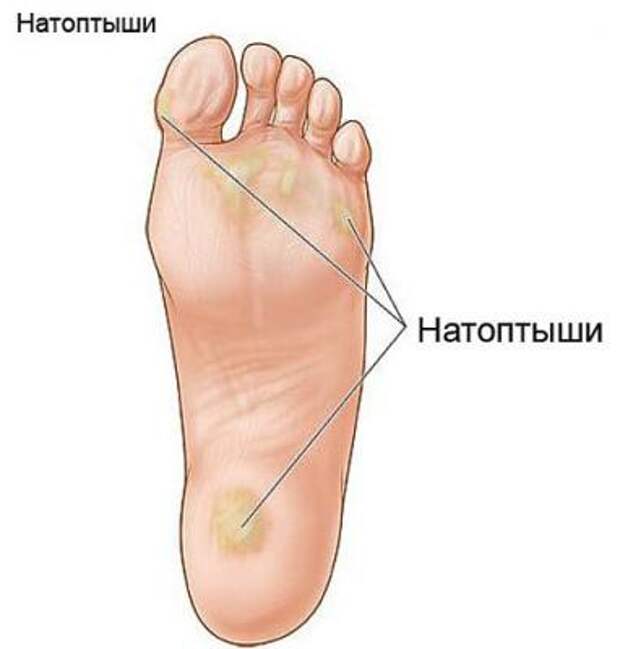 Бык Энтомол Рез. 2007 г.; 97: 299 10.1017/S000748530700507X [PubMed] [CrossRef] [Академия Google]
Бык Энтомол Рез. 2007 г.; 97: 299 10.1017/S000748530700507X [PubMed] [CrossRef] [Академия Google]
10. Де Ла Поза М., Фаринос Г.П., Бероис Б., Ортего Ф., Эрнандес-Креспо П., Кастаньера П. Генетическая структура S . nonagrioides (Lefèbvre) популяции в Средиземноморье. Энвирол Энтомол. 2008; 37: 1354–1360. [PubMed] [Google Scholar]
11. Kergoat GJ, Toussaint EFA, Capdevielle-Dulac C, Clamens AL, Ong’amo G, Conlong D, et al. Интегративная таксономия выявила шесть новых видов, связанных со средиземноморским кукурузным мотыльком Sesamia nonagrioides (Лефевр) (Lepidoptera, Noctuidae, Sesamiina). Zool J Linn Soc. 2015; 175: 244–270. 10.1111/zoj.12275 [CrossRef] [Google Scholar]
12. Bourguet D, Bethenod MT, Trouvé C, Viard F. Разнообразие растений-хозяев европейского кукурузного мотылька Ostrinia nubilalis : Какая ценность для устойчивой трансгенной инсектицидной Bt-кукурузы ? Proc R Soc B Biol Sci. 2000; 267: 1177–1184. 10.1098/рспб. 2000.1126 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2000.1126 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Midamegbe A, Vitalis R, Malausa T, Delava É, Cros-Arteil S, Streiff R. Сканирование кукурузного мотылька ( Ostrinia spp .) геном для адаптивной дивергенции между родственными хозяевами видами-братьями. Мол Экол. 2011;20: 1414–1430. 10.1111/j.1365-294X.2011.05035.x [PubMed] [CrossRef] [Google Scholar]
14. Orsucci M, Ramora B, Streiff R, Pommier A, Audiot P, Bourguet D, et al. Специализация хозяина, включающая влечение, избегание и производительность, у двух видов бабочек-фитофагов. Дж. Эвол Биол. 2015; 29: 114–125. 10.1111/jeb.12766 [PubMed] [CrossRef] [Google Scholar]
15. Prowell DP, McMichael M, Silvain J-F. Многолокусный генетический анализ использования хозяев, интрогрессии и видообразования в штаммах-хозяевах травяной совки (Lepidoptera: Noctuidae). Энн Энтомол Soc Am. 2006;97: 1034–1044. 10.1603/0013-8746(2004)097[1034:mgaohu]2.0.co;2 [CrossRef] [Google Scholar]
16. Dumas P, Legeai F, Lemaitre C, Scaon E, Orsucci M, Labadie K, et al. . Spodoptera frugiperda (Lepidoptera: Noctuidae) варианты растения-хозяина: два штамма-хозяина или два разных вида? Генетика. 2015; 143: 305–316. 10.1007/s10709-015-9829-2 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Dumas P, Legeai F, Lemaitre C, Scaon E, Orsucci M, Labadie K, et al. . Spodoptera frugiperda (Lepidoptera: Noctuidae) варианты растения-хозяина: два штамма-хозяина или два разных вида? Генетика. 2015; 143: 305–316. 10.1007/s10709-015-9829-2 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Онгамо Г.О., Ле Рю Б.П., Мойал П., Калатаюд П.А., Ле Галл П., Огол CKPO и др. Разнообразие растений-хозяев Sesamia calamistis : Последовательности гена цитохрома b обнаруживают локальную генетическую дифференциацию. Entomologia Experimentalis et Applicata. 2008. стр. 154–161. [Google Scholar]
18. Leniaud L, Audiot P, Bourguet D, Frerot B, Genestier G, Lee SF, et al. Генетическая структура популяций европейской и средиземноморской кукурузной мотыльки на нескольких дикорастущих и культивируемых растениях-хозяевах. Entomol Exp Appl. 2006; 120: 51–62. [Google Scholar]
19. Jarne P, Lagoda PJ. Микросателлиты, от молекул к популяциям и обратно. Тенденции Экол Эвол. 1996;11: 424–9. 10.1016/0169-5347(96)10049-5 [PubMed] [CrossRef] [Google Scholar]
Тенденции Экол Эвол. 1996;11: 424–9. 10.1016/0169-5347(96)10049-5 [PubMed] [CrossRef] [Google Scholar]
20. Raymond M, Rousset F. GENEPOP в Интернете (версия 3.4). URL http://wbiomed.curtin.edu.au/genepop/Обновлено от Raymond Rousset. 1995 год;
21. Meglecz E, Petenian F, Danchin E, D'Acier AC, Rasplus JY, Faure E. Высокое сходство между фланкирующими областями различных микросателлитов, обнаруженных у каждого из двух видов чешуекрылых: Parnassius apollo и Euphydryas aurinia . Мол Экол. 2004;13:1693–1700. 10.1111/j.1365-294X.2004.02163.x [PubMed] [CrossRef] [Google Scholar]
22. Sinama M, Dubut V, Costedoat C, Gilles A, Junker M, Malausa T, et al. Проблемы развития микросателлитов у чешуекрылых: Euphydryas aurinia (Nymphalidae) в качестве примера. Евр Дж Энтомол. 2011; 108: 261–266. 10.14411/eje.2011.035 [CrossRef] [Google Scholar]
23. Chapuis M-P, Estoup A. Микросателлитные нулевые аллели и оценка популяционной дифференциации\n10. 1093/molbev/msl191. Мол Биол Эвол. 2007; 24: 621–631. 10.1093/мольбев/мсл191 [PubMed] [CrossRef] [Google Scholar]
1093/molbev/msl191. Мол Биол Эвол. 2007; 24: 621–631. 10.1093/мольбев/мсл191 [PubMed] [CrossRef] [Google Scholar]
24. Chybicki I, Burczyk J. Одновременная оценка нулевых аллелей и коэффициентов инбридинга. Дж. Херед. 2008; 100: 106–113. 10.1093/Джеред/esn088 [PubMed] [CrossRef] [Google Scholar]
25. Dakin EE, Avise JC. Микросателлитные нулевые аллели в анализе отцовства. Наследственность. 2004; 93: 504–509. 10.1038/sj.hdy.6800545 [PubMed] [CrossRef] [Google Scholar]
26. Угельвиг Л.В. Андерсен А., Боосма Дж.Дж., Нэш Д.Р. Распространение и поток генов у редкой паразитической большой голубой бабочки Maculinea arion . Мол Экол. 2012;21: 3224–3236. 10.1111/j.1365-294X.2012.05592.x [PubMed] [CrossRef] [Google Scholar]
27. Эванно Г., Регнаут С., Гуде Дж. Определение количества кластеров людей с использованием структуры программного обеспечения: имитационное исследование. Мол Экол. 2005; 14: 2611–2620. 10.1111/j.1365-294X.2005.02553.x [PubMed] [CrossRef] [Google Scholar]
28. Белхир К., Борса П., Чихи Л., Рауфаст Н., Бонхом Ф. GENETIX 4.05, программное обеспечение Windows TM для популяционной генетики. Laboratoire genome, популяции, взаимодействия. CNRS Умр. 2004 г.; 5000. [Google Академия]
Белхир К., Борса П., Чихи Л., Рауфаст Н., Бонхом Ф. GENETIX 4.05, программное обеспечение Windows TM для популяционной генетики. Laboratoire genome, популяции, взаимодействия. CNRS Умр. 2004 г.; 5000. [Google Академия]
29. Ланджелла О. НАСЕЛЕНИЕ [Интернет]. 1999 [по состоянию на 23 марта 2019 г.]. Доступно: http://www.bioinformatics.org/project/?group_id=84
30. Pritchard JK, Stephens M, Donnelly P. Вывод структуры популяции с использованием данных о многолокусных генотипах. Генетика. 2000; 155: 945–959. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Franco̧is O, Ancelet S, Guillot G. Байесовская кластеризация с использованием скрытых марковских случайных полей в пространственной популяционной генетике. Генетика. 2006; 174: 805–816. 10.1534/генетика.106.059923 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Guillot G, Mortier F, Estoup A. GENELAND: Компьютерный пакет для ландшафтной генетики. Заметки Мол Эколь. 2005;5: 712–715. 10.1111/j.1471-8286.2005.01031.x [CrossRef] [Google Scholar]
10.1111/j.1471-8286.2005.01031.x [CrossRef] [Google Scholar]
33. Falush D, Stephens M, Pritchard JK. Вывод о структуре популяции с использованием данных о многолокусных генотипах: связанные локусы и коррелированные частоты аллелей. Генетика. 2003; 164: 1567–87. 10.1001/jama.1987.03400040069013 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Якобссон М., Розенберг Н.А. CLUMPP: программа сопоставления и перестановки кластеров для работы с переключением меток и мультимодальностью при анализе структуры населения. Биоинформатика. 2007; 23: 1801–1806 гг. 10.1093/биоинформатика/btm233 [PubMed] [CrossRef] [Google Scholar]
35. Джомбарт Т., Ахмед И. Адегенет 1.3–1: новые инструменты для анализа полногеномных данных SNP. Биоинформатика. 2011 г.; 27: 3070–307. 10.1093/биоинформатика/бтр521 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Розенберг Н.А. disstruct: программа для графического отображения структуры населения. Заметки Мол Эколь. 2003;4: 137–138. 10.1046/j.1471-8286.2003.00566.x [CrossRef] [Google Scholar]
2003;4: 137–138. 10.1046/j.1471-8286.2003.00566.x [CrossRef] [Google Scholar]
37. Руссе Ф. Генетическая дифференциация между особями. Дж. Эвол. биол. 2000; 13: 58–62. [Google Scholar]
38. Team R. Core, язык и среда для статистических вычислений. R Фонд статистических вычислений. 2010. [Google Scholar]
39. Excoffier L, Smouse PE, Quattro JM. Анализ молекулярной дисперсии, полученный на основе метрических расстояний между гаплотипами ДНК - приложения к данным об ограничении митохондриальной ДНК человека. Генетика. 1992;131: 479–491. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Mcardle BH, Anderson MJ. Подгонка многомерных моделей к данным сообщества: комментарий к анализу избыточности на основе расстояния Опубликовано: Экологическое общество Америки Stable; URL-адрес: http://www.jstor.org/stable/2680104. Америка (Нью-Йорк) 2001; 82: 290–297. 10.1890/0012-9658 [CrossRef] [Google Scholar]
41. Oksanen AJ, Blanchet FG, Kindt R, Legendre P, Minchin PR, Hara RBO, et al. Общественный экологический пакет «веганский». R версия 2.3–1. Доступно: https://cran.r-project.org/web/packages/vegan/. 2015.
Общественный экологический пакет «веганский». R версия 2.3–1. Доступно: https://cran.r-project.org/web/packages/vegan/. 2015.
42. Джойс А.Л., Сермено Чикас М., Серрано Сервантес Л., Паниагуа М., Шеффер С.Дж., Солис М.А. Связанное с растением-хозяином генетическое расхождение двух видов Diatraea . (Lepidoptera: Crambidae) стеблевые бурильщики на новых культурных растениях. Эколь Эвол. 2016;6: 8632–8644. 10.1002/экс3.2541 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Martel C, Réjasse A, Rousset F, Bethenod M-T, Bourguet D. Генетическая дифференциация, связанная с растением-хозяином, в северных французских популяциях европейского кукурузного мотылька . Наследственность. 2003;90: 141–149. 10.1038/sj.hdy.6800186 [PubMed] [CrossRef] [Google Scholar]
44. Thomas Y, Bethenod MT, Pelozuelo L, Frérot B, Bourguet D. Генетическая изоляция между двумя симпатрическими расами растений-хозяев европейского кукурузного мотылька, Ostrinia nubilalis Hübner . I. Половой феромон, сроки появления бабочек и паразитизм. Эволюция. 2003; 57: 261–273. 10.1111/j.0014-3820.2003.tb00261.x [PubMed] [CrossRef] [Google Scholar]
I. Половой феромон, сроки появления бабочек и паразитизм. Эволюция. 2003; 57: 261–273. 10.1111/j.0014-3820.2003.tb00261.x [PubMed] [CrossRef] [Google Scholar]
45. Calatayud PA, Guénego H, Ahuya P, Wanjoya A, Le Ru B, Silvain JF, et al. Поведение африканского стеблевого мотылька в полете и откладке яиц, Busseola fusca на различных видах растений-хозяев. Entomol Exp Appl. 2008; 129: 348–355. 10.1111/j.1570-7458.2008.00787.x [CrossRef] [Google Scholar]
46. Cruz D, Eizaguirre M. Поведение беременных самок средиземноморского кукурузного мотылька Sesamia nonagrioides : внешняя морфология антенн и яйцеклада сенсилла. Бычья инсектология. 2016; 69: 181–192. [Google Scholar]
47. 1. Petit C, Dupas S, Thiéry D, Capdevielle-Dulac C, Le Ru B, Harry M, et al. Зависят ли механизмы, модулирующие предпочтение хозяина у голометаболических фитофагов, от специализации их растения-хозяина? Количественный анализ литературы. J Pest Sci (2004). 2017;90: 797–805. 10.1007/s10340-017-0833-4 [CrossRef] [Google Scholar]
10.1007/s10340-017-0833-4 [CrossRef] [Google Scholar]
48. Bernays EA. Нейронные ограничения у насекомых-фитофагов: последствия для широты рациона и эволюции принадлежности к хозяину. Анну Рев Энтомол. 2001; 46: 703–727. 10.1146/annurev.ento.46.1.703 [PubMed] [CrossRef] [Google Scholar]
49. Caillaud Via. Специализированное пищевое поведение влияет как на экологическую специализацию, так и на ассортативное спаривание у симпатрических рас-хозяев гороховой тли. Я Нат. 2017;156:606 10.2307/3079066 [PubMed] [CrossRef] [Google Scholar]
50. Мерфи С.М. Непоследовательное использование растений-хозяев аляскинской бабочкой-парусником: эксперименты с предпочтениями взрослых особей предполагают стратегию лабильной откладки яиц. Экол Энтомол. 2007; 32: 143–152. 10.1111/j.1365-2311.2006.00824.x [CrossRef] [Google Scholar]
51. Anderson P, Sadek M, Larsson M, Hansson BS, Thöming G. мотылек Аним Бехав. 2013; 85: 1169–1175. 10.1016/j.anbehav.2013.03.002 [CrossRef] [Google Scholar]
52. Petit C, Le Ru B, Dupas S, Frérot B, Ahuya P, Kaiser-Arnauld L, et al. Влияние диетического опыта на индукцию предпочтения взрослых бабочек и личинок новому обонятельному сигналу. Глинвуд Р., редактор. ПЛОС Один. Публичная научная библиотека; 2015;10: e0136169 10.1371/journal.pone.0136169 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Petit C, Le Ru B, Dupas S, Frérot B, Ahuya P, Kaiser-Arnauld L, et al. Влияние диетического опыта на индукцию предпочтения взрослых бабочек и личинок новому обонятельному сигналу. Глинвуд Р., редактор. ПЛОС Один. Публичная научная библиотека; 2015;10: e0136169 10.1371/journal.pone.0136169 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
53. Safner T, Miller MP, McRae BH, Fortin MJ, Manel S. Сравнение байесовской кластеризации и методов обнаружения границ для определения границ в ландшафтной генетике. Int J Mol Sci. 2011; 12: 865–889.. 10.3390/ijms12020865 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54. Kalinowski ST. Компьютерная программа СТРУКТУРА не может достоверно определить основные генетические кластеры внутри видов: моделирование и последствия для структуры человеческой популяции. Наследственность. 2011; 106: 625–632. 10.1038/hdy.2010.95 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
55. Eizaguirre M, López C, Albajes R. Рассеивающая способность средиземноморского кукурузного мотылька, Sesamia nonagrioides . Entomol Exp Appl. 2004; 113: 25–34. 10.1111/j.0013-8703.2004.00201.x [CrossRef] [Google Scholar]
Рассеивающая способность средиземноморского кукурузного мотылька, Sesamia nonagrioides . Entomol Exp Appl. 2004; 113: 25–34. 10.1111/j.0013-8703.2004.00201.x [CrossRef] [Google Scholar]
. митохондриальная ДНК. Acta Zool Acad Sci Hungaricae. 2015; 61: 341–359. 10.17109/AZH.61.4.341.2015 [CrossRef] [Google Scholar]
57. Jones HBC, Lim KS, Bell JR, Hill JK, Chapman JW. Количественная оценка межвидовых различий в способности к расселению совок с использованием усовершенствованной техники полета на привязи. Эколь Эвол. 2016; 6: 181–19.0.10.1002/ece3.1861 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
58. Джакометти Р. Выращивание Sesamia nonagrioides Lefevre на меридической диете (Lepidoptera, Noctuidae). Редия. 1995; 78: 19–27. [Google Scholar]
59. Ле Ру Б.П., Онгамо Г.О., Мойал П., Мучугу Э., Нгала Л., Мусиока Б. и др. Географическое распространение и ареалы растений-хозяев восточноафриканских совок-стеблевых мотыльков. Энн ла Сок Энтомол о. 2006; 42: 353–361. 10.1080/00379271.2006.10697467 [CrossRef] [Google Scholar]
Энн ла Сок Энтомол о. 2006; 42: 353–361. 10.1080/00379271.2006.10697467 [CrossRef] [Google Scholar]
60. Черагали З., Эсфандиари М., Мосаддык М.С., Мемари Х.Р. Генетическое разнообразие популяций стеблевого мотылька Sesamia nonagrioides (Lepidoptera: Noctuidae) на юге и юго-западе Ирана с использованием RAPD-PCR. Норт-Уэст Джей Зоол. 2015;11: 70–75 [Google Scholar]
1. Wan Rosli W.I., Nurhana A.R., Farid C.G., Mohsin S.S.J. Влияние гидроксида натрия (NaOH) и гипохлорита натрия (NaHClO) на морфологию и концентрацию минералов Zea mays волос (кукурузный шелк) Ann. микроск. 2010; 10:4–10. [Google Scholar]
2. Liu J., Wang C., Wang Z., Zhang C., Lu S., Liu J. Антиоксидантная и нейтрализующая свободные радикалы активность экстракта и фракций кукурузных рылец ( Zea mays л.) и родственные флавоновые гликозиды. Пищевая хим. 2011; 126: 261–269. [Google Scholar]
[Google Scholar]
3. Максимович З., Маленчич Д., Ковачевич Н. Содержание полифенолов и антиоксидантная активность экстрактов Maydis stigma . Биоресурсная технология. 2005;96: 873–877. doi: 10.1016/j.biortech.2004.09.006. [PubMed] [CrossRef] [Google Scholar]
4. Hu Q.L., Zhang L.J., Li Y.N., Ding Y.J., Li F.L. Очистка и антиусталостная активность флавоноидов кукурузных рылец. Междунар. Дж. Физ. науч. 2010;5:321–326. [Google Scholar]
5. Bastien J.W. Фармакопея qollahuayaandeans. Дж. Этнофармакол. 1982; 8: 97–111. doi: 10.1016/0378-8741(83)
-0. [PubMed] [CrossRef] [Google Scholar]6. Касерес А., Хирон Л.М., Мартинес А.М. Мочегонная активность растений, используемых для лечения заболеваний мочевыводящих путей в Гватемале. Дж. Этнофармакол. 1987;19:233–245. doi: 10.1016/0378-8741(87)-8. [PubMed] [CrossRef] [Google Scholar]
7. Дат Д.Д., Хэм Н.Н., Хак Д.Х., Лам Н.Т., Сон П.Т., Дау Н.В., Грабе М., Йоханссон Р., Линдгрен Г., Стьернстром Н. Е. Исследования индивидуальных и комбинированных мочегонных эффектов четырех вьетнамских традиционных растительных лекарственных средств ( Zea mays , Imperatacylindrica , Plantago major и Orthosiphonstamineus ) J. Ethnopharmacol. 1992; 36: 225–231. дои: 10.1016/0378-8741(92)-В. [PubMed] [CrossRef] [Google Scholar]
Е. Исследования индивидуальных и комбинированных мочегонных эффектов четырех вьетнамских традиционных растительных лекарственных средств ( Zea mays , Imperatacylindrica , Plantago major и Orthosiphonstamineus ) J. Ethnopharmacol. 1992; 36: 225–231. дои: 10.1016/0378-8741(92)-В. [PubMed] [CrossRef] [Google Scholar]
8. Grases F., March JG, Ramis M., Costa-Bauzá A. Влияние Zea mays на факторы риска образования камней в почках у крыс. Фитотер. Рез. 1993; 7: 146–149. doi: 10.1002/ptr.2650070210. [CrossRef] [Google Scholar]
9. Есилада Э., Хонда Г., Севик Э., Табата М., Фуджита Т., Танака Т., Такеда Ю., Такаиси Ю. Традиционная медицина в Турции. V. Народная медицина во внутренних Таврских горах. Дж. Этнофармакол. 1995; 46: 133–152. [PubMed] [Академия Google]
10. Стенкамп В. Фитопрепараты для простаты. Фитотерапия. 2003; 74: 545–552. [PubMed] [Google Scholar]
11. Эбрагимзаде М.А., Махмуди М., Ахангар Н., Эхтешами С. , Ансаруди Ф., Набави С.Ф., Набави С.М. Антидепрессантное действие кукурузных рылец. Фармакологияонлайн. 2009; 3: 647–652. [Google Scholar]
, Ансаруди Ф., Набави С.Ф., Набави С.М. Антидепрессантное действие кукурузных рылец. Фармакологияонлайн. 2009; 3: 647–652. [Google Scholar]
12. Velazquez D.V.O., Xavier H.S., Batista J.E.M., Castro-Chaves C.D. Экстракты Zea mays L. изменяют функцию клубочков и выведение калия с мочой у крыс, находящихся в сознании. Фитомедицина. 2005; 12:363–369.. [PubMed] [Google Scholar]
13. Максимович З.А., Ковачевич Н. Предварительный анализ антиоксидантной активности экстрактов Maydis stigma . Фитотерапия. 2003; 74: 144–147. doi: 10.1016/S0367-326X(02)00311-8. [PubMed] [CrossRef] [Google Scholar]
14. Эбрагимзаде М.А., Пурморад Ф., Хафе С. Антиоксидантная активность иранских кукурузных рылец. Турок. Дж. Биол. 2008; 32:43–49. [Google Scholar]
15. Bai H., Hai C., Xi M., Liang X., Liu R. Защитный эффект кукурузного шелка ( Maydis stigma ) Экстракт этанола при радиационно-индуцированном окислительном стрессе у мышей. Растительная пища Хум. Нутр. 2010;65:271–276. [PubMed] [Google Scholar]
Нутр. 2010;65:271–276. [PubMed] [Google Scholar]
16. Сепехри Г., Дерахшанфар А., Заде Ф.Ю. Защитные эффекты введения экстракта кукурузных рылец на нефротоксичность, вызванную гентамицином, у крыс. Комп. клин. Патол. 2011;20:89–94. doi: 10.1007/s00580-009-0943-3. [CrossRef] [Google Scholar]
17. Алам Э.А. Оценка антиоксидантной и антибактериальной активности египетского Maydis stigma ( волоска Zea mays ) богат некоторыми биологически активными компонентами. Варенье. науч. 2011;7:726–729. [Google Scholar]
18. Аноним. Таблетка кукурузного шелка. [(по состоянию на 13 апреля 2011 г.)]. Доступно в Интернете: http://www.nutritional-supplement-bible.com/cornsilk-tablets.html.
19. Аноним. Кукурузный чай, общее использование и преимущества. [(по состоянию на 13 апреля 2011 г.)]. Доступно в Интернете: http://www.cornsilktea.net.
20. Ван Росли В.И., Нурханан А.Р., Мохсин С.С.Дж., Фарид К.Г. Водная, спиртовая обработка и экспресс-анализ стигмы майдиса ( Zea mays волоска) Ann. микроск. 2008; 8: 66–72. [Google Scholar]
микроск. 2008; 8: 66–72. [Google Scholar]
21. Liu J., Lin S., Wang Z., Wang C., Wang E., Zhang Y., Liu J. Экстракция флавоноидов в сверхкритической жидкости из Maydis stigma и удаление нитритов. способность. Пищевые продукты Биопрод. Процесс. 2011; 89: 333–339. [Google Scholar]
22. Аноним. Кукуруза. [(по состоянию на 29 июня 2011 г.)]. Доступно в Интернете: http://www.newworldencyclopedia.org/entry/Maize.
23. Леон Н.Д., Coors J.G. Генетическое улучшение кукурузы для производства лигно-целлюлозного биосырья. В: Вермеррис В., редактор. Генетическое улучшение биоэнергетических культур. Спрингер Наука; Нью-Йорк, штат Нью-Йорк, США: 2008. стр. 185–210. [Академия Google]
24. Инглетт Г.Е. Кукуруза: культура, переработка, продукция. Издательская компания AVI; Вестпорт, Коннектикут, США: 1970. [Google Scholar]
25. Pietta P.G. Флавоноиды как антиоксиданты. Дж. Нат. Произв. 2000;63:1035–1042. doi: 10.1021/np9904509. [PubMed] [CrossRef] [Google Scholar]
26. Snook M.E., Widstrom N.W., Wiseman B.R., Byrne P.F., Harwood J.S., Costello C.E. Новые C-4"-гидроксипроизводные майзина и 3'-метоксимайзина, выделенные из кукурузных рылец. ( Zea mays ) J. Agric. Food Chem. 1995;43:2740–2745. [Google Scholar]
Snook M.E., Widstrom N.W., Wiseman B.R., Byrne P.F., Harwood J.S., Costello C.E. Новые C-4"-гидроксипроизводные майзина и 3'-метоксимайзина, выделенные из кукурузных рылец. ( Zea mays ) J. Agric. Food Chem. 1995;43:2740–2745. [Google Scholar]
27. Ren S.C., Liu Z.L., Ding XL. Выделение и идентификация двух новых флавоновых гликозидов из кукурузных рылец ( Stigma maydis ) J. Med. Растения Рез. 2009;32:1009–1015. [Google Scholar]
28. Elliger C.A., Chan B.G., Waiss A.C., Jr., Lundin RE., Haddon W.F. C-гликозилфлавоны из Zea mays , подавляющие развитие насекомых. Фитохимия. 1980; 19: 293–297. [Google Scholar]
29. Snook M.E., Widstrom N.W., Gueldner R.C. Метод высокоэффективной жидкостной хроматографии с обращенной фазой для определения майзина в кукурузных рыльцах. Ж. Хроматогр. А. 1989;477:439–447. doi: 10.1016/S0021-9673(01)89654-0. [CrossRef] [Google Scholar]
30. Waiss A.C., Chan B.G., Elliger C.A., Wiseman B.R., McMillian W.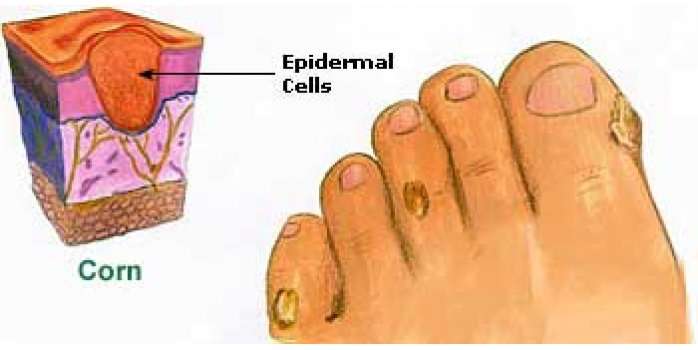 W., Widstrom N.W., Zuber M.S., Keaster A.J. Майзин, флавоновый гликозид из кукурузных рылец с антибиотической активностью в отношении кукурузного ушного червя. Ж. Экономический энтомол. 1979; 72: 256–258. [Google Scholar]
W., Widstrom N.W., Zuber M.S., Keaster A.J. Майзин, флавоновый гликозид из кукурузных рылец с антибиотической активностью в отношении кукурузного ушного червя. Ж. Экономический энтомол. 1979; 72: 256–258. [Google Scholar]
31. Эль-Гораб А., Эль-Массри К.Ф., Шибамото Т. Химический состав летучих экстрактов и антиоксидантная активность летучих и нелетучих экстрактов египетских кукурузных рылец ( Zea mays L.) J. Agric. Пищевая хим. 2007;55:9124–9127. [PubMed] [Google Scholar]
32. Wang C., Zhang T., Liu J., Lu S., Zhang C., Wang E., Wang Z., Zhang Y., Liu J. Исследование субхронической токсичности кукуруза с крысами. Дж. Этнофармакол. 2011; 137:36–43. [PubMed] [Google Scholar]
33. Hashim P. Центелла азиатская в продуктах питания и напитках и ее потенциальное антиоксидантное и нейропротекторное действие. Дж. Междунар. Еда Рез. 2011;18:2217–2222. [Академия Google]
34. Владимир-Кнежевич С., Блажекович Б., Штефан М.Б., Алегро А., Кёсеги Т.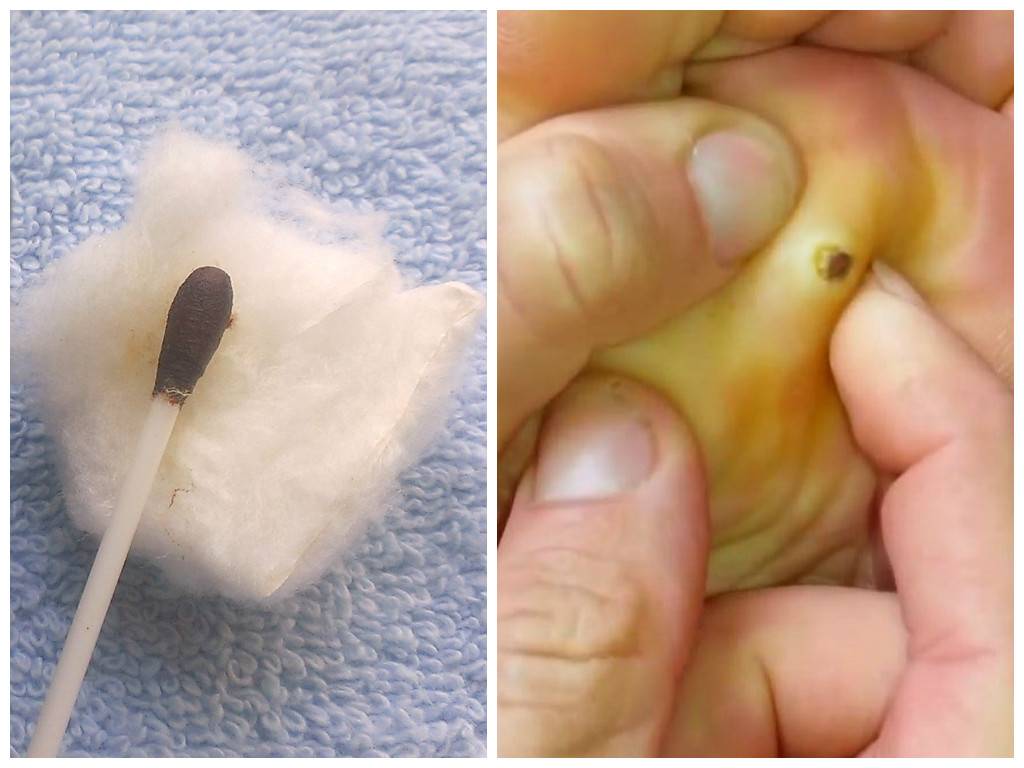 , Петрик Й. Антиоксидантная активность и содержание полифенолов трех выбранных видов микромерий из Хорватии. Молекулы. 2011;16:1454–1470. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Петрик Й. Антиоксидантная активность и содержание полифенолов трех выбранных видов микромерий из Хорватии. Молекулы. 2011;16:1454–1470. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Zhu K.X., Lian C.X., Guo X.N., Peng W., Zhou H.M. Антиоксидантная активность и общее содержание фенолов в различных экстрактах из обезжиренных зародышей пшеницы. Пищевая хим. 2011; 126:1122–1126. doi: 10.1016/j.foodchem.2010.11.144. [Перекрестная ссылка] [Академия Google]
36. Хассас-Роудсари М., Чанг П.Р., Пегг Р.Б., Тайлер Р.Т. Антиоксидантная способность биоактивных веществ, экстрагированных из муки канолы путем экстракции в докритической воде, этаноле и горячей воде. Пищевая хим. 2009; 114: 717–726. doi: 10.1016/j.foodchem.2008.09.097. [CrossRef] [Google Scholar]
37. Кан А., Орхан И., Коксари Г., Сенер Б. In-vitro нейропротекторные свойства экстрактов рыльца майдиса из четырех сортов кукурузы. Междунар. Дж. Пищевая наука. Нутр. 2011; 63:1–4. [PubMed] [Академия Google]
38. Бамп Е.А., Браун Дж.М. Роль глутатиона в радиационном ответе клеток млекопитающих in vitro и in vivo . Фармакол. тер. 1990; 47: 117–136. [PubMed] [Google Scholar]
Бамп Е.А., Браун Дж.М. Роль глутатиона в радиационном ответе клеток млекопитающих in vitro и in vivo . Фармакол. тер. 1990; 47: 117–136. [PubMed] [Google Scholar]
39. Hu Q.I., Deng Z.I. Защитное действие флавоноидов из кукурузных рылец на окислительный стресс, вызванный истощающими физическими упражнениями у мышей. фр. Дж. Био. 2011;10:3163–3167. [Google Scholar]
40. Нгуен Т., Шерратт П.Дж., Пикетт С.Б. Регуляторные механизмы, контролирующие экспрессию генов, опосредованные элементом антиоксидантного ответа. Анну. Преподобный Фарм. Токсикол. 2003; 43: 233–260. [PubMed] [Академия Google]
41. Пинейро А.С.С., Паис А.А., Тардиво А.С.Б., Алвес М.Ж.К.Ф. Влияние водного экстракта кукурузных рылец ( Zea mays L.) на почечную экскрецию воды и электролитов и артериальное давление у наркотизированных крыс Вистар. Revista Brasileira de Plantas Medicinais. 2011;13:375–381. [Google Scholar]
42. Приди В.Р., Уотсон Р.Р. Справочник по бремени болезней и показателям качества жизни.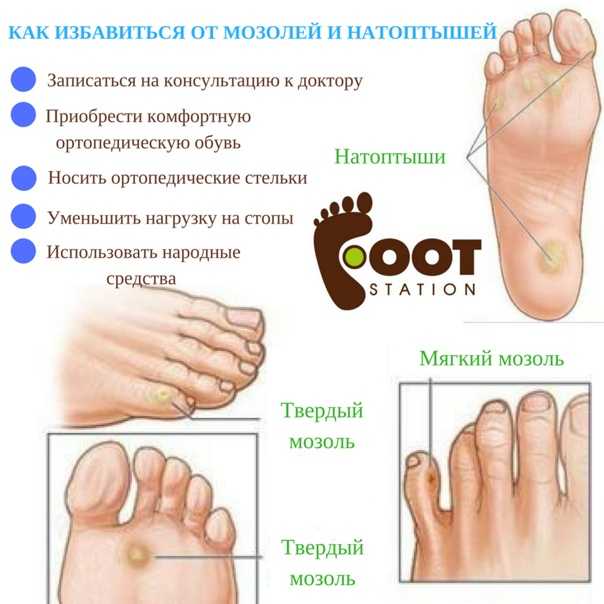 Спрингер; Нью-Йорк, штат Нью-Йорк, США: 2010 г. Глоссарий; п. 4230. [Google Scholar]
Спрингер; Нью-Йорк, штат Нью-Йорк, США: 2010 г. Глоссарий; п. 4230. [Google Scholar]
43. Guo J., Liu T., Han L., Liu Y. Влияние кукурузных рылец на гликемический метаболизм. Нутр. Метаб. 2009 г.;6:47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Ramasamy R., Vannucci S.J., Yan S.S.D., Herold K., Yan S.F., Schmidt A.M. Конечные продукты повышенного гликирования и RAGE: общая угроза старения, диабета, нейродегенерации и воспалений. Гликобиология. 2005; 15:16–28. [PubMed] [Google Scholar]
45. Farsi D.A., Harris C.S., Reid L., Bennett S.A.L., Haddad P.S., Martineau L.C., Arnason J.T. Ингибирование неферментативного гликирования экстрактами шелка мексиканской расы и современных инбредных линий кукурузы (9).0003 Zea mays ) Фитотерм. Рез. 2008; 22:108–112. doi: 10.1002/ptr.2275. [PubMed] [CrossRef] [Google Scholar]
46. Zhao W., Yin Y., Yu Z., Liu J., Chen F. Сравнение антидиабетических эффектов полисахаридов из кукурузных рылец на нормальных крысах и крысах с гипергликемией. Междунар. Дж. Биол. макромол. 2012;50:1133–1137. [PubMed] [Google Scholar]
Междунар. Дж. Биол. макромол. 2012;50:1133–1137. [PubMed] [Google Scholar]
47. Кауп С.Р., Арункумар Н., Бернхардт Л.К., Вазари Р.Г., Шетти С.С., Пай С.Р., Арункумар Б. Антигиперлипедемическая активность экстракта Cynodondactylon в диете с высоким содержанием холестерина, получавшей крыс Wistar. Геномная Мед. Биомарк. наук о здоровье. 2011;3:98–102. doi: 10.1016/j.gmbhs.2011.11.001. [CrossRef] [Google Scholar]
48. Шрайнер Г.Е. Токсическая нефропатия: неблагоприятные эффекты на почки, вызванные лекарствами и химическими веществами. ДЖАМА. 1965; 191: 849–850. doi: 10.1001/jama.1965.03080100067015. [PubMed] [CrossRef] [Google Scholar]
49. Нгемфо Э.Л., Димо Т., Азебазе А.Г.Б., Асонгалем Э.А., Алауи К., Донгмо А.Б., Черра Ю., Камчуинг П. экстракты коры стебля Allanblackia monticola STANER L.C. (Guttiferae) J. Ethnopharmacol. 2007; 114:417–424. doi: 10.1016/j.jep.2007.08.022. [PubMed] [CrossRef] [Академия Google]
50. Stoecklin G., Lu M., Rattenbacher B., Moroni C. Элемент конститутивного распада способствует деградации мРНК фактора некроза опухоли альфа через независимый от AU путь. Мол. Клетка. биол. 2003; 23:3506–3515. doi: 10.1128/MCB.23.10.3506-3515.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Элемент конститутивного распада способствует деградации мРНК фактора некроза опухоли альфа через независимый от AU путь. Мол. Клетка. биол. 2003; 23:3506–3515. doi: 10.1128/MCB.23.10.3506-3515.2003. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Habtemariam S. Экстракт кукурузных рылец (стигма Zea mays ) Ингибирует фактор некроза опухоли-α- и бактериальный липополисахарид-индуцированную адгезию клеток и Выражение ICAM-1. Планта Мед. 1998;64:314–318. doi: 10.1055/s-2006-957441. [PubMed] [CrossRef] [Google Scholar]
52. Wang G.Q., Xu T., Bu X.M., Liu B.Y. Противовоспалительное действие кукурузных рылец на крысиной модели каррагенин-индуцированного плеврита. Воспаление. 2011; 35: 822–827. [PubMed] [Google Scholar]
53. Мигель М.Г. Антиоксидантная и противовоспалительная активность эфирного масла: краткий обзор. Молекулы. 2010;15:9252–9287. doi: 10,3390/молекулы15129252. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
54.