2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Всемирная организация здравоохранения (ВОЗ) обновила рекомендации по лечению пациентов, включив в них блокаторы рецепторов к интерлейкину-6 – группу спасительных лекарственных препаратов для пациентов, тяжело или критически больных COVID‑19. Прием этих препаратов особенно важен при назначении кортикостероидов
Данные выводы были сделаны на основании перспективного и динамического сетевого метаанализов, которые были инициированы ВОЗ и являются самыми масштабными из всех проводившихся до сих пор анализов в отношении лекарственных препаратов. Были изучены данные по более чем 10 000 пациентов, принявших участие в 27 клинических испытаниях.
Это первые лекарственные препараты, признанные эффективными против COVID-19 с тех пор, как в сентябре 2020 г. ВОЗ рекомендовала применение кортикостероидов.
Пациенты с тяжелой или критической формой COVID-19 часто имеют чрезмерную реакцию иммунной системы, которая может причинить серьезный вред здоровью. Такую чрезмерную иммунную реакцию подавляют препараты-ингибиторы интерлейкина-6 – тоцилизумаб и сарилумаб.
Перспективный и динамический сетевой метаанализы показали, что в сравнении со стандартной схемой лечения назначение этих препаратов пациентам с тяжелой или критической формой заболевания позволяет на 13% снизить вероятность летального исхода. Это означает, что снижение числа летальных исходов достигает 15 на тысячу пациентов и 28 на тысячу критически больных пациентов. Вероятность необходимости применения механической вентиляции легких пациентов с тяжелой или критической формой заболевания снижается, в сравнении со стандартной схемой лечения, на 28%. Это означает, что на тысячу пациентов в механической вентиляции легких нуждается на 23 пациента меньше.
ВОЗ получила данные от исследователей клинических испытаний в 28 странах, включая данные еще готовящихся к публикации исследований. Они были составлены и проанализированы исследователями во всем мире. Благодаря этим важным партнерским отношениям ВОЗ смогла оперативно издать заслуживающую доверия рекомендацию в отношении использования блокаторов рецепторов к интерлейкину-6 в случае пациентов, тяжело или критически больных COVID-19.
«Эти препараты дают надежду пациентам и родным пациентов, тяжело или критически больных COVID-19. Однако для большинства людей в мире блокаторы рецепторов к IL-6 остаются недоступными и лишком дорогостоящими, – заявил Генеральный директор ВОЗ д-р Тедрос Адханом Гебрейесус. – Несправедливое распределение вакцин означает, что наиболее подверженным риску развития тяжелой формы заболевания COVID-19 является население стран с низким или средним уровнем дохода. Таким образом, наибольшая потребность в этих лекарственных препаратах ощущается в странах, население которых в настоящее время имеет наиболее ограниченный доступ к ним. Данную ситуацию необходимо срочно изменить».
Для того чтобы улучшить доступ к этим спасительным препаратам, а также сделать их более доступными по цене, ВОЗ призывает всех производителей снизить цены и обеспечить поставки в страны с низким или средним уровнем дохода, особенно в те страны, в которых резко растет заболеваемость COVID-19.
ВОЗ также призывает компании принять прозрачные неисключительные и непринудительные лицензионные соглашения с использованием платформы C-TAP и Патентного пула лекарственных средств или отказать от исключительных прав.
Кроме того, ВОЗ призвала производителей подавать предварительные заявки для преквалификации блокаторов рецепторов к интерлейкину-6. Преквалификация инновационных и биоэквивалентных лекарственных препаратов имеет своей целью расширить поставки препаратов гарантированного качества, повысить их доступность с помощью механизмов рыночной конкуренции и снизить цены для удовлетворения срочных потребностей общественного здравоохранения.
Ученые из Китая рассказали о новом маркере, который указывает на высокий риск летального исхода от коронавирусной инфекции пациентов отделений интенсивной терапии. В расчеты они включили смертность среди больных в течение 28 дней после их поступления в медучреждение. Исследователи создали упрощенный индекс иммунной дисрегуляции: пропорцию количества интерлейкина-6 к количеству лимфоцитов в крови. Российские специалисты уверены, что перспективную методику необходимо использовать в больницах уже сейчас. Предложенная формула действительно показывает более тяжелое течение заболевания и дает возможность медикам принять экстренные меры до момента критического ухудшения состояния пациента.
Медики из отделения интенсивной терапии Первой дочерней больницы Университета Сучжоу опубликовали исследование, в котором сообщили о новом разработанном ими показателе критического состояния пациентов, находящихся в отделении интенсивной терапии. Всего в исследование включены 172 заболевших, из которых 50,5% умерли в реанимации в течение 28 дней с момента поступления. Как сказано в статье, выжившие имели более высокое количество лимфоцитов в крови и более низкий уровень интерлейкина-6 (ИЛ-6 — один из важнейших медиаторов острой фазы воспаления. — «Известия»).
Проанализировав полученные данные, ученые разработали формулу повышенного риска, которая представлена как отношение интерлейкина-6 к лимфоцитам (ИЛ-6 /лимфоциты). В выводах статьи указано, что расчеты с помощью выявленной корреляции обладают улучшенной прогностической ценностью по сравнению с отдельным измерением изменений этих показателей. Новый маркер может быть также использован для выявления пациентов с высоким риском смерти, которые нуждаются в более своевременной терапии на ранней стадии COVID-19.
Фото: Global Look Press/Keystone Press Agency/Yang Shunpi
Найденная китайскими специалистами корреляция действительно показывает более тяжелое течение болезни у пациентов с коронавирусной инфекцией. Это подтверждают и отечественные исследователи, сообщила «Известиям» врач-инфекционист, сотрудник научно-клинического отдела МГЦ СПИД и Международного центра вирусологии РУДН Елена Белова.
— Выявлена связь прогностически более тяжелого течения болезни и величины коэффициента интерлейкина-6 в отношении к количеству лимфоцитов. Чем он выше, тем прогноз хуже — пациенты переносят заболевание тяжелее, — пояснила эксперт. — Нужно контролировать параметры и интерлейкина-6, и лимфоцитов в комплексе с другими лабораторными и инструментальными показателями, для того чтобы иметь возможность оказывать помощь данным пациентам как можно раньше. До ухудшения их состояния.
По словам Елены Беловой, для мониторинга состояния тяжелых больных, находящихся в реанимации, сейчас учитывается множество показателей: общий анализ крови, С-реактивный белок, биохимический анализ крови, а также данные компьютерной томограммы и многие другие.
Научный сотрудник лаборатории анализа показателей здоровья населения и цифровизации здравоохранения МФТИ, младший научный сотрудник лаборатории экспериментальной хирургии и онкологии Курского государственного медицинского университета Давид Наимзада сообщил «Известиям», что новый маркер тяжелого состояния имеет ряд преимуществ, так как измерить его несложно.
Фото: ИЗВЕСТИЯ/Сергей Коньков
— Отношение ИЛ-6 и лимфоцитов, очевидно, призвано отражать дисбаланс провоспалительных факторов и характеризовать вероятность развития «цитокинового шторма». Наибольший интерес представляет доступность используемых в статье маркеров. Лимфоциты можно сдать везде, а ИЛ-6 определяется реакцией иммунофлюоресценции, также доступной достаточно широко — в любой городской больнице, — подчеркнул специалист.
Более того, использовать эту формулу можно не только для выявления тяжелых больных при коронавирусной пневмонии. Этот маркер можно применять и в более широком смысле: для оценки рисков у больных с синдромом системного воспалительного ответа, уверен Давид Наимзада.
Медики подчеркивают, что для оценки состояния находящихся в стационарах пациентов с коронавирусом необходим системный поход. Как сообщил «Известиям» заместитель заведующего лабораторией анализа показателей здоровья населения и цифровизации здравоохранения МФТИ (вуз-участник проекта «5-100») Станислав Отставнов, на сегодняшний момент уже применяется ряд предикторов различных осложнений и смерти. В статье китайских ученых говорится о том, что комплексный показатель информативнее, чем его компоненты по отдельности.
— Однако необходимо понимать, что пациенты отделений реанимации и интенсивной терапии, как правило, страдают букетом других заболеваний (ишемическая болезнь сердца, диабет, онкология), каждое из которых имеет свои маркеры, и они сами по себе могут привести к смерти, — отметил эксперт. — Данная вероятность повышается при инфицировании коронавирусом.
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
Поэтому, по его словам, разработанная китайскими авторами формула обладает некоторым потенциалом для построения прогнозов, но одной ее недостаточно.
Сами авторы научной работы подчеркивают, что у нее есть ряд ограничений. В частности, опыт всего одной больницы. Необходимы дальнейшие исследования для сравнения ИЛ-6 / лимфоцитов у пациентов из групп риска и других иммунологических показателей. В Министерстве здравоохранения РФ на момент публикации не предоставили ответ на вопрос, будет ли такой анализ востребован в России.
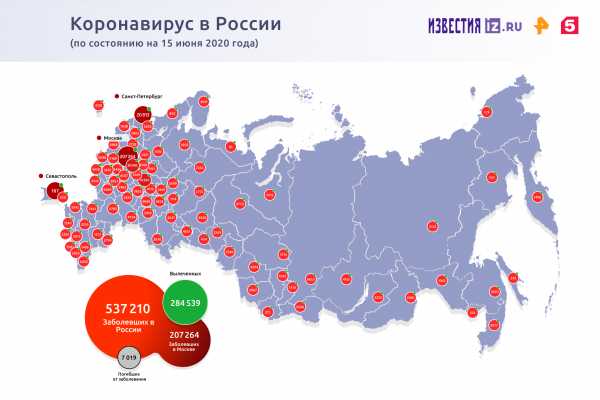
По данным Роспотребнадзора на утро 15 июня в России выявлено 8246 новых случаев коронавируса в 83 регионах. Зафиксировано 143 летальных исхода. За сутки в России полностью выздоровели 4489 человек.
ЧИТАЙТЕ ТАКЖЕ
Интерлейкин-6 у больных COVID-19
Что такое цитокиновый шторм.
Обнаружено, что коронавирусы способны приводить к излишнему, нерегулируемому иммунному ответу в организме хозяина — синдрому высвобождения цитокинов. Всё чаще звучит информация о том, что данный вид иммунного ответа является неотъемлемой частью развития дисфункции органов-мишеней и одним из основных факторов заболеваемости и смертности. В том числе он может служить подоплекой в развитии острого респираторного дистресс синдрома (ОРДС) у больных COVID-19. Прогрессирование COVID-19 до осложненного заболевания может быть следствием чрезмерного, нерегулируемого иммунного ответа хозяина и аутоиммунного повреждения.
«Цитокиновый шторм» — воспалительная реакция в организме, при которой уровень цитокинов в крови резко возрастает, что приводит к атаке иммунитета на клетки и ткани собственного организма. Следствием этого может стать разрушение тканей и органов, и, как следствие, гибель организма.
Воспаление развивается в самых разных органах и в сочетании с нехваткой кислорода может привести к их недостаточности. ОРДС, наблюдаемый при тяжелом течении COVID-19, характеризуется затрудненным дыханием и низким уровнем кислорода в крови. В результате у некоторых пациентов могут развиться вторичные бактериальные и грибковые инфекции. ОРДС может привести к дыхательной недостаточности, которая является причиной смерти в 70 % случаев летальных исходов COVID-19. Кроме того, мощный выброс цитокинов иммунной системой в ответ на вирусную инфекцию и/или вторичные инфекции могут привести к симптомам сепсиса, вследствие неконтролируемого воспаления, приводящего к полиорганной недостаточности, особенно поражая сердечную, печеночную и почечную системы.
Это продукт распада фибрина. Для диагностики тромбоза можно определить концентрацию D-димеров в крови — тест на D-димеры. Тест на D-димеры стал важным исследованием для пациентов с подозрением на тромботические нарушения. Его главная польза, таким образом, — исключение тромбоэмболии. Кроме того, он используется в диагностике такого нарушения, как ДВС-синдром (синдром внутрисосудистого свертывания).
Анализ на D-димеры показан при подозрениях на тромбоз глубоких вен (ТГВ), легочную эмболию (ТЭЛА) или ДВС-синдром. Выполнение теста на D-димеры в первую очередь позволяет избежать большого числа визуальных исследований, а также является менее инвазивным. Поэтому тест на D-димеры рекомендуется в качестве первоначальной диагностики.
У людей с острыми респираторными инфекциями использование антибиотиков без необходимости значительно способствует повышению устойчивости бактерий, затрат на лечение и риска неблагоприятных событий, связанных с приемом лекарств. Содержание в крови маркера – прокальцитонина – повышается при бактериальных инфекциях и снижается, когда пациенты выздоравливают от них.
Если при коронавирусной инфекции с поражением респираторных отделов лёгких (вирусный пневмонит, интерстициопатия) мы наблюдаем повышение прокальцитонина, то это действительно свидетельствует о присоединении бактериальной инфекции, и только в этом случае требуется назначение антибиотиков.
Поэтому при ведении пациента с COVID-19 целесообразно мониторировать два показателя — С-Реактивный Белок и Прокальцитонин.
Определение уровня С-Реактивного Белка позволяет определить алгоритм лечения пациента. Повышение СРБ коррелирует с объёмом поражения лёгочной ткани, и тем самым у нас есть практический выход — значительный рост СРБ (выше 50 мг/л) и «прогрессия» по результатам компьютерной томографии (КТ), прогрессирование дыхательной недостаточности являются основанием для привлечения противовоспалительной терапии , а никак не модификации антимикробной терапии!
Показания: Обнаружение небольшого количества альбумина в моче (микроальбуминурия) позволяет определить начинающая нефропатию и оценить кардиоваскулярный риск. Используется как скрининговое исследование при почечной и сердечной недостаточности различной этиологии.
Благодаря проведению данного исследования имеется возможность назначения эффективных антигипертензивных препаратов. Что позволило достигнуть значительного снижения распространенности таких сердечно-сосудистых осложнений как мозговой инсульт и ишемическая болезнь сердца.
Наши филиалы:
+998 95 199-55-00, +998 95 196-55-00
+998 71 277-00-69, +998 71 277-50-90
Метод определения Иммуноанализ.
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Синонимы: Интерлейкин-6; ИЛ-6;
Interleukin 6; IL-6; Serum Interleukin-6.
Пределы определения: 1,5-5000 пг/мл.Цитокины – это небольшие белково-пептидные информационные молекулы. Интерлейкин 6 (ИЛ-6) гликопротеид с молекулярной массой 19-24 кДа. Этот белок относится к цитокинам воспаления.
Источники его продукции – клетки иммунной системы, а также клетки, не имеющие прямого отношения к иммунной системе: фибробласты, кератиноциты, хондроциты, клетки стромы эндометрия, клетки Лейдига в яичках, фолликулярно-звёздчатые клетки гипофиза и гладкомышечные клетки кровеносных сосудов, эндотелиальные и синовиальные клетки.
ИЛ-6 может выделяться также опухолевыми клетками различной гистологической природы. ИЛ-6 является мультифункциональным цитокином; рецепторы для ИЛ-6 обнаружены как на лимфоидных, так и нелимфоидных клетках. Он оказывает существенное влияние на многие органы и системы: кровь, печень, иммунную систему, обмен веществ; обладает пирогенными свойствами, участвует в регуляции функций эндокринной системы (стимулирует секрецию соматотропного гормона и подавляет секрецию тиреотропного гормона). Одной из основных функций ИЛ-6 является регуляция процессов созревания антител, продуцирующих В-лимфоцитов и самой продукции иммуноглобулинов. Он снижает синтез альбумина и преальбумина.
Определение уровня ИЛ-6 проводится при углубленном исследовании иммунного статуса при тяжелых воспалительных заболеваниях, бактериальных инфекциях, злокачественных новообразованиях.
Повышение уровня ИЛ-6 в крови наблюдается при многих патологических состояниях: тяжёлых воспалительных процессах, инфекциях, травмах, при аутоиммунных заболеваниях, у ВИЧ-инфицированных людей, при аллергии и бронхиальной астме.
Показана возможность использования ИЛ-6 в качестве маркёра при ранней оценке тяжести острого панкреатита. Исследования последних лет показали, что высокое содержание ИЛ-6 позволяет рассматривать этот цитокин в качестве маркёра агрессивности течения заболевания при злокачественном новообразовании яичников, а также планировать выбор объёма оперативного лечения.
Вскоре в России появится препарат для профилактики тяжелейшего осложнения COVID-19 — цитокинового шторма, анонсировал глава Минздрава РФ Михаил Мурашко. Как пояснила «Газете.Ru» главный гериатр ведомства Ольга Ткачева, цитокиновый шторм — это опаснейшая реакция иммунной системы на коронавирус нового типа, которая приводит к поражению многих органов — в том числе легких, печени и почек. Врачи уверяют: цитокиновый шторм может развиться и у здорового человека, подхватившего COVID-19.
В России зарегистрирован препарат для профилактики цитокинового шторма — тяжелейшего осложнения COVID-19, сообщил министр здравоохранения страны Михаил Мурашко в эфире Первого канала.
«Один из препаратов, который профилактирует цитокиновый шторм, поражение легких, зарегистрирован на прошлой неделе и уже вошел в клиническую практику, причем это отечественный препарат. Еще один препарат противовирусный, я воздержусь просто пока называть, на этой неделе завершает исследование», — анонсировал глава ведомства.
Как пояснила «Газете.Ru» главный гериатр Минздрава РФ Ольга Ткачева,
цитокиновый шторм — это «чрезмерная реакция» иммунной системы на вирус. «Она иногда бывает опаснее, чем сам вирус.
Цитокиновый шторм приводит к развитию сильных воспалительных процессов с поражением как легких, так и печени с почками. Это генерализованное поражение», — рассказала врач.
Цитокиновый шторм может возникнуть в случае, если у пациента повышен уровень интерлейкина 6 (IL-6), стимулирующего иммунный ответ, а также С-реактивного белка и сывороточного амилоида, которые являются маркерами острого воспаления, заявил профессор Медицинской школы Университета Кейс Вестерн Резерв Майкл Ледерман на онлайн-конференции Департамента здравоохранения города Москвы.
Американский эксперт считает, что цитокиновый шторм чаще наблюдается у пожилых людей, страдающих от хронических заболеваний.
Между тем доцент кафедры инфекционных болезней у детей ПФ РНИМУ им. Пирогова Минздрава РФ Иван Коновалов уверен, что вирус может вызвать цитокиновый шторм в организме независимо от физического состояния больного. «Цитокиновый шторм — это реакция иммунитета. Здесь нет прямой взаимосвязи с общим состоянием здоровья — нельзя говорить о том, что у здорового человека цитокинового шторма быть не может», — подчеркнул он в разговоре с «Газетой.Ru».
Медик отметил, что
такой воспалительный процесс фиксируется не только при COVID-19, но и при свином гриппе. Он приводит к «необратимым изменениям патологического характера», рассказал Коновалов.
«Такой способ взаимодействия иммунной системы с новом возбудителем реализуется в виде неконтролируемой воспалительной реакции. Эта гиперреакция иммунной системы вызывает истощение работы иммунитета. В результате возникает вторичная реакция — иммунная недостаточность, которая может облегчить присоединение бактериальной инфекции», — пояснил доцент ПФ РНИМУ им. Пирогова.
О наиболее «мощном», летальном цитокиновом шторме может свидетельствовать прогрессирующая дыхательная недостаточность у заболевшего COVID-19, считает американский профессор Ледерман.
«Хочу отметить, что признаком массивного цитокинового шторма является прогрессирующая дыхательная недостаточность. На мой взгляд, прогрессирующая дыхательная недостаточность может быть индикатором развивающегося «мощного» цитокинового шторма и, соответственно, быть критерием для дальнейших наших действий», — подчеркнул он на конференции Мосгорздрава.
Врачи уверены, что профилактики цитокинового шторма, которую могли бы провести сами пациенты с COVID-19, не существует. «Это дело врачей — медик должен назначать лечение, если видит цитокиновый шторм. И тут уже важно проводить не просто противовирусную терапию, а терапию, связанную со снижением активности воспаления», — сообщила главный гериатор Минздрава РФ Ткачева «Газете.Ru».
Коновалов также уверен, что в борьбе с цитокиновым штормом помогут не профилактические меры, а оперативное лечение при первом возникновении осложнения. «Вопрос заключается не в профилактике, а в своевременном контроле начала этого процесса. Тогда люди, даже перенося цитокиновый шторм, например, при коронавирусной инфекции нового типа, имеют больше шансов на то, чтобы выжить», — заключил медик.
Тем не менее уже существует общее мнение относительно препарата, который может противоборствовать цитокиновому шторму, — это «Тоцилизумаб». Данное лекарство подавляет вызывающий осложнение интерлейкин 6 (IL-6).
«Существует несколько способов ингибирования (подавления — «Газета.Ru) IL-6. Один из них — использование моноклонального антитела на примере Тоцилизумаба. При лечении пациентов с ВИЧ-инфекцией с помощью Тоцилизумаба было получено много данных. Выяснилось, что при его применении резко снижаются воспалительные показатели, Т-клеточная активация и концентрация С-реактивного белка, который является продуктом активности IL-6», — рассказал Ледерман из Медицинской школы Университета Кейс Вестерн Резерв.
Отметим, что японские ученые лаборатории иммунологии Института генетической медицины Университета Хоккайдо также считают Тоцилизумаб наиболее эффективным препаратом. Они утверждает, что польза этого лекарства состоит в содержащемся в нем антителе, которое ограничивает рецептор интерлейкина IL-6. Исследование Тоцилизумабы приводится в научном журнале Immunity.
Те медики, в распоряжении которых нет Тоцилизумаба, пытаются вылечить пациентов с цитокиновым штормом любыми способами, потому что это осложнение часто приводит к летальному исходу, сообщил доктор медицинских наук из Университета Алабамы Рэнди Крон.
«Трудно смотреть, как люди умирают на глазах, поэтому, если возможно вмешаться каким-то образом, то врачи делают это. Поэтому некоторые из наших коллег пытаются лечить связанный с COVID-19 цитокиновый шторм с помощью любого подхода», — рассказывал ученый журналу Forbes.
АЛГОРИТМ ОБСЛЕДОВАНИЯ ПАЦИЕНТА С ПОДОЗРЕНИЕМ НА COVID‑19 При наличии факторов, свидетельствующих о случае, подозрительном на коронавирусную инфекцию, вызванную SARS‑CoV‑2, пациентам вне зависимости от вида оказания медицинской помощи проводится комплекс клинического обследования для определения степени тяжести состояния, включающий сбор анамнеза, физикальное обследование, исследование диагностического материала с применением методов амплификации нуклеиновых кислот, пульсоксиметрию. По результатам проведенного комплекса клинического обследования решается вопрос о виде оказания медицинской помощи и объеме дополнительного обследования. Диагноз устанавливается на основании клинического обследования, данных эпидемиологического анамнеза и результатов лабораторных исследований. 1. Подробная оценка всех жалоб, анамнеза заболевания, эпидемиологического анамнеза. При сборе эпидемиологического анамнеза устанавливается наличие зарубежных поездок за 14 дней до первых симптомов, а также наличие тесных контактов за последние 14 дней с лицами, подозрительными на инфицирование SARS‑CoV‑2, или лицами, у которых диагноз COVID‑19 подтвержден лабораторно. 2. Ф изикальное обследование с установлением степени тяжести состояния пациента, обязательно включающее: • Оценку видимых слизистых оболочек верхних дыхательных путей, – аускультацию и перкуссию легких, • Пальпацию лимфатических узлов, • Исследование органов брюшной полости с определением размеров печени и селезенки, • Термометрию, • оценку уровня сознания, • Измерение частоты сердечных сокращений, артериального давления, частоты дыхательных движений. • Пульсоксиметрию с измерением SpO2 для выявления дыхательной недостаточности и оценки выраженности гипоксемии. 1. Лабораторная диагностика этиологическая: • Выявление РНК SARS‑CoV‑2 с применением методов амплификации нуклеиновых кислот (информация представлена в разделе 4.2). Инструкция по проведению этиологической лабораторной диагностики коронавирусной инфекции представлена в Приложении 3 . • Выявление иммуноглобулинов класса M и класса G к SARS‑CoV‑2. 2. Лабораторная диагностика общая (дополнительная): Объем, сроки и кратность лабораторных исследований зависят от степени тяжести заболевания. Легкое течение заболевания с наблюдением пациента в амбулаторных условиях не требует дополнительных лабораторных исследований. В случае госпитализации по поводу среднетяжелого, тяжелого и крайне тяжелого течения необходимо выполнить следующие исследования: Общий (клинический) анализ крови с определением уровня эритроцитов, гемоглобина, гематокрита, лейкоцитов, тромбоцитов, лейкоцитарной формулы. Биохимический анализ крови (мочевина, креатинин, электролиты, глюкоза, аланинаминотрансфераза, аспартатаминотрансфераза, билирубин, альбумин, лактат, лактатдегидрогеназа, тропонин, ферритин, прокальцитонин, мозговой натрий‑уретический пептид – NT‑proBNP/BNP). Биохимический анализ крови не дает какой‑либо специфической информации, но обнаруживаемые отклонения могут указывать на наличие органной дисфункции, декомпенсацию сопутствующих заболеваний и развитие осложнений, имеют определенное прогностическое значение, оказывают влияние на выбор лекарственных средств и/или режим их дозирования. С‑реактивный белок (СРБ) является основным лабораторным маркером активности процесса в легких. Его повышение коррелирует с объемом поражения легочной ткани и является основанием для начала противовоспалительной терапии. Прокальцитонин при коронавирусной инфекции с поражением респираторных отделов легких находится в пределах референсных значений. Повышение прокальцитонина свидетельствует о присоединении бактериальной инфекции и коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при бактериальных осложнениях. Коагулограмма в объеме: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (протромбиновое отношение и% протромбина по Квику), фибриноген, D‑димер (количественным методом). Прогностические лабораторные маркеры Лимфопения и тромбоцитопения. У большинства пациентов с COVID‑19 наблюдается нормальное число лейкоцитов, у одной трети обнаруживается лейкопения; лимфопения присутствует у 83,2% пациентов. Тромбоцитопения носит умеренный характер, но более отчетлива среди группы с тяжелым течением и умерших от COVID‑19. Возрастание D‑димера в 3‑4 раза более возрастной нормы и удлинение протромбинового времени, особенно при тяжелом течении (снижение% протромбина), увеличение фибриногена имеет клиническое значение. Необходимо учитывать возрастные особенности; D‑димер повышается после 50 лет в связи с накоплением хронических заболеваний. Расчет возрастного уровня верхней границы референтного интервала может быть выполнен по формуле: возраст х 0,01 мкг/мл (при измерении в единицах FEU). Также с осторожностью нужно подходить к исследованию D‑димера у беременных. Для беременности, даже физиологически протекающей, характерно повышение D‑димера с существенным разбросом значений в этой группе. Вне инфекции SARS‑CoV‑2 D‑димер не является определяющим в тактике и при назначении низкомолекулярных гепаринов. Клиническое значение его повышения при COVID‑19 у беременных окончательно не определено. Наличие органной дисфункции, декомпенсации сопутствующих заболеваний и развитие осложнений, выявленные биохимическим анализом крови, имеют прогностическое значение и оказывают влияние на выбор лекарственных средств и/или режим их дозирования. Возможно повышение активности аминотрансфераз и креатинкиназы, концентрации тропонина, креатинина или мочевины; Уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной̆ инфильтрации и прогнозом при пневмонии. Концентрация СРБ увеличивалась у большинства пациентов, одновременно с увеличением интерлейкина‑6 (ИЛ‑6) и СОЭ в разной степени. ИЛ‑6, ИЛ‑10 и TNF‑α возрастают во время болезни и снижаются при выздоровлении. Пациенты, нуждающиеся в госпитализации, имеют значительно более высокие уровни ИЛ‑6, ИЛ‑10 и TNF‑α и сниженное количество CD4 и CD8 T‑клеток. Уровень ИЛ‑6, ИЛ‑10 и фактора некроза опухоли‑α обратно коррелирует с количеством CD4 и CD8, ассоциированных с лимфопенией. Отмечено увеличение острофазового белка ферритина при неблагоприятном течении заболевания. Лабораторными признаками «цитокинового шторма» и ОРДС могут быть: внезапное нарастание клинических проявлений через 1‑2 недели от момента начала заболевания, сохраняющаяся или вновь появившаяся фебрильная лихорадка, выраженная лимфопения в общем анализе крови, снижение количества Т‑ и В‑лимфоцитов, значительное повышение уровня D‑димера (>1500) или его быстрое нарастание и/или высокие уровни интерлейкина‑6 (> 40 пг/мл) и/или повышение уровня С‑реактивного белка более 75 мг/л, интерстициальное поражение легких. При развитии ОРДС каждые 48‑72 часа до стойкого получения отрицательных уровней необходимо определять: ИЛ‑6, D‑димер, ферритин, фибриноген, C‑реактивный белок, триглицериды, ЛДГ. В диагностике и прогнозе течения сепсиса имеет значение уровень прокальцитонина: 0.5 мкг/л – пациенты с высоким риском, вероятна бактериальная коинфекция. Анализ на прокальцитонин при поступлении является дополнительной информацией для ранней оценки риска и исключения бактериальной коинфекции у пациентов с COVID‑19. Развитие сердечно‑сосудистых осложнений при COVID‑2019 также сопровождается лимфопенией, тромбоцитопенией, повышением СРБ, МВ фракции креатинкиназы, высокочувствительного тропонина и мозгового натрий‑уретического пептида (NT pro‑BNP). Для выявления пациентов группы риска необходимо рассмотреть регулярный контроль тропонина (ежедневно в ОРИТ, через день – у стационарных пациентов), контроль NT‑proBNP как маркера миокардиального стресса: у пациента с нарастающей одышкой и NT‑proBNP ≥ 2000 пг/мл отмечен наивысший риск и приоритет для очного осмотра и госпитализации в ОРИТ; при 400 ≤ NT‑proBNP
Пациентка К., 34 лет, с острым миелоидным лейкозом и апластической астроцитомой после перенесенной костно-пластической трепанации черепа по удалению объемного образования правой лобной области и курса лучевой терапии, переведена 25.04.2010 из НМИЦ гематологии Минздрава России в НМИЦ кардиологии Минздрава России в связи с выявлением у нее новой коронавирусной инфекции COVID-19 и двусторонней полисегментарной пневмонии. Помимо перечисленного у пациентки имела место эпилепсия с редкими фокальными и генерализованными тоническими приступами, рефрактерная анемия с избытком бластов и вторичная тромбоцитопения.
При поступлении по данным компьютерной томографии органов грудной клетки объем поражения легких составлял 25% (КТ-1). Была назначена специфическая противовирусная (азитромицин 500 мг перорально с гидроксихлорохином) и антибактериальная терапия (велпенем, амикацин). В связи с выраженной тромбоцитопенией (20-30 тыс.) за период нахождения в стационаре пациентке многократно проводились трансфузии тромбоцитарной массы, антикоагулянтная терапия не назначалась. Состояние пациентки было стабильным и постепенно улучшалось.
Однако спустя 2 недели появилась стойкая фебрильная лихорадка до 39,4⁰С, ухудшилась КТ-картина (увеличение поражения легочной ткани до 40-50%), резко повысился уровень С-реактивного белка до 1437 мг/л и интерлейкина-6 до 88,39 пг/мл, при этом прокальцитонин находился в пределах нормальных значений (0,41 нг/л). Состояние было расценено как проявления цитокинового шторма, в связи с чем пациентке был введен блокатор интерлейкина-6 сарилумаб в дозе 200 мг (с учетом заболевания крови). Состояние пациентки несколько улучшилось.
На 21 сутки усугубляется дыхательная недостаточность (сатурация кислорода до 84% на атмосферном воздухе, тахипноэ до 30 в минуту). Пациентка находится на кислородной поддержке. Вновь появляется лихорадка до 39,6⁰С, тахикардия, присоединяется мучительный сухой кашель, появляется олигурия. На компьютерной томографии отрицательная динамика в виде расширения зон инфильтрации и формирования обширных участков консолидации – КТ 3/4 (процент поражения легочной ткани 60-70%). Уровень интерлейкин-6 повышается до 19000 пг/мл, Д-димера до 4147 нг/мл, креатинина до 213 мкмоль/л. СКФ (по формуле CKD-EPI) 25 мл/мин/1,73м2. Все это можно трактовать как острое почечное повреждение на фоне вновь развившегося цитокинового шторма.
Учитывая тяжесть течения новой коронавирусной инфекции COVID-19 и двусторонней полисегментарной пневмонии, а также тяжесть сопутствующей патологии было принято решение о выполнении пациентке экстракорпоральной очистки крови. Был проведен сеанс заместительной почечной терапии - гемодиафильтрации на аппарате Diapact с использованием высокопроницаемого диализатора (Emic-2) для удаления средних молекул (до 40 тыс. дальтон). Сеанс гемодиафильтрации проводил научный сотрудник лаборатории искусственного и вспомогательного кровообращения отдела сердечно-сосудистой хирургии Табакьян Евгений Аведикович.
После проведения экстракорпоральной очистки крови достигнуто значительное улучшение клинического состояния пациентки в виде уменьшение выраженности кашля, снижения температуры тела, уменьшения слабости, увеличения диуреза. Кроме того, регрессировали признаки дыхательной недостаточности: частота дыхания 16-18 в мин, сатурация на атмосферном воздухе 95-96%. Важно отметить стабилизацию картины крови в виде снижения уровня интерлейкина-6 и С-реактивного белка. Уровень креатинина составил 46 мкмоль/л и СКФ 128 мл/мин/1,73м2.
В настоящее время состояние пациентки стабильное, сохраняется нормотермия, сатурация кислорода 95-97% на атмосферном воздухе, диурез сбалансирован. Планируется перевод в НМИЦ гематологии Минздрава России для дальнейшего лечения по поводу острого миелоидного лейкоза.
Клинический случай подготовил сотрудник 1 коечного отделения СOVID Центра НМИЦ Кардиологии Минздрава России д.м.н. Н.М. Данилов.
Интерлейкины представляют собой белки, принадлежащие к группе цитокинов. Они участвуют в процессе коммуникации между клетками иммунной системы. Для чего нужны интерлейкины? Что их характеризует?
Интерлейкины в основном продуцируются лейкоцитами. Долгое время считалось, что только эти клетки способны производить эти белки.Однако оказалось, что другие клетки, такие как фибробласты и жировые клетки, также обладают способностью продуцировать интерлейкины.
Эти белки участвуют в различных иммунных и кроветворных процессах. Он действует как сигнальные молекулы. Различные типы клеток по всему телу могут получать информацию, передаваемую интерлейкинами.
Эти соединения пронумерованы от 1 до 33. В настоящее время открыто более 48 интерлейкинов. Несовпадение этих цифр связано с тем, что одна цифра в названии может обозначать несколько одинаковых веществ.
Что означает, что интерлейкины являются цитокинами?
Цитокины — это белки, ответственные за связь между клетками. Они образуют чувствительную систему связей, известную как цитокиновая сеть. Они участвуют, например, в развитии таких состояний, как лихорадка.
Цитокины обладают очень сложной и широкой активностью. Мы можем перечислить следующие наиболее важные особенности белков этой группы, которые также имеют интерлейкины:
• плейотропное или разнонаправленное действие.Это означает, что один и тот же цитокин может оказывать разное действие в зависимости от клетки, пораженной
. • избыточность – это означает, что разные цитокины могут одинаково влиять на данную группу из
клеток • синергизм – действие двух цитокинов одновременно оказывает более сильное влияние на клетки, чем действие одного
• антагонизм – цитокины противоположной природы могут взаимно компенсировать эффекты друг друга. Окончательный эффект определяется разницей концентраций
• положительная обратная связь – это означает, что один тип цитокинов может стимулировать продукцию других
• отрицательная обратная связь – продукция цитокинов одним типом клеток может блокировать их продукцию другими клетками
Цитокины, а также интерлейкины могут взаимодействовать тремя различными способами:
• аутокринный – то есть вырабатываемое вещество влияет на вырабатывающую его клетку
• паракринный – означает, что вещество воздействует на ткани, находящиеся вблизи клетки, которая его вырабатывает
• эндокринная – вещество, вырабатываемое клеткой, попадает в кровоток и транспортируется к отдаленным органам, пораженным
Благодаря этим свойствам цитокины создают очень чувствительную сеть взаимозависимостей.Интерлейкины являются его неотъемлемой частью. Концентрации этих сигнальных веществ контролируют иммунный ответ.
Цитокины влияют на клетку, связываясь с соответствующими мембранными рецепторами. Они отличаются очень высокой чувствительностью. Даже низкая концентрация сигнальных молекул вызывает возбуждение.
Какова роль интерлейкинов?
Интерлейкины — цитокины, ответственные за передачу информации между лейкоцитами. При их использовании одна группа лейкоцитов может оказывать влияние на другую.
Лейкоциты – это клетки, которые являются основным компонентом иммунной системы. Их задачей является фагоцитоз микроорганизмов и мертвых клеток. Они отвечают за формирование специфического ответа за счет продукции антител. Они также обладают способностью нейтрализовать свободные радикалы. Именно интерлейкины контролируют активность лейкоцитов.
Наиболее важные вещества, принадлежащие к этой группе:
• Интерлейкин 1
• Интерлейкин 2
• Интерлейкин 3
• Интерлейкин 4
• Интерлейкин 6
• Интерлейкин 7
• Интерлейкин 8
• Интерлейкин 10
• Интерлейкин 12
интерлейкинов участвуют в возникновении воспаления.Особое значение имеет группа соединений, называемая интерлейкином 1.
Интерлейкин 1
Интерлейкин 1 (IL 1) — это название, которое определяет целую группу цитокинов, играющих решающую роль в процессе воспаления. Он вырабатывается в ответ на различные типы антигенов. Факторами, стимулирующими его выработку, могут быть бактерии, вирусы или грибки.
IL 1 действует как универсальный фактор, стимулирующий воспалительную реакцию. Он также обладает способностью стимулировать клетки к выработке других провоспалительных цитокинов.
Интерлейкин 1 имеет потенциал в качестве противоракового препарата. Интенсивные исследования его использования все еще продолжаются. Проблема заключается в сильных побочных эффектах, связанных с пирогенной и поствоспалительной активностью. В настоящее время большие надежды связаны с производными интерлейкина 1, обладающими противораковыми свойствами и ограничивающими вредные механизмы.
Существует 10 различных соединений под названием интерлейкин 1. Самые важные из них:
• Ил-1α
• Ил-1β
• Ил-1γ
Интерлейкин 2
Интерлейкин 2 (ИЛ 2) является наиболее важным цитокином, стимулирующим рост Т-клеток, особенно обладающих цитотоксическими свойствами.Это означает, что ИЛ-2 опосредованно стимулирует процесс запрограммированной гибели клеток (апоптоз), инфицированных вирусами и новообразованиями.
Стимуляция Т-клеток увеличивает продукцию молекул, стимулирующих апоптоз на их поверхности.
Интерлейкин 2 был включен в исследования в качестве противоракового препарата. Однако сильные побочные эффекты исключили это вещество из потенциального терапевтического использования.
Интерлейкин 3
Интерлейкин 3 (IL3) представляет собой цитокин, продуцируемый Т-клетками.Вопреки ранее упомянутому, существенно не влияет на воспалительные процессы. Его основная задача – стимулировать процесс кроветворения. Это означает, что IL3 стимулирует выработку различных типов клеток крови.
Этот цитокин не активен у здоровых людей. Его уровень повышается при воспалительном процессе. Его работа заключается в увеличении производства клеток крови в ответ на инфекцию.
Интерлейкин 4
Интерлейкин 4 (IL 4) играет важную роль в развитии аллергической реакции.Он имеет широкую основу и стимулирует множество различных клеток иммунной системы. Его продуцируют базофилы, тучные клетки и Th3-лимфоциты.
Его присутствие стимулирует активность макрофагов и моноцитов. ИЛ-4 участвует в формировании очага воспаления. Положительно влияет на продукцию цитокинов, стимулирующих гемопоэз. Следовательно, повышение концентрации интерлейкина 4 стимулирует гемопоэтические процессы.
Интерлейкин 6
Интерлейкин 6 (IL 6) является многонаправленным.Его продуцируют моноциты и макрофаги. Факторами, стимулирующими его продукцию, являются поствоспалительные цитокины, особенно интерлейкин 1. ИЛ-6 прямо и сильно стимулирует воспалительные процессы.
Однако высокая концентрация этого вещества может ограничивать развитие воспаления. Это связано с тем, что интерлейкин 6 блокирует синтез воспалительных цитокинов посредством механизма ингибирования по принципу обратной связи.
IL 6 является пирогенным агентом. Это означает, что он стимулирует повышение температуры тела при воспалении.Другие функции интерлейкина 6 включают активацию Т-клеток и стимуляцию дифференцировки В-клеток.
Интерлейкин 7
Интерлейкин 7 (IL 7) участвует в реакции организма на ВИЧ. Стимулирует дифференцировку цитотоксических лимфоцитов. Эти иммунные единицы стимулируют апоптоз или самоубийство клеток, инфицированных вирусом.
Интерлейкин 8
Интерлейкин 8 (IL 8) представляет собой цитокин, который стимулирует миграцию иммунных клеток по всему телу.Это означает, что он стимулирует движение и распространение Т-лимфоцитов, нейтрофилов и моноцитов. Это действие носит защитный характер.
ИЛ-8 стимулирует высвобождение гистамина базофилами. Этот процесс вызывает аллергическую реакцию.
Интерлейкин 10
Интерлейкин 10 (IL10) по своей природе противоположен ранее описанным цитокинам. Его основная задача – блокировать воспалительный процесс. Он продуцируется В-лимфоцитами, макрофагами, дендритными клетками и Treg-лимфоцитами.
IL 10 используется для контроля воспалительных процессов в организме. Некоторые бактерии и вирусы обладают способностью стимулировать выработку интерлейкина 10. Таким образом, они блокируют иммунный ответ нашего организма, тем самым повышая свою выживаемость.
Интерлейкин 12
Интерлейкин 12 (IL12) является антагонистом IL10. Это означает, что он блокирует его противовоспалительную активность. В его задачи входит активация моноцитарных макрофагов и NK-клеток.Стимулирует выработку интерферона.
Синтез интерлейкина 12 происходит под влиянием различных видов возбудителей.
Интерлейкины и аутоиммунные заболевания
интерлейкинов отвечают за поддержание активности иммунной системы. Однако в случае аутоиммунных заболеваний наблюдались повышенные уровни некоторых из этой группы цитокинов. Это свидетельствует об участии интерлейкинов в патомеханизме этих нарушений.
Интерлейкин 18 играет физиологическую роль в формировании ответа на патогены.Однако он способен вызывать очень сильные воспалительные реакции. Нарушения активности этого цитокина участвуют в развитии аутоиммунных заболеваний. Примеры включают диабет 1 типа, рассеянный склероз и псориаз.
Другим примером является интерлейкин 15. Он имеет физиологическую функцию, защищающую от развития заболеваний. Его активность потенциально может быть использована при лечении рака.
Чрезмерная активность интерлейкина-15 в настоящее время связана с патогенезом аутоиммунных заболеваний.Нарушение его экспрессии наблюдается при таких заболеваниях, как:
• системная красная волчанка
• псориаз
• воспалительные заболевания кишечника
• рассеянный склероз
• ревматоидный артрит
Ведутся исследования моноклональных антител, блокирующих активность интерлейкина-15, которые можно было бы использовать для лечения этих заболеваний.
Влияние интерлейкинов на отторжение трансплантата
Вполне вероятно, что IL15 также участвует в отторжении организма реципиента.
Упомянутый ранее интерлейкин 10 оказывает противоположное действие и может использоваться для блокирования иммунного ответа после трансплантации.
Влияние интерлейкинов на отторжение трансплантата
Интерлейкины участвуют в механизмах защиты от многих заболеваний. Нарушения их деятельности в значительной степени способствуют развитию аутоиммунных заболеваний. Современная наука все еще изучает эти процессы.
Терапевтический потенциал демонстрируют как вещества, блокирующие, так и повышающие активность интерлейкинов.Большой проблемой при поиске новых лекарств является уменьшение побочных эффектов.
Дифференциация пневмонии от инфекции SARS-CoV-2 от заражения другими микроорганизмами это сложно, потому что это очень похоже клиническая картина (особенно это относится к воспалению легкие, вызванные атипичными микроорганизмами) и потеря стоимости в случае COVID-19 прогностическая концентрация СРБ в сыворотке - маркер обычно используется для дифференциации пневмонии вирусной и бактериальной этиологии.СРБ – это белок, участвующий в системной неспецифический иммунный ответ на состояние воспалительный (белок острой фазы). СРБ человека пентамер из 5 идентичных субъединиц. Распознает молекулы с открытыми группами фосфохолины на поверхности патогены или поврежденные клетки и активирует систему комплемента классическим способом. Он производится прежде всего в печени и ее продукции стимулирует интерлейкин 6 (ИЛ-6) 10,11 - один из цитокинов, играющих основную роль в патогенезе COVID-19.Характеристика инфекции SARS-CoV-2 значителен (даже до значения трехзначное) увеличение концентрации СРБ и его увеличение наблюдается по мере интенсификации процесса заболевание и не связано с суперинфекцией бактериальный, а именно под действием ИЛ-6, высвобождаемого в ответ на инфекцию SARS-CoV-2. Поэтому антибактериальная терапия не должна проводиться только из-за высокой концентрации СРБ, если не другие признаки бактериальной инфекции.
Другой биомаркер бактериальной инфекции нижние дыхательные пути - прокальцитонин (ПКТ) - прогормон выделяется в больших количествах моноцитами и макрофагами в ответ на бактериальную инфекцию.Стимулируется производство ПКТ провоспалительные цитокины, такие как интерлейкин 1b (IL-1b), фактор некроза опухоли (TNF) и IL-6, в то время как он ингибирует гамма-интерферон, который выделяется при вирусных инфекциях. ПКТ вырабатывается преимущественно в печени, легких и кишечнике. Обсуждения продолжаются по пороговому значению исключающей концентрации ПКТ бактериальная инфекция. 12 До эпидемии COVID-19 различные руководства и экспертные органы рекомендуется не использовать антибиотики у пациентов с уровнем ПКТ в сыворотке ≤0,1 нг/мл, в то время как они настоятельно рекомендовали ≥0,5 нг/мл у пациентов ПКТ. 15 Для COVID-19 однако оказалось, что применение ПКТ в качестве маркера, помогающего принять решение об антибактериальной терапии, непросто. Было заявлено что увеличение концентрации ПКТ коррелирует с прогрессированием COVID-19 и риск смерти, но не всегда связанные сосуществование с бактериальной инфекцией. 13–15 Липпи и др. В метаанализе обнаружили, что повышенные уровни ПКТ связывают примерно в 5 раз больше риска быть тяжелым течение инфекции SARS-CoV-2 и серийные измерения можно использовать для предсказания прогрессирование болезни. 16 Многие другие авторы также обнаружил корреляцию между высокой концентрацией ПКТ и риск прогрессирования и смерти от COVID-19. Они наблюдали также, что повышенный уровень ПКТ не всегда коррелирует с сосуществованием инфекции бактериальный. Например, Ху и др. Подтверждено коинфекция у 20% пациентов в критическом состоянии из-за COVID-19 и у 50% пациентов в критическом состоянии, в то время как повышенный уровень ПКТ обнаруживали его гораздо чаще - у 50% тяжелобольных и у 80% тяжелобольных. 13 Ванхомвеген и др. Обнаружено, что включение антибактериальная терапия у госпитализированных больных в отделении интенсивной терапии из-за COVID-19, в котором концентрация ПКТ был ≥0,5 нг/мл, что было бы излишним в 87% случаев. 16
Итак, когда следует принимать решение о начале антибактериальной терапии? Авторы рекомендаций NICE перечисляют ряд тестов, используемых в дифференциальной диагностике. Одним из них является изучение морфологии кровь с оценкой процентного содержания лейкоцитов. Существенный это прежде всего абсолютный термин количество нейтрофилов при инфекции SARS-CoV-2 не увеличивается, поэтому превышение нормы может указывают на бактериальную суперинфекцию.необходимо подчеркнем, что мы судим об абсолютном количестве этих ячеек, а не их процент. В COVID-19, может быть может возникнуть лимфопения, что приведет к завышению процентного содержания нейтрофилов в лейкограмме. Здесь стоит обратить внимание что лимфопения у пациентов с COVID-19 может быть связаны с повышенным риском развития легочный аспергиллез. Также снижено абсолютное число нейтрофилов (гранулоцитопения) связывает с повышенным риском грибковых и бактериальных инфекций. Таким больным людям чаще требуется антибиотикотерапия.
С бактериальным или грибковым загрязнением течение COVID-19 также можно увидеть.Если после временного клинического улучшения и снижения значения СРБ и ПКТ, наблюдается появление новых изменения в легких при визуализирующих исследованиях и увеличение воспалительных маркеров - это сильно указывает на суперинфекцию. Затем целесообразно провести дифференциальную диагностику и собрать биологический материал для исследования. микробиологический. Обратите внимание, что у пациентов длительное время госпитализируется, особенно в реанимацию, повышается риск инфекций, в том числе респираторных пневмония (ВАП), инфекции сосудистого русла связанные с доступом к венам и инфекциями мочевыводящих путей у пациентов с катетером мочевого пузыря.Ухудшение однако состояние больного не всегда должно быть связано с суперинфекцией; может быть результатом речи осложнения COVID-19, в том числе опасные для жизни тромбоэмболические осложнения.
Проведение расширенной диагностики под сосуществование бактериальных инфекций является также указывается перед принятием решения о включении тоцилизумаб для лечения COVID-19. Лук это может усугубить бактериальную инфекцию и привести к сепсису. По характеристикам Лекарственное средство (SmPC) не следует назначать лечение тоцилизумабом у активных пациентов инфекции (исключение составляет SARS-CoV-2, хотя это не входит в SPC). 17 Однако профилактическое назначение антибиотиков у квалифицированных пациентов не следует для лечения ингибитором ИЛ-6. рекомендует однако проявлять особую бдительность, чтобы своевременно обнаружить тяжелую инфекции. Следует помнить, что сразу после введения клинические признаки могут быть менее выраженными, а уровень СРБ будет снижаться, а может и не снижаться. быть хорошим предиктором бактериальной суперинфекции. Данные пациентов, получавших тоцилизумаб при ревматоидном воспалении артрит также указывают на риск раскрытия латентный туберкулез, 17 , однако неизвестно, как он высок у пациентов с COVID-19.
Проф. Павел Сливинский, заведующий 2-м отделением болезней легких ИГиЧП в Варшаве, президент Польского общества болезней легких, говорит в интервью «Health Manager», что COVID-19 продолжает удивлять врачей и ученых. У некоторых больных симптомы слабо выражены или их нет вовсе, но через несколько месяцев наблюдения выясняется, что у них произошли изменения, например, в легких.
SARS-CoV-2 в первую очередь поражает легкие. Каков патомеханизм? Можем ли мы остановить этот процесс и предотвратить интерстициальную пневмонию от COVID-19?
- У нас нет эффективных лекарств от COVID-19. У наиболее тяжелых больных предпринимаются попытки лечения некоторыми ранее известными препаратами. Ремдесивир, когда он эффективен, находится на ранних стадиях заболевания, останавливая размножение вируса.Однако на поздних стадиях болезни он мало что прибавляет. Отчеты из Великобритании показали улучшение выживаемости пациентов после применения дексаметазона, но также и при условии, что он вводился как можно раньше. Он работает, ослабляя защитные силы организма и выработку цитокинов. Повышенный уровень интерлейкина 6 может быть показанием к назначению тоцилизумаба. Однако эффективность этих препаратов не подтверждена надежными исследованиями из-за слишком короткого времени их введения при показаниях к COVID-19.В случае со многими пациентами мы подходим к стадии, когда не остается ничего другого, кроме как посмотреть, сможет ли тело защитить себя. В это время мы поддерживаем пациента, противодействуя последствиям дыхательной недостаточности, используя оксигенотерапию или искусственную, неинвазивную или инвазивную вентиляцию легких в зависимости от показаний.
Для того, чтобы противовирусное лечение было эффективным, пациенты должны обратиться к врачу при первых симптомах. Однако чаще всего они попадают в больницы с запущенными заболеваниями.Как это можно изменить?
- Больных очень много, система не справляется с таким количеством больных. Я не хочу сказать, что ВОП закрылись, но записаться на прием почему-то, безусловно, сложнее, чем до пандемии. У пациентов есть симптомы, но не всегда есть куда мазать, они не могут позвонить в поликлинику, а если записываются на консультацию и получают направление на анализы, то ждут результата и время идет. Именно поэтому они редко обращаются в больницу с первыми симптомами.Чаще всего они не подлежат госпитализации при скудной симптоматике. Вопрос в том, когда следует считать, что симптомы болезни усилились, чтобы бить тревогу. Определение этого пациентом или врачом во время телефонной консультации достаточно субъективно. К счастью, некоторые люди уже приобрели пульсоксиметры для контроля насыщения организма кислородом, что я считаю отличным ходом. Недавно небольшая часть вошла в программу Home Healthcare, которая включает в себя наблюдение пациента с положительным результатом на SARS-CoV-2 дома с помощью пульсоксиметра и автоматическое реагирование на значительную десатурацию.Снижение насыщенности ниже 92%. потому что это указывает на низкую оксигенацию организма, а это первый признак того, что что-то не так в паренхиме легких. В этой ситуации пациент должен получить быструю диагностику и возможное лечение. И тут возникают дополнительные проблемы, потому что больной, зараженный коронавирусом и с пониженной сатурацией, не может провести амбулаторное рентгенологическое исследование органов грудной клетки, которое в конечном итоге выявило бы пневмонию в ее начальной стадии. Эта ситуация означает, что обычно, когда они обращаются за медицинской помощью, их состояние тяжелое и лечение неэффективно.
Какие изменения связаны с интерстициальной пневмонией?
- У COVID-19 короткая история, поэтому больше наблюдений у нас пока нет. Но мы знаем, что любая пневмония, будь то бактериальная или вирусная, может привести к фиброзу легочной паренхимы. Обширные изменения связаны со стойкой дыхательной недостаточностью. Рентгенологи все чаще описывают процент легочной паренхимы, вовлеченной в течение COVID-19. Есть пациенты, у которых этот процент достигает 90%.Прогноз в такой ситуации неопределенный. Эта группа пациентов нуждается в неинвазивной вентиляции или поддержке интубации. Легочная эмболия также, по-видимому, имеет важное значение в патомеханизме заболевания, на что указывают результаты аутопсийных тестов. Таким образом, с одной стороны, происходит разрушение легочной паренхимы, а с другой стороны, вовлекаются легочные сосуды, что в свою очередь приводит к дыхательной и циркуляторной недостаточности.
Некоторые пациенты с COVID-19 проходят бессимптомно. Эта группа также может испытывать ряд осложнений, включая легочные осложнения.
- Все больше и больше анализов показывают, что у вас могут быть легкие симптомы или не быть вовсе, а через несколько месяцев наблюдения выясняется, что есть изменения, например, в легких. В научных публикациях появляется термин «долгий COVID». Это касается пациентов, которые уже имеют отрицательные результаты теста на SARS-CoV-2, перенесли заболевание относительно легко, но связаны с осложнениями различной степени тяжести. Мы не знаем точно, какие механизмы за это отвечают. Тем не менее история медицины знает подобные случаи.Многие люди страдают от невыявленных болезней, которые незаметно разрушают организм. Сахарный диабет и артериальная гипертензия ничем не болеют, поэтому их часто диагностируют случайно. Многие люди функционируют с невыявленной ХОБЛ. Спирометрию проводят только тогда, когда заболевание приводит к значительному поражению легких и появлению одышки. Часто при диагностике ХОБЛ обнаруживается, что большая часть легких больше не работает.
Как я могу помочь пациентам с поражением легких?
- Следствием пневмонии в анамнезе могут быть фиброзные изменения в легких.Если они достаточно обширны, они могут быть серьезной проблемой для здоровья. У нас уже несколько лет есть два препарата: пирфенидон и нинтеданиб, которыми мы лечим идиопатический легочный фиброз (ИЛФ). Однако такая терапия не лечит заболевание, а замедляет его прогрессирование. Возможно, оба этих препарата также можно будет использовать при лечении легочного фиброза после COVID-19. Исследования продолжаются. В настоящее время медицина не располагает методами купирования фиброзных изменений в легких. Остается только симптоматическое лечение. Мы поддерживаем дыхательную недостаточность кислородной терапией или, в тяжелых случаях, респиратором.В крайнем случае можно подумать о трансплантации легких, которая не является распространенным терапевтическим методом нигде в мире, а тем более в Польше. Кроме того, для трансплантации легкого пациент должен быть в достаточно хорошем общем состоянии, соответствующего возраста и соответствовать ряду других критериев приемлемости. Я бы не возлагал на это больших надежд, потому что такое большое количество людей, заболевших тяжелой пневмонией в результате перенесенного в анамнезе COVID-19, находится вне досягаемости трансплантологии. Большинство людей с дыхательной недостаточностью останутся под наблюдением домашних кислородных центров, и со временем им, вероятно, потребуется неинвазивная искусственная вентиляция легких, которую мы также можем предложить на дому в течение нескольких лет.
Мы говорим здесь о легких, которые являются первым и наиболее часто поражаемым органом при COVID-19, но помните, что это не единственный орган. Многие больные умирают от сердечной или почечной недостаточности. Сегодня можно сказать, что COVID-19 — полиорганное заболевание. Воспалительный процесс распространяется по всему организму и поражает различные органы. Все больше и больше исследований показывают, что вирус также может вызывать неврологические изменения.
COVID-19 вызывает многочисленные осложнения, часто хронические.Как польская система здравоохранения справится с наплывом такого большого количества пациентов? Еще до эпидемии были серьезные проблемы с попаданием к специалистам.
- Трудно сказать, как именно он справится с этим. Вероятно, не может. Основная проблема – нехватка кадров и недостаточное финансирование. Эпидемия только подчеркнула это состояние. Помимо пациентов с осложнениями после COVID-19, мы можем ожидать увеличения числа нековидных пациентов, которым не был поставлен диагноз и назначено лечение, поскольку они не обращались к врачам из-за боязни заражения.Кроме того, основной упор был сделан на лечение инфекций SARS-CoV-2. Пандемия нарушила всю систему. Многие палаты, например, легочные, переоборудовали в ковидные палаты. Таким образом, многим другим больным негде было диагностировать и лечить себя. Как следствие, больные приходят к нам поздно, с далеко зашедшими изменениями, т.е. онкология. Их лечение сложнее, а прогноз хуже. Польская система здравоохранения требует основательных реформ. Мы больше не можем залатать его кустарными движениями, так как это приведет к катастрофе со здоровьем.
Мы рекомендуем вам поставить лайк профилю Health Manager на Facebook: www.facebook.com/MenedzerZdrowia и подписаться на аккаунты в Twitter и LinkedIn: www.twitter.com/MenedzerZdrowia и www.linkedin.com /MenedzerZdrowia .
.Мы являемся свидетелями исторических событий, которые будут позорно запечатлены на страницах нашей истории. Разумеется, речь идет о пандемии коронавируса, о которой Всемирная организация здравоохранения объявила 11 марта 2020 года. Ранее аналогичный статус получило распространение вируса h2N1 в 2009 году, что было раскритиковано как распространение паники по всему миру.
Первые случаи заражения вирусом под названием 2019-nCoV произошли в китайском Ухане в конце прошлого года и быстро распространились на другие страны мира.Всемирная организация здравоохранения (ВОЗ) официально назвала вирус COVID-19 11 февраля 2020 года, а после его классификации Международным комитетом по таксономии вирусов он был назван возбудителем тяжелого острого респираторного синдрома короновируса 2 или SARS-CoV. -2.
Рис. 1. Структура коронавируса SARS-CoV-2.
Пациенты с SARS-CoV-2 могут испытывать широкий спектр проблем, начиная от легких симптомов и заканчивая тяжелым заболеванием.Эти симптомы обычно появляются через 2-14 дней после контакта с вирусом. Исследования показывают, что пациенты могут быть наиболее заразными за несколько дней до появления симптомов. Основными начальными симптомами SARS-CoV-2 являются озноб, мышечные боли, головная боль, боль в горле и потеря вкуса и обоняния. По крайней мере, у 80 процентов людей, инфицированных SARS-CoV-2, наблюдается типичный иммунный ответ. При нормальном иммунном ответе несколько различных типов иммунных клеток (лимфоцитов) и химических мессенджеров высвобождаются в сложной последовательности, вызывая легкое локальное воспаление.
В настоящее время у нас мало макроскопической и микроскопической информации о патологических повреждениях, вызванных SARS-CoV-2. Макроскопические признаки SARS-CoV-2, вероятно, проявляются в грудной клетке и могут включать плеврит, перикардит, консолидацию легких и отек легких. Вес легких может увеличиться выше нормы. Следует отметить, что вирусная инфекция может накладываться на вторичную инфекцию, что может привести к гнойному воспалению, характерному для вторичных бактериальных инфекций.Микроскопические данные неспецифичны и включают отек, гиперплазию пневмоцитов, очаговое воспаление и образование многоядерных гигантских клеток с генерализованными диффузными альвеолярными поражениями с экссудатом. Воспаление представлено преимущественно лимфоцитарными и многоядерными гигантскими клетками, видимыми рядом с крупными атипичными пневмоцитами, без видимых вирусных включений. В целом, особенности очень похожи на те, которые наблюдаются при инфекциях SARS и коронавирусе MERS.
Подавляющее большинство пациентов с COVID-19 имеют хороший прогноз, но есть люди, для которых он не оптимистичен и болезнь заканчивается смертью.У большинства из этих критически больных и умерших пациентов не развиваются тяжелые клинические симптомы на ранних стадиях заболевания. У некоторых пациентов наблюдается только легкая лихорадка, кашель или болезненность мышц. Эти состояния внезапно ухудшаются на поздних стадиях болезни или в процессе выздоровления. Острый респираторный дистресс-синдром (ОРДС) и полиорганная недостаточность проявляются быстро, вызывая смерть в короткие сроки. Считается, что цитокиновый шторм является одной из ведущих причин ОРДС и полиорганной недостаточности.
Синдром цитокинового шторма (CSS) характеризуется системными симптомами и признаками, возникающими в результате массивной и неконтролируемой воспалительной реакции из-за нарушения регуляции провоспалительных и противовоспалительных цитокинов. Известно, что такие вирусы, как герпес и вирус Эпштейна-Барр, вызывают CSS, как и грипп H5N1. Текущая литература указывает на то, что SARS-CoV-2 запускает CSS и связывается с тяжелыми симптомами, характерными для критических пациентов. CSS у этих пациентов часто приводит к летальному исходу, как это было в случае с предыдущими эпидемиями SARS и MERS.
Первыми высвобождаемыми цитокинами являются интерлейкин 1β (ИЛ-1β) и фактор некроза опухоли-α (ФНО-α) , которые привлекают к месту инфекции различные циркулирующие лейкоциты (лейкоциты), включая нейтрофилы, моноциты, макрофаги и клетки NK. Этот ответ, наряду с антипатогенными химическими веществами, высвобождаемыми этими клетками (то есть комплементом), включает врожденный иммунный ответ. Эти клетки непосредственно атакуют заражающий патоген, а также высвобождают дополнительные цитокины, в основном интерлейкин-1 (ИЛ-1) и интерлейкин-6 (ИЛ-6) .ИЛ-6 необходим для индукции адаптивного иммунного ответа, который индуцирует Т-клетки, В-клетки и хелперные Т-клетки (Th) в месте инфекции. IL-6 также стимулирует дальнейшее рекрутирование, пролиферацию и активацию макрофагов.
Вероятно, одно из самых смертельных проявлений аномального иммунного ответа, синдром цитокинового шторма (CSS), наблюдается врачами и персоналом отделения интенсивной терапии. Некоторые также называют эту реакцию синдромом высвобождения цитокинов (CRS).CSS характеризуется постоянной активацией и экспансией популяции макрофагов и лимфоцитов, которые секретируют большое количество цитокинов, вызывая цитокиновый шторм. Это массовое высвобождение цитокинов похоже на гемофагоцитарный лимфогистиоцитоз (ГЛГ), синдром, характеризующийся начальной неконтролируемой и устойчивой активацией цитотоксических Т-лимфоцитов и NK-клеток.
Эта активация побуждает воспалительные моноциты сильно экспрессировать IL-6, инициируя локальный, а затем системный каскадный эффект, который приводит к перепроизводству IL-6, что ускоряет воспалительный процесс.Поскольку ИЛ-6 также увеличивает проницаемость сосудов, чрезмерный уровень ИЛ-6 делает кровеносные сосуды очень негерметичными. Это, наряду с факторами свертывания, высвобождаемыми из эндотелиальных клеток сосудов, стимулирует каскад свертывания крови, вызывая микромбоз (небольшие тромбы), что приводит к ишемии и гибели тканей почек, кишечника, сердца, печени, головного мозга и конечностей.
При возникновении инфекции иммунная система реагирует, высвобождая десятки провоспалительных и противовоспалительных цитокинов.Ожидается, что интерлейкин-6 (IL-6) будет ключевым компонентом цитокинового ответа. Последовательности на рис. 2 представляют собой очень упрощенные обзоры, иллюстрирующие нарушение регуляции иммунного ответа, приводящее к CSS.
В Польше у нас есть 3 доступных и наиболее часто используемых типа тестов на коронавирус:
Вышеуказанные методы обычно используются для диагностики пациентов с подозрением на COVID-19. Однако существуют и другие методы, с помощью которых возможно обнаружение. Иммуногистохимия — метод, используемый, в частности, в онкологической диагностике, — также может похвастаться продуктами для выявления присутствия вируса SARS-CoV-2 в материале, взятом у пациента. IHC основан на специфической аффинности антител к антигену. Затем эти антитела соответствующим образом метят в материале хромогенными методами.
Американская компания BioSB объявила о наличии следующих продуктов для выявления и тестирования ИГХ COVID-19:
SARS-CoV-2 - мышиный моноклональный клон BSB-134, для использования на замороженном, фиксированном формалином, парафиновом материале и для клеточных препаратов. Продукт доступен в концентрированной и готовой к использованию версии. Иммуноген представляет собой рекомбинантный нуклеокапсид SARS-CoV-2.реактив РУО.
ACE2 - мышиный моноклональный клон BSB-135, IVD
TMPRSS2 - мышиный моноклональный клон BSB-136, IVD
CD147 - мышиный моноклональный клон BSB-137, IVD
IL-1a - мышиный моноклональный клон BSB-138, IVD
IL-1b - мышиный моноклональный клон BSB-139, IVD
ИЛ-6 - мышиный моноклональный клон BSB-140, IVD
TNFa-IP2 - мышиный моноклональный клон BSB-141, IVD
Заинтересованным лицам предлагается связаться с отделом продаж.
.© Borgis - Postępy Nauk Медицинский 10/2010, стр. 770-774
* Dariusz Marek Lebensztejn 1 , Jolanta Tobolczyk 2 , Eugeniusz Tarasów 3 , Elżbieta Skiba 1 , Anna Romanowska 1 , Irena Werpachowska 1 , Maciej Kaczzmarski 1 1 1 Оценка концентрации С-реактивного белка, интерлейкина 6 и его растворимого рецептора в сыворотке крови детей с неалкогольной жировой болезнью печени** Оценка сывороточного С-реактивного белка, интерлейкина 6 и его растворимого рецептора у детей с неалкогольной жировой болезнью печени 1 Кафедра педиатрии, гастроэнтерологии и детской аллергологии Белостокского медицинского университета Реферат Резюме ВВЕДЕНИЕ Одной из причин ожирения печени как у детей, так и у взрослых является неалкогольная жировая болезнь печени (НАЖБП), которая чаще всего встречается у людей с ожирением.Поражения печени могут быть изолированным стеатогепатитом или прогрессировать в стеатогепатит (НАСГ) и даже в цирроз, печеночную недостаточность и рак печени (1-3). Исследования, проведенные в последние годы, меняют подход к висцеральному жиру. Первоначально его рассматривали только как неактивный запас энергии, но в настоящее время он считается важным эндокринным, паракринным и аутокринным органом, являясь местом продукции и превращения многих биологически активных веществ (4). Вещества, которые он выделяет (адипокины), необходимы для правильного функционирования органов и тканей. Избыток жировой ткани и ее аномальное распределение, приводящее к висцеральному ожирению, способствуют развитию многих болезней цивилизации, особенно инсулинорезистентности, артериальной гипертензии, дисфункции эндотелия сосудов и атеросклероза (4). Висцеральное ожирение и связанная с ним НАЖБП характеризуются наличием системного хронического воспаления ( хроническое слабовыраженное системное воспаление ) (5, 6).Таким образом, анализ воспалительных маркеров может быть важным элементом в оценке пациентов с НАЖБП (7). По этой причине целью исследования была оценка концентрации С-реактивного белка (вчСРБ), интерлейкина 6 (ИЛ-6) и его растворимого рецептора (ИЛ-6рР) как маркеров воспаления в сыворотке крови детей с -алкогольная жировая болезнь печени, , с особым акцентом на оценку полезности протестированных биохимических маркеров для дифференциации детей с ожирением с жировой дистрофией печени и детей без жирового органа, оцениваемого в тестах визуализации. МАТЕРИАЛЫ И МЕТОДЫ В проспективное исследование включено 45 детей (29 мальчиков и 16 девочек) в возрасте от 7 до 17 лет (средний возраст 12,3 года) с простым ожирением (ИМТ > 97 пк), которым был поставлен диагноз в отделении педиатрии, гастроэнтерологии и детской аллергологии Медицинского Университет в Белостоке в связи с первоначальным подозрением на патологию печени (гепатомегалия и/или повышенная активность АЛТ в сыворотке и/или аномальное изображение печени на УЗИ). У всех пациентов были исключены другие причины стеатоза: вирусные (инфекции HBV и HCV), аутоиммунные гепатиты, метаболические заболевания (болезнь Вильсона, дефицит альфа-1-антитрипсина), токсическое поражение печени. Дети с активным воспалением, а также с потенциальными очагами воспаления также были исключены из исследования. У всех испытуемых рассчитывали индекс массы тела (ИМТ) и окружность талии и бедер (ОТХ), активность аланинаминотрансферазы (АЛТ), гамма-глутамилтранспептидазы (ГГТП), параметры липидного профиля (общий холестерин, ЛПВП-холестерин, ЛПНП-холестерин, триацилглицерины) измеряли. ) параметры инсулинорезистентности (концентрация глюкозы и инсулина, с расчетом индекса инсулинорезистентности - HOMA-IR). Концентрацию вчСРБ в сыворотке крови определяли нефелометрическим методом на анализаторе DADE Behring (Германия). Концентрацию IL-6 и его растворимого рецептора (IL-6sR) определяли натощак методом иммуноферментного анализа с использованием коммерческих наборов фирмы R&D Systems, Inc., США. Ультразвуковое исследование брюшной полости (УЗИ) выполнено на аппарате General Electric LOGIQ 500, конвексный датчик 3-5 МГц. Степень ожирения печени оценивали по четырехбалльной шкале по Saverymutt et al.(8). Исследование 1 HMRS была выполнена с использованием магнитно-резонансной системы 1,5 Тл с использованием последовательности PRESS 35 (локальная спектроскопия с точечным разрешением одиночных вокселей) со следующими параметрами сбора данных: TE (временное эхо) 35 мс, TR (время повторения) 1 500 мс, количество повторений 192, ширина спектра 2 кГц. Воксели размером 3 х 3 х 3 см (27 см 3 ) располагали в правой доле печени, чтобы не затрагивать крупные сосуды и желчные протоки.До сих пор не установлен стандарт для общего содержания липидов в печени у детей; Таким образом, вслед за Тарасовым (9) стандарт для молодых людей был принят равным 55 ± 30 относительных единиц (как указано выше). Условно установлено, что общее содержание липидов в печени превышает 55 МЕ. это будет соответствовать диагнозу жирового организма. Полученные результаты были подвергнуты статистическому анализу, в ходе которого были рассчитаны среднее арифметическое и стандартное отклонение измеряемых признаков. Для сравнения групп использовали критерий Манна-Уитни.Связи между исследуемыми признаками определялись коэффициентами Спирмена и Пирсона. При расчетах принимали уровень значимости p1HMRS от лиц без стеатоза органов, оценивали площадь под ROC-кривой (AUC). Расчеты выполнены с использованием статистической программы AccuROC (Монреаль, Канада). Протокол исследования одобрен Комитетом по биоэтике Белостокского медицинского университета. РЕЗУЛЬТАТЫ Ожирение печени выявлено при УЗИ у 32 детей (71%) (I подгруппа), у 16 из них также выявлена повышенная активность АЛТ в сыворотке крови (Ia подгруппа).У 13 детей не выявлено ни патологической картины печени на УЗИ, ни повышенной активности АЛТ в сыворотке крови (II подгруппа). У меня есть код доступа 90 038 19 90 039 полученный код необходимо ввести на странице статьи, на которую он был погашен 49 90 039 119 90 039 Ссылки 1.Брант Э.М.: Гистопатология неалкогольной жировой болезни печени. Clin Liver Dis 2009; 13: 533-44. 2. Адамс Л.А., Лимф Дж.Ф., Сент-Совер Дж.С. и др.: Естественная история неалкогольной жировой болезни печени: популяционное когортное исследование. Гастроэнтерология 2005; 129: 113-21. 3. Suzuki D, Hashimoto E, Kaneda K и др.: Печеночная недостаточность, вызванная неалкогольным стеатогепатитом у молодого мужчины с ожирением. J Гастроэнтерол Гепатол 2005; 20: 327-9. 4. Kershaw EE, Flier JS: Жировая ткань как эндокринный орган.J Clin Endocrinol Metab 2004; 89: 2548-56. 5. Haukeland JW, Damas JK, Konopski Z и др.: Системное воспаление при неалкогольной жировой болезни печени характеризуется повышенным уровнем CCL2. Дж. Гепатол, 2006 г.; 44: 1167-74. 6. Verrijken A, Francque S, Mertens I и др.: Висцеральная жировая ткань и воспаление коррелируют с повышенными тестами печени в когорте пациентов с избыточным весом и ожирением. Int J Obes (Лондон) 2010; 34: 899-907. 7. Tilg H: Роль цитокинов в неалкогольной жировой болезни печени.Диг Дис 2010; 28: 179-85. 8. Саверимутту С.Х., Джозеф А.Е., Максвелл Д.Д.: Ультразвуковое сканирование для выявления фиброза и стеатоза печени. Br Med J 1986; 292: 13-15. 9. Tarasów E: Протонная магнитно-резонансная спектроскопия при паренхиматозных заболеваниях печени. Хабилитационная диссертация. Медицинский университет Белостока, 2003. 9000 3 10. Angulo P, Hui JM, Marchesini G и др.: Оценка фиброза НАЖБП: неинвазивная система, которая идентифицирует фиброз печени у пациентов с НАЖБП.Гепатология 2007; 45: 846-54. 11. Riquelme A, Arrese M, Soza A и др.: Неалкогольная жировая болезнь печени и ее связь с ожирением, резистентностью к инсулину и повышенным уровнем сывороточного С-реактивного белка у латиноамериканцев. Печень, 2009 г.; 29: 82-8. 12. Корук М., Тайси С., Савас М.С. и др. .: Сывороточные уровни белков острой фазы у пациентов с неалкогольным стеатогепатитом. Терк Дж. Гастроэнтерол 2003; 14: 12-7. 13. Йонеда М., Маватари Х., Фуджита К. и др.: Высокочувствительный С-белок является независимым клиническим признаком неалкогольного стеатогепатита (НАСГ), а также тяжести фиброза при НАСГ.J Гастроэнтерол 2007; 42: 573-82. 14. Учихара М., Изуми Н.: Высокочувствительный С-реактивный белок (вч-СРБ): многообещающий биомаркер для скрининга неалкогольного стеатогепатита (НАСГ). Ниппон Риншо, 2006 г.; 64: 1133-8. 15. Oruc N, Ozutemiz O, Yuce G и др.: Сывороточные уровни прокальцитонина и CRP при неалкогольной жировой болезни печени: исследование случай-контроль. BMC Гастроэнтерология 2009; 9: 16. 16. Koenig W, Sund M, Frohlich M et al.: C-реактивный белок, чувствительный маркер воспаления, предсказывает будущий риск ишемической болезни сердца у изначально здоровых мужчин среднего возраста: результаты исследования MONICA (Мониторинг тенденций и детерминантов в Аугсбургском когортном исследовании сердечно-сосудистых заболеваний, 1984-92 гг.Тираж 1999 г.; 99: 237-42. 17. Kogiso T, Moriyoshi Y, Shimizu S и др.: Высокочувствительный С-реактивный белок как сывороточный предиктор неалкогольной жировой болезни печени на основе системы оценки информационного критерия Акаике у населения Японии в целом. J Гастроэнтерол 2009; 44: 313-21. 18. Visser M, Bouter LM, McQuillan GM и др.: Низкосортное системное воспаление у детей с избыточным весом. Педиатрия 2001; 107: 13. 19. Baumann H, Gauldie J: Регуляция генов белков плазмы острой фазы печени с помощью фактора, стимулирующего гепатоциты, и других медиаторов воспаления.Мол Биол Мед 1990; 7: 147-59. 20. Wieckowska A, Papouchado BG, Li Z et al.: Повышение уровня печеночного и циркулирующего интерлейкина-6 при неалкогольном стеатогепатите человека. Am J Gastroenterol 2008; 103: 1372-1379. 21. Mandato C, Lucariello S, Licenziati MR и др.: Метаболические, гормональные, окислительные и воспалительные факторы при заболеваниях печени, связанных с ожирением у детей. Дж. Педиатр, 2005 г.; 147: 62-6. 22. Cali AMG, De Oliveira AM, Kim H и др.: Нарушение регуляции уровня глюкозы и стеатоз печени у подростков с ожирением: есть ли связь.Гепатология 2009; 49: 1896-906. 23. Abiru S, Migita K, Maeda Y и др.: Сывороточные уровни цитокинов и растворимых рецепторов цитокинов у пациентов с неалкогольным стеатогепатитом. Международное исследование печени, 2006 г.; 26: 39-45. С-реактивный белок является чрезвычайно важным белком в организме человека. Он, наряду с прокальцитонином, первым появляется в крови человека в ответ на развитие воспаления. CRP вырабатывается клетками печени (гепатоцитами) и жировыми клетками (адипоцитами) в ответ на контакт организма с патологическим агентом, например бактериями. Выработка С-реактивного белка стимулируется действием интерлейкинов, особенно интерлейкинов 6 и 1b , , которые призваны «информировать» клетки человека о потенциальной угрозе для организма.Еще одним соединением, стимулирующим выработку CRP , является фактор некроза опухоли альфа, или ФНО-альфа. Однако он играет меньшую роль в его продукции, чем интерлейкины. С-реактивный белок бесценен, помогая клеткам иммунной системы бороться с угрозой. Это связано с патологически измененными клетками, которые могут быть раковыми клетками, поврежденными клетками, бактериями или вирусами. Таким образом, он способствует связыванию особых белков, участвующих в иммунной реакции организма — так называемыхсистема комплемента. Патологические клетки, покрытые белками системы комплемента, становятся легкой мишенью для лейкоцитов и элиминируются ими. CRP также регулирует работу других клеток нашего организма, в том числе моноциты и нейтрофилы, классифицируемые как лейкоциты (лейкоциты). С-реактивный белок также стимулирует выработку интерлейкина 10, белка, который парадоксальным образом подавляет воспалительные реакции в организме. Это связано с тем, что CRP также может увеличиваться при заживлении ран и восстановлении поврежденных тканей. Too Высокий CRP связан с продолжающимся воспалением в организме. По этой причине он используется везде: Из-за небольшого количества, взятого при анализе крови, противопоказаний для исследования уровня С-реактивного белка нет. Пациент записывается в пункт сбора в определенный день и в согласованное время.В день осмотра он явился на ресепшн для подтверждения своего присутствия на объекте. Затем Как уже было сказано, С-реактивный белок используется для определения наличия в организме воспаления . Концентрация СРБ повышается уже через 4-6 часов после начала воспаления и достигает пика примерно через 1-2 дня. У здорового человека принято, что норма СРБ составляет от 0,08 мг/дл до 3,1 мг/дл, но только значения выше 10 мг/дл свидетельствуют об остром воспалении. С-реактивный белок не является специфическим маркером. Его значения могут быть увеличены во многих ситуациях, например: Как видите, таких ситуаций много, и причины их совершенно разные. Однако это не меняет того факта, что лечащий врач на основании результата СРБ может сделать некоторые предположения относительно причины заболевания. Например, значения до 50 мг/дл характерны для вирусных инфекций и атипичных бактерий, таких как, например, Mycoplasma pneumoniae . При значении СРБ до 100 мг/дл можно заподозрить инфицирование стрептококками и стафилококками, ответственными за м. .в при инфекциях кожи и горла. Значения до 500 мг/дл характерны для инфицирования грамотрицательными бактериями и после обширных операций и травм. Недавно было обнаружено, что концентрация белка СРБ (точнее высокочувствительного С-реактивного белка, так называемого вчСРБ) может быть связана с риском сердечного приступа или ишемического инсульта. Это связано с тем, что атеросклероз, главный виновник сердечно-сосудистых заболеваний, накапливается в артериях в виде бляшек и вызывает воспаление.Центры по контролю и профилактике заболеваний и Американская кардиологическая ассоциация, занимающиеся рекомендациями по диагностике сердечных заболеваний, разработали следующие стандарты hsCRP: Каждый результат должен обсуждаться с лечащим врачом, который знает полную историю болезни пациента. Определение концентрации целых 6 параметров крови поможет предсказать, будет ли кто-то страдать от тяжелого течения COVID-19 или нет. Благодаря этому можно будет ввести более агрессивную, но и более эффективную фармакотерапию. Может ли стандартный анализ крови определить, кому из пациентов с COVID-19 будет труднее? По мнению ученых Массачусетской больницы общего профиля в США и ученых из Университета Джорджа Вашингтона, да, это возможно.До сих пор врачи оценивали риск тяжелого течения COVID-19 с учетом нескольких факторов, включая возраст, сердечно-сосудистые заболевания, ожирение и иммунодефицит (врожденный или приобретенный). Открытие ученых, проведенное двумя способами, может помочь в лечении COVID-19, заболевания, вызываемого коронавирусом SARS-CoV-2, поскольку позволит прогнозировать его течение и проводить более быстро, агрессивно и эффективно фармакотерапия. - Мы хотели найти способ как можно раньше и быстрее выявить пациентов с высоким риском, т.е. тех, кто может серьезно заболеть, и кому потенциально может помочь агрессивная терапия, а также пациентов, состояние которых ухудшается быстрее всего, пояснил проф.Джон М. Хиггинс из Массачусетской больницы общего профиля. См. также Исследователи были вдохновлены результатами исследований в Китае, согласно которым у некоторых пациентов наблюдалась более интенсивная воспалительная реакция, чем у других, а также выводами их коллег из MGH, которые отметили, что у некоторых пациентов с сердечными заболеваниями, диабетом или раком, обострение заболевания было связано с с изменением количества и типов клеток крови. О чем именно говорит RDW-CV? Эритроциты – шаровидные клетки крови, различающиеся по размерам, однако, отличия незначительные, в пределах установленной нормы. Однако при некоторых болезненных состояниях объем эритроцитов значительно варьирует. WFD является показателем степени изменчивости объема эритроцитов. проф. Джон М. Хиггинс и его коллеги проанализировали данные 1641 пациента с COVID-19, которые были госпитализированы в четыре больницы в Бостоне с 4 марта по 28 апреля 2020 года.Исследователи изучили результаты стандартных тестов, проведенных у этих пациентов (включая анализы крови). - Было обнаружено, что индекс разрушения объема эритроцитов, называемый RDW, сильно коррелирует со смертностью пациентов, и эта корреляция сохранялась при контроле других выявленных факторов риска, таких как возраст, другие лабораторные тесты и ранее существовавшие заболевания. Это нас очень удивило, — пояснил соавтор исследования доктор Джонатан Карлсон. См. также Пациенты, у которых значения RDW были вне нормального диапазона при поступлении, имели в 2,7 раза более высокий риск смерти (при 31% смертности по сравнению с 11% у пациентов с нормальным значения RDW).Еще более высокий риск летального исхода был связан с увеличением показателя ВРД, зарегистрированным после поступления в стационар. Это открытие, по мнению исследователей, указывает на то, что WFD следует контролировать во время госпитализации, чтобы помочь определить, реагируют ли пациенты на лечение или ухудшается. Это также очень необходимо при определении стратегии лечения. Результаты тестирования опубликованы в "JAMA Network Open". К аналогичным выводам пришли исследователи из Университета Джорджа Вашингтона, которые проанализировали данные 299 человек с COVID-19, поступивших в университетскую больницу в период с 12 марта по 9 мая 2020 года.Они выявили в крови пять соединений, повышенная концентрация которых может быть связана с усилением воспаления и нарушениями свертывания крови у пациентов с COVID-19 и повышать риск пребывания пациента в отделении реанимации, применения ИВЛ и даже риск смерти. Речь идет о: По мнению авторов исследования, возможность тестирования пяти биомаркеров в крови пациентов, поступивших с COVID-19 в приемное отделение больницы, позволит врачам принимать более быстрые и точные решения о методе лечения. - Мы надеемся, что эти биомаркеры помогут клиницистам определить, например, насколько агрессивно приходится обращаться с пациентами, когда пациент может покинуть больницу, как следить за его состоянием, когда он возвращается домой, — прокомментировал ведущий автор Шант Аянян. Результаты этого исследования были опубликованы в журнале Future Medicine. См. также Источник: medicalxpress.com/JAMA Network Open/focus.pl
Заведующий кафедрой: проф.доктор хаб. Maciej Kaczmarski
2 Кафедра клинической иммунологии Белостокского медицинского университета
Заведующий отделением: д-р хаб. Анна Стасяк-Бармута
3 Кафедра радиологии Белостокского медицинского университета
Заведующий отделением: д-р хаб. Урсула Лебковска 9000 3
Введение. Неалкогольная жировая болезнь печени (НАЖБП) считается заболеванием, характеризующимся наличием хронического системного воспалительного процесса легкой степени выраженности.С-реактивный белок (СРБ) и интерлейкин 6 (ИЛ-6) являются маркерами воспалительного процесса. Цель исследования — оценить вчСРБ, ИЛ-6 и его растворимый рецептор (ИЛ-6ср) в сыворотке детей с ожирением и НАЖБП.
Материал и методы. Концентрацию вчСРБ в сыворотке крови определяли натощак нефелометрическим методом у 45 детей с простым ожирением (ИМТ>97 пк), в возрасте 7-17 лет (в среднем 12 лет), с исходно диагностированной патологией печени (гепатомегалия и/или гипертрансаминаземия и/или стеатоз) печени по УЗИ), а ИЛ-6 и ИЛ-6сР по ИФА.У всех пациентов были исключены другие причины ожирения печени: вирусные (HBV, HCV), метаболические (болезнь Вильсона, дефицит альфа-1-антитрипсина) и аутоиммунные. Степень жировой дистрофии печени оценивали с помощью УЗИ по Саверимутту. Исследование 1 HMRS проводилось с использованием системы магнитно-резонансной томографии 1,5 Тл с использованием последовательности PRESS.
Результаты. НАЖБП диагностирована при УЗИ у 32 детей; у 16 больных подтверждено одновременное повышение активности АЛТ.вчСРБ положительно коррелировал с GPT (r = 0,44, p = 0,012) и GGTP (r = 0,37, p = 0,04). Показано, что оценка концентрации вчСРБ позволила дифференцировать детей с ожирением с диагностированной жировой дистрофией печени в 1 HMRS (содержание общих липидов более 55 МЕ) от детей с ожирением без стеатоза (AUC = 0,697, p = 0,04). Подобная взаимосвязь не была продемонстрирована для IL-6 и IL-6sR.
Заявка. вчСРБ можно считать биомаркером жировой дистрофии печени у детей с ожирением.
Цели. Неалкогольная жировая болезнь печени (НАЖБП) представляет собой воспалительное заболевание, характеризующееся вялотекущим системным воспалением. С-реактивный белок (СРБ) и интерлейкин 6 (ИЛ-6) считаются маркерами воспаления. Таким образом, целью исследования было оценить сывороточные уровни hsCRP, IL-6 и его растворимого рецептора (IL-6sR) у детей с ожирением и НАЖБП.
Материал и методы. Уровни hsCRP, IL-6 и IL-6sR в сыворотке крови натощак определяли (нефелометрия и ИФА соответственно) у 45 последовательных детей с ожирением (ИМТ > 97 пк, возраст 7-17 лет, средний возраст 12 лет) с подозрением на заболевание печени ( гепатомегалия и/или повышение активности сывороточных трансаминаз и/или стеатоз печени при УЗИ).У всех детей были исключены вирусные гепатиты (HBV, HCV), метаболические заболевания печени (болезнь Вильсона, дефицит альфа-1-антитрипсина) и аутоиммунные гепатиты. Степень стеатоза печени оценивали на УЗИ по Саверимутту. 1 HMR-спектроскопию выполняли с помощью сканера 1,5 T с последовательностью PRESS.
Результаты. Ожирение печени подтверждено у 32 детей при УЗИ (у 16 из них также повышена активность АЛТ). Уровень вчСРБ коррелировал с ГПТ (r = 0.44, р = 0,012) и активность ГГТ (r = 0,37, р = 0,04). Способность вчСРБ дифференцировать детей со стеатозом печени, диагностированным в 1 HMRS, от детей без стеатоза была значимой (AUC = 0,697, p = 0,04). Мы не обнаружили таких корреляций для IL-6 и IL-6sR.
Заключение. вчСРБ можно рассматривать как подходящий сывороточный маркер, предсказывающий стеатоз печени у детей с ожирением.
Мы загрузили отрывок из статьи выше, к которой вы можете получить полный доступ.
Вариант № 1
Вариант № 2
Вариант № 3
СРБ С-реактивный белок - Медицинский центр Энел-Мед
Описание теста
С-реактивный белок , также известный как СРБ, возникает в организме во время воспаления. Это белок, относящийся к так называемому острая фаза и появляется в крови человека уже через 6 часов после появления фактора, вызвавшего патологическую реакцию организма. Его повышенная концентрация может быть связана не только с инфекцией, но и с серьезными хроническими заболеваниями, такими как рак или аутоиммунные заболевания.Приглашаем вас проверить уровень С-реактивного белка в учреждения enel-med по всей Польше.
Анализ концентрации С-реактивного белка - показания.
Определение концентрации С-реактивного белка – противопоказания
Проверка концентрации С-реактивного белка – как подготовиться к анализу?
Проверка уровня С-реактивного белка – как работает тест?
направляется в пункт сбора. Его пригласит для выполнения услуги медицинский работник.
После выполнения необходимых формальностей пациент получит образец венозной крови. Испытания проводятся квалифицированным персоналом. Сотрудники пункта сбора информируют пациента о дате проведения анализов и способе получения результатов анализов. После осмотра вы должны оставаться в учреждении около 5 минут, чтобы прижать место инъекции.О любых жалобах, связанных с процедурой сдачи крови, следует сообщать сотруднику пункта сдачи крови. Определение концентрации С-реактивного белка – интерпретация результатов
Анализ крови на воспаление
Что говорит показатель RDW-CV о COVID-19
Какие показатели крови все же могут свидетельствовать о тяжелом течении COVID-19?