2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
анализы на covid-19 и антитела
Исследование на определение антителIgM и IgGк возбудителю коронавирусной инфекции SARS-CoV-2.
Тестирование позволяет выявить наличие в организме человека специфических иммуноглобулинов классов IgM и IgG к коронавирусу SARS-CoV-2, который является возбудителем заболевания COVID-19. Обнаружение в сыворотке крови данных антител свидетельствует о перенесённом заболевании.
Когда вирус оказывается в организме инфицированного, егоиммунитетусиленно синтезируетиммуноглобулины М и G, которые впоследствии защищают организм от заражения коронавирусом повторно и помогают ему более эффективно бороться с инфекцией.
При других инфекциях организм заражённогочеловека в первую очередь синтезирует иммуноглобулины IgM, а затем IgG. Однако при заболевании COVID-19 антитела обоих классов идентифицируют в сыворотке крови практически в одно время — в течение недели после появления первых симптомов. Эта особенность позволяет определить этап заболеванияу пациента и, соответственно, его заразность для окружающих.
Обнаружение в крови антител обоих классов показывает текущее либо прошедшее течение коронавирусной инфекции.
Иммуноглобулины M (IgM) появляются в кровипосле проникновения вируса в дыхательные пути — уже через 4-5 дней от первых признаков заболевания, тогда как иммуноглобулины G(IgG)синтезируются организмом позднее и целиком сменяют M только через 2-3 месяца от датызаражения.
Во время исследования на определение антител к COVID-19 оценивается качество и количество антител в сыворотке крови. Наличие иммуноглобулинов в организме показывает, что человек переболел либо ещё болеет коронавирусом. Количество обнаруженных антител помогает определить форму заболевания и стойкость иммунной защиты организма при повторном заражении вирусом.
Зачем проходить исследование на определение антител
Выявив наличие в крови и уровень специфических иммуноглобулиновIgG, можно даже при отсутствии симптомов диагностироватьперенесённое заболеваниеи степень защищённости организма от повторного заражения коронавирусом SARS-CoV-2. Кроме того, исследование поможет отличить заболевание COVID-19 от похожих по симптомам патологий.
Кроме того, исследование поможет отличить заболевание COVID-19 от похожих по симптомам патологий.
Тестированиепоказываеттечение инфекции в данный моментлибо недавно перенесенное заболевание. Также идентифицирование антител у переболевших COVID-19 пациентов позволяетиспользоватьсыворотку их кровидля лечения тяжёлых форм заболевания.
На данный момент исследование коронавируса и его влияния на организм продолжается, поэтому пока невозможно точно сказать, что после перенесённого заболевания человек не сможет заразиться вновь или стать бессимптомным носителем. Таким образом, рекомендации по соблюдению дистанции и использованию масок в общественных местах остаются актуальными даже при наличии у человека соответствующих иммуноглобулинов.
Качественный или количественный анализ на антитела к SARS-CoV-2: что лучше?
На самом деле оба варианта тестов способны определить наличие антител в вашем организме, однако разница между ними есть.
Качественный тест на выявление иммуноглобулинов характеризуется высокой скоростью получения результата — в течение нескольких часов в день взятия анализа.
По результатам данноготеста вы узнаете о наличии либо отсутствии у вас антител конкретного типа (IgM или IgG). Данный тест не может показать количество иммуноглобулинов и, соответственно, степень защиты организма, этап заболевания либо изменение уровня антител после терапии, поэтому его рекомендуется делать только после контакта с носителем вируса или при характерных симптомах.
Количественный тест на антитела IgG к SARS-CoV-2считается наиболее точным анализом на определение иммуноглобулинов в составе крови, так как во время него пользуются иммунохемилюминесцентным методом ИФА для подсчёта количества антител.
Количественный тест обладает множеством преимуществ. Результаты количественного анализа способны показать стадию заболевания и уровень иммунитета против коронавируса, а если сделать такой тест после вакцинирования от коронавируса, то можно понять динамику количества иммуноглобулинов в вашем организме. Высокая чувствительность и специфичность метода (97%) обеспечивает точные результаты.Высокий уровень антител позволяет стать донором плазмы для терапии тяжелых больных
Высокая чувствительность и специфичность метода (97%) обеспечивает точные результаты.Высокий уровень антител позволяет стать донором плазмы для терапии тяжелых больных
В сети медицинских центров «Семейная клиника» доступны ВСЕ виды лабораторных анализов на COVID-19 по весьма привлекательным ценам.
Подробности уточняйте в медицинских центрах или по телефонам: 8-499-653-84-71; 8-929-653-91-15
Российские лаборатории предлагают несколько вариантов тестов на антитела к возбудителю COVID-19. Какой стоит выбрать, в каких случаях что понадобится и почему не надо сравнивать тесты из разных лабораторий — разбирался РБК
Фото: Владимир Смирнов / ТАСС
Основные виды тестов
Что такое антитела и какие они бывают
Чем различаются тесты и в чем их проблемы
adv. rbc.ru
rbc.ru
Какой должен быть результат теста
adv.rbc.ru
Нужны ли тесты на антитела для вакцинации
Принцип действия тест-систем прост: в них работают белки коронавируса, с которыми должны связываться антитела из сыворотки крови человека. Если белки связываются, значит, антитела есть и способны нейтрализовать вирус.
Антитела могут образовываться к разным белкам вируса. В SARS-CoV-2, который вызывает COVID-19, есть четыре структурных белка, кодирующих РНК вируса. Это спайковый (S), оболочечный (E), нуклеокапсидный (N) и мембранный (M) белки. Например, «шипы» на оболочке коронавируса, с помощью которых он прикрепляется к клеткам, сформированы S-белком.
Качественные и количественные
Количественный анализ показывает концентрацию антител, выраженную в определенных единицах в объеме биологического материала (например ед.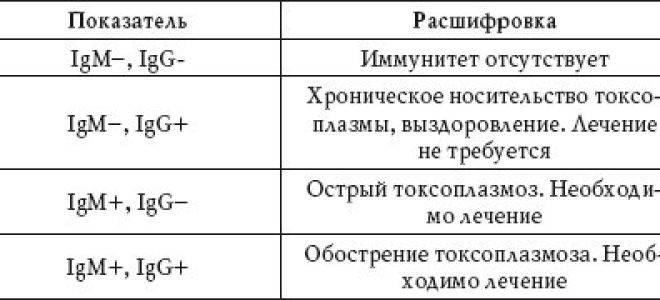 /мл), его результаты могут использоваться для оценки динамики уровня антител в крови. Качественный анализ лишь дает возможность понять, есть ли антитела в крови или нет.
/мл), его результаты могут использоваться для оценки динамики уровня антител в крови. Качественный анализ лишь дает возможность понять, есть ли антитела в крови или нет.
Тесты на IgG к S-белку
Тесты на IgG к RBD-домену S1/S2 белка
Тесты на IgG к нуклеокапсидному N-белку
 Чаще этот анализ выполняется для оценки наличия естественного иммунитета, появившегося после болезни.
Чаще этот анализ выполняется для оценки наличия естественного иммунитета, появившегося после болезни.Тесты на IgM
Тесты на авидность антител
Антитела, или иммуноглобулины (сокращенно их обозначают Ig), — это молекулы, которые вырабатывает иммунная система, с их помощью организм борется с любыми патогенами, например с вирусами или аллергенами. «Каждое антитело, или солдат, в нашей системе обучено распознавать один конкретный антиген. В нашем организме тысячи различных антител. Когда организм человека впервые подвергается воздействию какого-либо антигена, требуется время, чтобы иммунная система отреагировала и выработала антитела, специфические для этого антигена», — описывает ВОЗ механизм работы антител.
Тест на антитела, или серологическое исследование, — это проведение анализа на наличие антител в сыворотке крови. Антитела, которые работают против SARS-CoV-2, обычно обнаруживаются в первые несколько недель после заражения. Наличие антител показывает, что человек был инфицирован SARS-CoV-2, независимо от того, протекало ли заболевание в тяжелой, легкой или бессимптомной форме.
Но антитела могут появиться не только после болезни.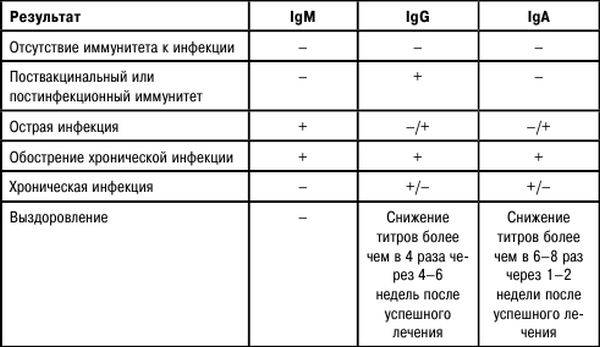 Начать их выработку организм может и после вакцинации.
Начать их выработку организм может и после вакцинации.
Антиген — это элемент вируса, к которому вырабатываются антитела. После того как антитела, специфические для конкретного антигена, выработаны, они начинают работать вместе с остальной иммунной системой, чтобы уничтожить патоген и остановить болезнь. Вакцины содержат ослабленные или инактивированные частицы конкретного микроорганизма (антиген), которые вызывают иммунную реакцию организма.
Антитела бывают разных классов, которые обычно обозначают латинскими буквами А, М, G, Е и D. Таким образом, антитела класса A будут обозначаться IgА. Чаще всего в крови исследуется наличие антител IgM и IgG.
Первыми после активации иммунной системы и распознавания чужеродного вещества, выявления его особенностей начинают вырабатываться антитела IgM.
После этого начинают образовываться антитела класса IgG. То есть антитела IgM — маркер острой инфекции, антитела IgG — маркер перенесенного заболевания или наличия иммунитета.
Структурные белки — белки, с помощью которых кодируется геном микроорганизмов. У коронавирусов они кодируют РНК.
Считается, что чем выше уровень антител в крови, тем ниже риск повторного заражения вирусом SARS-CoV-2, а также вероятность тяжелого течения и развития осложнений COVID-19.
Коронавирус
Россия Москва Мир
0 (за сутки)
Заразились
0 (за сутки)
Умерли
0 (за сутки)
Заразились
0 (за сутки)
Умерли
0 (за сутки)
Заразились
0 (за сутки)
Умерли
Сравнивать результаты количественного анализа можно только в случае тестов, полученных в разное время, но выполненных по одной и той же методике. Тогда можно сделать вывод, как изменился уровень антител. Если же тест-системы и методики разные, сравнить их не получится.
Сейчас в России используется 150 разнообразных тест-систем на COVID-19, которые различаются чувствительностью, возможностью количественной и качественной оценки уровня антител, используемыми антигенами и т. д., пояснила РБК Эльвира Соколовская, исполнительный директор сети клиник «Семейный доктор».
д., пояснила РБК Эльвира Соколовская, исполнительный директор сети клиник «Семейный доктор».
У каждой тест-системы свои показатели измерения и референсные значения, объясняет Дмитрий Денисов, медицинский директор лабораторной службы «Хеликс». Эти значения лаборатории указывают, как правило, на бланках результата. «В связи с этим для определения уровня антител и возможности последующего сравнения результатов следует сдавать тест в одной лаборатории, который будет выполняться одинаковым методом на реагентах одного и того же производителя», — рекомендует эксперт.
Различия есть и в тестах на то, к какой части вируса вырабатываются антитела. Например, один из самых популярных — на антитела к спайковому белку (S). «Считается, что определенный подтип таких антител в первую очередь обеспечивает защиту от инфекции. Это так называемые нейтрализующие антитела. Часто такой анализ выполняется для контроля эффективности проведения вакцинации препаратами, содержащими именно антиген S-белка», — пояснил РБК специалист.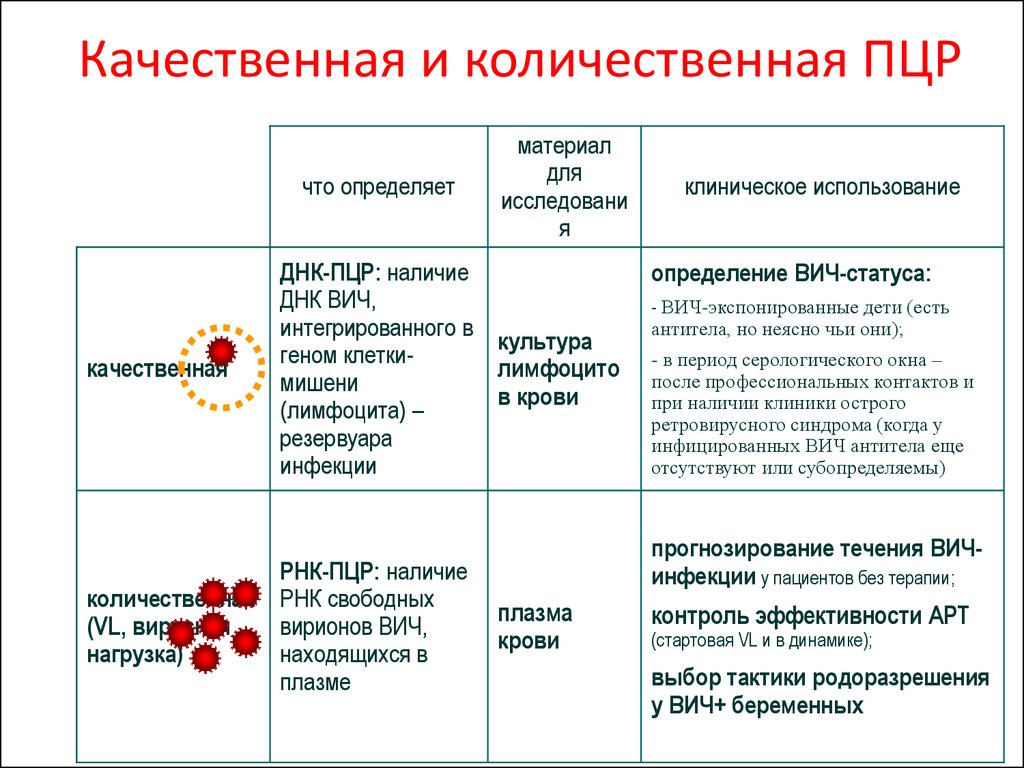
«Если привить вакцинами «Спутник V», Phizer, AstraZeneca, образуются только антитела к S-белкам. После перенесенной инфекции — антитела и к S-белкам, и к N-белкам, и к другим структурным вирусным белкам», — рассказывает вирусолог, профессор МГУ Алексей Аграновский.
Сейчас в мире нет единого подхода к тому, какой результат теста на антитела доказывает, что у человека есть защита от коронавируса. «В настоящее время нет ни одного руководящего документа или обзорных работ с достаточным уровнем доказательности, которые бы регламентировали оценку результатов исследований на уровень IgG», — поясняет Дмитрий Денисов.
«Тест-системы существуют разные, в том числе определяющие антитела к двум-трем белкам. Они сделаны по разным принципам. И у них есть коэффициент — разница между контролем, который не должен связывать, и образцом — сывороткой, которая связывает. Этот коэффициент разный, цифры во всех тест-системах разные. Где-то хорошо — это, например, показатель 400, а в каких-то тестах — 2.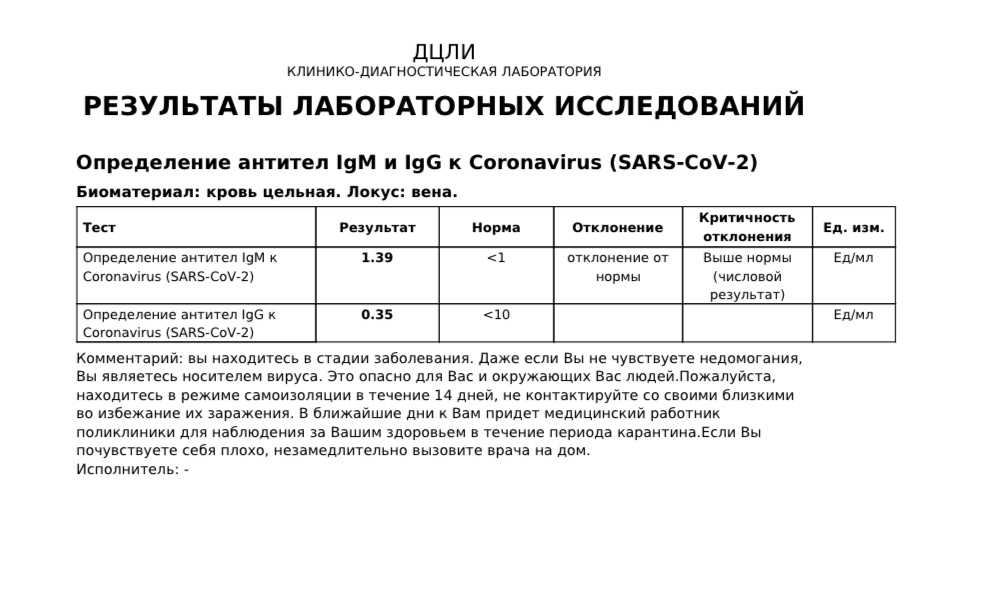 Когда выдают анализ, выдают и расшифровку с обозначением, что, допустим, от 1 до 20 означает отсутствие антител, от 20 до 40 — сомнительный анализ, а выше 40 — определенно положительный анализ, есть антитела. Цифры условные. Единых чисел для всех сейчас нет», — объяснил РБК академик РАН Виталий Зверев, завкафедрой микробиологии, вирусологии, иммунологии Сеченовского университета.
Когда выдают анализ, выдают и расшифровку с обозначением, что, допустим, от 1 до 20 означает отсутствие антител, от 20 до 40 — сомнительный анализ, а выше 40 — определенно положительный анализ, есть антитела. Цифры условные. Единых чисел для всех сейчас нет», — объяснил РБК академик РАН Виталий Зверев, завкафедрой микробиологии, вирусологии, иммунологии Сеченовского университета.
Анастасия Луканина, замглавврача сети лабораторий «Инвитро», отмечает, что с началом распространения в Москве индийского штамма («дельта» и «дельта плюс») установить корректный уровень антител IgG в крови, при котором обеспечивается иммунитет, нельзя.
Всемирная организация здравоохранения (ВОЗ) не рекомендует использовать тесты на антитела для принятия решения о вакцинации, заявила РБК официальный представитель ВОЗ в России Мелита Вуйнович.
«Оценка иммунитета является сложной задачей и требует различных научных уровней и наличия сложных лабораторий. Присутствие определенных антител в обычных тестах (выполняемых в коммерческих лабораториях. — РБК), как правило, не говорит о том, являются ли они нейтрализующими антителами, то есть могут ли они остановить вирус, поэтому ВОЗ не рекомендует данный вид тестов», — объяснила Вуйнович.
— РБК), как правило, не говорит о том, являются ли они нейтрализующими антителами, то есть могут ли они остановить вирус, поэтому ВОЗ не рекомендует данный вид тестов», — объяснила Вуйнович.
Представитель ВОЗ также подчеркнула, что само по себе наличие антител не служит препятствием для вакцинации: сделать прививку можно при любом их уровне в крови. «Если у вас есть антитела, это не значит, что вакцина нанесет вам какой-то вред. Это абсолютно неправда. Несмотря на уровень титров антител, возможно безопасно вакцинироваться», — говорила она ТАСС.
Коронавирус
Россия Москва Мир
0 (за сутки)
Заразились
0 (за сутки)
Умерли
0 (за сутки)
Заразились
0 (за сутки)
Умерли
0 (за сутки)
Заразились
0 (за сутки)
Умерли
Это мнение разделяют медицинские эксперты. «У граждан, переболевших COVID-19, в течение шести месяцев сохраняется напряженный иммунитет, с высокой долей вероятности гарантирующий невозможность повторного заболевания COVID-19. С точки зрения экспертов, наличие высокого уровня иммуноглобулина G не является противопоказанием для вакцинирования. Предлагается отказаться от учета иммуноглобулина G как гарантии достаточности иммунитета против COVID-19. Только вакцинация», — утверждает Анастасия Луканина.
С точки зрения экспертов, наличие высокого уровня иммуноглобулина G не является противопоказанием для вакцинирования. Предлагается отказаться от учета иммуноглобулина G как гарантии достаточности иммунитета против COVID-19. Только вакцинация», — утверждает Анастасия Луканина.
Анализ крови, COVID-19, Блог неотложной медицинской помощи
Мы достигли критической стадии в борьбе с COVID-19, и по мере продолжения усилий по вакцинации появляются новые варианты вируса. Все мы задаемся вопросом, достаточно ли мы защищены от этого сложного вируса. Что, если бы вы пережили случай COVID-19 в начале пандемии и никогда не знали, что он у вас есть? Через какое время после вакцинации наш организм имеет достаточно антител для защиты от инфекции или повторного заражения? Один из лучших способов определить, есть ли у вас защита от COVID-19.вирус с количественным тестированием антител.
После того, как мы боремся с вирусным заболеванием, наша иммунная система создает белки, которые помогают бороться с будущими инфекциями. Как переживание болезни, так и вакцинация могут помочь организму выработать эти ценные антитела. Исследования показали, что эти антитела обладают мощной противовирусной активностью, что коррелирует с наличием защиты.
Антитела обеспечивают необходимую защиту, но с COVID-19, мы все еще не уверены, как долго мы будем оставаться защищенными. CDC в настоящее время оценивает это явление и различные другие факторы, которые могут повлиять на уровень антител и иммунитет. Были зарегистрированы случаи повторного заражения COVID-19, но они остаются редкими.
Защита от антител существует в спектре или диапазоне, что делает тестирование таким полезным. Некоторые люди имеют сильную иммунную систему и сохранят высокий уровень антител и более длительный период защиты. Другим, возможно, не так повезло, поскольку они имеют такой же уровень защитных преимуществ от антител. Особенно это касается пожилых людей и людей с ослабленным иммунитетом.
Другим, возможно, не так повезло, поскольку они имеют такой же уровень защитных преимуществ от антител. Особенно это касается пожилых людей и людей с ослабленным иммунитетом.
Качественный тест на антитела проверяет, есть ли у вас антитела или нет… да или нет! Количественный тест на антитела определяет, какой уровень или сколько этих антител вырабатывается вашим организмом. Количественные тесты на антитела соответствуют международным стандартам, гарантирующим точность результатов. Поэтому, если вы хотите выяснить, насколько велика ваша защита, Количественный тест на антитела является жизнеспособным выбором.
Этот тест отличается высокой чувствительностью и клинической специфичностью. Он может измерять уровни антител, вырабатываемых как болезнью, так и вакцинами, путем тестирования антител к шиповидному белку. Эта инновационная технология оказывается весьма важной. Это поможет исследователям, поскольку они продолжают узнавать, какие вакцины могут обеспечить наилучший уровень защиты от вируса. Исследователи также изучают такие факторы, как продолжительность действия иммунитета от вакцин и частота повторных прививок.
Это поможет исследователям, поскольку они продолжают узнавать, какие вакцины могут обеспечить наилучший уровень защиты от вируса. Исследователи также изучают такие факторы, как продолжительность действия иммунитета от вакцин и частота повторных прививок.
Иммуноанализ представляет собой высокоселективную процедуру, используемую для измерения присутствия аналитов в растворе. Это делается за счет распознавания антител. Процесс иммуноанализа этого теста направлен на рецептор-связывающий домен (RBD) в шиповидном белке. Эксперты сосредотачиваются на RBD в исследованиях будущих вакцин и терапевтических средств.
Важно отметить, что тест на антитела не заменяет тест на COVID-19.диагностический тест. Если у вас есть симптомы COVID-19, посетите центр неотложной помощи MD Now для надлежащего тестирования. Антитела могут появиться в тестах только через две недели после появления симптомов или после полного введения серии вакцин.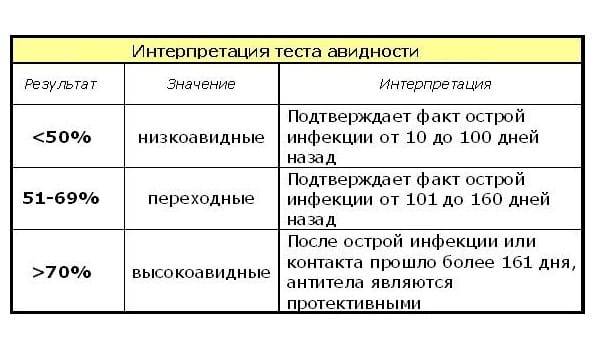 Выбор теста на антитела вместо обычного теста может привести к ложноотрицательному результату, что может способствовать распространению вируса.
Выбор теста на антитела вместо обычного теста может привести к ложноотрицательному результату, что может способствовать распространению вируса.
MD Now с гордостью управляет Roche Elecsys ® Количественный иммунологический тест на антитела к SARS-CoV-2 S.
Процедура проведения теста на антитела к COVID-19 проста. Все, что для этого требуется, — быстрое взятие крови. Никакой предварительной записи не требуется, и вы получите свои результаты в течение 48 часов или меньше.
Наши более чем 75 офисов во Флориде открыты 365 дней в году, чтобы вы могли посетить нас в удобное для вас время. Наша команда под руководством врачей, от вакцинации до тестирования, готова помочь вам вернуться к нормальной жизни прямо сейчас.
Готовы ли вы расширить свои возможности и позаботиться о своем здоровье? Посетите любую из наших современных клиник для лечения COVID-19. Количественное тестирование на антитела сегодня или свяжитесь с нами для получения дополнительной информации.
Количественное тестирование на антитела сегодня или свяжитесь с нами для получения дополнительной информации.
Клин Чим Acta. 2020 ноябрь; 510: 613–616.
Published online 2020 Aug 25. doi: 10.1016/j.cca.2020.08.033
, a, 1 , a, 1 , b, 1 , a , A , B , B , A , B, ⁎ и B, ⁎
Информация о статье.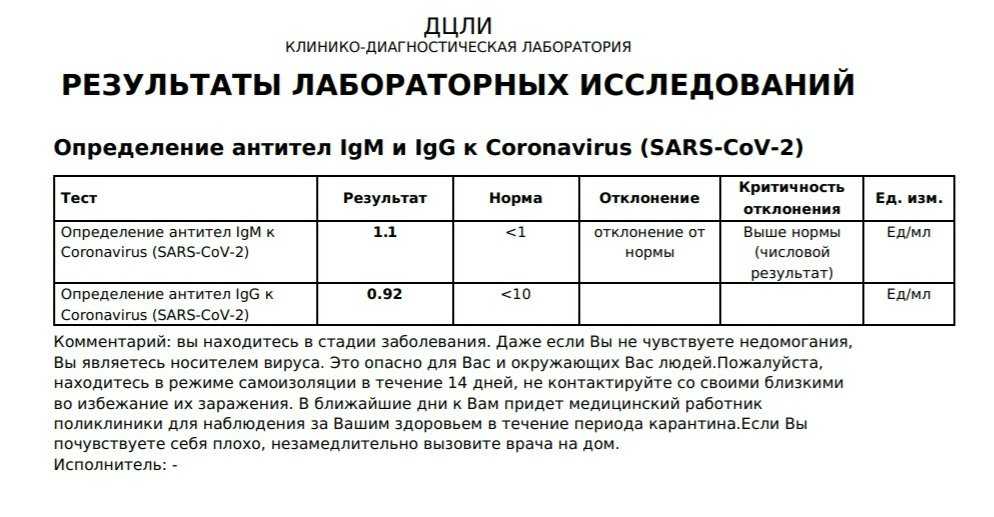 Статья. Статья Копа0002 Качественное и количественное определение нуклеиновых кислот SARS-CoV-2, патогена, вызывающего коронавирусную болезнь 2019 (COVID-19), играет важную роль в диагностике, эпиднадзоре, профилактике и борьбе с COVID-19.
Статья. Статья Копа0002 Качественное и количественное определение нуклеиновых кислот SARS-CoV-2, патогена, вызывающего коронавирусную болезнь 2019 (COVID-19), играет важную роль в диагностике, эпиднадзоре, профилактике и борьбе с COVID-19.
Всего было собрано 117 образцов от 30 пациентов с подтвержденным COVID-19 и 61 пациента без COVID-19. Для качественного и количественного анализа этих образцов использовали количественную ПЦР с обратной транскриптазой (RT-qPCR) и капельную цифровую ПЦР (ddPCR) для оценки диагностической эффективности и применимости двух методов.
Частота положительных результатов RT-qPCR и ddPCR составила 93,3% и 100% соответственно. Среди 117 образцов 6 образцов были положительными по одному гену с помощью RT-qPCR, но положительными с помощью ddPCR, а 3 образца были протестированы как отрицательные с помощью RT-qPCR, но положительные с помощью ddPCR. Вирусная нагрузка образцов с противоречивыми результатами была относительно низкой (3,1–20,5 копий/тест). Среди 46 положительных образцов было 17 образцов (37%) с вирусной нагрузкой ниже 20 копий/тест, и только 9 из них были успешно обнаружены с помощью RT-qPCR. Пациент в тяжелом состоянии находился под динамическим наблюдением. Все 6 образцов от этого пациента дали отрицательный результат с помощью RT-qPCR, но 4 образца дали положительный результат с помощью ddPCR с низкой вирусной нагрузкой.
Среди 46 положительных образцов было 17 образцов (37%) с вирусной нагрузкой ниже 20 копий/тест, и только 9 из них были успешно обнаружены с помощью RT-qPCR. Пациент в тяжелом состоянии находился под динамическим наблюдением. Все 6 образцов от этого пациента дали отрицательный результат с помощью RT-qPCR, но 4 образца дали положительный результат с помощью ddPCR с низкой вирусной нагрузкой.
Качественный анализ образцов COVID-19 может удовлетворить потребности клинического скрининга и диагностики, в то время как количественный анализ предоставляет исследовательскому сообществу больше информации. Хотя и ddPCR, и RT-qPCR могут давать качественные и количественные результаты, ddPCR показала более высокую чувствительность и более низкий предел обнаружения, чем RT-qPCR, и не использует стандартную кривую для количественного определения вирусной нагрузки. Таким образом, ddPCR предлагает больше преимуществ, чем RT-qPCR.
Ключевые слова: Качественный анализ, Количественный анализ, COVID-19, Тестирование нуклеиновых кислот
Коронавирусная болезнь 2019 (COVID-19) — это новое и появляющееся инфекционное заболевание, которое быстро распространилось по всему миру. Заболевание вызывает новый коронавирус SARS-CoV-2. Согласно данным, опубликованным Университетом Джонса Хопкинса, во всем мире более 10 миллионов человек были диагностированы с COVID-19, а число погибших превысило полмиллиона [1]. В связи с высокой контагиозностью и высоким процентом тяжелых исходов COVID-19, своевременная и эффективная диагностика COVID-19 очень важна для лечения заболевания, профилактики эпидемий и борьбы с эпидемиями.
Заболевание вызывает новый коронавирус SARS-CoV-2. Согласно данным, опубликованным Университетом Джонса Хопкинса, во всем мире более 10 миллионов человек были диагностированы с COVID-19, а число погибших превысило полмиллиона [1]. В связи с высокой контагиозностью и высоким процентом тяжелых исходов COVID-19, своевременная и эффективная диагностика COVID-19 очень важна для лечения заболевания, профилактики эпидемий и борьбы с эпидемиями.
Анализ вирусных нуклеиновых кислот является основным методом диагностики COVID-19. В качестве текущего золотого стандарта диагностики COVID-19 в количественной полимеразной цепной реакции с обратной транскриптазой (RT-qPCR) используются специфические праймеры и флуоресцентные зонды для нацеливания на определенные области генома SARS-CoV-2. Флуоресцентные зонды используются для наблюдения за ходом реакции амплификации, а интенсивность флуоресценции отражает количество ампликонов в образце. Значение порогового цикла (Ct), которое может быть напрямую связано с исходной целевой концентрацией в образце, используется для определения того, является ли образец положительным или отрицательным [2].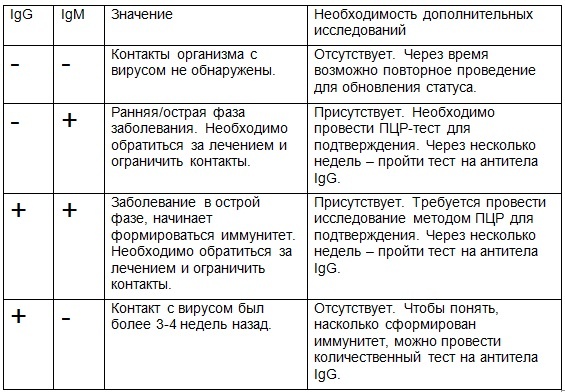 Хотя RT-qPCR может предоставить количественные результаты с использованием значений Ct и стандартной кривой [3], она в основном используется для качественного анализа при клиническом COVID-19.обнаружение.
Хотя RT-qPCR может предоставить количественные результаты с использованием значений Ct и стандартной кривой [3], она в основном используется для качественного анализа при клиническом COVID-19.обнаружение.
Помимо качественной диагностики, количественное определение также играет важную роль в диагностике, эпиднадзоре, профилактике и контроле COVID-19. В качестве технологии абсолютного количественного определения нуклеиновых кислот цифровая полимеразная цепная реакция (дПЦР) также применялась для обнаружения нуклеиновых кислот SARS-CoV-2 [4], [5], [6]. В анализе dPCR образец сначала разбавляют и равномерно распределяют по множеству независимых реакционных камер. Затем проводится ПЦР-амплификация, при которой нуклеиновые кислоты SARS-CoV-2 нацеливаются на специфические праймеры и флуоресцентные зонды. Наконец, обнаруживаются сигналы конечных точек ПЦР, и выполняется статистический анализ распределения Пуассона для определения количества копий вирусной РНК [7]. Помимо получения качественных результатов, дПЦР также может предоставить абсолютное количество SARS-CoV-2, не полагаясь на стандартную кривую.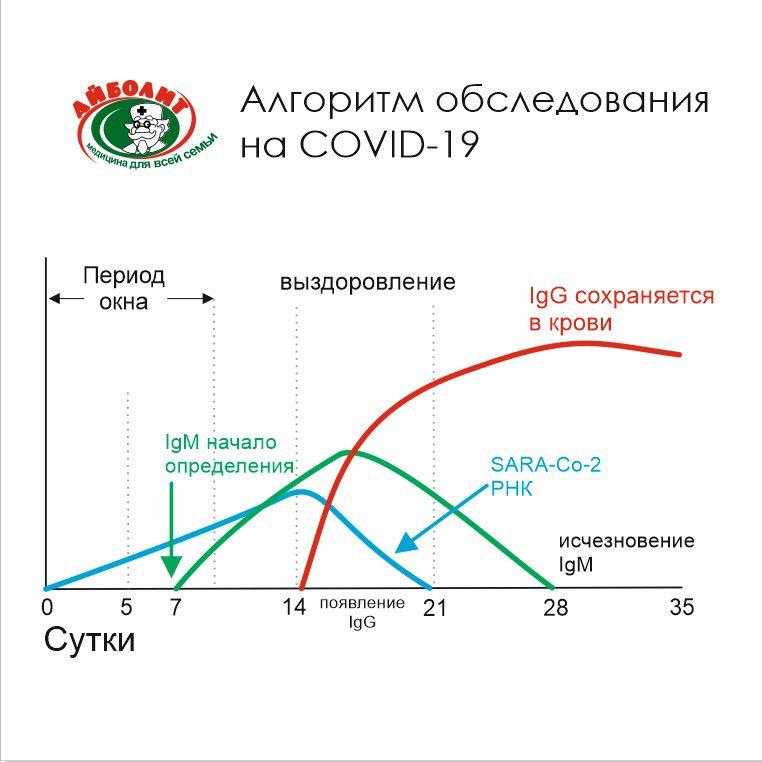
В этом исследовании 117 клинических образцов были проанализированы качественно и количественно с помощью RT-qPCR и капельной цифровой PCR (ddPCR) соответственно. Целью данного исследования было изучение диагностической эффективности и применимости методов качественного и количественного анализа.
Сорок мазков из зева и 16 образцов мокроты от 30 пациентов с подтвержденным COVID-19 и 51 мазок из зева и 10 образцов мокроты от 61 пациента, у которых не было обнаружено COVID-19были собраны в пекинской больнице Юань при Столичном медицинском университете в период с февраля по апрель 2020 г. Диагностическими критериями служили Протокол диагностики и лечения COVID-19 (пробная версия 7), установленный Национальной комиссией здравоохранения Китайской Народной Республики [8]. ]. Также были собраны результаты лабораторных анализов пациентов и клинические данные. Образцы, которые не могут быть протестированы немедленно, хранили при температуре -80 °C.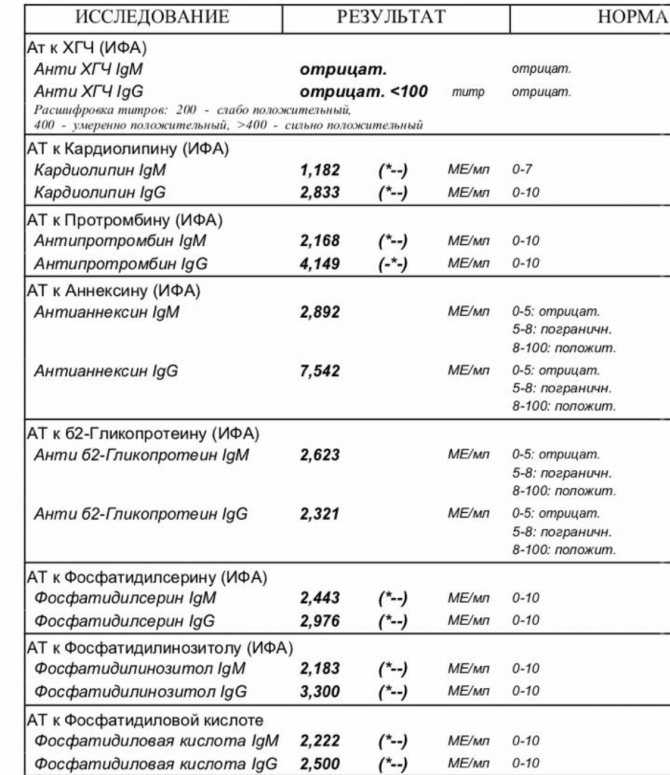 Это исследование было одобрено Комитетом по этике пекинской больницы Юань.
Это исследование было одобрено Комитетом по этике пекинской больницы Юань.
Вирусную РНК экстрагировали с использованием наборов для выделения нуклеиновых кислот (Lot. T124, Tianlong Science and Technology Co., Сиань, Китай) на экстракторе нуклеиновых кислот (GeneRotex, Tianlong Science and Technology) в соответствии с инструкциями производителя. Образцы мокроты обрабатывали равным объемом 7,5% Sputasol (Oxoid Ltd., Basingstoke, United Kingdom) до полного разжижения. Супернатант отбирали для экстракции нуклеиновой кислоты.
RT-qPCR проводили с использованием набора для обнаружения РНК SARS-CoV-2 (BioGerm Medical Biotechnology Co., Ltd., Шанхай, Китай) на системе ПЦР в реальном времени ABI 7500 (Thermo Fisher Scientific, Waltham, MA) в соответствии с инструкции производителя. В этом наборе были обнаружены гены ORF1ab и N SARS-CoV-2.
ddPCR проводили с использованием набора для обнаружения нуклеиновых кислот SARS-CoV-2 (метод цифровой ПЦР) (TargetingOne, Пекин, Китай) и системы ПЦР TD-1™ Droplet Digital™ (TargetingOne, лицензирована в Китае, регистрационный номер: 20170025). 2019 г.0065; 20192220517), следуя инструкциям производителя. В этом наборе были обнаружены гены ORF1ab и N SARS-CoV-2.
2019 г.0065; 20192220517), следуя инструкциям производителя. В этом наборе были обнаружены гены ORF1ab и N SARS-CoV-2.
Результаты считались действительными, когда эталонный ген был положительным. В соответствии с инструкциями набора RT-qPCR значение Ct ≤38 для генов ORF1ab и N определялось как положительный тест, а значение Ct >38 для обоих генов определялось как отрицательный тест. Значение Ct ≤38 только для одного гена было определено как однократно положительный тест. В анализе ddPCR, если ORF1ab ≥ 3 копий/тест и сумма ORF1ab и генов N ≥ 5 копий/тест или если ген N ≥ 5 копий/тест, результат считался положительным; в противном случае результат считался отрицательным. Окончательное число копий вирусной РНК определяли как большее значение между числами копий двух генов.
Всего в это исследование было включено 30 пациентов с подтвержденным COVID-19 и 61 пациент, у которых не было COVID-19, и подробная информация представлена в .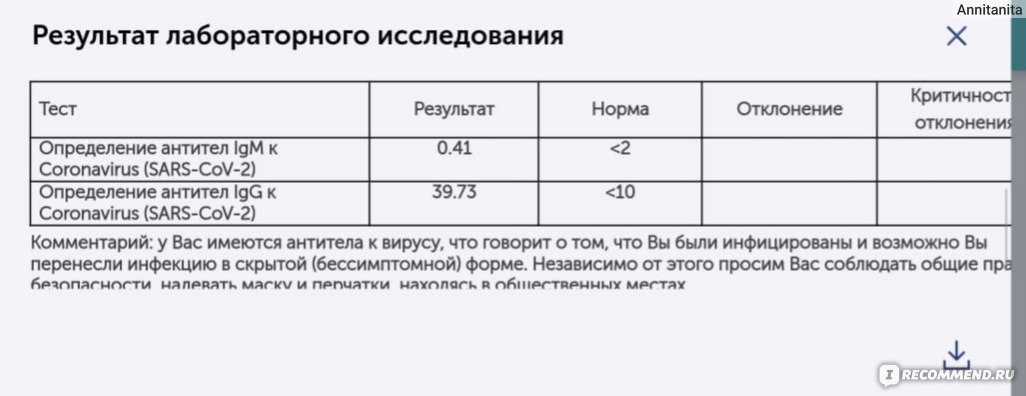 Пятнадцать из 30 пациентов с COVID-19 были мужчинами, а средний возраст составлял 62 года (IQR, 45–71 год). Основными симптомами среди этих пациентов были лихорадка и кашель, о которых сообщалось у 83,3% и 63,3% пациентов соответственно. Пятнадцать пациентов имели легкие симптомы и были моложе 64 лет, а остальные 15 пациентов имели тяжелые симптомы и были старше 60 лет. Из 61 пациента без COVID-19 было 38 пациентов мужского пола.а средний возраст составлял 37 лет (IQR, 30–56 лет). У всех 61 пациента была лихорадка.
Пятнадцать из 30 пациентов с COVID-19 были мужчинами, а средний возраст составлял 62 года (IQR, 45–71 год). Основными симптомами среди этих пациентов были лихорадка и кашель, о которых сообщалось у 83,3% и 63,3% пациентов соответственно. Пятнадцать пациентов имели легкие симптомы и были моложе 64 лет, а остальные 15 пациентов имели тяжелые симптомы и были старше 60 лет. Из 61 пациента без COVID-19 было 38 пациентов мужского пола.а средний возраст составлял 37 лет (IQR, 30–56 лет). У всех 61 пациента была лихорадка.
Клинические особенности включенных пациентов.
| Features | Value | ||
|---|---|---|---|
| Patients with confirmed COVID-19 | |||
| Age, median (IQR), years | 62 (45–71) | ||
| Male , n (%) | 15 (50) | ||
| Признаки и симптомы при поступлении, n (%) | |||
| Fever | 25 (83. 3) 3) | ||
| Cough | 19 (63.3) | ||
| Fatigue | 9 (30) | ||
| Dyspnea | 8 (26.70) | ||
| Myalgia | 6 (20) | ||
| Anorexia | 5 (16.7) | ||
| Headache | 3 (10) | ||
| Pharyngodynia | 1 (3.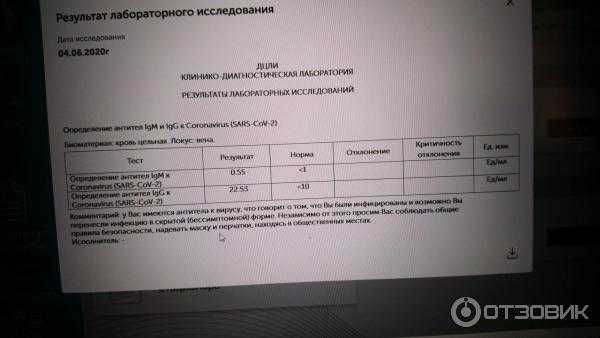 3) 3) | ||
| Nausea and vomiting | 1 (3.3) | ||
| Stomach ache | 1 (3.3) | ||
| No signs or symptoms | 1 (3.3) | ||
| Underlying chronic diseases, n (%) | |||
| Hypertension | 11 (36.7) | ||
| Mellitus | 4 (13.3) | ||
| Hyperlipemia | 2 (6. 7) 7) | ||
| Coronary heart disease | 2 (6.7) | ||
| Arrhythmia | 1 (3.3) | ||
| Bronchiectasis | 1 (3.3) | ||
| Chronic obstructive pulmonary disease | 1 (3.3) | ||
| Clinical classification, (%) | |||
| Mild type | 15 (50) | ||
| Severe type | 15 (50) | ||
| Clinical stage, n (%) | |||
| Early stage | 13 (43.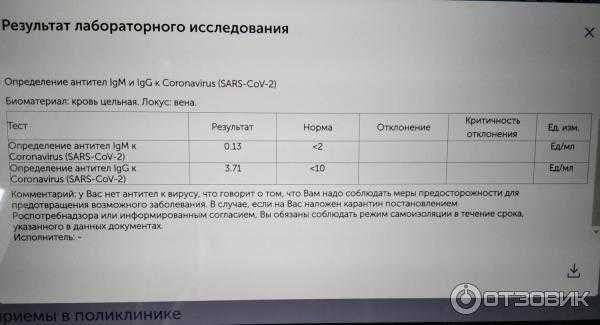 3) 3) | ||
| Progressive stage | 15 (50) | ||
| Recovery stage | 2 (6.7) | ||
| Patients without COVID-19 | |||
| Age, median (IQR), years | 37 (30–56) | ||
| Мужской, n (%) | 38 (62,3) | ||
Открыть в отдельном окне
3 9,22 9,22 Сравнение результатов RT-qPCR и ddPCR с результатами клинической диагностики
В этом исследовании 117 образцов были получены однократно или многократно. После тестирования 28 из 30 пациентов с COVID-19 были признаны положительными с помощью RT-qPCR с показателем положительного выявления 93,3%; и все пациенты были признаны положительными с помощью ddPCR с положительным уровнем обнаружения 100% ( ).
Сравнение RT-qPCR и ddPCR с результатами клинической диагностики.
| Analytical method | RT-qPCR | ddPCR | |||
|---|---|---|---|---|---|
| Positive | Negative | Positive | Negative | ||
| Clinical diagnosis results | Positive | 28 | 2 | 30 | 0 |
| Отрицательный | 0 | 61 | 0 | 61 | |
| Positive detection rate | 93.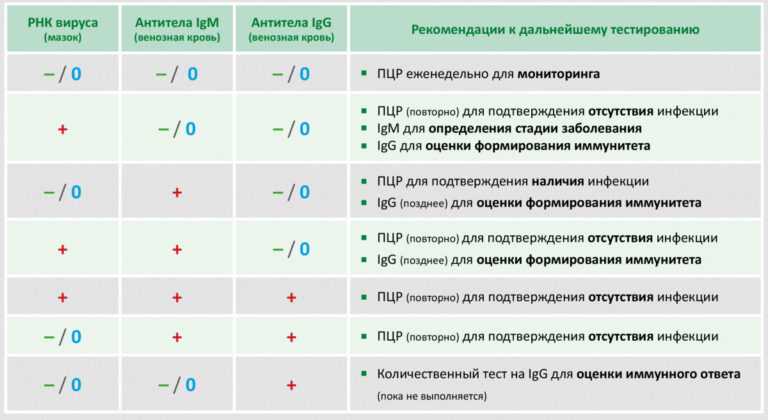 3% 3% | – | 100% | – | |
Open in a separate window
117 протестированных образцов включали 91 образец глоточного мазка и 26 образцов мокроты. Как показано в , 37 образцов дали положительный результат как с помощью RT-qPCR, так и с помощью ddPCR, а 71 образец дал отрицательный результат с помощью обоих методов. Шесть образцов были протестированы как положительные по одному гену с помощью RT-qPCR, но как положительные с помощью ddPCR, и 3 образца были протестированы как отрицательные с помощью RT-qPCR, но положительные с помощью ddPCR. Вирусная нагрузка 9образцов с противоречивыми результатами между RT-qPCR и ddPCR была относительно низкой (от 3,1 копий/тест до 20,5 копий/тест, ). Пять из этих 9 образцов были взяты у разных пациентов с COVID-19. У трех из этих 5 пациентов была лихорадка или респираторные симптомы, а другие 2 пациента были повторно госпитализированы после положительного результата теста при последующем обследовании и не имели симптомов при повторной госпитализации.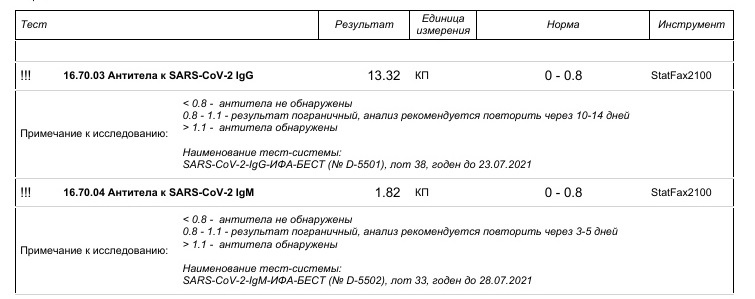 Остальные 4 из 9 образцов были взяты у одного пациента в разное время. У этого пациента была бактериальная коинфекция, и ему была проведена экстракорпоральная мембранная оксигенация (ЭКМО).
Остальные 4 из 9 образцов были взяты у одного пациента в разное время. У этого пациента была бактериальная коинфекция, и ему была проведена экстракорпоральная мембранная оксигенация (ЭКМО).
Сравнение результатов RT-qPCR и ddPCR.
| Sample type | RT-qPCR positive | RT-qPCR single-gene positive | RT-qPCR negative | Sum | |||
|---|---|---|---|---|---|---|---|
| ddPCR Positive | ddPCR Negative | ddPCR положительный | ddPCR отрицательный | ddPCR положительный | ddPCR отрицательный | ||
| Pharyngeal swab | 27 | 0 | 4 | 0 | 1 | 59 | 91 |
| Sputum | 10 | 0 | 2 | 0 | 2 | 12 | 26 |
Открыть в отдельном окне
Подробная информация о образцах с противоречивыми результатами между RT-qPCR и ddPCR.
| No. | Sample type | ddPCR (copies/test) | RT-qPCR | ||||
|---|---|---|---|---|---|---|---|
| ORF1ab | N gene | Viral load | |||||
| 1 | Pharyngeal swab | 9.6 | 1.2 | 9.6 | ORF1ab (+) N (−) | ||
| 2 | Pharyngeal swab | 9.5 | 0 | 9.5 | ORF1ab (+) N (−) | ||
| 3 | Pharyngeal тампон | 20. 5 5 | 13.2 | 20.5 | ORF1ab (−) N (+) | ||
| 4 | Pharyngeal swab | 11.7 | 5.9 | 11.7 | ORF1ab (−) N (+) | ||
| 5 | Pharyngeal swab | 9.5 | 6.8 | 9.5 | ORF1ab (−) N (−) | ||
| 6 | Sputum | 13.8 | 15.2 | 15.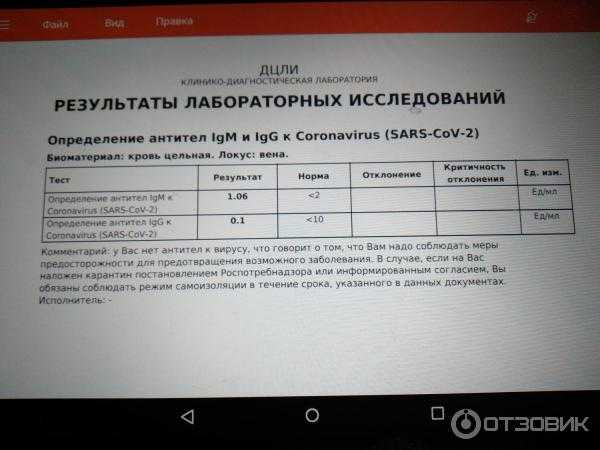 2 2 | ORF1ab (−) N ( +) | ||
| 7 | Sputum | 8.3 | 4.2 | 8.3 | ORF1ab (+) N (−) | ||
| 8 | Sputum | 5.9 | 4.4 | 5.9 | ORF1ab (−) N ( -) | ||
| 9 | Мокрота | 3,1 | 3,1 | 3,1 | orf1ab ( -) N (−) 61 | ORF1AB ( -) N (−) 61 | ORF1AB ( -) N (−) 569 9013. Анализ вирусной нагрузки положительных образцов Анализ вирусной нагрузки положительных образцов Распределение вирусной нагрузки в 46 положительных образцах ddPCR было дополнительно проанализировано, и результаты показаны на рис. . Было всего 4 образца с вирусной нагрузкой более 10 000 копий/тест, тогда как с вирусной нагрузкой менее 20 копий/тест было 17 образцов (37%). Только 9 из 17 образцов были успешно обнаружены с помощью RT-qPCR, а 6 образцов и 2 образца были положительными и отрицательными по одному гену соответственно. Открыть в отдельном окне Гистограмма, показывающая распределение вирусной нагрузки по 46 положительным образцам. Вирусную нагрузку образцов определяли количественно с помощью ddPCR. По оси X показаны различные диапазоны вирусной нагрузки (копии/тест), а по оси Y — количество образцов в пределах каждого диапазона вирусной нагрузки. 3.5. Результаты RT-qPCR и ddPCR для образцов динамического мониторинга Мы использовали RT-qPCR и ddPCR для тестирования 6 образцов мокроты, собранных в разное время у тяжелого пациента. Открыть в отдельном окне Результаты ddPCR для динамического мониторинга. В разное время было собрано шесть образцов мокроты от тяжелого пациента. По оси X показаны даты сбора образцов, а по оси Y — вирусная нагрузка (копии/тест) каждого образца. Качественное и количественное определение нуклеиновых кислот SARS-CoV-2 играет важную роль в диагностике, эпиднадзоре, профилактике и борьбе с COVID-19. RT-qPCR и ddPCR являются основными методами качественного и количественного обнаружения вирусных нуклеиновых кислот. В этом исследовании мы использовали RT-qPCR и ddPCR для проведения качественного и количественного анализа 117 образцов от 30 пациентов с подтвержденным COVID-19 и 61 пациента без COVID-19, а также дополнительно оценили диагностическую эффективность и применимость двух методов. В этом исследовании было обнаружено, что ddPCR имеет более высокую чувствительность и более низкий предел обнаружения (LoD) по сравнению с RT-qPCR. Результаты показали, что частота положительных результатов RT-qPCR и ddPCR составила 93,3% и 100% соответственно. Девять образцов (7,7%) от пациентов с подтвержденным COVID-19 были положительно идентифицированы с помощью ddPCR, но были признаны положительными или отрицательными по одному гену с помощью RT-qPCR. Кроме того, наши результаты показали, что образцы с низкой вирусной нагрузкой не были редкостью при клинических испытаниях. Среди 46 положительных образцов 17 (37%) имели вирусную нагрузку менее 20 копий/тест. Таким образом, обнаружение SARS-CoV-2 с более высокой чувствительностью имеет клиническую ценность. Сообщалось, что RT-qPCR-тестирование на SARS-CoV-2 имеет потенциально высокий уровень ложноотрицательных результатов [13]; одна из возможных причин заключается в том, что LoD RT-qPCR не соответствует клиническим требованиям [14]. Поскольку ddPCR не опирается на калибровочные кривые или значения Ct для обнаружения образцов или количественного определения, результаты являются более объективными, чем результаты RT-qPCR, и могут избежать серой зоны значений Ct. Большинство коммерческих диагностических наборов RT-qPCR для COVID-19 включают две или три мишени, и образец считается положительным, если две или более мишени положительны. Положительный результат только для одной цели определяется как неопределенный и требует повторного тестирования. Результаты ddPCR обеспечивают абсолютное количество вирусной РНК, что предотвращает неопределенность результатов теста и повторное тестирование. Кроме того, ddPCR может точно определять изменения в вирусной нагрузке, что может предоставить клиницистам дополнительную информацию, которая может быть использована для руководства клинической оценкой и лечением. После COVID-19является новым инфекционным заболеванием, необходимо углубить наше понимание болезни, чтобы лучше предотвратить вспышку и контролировать ее. Количественный анализ предоставляет исследовательскому сообществу больше информации, которая может продвинуть исследования и лечение COVID-19. Хотя и ddPCR, и RT-qPCR могут давать качественные и количественные результаты, ddPCR показала более высокую чувствительность и более низкий LoD, чем RT-qPCR, и не использует стандартную кривую для количественного определения вирусной нагрузки. Таким образом, ddPCR предлагает больше преимуществ, чем RT-qPCR. Yan Dang: Сбор данных, Формальный анализ, Письмо - первоначальный вариант. Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье. Благодарим Отделение клинической лаборатории Отделения научных исследований и Центра биоинформатики пекинского госпиталя Юань за своевременную помощь в сборе образцов. Исследование проводилось при финансовой поддержке Национального крупного проекта Китая в области науки и технологий (2018ZX10305410-006 для Джинли Лу), Научно-исследовательского проекта пекинской больницы Юань 2018 года по развитию талантов молодежи и среднего возраста (YNKTQN20180204 для Ян Данга), Пекинской науки и технологический проект (Z201100005420025 для Юн Го) и Университет Цинхуа. 1. Ресурсный центр по коронавирусу Джона Хопкинса, карта COVID-19. https://coronavirus.jhu.edu/map.html, 2020 (по состоянию на 8 июля 2020 г.). 2. Чу Д.К.В., Пан Ю., Ченг С.М.С., Хуэй К.П.Ю., Кришнан П., Лю Ю., Нг Д.Ю.М., Ван Ц.К.С., Ян П., Ван К., Пейрис М., Пун Л.Л.М. Молекулярная диагностика нового коронавируса (2019-nCoV), вызвавшего вспышку пневмонии. клин. хим. 2020;66(4):549–555. doi: 10.1093/clinchem/hvaa029. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 3. Пан Ю., Чжан Д., Ян П., Пун Л.Л.М., Ван К. Вирусная нагрузка SARS-CoV-2 в клинических образцах. Ланцет Инфекция. Дис. 2020;20(4):411–412. doi: 10.1016/s1473-3099(20)30113-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 4. Ю Ф., Ян Л., Ван Н., Ян С., Ван Л., Тан Ю., Гао Г., Ван С. , Ma C., Xie R., Wang F., Tan C., Zhu L., Guo Y., Zhang F. Количественное обнаружение и анализ вирусной нагрузки SARS-CoV-2 у инфицированных пациентов. клин. 5. Суо Т., Лю С., Фэн Дж., Го М., Ху В., Го Д., Улла Х., Ян Ю., Чжан Ц., Ван С., Саджид М., Хуан З. ., Deng L., Chen T., Liu F., Xu K., Liu Y., Zhang Q., Liu Y., Xiong Y., Chen G., Lan K., Chen Y. ddPCR: более точный инструмент для обнаружения SARS-CoV-2 в образцах с низкой вирусной нагрузкой. Эмердж. Микробы. Заразить. 2020;9(1):1259–1268. doi: 10.1080/22221751.2020.1772678. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Chen H., Wu R., Xing Y., Du Q., Xue Z., Xi Y., Yang Y., Deng Y. , Хан Ю., Ли К., Луан Ю., Чжан Ю., Вэй С., Ю Т., Ли Х., Чжу Л., Су С., Лиан Х., Лу Л., Тан С., Чжэн H., Chen B., Yu P., Guo Y., Ma C. Влияние различных методов инактивации на число копий РНК коронавируса 2 тяжелого острого респираторного синдрома. Дж. Клин. микробиол. 2020 г.: 10.1128/JCM.00958-20. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 7. 8. Национальная комиссия здравоохранения Китайской Народной Республики, Протокол диагностики и лечения COVID-19 (пробная версия 7). http://en.nhc.gov.cn/2020-03/29/c_78469.htm, 2020 (по состоянию на 8 июля 2020 г.). 9. Lu R., Wang J., Li M., Wang Y., Dong J., Cai W. Обнаружение SARS-CoV-2 с помощью цифровой ПЦР для диагностики COVID-19, мониторинга лечения и критериев выписки. medRxiv. 2020 г.: 10.1101/2020.03.24.20042689. [CrossRef] [Google Scholar] 10. Дун Л., Чжоу Дж., Ню С., Ван Ц., Пан Ю., Шэн С., Ван С., Чжан Ю., Ян Дж., Лю М. , Zhao Y., Zhang X., Zhu T., Peng T., Xie J., Gao Y., Wang D., Zhao Y., Dai X., Fang X. Высокоточное и чувствительное диагностическое обнаружение SARS-CoV -2 с помощью цифровой ПЦР. medRxiv. 2020 г.: 10.1101/2020.03.14.20036129. [CrossRef] [Google Scholar] 11. |