2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Резюме. В статье представлены материалы мастер-класса, проведенного Н.К. Мурашко, доктором медицинских наук, профессором, заведующей кафедрой неврологии и рефлексотерапии Национальной медицинской академии последипломного образования им. П.Л. Шупика, в рамках IV Национального конгресса «Людина та Ліки — Україна». Рассмотрены вопросы диагностики и лечения хронической ишемии мозга
23–24 марта 2011 г. в киевском Доме кино прошел IV Национальный конгресс «Людина
та Ліки — Україна», в ходе работы которого были рассмотрены важные вопросы профилактики, диагностики и лечения различных заболеваний. В рамках форума были проведены несколько мастер-классов, которые позволили врачам получить актуальные практические навыки о лечении ряда распространенных заболеваний. Одним из наиболее интересных оказался мастер-класс, который проводила Наталья Константиновна Мурашко, доктор медицинских наук, профессор, заведующая кафедрой неврологии и рефлексотерапии Национальной медицинской академии последипломного образования им.
П.Л. Шупика. Этот мастер-класс был посвящен важнейшему вопросу — диагностике и лечению хронической ишемии мозга. Профессор Н.К. Мурашко не только раскрыла актуальность проблемы, но и дала практические рекомендации, касающиеся диагностики и лечения с учетом современных стандартов ведения больных с данной патологией. Еще одним преимуществом общения в формате мастер-класса является обратная связь от аудитории в режиме реального времени. В ходе доклада проводились опросы участников, некоторые результаты которых приведены ниже. Так, интересным представляется то, что среди участников мастер-класса наряду с 41% неврологов присутствовали терапевты (25%), кардиологи (12%) и семейные врачи (11%).
Свой доклад профессор Н.К. Мурашко начала с определения хронической ишемии мозга и рекомендаций относительно ее своевременной диагностики. Хроническая ишемия мозга — это медленно прогрессирующее диффузное или очаговое поражение головного мозга, развитие которого связано с артериальной гипертензией, атеросклеротическими процессами, дислипидемией.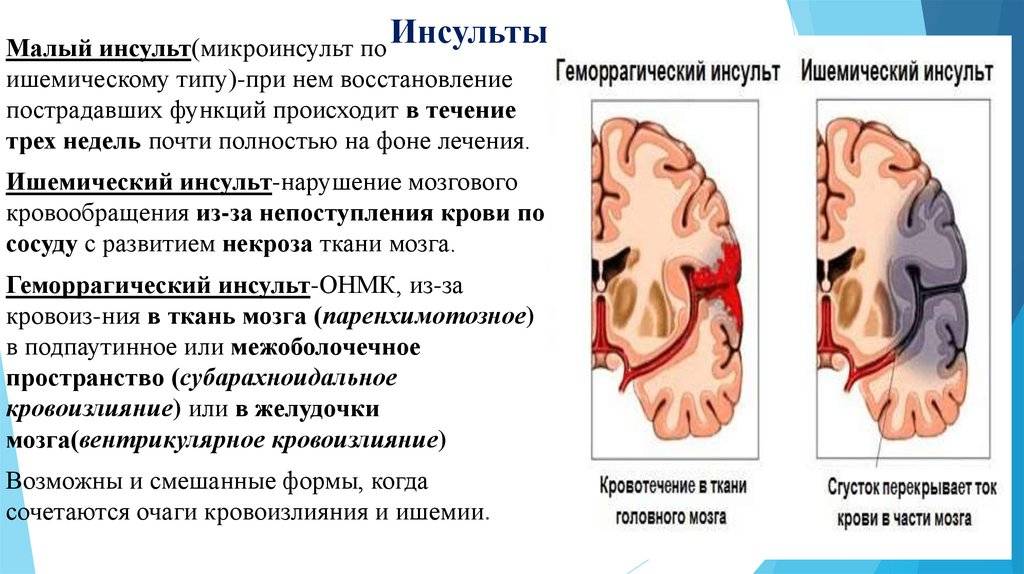 В основе механизма развития ишемии мозга лежат атеросклеротическое поражение сосудов крупного и среднего диаметра, аномалии их строения. В свою очередь, нарушения структуры мелких сосудов обусловлены микроангиопатиями, причинами развития которых могут быть артериальная гипертензия, сахарный диабет, воспалительные заболевания.
В основе механизма развития ишемии мозга лежат атеросклеротическое поражение сосудов крупного и среднего диаметра, аномалии их строения. В свою очередь, нарушения структуры мелких сосудов обусловлены микроангиопатиями, причинами развития которых могут быть артериальная гипертензия, сахарный диабет, воспалительные заболевания.
В зависимости от выраженности клинических проявлений выделяют три стадии заболевания. При I (начальной) стадии пациент жалуется на головокружение, головную боль, повышенную утомляемость и снижение памяти на недавние события. При этом на I стадии прогноз является благоприятным — возможно полное устранение симптоматики. При II стадии (субкомпенсации) увеличивается количество жалоб, наблюдается более отчетливая неврологическая симптоматика в виде наличия рефлексов орального автоматизма, координаторных и двигательных расстройств с формированием вестибуло-атактического, пирамидного, псевдобульбарного и экстрапирамидного синдромов, а также усиление интеллектуально-мнестических и эмоциональных нарушений. Для III стадии характерно уменьшение количества предъявляемых пациентом жалоб, что связано с прогрессированием когнитивных нарушений, вплоть до деменции. На этом этапе становятся более выраженными такие признаки развития заболевания, как парезы, параличи, мышечная ригидность, потеря чувствительности. При диагностике с помощью магнитно-резонансной (МРТ) и компьютерной (КТ) томографии четко визуализируется лейкоареоз — диффузное изменение белого вещества головного мозга. Это является неблагоприятным прогнозом, резко повышает риск развития инсульта, транзиторной ишемической атаки и др. На этой стадии пациент нетрудоспособен.
Для III стадии характерно уменьшение количества предъявляемых пациентом жалоб, что связано с прогрессированием когнитивных нарушений, вплоть до деменции. На этом этапе становятся более выраженными такие признаки развития заболевания, как парезы, параличи, мышечная ригидность, потеря чувствительности. При диагностике с помощью магнитно-резонансной (МРТ) и компьютерной (КТ) томографии четко визуализируется лейкоареоз — диффузное изменение белого вещества головного мозга. Это является неблагоприятным прогнозом, резко повышает риск развития инсульта, транзиторной ишемической атаки и др. На этой стадии пациент нетрудоспособен.
На начальных этапах формирования сосудистой мозговой недостаточности использование ультразвуковых и нейровизуализационных методов диагностики позволяет выявить характерные для хронической ишемии мозга особенности гемодинамики, а также субклинические очаговые церебральные повреждения. Снижение кровотока в лобных и теменных отделах головного мозга демонстрирует нарушения церебральной перфузии.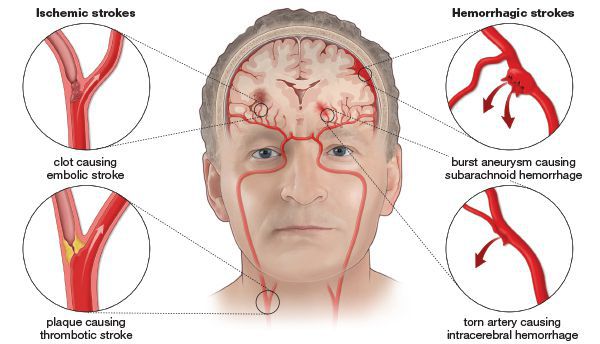 У пациентов при І стадии заболевания отмечается бόльшая степень выраженности структурных изменений сердечно-сосудистой системы, у больных часто наблюдается атеросклеротическое поражение экстракраниальных артерий. Кроме того, интракраниальные артерии также претерпевают структурную перестройку, о чем могут свидетельствовать данные транскраниальной допплерографии. Так, отмечается повышение индексов сопротивления в сочетании со снижением скоростных параметров кровотока и функциональной сосудистой гипореактивностью. В результате существенно ухудшается церебральная перфузия — не только в лобных и теменных сегментах, но и в полушариях мозга в целом. В условиях имеющихся циркуляторных нарушений прогрессируют изменения вещества мозга — у больных наблюдаются малые глубинные инфаркты, в ряде случаев визуализируется лейкоареоз. Также обязательным для диагностики хронической ишемии мозга является использование тестов, позволяющих определить степень нарушения когнитивных функций, например краткая шкала оценки психического статуса (Mini-mental State Examination), а также инструментальные методы МРТ или КТ головного мозга, ультразвуковая допплерография, дуплексное ультразвуковое сканирование.
У пациентов при І стадии заболевания отмечается бόльшая степень выраженности структурных изменений сердечно-сосудистой системы, у больных часто наблюдается атеросклеротическое поражение экстракраниальных артерий. Кроме того, интракраниальные артерии также претерпевают структурную перестройку, о чем могут свидетельствовать данные транскраниальной допплерографии. Так, отмечается повышение индексов сопротивления в сочетании со снижением скоростных параметров кровотока и функциональной сосудистой гипореактивностью. В результате существенно ухудшается церебральная перфузия — не только в лобных и теменных сегментах, но и в полушариях мозга в целом. В условиях имеющихся циркуляторных нарушений прогрессируют изменения вещества мозга — у больных наблюдаются малые глубинные инфаркты, в ряде случаев визуализируется лейкоареоз. Также обязательным для диагностики хронической ишемии мозга является использование тестов, позволяющих определить степень нарушения когнитивных функций, например краткая шкала оценки психического статуса (Mini-mental State Examination), а также инструментальные методы МРТ или КТ головного мозга, ультразвуковая допплерография, дуплексное ультразвуковое сканирование. Также показано детальное кардиологическое исследование с применением эхокардиографии, электрокардиографии, холтеровского мониторирования артериального давления и др. Кроме того, необходимо провести офтальмологическое исследование и исследование липидного профиля.
Также показано детальное кардиологическое исследование с применением эхокардиографии, электрокардиографии, холтеровского мониторирования артериального давления и др. Кроме того, необходимо провести офтальмологическое исследование и исследование липидного профиля.
При лечении хронической ишемии мозга врач должен работать сразу в нескольких направлениях. Во-первых, необходимо проводить медикаментозную терапию основного заболевания (артериальной гипертензии, атеросклероза), а во-вторых, улучшить перфузию головного мозга, назначить нейропротекторную терапию, которая позволит защитить нервную ткань от дальнейшего повреждения.
При лечении артериальной гипертензии на фоне хронической ишемии мозга предпочтение отдается антигипертензивным препаратам с нейропротекторным эффектом (для первичной и вторичной профилактики инсульта). Целевые показатели артериального давления у этих больных должны быть <140/90 мм рт. ст., но при этом должны быть не ниже 110/75. Снижение артериального давления необходимо проводить постепенно с учетом особенностей циркадного ритма больного.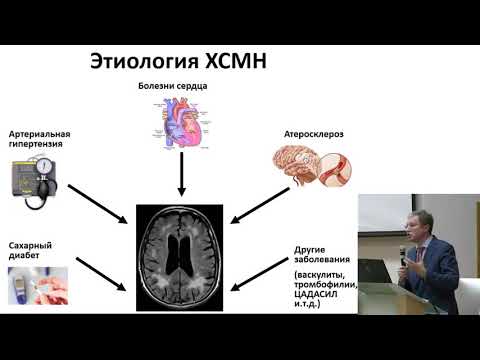
При терапии хронической ишемии мозга, возникшей на фоне артериальной гипертензии, кроме антигипертензивных препаратов, применяются вазоактивные, антиоксидантные лекарственные средства, антиагреганты, статины, и, конечно же, нейропротекторы.
В ходе доклада был проведен опрос, согласно результатам которого многие учасники мастер-класса называли в качестве препарата нейропротекторного действия Кортексин®, который на рынке Украины сопровождает компания «ZDRAVO». Действующим веществом данного препарата является комплекс полипептидов и аминокислот, оказывающих тканеспецифическое действие на клетки нервной системы. Препарат обладает широким спектром фармацевтического действия, что особенно эффективно при лечении пациентов с различными сопутствующими заболеваниями (черепно-мозговая травма, сахарный диабет, артериальная гипертензия, эпилепсия). Сейчас при обилии разнообразных лекарственных средств большим интересом со стороны врачей пользуются нейропротекторы, оказывающие не только ноотропное действие. К числу препаратов широкого спектра действия и относится Кортексин®, который, кроме ноотропного эффекта, также обладает церебропротекторным, нейротрофическим, антиоксидантным и корригирующим влиянием на биоэлектрическую активность головного мозга. Кортексин® способствует улучшению процессов обучения и памяти, поскольку позитивно влияет на когнитивные функции.
К числу препаратов широкого спектра действия и относится Кортексин®, который, кроме ноотропного эффекта, также обладает церебропротекторным, нейротрофическим, антиоксидантным и корригирующим влиянием на биоэлектрическую активность головного мозга. Кортексин® способствует улучшению процессов обучения и памяти, поскольку позитивно влияет на когнитивные функции.
Чем руководствуется врач при выборе того или иного препарата? Конечно же, наличием не только показаний к применению, а и противопоказаний, которые являются одним из важнейших аргументов при назначении комплексного лечения больных. Например, влияет ли прием препарата на показатели артериального давления, гликемический профиль, показан ли его прием при наличии в анамнезе черепно-мозговой травмы и т.д. Так, при применении препарата Кортексин® отсутствуют противопоказания и какие-либо побочные реакции. Кортексин® совместим со всеми группами лекарственных средств и его прием разрешен даже детям с первых дней жизни в терапии неврологических заболеваний любого генеза (травматического, инфекционного и т. д.), а также для коррекции расстройств нервной системы у детей школьного возраста. Показания к назначению Кортексина — это острая и хроническая ишемия мозга, черепно-мозговая травма, вирусные или бактериальные нейроинфекции, астенические состояния, энцефалопатии различного генеза (энцефалиты, эцефаломиелиты), эпилепсия, судорожный синдром, нарушение памяти и мышления, снижение способности к обучению.
д.), а также для коррекции расстройств нервной системы у детей школьного возраста. Показания к назначению Кортексина — это острая и хроническая ишемия мозга, черепно-мозговая травма, вирусные или бактериальные нейроинфекции, астенические состояния, энцефалопатии различного генеза (энцефалиты, эцефаломиелиты), эпилепсия, судорожный синдром, нарушение памяти и мышления, снижение способности к обучению.
Кортексин® используется только для внутримышечного введения, что позволяет достичь высокой эффективности лечения. Преимущество применения Кортексина заключается еще и в том, что в случаях, когда нельзя проводить частую инфузионную терапию (хроническая сердечная недостаточность, ишемическая болезнь сердца, поражения почек), и при этом требуется быстрый эффект, можно провести внутримышечные инъекции и достичь положительного результата. Еще одним преимуществом Кортексина является то, что его достаточно применять всего лишь 1 раз в сутки. Рекомендуется назначать препарат внутримышечно по 10 мг 1 раз в сутки на протяжении 10 дней. Такой продолжительности лечения зачастую достаточно для больных с хронической ишемией мозга.
Такой продолжительности лечения зачастую достаточно для больных с хронической ишемией мозга.
Однако, если у пациента острое нарушение мозгового кровообращения или острая травма головного мозга — есть необходимость увеличить длительность терапии Кортексином. В одной из длительных схем применения Кортексина рекомендуется после 10-дневного курса лечения на 11–15-й день назначать препарат по 10 мг через день, а на 16–20-й день — по 10 мг 1 раз в сутки через 3 дня.
Кроме того, Кортексин® снижает уровень пароксизмальной активности головного мозга и судорожной готовности, способен востанавливать биоэлектрическую активность у эпилептических больных. Ввиду отсутствия побочных реакций при применении Кортексина и наличия значительных побочных эффектов при применении противосудорожных препаратов в высоких дозах сложно переоценить значение данного нейропротектора для этих больных. В ходе мастер-класса также были продемонстрированы результаты клинических исследований применения Кортексина для терапии судорожных синдромов. Установлено, что применение Кортексина у лиц с черепно- мозговой травмой привело к уменьшению количества случаев посттравматической эпилепсии у пациентов на 80%. Также показано снижение частоты и степени выраженности эпилептического синдрома при приеме Кортексина.
Установлено, что применение Кортексина у лиц с черепно- мозговой травмой привело к уменьшению количества случаев посттравматической эпилепсии у пациентов на 80%. Также показано снижение частоты и степени выраженности эпилептического синдрома при приеме Кортексина.
Показания для применения препарата включают и критические состояния новорожденных, и перинатальные повреждения нервной системы, различные формы детского церебрального паралича, задержку психомоторного развития. Также показано, что Кортексин® уменьшает выраженность задержки психического развития у детей, которые принимают антиконвульсанты. При назначении Кортексина детям рекомендована следующая схема: детям, масса тела которых <20 кг, препарат назначают в дозе 0,5 мг/кг 1 раз в сутки в течение 10 дней, при массе тела >20 кг схема применения Кортексина — 10 мг 1 раз в сутки в течение 10 дней.
Следует отметить, что проблемы диагностики и лечения хронической ишемии мозга, которые были освещены на мастер-классе, а также предложенные схемы лечения с применением препаратов, в том числе и Кортексина, очень заинтересовали аудиторию и вызвали бурное обсуждение.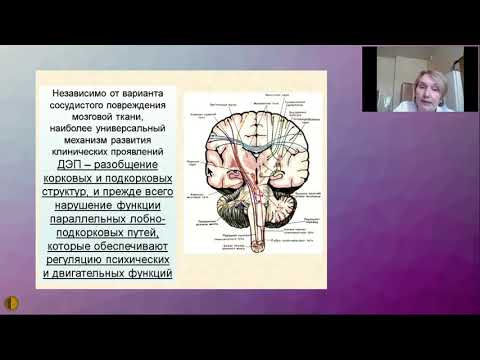
Евгения Лукьянчук,
фото Сергея Бека
Ишемия головного мозга – это распространенное заболевание, которое занимает лидирующие места среди причин смертности и инвалидизации во всем мире. Причинами возникновения патологического состояния является гипоксия участка ткани мозга, вследствие локального сужения мозгового кровотока. Патология запускает цепную реакцию негативных процессов в нейронах и в конечном итоге приводит к гибели нервных клеток.
Лечение ишемии головного мозга в клиниках Германии, Израиля, Австрии, США, Финляндии и Швейцарии направлено на купирование негативных проявлений заболевания, а также на устранение его симптоматики.
Лечение ишемии головного мозга за рубежом осуществляется стационарно. Первые несколько суток пациент пребывает в реанимационном отделении, что гарантирует предельно быструю реакцию при возникновении ухудшений или осложнений.
Программа лечения назначается для каждого пациента в индивидуальном порядке и представляет собой целый комплекс мер включающих прием самых современных медикаментозных препаратов.
Комфортные условия пребывания в стационаре и продуманная программа лечения позволяют с минимальными последствиями для пациента получить положительный результат и восстановить здоровье.
Пациенты рекомендуемых нами неврологических клиник для подтверждения и уточнения диагноза проходят все необходимые диагностические тесты, включая:
Компания «Пациент Менеджмент» является лидером в оказании услуг по медицинскому менеджменту.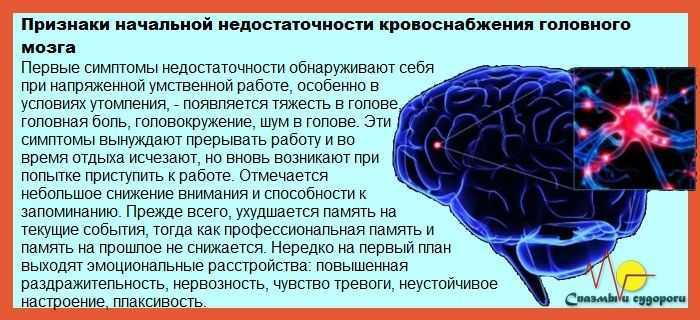 Одной из наших сильных сторон является тесное сотрудничество с известными медицинскими центрами, занимающимися, в том числе, лечением неврологических заболеваний.
Одной из наших сильных сторон является тесное сотрудничество с известными медицинскими центрами, занимающимися, в том числе, лечением неврологических заболеваний.
Мы организовываем лечение у опытных докторов, которые могут предложить своим иностранным пациентам высококвалифицированные услуги при адекватной стоимости лечения и великолепном сервисе. Очень важным плюсом сотрудничества с нашей компанией, является возможность сократить ожидание приема у необходимого специалиста до минимума.
Обращайтесь к нам в «Пациент Менеджмент», и организованное нами лечение ишемии головного мозга в лучших клиниках Германии, Израиля, Австрии, США, Финляндии или Швейцарии станет для Вас великолепным шансом на полное выздоровление!
Клиники
Врачи
Все страныАвстрияГерманияИзраильИспанияФранцияШвейцария
Любой городАахенАликантеБазельБерлинБоннБохумВенаВилье-Сюр-ОржВисбаденГамбургГанноверГаршГерцлияДюйсбургДюссельдорфЖеневаЖенольеЗолингенИерусалимЛасницхееЛозаннаМаннхаймМеербушМюнхенНойсОберхаузенПарижРамат-ГаннТель-АвивТирзееТюбингенФранкфурт на МайнеХайдельбергЦюрихШверинЭссен
Основные симптомы ишемии включают:
Другими состояниями, которые могут возникнуть в результате ишемии головного мозга, являются инсульт, кардиореспираторная остановка и необратимое повреждение головного мозга. Причины ишемии головного мозга могут варьироваться от серповидноклеточной анемии до врожденных пороков сердца.
Причины ишемии головного мозга могут варьироваться от серповидноклеточной анемии до врожденных пороков сердца.
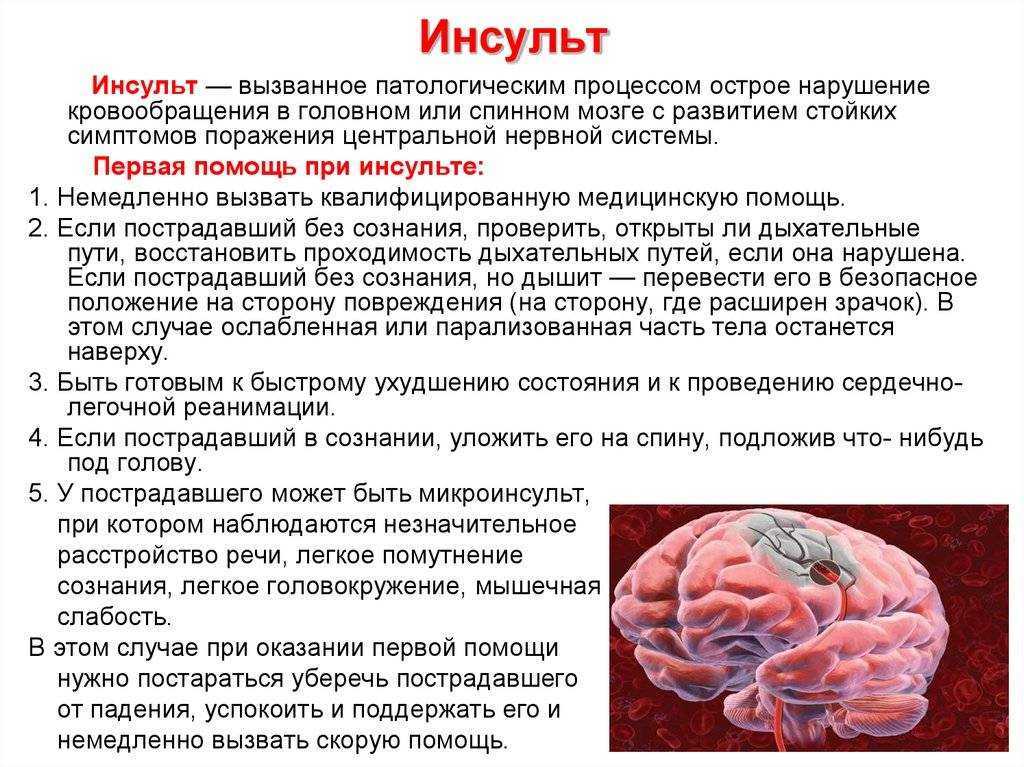
Термин «инсульт» можно разделить на три категории: ишемия головного мозга, субарахноидальное кровоизлияние и внутримозговое кровоизлияние. Ишемию головного мозга можно разделить на тромботическую, эмболическую и гипоперфузионную. Тромботические и эмболические поражения носят очаговый или многоочаговый характер, в то время как гипоперфузия поражает головной мозг в целом.
 Обычно это вызвано остановкой сердца. Если адекватное кровообращение восстанавливается в течение короткого периода времени, симптомы могут быть кратковременными. Однако, если до восстановления проходит большое количество времени, повреждение головного мозга может быть необратимым. Хотя реперфузия может быть необходима для защиты как можно большей ткани головного мозга, она также может привести к реперфузионному повреждению или повреждению, возникающему в результате восстановления кровоснабжения ишемизированной ткани.
Обычно это вызвано остановкой сердца. Если адекватное кровообращение восстанавливается в течение короткого периода времени, симптомы могут быть кратковременными. Однако, если до восстановления проходит большое количество времени, повреждение головного мозга может быть необратимым. Хотя реперфузия может быть необходима для защиты как можно большей ткани головного мозга, она также может привести к реперфузионному повреждению или повреждению, возникающему в результате восстановления кровоснабжения ишемизированной ткани. Симптомы церебральной ишемии включают:
Симптомы церебральной ишемии варьируются от легких до тяжелых. Симптомы могут длиться от нескольких секунд до нескольких минут или в течение длительного периода времени. Если мозг повреждается необратимо и происходит отмирание тканей, симптомы могут быть постоянными
Если мозг повреждается необратимо и происходит отмирание тканей, симптомы могут быть постоянными
Церебральная ишемия связана со многими заболеваниями или нарушениями. Пациенты со сдавленными сосудами, бляшками в артериях, тромбами, очень низким артериальным давлением в результате инфаркта, врожденными пороками сердца и даже серповидно-клеточной анемией имеют более высокую склонность к церебральной ишемии по сравнению со своими здоровыми сверстниками.
Серповидноклеточная анемия может вызвать церебральную ишемию, связанную с клетками крови неправильной формы. Серповидные клетки крови сгущаются легче, чем нормальные клетки крови, препятствуя притоку крови к мозгу.
Сдавление кровеносных сосудов может также привести к церебральной ишемии из-за закупорки артерий, доставляющих кислород в мозг. Опухоли могут быть причиной сдавления кровеносных сосудов.
Скопление бляшек в артериях также может привести к ишемии. Даже малейшее накопление зубного налета может привести к сужению проходов, в результате чего эта область становится более склонной к образованию тромбов. Большие сгустки крови также могут вызывать ишемию, блокируя кровоток.
Большие сгустки крови также могут вызывать ишемию, блокируя кровоток.
Сердечный приступ также может привести к церебральной ишемии из-за связи, которая существует между сердечным приступом и низким кровяным давлением. Чрезвычайно низкое артериальное давление обычно характеризует недостаточное насыщение тканей кислородом. Невылеченные сердечные приступы замедляют кровоток настолько, что кровь может начать свертываться и остановить приток крови к мозгу или другим основным органам. Церебральная ишемия может быть результатом событий, отличных от сердечных приступов.
Врожденные пороки сердца могут привести к церебральной ишемии из-за отсутствия правильного формирования и соединения артерий. Пациенты с врожденными пороками сердца также могут быть предрасположены к образованию тромбов.
Для лечения ишемии головного мозга врачи могут назначать лекарства от ишемического инсульта. Альтеплаза — лекарство, применяемое при остром ишемическом инсульте. Если это лекарство вводится в течение четырех с половиной часов, лечение tpa повышает вероятность многообещающего результата по сравнению с лечением плацебо. Системное артериальное давление должно поддерживаться для восстановления притока крови к головному мозгу. Также обычно назначают противосудорожные препараты, чтобы избежать судорог.
Системное артериальное давление должно поддерживаться для восстановления притока крови к головному мозгу. Также обычно назначают противосудорожные препараты, чтобы избежать судорог.
1. Pantoni L. Церебральная болезнь мелких сосудов: от патогенеза и клинических характеристик до терапевтических задач. Ланцет Нейрол 2010 г.; 9: 689–701. doi: 10.1016/S1474-4422(10)70104-6. [PubMed] [Google Scholar]
2. Wardlaw JM, Smith C, Dichgans M. Болезнь мелких сосудов: механизмы и клинические последствия. Ланцет Нейрол 2019; 18: 684–696. дои: 10.1016/S1474-4422(19)30079-1. [PubMed] [Google Scholar]
3. Liu Y, Dong YH, Lyu PY, Chen WH, Li R. Заболевание мелких сосудов головного мозга, вызванное артериальной гипертензией, приводящее к когнитивным нарушениям. Чин Мед J 2018; 131: 615–619. дои: 10.4103/0366-6999.226069. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Bos D, Wolters FJ, Darweesh SKL, Vernooij MW, de Wolf F, Ikram MA, et al. Заболевание мелких сосудов головного мозга и риск деменции: систематический обзор и метаанализ популяционных данных. Болезнь Альцгеймера 2018; 14:1482–1492. doi: 10.1016/j.jalz.2018.04.007. [PubMed] [Google Scholar]
Bos D, Wolters FJ, Darweesh SKL, Vernooij MW, de Wolf F, Ikram MA, et al. Заболевание мелких сосудов головного мозга и риск деменции: систематический обзор и метаанализ популяционных данных. Болезнь Альцгеймера 2018; 14:1482–1492. doi: 10.1016/j.jalz.2018.04.007. [PubMed] [Google Scholar]
5. Sweeney MD, Montagne A, Sagare AP, Nation DA, Schneider LS, Chui HC, et al. Сосудистая дисфункция — игнорируемый партнер болезни Альцгеймера. Болезнь Альцгеймера 2019; 15:158–167. doi: 10.1016/j.jalz.2018.07.222. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. де Лаат К.Ф., ван Норден А.Г., Гонс Р.А., ван Аудхеусден Л.Дж., ван Уден И.В., Блум Б.Р. и соавт. Походка у пожилых людей с поражением мелких сосудов головного мозга. Ход 2010 г.; 41:1652–1658. doi: 10.1161/STROKEAHA.110.583229. [PubMed] [Google Scholar]
7. Сайни М., Икрам К., Хилал С., Цю А., Венкетасубраманян Н., Чен С. Тихий ход: скорее не слушается, чем молчит. Ход 2012 г. ; 43:3102–3104. doi: 10.1161/strokeaha.112.666461. [PubMed] [Google Scholar]
; 43:3102–3104. doi: 10.1161/strokeaha.112.666461. [PubMed] [Google Scholar]
8. van Rooij FG, Vermeer SE, Goraj BM, Koudstaal PJ, Richard E, de Leeuw FE и соавт. Диффузионно-взвешенная визуализация при транзиторных неврологических приступах. Энн Нейрол 2015 г.; 78:1005–1010. doi: 10.1002/ana.24539. [PubMed] [Google Scholar]
9. Бинсвангер О. Die Abgrenzung der allgemeinen progresiven Paralyse. Берл Клин Вохеншр 1894 г.; 31:1103–1105. 1137-1139, 1180-1186. [Google Scholar]
10. Мари П. Des foyers lacunaires de désintégration et de différents autres états cavitaires du cerveau. Париж, Франция: Феликс Алькан; 1901. [Google Scholar]
11. Регенхардт Р.В., Дас А.С., Ло Э.Х., Каплан Л.Р. Успехи в понимании патофизиологии лакунарного инсульта: обзор. ДЖАМА Нейрол 2018; 75:1273–1281. doi: 10.1001/jamaneurol.2018.1073. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Brown R, Benveniste H, Black SE, Charpak S, Dichgans M, Joutel A, et al. Понимание роли периваскулярного пространства при поражении мелких сосудов головного мозга. Сердечно-сосудистые препараты 2018; 114: 1462–1473. дои: 10.1093/cvr/cvy113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Понимание роли периваскулярного пространства при поражении мелких сосудов головного мозга. Сердечно-сосудистые препараты 2018; 114: 1462–1473. дои: 10.1093/cvr/cvy113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Valdes Hernandez MC, Maconick LC, Munoz Maniega S, Wang X, Wiseman S, Armitage PA, et al. Сравнение локализации острых симптоматических и «тихих» поражений мелких сосудов. Int J Ход 2015 г.; 10:1044–1050. doi: 10.1111/ijs.12558. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Smith EE, Saposnik G, Biessels GJ, Doubal FN, Fornage M, Gorelick PB, et al. Профилактика инсульта у пациентов с бессимптомным цереброваскулярным заболеванием: научное заявление для медицинских работников Американской кардиологической ассоциации/Американской ассоциации инсульта. Ход 2017; 48:e44–e71. doi: 10.1161/STR.0000000000000116. [PubMed] [Академия Google]
15. Чой С.Х., На Д.Л., Чанг К.С., Ли К.Х., На Д.Г., Адэр Дж.К. Диффузионно-взвешенная МРТ при сосудистой деменции. Неврология 2000 г.; 54:83.doi: 10.1212/WNL.54.1.83. [PubMed] [Google Scholar]
Неврология 2000 г.; 54:83.doi: 10.1212/WNL.54.1.83. [PubMed] [Google Scholar]
16. Boone KB, Miller BL, Lesser IM, Mehringer CM, Hill-Gutierrez E, Goldberg MA, et al. Нейропсихологические корреляты поражений белого вещества у здоровых пожилых людей. Пороговый эффект. Арка Нейрол 1992 год; 49: 549–554. doi: 10.1001/archneur.1992.005302024. [PubMed] [Академия Google]
17. Banerjee G, Carare R, Cordonnier C, Greenberg SM, Schneider JA, Smith EE, et al. Растущее влияние церебральной амилоидной ангиопатии: важные новые идеи для клинической практики. J Нейрол Нейрохирург Психиатрия 2017; 88:982–994. doi: 10.1136/jnnp-2016-314697. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Oudeman EA, Greving JP, Van den Berg-Vos RM, Biessels GJ, Bron EE, van Oostenbrugge R, et al. Неочаговые транзиторные неврологические приступы связаны с поражением мелких сосудов головного мозга. Ход 2019; 50:3540–3544. doi: 10.1161/strokeaha. 119.025328. [PubMed] [Google Scholar]
119.025328. [PubMed] [Google Scholar]
19. Bos MJ, van Rijn MJ, Witteman JC, Hofman A, Koudstaal PJ, Breteler MM. Частота и прогноз транзиторных неврологических приступов. ЯМА 2007 г.; 298: 2877–2885. дои: 10.1001/jama.298.24.2877. [PubMed] [Google Scholar]
20. Fandler S, Gattringer T, Eppinger S, Doppelhofer K, Pinter D, Niederkorn K, et al. Частота и предикторы дисфагии у пациентов с недавними небольшими подкорковыми инфарктами. Ход 2017; 48:213–215. doi: 10.1161/STROKEAHA.116.015625. [PubMed] [Google Scholar]
21. Urban PP, Wicht S, Vukurevic G, Fitzek C, Fitzek S, Stoeter P, et al. Дизартрия при остром ишемическом инсульте: топография поражения, клинико-рентгенологическая корреляция и этиология. Неврология 2001 г.; 56:1021–1027. doi: 10.1212/wnl.56.8.1021. [PubMed] [Google Scholar]
22. Staekenborg SS, van der Flier WM, van Straaten EC, Lane R, Barkhof F, Scheltens P. Неврологические признаки в зависимости от типа цереброваскулярной патологии при сосудистой деменции. Ход 2008 г.; 39:317–322. doi: 10.1161/STROKEAHA.107.493353. [PubMed] [Google Scholar]
Ход 2008 г.; 39:317–322. doi: 10.1161/STROKEAHA.107.493353. [PubMed] [Google Scholar]
23. Aizenstein HJ, Baskys A, Boldrini M, Butters MA, Diniz BS, Jaiswal MK, et al. Консенсусный отчет о сосудистой депрессии - критическое обновление. БМС Мед 2016; 14:161.doi: 10.1186/s12916-016-0720-5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Gan R, Sacco RL, Kargman DE, Roberts JK, Boden-Albala B, Gu Q. Проверка достоверности лакунарной гипотезы: опыт изучения инсульта на севере Манхэттена. Неврология 1997 год; 48:1204–1211. дои: 10.1212/WNL.48.5.1204. [PubMed] [Google Scholar]
25. Мид Г.Э., Льюис С., Уордлоу Дж.М., Деннис М.С., Уорлоу С.П. Должны ли компьютерно-томографические признаки лакунарного инсульта влиять на тактику ведения пациентов? J Нейрол Нейрохирург Психиатрия 1999 г.; 67:682–684. doi: 10.1136/jnnp.67.5.682. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Makin SDJ, Doubal FN, Dennis MS, Wardlaw JM. Клинически подтвержденный инсульт с отрицательной диффузионно-взвешенной магнитно-резонансной томографией: продольное изучение клинических исходов, рецидивов инсульта и систематический обзор. Ход 2015 г.; 46:3142–3148. doi: 10.1161/STROKEAHA.115.010665. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клинически подтвержденный инсульт с отрицательной диффузионно-взвешенной магнитно-резонансной томографией: продольное изучение клинических исходов, рецидивов инсульта и систематический обзор. Ход 2015 г.; 46:3142–3148. doi: 10.1161/STROKEAHA.115.010665. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Potter G, Doubal F, Jackson C, Sudlow C, Dennis M, Wardlaw J. Ассоциации неправильной классификации клинического инсульта («клинико-визуализирующая диссоциация») при остром ишемическом инсульте. Цереброваскулярный дис 2010 г.; 29: 395–402. дои: 10.1159/000286342. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Ay H, Arsava EM, Rosand J, Furie KL, Singhal AB, Schaefer PW, et al. Тяжесть лейкоареоза и склонность к росту инфаркта при остром инсульте. Ход 2008 г.; 39:1409–1413. doi: 10.1161/STROKEAHA.107.501932. [PubMed] [Google Scholar]
29. Appleton JP, Woodhouse LJ, Adami A, Becker JL, Berge E, Cala LA, et al. Визуализирующие маркеры заболевания мелких сосудов и слабости головного мозга, а также исходы острого инсульта. Неврология 2020; 94:е439–е452. doi: 10.1212/WNL.0000000000008881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Неврология 2020; 94:е439–е452. doi: 10.1212/WNL.0000000000008881. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Георгакис М.К., Дюринг М., Уордлоу Дж.М., Дичганс М. WMH и отдаленные исходы при ишемическом инсульте: систематический обзор и метаанализ. Неврология 2019; 92:e1298–e1308. doi: 10.1212/WNL.0000000000007142. [PubMed] [Google Scholar]
31. Ahmad H, Cerchiai N, Mancuso M, Casani AP, Bronstein AM. Связаны ли аномалии белого вещества с «необъяснимым головокружением»? Дж Нейрол Наука 2015 г.; 358:428–431. doi: 10.1016/j.jns.2015.09.006. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Callisaya ML, Beare R, Phan T, Blizzard L, Thrift AG, Chen J, et al. Прогрессирование гиперинтенсивности белого вещества предположительно сосудистого генеза увеличивает риск падений у пожилых людей. J Gerontol A Biol Sci Med Sci 2015 г.; 70:360–366. doi: 10.1093/gerona/glu148. [PubMed] [Google Scholar]
33. van der Holst HM, van Uden IW, Tuladhar AM, de Laat KF, van Norden AG, Norris DG, et al. Церебральная болезнь мелких сосудов и случайный паркинсонизм: исследование RUN DMC. Неврология 2015 г.; 85: 1569–1577. doi: 10.1212/WNL.0000000000002082. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Церебральная болезнь мелких сосудов и случайный паркинсонизм: исследование RUN DMC. Неврология 2015 г.; 85: 1569–1577. doi: 10.1212/WNL.0000000000002082. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Poggesi A, Pracucci G, Chabriat H, Erkinjuntti T, Fazekas F, Verdelho A, et al. Мочевые жалобы у здоровых пожилых людей с возрастными изменениями белого вещества: исследование лейкоареоза и инвалидности (LADIS). J Am Geriatr Soc 2008 г.; 56:1638–1643. doi: 10.1111/j.1532-5415.2008.01832.x. [PubMed] [Google Scholar]
35. Сакакибара Р., Хаттори Т., Утияма Т., Яманиши Т. Функция мочеиспускания у пожилых людей с лейкоареозом и без него: связь с когнитивной функцией и функцией походки. J Нейрол Нейрохирург Психиатрия 1999 г.; 67: 658–660. doi: 10.1136/jnnp.67.5.658. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Kuchel GA, Moscufo N, Guttmann CR, Zeevi N, Wakefield D, Schmidt J, et al. Локализация гиперинтенсивности белого вещества головного мозга и недержания мочи у пожилых людей, проживающих по месту жительства.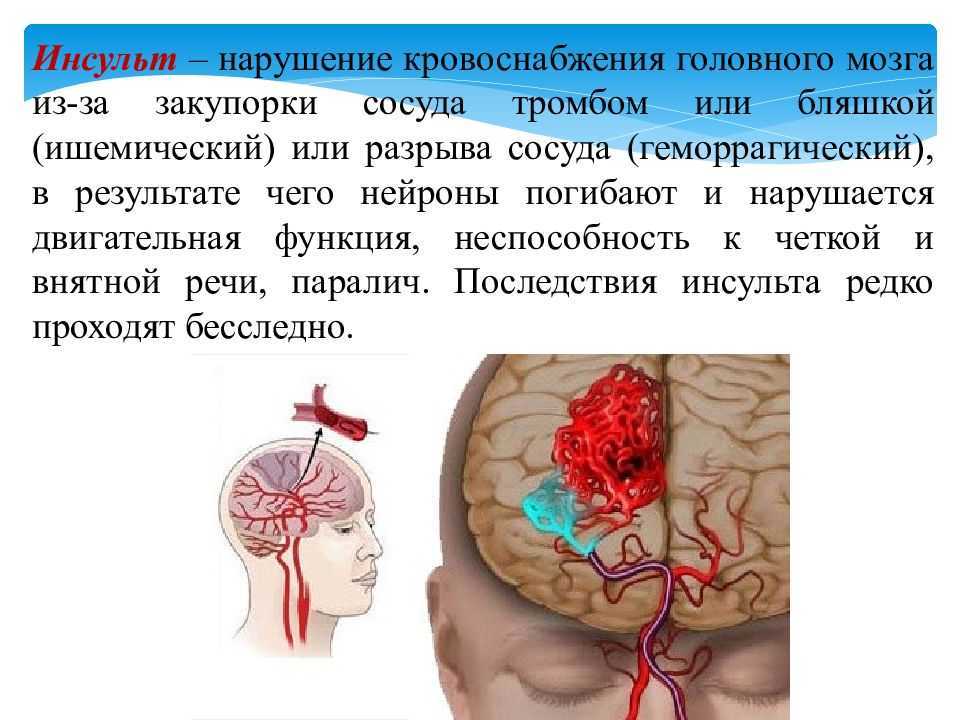 J Gerontol A Biol Sci Med Sci 2009 г.; 64:902–909. doi: 10.1093/gerona/glp037. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Gerontol A Biol Sci Med Sci 2009 г.; 64:902–909. doi: 10.1093/gerona/glp037. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Itoh Y, Yamada S, Konoeda F, Koizumi K, Nagata H, Oya M, et al. Бремя симптома гиперактивного мочевого пузыря на качество жизни пациентов с инсультом. Нейроурол Уродин 2013; 32:428–434. doi: 10.1002/nau.22336. [PubMed] [Google Scholar]
38. Кларксон Б.Д., Гриффитс Д., Резник Н.М. Различают ли структурные аномалии головного мозга отдельные формы ургентного недержания мочи? Нейроурол Уродын 2018; 37:2597–2605. doi: 10.1002/nau.23591. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Ogama N, Yoshida M, Nakai T, Niida S, Toba K, Sakurai T. Гиперинтенсивность лобного белого вещества предсказывает дисфункцию нижних мочевыводящих путей у пожилых людей с амнестически легкими когнитивными нарушениями и болезнью Альцгеймера. Geriatr Gerontol Int 2016; 16:167–174. doi: 10.1111/ggi.12447. [PubMed] [Google Scholar]
40. Tadic SD, Griffiths D, Murrin A, Schaefer W, Aizenstein HJ, Resnick NM. Мозговая активность во время наполнения мочевого пузыря связана со структурными изменениями белого вещества у пожилых женщин с недержанием мочи. НейроИзображение 2010 г.; 51:1294–1302. doi: 10.1016/j.neuroimage.2010.03.016. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Tadic SD, Griffiths D, Murrin A, Schaefer W, Aizenstein HJ, Resnick NM. Мозговая активность во время наполнения мочевого пузыря связана со структурными изменениями белого вещества у пожилых женщин с недержанием мочи. НейроИзображение 2010 г.; 51:1294–1302. doi: 10.1016/j.neuroimage.2010.03.016. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Wakefield DB, Moscufo N, Guttmann CR, Kuchel GA, Kaplan RF, Pearlson G, et al. Гиперинтенсивность белого вещества предсказывает функциональное снижение мочеиспускания, подвижности и когнитивных функций у пожилых людей. J Am Geriatr Soc 2010 г.; 58:275–281. doi: 10.1111/j.1532-5415.2009.02699.x. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Wehrberger C, Jungwirth S, Fischer P, Tragl KH, Krampla W, Marlies W, et al. Взаимосвязь между гиперинтенсивностью белого вещества головного мозга и функцией нижних мочевыводящих путей в популяционной гериатрической когорте. Нейроурол Уродын 2014; 33:431–436. doi: 10.1002/nau.22419. [PubMed] [Google Scholar]
doi: 10.1002/nau.22419. [PubMed] [Google Scholar]
43. Yee CH, Leung C, Wong YY, Lee S, Li J, Kwan P, et al. Симптомы нижних мочевыводящих путей у субъектов с субклиническими поражениями белого вещества головного мозга. J Сопротивление старению 2018; 2018:1582092.doi: 10.1155/2018/1582092. [Бесплатная статья PMC] [PubMed] [Google Scholar]
44. Американская психиатрическая ассоциация. Диагностическое и статистическое руководство по психическим расстройствам. Вашингтон, округ Колумбия: Американское психиатрическое издательство; 2013. [Google Академия]
45. Hamilton O K L, Backhouse E V, Janssen E, Jochems A C C, Maher C, Stevenson A J, et al. Когнитивные нарушения при спорадической церебральной болезни мелких сосудов (ЗМС): систематический обзор и метаанализ когорт с инсультом, деменцией и неклиническими проявлениями ЗМС. medRxiv 2002 г.; 2010. 20020628.20202020. дои: 10.1101/2020.02.10.20020628. [Google Scholar]
46. Sigurdsson S, Aspelund T, Kjartansson O, Gudmundsson EF, Jonsdottir MK, Eiriksdottir G, et al. Частота инфарктов головного мозга, когнитивные изменения и риск развития деменции среди населения в целом: исследование AGES-Рейкьявик (исследование возрастных генов/восприимчивости окружающей среды-Рейкьявик). Ход 2017; 48:2353–2360. doi: 10.1161/strokeaha.117.017357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Частота инфарктов головного мозга, когнитивные изменения и риск развития деменции среди населения в целом: исследование AGES-Рейкьявик (исследование возрастных генов/восприимчивости окружающей среды-Рейкьявик). Ход 2017; 48:2353–2360. doi: 10.1161/strokeaha.117.017357. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Роман Г.К., Эркинджунти Т., Валлин А., Пантони Л., Чуй Х.К. Подкорковая ишемическая сосудистая деменция. Ланцет Нейрол 2002 г.; 1: 426–436. doi: 10.1016/S1474-4422(02)00190-4. [PubMed] [Google Scholar]
48. Каммингс Дж.Л. Сосудистые подкорковые деменции: клинические аспекты. Деменция 1994 год; 5: 177–180. дои: 10.1159/000106718. [PubMed] [Академия Google]
49. Sachdev P, Kalaria R, O'Brien J, Skoog I, Alladi S, Black SE, et al. Диагностические критерии сосудистых когнитивных расстройств: заключение VASCOG. Ассоциированная болезнь Альцгеймера Расстройство 2014; 28:206–218. doi: 10.1097/WAD.0000000000000034. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Debette S, Schilling S, Duperron MG, Larsson SC, Markus HS. Клиническое значение маркеров магнитно-резонансной томографии сосудистого поражения головного мозга: систематический обзор и метаанализ. ДЖАМА Нейрол 2019; 76:81–94. doi: 10.1001/jamaneurol.2018.3122. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Chang KJ, Lee S, Lee Y, Lee KS, Back JH, Jung YK, et al. Тяжесть гиперинтенсивности белого вещества и продолжительность пребывания в больнице у пациентов с когнитивными нарушениями: исследование CREDOS (Центр клинических исследований деменции Южной Кореи). Дж Болезнь Альцгеймера 2015 г.; 46:719–726. дои: 10.3233/jad-142823. [PubMed] [Google Scholar]
52. Sibolt G, Curtze S, Melkas S, Pohjasvaara T, Kaste M, Karhunen PJ, et al. Тяжелые поражения белого вещества головного мозга у пациентов с ишемическим инсультом связаны с меньшим временем пребывания дома и ранней госпитализацией. Int J Ход 2015 г.; 10:1192–1196. doi: 10.1111/ijs.12578. [PubMed] [Google Scholar]
Int J Ход 2015 г.; 10:1192–1196. doi: 10.1111/ijs.12578. [PubMed] [Google Scholar]
53. Fanning JP, Wong AA, Fraser JF. Эпидемиология бессимптомного инфаркта мозга: систематический обзор популяционных когорт. БМС Мед 2014; 12:119.doi: 10.1186/s12916-014-0119-0. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Ling Y, Chabriat H. Случайные церебральные лакуны: обзор. J Мозговой кровоток Metab 2020; 40:909–921. дои: 10.1177/0271678X20908361. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Гьянвали Б., Шайк М.А., Тан Б.И., Венкетасубраманян Н., Чен С., Хилал С. Факторы риска и клиническая значимость возникновения и прогрессирования маркеров церебральной болезни мелких сосудов в азиатской популяции клиник памяти. Дж Болезнь Альцгеймера 2019; 67:1209–1219. дои: 10.3233/JAD-180911. [PubMed] [Google Scholar]
56. Биффи А., Гринберг С.М. Церебральная амилоидная ангиопатия: систематический обзор. Дж Клин Нейрол 2011 г. ; 7: 1–9. doi: 10.3988/jcn.2011.7.1.1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
; 7: 1–9. doi: 10.3988/jcn.2011.7.1.1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Hilal S, Mok V, Youn YC, Wong A, Ikram MK, Chen CL. Распространенность, факторы риска и последствия заболеваний мелких сосудов головного мозга: данные трех азиатских стран. J Нейрол Нейрохирург Психиатрия 2017; 88:669–674. doi: 10.1136/jnnp-2016-315324. [PubMed] [Google Scholar]
58. Ван Мидделаар Т., Аргилландер Т.Е., Флорис Х.Б.М., Дейнум Дж., Ричард Э., Клейн К.Дж.М. Влияние антигипертензивных препаратов на заболевание мелких сосудов головного мозга: систематический обзор и метаанализ. Ход 2018; 49: 1531–1533. doi: 10.1161/strokeaha.118.021160. [PubMed] [Google Scholar]
59. Chokesuwattanaskul A, Cheungpasitporn W, Thongprayoon C, Vallabhajosyula S, Bathini T, Mao MA, et al. Влияние циркадного паттерна артериального давления на тихую церебральную болезнь мелких сосудов: систематический обзор и метаанализ. Ассоциация J Am Heart 2020; 9:e016299. doi: 10.1161/JAHA.119.016299. [Бесплатная статья PMC] [PubMed] [Google Scholar]
doi: 10.1161/JAHA.119.016299. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Cordonnier C, Al-Shahi Salman R, Wardlaw J. Спонтанные микрокровоизлияния в мозг: систематический обзор, анализ подгрупп и стандарты дизайна исследования и отчетности. Мозг 2007 г.; 130:1988–2003. doi: 10.1093/brain/awl387. [PubMed] [Google Scholar]
61. Vinters HV, Zarow C, Borys E, Whitman JD, Tung S, Ellis WG, et al. Обзор: Сосудистая деменция: клинико-патологические и генетические аспекты. Приложение Нейропатол Нейробиол 2018; 44:247–266. doi: 10.1111/нан.12472. [PubMed] [Google Scholar]
62. Janghorbani M, Hu FB, Willett WC, Li TY, Manson JE, Logroscino G, et al. Проспективное исследование диабета 1 и 2 типа и риска подтипов инсульта: исследование здоровья медсестер. Лечение диабета 2007 г.; 30: 1730–1735. дои: 10.2337/dc06-2363. [PubMed] [Google Scholar]
63. Geijselaers SL, Sep SJ, Stehouwer CD, Biessels GJ. Регуляция уровня глюкозы, познание и МРТ головного мозга при диабете 2 типа: систематический обзор. Ланцет диабетический эндокринол 2015 г.; 3: 75–89. doi: 10.1016/S2213-8587(14)70148-2. [PubMed] [Google Scholar]
Ланцет диабетический эндокринол 2015 г.; 3: 75–89. doi: 10.1016/S2213-8587(14)70148-2. [PubMed] [Google Scholar]
64. Rensma SP, van Sloten TT, Ding J, Sigurdsson S, Stehouwer CD, Gudnason V, et al. Диабет 2 типа, изменение депрессивных симптомов с течением времени и церебральная болезнь мелких сосудов: продольные данные исследования AGES-Reykjavik. Лечение диабета 2020; 43: 1781–1787. дои: 10.2337/dc19-2437. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Дирборн Дж.Л., Шнайдер А.Л., Шарретт А.Р., Мосли Т.Х., Безерра Д.К., Кнопман Д.С. и соавт. Ожирение, резистентность к инсулину и возникающее заболевание мелких сосудов при магнитно-резонансной томографии: исследование риска атеросклероза в сообществах. Ход 2015 г.; 46:3131–3136. doi: 10.1161/STROKEAHA.115.010060. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Romero JR, Preis SR, Beiser A, DeCarli C, Viswanathan A, Martinez-Ramirez S, et al. Факторы риска, методы профилактики инсульта и распространенность церебральных микрокровоизлияний в Framingham Heart Study. Ход 2014; 45:1492–1494. doi: 10.1161/STROKEAHA.114.004130. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ход 2014; 45:1492–1494. doi: 10.1161/STROKEAHA.114.004130. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Dickie DA, Ritchie SJ, Cox SR, Sakka E, Royle NA, Aribisala BS, et al. Сосудистые факторы риска и прогрессирование гиперинтенсивности белого вещества в когорте новорожденных Лотиана. Нейробиол Старение 2016; 42:116–123. doi: 10.1016/j.neurobiolaging.2016.03.011. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68. Hankey GJ. Роль питания в риске и бремени инсульта: обновление данных. Ход 2017; 48:3168–3174. doi: 10.1161/strokeaha.117.016993. [PubMed] [Google Scholar]
69. Heye AK, Thrippleton MJ, Chappell FM, Valdes Hernandez MC, Armitage PA, Makin SD, et al. Артериальное давление и натрий: связь с маркерами МРТ при церебральном заболевании мелких сосудов. J Мозговой кровоток Metab 2016; 36: 264–274. doi: 10.1038/jcbfm.2015.64. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Staals J, Makin SDJ, Doubal F, Dennis M, Wardlaw JM. Подтип инсульта, сосудистые факторы риска и общее бремя МРТ заболеваний мелких сосудов головного мозга. Неврология 2014; 83:1228–1234. doi: 10.1212/WNL.00000000000000837. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Подтип инсульта, сосудистые факторы риска и общее бремя МРТ заболеваний мелких сосудов головного мозга. Неврология 2014; 83:1228–1234. doi: 10.1212/WNL.00000000000000837. [Бесплатная статья PMC] [PubMed] [Google Scholar]
71. Chabriat H, Joutel A, Dichgans M, Tournier-Lasserve E, Bousser MG. Кадасил. Ланцет Нейрол 2009 г.; 8: 643–653. doi: 10.1016/S1474-4422(09)70127-9. [PubMed] [Google Scholar]
72. Makin SD, Doubal FN, Shuler K, Chappell FM, Staals J, Dennis MS, et al. Влияние коэффициента интеллекта в раннем возрасте на когнитивные нарушения после инсульта. Евро Ход J 2018; 3: 145–156. дои: 10.1177/2396987317750517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Kivipelto M, Mangialasche F, Ngandu T. Вмешательства в образ жизни для предотвращения когнитивных нарушений, деменции и болезни Альцгеймера. Нат Рев Нейрол 2018; 14: 653–666. doi: 10.1038/s41582-018-0070-3. [PubMed] [Google Scholar]
74. Aribisala BS, Riha RL, Valdes Hernandez M, Munoz Maniega S, Cox S, Radakovic R, et al. Морфологические изменения сна и головного мозга на восьмом десятилетии жизни. Сон Мед 2020; 65:152–158. doi: 10.1016/j.sleep.2019.07.015. [PubMed] [Google Scholar]
Морфологические изменения сна и головного мозга на восьмом десятилетии жизни. Сон Мед 2020; 65:152–158. doi: 10.1016/j.sleep.2019.07.015. [PubMed] [Google Scholar]
75. Huang Y, Yang C, Yuan R, Liu M, Hao Z. Ассоциация обструктивного апноэ сна и церебральной болезни мелких сосудов: систематический обзор и метаанализ. Сон 2020; 43:1–10. дои: 10.1093/сон/zsz264. [PubMed] [Google Scholar]
76. Chauhan G, Adams HHH, Satizabal CL, Bis JC, Teumer A, Sargurupremraj M, et al. Генетические факторы и факторы риска образа жизни для инфарктов мозга, определяемых МРТ, в популяционных условиях. Неврология 2019; 92:е486–е503. doi: 10.1212/WNL.0000000000006851. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Backhouse EV, McHutchison CA, Cvoro V, Shenkin SD, Wardlaw JM. Когнитивные способности, образование и социально-экономический статус в детстве и риск постинсультной депрессии в более позднем возрасте: систематический обзор и метаанализ. PLoS Один 2018; 13:e0200525.doi: 10.1371/journal.pone.0200525. [Бесплатная статья PMC] [PubMed] [Google Scholar]
PLoS Один 2018; 13:e0200525.doi: 10.1371/journal.pone.0200525. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Wardlaw JM, Smith EE, Biessels GJ, Cordonnier C, Fazekas F, Frayne R, et al. Стандарты нейровизуализации для исследования заболеваний мелких сосудов и их вклада в старение и нейродегенерацию. Ланцет Нейрол 2013; 12:822–838. doi: 10.1016/S1474-4422(13)70124-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Duperron MG, Tzourio C, Sargurupremraj M, Mazoyer B, Soumare A, Schilling S, et al. Бремя расширенных периваскулярных пространств, появляющийся маркер церебральной болезни мелких сосудов, в высокой степени передается по наследству. Ход 2018; 49:282–287. doi: 10.1161/STROKEAHA.117.019309. [PubMed] [Google Scholar]
80. Beaudet G, Tsuchida A, Petit L, Tzourio C, Caspers S, Schreiber J, et al. Возрастные изменения скелетонизированной средней диффузии ширины пика (PSMD) на протяжении взрослой жизни: многогрупповое исследование. Фронтовая психиатрия 2020; 11:342.doi: 10.3389/fpsyt.2020.00342. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Фронтовая психиатрия 2020; 11:342.doi: 10.3389/fpsyt.2020.00342. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Wardlaw JM, Chappell FM, Valdes Hernandez MDC, Makin SDJ, Staals J, Shuler K, et al. Снижение гиперинтенсивности белого вещества и исходы после малого инсульта. Неврология 2017; 89:1003–1010. doi: 10.1212/WNL.0000000000004328. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82. van Leijsen EMC, van Uden IWM, Ghafoorian M, Bergkamp MI, Lohner V, Kooijmans ECM, et al. Нелинейная временная динамика заболевания мелких сосудов головного мозга: исследование RUN DMC. Неврология 2017; 89: 1569–1577. doi: 10.1212/WNL.0000000000004490. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. De Guio F, Duering M, Fazekas F, De Leeuw FE, Greenberg SM, Pantoni L, et al. Атрофия головного мозга при церебральных заболеваниях мелких сосудов: степень, последствия, технические ограничения и перспективы: инициатива HARNESS. J Мозговой кровоток Metab 2020; 40:231–245. дои: 10.1177/0271678X19888967. [Бесплатная статья PMC] [PubMed] [Google Scholar]
дои: 10.1177/0271678X19888967. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Bath PM, Wardlaw JM. Фармакологическое лечение и профилактика заболеваний мелких сосудов головного мозга: обзор возможных вмешательств. Int J Ход 2015 г.; 10: 469–478. doi: 10.1111/ijs.12466. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Smith EE, Markus HS. Новые подходы к лечению, направленные на изменение течения заболеваний мелких сосудов головного мозга. Ход 2020; 51:38–46. doi: 10.1161/STROKEAHA.119.024150. [PubMed] [Google Scholar]
86. Dao E, Barha CK, Best JR, Hsiung GY, Tam R, Liu-Ambrose T. Влияние аэробных упражнений на прогрессирование гиперинтенсивности белого вещества может различаться в зависимости от пола. Банка J Старение 2019; 38:236–244. doi: 10.1017/s0714980818000582. [PubMed] [Google Scholar]
87. Venkatraman VK, Sanderson A, Cox KL, Ellis KA, Steward C, Phal PM, et al. Влияние 24-месячной программы физической активности на изменения головного мозга у пожилых людей с риском развития болезни Альцгеймера: активное исследование AIBL. Нейробиол Старение 2020; 89:132–141. doi: 10.1016/j.neurobiolaging.2019.02.030. [PubMed] [Google Scholar]
Нейробиол Старение 2020; 89:132–141. doi: 10.1016/j.neurobiolaging.2019.02.030. [PubMed] [Google Scholar]
88. Liu-Ambrose T, Best JR, Davis JC, Eng JJ, Lee PE, Jacova C, et al. Аэробные упражнения и сосудистые когнитивные нарушения: рандомизированное контролируемое исследование. Неврология 2016; 87:2082–2090. doi: 10.1212/WNL.0000000000003332. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. Bolandzadeh N, Tam R, Handy TC, Nagamatsu LS, Hsu CL, Davis JC, et al. Тренировки с отягощениями и прогрессирование поражения белого вещества у пожилых женщин: исследовательский анализ 12-месячного рандомизированного контролируемого исследования. J Am Geriatr Soc 2015 г.; 63:2052–2060. doi: 10.1111/jgs.13644. [PubMed] [Google Scholar]
90. Karama S, Ducharme S, Corley J, Chouinard-Decorte F, Starr J, Wardlaw JM, et al. Курение сигарет и истончение коры головного мозга. Мол Психиатрия 2015 г.; 20:778–785. doi: 10.1038/mp.2014.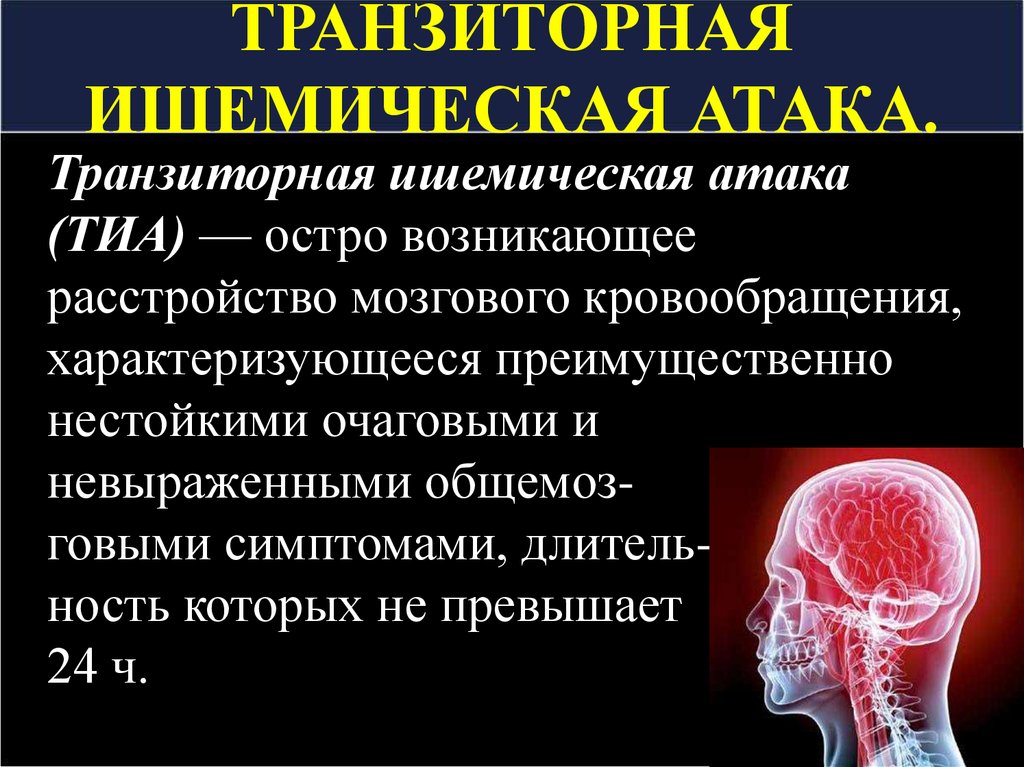 187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
187. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Gardener H, Rundek T, Wright CB, Elkind MS, Sacco RL. Диетический натрий и риск инсульта в Северном Манхэттенском исследовании. Ход 2012 г.; 43:1200–1205. doi: 10.1161/STROKEAHA.111.641043. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Ngandu T, Lehtisalo J, Solomon A, Levalahti E, Ahtiluoto S, Antikainen R, et al. Двухлетнее мультидоменное вмешательство, состоящее из диеты, физических упражнений, когнитивных тренировок и мониторинга сосудистых рисков по сравнению с контрольной группой для предотвращения снижения когнитивных функций у пожилых людей из группы риска (FINGER): рандомизированное контролируемое исследование. Ланцет 2015 г.; 385: 2255–2263. doi: 10.1016/S0140-6736(15)60461-5. [PubMed] [Google Scholar]
93. Kwok CS, Shoamanesh A, Copley HC, Myint PK, Loke YK, Benavente OR. Эффективность антитромбоцитарной терапии при вторичной профилактике после лакунарного инсульта: объединенный анализ рандомизированных исследований. Ход 2015 г.; 46:1014–1023. doi: 10.1161/STROKEAHA.114.008422. [PubMed] [Google Scholar]
Ход 2015 г.; 46:1014–1023. doi: 10.1161/STROKEAHA.114.008422. [PubMed] [Google Scholar]
94. Следователи Т.С., Бенавенте О.Р., Харт Р.Г. др. е. Эффекты клопидогреля в сочетании с аспирином у пациентов с недавним лакунарным инсультом. N Английский J Med 2012 г.; 367: 817–825. дои: 10.1056/NEJMoa1204133. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Qiu J, Ye H, Wang J, Yan J, Wang J, Wang Y. Антитромбоцитарная терапия, церебральные микрокровоизлияния и внутримозговое кровоизлияние: метаанализ. Ход 2018; 49: 1751–1754. doi: 10.1161/STROKEAHA.118.021789. [PubMed] [Google Scholar]
96. Cheng Y, Wang Y, Song Q, Qiu K, Liu M. Использование антикоагулянтной терапии и церебральные микрокровоизлияния: систематический обзор и метаанализ. Дж Нейрол 2019; 15:1–14. doi: 10.1007/s00415-019-09572-x. [PubMed] [Google Scholar]
97. Al-Shahi Salman R, Minks DP, Mitra D, Rodrigues MA, Bhatnagar P, du Plessis JC, et al. Влияние антитромбоцитарной терапии на риск инсульта по признакам внутримозгового кровоизлияния и заболеваний мелких сосудов головного мозга: анализ подгрупп рандомизированного открытого исследования RESTART. Ланцет Нейрол 2019; 18: 643–652. doi: 10.1016/S1474-4422(19)30184-X. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ланцет Нейрол 2019; 18: 643–652. doi: 10.1016/S1474-4422(19)30184-X. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Benavente OR, Coffey CS, Conwit R, Hart RG, McClure LA, Pearce LA, et al. Целевые уровни артериального давления у пациентов с недавним лакунарным инсультом: рандомизированное исследование SPS3. Ланцет 2013; 382: 507–515. doi: 10.1016/S0140-6736(13)60852-1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
99. Pearce LA, McClure LA, Anderson DC, Jacova C, Sharma M, Hart RG, et al. Влияние длительного снижения артериального давления и двойного антитромбоцитарного лечения на когнитивную функцию у пациентов с недавним лакунарным инсультом: вторичный анализ рандомизированного исследования SPS3. Ланцет Нейрол 2014; 13:1177–1185. doi: 10.1016/S1474-4422(14)70224-8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
100. SPRINT MIND Исследователи исследовательской группы SPRINT, Nasrallah IM, Pajewski NM, Auchus AP, Chelune G, Cheung AK, et al. Ассоциация интенсивного и стандартного контроля артериального давления с поражением белого вещества головного мозга. ЯМА 2019; 322: 524–534. дои: 10.1001/jama.2019.10551. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ассоциация интенсивного и стандартного контроля артериального давления с поражением белого вещества головного мозга. ЯМА 2019; 322: 524–534. дои: 10.1001/jama.2019.10551. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Croall ID, Lohner V, Moynihan B, Khan U, Hassan A, O'Brien JT, et al. Использование DTI для оценки микроструктуры белого вещества при церебральной болезни мелких сосудов (SVD) в многоцентровых исследованиях. Clin Sci (Лондон) 2017; 131: 1361–1373. DOI: 10.1042/CS20170146. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Croall ID, Tozer DJ, Moynihan B, Khan U, O'Brien JT, Morris RG, et al. Влияние стандартного и интенсивного контроля артериального давления на мозговой кровоток при заболевании мелких сосудов: рандомизированное клиническое исследование PRESERVE. JAMA Нейрол 2018; 75:720–727. doi: 10.1001/jamaneurol.2017.5153. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Collins R, Armitage J, Parish S, Sleight P, Peto R. Влияние снижения уровня холестерина с помощью симвастатина на инсульт и другие серьезные сосудистые события у 20 536 человек с цереброваскулярными заболеваниями или другими состояниями высокого риска. Ланцет 2004 г.; 363: 757–767. doi: 10.1016/s0140-6736(04)15690-0. [PubMed] [Google Scholar]
Влияние снижения уровня холестерина с помощью симвастатина на инсульт и другие серьезные сосудистые события у 20 536 человек с цереброваскулярными заболеваниями или другими состояниями высокого риска. Ланцет 2004 г.; 363: 757–767. doi: 10.1016/s0140-6736(04)15690-0. [PubMed] [Google Scholar]
104. Mok VC, Lam WW, Fan YH, Wong A, Ng PW, Tsoi TH, et al. Влияние статинов на прогрессирование поражения белого вещества головного мозга: апостериорный анализ исследования ROCAS (регресс стеноза церебральной артерии). Дж Нейрол 2009 г.; 256: 750–757. doi: 10.1007/s00415-009-5008-7. [PubMed] [Google Scholar]
105. тен Дам В.Х., ван ден Хеувел Д.М., ван Бухем М.А., Вестендорп Р.Г., Боллен Э.Л., Форд И. и др. Влияние правастатина на инфаркты головного мозга и поражения белого вещества. Неврология 2005 г.; 64: 1807–1809. doi: 10.1212/01.WNL.0000161844.00797.73. [PubMed] [Google Scholar]
106. Xiong Y, Wong A, Cavalieri M, Schmidt R, Chu WW, Liu X, et al. Статины перед инсультом, прогрессирование гиперинтенсивности белого вещества и снижение когнитивных функций у пациентов, перенесших инсульт, со сливной гиперинтенсивностью белого вещества. Нейротерапия 2014; 11: 606–611. doi: 10.1007/s13311-014-0270-5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Статины перед инсультом, прогрессирование гиперинтенсивности белого вещества и снижение когнитивных функций у пациентов, перенесших инсульт, со сливной гиперинтенсивностью белого вещества. Нейротерапия 2014; 11: 606–611. doi: 10.1007/s13311-014-0270-5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
107. McHutchison C, Blair GW, Appleton JP, Chappell FM, Doubal F, Bath PM, et al. Цилостазол для вторичной профилактики инсульта и снижения когнитивных функций: систематический обзор и метаанализ. Ход 2020; 51:2374–2385. doi: 10.1161/STROKEAHA.120.029454. [Бесплатная статья PMC] [PubMed] [Google Scholar]
108. Blair GW, Appleton JP, Flaherty K, Doubal F, Sprigg N, Dooley R, et al. Переносимость, безопасность и промежуточные фармакологические эффекты цилостазола и изосорбида мононитрата, отдельно и в комбинации, у пациентов с лакунарным ишемическим инсультом: исследование LACunar Intervention-1 (LACI-1), рандомизированное клиническое исследование. EClinicalMedicine 2019; 11:34–43. doi: 10.1016/j.eclinm.2019.04.001. [Бесплатная статья PMC] [PubMed] [Google Scholar]
doi: 10.1016/j.eclinm.2019.04.001. [Бесплатная статья PMC] [PubMed] [Google Scholar]
109. Wardlaw JM, Bath PMW, Doubal F, Heye A, Sprigg N, Woodhouse LJ, et al. Протокол: Лакунарное вмешательство, испытание 2 (LACI-2). Испытание двух перепрофилированных лицензированных препаратов для предотвращения прогрессирования церебральной болезни мелких сосудов. Евро Ход J 2020; дои: 10.1177/2396987320920110. [Бесплатная статья PMC] [PubMed] [Google Scholar]
110. Исследователи ENOS Trial Investigators. Эффективность оксида азота с продолжением антигипертензивного лечения или без него для лечения высокого кровяного давления при остром инсульте (ENOS): частично-факторное рандомизированное контролируемое исследование. Ланцет 2015 г.; 385: 617–628. doi: 10.1016/S0140-6736(14)61121-1. [Бесплатная статья PMC] [PubMed] [Google Scholar]
111. Woodhouse L, Scutt P, Krishnan K, Berge E, Gommans J, Ntaios G, et al. Влияние сверхострого введения (в течение 6 часов) трансдермального тринитрата глицерина, донора оксида азота, на исход после инсульта: анализ подгрупп исследования эффективности оксида азота при инсульте (ENOS).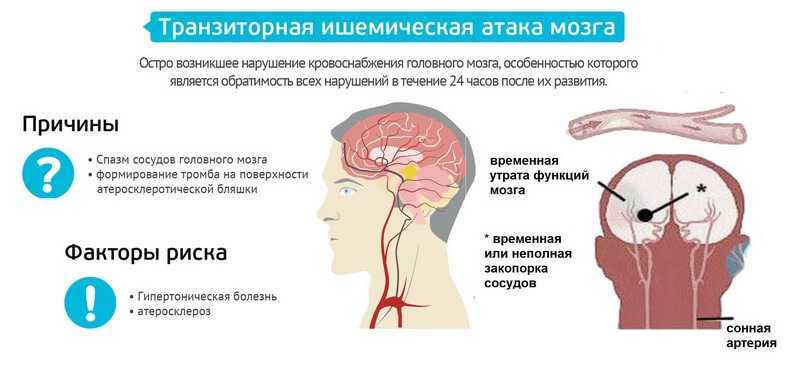 Ход 2015 г.; 46:3194–3201. doi: 10.1161/STROKEAHA.115.009647. [PubMed] [Академия Google]
Ход 2015 г.; 46:3194–3201. doi: 10.1161/STROKEAHA.115.009647. [PubMed] [Академия Google]
112. Cavalieri M, Schmidt R, Chen C, Mok V, de Freitas GR, Song S, et al. Витамины группы В и выявленные с помощью магнитно-резонансной томографии ишемические поражения головного мозга у пациентов с недавней транзиторной ишемической атакой или инсультом: МРТ-подисследование VITAmins TO Prevent Stroke (VITATOPS). Ход 2012 г.; 43:3266–3270. doi: 10.1161/STROKEAHA.112.665703. [PubMed] [Google Scholar]
113. Wang Y, Meng R, Song H, Liu G, Hua Y, Cui D и др. Дистанционное ишемическое кондиционирование может улучшить результаты лечения пациентов с церебральной болезнью мелких сосудов. Ход 2017; 48:3064–3072. doi: 10.1161/STROKEAHA.117.017691. [PubMed] [Google Scholar]
114. Amarenco P, Goldstein LB, Messig M, O’Neill BJ, Callahan A, III, Sillesen H, et al. Относительные и кумулятивные эффекты контроля липидов и артериального давления в исследовании «Профилактика инсульта путем агрессивного снижения уровня холестерина». Ход 2009 г.; 40:2486–2492. doi: 10.1161/STROKEAHA.108.546135. [PubMed] [Google Scholar]
Ход 2009 г.; 40:2486–2492. doi: 10.1161/STROKEAHA.108.546135. [PubMed] [Google Scholar]
115. Mok VC, Lam WW, Chen XY, Wong A, Ng PW, Tsoi TH, et al. Статины при бессимптомном стенозе средней мозговой артерии: исследование регрессии стеноза мозговой артерии. Цереброваскулярный дис 2009 г.; 28:18–25. дои: 10.1159/000215939. [PubMed] [Google Scholar]
116. Rajani RM, Quick S, Ruigrok SR, Graham D, Harris SE, Verhaaren BFJ, et al. Устранение эндотелиальной дисфункции снижает уязвимость белого вещества головного мозга при заболевании мелких сосудов у крыс. Sci Transl Med 2018; 10:eaam9507.doi: 10.1126/scitranslmed.aam9507. [PubMed] [Google Scholar]
117. Miyamoto N, Pham LD, Hayakawa K, Matsuzaki T, Seo JH, Magnain C, et al. Возрастное снижение олигодендрогенеза замедляет восстановление белого вещества у мышей. Ход 2013; 44:2573–2578. doi: 10.1161/STROKEAHA.113.001530. [Бесплатная статья PMC] [PubMed] [Google Scholar]
118. Hasel P, Dando O, Jiwaji Z, Baxter P, Todd AC, Heron S, et al. Нейроны и активность нейронов контролируют экспрессию генов в астроцитах, чтобы регулировать их развитие и метаболизм. Нац Коммуна 2017; 8:15132.doi: 10.1038/ncomms15132. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Hasel P, Dando O, Jiwaji Z, Baxter P, Todd AC, Heron S, et al. Нейроны и активность нейронов контролируют экспрессию генов в астроцитах, чтобы регулировать их развитие и метаболизм. Нац Коммуна 2017; 8:15132.doi: 10.1038/ncomms15132. [Бесплатная статья PMC] [PubMed] [Google Scholar]
119. Han SW, Song TJ, Bushnell CD, Lee SS, Kim SH, Lee JH, et al. Цилостазол снижает пульсацию церебральных артерий у пациентов с умеренно выраженной гиперинтенсивностью белого вещества: анализ подгрупп из исследования «Эффект цилостазола при остром лакунарном инфаркте на основе индекса пульсации транскраниальной допплерографии» (ECLIPse). Цереброваскулярный дис 2014; 38:197–203. дои: 10.1159/000365840. [PubMed] [Google Scholar]
120. Bath PM, Scutt P, Anderson CS, Ankolekar S, Appleton JP, Berge E, et al. Догоспитальное трансдермальное введение тринитрата глицерина у пациентов с подозрением на сверхострый инсульт (RIGHT-2): рандомизированное, симуляционно-контролируемое, слепое исследование фазы 3 на базе скорой помощи.