2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью.
Этот класс органических веществ можно рассматривать с точки зрения двух наук: биологии и химии. Начнем с биологической роли белков.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
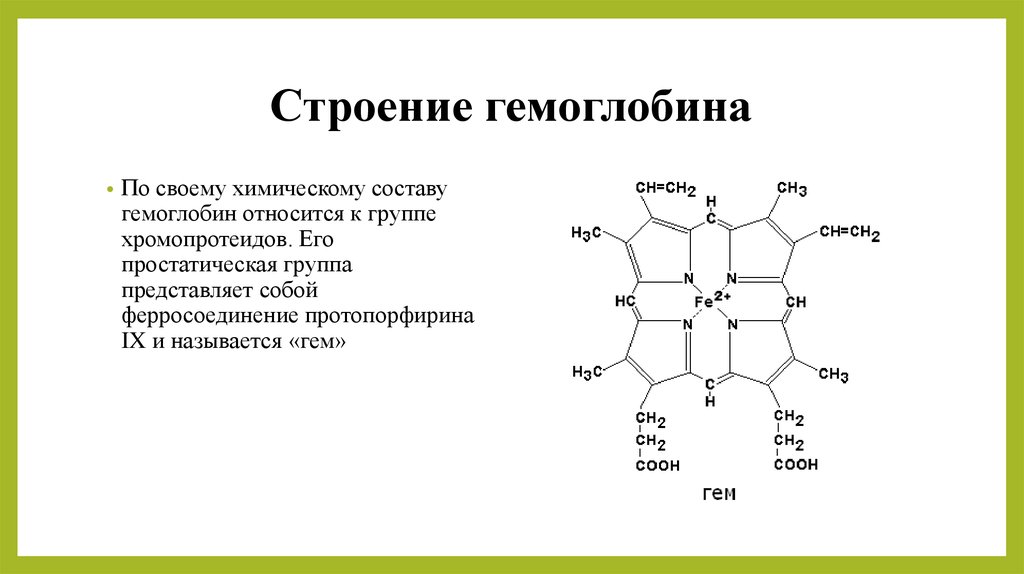
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена.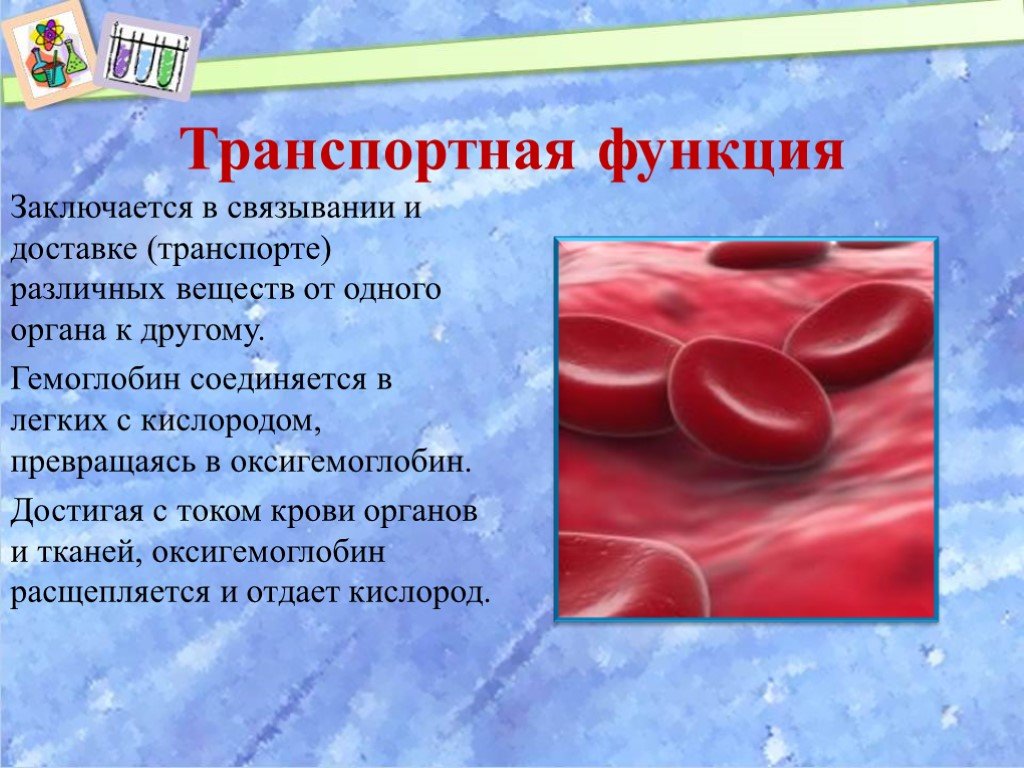 Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
The image is a derivative of "Protein structure vector illustration" by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
Как видно из условий, обратимость зависит от условий протекания реакций. Чем они жестче, тем меньше вероятность обратимости реакции.
Раствор белка + NaOH(10%-й р-р) + CuSO4 = фиолетовое окрашивание.
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Какая из структур белка является самой прочной?
Первичная
Вторичная
Третичная
Четвертичная
Какую из перечисленных функций способен выполнять белок?
Результативную
Регуляторную
Регулятивную
Растворную
За счет какой связи образуется первичная структура белка?
Ионной
Водородной
Пептидной
Ковалентной неполярной
При гидролизе белка получается (получаются). ..
..
Аминокислоты, образующие этот белок
Углекислый газ
Аминокислота и вода
Белок гидролизу не подвергается
Какая реакция с белком дает фиолетовое окрашивание?
Ксантопротеиновая
Цистеиновая
Биуретовая
Денатурация
Еще больше наглядных примеров функций белков в клетках живых организмов — на онлайн-курсах химии в Skysmart.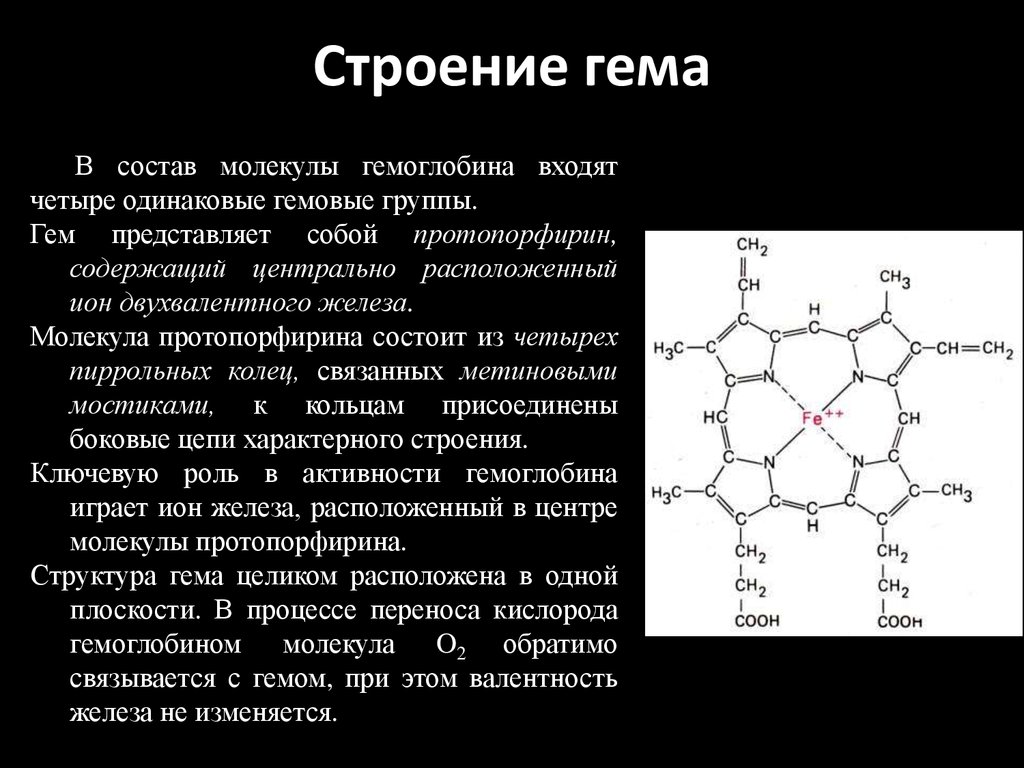 Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
Мы поможем полюбить предмет, разобраться в непонятных темах, улучшить оценки в школе и подготовиться к государственным экзаменам. Выберите подходящий курс и начните учиться с удовольствием!
a
b
c
a
c
16 Апреля 2020
5 Июня 2020
5 минут
1290
ProWellness
Оглавление
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами.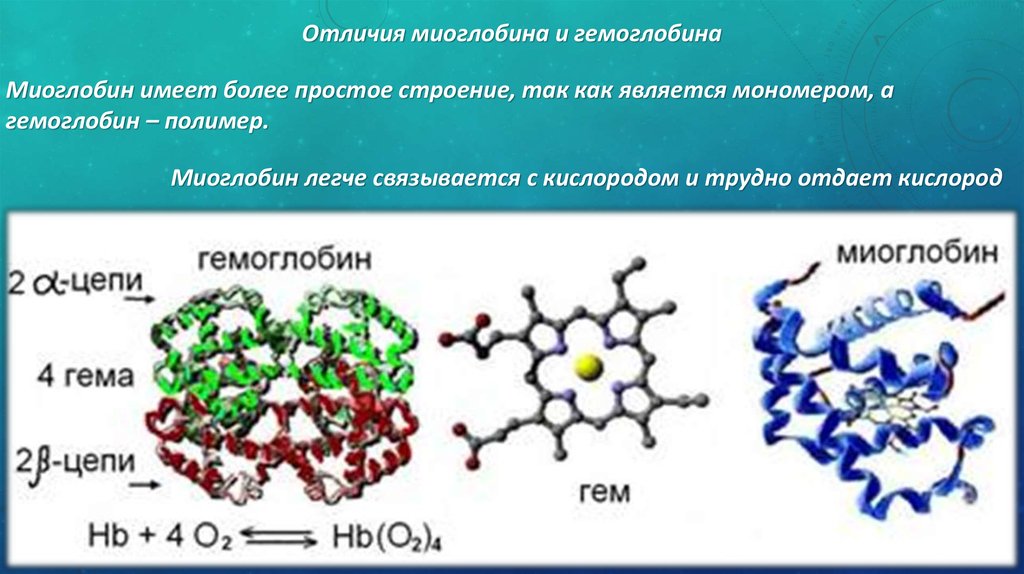 Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Железо – распространенный в природе химический элемент. В организме вещество скапливается преимущественно в крови, селезенке, печени, костном мозге и мышцах. Попадает оно в него с пищей, а покидает – с потом, мочой и менструальными выделениями. Общего количества металла в теле человека достаточно для изготовления одного крупного гвоздя – 2,5–4,5 г.
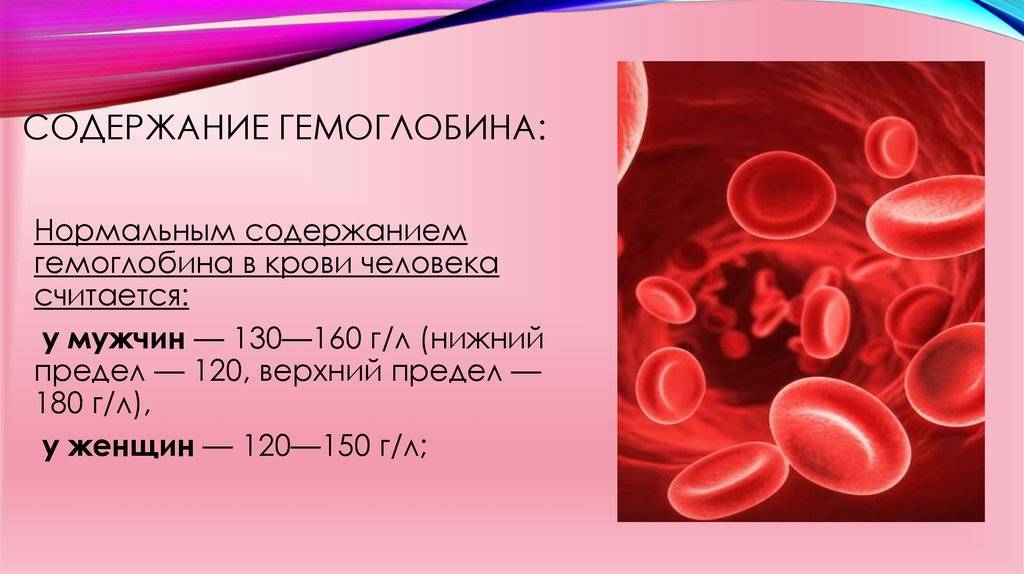
Внимание! По статистике ВОЗ, у 60% населения наблюдается дефицит железа.Из них 30% балансирует на грани железодефицитной анемии, при которой существенно снижается уровень гемоглобина в крови.
В организме человека на железо возложено много функций. Две наиболее важные – транспортировка кислорода к клеткам и обмен веществ.
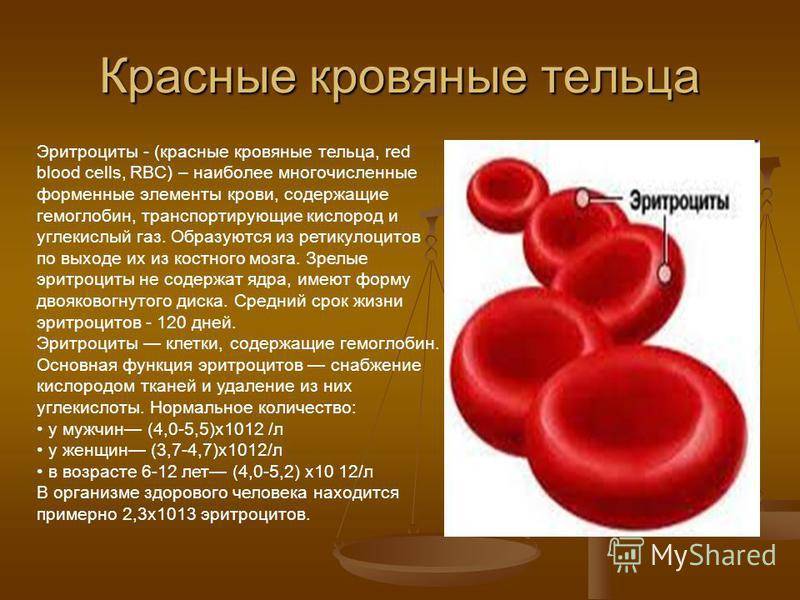
Железо является одной из главных составляющих гемоглобина – белка, входящего в состав эритроцитов. Микроэлемент захватывает молекулы кислорода, и эритроциты транспортируют их ко всем тканям. Они же, и вновь не без помощи микроэлемента, подбирают молекулы углекислого газа и переносят их в легкие для утилизации. Без железа не смогут протекать дыхательные процессы на уровне клеток, что неминуемо приведет к гибели организма.
Железо входит в состав многих ферментов и белков, а значит оказывает огромное влияние на метаболические процессы – разрушение и вывод из организма токсинов, холестериновый обмен, преобразование калорий в энергию.
Сколько железа нужно употреблять в день конкретному человеку, зависит от его возраста, половой принадлежности и индивидуальных особенностей.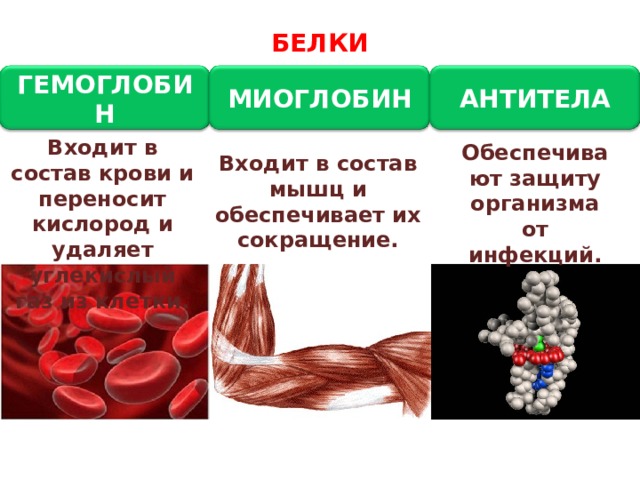 Средняя суточная норма потребления микроэлемента составляет 15 мг для женщин, 20 мг – для беременных и кормящих матерей, 10 мг – для мужчин, 5–15 мг – для детей.
Средняя суточная норма потребления микроэлемента составляет 15 мг для женщин, 20 мг – для беременных и кормящих матерей, 10 мг – для мужчин, 5–15 мг – для детей.
Дефицит железа проявляется не сразу. Он развивается в три этапа:
Внимание! Самый распространенный тип анемии – железодефицитный. На него приходится около 90% всех фиксируемых случаев малокровия.
Несмотря на важность и быстрый расход железа, его избыток не менее опасен, чем недостаток. О нем свидетельствуют отеки, суставные боли, снижение веса, желтизна склеры, сердечная недостаточность.
Для определения уровня железа в организме проводится биохимический анализ крови. Оптимальная концентрация микроэлемента в сыворотке крови для мужчин – 11,6–30,4 мкмоль/л, для женщин – 9–30,4 мкмоль/л.
Железо содержится в продуктах и животного, и растительного происхождения. Однако в них присутствует микроэлемент двух разных видов: органический гемовый и неорганический негемовый. Первый усваивается в 3 раза лучше. Получить нужную дозу вещества из растительной пищи очень сложно.
Получить нужную дозу вещества из растительной пищи очень сложно.
Таблица: содержание железа в продуктах питания и степень его усвоения
|
Продукт |
Содержание железа в 100 г, мг |
Степень усвоения железа, % |
|
Мясо |
3-4 |
20 |
|
Рыба |
2,5 |
11 |
|
Орехи |
51 |
6 |
|
Фасоль |
72 |
3 |
|
Соя |
9 |
5 |
|
Гречневая крупа |
7 |
5 |
|
Свиная печень |
30 |
15 |
|
Говяжья печень |
9 |
11 |
Внимание! Железо лучше усваивается в присутствии марганца, меди, кобальта, аскорбиновой кислоты.Ухудшают его всасывание кальций, щавелевая кислота, фосфаты и танины, которых много в чае. Молоко содержит железо, но из-за присутствия в его составе кальция, микроэлемент не усваивается.
Оптимальная суточная дозировка железа для профилактики анемии составляет 1,5 мг/кг, для лечения дефицита – 2-3 мг/кг. Дневную дозу делят на 3 приема, причем желательно принимать микроэлемент в одно и тоже время и с равными промежутками, поскольку костный мозг лучше реагирует на регулярное поступление вещества.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Железо является важным элементом для производства крови. Около 70 процентов железа в вашем организме содержится в эритроцитах крови, называемых гемоглобином, и в мышечных клетках, называемых миоглобином. Гемоглобин необходим для переноса кислорода в крови от легких к тканям. Миоглобин в мышечных клетках принимает, хранит, транспортирует и выделяет кислород.
Около 6 процентов железа в организме входит в состав некоторых белков, необходимых для дыхания и энергетического обмена, а также в качестве компонента ферментов, участвующих в синтезе коллагена и некоторых нейротрансмиттеров. Железо также необходимо для правильной работы иммунной системы.
Железо также необходимо для правильной работы иммунной системы.
Около 25 процентов железа в организме хранится в виде ферритина, который содержится в клетках и циркулирует в крови. В среднем взрослый мужчина имеет около 1000 мг запасенного железа (достаточно примерно на три года), в то время как женщины в среднем имеют только около 300 мг (хватает примерно на шесть месяцев). Когда потребление железа хронически низкое, его запасы могут истощиться, что приведет к снижению уровня гемоглобина.
Когда запасы железа истощаются, такое состояние называется истощением железа. Дальнейшее снижение можно назвать железодефицитным эритропоэзом, а дальнейшее снижение вызывает железодефицитную анемию.
Кровопотеря является наиболее распространенной причиной дефицита железа. У мужчин и женщин в постменопаузе дефицит железа почти всегда является результатом желудочно-кишечной кровопотери. У женщин в период менструации увеличение потребности в железе часто связано с мочеполовой кровопотерей. Оральные контрацептивы, как правило, уменьшают менструальную кровопотерю, тогда как внутриматочные средства, как правило, увеличивают менструальное кровотечение. Другие причины мочеполовых кровотечений и кровотечений из дыхательных путей также увеличивают потребность в железе.
Оральные контрацептивы, как правило, уменьшают менструальную кровопотерю, тогда как внутриматочные средства, как правило, увеличивают менструальное кровотечение. Другие причины мочеполовых кровотечений и кровотечений из дыхательных путей также увеличивают потребность в железе.
Для доноров крови каждая сдача крови приводит к потере от 200 до 250 мг железа. В периоды роста в младенчестве, детстве и подростковом возрасте потребность в железе может превышать поступление железа из рациона и запасов. Потеря железа в результате роста тканей во время беременности и кровотечения во время родов и после родов составляет в среднем 740 мг. Грудное вскармливание увеличивает потребность в железе примерно на 0,5–1 мг в день.
Ваш "уровень железа" проверяется перед каждой сдачей крови, чтобы определить, безопасно ли для вас сдавать кровь. Железо не вырабатывается в организме и должно усваиваться из того, что вы едите. Минимальная суточная потребность взрослого человека в железе составляет 1,8 мг. Только от 10 до 30 процентов железа, которое вы потребляете, усваивается и используется организмом.
Только от 10 до 30 процентов железа, которое вы потребляете, усваивается и используется организмом.
Суточная потребность в железе может быть обеспечена за счет приема препаратов железа. Сульфат железа 325 мг перорально один раз в день, а также с пищей с высоким содержанием железа. Также рекомендуются продукты с высоким содержанием витамина С, поскольку витамин С помогает организму усваивать железо. Приготовление пищи в железных кастрюлях может добавить к вашим продуктам до 80 процентов железа. Проконсультируйтесь с лечащим врачом, прежде чем принимать добавки железа.
Продолжить чтение
Некоторые продукты, богатые железом, включают:
1. Перутц М.Ф., Россманн М.Г., Каллис М.Г., Мюрхед Х., Уилл Г., Норт АСТ Структура гемоглобина. Трехмерный синтез Фурье с разрешением 5,5 Å, полученный с помощью рентгеноструктурного анализа. Природа. 1960; (185): 416–422. [PubMed] [Google Scholar]
Перутц М.Ф., Россманн М.Г., Каллис М.Г., Мюрхед Х., Уилл Г., Норт АСТ Структура гемоглобина. Трехмерный синтез Фурье с разрешением 5,5 Å, полученный с помощью рентгеноструктурного анализа. Природа. 1960; (185): 416–422. [PubMed] [Google Scholar]
2. Инграм В.М. Генные мутации гемоглобина человека: химическая разница между нормальным и серповидноклеточным гемоглобином. Природа. 1957;(180):326–328. [PubMed] [Google Scholar]
3. Эллисон А.С. Защита, обеспечиваемая серповидно-клеточным признаком, против субтертической малярийной инфекции. Br Med J. 1954; (1): 290–294. [PMC бесплатная статья] [PubMed] [Google Scholar]
4. Perutz MF, Lehmann H. Молекулярная патология гемоглобина человека. Природа. 1968; 219(157):902–909. [PubMed] [Google Scholar]
5. Маренго-Роу А. Гемоглобинопатии. Бр Дж Хосп Мед. 1971; 6: 617–630. [Google Scholar]
6. Перуц М.Ф. Белки и нуклеиновые кислоты: структура и функции. Амстердам: Эльзевир; 1962. С. 35–48. [Google Scholar]
7. Конотей-Ахулу ФИД. Наследственные качественные и количественные дефекты эритроцитов в Гане. Историко-географический обзор. Ghana Med J. 1968; (7): 118–119. [Google Scholar]
Конотей-Ахулу ФИД. Наследственные качественные и количественные дефекты эритроцитов в Гане. Историко-географический обзор. Ghana Med J. 1968; (7): 118–119. [Google Scholar]
8. Херрик Дж. Б. Своеобразные удлиненные и серповидные эритроциты при тяжелой анемии. Arch Intern Med. 1910;6:517. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9. Bunn HF. Патогенез и лечение серповидноклеточной анемии. N Engl J Med. 1997; 337(11):762–769.. [PubMed] [Google Scholar]
10. Рафаэль Р.И. Патофизиология и лечение серповидно-клеточной анемии. Clin Adv Hematol Oncol. 2005;3(6):492–505. [PubMed] [Google Scholar]
11. Pauling L, Itano HA, Singer SJ, Wells IC. Серповидноклеточная анемия, молекулярное заболевание. Наука. 1949; (110): 543–548. [PubMed] [Google Scholar]
12. Nagel RL, Platt OS. Общая патофизиология серповидноклеточной анемии. В: Steinberg MH, Forget BG, Higgs DR, редакторы. Нарушения гемоглобина. Кембридж: Издательство Кембриджского университета; 2001. стр. 49.4–526. [Google Scholar]
стр. 49.4–526. [Google Scholar]
13. Патаре А., Кинди С.А., Даар С., Деннисон Д. Цитокины при серповидноклеточной анемии. Гематология. 2003;8(5):329–337. [PubMed] [Google Scholar]
14. Hebbel RP, Mohandas N. Клеточная адгезия и микрореология при серповидно-клеточной анемии. В: Steinberg MH, Forget BG, Higgs DR, редакторы. Нарушения гемоглобина. Кембридж: Издательство Кембриджского университета; 2001. стр. 527–549. [Google Scholar]
15. Адамс Р.Дж., Брамбилла Д. Оптимизация первичной профилактики инсульта при серповидноклеточной анемии (СТОП 2). Исследуемые испытания Прекращение профилактических переливаний, используемых для предотвращения инсульта при серповидноклеточной анемии. N Engl J Med. 2005;353(26):2769–2778. [PubMed] [Google Scholar]
16. Marengo-Rowe AJ, Beale D, Lehmann H. Новый вариант гемоглобина человека из южной Аравии: G-Audhali (альфа-23B4 глутаминовая кислота → валин) и вариабельность B4 в гемоглобине человека . Природа. 1968;219(159):1164–1166. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
17. Perutz RR, Ligouri AM, Eirich F. Рентгенологическое исследование и исследование растворимости гемоглобина у пациентов с серповидноклеточной анемией. Природа. 1951; 167 (4258): 929–931. [PubMed] [Google Scholar]
18. Баллас С.К., Смит Э.Д. Изменения эритроцитов во время развития болезненного кризиса серповидноклеточной анемии. Кровь. 1992;79(8):2154–2163. [PubMed] [Google Scholar]
19. Вичинский Е.П. Комплексная помощь при серповидно-клеточной анемии: ее влияние на заболеваемость и смертность. Семин Гематол. 1991;28(3):220–226. [PubMed] [Google Scholar]
20. Национальный институт сердца, легких и крови, Национальный институт здоровья. Лечение серповидноклеточной анемии (публикация NIH № 02-2117). Bethesda, MD: NIH, 2002. Доступно на http://www.nhlbi.nih.gov/health/prof/blood/sickle/; по состоянию на 13 февраля 2006 г.
21. Vermylen C, Cornu G. Трансплантация гемопоэтических стволовых клеток при серповидноклеточной анемии. Карр Опин Гематол. 1997;4(6):377–380. [PubMed] [Google Scholar]
Карр Опин Гематол. 1997;4(6):377–380. [PubMed] [Google Scholar]
22. Steinberg MH, Barton F, Castro O, Pegelow CH, Ballas SK, Kutlar A, Orringer E, Bellevue R, Olivieri N, Eckman J, Varma M, Ramirez G, Adler B, Smith W, Carlos T, Ataga K, DeCastro L, Bigelow C, Saunthararajah Y, Telfer M, Vichinsky E, Claster S, Shurin S, Bridges K, Waclawiw M, Bonds D, Terrin M. Влияние гидроксимочевины на смертность и заболеваемость в Серповидноклеточная анемия взрослых: риски и преимущества до 9лет лечения. ДЖАМА. 2003; 289(13):1645–1651. [PubMed] [Google Scholar]
23. Cokic VP, Smith RD, Beleslin-Cokic BB, Njoroge JM, Miller JL, Gladwin MT, Schechter AN. Гидроксимочевина индуцирует фетальный гемоглобин за счет зависимой от оксида азота активации растворимой гуанилатциклазы. Джей Клин Инвест. 2003;111(2):231–239. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Platt OS, Brambilla DJ, Rosse WF, Milner PF, Castro O, Steinberg MH, Klug PP. Смертность при серповидноклеточной анемии.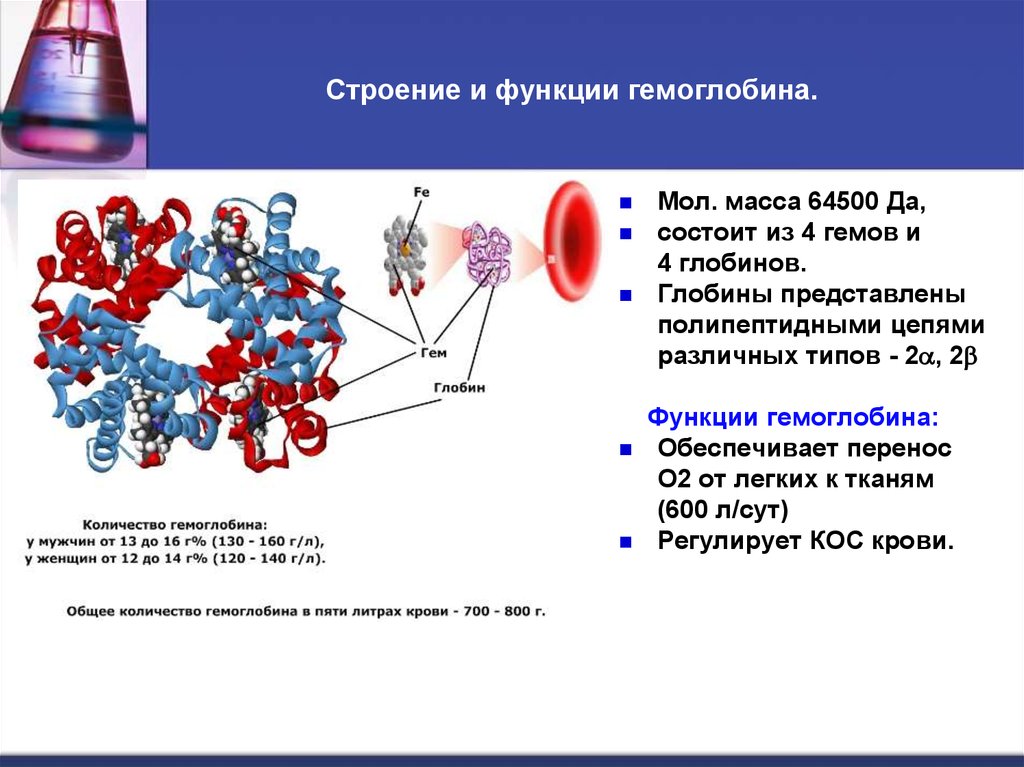 Продолжительность жизни и факторы риска ранней смерти. N Engl J Med. 1994;330(23):1639–1644. [PubMed] [Google Scholar]
Продолжительность жизни и факторы риска ранней смерти. N Engl J Med. 1994;330(23):1639–1644. [PubMed] [Google Scholar]
25. Удани М., Зен К., Коттман М., Леонард Н., Джефферсон С., Деймонт С., Траски Г. Молекула адгезии базальных клеток/лютеранский белок. Рецептор, ответственный за адгезию серповидных клеток к ламинину. Джей Клин Инвест. 1998;101(11):2550–2558. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Ataga KI, Orringer EP. Гиперкоагуляция при серповидно-клеточной анемии: любопытный парадокс. Am J Med. 2003;115(9):721–728. [PubMed] [Google Scholar]
27. Вествик Дж., Уотсон-Уильямс Э.Дж., Кришнамурти С., Маркс Г., Эллис В., Скалли М.Ф., Уайт Дж.М., Каккар В.В. Активация тромбоцитов при стационарной серповидно-клеточной анемии. J Мед. 1983;14(1):17–36. [PubMed] [Google Scholar]
28. Westerman MP, Green D, Gilman-Sachs A, Beaman K, Freels S, Boggio L, Allen S, Zuckerman L, Schlegel R, Williamson P. Антифосфолипидные антитела, белки C и S и изменения коагуляции при серповидно-клеточной анемии.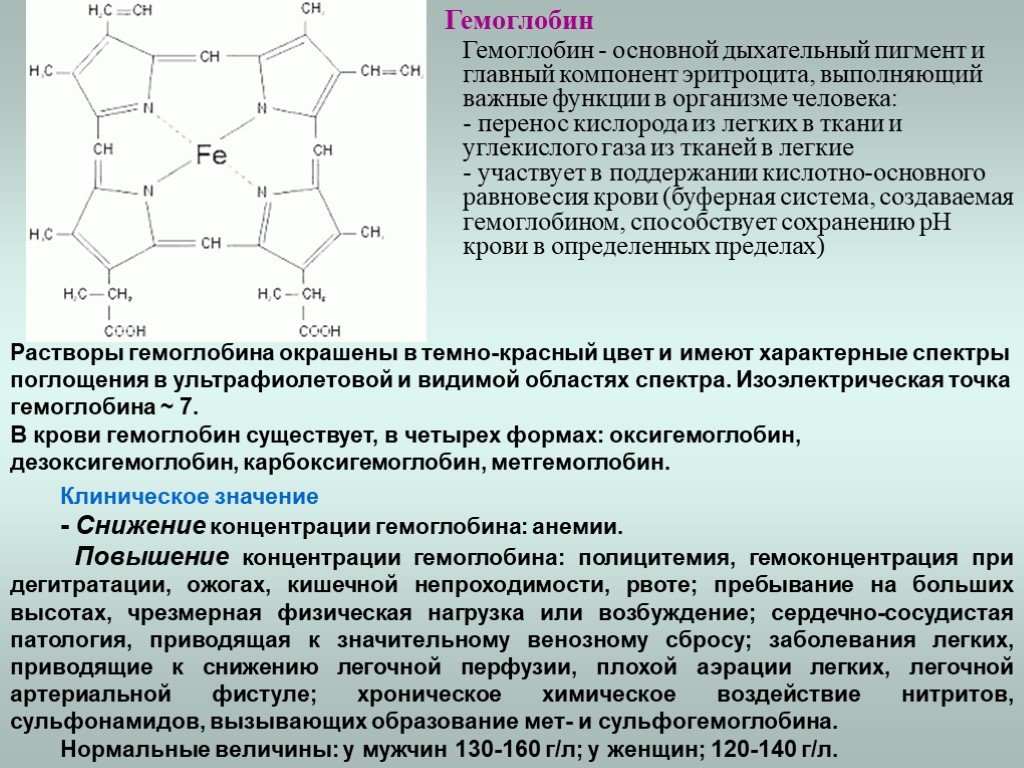 J Lab Clin Med. 1999;134(4):352–362. [PubMed] [Google Scholar]
J Lab Clin Med. 1999;134(4):352–362. [PubMed] [Google Scholar]
29. Фрэнсис Р.Б., мл. Тромбоциты, коагуляция и фибринолиз при серповидно-клеточной анемии: их возможная роль в окклюзии сосудов. Коагуляционный фибринолиз крови. 1991;2(2):341–353. [PubMed] [Google Scholar]
30. Перуц М.Ф. Стереохимия кооперативных эффектов в гемоглобине. Природа. 1970; 228(5273):726–739. [PubMed] [Google Scholar]
31. Перуц М.Ф., Уилкинсон А.Дж., Паоли М., Додсон Г.Г. Новый взгляд на стереохимический механизм кооперативных эффектов в гемоглобине. Annu Rev Biophys Biomol Struct. 1998; (27): 1–34. [PubMed] [Google Scholar]
32. Charache S, Weatherall DJ, Clegg JB. Полицитемия, ассоциированная с гемоглобинопатией. Джей Клин Инвест. 1966;45(6):813–822. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Botha MC, Beale D, Isaacs WA, Lehmann H. Гемоглобин J Кейптаун-альфа-2 92 аргинин заменен глутамином бета-2. Природа. 1966; 212(64):792–795. [PubMed] [Google Scholar]
34. Джонс Р.Т., Осгуд Э.Е., Бримхолл Б., Колер Р.Д. Гемоглобин Якина. I. Клинико-биохимические исследования. Джей Клин Инвест. 1967; 46 (11): 1840–1847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джонс Р.Т., Осгуд Э.Е., Бримхолл Б., Колер Р.Д. Гемоглобин Якина. I. Клинико-биохимические исследования. Джей Клин Инвест. 1967; 46 (11): 1840–1847. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Lokich JJ, Moloney WC, Bunn HF, Bruckheimer SM, Ranney HM. Гемоглобин Бригама (α 2 A β 2 100 Pro→Leu). Вариант гемоглобина, связанный с семейным эритроцитозом. Джей Клин Инвест. 1973;52(8):2060–2067. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Адамсон Дж. В., Парер Дж. Т., Стаматояннопулос Г. Эритроцитоз, связанный с гемоглобином Ренье: кислородное равновесие и регуляция костного мозга. Джей Клин Инвест. 1969; 48 (8): 1376–1386. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Bunn HF, Bradley TB, Davis WE, Drysdale JW, Burke JF, Beck WS, Layer MB. Структурно-функциональные исследования гемоглобина Bethesda (α 2 А β 2 l45His ), вариант, связанный с компенсаторным эритроцитозом. Джей Клин Инвест. 1972; 51 (9): 2299–2309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Инвест. 1972; 51 (9): 2299–2309. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Дженсен М., Оски Ф.А., Натан Д.Г., Банн Х.Ф. Гемоглобин Syracuse A (α 2 A β 2 143 (h31)His→Pro) — новый высокоаффинный вариант, обнаруженный специальными методами электрофореза. Наблюдения за самоокислением нормального и вариантного гемоглобинов. Джей Клин Инвест. 1975;55(3):469–477. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Reissmann KR, Ruth WE, Nomura T. Человеческий гемоглобин с пониженным сродством к кислороду и нарушенными гем-гемовыми взаимодействиями. Джей Клин Инвест. 1961; (40): 1826–1833. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Imamura T, Fujita S, Ohta Y, Hanada M, Yanase T. Гемоглобин Йошизука (G10(108)β-аспарагин→аспарагиновая кислота): новый вариант с пониженное сродство к кислороду из японской семьи. Джей Клин Инвест. 1969;48(12):2341–2348. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Имаи К., Моримото Х., Котани М., Шибата С., Мияджи Т. Исследования функции аномальных гемоглобинов. II. Кислородное равновесие аномальных гемоглобинов: Симоносеки, Убэ II, Хикари, Гифу и Агеноги. Биохим Биофиз Акта. 1970; 200(2):197–202. [PubMed] [Google Scholar]
Имаи К., Моримото Х., Котани М., Шибата С., Мияджи Т. Исследования функции аномальных гемоглобинов. II. Кислородное равновесие аномальных гемоглобинов: Симоносеки, Убэ II, Хикари, Гифу и Агеноги. Биохим Биофиз Акта. 1970; 200(2):197–202. [PubMed] [Google Scholar]
42. Каррелл Р.В., Леманн Х., Хатчинсон Х.Е. Гемоглобин Колн (β-98 валин → метионин): нестабильный белок, вызывающий анемию с тельцами включения. Природа. 1966; 210(39):915–916. [PubMed] [Google Scholar]
43. Dacie JV, Shinton NK, Gaffney PJ, Jr, Lehmann H. Гемоглобин Хаммерсмит (бета-42 (CDI) Phe заменен на Ser) Nature. 1967;216(5116):663–665. [PubMed] [Google Scholar]
44. Sakuragawa M, Ohba Y, Miyaji T, Yamamoto K, Miwa S. Японский мальчик с гемолитической анемией из-за нестабильного гемоглобина (Hb Bristol) Nippon Ketsueki Gakkai Zasshi. 1984;47(4):896–902. [PubMed] [Google Scholar]
45. Murari J, Smith LL, Wilson JB, Schneider RG, Huisman TH. Некоторые свойства гемоглобина Ган Хилл. Гемоглобин. 1977;1(3):267–282. [PubMed] [Google Scholar]
1977;1(3):267–282. [PubMed] [Google Scholar]
46. Plaseska D, Dimovski AJ, Wilson JB, Webber BB, Hume HA, Huisman TH. Гемоглобин Монреаль: новый вариант с расширенной бета-цепью из-за делеции Asp, Gly, Leu в положениях 73, 74 и 75 и вставки Ala, Arg, Cys, Gln в том же месте. Кровь. 1991;77(1):178–181. [PubMed] [Google Scholar]
47. Winterbourn CC, Carrell RW. Изучение денатурации гемоглобина и образования телец Гейнца в нестабильных гемоглобинах. Джей Клин Инвест. 1974; 54 (3): 678–689. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Кэти IAB. Явная идиопатическая анемия с тельцами Гейнца. Грейт-Ормонд-стрит, Дж. 1952; (2): 43–48. [Google Scholar]
49. Hörlein H, Weber G. Über Chronishce Familiare Metthämoglobinamie und Eine Modification des Methämoglobins. Dtsch Med Wochenschr. 1948;73:476. [PubMed] [Google Scholar]
50. Джеральд П.С., Эфрон М.Л. Химические исследования нескольких разновидностей Hb, M. Proc Natl Acad Sci U S A. 1961; (47): 1758–1767.