2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Главный внештатный специалист по радиотерапии Департамента здравоохранения города Москвы, врач-онколог, радиотерапевт, член Европейского общества медицинской онкологии (ESMO), член Американского общества клинической онкологии(ASMO), член Американского общества терапевтической радиологии и онкологии (ASTRO), член Иорданско-Палестинской медицинской ассоциации, член Израильского клинической онкологии и лучевой терапии (ISCORT) Салим Нидаль рассказал о том, почему лучевая терапия незаменима в онкологии.
– Каковы основные способы лечения в онкологии?
– В лечении онкологических заболеваний
применяются три основных метода:
хирургия, лучевая терапия и химиотерапия.
Раньше на первом месте по значимости
было оперативное вмешательство,
затем шла химиотерапия и только потом
лучевая терапия. Но за последние 20 лет
благодаря техническим достижениям радиотерапия
в онкологии вышла на качественно
новый уровень. Она может быть
использована в 95 % случаев развития
всех видов злокачественных новообразований.
В рамках территориальной программы
ОМС в городе Москве лучевую
терапию проводят при всех онкологических
заболеваниях, кроме лейкемии.
Из 100 онкологических пациентов порядка 60 получают химиотерапию. Лучевая терапия, по современным данным, требуется 80 % пациентов на каком-то этапе как самостоятельный метод лечения или в сочетании с химиотерапией и хирургией. При многих онкологических заболеваниях лучевая терапия незаменима. Например, при раке шейки матки – одном из самых распространенных женских онкологических заболеваний, особенно среди молодых женщин. Отметим, что при определенных локализациях и стадиях заболевания лучевая терапия может являться альтернативой оперативному лечению. Например, при некоторых видах рака легкого, когда операция невозможна. При ранних стадиях рака легкого лучевая терапия может замещать оперативное лечение на 100 %.
Раньше опухоли головы и шеи традиционно лечили оперативным путем. К примеру, при опухоли гортани третьей стадии хирурги полностью удаляли орган. После подобной операции человек, как правило, оставался с трахеостомой. Это сильно ухудшало качество жизни. Применение современных методов радиотерапии позволяет избежать оперативного вмешательства и вылечиться с минимальными побочными эффектами. Лучевая терапия может сохранить не только орган, но и его функции.
Неоадъювантную (предоперационную) лучевую терапию применяют для уменьшения размера опухоли или с целью проведения органосохраняющего лечения. К примеру, лучевая терапия перед операцией при раке прямой кишки повышает шансы на сохранение функции органа до 40 %. Многие исследования показывают, что у 20–30 % пациентов, которым проводилась лучевая терапия до операции, не остается злокачественных клеток. Лучевая терапия может полностью избавить пациента от опухоли, уничтожая оставшиеся раковые клетки, что снижает риск рецидива заболевания после оперативного лечения. Доказано, что, увеличивая локальный контроль, мы увеличиваем выживаемость. Обычно первый сеанс лучевой терапии проводится на 3–6-й неделе после операции в зависимости от того, сколько времени требуется для восстановления пациента.
Современные технологии радиотерапии с модуляцией интенсивности пучка излучения и визуальным контролем точности облучения, доступные нашим пациентам, позволяют воздействовать на злокачественные новообразования с точностью до миллиметра. Доза излучения направляется избирательно в опухоль, не затрагивая здоровые ткани. Поэтому побочные эффекты от лучевой терапии минимальные. Иногда их и вовсе нет.
Лучевую терапию применяют и для того, чтобы улучшить качество жизни пациента с неизлечимой болезнью. Например, чтобы уменьшить давление опухоли на спинной мозг или крупные сосуды или восстановить функцию глотания. Облучая злокачественные образования в районе спинного мозга или позвоночника, мы можем сохранить пациенту способность двигаться. В таких случаях лучевая терапия дает шанс на более длительную жизнь и уменьшает болевой синдром.
Сейчас можно облучить одновременно до 6 метастазов, тем самым сохранив пациенту время жизни. Мы не можем говорить о том, что человек полностью выздоровеет, но мы контролируем его состояние. После лучевой терапии такой пациент может прожить 2–3 года.
– Из каких этапов состоит лучевая терапия?
– Лучевая терапия состоит из четырех крайне важных для эффективности лечения этапов: консультация врача, КТ симуляция, планирование лечения, сеанс лучевой терапии. Перед началом лечения необходима консультация онколога-радиолога (его также называют лучевым или радиотерапевтом). Основываясь на конкретном случае, онколог-радиолог порекомендует определенный вид лучевой терапии, обсудит с пациентом необходимость сочетания с другими методами лечения, определит конкретные цели терапии и предупредит о возможных побочных эффектах.
– Что такое стереотаксическая радиохирургия?
– Стереотаксическая радиохирургия – это высокоточная методика облучения, при которой происходит деструкция новообразования (обычно не превышающего 4 см в диаметре) под воздействием высоких доз излучения с минимальным воздействием на окружающие здоровые ткани. Облучение проводится за 1–5 сеансов.
Существует два вида стереотаксической радиохирургии: стереотаксическая радиохирургия при опухолях головного мозга (SRS) и экстракраниальная стереотаксическая радиотерапия (SBRT).
– В каких случаях применяется радиохирургическое лечение?
– Оно применяется при расположении новообразования в малодоступных для хирургического лечения местах, в случае, когда новообразования расположены близко к жизненно важным органам и структурам, при опухолях, меняющих свое положение в зависимости от дыхания, SRS и SBRT представляют собой альтернативную терапию для больных, которым по каким-либо причинам противопоказано хирургическое лечение, для выполнения радиохирургического лечения требуется проведение трехмерной и/или четырехмерной КТ симуляции для точного определения локализации, конфигурации и размера новообразования и применение устройства для иммобилизации пациента с целью идентичного воспроизведения позиции пациента при радиотерапии, прецизионность (точность) терапии обеспечивается за счет точного воспроизведения укладки больного с помощью фиксирующих устройств и оптического контроля локализации опухоли в течение всего сеанса радиотерапии.
С 2018 года стереотаксическое радиохирургическое
лечение с применением
технологии 4D ViMAT IGRT вошло в Территориальную
программу обязательного
медицинского страхования для жителей
города Москвы
Проведенное в семи странах с низким и средним уровнем дохода пятилетнее клиническое исследование подтвердило безопасность и эффективность лечения рака шейки матки путем комбинирования высоких доз внутренней лучевой терапии (брахитерапии) с дистанционной лучевой терапией (телетерапией) тазовой области.
Результаты исследования МАГАТЭ были представлены на пленарном заседании 59-го ежегодного совещания Американского общества радиационной онкологии (АОРО).
Один из авторов исследования и директор Отдела здоровья человека МАГАТЭ Мэй Абдель Вахаб отмечает, что рак шейки матки — одна из наиболее распространенных причин смерти от рака среди женщин в развивающихся странах.
«80% больных раком проживают в странах с низким и средним уровнем доходов. Крайне важно располагать данными, которые можно использовать в этих условиях», — говорит г-жа Абдель Вахаб.
В исследовании, которое проводилось с сентября 2005 года по май 2010 года, приняла участие 601 пациентка с местнораспространенным раком шейки матки. Это были женщины из Индии, Перу, Южной Африки, Бразилии, Пакистана, Марокко и Македонии.
«Наше исследование показало, что сочетание лучевой терапии тазовой области с четырьмя фракциями брахитерапии с высокой мощностью дозы (ВМД) по 7 грей (Гр) каждая — эффективный и безопасный метод лечения местнораспространенного рака шейки матки», — рассказывает г-жа Абдель Вахаб.
Пациентки проходили процедуры телетерапии тазовой области. Им произвольно назначали одну из двух схем брахитерапии: половина пациенток прошли четыре сеанса облучения с дозами по 7 Гр (4 фракции по 7 Гр) каждый, вторая половина — два сеанса облучения с дозами по 9 Гр (2 фракции по 9 Гр) каждый. Кроме того, половина пациенток из каждой группы, получавшей дозы как по 7 Гр, так и по 9 Гр, прошли химиотерапию, в то время как остальные пациентки — нет.
Результаты продемонстрировали гораздо более высокие показатели контроля над опухолью в группе, которая подвергалась телетерапии в сочетании с 4 фракциями брахитерапии с ВМД по 7 Гр: без химиотерапии локальный контроль достигался в 88% случаев, с химиотерапией — в 89% случаев. Показатели контроля у пациенток, которые подвергались телетерапии в сочетании с 2 фракциями брахитерапии с ВМД по 9 Гр, составили 78% без химиотерапии и 75% с химиотерапией.
Химиотерапия не повлияла ни на показатели общей и онкоспецифической выживаемости, ни на контроль над опухолью в шейке матки и прилегающих областях.
«Данные о том, что химиотерапия не оказывает существенного влияния ни на выживаемость, ни на контроль над опухолью, по всей видимости, отличаются от результатов совместного исследования по мета-анализу применения химиорадиотерапии для лечения рака шейки матки, в ходе которого было установлено, что химиотерапия улучшает показатели локального контроля на 6%, — рассказывает г-жа Абдель Вахаб. — Но надо отметить, что наше исследование не было рассчитано на выявление различий в локальном контроле, которые были бы ниже 10%. Иными словами, результаты обоих исследований не являются взаимоисключающими».
Исследование снабдило рекомендациями клинических специалистов, занимающихся лечением рака шейки матки, и продемонстрировало целесообразность проведения международных клинических исследований, в том числе в странах, где возможности проведения исследований ограничены.
«Благодаря данным, полученных в ходе этого широкомасштабного рандомизированного исследования, врачи знают, каких результатов следует ожидать от применения схемы из двух фракций по 9 Гр в условиях ограниченных ресурсов», — резюмирует г-жа Абдель Вахаб.
Лучевая терапия (радиотерапия) является общепринятым безопасным и эффективным методом лечения злокачественных опухолей. Преимущества данного метода для пациентов неоспоримы.
Радиотерапия обеспечивает сохранение анатомии и функции органа, улучшает качество жизни и показатели выживаемости, уменьшает болевой синдром. Уже десятилетия лучевая терапия при раке (ЛТ) широко используется при большинстве онкологических заболеваний. Никакой другой метод лечения рака не способен столь же эффективно заменить ЛТ с целью уничтожения опухоли или облегчения боли и других симптомов.
Лучевая терапия используется при лечении практически всех злокачественных новообразований, в каких бы тканях и органах они не возникали. Облучение при онкологии используется отдельно или в сочетании с другими методами, например хирургической операцией или химиотерапией. Радиотерапия может проводиться с целью полного излечения от рака или облегчения его симптомов, когда исчезновение опухоли невозможно.
В настоящее время полное излечение возможно более чем в 50% случаев злокачественных опухолей, для чего крайне важна радиотерапия. Как правило, радиология на каком-либо этапе заболевания требуется около 60% пациентов, проходящих лечение по поводу рака. К большому сожалению, в российской действительности этого не происходит.
Лучевая терапия в онкологии подразумевает лечение злокачественных новообразований с помощью высокоэнергетического излучения. Онколог-радиолог использует облучение с целью полного излечения от рака или облегчения болевого синдрома и других симптомов, которые вызваны опухолью.
Принцип действия облучения при раке сводится к нарушению репродуктивных возможностей раковых клеток, то есть их способности к размножению, в результате чего организм естественным образом избавляется от них.
Радиотерапия повреждает раковые клетки путем негативного влияния на их ДНК, в результате чего клетки более не способны делиться и расти. Данный метод лечения рака является самым эффективным при уничтожении активно делящихся клеток.
Высокая чувствительность клеток злокачественных опухолей к излучению обусловлена двумя основными факторами:
Онколог-радиолог может проводить наружную (внешнюю) радиотерапию, источником излучения при которой является линейный ускоритель заряженных частиц (устройство, ускоряющее электроны с целью формирования рентгеновских или гамма-лучей).
Облучение при раке также возможно с помощью источников радиоактивного излучения, которые помещаются в организм пациента (так называемая брахитерапия, или внутренняя ЛТ).
При этом радиоактивное вещество находится внутри игл, катетеров, зерен или специальных проводников, которые временно или постоянно имплантируются внутрь опухоли или размещаются в непосредственной близости от нее.
Брахитерапия является весьма распространенным методом лучевой терапии при раке предстательной железы, матки и шейки матки или молочной железы. Метод излучения настолько точно воздействует на опухоль изнутри, что последствия (осложнения после лучевой терапии на здоровые органы) - практически исключаются.
Некоторым пациентам, страдающим злокачественной опухолью, радиотерапия назначается вместо хирургического вмешательства. Подобным образом нередко проводится лечение рака предстательной железы и рака гортани.
В некоторых случаях ЛТ является лишь частью плана лечения пациента. В тех случаях, когда облучение при раке назначается после хирургической операции, оно называется адъювантным.
Например, женщине лучевая терапия может быть назначена после органосохраняющей операции на молочной железе. Это позволяет полностью излечить рак молочной железы и сохранить анатомию груди.
Кроме этого, возможно проведение радиотерапии до хирургического вмешательства. В таком случае она носит название неоадъювантной или индукционной и позволяет улучшить показатели выживаемости или облегчить для хирурга проведение операции. Примерами такого подхода служит облучение при раке пищевода, прямой кишки или легких.
В некоторых случаях перед хирургическим удалением рака ЛТ назначается пациенту совместно с химиотерапией. Комбинированное лечение позволяет уменьшить объем оперативного вмешательства, который мог бы потребоваться в противном случае. Например, некоторым пациентам, страдающим раком мочевого пузыря, при одновременном назначении всех трех методов лечения удается полностью сохранить данный орган. Возможно одновременное проведение химиотерапии и радиотерапии без хирургического вмешательства с целью улучшения местного ответа опухоли на лечение и уменьшения выраженности метастазирования (распространения опухоли).
В некоторых случаях, например при раке легких, органов головы и шеи или шейки матки, подобного лечения может оказаться вполне достаточно без необходимости проведения операции.
Поскольку излучение повреждает и здоровые клетки, очень важно, чтобы оно было прицельно направлено на область раковой опухоли. Чем меньше облучение воздействует на здоровые органы, тем меньше возможно негативное последствие лучевой терапии. Именно поэтому при планировании лечения используются различные методы визуализации (отображения опухоли и окружающих ее органов), что обеспечивает точную доставку излучения к опухоли, защиту рядом расположенных здоровых тканей и уменьшение выраженности побочных эффектов и осложнений радиотерапии впоследствии.
Более точное соответствие дозы излучения объему новообразования обеспечивает современный метод трехмерной конформной лучевой терапии под названием радиотерапия с модулированной интенсивностью (РТМИ). Данный метод облучения при раке позволяет безопасно подводить к опухоли более высокие дозы, чем при традиционной ЛТ. Нередко РТМИ используется совместно с радиотерапией под визуальным контролем (РТВК), что обеспечивает крайне точную доставку выбранной дозы излучения к злокачественному новообразованию или даже какой-либо определенной зоне внутри опухоли. Современные разработки в области радиологии в онкологии, такие как РТВК, позволяют подстраивать ход процедуры под особенности органов, склонных к движению, например легких, а также под опухоли, которые расположены близко к жизненно важным органам и тканям.
К другим методикам ультраточной доставки излучения к опухоли относится стереотаксическая радиохирургия, в ходе которой для определения четких координат новообразования используется трехмерная визуализация. После этого прицельно наведенные рентгеновские или гамма-лучи сходятся на опухоли с целью ее уничтожения. Методика «Гамма-нож» использует кобальтовые источники радиоактивного излучения для фокусировки множества лучей на небольших зонах. В ходе стереотаксической лучевой терапии для доставки излучения к головному мозгу также используются линейные ускорители заряженных частиц. Подобным образом возможно лечение опухолей и других локализаций. Такая лучевая терапия называется экстракраниальная стереотаксическая радиотерапия (или СР тела). Особую ценность данный метод представляет при лечении опухолей легких, рака печени и костей.
Лучевая терапия также используется для уменьшения притока крови к опухоли, расположенной в богатых сосудами органах, например, печени. Так, в ходе стереотаксической хирургии применяются особые микросферы, наполненные радиоактивным изотопом, которые закупоривают кровеносные сосуды опухоли и вызывают ее голодание.
Помимо способа активного лечения рака, радиотерапия также является паллиативным методом. Это означает, что ЛТ позволяет облегчить боль и страдание пациентов с прогрессирующими формами злокачественных новообразований. Паллиативное облучение при раке улучшает качество жизни пациентов, испытывающих сильные боли, затруднение при передвижении или приеме пищи на фоне растущей опухоли.
Лучевая терапия (или радиотерапия, радиационная терапия) - метод лечения онкозаболевания с помощью ионизирующей радиации. Относится к видам местного воздействия на опухоль. Лучевая терапия проводится на специальном оборудовании в виде медицинского линейного ускорителя, подающего в заранее обозначенную область воздействия направленный поток элементарных частиц.
Под воздействием потока элементарных частиц необратимо разрушается структура ДНК агрессивных злокачественных клеток, что препятствует их дальнейшему делению. Именно активные быстро делящиеся раковые клетки больше подвержены ионизации и быстрее погибают в результате облучения по сравнению со здоровыми тканями. ДНК раковой клетки также нарушается опосредованно во время лучевой терапии - за счет радиолиза воды и изменений цитоплазмы клетки, не совместимых с ее жизнедеятельностью.
Современное медицинское оборудование позволяет усилить эффективность терапии за счет более узкого, точного и мощного концентрированного направления луча с ионными частицами в пораженную раком зону, что позволяет максимально сберечь здоровые ткани.
В зависимости от цели лечения и индивидуальных характеристик заболевания, могут использовать следующие типы ионизирующей радиации:
Воздействовать на опухоль с помощью луча можно тремя способами:
Схема лечения зависит от стадии, вида, локализации опухоли и цели процедуры. Первичное курсовое лечение обычно длится от 2 недель до 7 недель с проведением процедуры до 5 раз в неделю. Сам сеанс облучения составляет от нескольких минут до 45 минут. В случае вспомогательного лечения при неоперабельных опухолях или в добавление к другим видам лечения (химиопрепаратами или хирургической операции) могут назначать разовые процедуры. Лучевая терапия может проводиться и в профилактических целях.
Лучевая терапия применяется в лечении новообразований различной этиологии. Например, при раке мозга, молочной железы, шейки матки, желудка, гортани, легкого, поджелудочной железы, простаты, позвоночника. Хорошо поддаются воздействию опухоли кожи и саркома мягких тканей. Можно лечить радиолучом лимфому и лейкемию.
В результате облучения могут пострадать здоровые ткани и возникнуть местные реакции. Такие последствия облучения называют локальными.
К ним относят: сухость и шелушение кожи, повышенную ломкость сосудов в месте облучения, мелкоочаговые кровоизлияния, лучевые ожоги кожи вплоть до образования язв.
Системные последствия обусловлены распадом опухоли после облучения и общей интоксикацией организма продуктами распада. В таком случае появляются слабость, утомляемость, тошнота и рвота, часто выпадают волосы, становятся ломкими ногти, меняются показатели крови, происходит угнетение кроветворения. Все проявления носят временный характер и проходят по мере восстановления организма.
Побочные явления и неприятные последствия лучевой терапии можно минимизировать, если тщательно придерживаться рекомендаций врачей, соблюдать режим питья и питания, носить одежду свободного кроя из натуральных тканей и др.
Рентгенотерапия — это медицинская дисциплина, изучающая теорию и практику применения рентгеновского излучения с лечебной целью.
Является частным разделом лучевой терапии, при котором с лечебной целью используется рентгеновское излучение с энергией от 10 до 250 кВ. С увеличением напряжения на рентгеновской трубке увеличивается энергия излучения и вместе с этим его проникающая способность в тканях возрастает от нескольких миллиметров до 8—10 см.
Использование рентгенотерапии началось в 1897 г., однако научные основы рентгенотерапия получила только с развитием физики, дозиметрии, радиобиологии и накоплением клинического опыта. Рентгенотерапия при напряжении от 160 до 250 кв до 50-х годов нашего столетия была единственным методом дистанционного облучения глубоко расположенных патологических процессов как воспалительного и дистрофического характера, так и злокачественных опухолей. Однако, при раке внутренних органов, характеризующемся малой радиочувствительностью и требующем для своего разрушения больших доз излучения (в пределах 60—70 Гр), рентгенотерапия оказалась малоэффективной.
Различают рентгенотерапию глубокую или ортовольтную (расстояние фокус — кожа 30 см и больше) и близкофокусную (расстояние фокус — кожа 7,5-20 см).
Рентгеновское излучение, генерируемое в рентгеновских трубках при помощи высоковольтных электрических аппаратов, при воздействии на ткани и органы тела человека вызывает подавление функций отдельных клеток, угнетение их роста, а в ряде случаев и их деструкцию. Эти явления оказываются следствием поглощения и рассеяния— первичных физических процессов взаимодействия рентгеновского излучения с биологической средой. За первичными физическими следуют физико-химические и биохимические процессы, определяющие развитие терапевтического эффекта. Особенностью рентгеновского излучения является его непрерывный энергетический спектр, в котором присутствуют кванты излучения с любыми энергиями, вплоть до максимального значения, соответствующего наибольшему напряжению генерирования. Последнее в настоящее время в рентгенотерапии обычно не превышает 250 кВ.
Для получения однородного пучка используют фильтры, поглощающие мягкие лучи. Для излучений малой энергии применяют фильтры из легких металлов (алюминий, латунь толщиной 0,5—6 мм). Для излучений больших энергий (180—200 кВ) однородность излучения достигается применением фильтров из тяжелых металлов (цинк, медь толщиной 0,5—2 мм).
Для ограничения поля облучения и удобства центрации при рентгенотерапии применяют цилиндрические или прямоугольные тубусы, обеспечивающие необходимое для каждого конкретного больного кожно-фокусное расстояние. Выходное окно тубусов аппаратов для короткофокусной рентгенотерапии имеет диаметр до 10 см и для глубокой площадь 16—400 см2.
Лечебный эффект рентгенотерапии связан с поглощенной дозой излучения в области патологического очага. Величина оптимальной поглощенной дозы, ее дробление, ритм облучения обусловлены в каждом случае характером патологического процесса. На степень сопутствующих реакций окружающих патологический очаг здоровых тканей и органов, а также реакций всего организма влияет величина интегральных доз в этих отдельных анатомических структурах и во всем теле больного.
Эффекты воздействия рентгенотерапии не однозначны для разных гистологических структур, что связано с различной чувствительностью последних к ионизирующему излучению.
Однако чувствительность облучаемых тканей в организме человека зависит и от ряда других многочисленных факторов — возраста, пола, температуры тела и облучаемого участка, локализации последнего, его гидрофильности, кровоснабжения, кислородного насыщения, его функциональной активности, интенсивности обменных процессов и мн. др., в том числе и от исходного состояния, а также реактивности организма. На биологические эффекты рентгенотерапии влияет характер распределения дозы облучения во времени. Дробное облучение по сравнению с однократным оказывается менее повреждающим. В этом случае лучше выявляется дифференциальная чувствительность тканей и так называемый терапевтический интервал — разница в чувствительности нормальных и патологических гистоструктур.
Рентгенотерапия может вызывать различные эффекты. В зависимости от величины поглощенной дозы излучения, ритма облучения, объекта воздействия, характера и стадии заболевания и, наконец, реактивности организма больного могут иметь место противовоспалительные, десенсибилизирующие, деструктивные, анальгезирующие и другие эффекты. В связи с расширением возможностей использования высокоэнергетических источников излучения рентгенотерапии применяется преимущественно при сравнительно неглубоком расположении патологического очага и при возможности применения небольших доз излучения.
Рентгенотерапия является эффективным методом лучевого лечения в различных областях медицины: онкологии, дерматологии и косметологии, травматологии и ортопедии.
Для лечения поверхностных злокачественных новообразований базальноклеточного и плоскоклеточного рака кожи, начальных стадий рака губы и рака вульвы близкофокусная рентгенотерапия является методом выбора и имеет ряд преимуществ перед хирургическими методами лечения. При большем распространении процесса ренгенотерапия сочетается с дистанционными методами лучевой терапии.
Близкофокусная рентгенотерапия является самостоятельным радикальным методом лечения предраковых заболеваний (старческая кератома, болезнь Боуэна, кожный рог, лейкоплакия и т.д.), ряда дегенеративных воспалительных и гипертрофических заболеваний кожи (синдром Дюпюитрена, подошвенный фиброматоз, келоидные рубцы, бородавки и кондиломы, дерматологические заболевания, в том числе псориаз, грибовидные микозы, экземы, нейродермиты).
Рентгенотерапия применяется при лечении гинекомастии, послеоперационной лимфореи, является высокоэффективным методом лечения дегенеративных и воспалительных заболеваний (невралгии и невриты лицевого нерва, плечевого сплетения, пояснично-крестцовый радикулит, артрозы).
Рентгенотерапия может применяться также при некоторых неспецифических дегенеративно-дистрофических и воспалительных процессах костно-суставного аппарата, сопровождающиеся реактивным воспалением мягких тканей и выраженным болевым синдромом.
Хороший результат получают при рентгенотерапии острых воспалительных процессов, при использовании малых разовых доз порядка 0,1—0,15 Гр и суммарной дозы не превышающей 1 Гр - рекомендуется только в ранних стадиях острых воспалительных заболеваний и в случаях отсутствия других равноценных способов лечения или при неэффективности последних у лиц старше 40 лет. При неопухолевых заболеваниях у детей рентгенотерапию применять не следует.
Рентгенотерапия должна применяться только при наличии научно обоснованных показаний к такому лечению и только у больных с безупречно доказанным заболеванием.
Возможность применения различных режимов фракцирования дозы облучения делает этот метод применимым для лечения даже очень пожилых пациентов.
Возможно применение 1-2 сеансов облучения с интервалом в несколько недель или 5-10 сеансов через день в течение 3 недель, а также иные варианты.
В радиотерапевтическом отделении ГБУЗ ТОКОД с 2 июня 2015 года рентгенотерапия проводится на современной рентгено-терапевтической установке XTRAHL 200 (Великобритания).
Система XTRAHL 200 идеально подходит как для близкофокусной рентгенотерапии поверхностных кожных новообразований, так и для ортовольтной терапии вторичных поражений, в том числе и костных метастазов.
Показания для рентгенотерапии:
Противопоказания к рентгенотерапии могут быть абсолютными и относительными.
Абсолютные противопоказания.
Относительные противопоказания.
| Массивная базалиома до облучения у 90 летней женщины, которой было отказано в оперативном лечении. | Та же базалиома через несколько недель после облучения. Опухоль ликвидирована, оставшаяся рана превратится в белый рубец в течение полугода. |
В большинстве случаев рентгенотерапия не вызывает системных последствий. Большая часть побочных эффектов обусловлена реакцией кожи, которая проявляется в виде эпидермита. Сначала во время каждого сеанса возникает отек, покраснение, зуд. По мере продолжения лечения симптомы становятся более выраженными и достигают максимума к третьей неделе терапии и проходят через 1 – 1,5 месяца после ее окончания.
На пораженном участке кожи образуются пузырьки, заполненные экссудатом. Они лопаются, открывая воспаленный эпидермис ярко-красного цвета. Это служит воротами для патогенной флоры, и при несоблюдении рекомендаций врача присутствует развития бактериальной инфекции. Также отмечают появление ранок, покрытых корками.
Чувствительность кожи к излучению зависит от множества факторов.
Это: локализация опухоли, передняя поверхность шеи более восприимчива к радиационному воздействию, чем кожа крыльев носа и других участков лица, затылка; температура воздуха, в жаркую погоду кровоснабжение эпидермиса улучшается, что повышает риск развития последствий лечения, в холода такая вероятность снижается; лишний вес, было доказано, что кожа тучных людей в большей степени восприимчива к действию излучения; трещины, царапины увеличивают проницаемость эпидермиса; возрастные изменения.
Опасным последствием такого лечения служит лучевая язва. Под воздействием радиоактивных изотопов нарушается микроциркуляция в кровеносных сосудах, расположенных под кожей. Риск осложнений возрастает пропорционально глубине проникновения патологического процесса и силе облучения.
О начале язвенных изменений в коже свидетельствуют такие симптомы: сухость и шелушение; исчезновение поверхностного рисунка эпидермиса; появление сосудистых «звездочек»; нарушение пигментации.
Если опухоль расположена возле слизистых оболочек носа или рта, может возникнуть их воспаление – мукозит. Для него характерны сухость эпителия, появление жжения и болезненности при касании. Однако такие последствия встречаются нечасто. При лучевом лечении опухоли в области глаз отмечают рецидивирующий конъюнктивит.
Долгосрочные осложнения лучевой терапии
Со временем кожа, попавшая под воздействие излучения, становится тоньше, под ней заметна сосудистая сетка. Через год – полтора после окончания лечения возможно появление более светлых или, наоборот, темных участков эпидермиса. Выраженность этих признаков зависит от продолжительности лечения, полученной в итоге терапии дозы облучения, площади воздействия. Стоит отметить, что лучевая язва, о которой шла речь выше, может также появиться спустя несколько месяцев после окончания курса лечения.
Самым опасным последствием является высокий риск развития более тяжелой, злокачественной формы рака кожи – плоскоклеточного. По этой причине облучение нежелательно для пациентов моложе 50 лет. Также из-за риска возникновения осложнений подобный метод лечения не применяется при рецидивах базалиомы. После воздействия радиационного излучения на волосистую область отмечают выпадение волос. Со временем они отрастают, но становятся ломкими, тусклыми, их окраска более блеклая.
При лечении опухолей, расположенных на коже лица вблизи глаз, может возникнуть катаракта. Насколько высок риск подобного заболевания неизвестно, так как на сегодняшний день пороговая доза облучения хрусталика не установлена. Из-за рубцевания тканей после разрушения клеток новообразования ограничивается их подвижность, что оказывает влияние на мимику. Также происходят изменения в работе сальных и потовых желез в области воздействия излучения.
Профилактика осложнений
Больного предупреждают, что перед началом курса лечения (также и во время него) следует беречь кожу от повреждений. Кроме того, рекомендуется придерживаться таких правил:
защищаться от прямых солнечных лучей, не посещать солярий, выходить на улицу в одежде с длинным рукавом, лицо закрывать широкополой шляпой, открытые участки кожи мазать специальным кремом;
нельзя растирать кожу, попавшую под облучение, массировать, ставить банки, прикладывать горчичники, обрабатывать антисептиками и спиртовыми растворами (йодом, зеленкой, перекисью) без назначения доктора;
гигиенические процедуры следует проводить с осторожностью, чтобы не смыть нанесенные врачом отметки, определяющие область лучевого воздействия;
запрещено делать компрессы, ставить грелку;
перед применением ароматизированного мыла или геля для душа, пены для ванн, дезодоранта, крема следует в обязательном порядке проконсультироваться с врачом, средства декоративной косметики (если они разрешены) необходимо смывать за 4 часа до сеанса лучевого лечения базалиомы;
для профилактики бактериальной инфекции стоит ограничить посещение таких общественных мест, как бассейны или бани.
Лучевая терапия – это серьезная нагрузка на организм. Поэтому при появлении любых беспокоящих симптомах необходимо обратиться за консультацией к своему лечащему врачу или медсестре. Также лучше согласовывать с ними изменения в питании, климате. Стоит помнить, что опасность последствий лучевого лечения и рентгенотерапии сохраняется всю оставшуюся жизнь.
В сравнении со статистикой десятилетней давности, рак молочной железы значительно «помолодел». Статистика гласит, что в европейских странах каждая 10 женщина сталкивается с онкологией. В России болезньдиагностируют у 49 000 женщин. Половина случаев с летальным исходом. Эффективность лечения зависит от своевременности диагностики, стадии, вида онкологии.
Чтобы успешно избавиться от заболевания, важно заботиться о своем здоровье, периодически проводить самообследование, обращать внимание на симптомы онкологии груди, при малейшем подозрении обращаться к врачу. Если рак молочной железы обнаружен на 1 стадии, вероятность выздоровления составляет 90%. Не следует забывать о том, что рак коварен и в начале своего развития протекает без явных признаков.
Невозможно достоверно определить отчего возник рак в том или ином случае. Однако существуют факторы риска, приводящие к заболеванию.
К тому же, к факторам риска относятся вредные привычки, избыточное потребление жиров, аборты, длительный прием эстрогена.
Первые симптомы опухоли молочных проток нередко обнаруживаются при самодиагностике.
Во время медицинского обследования нужно обратить внимание на такие показатели:
Если врачи обнаружили образование непонятной этиологии или присутствуют настораживающие признаки, следует посетить маммолога. После мануального обследования органа на предмет симптомов РМЖ, специалист назначит дополнительные процедуры, в их числе маммография и дуктография (с применением контрастного вещества), УЗИ. Возможно, опухоль доброкачественная или находится на начальной стадии. Чтобы дать ответы на эти вопросы, проводят биопсию с исследованием материала, назначают анализы на онкомаркеры.
Эффективность лечения во многом зависит от своевременной диагностики. Фото рака молочной железы 3 стадии позволит узнать как выглядит болезнь.
Классификация рака молочной железы начинается с нулевой стадии. Обозначается как рак молочной железы t2n1m0 прогноз благоприятный. Это неинвазивная онкология, означает что раковые клетки не обнаружены за пределами образования.
Врачи иногда называют опухоль «невинной» или «местной». Предлагают женщинам плановое наблюдение или ограничиваются удалением. Стандарты европейских стран придерживаются таких тактик лечения:
Турецкие специалисты предлагают эффективное устранение недуга на нулевой стадии. Используются инновационные методы, в числе которых иммунотерапия, лечение стволовыми клетками, TrueBeam и другие. При своевременном обращении выживаемость достигает 95-98%. Женщины быстро восстанавливаются и возвращаются к привычному образу жизни.
Если у женщины 1 стадия рака груди прогноз благоприятный. Это инвазивная онкология, при которой раковые клетки проникли в соседние ткани. Опухоль достигает 2 сантиметра, но при пальпации трудно прощупывается.
Высокую эффективность показала химиотерапия при раке молочной железы. Кроме того, используют:
Специалисты сходятся во мнении, что в начале заболевания онкопатология не имеет ярко выраженных симптомов. Чтобы обнаружить болезнь, нужно регулярно проводить самодиагностику. Тревожный звонок — изменение с одной стороны.
На 2 степени рака молочной железы опухоль достигает 5 сантиметров в диаметре, патогенные клетки проникают в лимфоузлы, окружающие железу. Обязательная процедура — хирургическое вмешательство. Кроме того, проводятся органосохраняющие операции, в их числе удаление груди (мастэктомия).
Решение принимается лечащим врачом на основе обследований. Если метастазы проникают в лимфатические узлы, их удаляют. На 2 стадии лечения РМЖ показана химиотерапию до и после операции, а также лучевая терапия. По результатом американских исследований пятилетняя выживаемость — от 75-80%.
2а степень
Характеризуется наличиемопухоли, достигающей в диаметре 2 сантиметров с поражением лимфатической системы, либо 5 сантиметров без вовлечения других тканей. Еще один вариант — пораженные лимфоузлы без обнаружения раковых клеток в молочной протоке. Прогноз благоприятный — при своевременной диагностике выживаемость 93%.
2b степень
Характеризуется наличием опухоли более 5 сантиметров в диаметре без поражения подмышечных лимфоузлов либо новообразование размером 2-5 сантиметров с проникновением в лимфатическую систему.
3 стадия рака молочной железы тоже подразделяется на 2 категории. Первая представляет собой опухоль больше 5 сантиметров и большим количеством патогенных клеток в лимфоузлах. При 3б стадии рака молочной железы новообразование может быть разных размеров с разрастанием на кожу, грудную клетку.
План манипуляций определяется совместно в врачом, радиологом, химиотерапевтом, пластическим хирургом. На способ лечения влияет размер новообразования, наличие метастазов и общее состояние пациентки. Высокую эффективность показала химиотерапия при раке молочной железы 3 стадии. Для устранения патологии требует комплексного подхода. Химиотерапевтическое, хирургическое лечение и применение лучевой терапии повышает шансы на выздоровление и предотвращение рецидивов.
Многих женщин интересует, излечим ли рак молочной железы 3 стадии. При правильной схеме лечения выживаемость составляет 72%. Пациентки могут счастливо прожить более 10 лет. Для предотвращения косметического дефекта, турецкие специалисты проводят реконструкцию груди.
Рак молочной железы 4 стадии — это опухоль, распространившаяся за пределы органа, подмышечной впадины и лимфоузлов, расположенных на шее, печени и легких. РМЖ 4 стадия требует индивидуального подхода к лечению. Если работа печени и почек не нарушена, показана химиотерапия при раке молочной железы 4 стадии.
Кроме борьбы с основным недугом, практикуется поддерживающие манипуляции для всего организма. Также проводится таргетная и гормонотерапия. Если удалось подавить возникновение отдельных метастазов, есть смысл в удалении груди. Важную роль при онкологии молочной железы 4 степени имеют паллиативные способы лечения. Это снижает интоксикацию из-за распадающейся опухоли. Питание должно быть максимально полезным и содержать больше овощей.
Симптомы опухоли 4 степени:
Прогноз рака молочной железы 4 стадии менее благоприятный, чем в начале болезни. Выживаемость при онкологии с метастазами — 22%. Но и это не приговор, турецкие онкологи боятся за жизнь пациентов, им удается ее продлить и сделать максимально полноценной.
Первая стадия рака молочной железы поддается лечению, но чем дольше человек болеет и не обращается за помощью, тем сложнее избавиться от недуга. Классификация рака молочной железы поможет подобрать максимально эффективный способ борьбы.
Проводится двумя методами:
Хирург-онколог обсудит с пациентом оба метода, чтобы отдать предпочтение самому эффективному в конкретном случае. Мастэктомия показана если в груди обнаружено несколько очагов заболевания или диагностирован ген, предрасполагающий к онкологии.
Хирургическое вмешательство является обязательной составляющей в комплексе лечения наряду с иммунотерапией, химиотерапией. Чем раньше женщина обратиться за помощью, тем больше шансов на полное излечение и меньше объем операции. Хирургическое вмешательства рака молочной железы показано на 1 стадии, а также на 2, 3 и 4, в зависимости от состояния организма и развития болезни.
Химиотерапия эффективна на 1, 2 и 3 степени онкологии грудной железы. В основе лечения — прием противоопухолевых медикаментов. Терапию назначают не всем пациентам, но в некоторых случаев без нее не обойтись:
План разрабатывается индивидуально для каждой пациентки.
В ее основе ионизирующие излучение. Процедура показала высокую эффективность в послеоперационный период при карциноме молочной железы. Частичное облучение также практикуется при раке груди 1 степени. Зачастую, облучение проводится в комплектной терапии.
Четвертая стадия рака молочной железы, как правило, заканчивается полным удалением груди. После этой процедуры показана реконструкция. Онко-хирурги удаляют грудь частично или полностью. У женщины появляется возможность восстановить орган с помощью одной или нескольких операций.
Реконструкция показана высокую эффективность на 4 стадии рака молочной железы с метастазами, когда грудь сохранить не удается. Врачи удаляют опухоль вместе с окружающими тканями. При 1 степени процедура тоже показала высокую эффективность — удаляют очаг, сохраняя сосок и кожу. После этого можно установить имплант.
70% онкозаболеваний гормонозависимые. Не последнюю роль в возникновении заболевания сыграли прогестерон и эстроген. Именно поэтому гормонотерапия на 1 стадии показала хорошие результаты. Специальные препараты также принимают также для профилактики, чтобы предотвратить рецидив и в комплексе с другими способами лечения на разных стадиях болезни.
| Стадии | Причины опухоли | Симптомы | Способы лечения опухоли | Прогноз результата |
| Нулевая (начальная) | · Наследственность; · Возраст; · Травмы; · Стрессы; · Питание.
| Болезнь протекает бессимптомно. | Проводится операция лампэктомия с захватом здоровой ткани, лучевая и гормональная терапия. | Лишь 5% женщинам удается диагностировать онкологию. Выживаемость достигает 95-98%. |
| Рак 1 степень | Кроме вышеупомянутых факторов, пусковым механизмом часто является фиброаденома — доброкачественная опухоль. | · Безболезненная опухоль; · Втягивание кожи; · Изменение формы груди; · Деформация сосков; · Чувство дискомфорта. | Полное или частичное удаление груди, облучение, химиотерапия, курс гормональных препаратов. | Выживаемость 93%. |
| 2 | Если не лечить рак, он переходит во вторую. | · Увеличение груди; · При пальпации может прощупываться опухоль в молочных протоках. | Если у женщины рак молочной железы 2 степени лечение включает хирургическое вмешательство, химиотерапию, гормонотерапию, облучение. | Выживаемость 80-90%. |
| 3 | Болезнь переходит в 3 степень при несвоевременной диагностике или неправильном лечении. | · Кровянистые или другие выделения из сосков; · Кожа напоминает корку лимона; · Потеря веса. | Хирургическое вмешательство, гормоно-, химио- и лучевая терапия, реконструкция груди. | Выживаемость 67-72%. |
| 4 | Несвоевременное лечение. | · Нарушение симметрии; · Выделения из молочных проток; · Болевые ощущения; · Наличие опухоли; · Интоксикация; · Рвота, общая слабость; · Значительная потеря веса. | Обезболивающие мероприятия, лучевая, гормональная, химиотерапия, оперативное вмешательство. | Выживаемость 22%. |
Турецкие специалисты разрабатывают и успешно внедряют протоколы лечения на основе инновационных технологий для всех степеней рака молочной железы. Главное в успешном избавлении от болезни — правильная постановка диагноза. 30% пациентов приезжают в Турцию с неточным диагнозом, из-за чего невозможно начать правильное своевременное лечение. В Турции для постановки диагноза применяется современное высокотехнологическое оборудование.
Список клиник, которые принимают пациентов с онкологией:
Для бесплатной консультации, напишите нам в WhatsApp или свяжитесь в нами любым удобным для вас способом по номеру:+90533 194 59 90
Важно регулярно проводить самообследование груди, а при малейших проблемах со здоровьем проходить полное обследование организма. Высокую эффективность в этом вопросе показала диагностика чекап, проводимая турецкими специалистами.
В целях профилактики онкологии, специалисты рекомендуют вести здоровый образ жизни, избегать стрессов, проверить генетическую предрасположенность к болезни, избегать радиоактивного излучения, уделить внимание питанию.
 Как известно, лучевая терапия успешно используется в онкологии уже более 80 лет. Благодаря успехам ядерной физики, созданию новых источников излучения, дозиметрии, а также достижениям клинической радиологии в лучевом лечении опухолевых заболеваний удалось достигнуть существенного прогресса.
Как известно, лучевая терапия успешно используется в онкологии уже более 80 лет. Благодаря успехам ядерной физики, созданию новых источников излучения, дозиметрии, а также достижениям клинической радиологии в лучевом лечении опухолевых заболеваний удалось достигнуть существенного прогресса. Побочные явления при лучевом воздействии наблюдаются как во время лучевого лечения, так и после его окончания.
Последствия лучевой терапии, вызывающие нарушения питания, зависят от подведенной дозы излучения, объема облученных тканей и месторасположения опухоли (например, полость рта, пищевод, желудок, печень, брюшная полость).
Непосредственно во время облучения наиболее часто отмечается тошнота, рвота, ухудшение аппетита, жидкий стул, реакции со стороны слизистой полости рта, пищевода, кишечника.
Отсроченные побочные явления могут возникать спустя месяцы и годы от окончания лучевой терапии и нередко отличаются особой тяжестью течения. В следующей таблице отражены непосредственные и отсроченные побочные явления лучевой терапии, вызывающие изменения в питании.
Главным методом лечения непосредственных и поздних лучевых повреждений является лекарственная терапия. Однако для смягчения указанных изменений очень важным является полноценное питание. Вопрос о том, какие продукты усиливают защиту организма от лучевого воздействия, окончательно еще не решен. Тем не менее, роль диетотерапии в уменьшении отрицательных последствий несомненна.
Одной из наиболее чувствительных областей организма являются полость рта и гортаноглотка. Будучи подвергнуты лучевой терапии, больные с таким расположением опухоли особенно страдают от проявлений лучевых реакций, а их родственники от изменившегося не в лучшую сторону характера полуголодного пациента.
При лучевой терапии опухолей лица и шеи может отмечаться сухость во рту, першение в горле, боли при глотании, осиплость голоса, потеря аппетита. Для предотвращения усиления подобных реакций рекомендуется не употреблять острую, соленую, кислую и грубую пищу. Полезна пища, приготовленная на пару, вареная, измельченная или протертая.
Питание должно быть частым и небольшими порциями.
Рекомендуется употреблять больше жидкости (кисели, фруктовые компоты, отвар шиповника. некислый клюквенный морс). Для уменьшения сухости и першения в горле используется отвар ромашки, календулы, мяты. Рекомендуется закапывать в нос масло облепихи на ночь. Днем принимать несколько ложек растительного масла натощак.
При облучении полости рта основная задача питания заключается в том, чтобы снизить по возможности побочные явления радиации и предупредить их дальнейшее развитие. Для профилактики инфекции необходима тщательная гигиена, которая достигается полосканием рта 3%-ным раствором теплой перекиси водорода (2/3 чашки перекиси, смешанной с 1/3 чашки теплой воды) или однопроцентным раствором соды, минеральными щелочными водами.
Обязательно следует прекратить курение и употребление алкоголя, чтобы избежать раздражения чувствительных тканей полости рта (к сожалению, эти привычки широко распространены среди пациентов с опухолями головы и шеи).
Большое внимание следует уделять профилактическому уходу за зубами. Перед лечением весьма целесообразно провести санацию полости рта, проконсультироваться у зубного врача для определения необходимости лечения или удаления зубов. Зубы должны систематически обрабатываться фторсодержашей пастой. Зубы следует чистить мягкой зубной щеткой. При болях в полости рта рекомендуется пища мягкой консистенции, способствующая облегчению процесса глотания.
Во избежание истощения желательно увеличить количество белков и калорий. В рацион должны быть введены протертое тюбиковое питание, готовые мясные, овощные и фруктовые смеси для детского питания.
Приведем ряд практических рекомендаций, если возникает боль при пережевывании пищи:
А теперь ознакомьтесь с рекомендациями для лечения последствий лучевой терапии пищевода — они могут вам понадобиться.
Воспалительные и язвенные изменения пищевода могут возникать вследствие лучевой терапии этого органа, а также облучения легких, позвоночника, средостения. Выраженные токсические реакции объясняются высокой чувствительностью пищевода к лучевому воздействию. Побочные явления особенно усиливаются при сочетанном применении лучевой и химиотерапии. Послелучевое поражение слизистой оболочки пищевода обычно возникает через 2—3 недели после окончания лучевой терапии и без специального лечения может продолжаться длительное время. Но даже за короткий период это осложнение приводит к потере веса, а при выраженной лучевой реакции — к истощению.
Основными признаками лучевого повреждения пищевода являются боли и затруднения при прохождении пищи. Применение обезболивающих и анестезирующих средств уменьшает болевой синдром и облегчает прием и проглатывание пищи. С этой целью можно применять альмагель А по столовой ложке 3 раза в лень до еды либо раствор новокаина.
Для улучшения прохождения пищи особенно полезны облепиховое масло, шиповниковое или красное пальмовое масло. Необходимо повышенное потребление витаминов Е и А. Последний содержится в рыбьем жире. Лечебное питание при лучевых реакциях пищевода напоминает диету, рекомендованную при изменениях полости рта и гортаноглотки, вызванных лучевой терапией (см. выше).
При облучении опухолей органов брюшной полости может отмечаться потеря аппетита, снижение веса, тошнота и рвота, понос, боли. При облучении органов малого таза побочные эффекты проявляются в тошноте, потере аппетита, поносе, нарушении мочеиспускания, болях в прямой кишке, сухости влагалища и выделениях.
Для устранения этих явлений рекомендуется диетическое питание. Число приемов пищи следует увеличить. Пища должна быть отварной или приготовленной на пару. Не рекомендуются острые, копченые, соленые блюда. При вздутии живота следует отказаться от молочных продуктов, рекомендуются протертые каши, супы, кисели, паровые блюда, пшеничный хлеб. Потребление сахара следует ограничить. Сливочное масло рекомендуется класть в готовые блюда.
При облучении органов брюшной полости непосредственные и отсроченные побочные явления отмечаются у 35—60% больных и выражаются в болях в животе, тошноте, рвоте, метеоризме и жидком стуле. Использование традиционно применяемых при желудочно- кишечных нарушениях лекарств позволяет свести к минимуму острые побочные явления. Облегчение достигается приемом внутрь противорвотных средств, спазмолитиков и антидиарейных препаратов. Полезны также транквилизаторы (успокаивающие средства).
Рекомендуется специальная безшлаковая диета, свободная от молока и молочных продуктов.
Терапевтическое действие этой диеты направлено на максимальное механическое и химическое щажение слизистой оболочки желудка и кишечника, на предупреждение и устранение в нем воспалительных и бродильных процессов.
Из первых блюд преобладают суп-лапша на бульоне из нежирной курицы, суп картофельный с мелко шинкованными овошами на нежирном мясном бульоне, некрепкий бульон из нежирной рыбы с рыбными фрикадельками.
Из вторых блюд наиболее приемлемыми являются отварная говядина. отварной язык, отварная курица, рагу из отварного мяса. Блюда и гарниры из овощей предлагаются следующие: отварной картофель со сливочным маслом, картофельная запеканка с отварным мясом, морковное пюре со сливочным маслом, пюре из отварных кабачков, перец, фаршированный отварным мясом и рисом.
В целях механического щажения кишки из рациона следует полностью исключить овощи и фрукты, кроме специальных детских консервов. Все блюда приготовлять в протертом (пюреобразном) виде, сваренными на воде или на пару.
Внимания и контроля требует потребление жидкости, минеральных солей и витаминов, чтобы своевременно скоррегировать водный и минеральный обмен, не допустить авитаминоза, предупредить возникновение инфекционных процессов. Показаны витаминно-минеральные комплексы. Особенно необходим витамин Е (токоферол).
При облучении малого таза могут возникать циститы, характеризующиеся болезненным и учащенным мочеиспусканием. Общее состояние больных при этом, как правило, не нарушается; температура тела нормальная или слегка повышенная.
С профилактической целью рекомендуются масляные микроклизмы с ромашкой. Также неплохо употреблять почечный чай, ибо развитие постлучевых циститов также не редкость. Такое фитосопровождение вполне разумно. Существенную роль в лечении постлучевых циститов играет лекарственная терапия, назначаемая врачом.
Противовоспалительное лечение дополняется диетотерапией. При послелучевых циститах хорошо помогает диета, не содержащая соли, концентрированных белков (мясо, творог, сыр, рыба, фасоль и т.п.), очищенных крахмалов (очищенный картофель, хлебобулочные изделия из муки высшего сорта) и искусственных Сахаров (сладости, конфеты, сладкие напитки, типа колы и т.п.).
Лучше всего употреблять свежие овощи, побольше свсжевыжатых овощных соков и каши из цельной крупы. Специалисты рекомендуют пить побольше клюквенного сока (можно подслащивать только свежим яблоч-ным соком). Практика показывает, что при цистите очень полезно ежедневно принимать до 500 мг натурального витамина С (он подавляет инфекцию), который в изобилии содержится в клюквенном соке (он обладает и другими полезными свойствами, например, вяжущим вкусом, который помогает устранять различные воспаления).
Считается, что вещества, содержащиеся в клюквенном соке, изменяют состав мочи, и она становится менее подходящей для нежелательных бактерий. А израильские ученые обнаружили еще одно положительное свойство клюквенного сока. В нем содержится компонент, который защищает клетки мочеиспускательного канала от проникновения болезнетворных бактерий.
Из питания желательно исключить острые и жирные блюда. Ешьте больше фруктов и овощей. ведь «насыщение» витаминами также немаловажно. Из рациона желательно исключить продукты. вызывающие раздражение мочевых путей: лук, чеснок, редьку, редис, хрен, шпинат, щавель, крепкие бульоны из мяса, рыбы, грибов, пиво и крепкие алкогольные напитки. Запрещается употребление острых блюд, соусов, солений, приправ, консервов. копченостей. Назначают обильное питье: молоко, чай с молоком, теплый некислый компот, минеральные вод.
Рекомендуются овощи, фрукты, молочные продукты. Особенно полезны арбузы, дыни. Диетологи считают, что хорошим помощником при лечении циститов являются дикорастущие ягоды: брусника, голубика, морошка, черника. При приготовлении блюд следует ограничить употребление соли.
Полезно применение трав — почечный чай, толокнянка, кукурузные рыльца. В анализе мочи следует обращать внимание на кислотность: при кислой реакции мочи назначают ощелачивающую диету, при щелочной реакции — подкисляющую.
Опухоли прямой кишки считаются чувствительными к лучевому воздействию. Лучевая терапия назначается довольно часто и может вызвать повреждения прямой кишки. Рекомендуют диету, включающую молоко, сливки, сметану и другие продукты, щадящие кишечник: жидкая часть овощных супов, яйца всмятку, кисели, желе, отварное мясо и рыба, фруктовые соки.
Врач может назначить микроклизмы из отваров вяжущих растений (ромашки, коры дуба и др.) или масла шиповника и облепихи. При запорах наиболее целесообразно использовать растительное и вазелиновое масло, настой александрийского листа. Употребление чернослива для регуляции функции кишечника при послелучевых повреждениях прямой кишки нежелательно.
Рак шейки матки является одним из немногих видов рака, для которых доступен эффективный скрининг. Мы можем обнаружить болезнь даже не на ранней стадии развития рака, а на предраковой стадии, т.е. когда клетки еще не злокачественные, но мы уже знаем, что они станут.Процесс рака шейки матки развивается не быстро, а занимает годы. Отсюда при раке шейки матки стоит использовать скрининговые тесты, т.е. обследование женщин без симптомов заболевания. Этот метод является цитологическим: он дешевый, безболезненный и общедоступный. Но проблема в Польше с отчетностью для этого исследования. В других странах скрининг такой же, как в Польше, или организован несколько иначе. Иногда этот тест становится частью страховки, что может больше мотивировать женщин пройти мазок Папаниколау.Если 100 процентов женщин в возрасте риска (25-59 лет) в Польше пройдут цитологическое исследование, рак шейки матки станет редким видом рака и не будет социальной проблемой. В других странах организация скрининга иная, и информированность населения также выше, следовательно, отчетность по тестированию выше.
Итак, организация скрининга в Польше не очень хорошая.
В нашей стране скрининг носит конъюнктурный характер, что означает отсутствие обязанности проходить тест и никаких последствий в случае его невыполнения.Женщинам предлагается пройти скрининг, и они сами решают, проходить скрининг или нет. В результате отчетность составляет 25-30 процентов. В случае болезни система гарантирует женщине полную онкологическую помощь, а лечение всегда стоит очень дорого. В системах частного страхования граждане несут более высокие страховые расходы, например, в скандинавских странах. Несмотря на то, что в Дании нет обязательного мазка Папаниколау, осведомленность о заболевании высока, и поэтому на обследование приходит в несколько раз больше женщин.
Диагностика рака шейки матки также оставляет желать лучшего. Она отвлечена. Как это затрудняет обнаружение?
Диагностика рака шейки матки в Польше проходит в несколько этапов. Первый этап – цитология. Если цитология окажется неверной, следует провести более референтное исследование – кольпоскопическое исследование. Таким способом врач диагностирует изображение шейки матки. Этот этап программы скрининга до сих пор оставался на усмотрение самих женщин.Конечно, были центры, которые проводили эти анализы, но они не были включены в программу скрининга, т.е. фактически женщина с аномальной цитологией была предоставлена сама себе. И это серьезный барьер, потому что многие женщины не знают, куда идти, чтобы сделать еще один анализ. Особенно женщины из небольших городов и деревень, где Интернет не так распространен. Кроме того, существует длительный период ожидания экспертизы – часто много месяцев.
Онкологический пакет не улучшил ситуацию?
Нет и не улучшится, потому что даже если предположить, что он работает по плану, быстрый путь работает с момента подозрения на рак.Здесь только на основании кольпоскопического исследования и забора образца, на основании которого будет диагностировано новообразование, можно ожидать быстрого пути. Конечно, при подозрении на опухоль можно вставить карту DILO, но этап от цитологии до сбора образцов все еще является преднеопластическим этапом. Между тем кольпоскопия не всегда заканчивается взятием пробы. Это связано с тем, что цитология имеет высокий процент ложноположительных и ложноотрицательных результатов. Это означает, что женщины с отклонением от нормы цитологических результатов (группа III и выше) могут оказаться полностью здоровыми при проведении кольпоскопии.Только когда у врача возникают подозрения на рак после проведения кольпоскопии, он берет образец.
На какой стадии диагностируют рак шейки матки в Польше?
Более чем в половине случаев выявляется в далеко зашедшей, неоперативной стадии, в остальных поддается хирургическому лечению. Операция не означает 100% шанс на излечение, если только это не очень ранняя стадия рака. Неоперабельный рак на более высоких стадиях развития с большей вероятностью дает метастазы, что значительно снижает шансы на выздоровление.Таким образом, лечение менее эффективно, чем в случае раннего рака, но все же эффективно на 30-70%. случаи. Отсюда важно, кто анализирует взятый образец, а в случае рака определяет стадию заболевания и состояние больного, так как от этих факторов зависит метод лечения. Это должен быть гинеколог-онколог.
Рак шейки матки можно лечить либо хирургическим путем на ранних стадиях, либо облучением на более поздних стадиях, но локализованным в тазу, либо химиотерапией, если диагноз поставлен на поздней стадии, когда уже присутствуют метастазы.Специализация в онкологической гинекологии была посвящена лечению рака у женщин. И именно гинеколог-онколог должен заниматься такими больными, ставить диагноз, направлять на дальнейшее лечение и наблюдать после лечения.
Что такое хирургическое лечение?
Рак шейки матки — это заболевание, которое классически лечится на стадиях IA1, IA2, а также IB1 и IIA1 путем гистерэктомии с придатками или без них, и обычно с удалением лимфатических узлов — лимфаденэктомией (поскольку они являются потенциальным местом метастазирования рака), за исключением очень ранняя стадия.Лимфаденэктомия является одновременно и терапевтической — мы удаляем очаги метастазов, и диагностической — ищем метастазы в лимфатической системе, потому что они оправдывают следующий этап лечения — лучевую терапию. Если у пациента нет метастазов в лимфатические узлы, от лучевой терапии теоретически можно отказаться, а при появлении метастазов следует провести послеоперационное облучение. Поскольку рак шейки матки – это болезнь относительно молодых женщин, а в условиях старения общества и последующих решений о деторождении все больше женщин не имеют материнства или даже совпадают с заболеванием, был разработан метод лечения, сохраняющий фертильность женщин. с ранним раком шейки матки.Этот метод пока нельзя считать стандартным, поскольку нет веских научных доказательств того, что он столь же эффективен и достаточно безопасен, как в случае радикального удаления всей матки. Это метод, ограничивающийся резекцией шейки матки, оставлением стержня и удалением лимфатических узлов для диагностики возможных метастазов. К сожалению, в каталоге услуг НХФ такая процедура спасения не вошла. Таким образом, хотя щадящее лечение теоретически возможно, оно является дорогостоящим в связи с его сложностью, длительностью и трудностями.Однако я бы сказал, что к лечению с сохранением фертильности следует относиться как к экспериментальному методу, проводимому в специализированных онкологических центрах, и пациенты должны знать, что нет веских данных о его безопасности, т.е. ситуациях, при которых заболевание рецидивирует после такой операции. Однако этот метод наверняка будет набирать популярность, поскольку имеющиеся данные весьма обнадеживают к его использованию, а число женщин, желающих сохранить фертильность и имеющих рак шейки матки, будет увеличиваться.
Лучевая терапия имеет долгую историю лечения рака шейки матки.
Рак шейки матки был первым раком, который лечили с помощью ионизирующего излучения вскоре после открытия радия Марией Склодовской-Кюри. Ранее, вне зависимости от стадии прогрессирования, были попытки лечиться только хирургическим путем. Когда было замечено, что опухоль резко уменьшается под воздействием радиации, лечение радиоактивным радием оказалось эффективным и безопасным терапевтическим методом.Почему рак шейки матки так хорошо подходит для этого? Поскольку это опухоль, она развивается вокруг цервикального канала, куда может быть помещен радий. Вы можете точно определить местонахождение опухоли и безопасно облучить ее строго определенной дозой. Лучевая терапия может лечить это новообразование на любой стадии, но этот метод имеет несколько больше побочных эффектов, чем сама операция, поэтому хирургическое лечение рекомендуется на ранних стадиях прогрессирования. Однако следует помнить, что наличие метастазов в лимфатических узлах после операции является показанием к применению адъювантной лучевой терапии, т.е. дополнительного лечения с облучением органов малого таза у больных.Исследования показали, что больные с метастазами в лимфатические узлы живут дольше после облучения, а заболевание рецидивирует реже, чем если бы лечение было прекращено после операции. В случае неоперабельного рака шейки матки мы также используем лучевую терапию, чтобы полностью уничтожить болезнь.
Используется ли лучевая терапия после лечения для сохранения фертильности?
Нет. Метод с сохранением фертильности исключает применение лучевой терапии. Почему? Потому что его употребление разрушает яичники и естественным образом вызывает бесплодие.Метод сохранения фертильности должен основываться на удалении самой шейки матки, оставляя тело матки, где может происходить оплодотворение и развитие эмбриона. Фаллопиевы трубы и яичники оставляем нетронутыми. Следовательно, у больного, подвергающегося щадящему методу, не может быть метастазов в лимфатические узлы, поэтому узлы необходимо удалить и обследовать. Однако, если метастазирование произошло, то консервативная операция не может быть удовлетворена, так как слишком велик риск рецидива. Ее нужно облучать, а если она проходит лучевую терапию, то процедура сохранения фертильности не имеет смысла.Поэтому условием сохранения фертильности является раннее развитие заболевания, возможность удаления самой опухоли с краями и отсутствие метастазирования в лимфатические узлы.
Поэтому критерии квалификации больных для традиционного хирургического и щадящего лечения разные.
Да. Некоторые пациенты, которых можно оперировать, не станут автоматически кандидатами на поддерживающее фертильность лечение. Это будет зависеть от разных факторов. У некоторых больных, у которых мы хотим сохранить фертильность, это окажется невозможным, например, когда после щадящей операции и лимфаденэктомии выясняется, что возникли метастазы в лимфатические узлы.Затем необходимо сообщить больному, что необходима лучевая терапия.
Каков риск рецидива после радикальной и щадящей операции?
Все дело в том, что риски сопоставимы. Однако мы можем сравнивать только крупные испытания традиционных методов лечения рака шейки матки с небольшими испытаниями методов лечения, сохраняющих фертильность. До сих пор, несмотря на недостаточную силу этих доказательств, кажется, что методы лечения, сохраняющие фертильность, связаны с таким же низким риском рецидива заболевания, как и радикальное лечение, то есть около 2-3 процентов.Риск должен оставаться низким, поскольку трудно представить себе лечение, сохраняющее фертильность, оставляющее женщину с высоким риском рецидива рака. Это было бы абсурдно.
Будут ли новые рекомендации по лечению рака шейки матки включать щадящий метод?
Да, хотя мы с осторожностью предлагаем щадящее лечение. Мы стараемся достаточно точно определить, какие методы лечения следует применять в зависимости от стадии заболевания.
Как улучшилась общая выживаемость при наиболее запущенном заболевании?
В последнее время также был достигнут прогресс в лечении метастатического рака шейки матки, наиболее распространенного рака. Внедрены новые препараты, т.н. быстрый путь из-за его высокой стоимости. Это биологические препараты, подавляющие развитие опухолевых сосудов, добавленные к химиотерапии, которые показали значительный эффект на плохо прогнозируемую группу больных. Эти препараты значительно улучшают выживаемость и реакцию на химиотерапию.И это будет включено в рекомендации.
Если говорить о среднем сроке выживания в таких случаях, который составляет 10-13 месяцев, то применение новых препаратов удлиняет этот срок на 4-5 месяцев. Поэтому с точки зрения онкологии прогресс важен. Мы не можем рассчитывать на чудодейственное средство для полного излечения, но маленькие шаги для продления жизни очень важны. Стоимость препарата еще не возмещена, но мы надеемся сделать это в ближайшие месяцы.
Что еще следует изменить в диагностике и уходе за пациенткой с раком шейки матки?
Моя клиническая практика показывает, что слишком много пациентов с раком шейки матки оперируются в больницах, которые не являются онкологическими центрами.Только 20 процентов случаев оперируются в онкогинекологических отделениях! К сожалению, после процедуры гинеколог-«неонколог» часто перестает чувствовать ответственность за пациентку, так как не в состоянии обеспечить ей дальнейшие этапы лечения и направляет ее в онкологический диспансер. Он также часто не контролирует регулярно своих пациентов в клинике. Онкогинекологические амбулатории, обеспечивающие постоянное наблюдение, обычно функционируют при онкологических диспансерах. Районная или городская больница, обычно таких поликлиник нет.Врач, отправляющий пациента после операции в другое место, не видит последствий своих терапевтических решений. Это может привести к тому, что пациенты не будут оперированы оптимально. Между тем, неправильная операция не может быть исправлена никакими дальнейшими терапевтическими методами.
К сожалению, «онкологический пакет» поощряет такую деятельность, потому что не говорит, на каком уровне должны проводиться онкологические процедуры. Их может делать каждый центр и получать за это деньги от Национального фонда здравоохранения.Иными словами, за счет качества лечения пациенты получили несколько более быстрый доступ к нему. Между тем, гарантом качества является только гинеколог-онколог и центр с опытом лечения рака, а не врач, который проводит несколько процедур в год. Центр лечения рака шейки матки также должен иметь лучевую терапию и химиотерапию. Пациентка должна выбрать врача, который будет смотреть ей в глаза не менее 5 лет после процедуры, потому что качество такого лечения будет лучше, чем в случае с врачом, который только проведет процедуру и не будет равнодушен к дальнейшая судьба больного.
Беседовала Марта Кобланска
.Рак шейки матки является четвертым наиболее распространенным видом рака у женщин в мире. Ежегодно от него страдают около 570 000 женщин, 60% из которых умирают. Ранний рак обычно протекает бессимптомно, поэтому очень важно регулярно, по крайней мере, каждые 3 года сдавать мазок Папаниколау. Вакцинация против ВПЧ снижает риск заражения вирусом более чем на 75%.
Рак шейки матки — распространенная злокачественная опухоль женского репродуктивного органа, развивающаяся в шейке матки. Матка состоит из гладкой мускулатуры и состоит из стержня, который находится внутри таза женщины и является местом беременности, и шейки матки, которая частично находится внутри влагалища.
Роль шейки матки в основном заключается в удержании развивающейся беременности внутри матки путем плотного закрытия цервикального канала.Во время родов цервикальный канал открывается и значительно расширяется. Вне беременности узкий канал шейки матки служит путем для сперматозоидов, защищает от инфекций, способствует удалению менструальной крови, а сокращения шейки матки играют роль в том, как женщина ощущает оргазм.
Наиболее частой локализацией развития рака является так называемая переходная/пограничная зона. Своим названием она обязана тому, что имеется место изменения между двумя видами эпителия: железистым — выстилающим полость матки и цервикальный канал, и плоским — покрывающим влагалищную часть шейки матки и влагалище.Со стороны влагалища можно также перечислить так называемые Щиты. Расположение указанной зоны вариабельно и зависит от возраста и концентрации гормонов в организме. У молодых девушек и женщин в постменопаузе внутренне располагаются в цервикальном канале. При гормональной активности располагается на диске влагалищной части шейки матки, около ее устья , наружном .
Щит может быть покрыт железистым эпителием – тогда его называют так называемым эктопия (обычно известная как: эрозия, дефект эпителия, эритроплакия).Следует отметить, что это физиологический процесс и не требует лечения, а термин эрозия некорректен и не должен использоваться. У молодых женщин внутри эктопии есть переходная зона, в которой будут располагаться потенциально раковые поражения.
Рак шейки матки является четвертым наиболее распространенным видом рака у женщин в мире . Ежегодно от него страдают около 570 000 женщин, 60% из которых умирают.Пик заболеваемости приходится на 50–60 лет. год жизни.
В Польше рак шейки матки в настоящее время занимает 7-е место среди наиболее распространенных видов рака (данные за 2018 г.) у женщин (после рака молочной железы, легких, толстой кишки, эндометрия, яичников и щитовидной железы).
Отчеты также за 2018 год прогнозируют, что около 2270 женщин разовьют его в 2020 году. Несмотря на постепенно снижающуюся заболеваемость, летальные исходы и несвоевременная диагностика онкологических заболеваний представляют собой большую проблему.
В 2018 годуиз-за него умерло около 1600 женщин, что ставит Польшу в хвост развитых стран по излечимости этого заболевания. В европейских странах благодаря распространению знаний об иммунизации, скрининге и использовании барьерных средств контрацепции (например, мужских презервативов) смертность снизилась на целых 70%.
Основной причиной рака шейки матки является вирус папилломы человека ( вирус папилломы человека - ВПЧ), который создает среду, благоприятную для превращения здоровых клеток в раковые.Заражение им протекает бессимптомно. Подтипы - 16 и 18.
особенно опасныВторым не менее опасным фактором является курение (повышает риск в 2 раза). Дополнительно упоминаются некоторые инфекции репродуктивных органов (хламидиоз, гонорея, вирус герпеса, цитомегаловирус), многочисленные беременности и роды (более 5), диета, бедная витамином С, и длительный прием противозачаточных средств.
К так называемым косвенным факторам риска относятся:
Стоит отметить, что ВПЧ можно заразиться не только при вагинальном, но и при оральном и анальном сексе. Кроме того, одного генитального контакта «кожа к коже» может быть достаточно для передачи вируса. Также было показано, что он присутствует на эротических аксессуарах.
Семейная предрасположенность к развитию рака шейки матки отсутствует.
В настоящее время считается, что наиболее важным фактором риска развития рака шейки матки является ВПЧ-инфекция эпителиальных клеток шейки матки.Гораздо реже вирус внедряется в эпителий влагалища или половых губ, приводя к заболеваниям этих областей. В подавляющем большинстве случаев организм женщины сам очищается от вируса, но в определенном проценте случаев инфекция приобретает стойкий характер. Это означает, что вирус постоянно заселяет клетки эпителия шейки матки, что может привести к их изменениям — так называемому дисплазия, приводящая к дисфункции и развитию, а иногда и к малигнизации и развитию рака. ВПЧ-инфекция неизлечима, а вирус гриппа неизлечим.Необходимо наблюдать за больным и в случае обострения хронической инфекции, а в случае развития дисплазии назначить соответствующее лечение.
Из этого следует, что образ жизни оказывает большое влияние на риск развития рака шейки матки. Его соответствующая модификация в сочетании с регулярными цитологическими и гинекологическими исследованиями и профилактической вакцинацией минимизирует этот риск.
Ранний рак обычно протекает бессимптомно, поэтому очень важно регулярно, по крайней мере, каждые 3 года сдавать мазок Папаниколау.
В Польше она доступна бесплатно КАЖДОЙ застрахованной женщине в возрасте 25–59 лет. Обследование заключается в сборе поверхностных клеток из области наружного отверстия и цервикального канала специальной маленькой кисточкой. Это безболезненно, безопасно, без проблем и коротко. Его всегда следует сочетать с гинекологическим осмотром.
После теста женщина узнает, в какой группе риска она находится и как часто его нужно повторять (например, людям, принимающим иммунодепрессанты или ВИЧ-инфицированным – раз в 1 год).
Вышеуказанная процедура, которую должна практиковать каждая женщина, позволяет распознать до 80% ранних форм рака и предраковых состояний!!!
Более запущенные формы проявляются такими симптомами, как кровянистые выделения, спонтанные или возникающие после полового акта, обильные, часто гнилостные выделения и чувство боли, которое появляется только при запущенных формах заболевания.
Рак шейки матки может развиваться как опухоль и постепенно заполнять просвет влагалища или может инфильтрировать шейку матки и распространяться глубже в ткани таза.В самых запущенных формах он проникает в мочевой пузырь и прямую кишку и может метастазировать в другие органы или отдаленные лимфатические узлы. В результате могут возникать отеки нижних конечностей (часто асимметричные), задержка мочи, частые инфекции мочевыводящих путей и ректальные кровотечения.
Рак шейки матки относится к числу злокачественных новообразований, которых можно избежать, выполняя описанное выше периодическое профилактическое обследование - цитологическое исследование.Кроме того, все более широкое распространение (особенно при неуверенности результатов цитологии) получает тестирование на наличие ДНК вируса папилломы человека ( вирус папилломы человека - ВПЧ) в эпителии шейки матки. Это исследование можно проводить одновременно с цитологией, так как метод сбора материала идентичен.
Одним из величайших достижений последних лет является внедрение вакцины против ВПЧ. В настоящее время на рынке существуют также эффективные так называемые бивалентные (ВПЧ 16,18), четырехвалентные (ВПЧ 6,11,16,18), а в последнее время даже 9-валентные варианты вакцин.Они снижают риск заражения вирусом более чем на 75%. Вакцина безопасна и легкодоступна. Девочки должны быть вакцинированы перед половым актом, предпочтительно в возрасте около 12 лет.
Обследованием, которое часто разрешает сомнения, возникающие при цитологическом исследовании или тестах на ВПЧ, является кольпоскопия шейки матки, т.е. осмотр ее через специальный микроскоп на гинекологическом кресле. Тест позволяет врачу увидеть изменения в шейке матки из-за инфекции ВПЧ или ранние изменения в клетках шейки матки, известные как дисплазия шейки матки, и, возможно, взять образцы, необходимые для диагностики рака (рак не может быть диагностирован с помощью мазка Папаниколау).
Гораздо чаще, чем рак шейки матки, обнаруживаются поражения, известные как дисплазия низкой, средней или высокой степени. На их долю приходится большинство аномальных результатов мазка Папаниколау. Эти термины описывают нарушения развития эпителиальных клеток шейки матки, которые могут (в случае легкой, средней и тяжелой степени дисплазии) привести к раку. Эти изменения требуют лечения, чтобы защитить женщину от рака шейки матки. Чем ниже степень дисплазии, тем больше шансов, что изменения регрессируют.Аналогичным образом, чем выше степень, тем выше вероятность трансформации в опухолевые клетки.
С целью диагностики рака шейки матки берется образец подозрительной ткани на исследование, позволяющее определить вид рака. Осмотр вместе со сбором материала производят в зеркалах, через влагалище и задний проход. Для определения стадии заболевания и выбора соответствующего лечения проводятся дополнительные исследования, такие как: рентгенография органов грудной клетки и компьютерная томография или МРТ органов брюшной полости и малого таза с целью исключения метастазов в другие органы.Также обязательна оценка общего состояния пациентки и ее воли к сохранению фертильности.
Метод лечения зависит от стадии рака на момент постановки диагноза и решения, связанного с рождением детей. Наилучшие результаты дает хирургическое вмешательство. На очень ранних стадиях прогрессирования, особенно у молодых женщин, желающих сохранить фертильность, достаточно радикально удалить шейные и тазовые лимфатические узлы. Это дает половине женщин, проходящих процедуру, шанс забеременеть.
Однако наиболее частым выбором является радикальное иссечение всей матки с окружающими тканями (так называемыми парафизами) и регионарными лимфатическими узлами. Если процедуру проводят молодой женщине, то можно вынести яичники за пределы таза, чтобы избежать их повреждения дополнительной лучевой терапией. Операция обычно выполняется путем вскрытия брюшной полости (лапаротомия), хотя возможно также использование лапароскопического или даже трансвагинального пути.
Лучевая терапия используется в качестве дополнительного лечения после операции, т.е. адъювантного лечения. После резекции опухоли лоханку, в которой находилась матка, облучают с целью уничтожения отдельных, незаметных раковых клеток.
Обычно состоит из двух этапов: облучение опухоли извне – телерадиотерапия. А изнутри, путем помещения внутрь опухоли (в цервикальный канал) радиоактивного элемента (не повреждает здоровые ткани вокруг опухоли) - брахитерапия.Основными осложнениями, которые могут возникнуть при лечении, являются диарея, уретрит и другие желудочно-кишечные жалобы, которые очень хорошо реагируют на симптоматическое лечение.
Химиотерапия — в основном производные платины — важна при лечении рака шейки матки. Он используется в качестве дополнения к лучевой терапии. Он усиливает действие ионизирующего излучения на опухоль и улучшает результаты лечения по сравнению с лучевой терапией.
К сожалению, слишком много случаев в Польше все еще диагностируется на поздних, неоперабельных стадиях, поэтому наиболее часто применяемым методом лечения рака шейки матки является радиохимиотерапия.
На очень поздних стадиях заболевания используется только паллиативная радиохимиотерапия или симптоматическое лечение.
Инвазивный рак редко встречается у женщин, осведомленных о факторах риска и регулярно проходящих профилактические осмотры и вакцинацию против ВПЧ – заболевание обычно диагностируется на стадии дисплазии или предраковой стадии. Если происходит опухолевая инвазия, заболевание часто диагностируется на ранней стадии (1.стадии) и это дает 55-95% шансов на выздоровление.
Чрезвычайно важно, чтобы лечение диагностированного рака шейки матки проводилось в специализированном онкологическом центре. Это значительно увеличивает шансы пациентов на излечение, особенно благодаря правильной диагностике и адаптации к ней лечения.
.90 000 Лучевая терапия - Исследования и лечение 9000 1Лучевая терапия или лучевая терапия является одним из трех наиболее важных методов лечения злокачественных опухолей (наряду с хирургией и химиотерапией). В рамках лучевой терапии ионизирующее излучение используется для уничтожения раковых клеток. Излучение, используемое в лучевой терапии, аналогично тому, которое используется в обычных рентгеновских лучах (рентген или компьютерная томография).Во время лучевой терапии используются гораздо более высокие дозы радиации в течение более длительного периода времени. В настоящее время в лучевой терапии используется множество новых, недавно разработанных методов лечения, с использованием различных источников ионизирующего излучения и пространственных методов, которые позволили значительно снизить частоту ранних и поздних осложнений лечения.
Ионизирующее излучение вызывает ряд изменений в клетках, что приводит к их гибели и, как следствие, уменьшению опухолевой массы. Конечно, в зоне облучения есть и здоровые ткани, которые следует особенно защищать.Ткани в нашем организме имеют разную чувствительность к облучению, поэтому на этапе планирования лечения проверяют, соблюдаются ли необходимые критерии их защиты (т.е. критические дозы органов). Кроме того, для защиты органов используются различные другие методы. К ним относятся облучение с задержкой вдоха, т. е. задержка дыхания (с целью предохранения сердца от иррадиации на левую сторону молочной железы), прием большого количества жидкости — «опьянение» (это позволяет защитить кишечник, при иррадиируют в области таза и полости), абдоминальную) или применение так называемогокожные болюсы.
Следует добавить, что здоровые клетки гораздо быстрее регенерируют радиационные повреждения. В опухолях регенеративные процессы протекают медленными темпами, поэтому опухолевые клетки более восприимчивы к облучению, чем здоровые.
Бывают случаи, когда мы не можем проводить лучевую терапию, потому что доза радиации, необходимая для излечения от рака, может необратимо разрушить слишком много здоровых тканей.
В новаторскую эпоху лучевой терапии для заживления опухоли использовались большие разовые дозы радиации, но это было связано с обширным некрозом окружающей здоровой ткани, трудноконтролируемыми кровоизлияниями из-за разрушения стенки кровеносного сосуда и другими серьезными осложнения. Чтобы исправить это, был введен метод деления общей дозы облучения на меньшие, но более часто вводимые дозы (т. е. фракционирование дозы). В результате удалось сохранить тот же терапевтический эффект при минимальных побочных эффектах.Развитие фракционирования дозы заложило основы современной лучевой терапии, которая в настоящее время является безопасным и высокоэффективным методом лечения многих злокачественных новообразований.
Новообразования различаются по природной чувствительности к облучению в зависимости от вида:
Самое главное при планировании лечения – это точный подбор дозы облучения и доставка ее в возможно строго ограниченную зону заболевания, и, как уже говорилось ранее, защита от облучения здоровых тканей (т.е. защита критических органов) .
Показания к лучевой терапии в основном зависят от цели лечения. Он делится на:
Его также можно использовать в сочетании с химиотерапией - такое лечение эффективно, например, у пациентов с раком анального канала: сочетание лучевой терапии и химиотерапии дает очень хорошие результаты, позволяя избежать операции, которая включала бы иссечение заднего прохода и создание фекальной свищ («искусственный задний проход») на животе.
Существует два основных типа лучевой терапии: телерадиотерапия и брахитерапия.
Телерадиотерапия основана на использовании источника ионизирующего излучения (чаще всего фотонов, электронов, иногда протонов), находящегося вне тела больного и проводящего лечение с расстояния в несколько десятков сантиметров. Испускаемое источником излучение направлено на больной участок тела.
Брахитерапия (с использованием гамма-излучения) - источник излучения вводится через подходящее устройство (проводник, трубку, иглу или капсулу) в тело (т.е.находится в непосредственном контакте с больным). Применение аппаратов происходит под общим наркозом, поэтому перед процедурой очень часто требуется консультация анестезиолога. Брахитерапию можно разделить на внутритканевую брахитерапию, при которой источник излучения находится непосредственно в опухоли, и внутриполостную брахитерапию — источник находится в полости тела, например в полости матки. При правильно спланированном лечении доза облучения почти полностью концентрируется внутри опухоли, что значительно снижает поражение окружающих здоровых тканей.
Осложнения облучения обычно ограничиваются облученной областью. Часто в середине лечения и до 2-х недель после его окончания вы чувствуете слабость и беспокойство (иногда с легкой лихорадкой). У больных с облученными опухолями брюшной полости дополнительно могут появиться тошнота и рвота, а при облучении органов малого таза - диарея.
Общие местные осложнения включают:
В целом осложнения лучевой терапии можно разделить на ранние (до 6 месяцев) и поздние. Ранние осложнения:
Поздние осложнения:
Следует подчеркнуть, что эти осложнения, хотя и возможны, не умаляют того факта, что лучевая терапия является эффективным и безопасным методом лечения многих злокачественных новообразований. Каждый метод, используемый для лечения людей, имеет разные побочные эффекты, но тщательные исследования и тщательный мониторинг качества лечения означают, что преимущества лечения намного перевешивают связанные с ним риски.
Планирование лечения (симуляция лечения) необходимо до начала лучевой терапии.Во время этой процедуры выполняются визуализирующие тесты (в основном компьютерная томография) для точного определения местоположения опухоли, определения области, которая должна быть подвергнута облучению, планирования распределения доз облучения с учетом здоровых органов, которые необходимо сохранить и защищен. Весь процесс занимает примерно 14 дней. Чтобы измерения и планы, подготовленные во время моделирования лечения, были полезными, ориентиры должны быть постоянно отмечены на коже пациента, часто татуируя маленькие (2-3 мм) точки на коже.Существуют также специальные приспособления из пластмассы, изготавливаемые индивидуально для каждого пациента, обеспечивающие повторяемость положения тела во время сеансов лучевой терапии (например, индивидуально подогнанные синтетические маски).
Частота и продолжительность лучевой терапии зависят от типа и локализации рака и выбранного режима лечения (может варьироваться в зависимости от использования других методов, таких как хирургия и химиотерапия).Обычно облучение проводят с понедельника по пятницу. Весь курс лечения обычно длится 5-7 недель, а разовая стандартная доза (фракция) составляет примерно 2 грея (Гр). В настоящее время используются многие другие методы деления общей дозы облучения, но подробное обсуждение этих методов выходит далеко за рамки этого текста. Например, при адъювантном лечении после органосохраняющей операции требуется около 3 недель. Паллиативное или симптоматическое лечение составляет 1 неделю лечения, а стереотаксические процедуры длятся в общей сложности около 3 дней.
Во время самого сеанса облучения пациент находится один в помещении, где проводится лучевая терапия (из-за необходимости защиты от радиации стены очень толстые - помещение часто называют "бункер"). Медицинский персонал следит за состоянием пациента с помощью медицинских приборов и камер и имеет с ним постоянный голосовой контакт. Врачи и техники находятся в соседней комнате и наблюдают за всем процессом лечения.Медицинский персонал не может находиться в процедурном кабинете, поскольку доза радиации, которую он получит при лечении последующих пациентов, будет представлять угрозу для их здоровья и жизни.
.Заболеваемость раком у беременных невелика, диагноз устанавливается в течение 0,02–0,1% всех беременностей. Статистика увеличивается, с каждым годом в общей популяции выявляется все больше впервые диагностированных злокачественных новообразований, кроме того, отмечается задержка возраста деторождения, а возраст является, в случае большинства раковых заболеваний, одним из факторов, определяющих большую подверженность болезням.
Наиболее распространенными видами рака, диагностируемыми у беременных, являются: рак молочной железы, рак шейки матки, лимфома Ходжкина и злокачественная меланома; реже встречаются неходжкинские лимфомы, острый лейкоз или хронические обострения, рак яичников, рак щитовидной железы и колоректальный рак.
Симптомы у беременных не очень характерны - они перекрывают друг друга и объясняются нарушениями гомеостаза организма беременной из-за изменения уровня гормонов, особенно половых гормонов, что важно при раке молочной железы и раке груди. репродуктивные органы. Симптомы, характерные для патологии желудочно-кишечного тракта, особенно толстого кишечника (запоры), как правило, связанные с наличием опухоли, объясняются нарушением висцеральных отношений вследствие увеличения матки, особенно в третьем триместре беременности.Увеличение груди, отечность и увеличение плотности железистой ткани влияют на точность визуализирующих тестов, боль и выделения из соска, которые являются физиологическими в последние недели беременности из-за повышения уровня пролактина - в повседневных ситуациях они могут быть первым симптомом рака молочной железы.
Из-за многочисленных ограничений как диагностика, так и лечение беременных женщин с диагностированным раком затруднены и часто задерживаются.
При подтверждении новообразования решения о дальнейшем лечении должны приниматься мультидисциплинарно, в команде, совместно со специалистами в области клинической онкологии, гинекологии и хирургии.Это большая проблема, особенно в случае быстропролиферирующих новообразований, против которых в нормальных условиях следует проводить быстрое и агрессивное лечение - у беременных терапевтические решения значительно сложнее, с одной стороны, с точки зрения сохранения жизнь матери, с другой - максимально возможная защита плода.
Из-за высокой токсичности химиотерапевтических средств применение химиотерапии ограничивается только химиочувствительными и химиоизлечимыми новообразованиями.
Проведение тестов с применением ионизирующего излучения при беременности стандартизировано Положением Министра здравоохранения об условиях безопасного применения ионизирующего излучения при всех видах медицинского облучения (ЖурналU.05.194.1625) § 17.
1. «Проведение рентгенологических исследований у беременных ограничивается необходимыми случаями, если они не могут быть выполнены после прекращения.
2. Испытания, указанные в пар. 1, следует проводить способом, обеспечивающим максимальную защиту плода от радиационного облучения, путем выбора соответствующей методики обследования и использования соответствующих средств индивидуальной защиты органов брюшной полости и таза»
Диагностические исследования (с применением ионизирующего излучения) при беременности могут быть проводится только в исключительных случаях, когда другие, более безопасные, менее инвазивные методы неприменимы, когда существует непосредственная опасность для жизни матери и плода и в случае облучения разовой дозой, не превышающей 5 рад.При дозе менее 5 рад нет повышенного риска невынашивания беременности и аномалий развития плода. В остальных случаях рентгенография брюшной полости, компьютерная томография и изотопные исследования при беременности противопоказаны. В обоснованных ситуациях при использовании максимально доступных методов предохранения могут быть выполнены рентгенография органов грудной клетки и маммография.
Противопоказаний к проведению УЗИ нет, и при подозрении на патологии органов брюшной полости и малого таза это исследование выбора.Его также можно безопасно повторить, не оказывая существенного влияния на плод.
В обоснованных ситуациях проводят МРТ-исследования, которые считаются относительно безопасными (второй и третий триместры беременности) при условии, что не используются контрастные вещества (гадолиния) в связи с их прохождением через плаценту, накоплением и токсическим действием на развитие тканей и органов плода. При крайней необходимости применения контрастных веществ - рекомендуется более безопасная, с меньшим риском передачи через плаценту, интенсивная гидратация пациента после исследования и максимальное сокращение времени исследования (избегание эффекта "перегрева", что опасно для плода).
Наиболее важным для развития и в то же время наиболее опасным периодом беременности является первый триместр (от 3 месяцев до 12 недель беременности), когда происходит дифференцировка клеток, построение тканей и формирование органов. При воздействии вредных доз в первые 3 недели беременности - пока женщина знает о своем состоянии - чаще всего происходят самопроизвольные выкидыши.
Возможность деформации органов в ближайшие недели связана с достаточным формированием первичных тканей и началом органообразования.На поздних сроках беременности, когда плод достаточно сформировался и органы начинают возобновлять свои функции, острых последствий применяемого облучения обычно не наблюдается. Может замедлиться рост плода, удлиниться срок беременности и увеличиться риск перинатальных осложнений. Кроме того, радиационное воздействие может вызвать аномальный рост ребенка в постнатальном периоде, умственную отсталость в детском возрасте, неадекватное возрасту замедление психомоторного развития, поражение костного мозга или развитие радиационно-индуцированных новообразований (п.кроветворная система, саркомы).
Женщинам детородного возраста предменопаузальные пробы с воздействием ионизирующего излучения, кроме экстренных случаев, рекомендуются в первую фазу цикла (1-10 дней) для снижения вероятности возможной беременности и непреднамеренного облучения плода . Женщина с подозрением на беременность должна сообщить об этом факте врачу-рентгенологу или технику, проводящему обследование – возможно, данный метод диагностики не является единственно рекомендуемым, при необходимости стоит использовать простой тест-полоску на беременность, чтобы минимизировать риск фатальных осложнений.
Пациент с диагнозом опухолевая болезнь, пролеченный химическим путем, подвергается многим побочным эффектам цитостатиков. Часто они настолько сильно выражены, что требуют прерывания или изменения схемы лечения и переноса даты следующего введения. В случае беременных введение цитостатиков отражается не только на общем состоянии женщины, но и влияет на плод, хотя кровь матери не имеет прямого контакта с кровью плода и транспорта питательных веществ и всех необходимых веществ для развития эмбриона происходит через плаценту.
Степень тератогенного действия цитостатиков зависит от периода беременности, типа цитостатиков, дозы и пути введения, а также продолжительности лечения.
Практически все ЛС, включенные в онкологические протоколы, транспортируются через плаценту - по правилам транспорта через биологические оболочки - чем больше препарата вводится системно за один раз, тем больше доз и большее общее количество ЛС доставлено матери - тем больше и сильнее обнажение плода.Важны и биофизические свойства самого препарата: полярность молекулы (связывание с полярными переносчиками), размер молекулы (мелкие легко проникают через клеточные мембраны), растворимость в воде и липидах (сродство к белково-липидным клеточным мембраны), степень связывания с белками (при худшей степени они легче проникают через плаценту и легче повреждают плод), активность в определенных диапазонах температур, чувствительность к условиям окружающей среды.
Несмотря на указанный выше , наиболее важным фактором, связанным с тератогенным действием цитотоксических препаратов, является гестационный период воздействия на плод .Ключевым моментом здесь являются первые несколько недель, когда клетки делятся и дифференцируются быстрее всего.
Неопластическая клетка обладает способностью быстро делиться, поэтому цитотоксические препараты нацелены на те элементы ее структуры и функции, которые наиболее важны в процессе пролиферации. Эмбрион также очень быстро делится в течение первых недель, поэтому влияние химиотерапевтических средств одинаково сильно. Большинство поражений плода происходит в период эмбриогенеза и органогенеза (до 60-го дня беременности - 10-й недели), что обосновывает прекращение химиотерапии в I триместре беременности .
Химическое лечение можно начинать не ранее 14-й недели беременности, но всегда следует учитывать возможность повреждения плода. После введения беременным цитостатиков - преимущественно в I триместре - примерно в 20% случаев наблюдались повреждения плода, в 40% - низкие при рождении и в 33% случаев наблюдалась панцитопения. Дети от беременностей, во время которых матери вводили цитостатики, с большей вероятностью, чем статистически, подвержены риску бесплодия во взрослом возрасте, связанному с повреждением гамет, задержкой физического и умственного развития и меньшей массой тела при рождении.
Наиболее тератогенными препаратами являются антиметаболиты и алкилирующие препараты .
В первой группе наиболее опасен ингибитор фолаттетрагидрогеназы метотрексат, встраивающийся в цепи ДНК при синтезе антипиримидиновых метаболитов: цитарабина, гемцитабина и пуринфлударабина и хлордеоксиаденозина.
В группе алкилирующих препаратов наибольшую опасность представляют хлорамбуцил и циклофосфамид, но первый легче проникает через плаценту, а второй более токсичен для материнского организма.
Растительные алкалоиды (винбластин, винкристин) и противораковые антрациклиновые антибиотики менее токсичны благодаря своей структуре: большие молекулы, вероятно, труднее проникают через плаценту. Их представители чаще оказывают негативное влияние на организм матери, следует учитывать их нейротоксичность, особенно в случае с винкристином, а также их токсическое действие на пищеварительную и дыхательную системы.
Производные платины (наиболее часто применяемые при раке легких, а у женщин при раке яичников, шейки матки и эндометрия) вызывают некоторую задержку развития плода и являются ототоксичными - могут вызывать потерю слуха.Этопозид может вызывать поражение костного мозга плода: вызывать панцитопению плода и новорожденных и значительно повышать риск вторичных лейкозов. Многочисленные сообщения о применении анатоксинов (доцетаксел и паклитаксел) при беременности свидетельствуют об отсутствии вредного воздействия на плод во втором и третьем триместрах беременности у беременных женщин, получавших лечение по поводу рака молочной железы и яичников. Это связано с защитным механизмом - таксаны являются субстратами для Р-гликопротеина, высокие концентрации которого обнаруживаются в плаценте, удаляют из клеток чужеродные вещества (в том числе лекарственные), препятствуя их накоплению и препятствуя достижению мест назначения.При крайней необходимости применения производных платины во время беременности применяют менее токсичный оксалиплатин, который меньше повреждает костный мозг, чем карбоплатин, а в случае антрациклинов предлагается доксорубицин. Цитостатики в виде липосомальных растворов более опасны из-за большей степени проникновения через плацентарный барьер.
Среди целевых препаратов не наблюдалось снижения фертильности или побочных эффектов на плод (в исследованиях на животных) при использовании трастузумаба (антитела к HER2).Исследования на животных не всегда надежны и не всегда предсказывают воздействие на человека, поэтому препарат не следует использовать во время беременности, за исключением случаев, когда потенциальная польза для матери превышает потенциальный риск для плода. В постмаркетинговом наблюдении у беременных женщин, получавших антитела к HER2, наблюдались случаи нарушения скорости роста и функции почек плода в связи с маловодием, некоторые из которых были связаны с фатальной гипоплазией легких плода.Женщинам детородного возраста, принимающим трастузумаб до беременности, следует рекомендовать использовать эффективные методы контрацепции во время лечения и в течение не менее 6 месяцев после лечения.
Ритуксимаб представляет собой генетически сконструированное химерное человеко-мышиное моноклональное антитело, иммуноглобулин, который содержит константные последовательности IgG1 человека (IgG способен проникать через плацентарный барьер) и вариабельные последовательности легкой и тяжелой цепи мыши.Применяется при фолликулярной лимфоме III или IV стадии в случае резистентности к химиотерапии или в случае второго или последующего рецидива после химиотерапии, при неходжкинской В-клеточной лимфоме с положительным антигеном CD20 в сочетании с химиотерапией СНОР.
Известно, что иммуноглобулины IgG проникают через плацентарный барьер, и у некоторых новорожденных матерей, получавших ритуксимаб во время беременности, наблюдалось преходящее (восстановление через 3–6 месяцев после рождения) снижение В-клеток и лимфоцитопения без признаков инфекции.По этим причинам препарат не следует применять беременным женщинам, за исключением случаев, когда возможная польза превышает потенциальный риск.
Из-за длительного действия ритуксимаба у пациентов с истощением В-лимфоцитов женщины детородного возраста должны использовать эффективные методы контрацепции как во время лечения, так и в течение 12 месяцев после прекращения лечения.
При метастазах в кости с низким уровнем кальция бисфосфонаты не рекомендуются во время беременности, поскольку они могут вызвать гипокальциемию плода (низкий уровень кальция) с симптоматическим рахитом после родов.
Противопоказано кормить грудью во время беременности во время химиотерапии, так как препараты проникают в грудное молоко.
Использование радиотерапии во время беременности также сопряжено с риском повреждения тканей плода. Биологический эффект облучения зависит, как и в случае любой ткани, от поглощенной дозы облучения, размера поля облучения (здесь чрезвычайно важна точность планирования) и расстояния от поля облучения. Кроме того, следует учитывать и период беременности (первый триместр — критический период эмбрионального и органогенеза, а в третьем триместре — технические трудности изготовления чехлов для такого крупного плода).
Суммарная допустимая доза облучения плода составляет 0,05–0,1 Гр (5–10 сГр). К наиболее частым побочным эффектам, связанным с применением лучевой терапии при беременности, относятся: летальные поражения, приводящие к самопроизвольным абортам в первые недели, поражение органов при органогенезе, торможение физического и психического развития плода, вторичные новообразования в постнатальном периоде.
Лучевую терапию при беременности применяют в особых случаях, учитывая последствия откладывания терапии до родов, кроме абсолютных показаний, ее следует избегать, а при крайней необходимости проводить облучение с применением фетальных щитов, контролем состояния матери и состояние ребенка в период лечения, включая дозу, поглощенную тканями плода.
Помимо стандартных терапевтических процедур, в онкологии и онкологической хирургии большое значение имеет поддерживающее лечение, позволяющее преодолеть побочные эффекты химиотерапии и пройти диагностический и лечебный путь наименее обременительным путем. Наиболее распространены болевые ощущения, желудочно-кишечные расстройства: тошнота и рвота, а также снижение показателей анализа крови и нарушение иммунной системы. Как известно, беременность – это период, в котором применение лекарственных препаратов весьма ограничено из-за риска поражения не только организма матери, но и плода.Поэтому при выборе метода поддерживающего лечения важно контролировать возможные побочные эффекты и категорию препарата, чтобы не повредить развивающийся плод.
При любой химической обработке или лучевой терапии существует риск необратимого нарушения фертильности. Все больше пациентов составляют молодые люди, которые еще не имеют детей или планируют их после окончания терапии. Во многих медицинских центрах мира для оплодотворения после окончания лечения используется процедура консервирования яйцеклеток и сперматозоидов.Это позволяет сохранить фертильность больных раком. Процедура должна быть выполнена до начала лечения, чтобы избежать повреждений от химиотерапии и лучевой терапии. В случае молодых людей осознание возможности иметь детей в будущем является одним из наиболее мотивирующих факторов в борьбе с раком.
Исследование:
лук. врач Паулина Цихон
Отделение онкологической хирургии
Медицинский университет Гданьска
Когда мы слышим о лечении рака, некоторые из нас сталкиваются с болезненными процедурами и неприятными побочными эффектами. Все это даже у здоровых людей может вызвать страх и желание убежать, а у больных даже привести к отказу от лечения.
Основная причина таких реакций заключается в том, что рак до сих пор является своего рода табу - о нем редко говорят, часто демонизируют и - вопреки очевидной медицинской статистике - до сих пор существует в общественном сознании как смертельная болезнь.Вот почему так важна достоверная информация о болезни – зная, что переживает больной человек и с чем он борется, мы сможем легче ему помочь.
Точно так же, как психические и эмоциональные реакции различаются от одной стадии к другой на разных стадиях болезни, они различаются и при одном типе лечения. Это связано со степенью агрессивности самого лечения и тяжестью возникновения побочных эффектов.
Инвазивное лечение, как с точки зрения диагностических процедур (бронхоскопия и лапароскопия), так и лечебных процедур (удаление опухоли, удаление больного органа вместе с опухолью, удаление метастазов).Целью хирургического лечения, помимо избавления от опухоли, может быть и облегчение дискомфорта.
Чувства и эмоции, которые могут возникнуть во время хирургического лечения:
Доминирует страх перед самой процедурой и ее последствиями. Может произойти:
Как вы можете помочь?
Стоит позаботиться о снижении стресса у больного перед операцией, так как в результате сильного стресса могут появиться такие симптомы, как обострение текущего заболевания, усиление тревоги или депрессии. Помните, что, как правило, чем больше у нас информации о том, что нас ждет, тем меньше мы боимся.
Этот вид лечения включает облучение определенного участка тела пучком энергии извне, помещение изотопа внутрь полости тела или внутри ткани.Последствия лучевой терапии зависят от места облучения.
Как и в случае хирургического лечения, здесь также доминирует тревога. Это может быть тревога:
Как вы можете помочь?
Это системное лечение, воздействующее на весь организм. Он включает введение лекарства в организм пациента (внутривенно или перорально) для разрушения раковых клеток и предотвращения распространения рака. Его также можно использовать в качестве продления жизни или паллиативного лечения. Тип и тяжесть побочных эффектов зависят от типа применяемого лекарства и индивидуальной реакции больного.
Чувства и эмоции, которые могут возникнуть во время химиотерапевтического лечения:
Как вы можете помочь?
Этот метод предполагает введение пациенту высоких доз гормонов. Это может привести к преждевременной менопаузе, феминизации или маскулинизации.
Чувства и эмоции, которые могут возникнуть во время гормональной терапии:
Как вы можете помочь?
Это введение интерферона или интерлейкинов, агентов, которые используются в иммунотерапии.
Чувства и эмоции, которые могут возникнуть при биологической терапии:
Как вы можете помочь?
Это включает введение препарата, который избирательно блокирует образование кровеносных сосудов в опухоли, предотвращая ее рост.Это относительно новый и все еще развивающийся метод терапии.
Чувства и эмоции, которые могут возникнуть во время лечения:
Как вы можете помочь:
Заключается во введении клеток, взятых у донора, непосредственно в кровь больного человека.Это терапия, используемая для лечения рака крови - лейкемии. Недостатком этого метода лечения является то, что иммунная система больного человека должна быть практически стерилизована и уничтожена, чтобы внедрить в его организм новые клетки. Это предполагает длительные периоды разлуки — пациенты должны быть отделены от своего окружения в строго контролируемой больничной среде, чтобы избежать заражения.
Чувства и эмоции, которые могут возникнуть во время лечения
Как вы можете помочь?
Следует помнить, что эмоции и чувства, о которых мы пишем, дело индивидуальное, и их возникновение обусловлено многими факторами, в основном вытекающими из психофизического состояния больного.
Также важно помнить о важности разговора со своим врачом о лечении, которое вы предлагаете. Его цель – развеять любые сомнения, прояснить процедуры и ответить на вопросы, волнующие пациента. Некоторые пациенты решают обратиться за помощью к психологу на протяжении всего лечения, чтобы облегчить адаптацию к следующим стадиям болезни, поработать над тревогой или другими эмоциями.
Следует помнить, что в лечении онкологического заболевания крайне важен комплексный подход – обратимся за помощью к специалистам, которые могут помочь нам в болезни и лечении (онколог, психолог, диетолог, сексолог, логопед).Это сделает путь через болезнь менее болезненным для пациента психически.
Ольга Клода-Краевская - психолог, специализируется на работе с онкологическими больными и их родственниками, обучается в польском Эриксоновском институте.
На основе:
де Вальден-Галушко К.: Психоонкология в клинической практике. Медицинское издательство PZWL, Варшава, 2011. 9000 4 .
© Borgis - Новая Медицина 2/2011, стр. 24-27
* Кшиштоф Щепаник, Ева Телка, Божена Йохимек, Виолетта Мистa, Лукаш Клешик
Оценка качества жизни после лучевого лечения у пациенток после пери- и постменопаузального удаления репродуктивного органа
Переносимость лучевой терапии гинекологического рака женщинами в постменопаузе
Отделение лучевой терапии, Онкологический центр - ИнститутМ. Склодовской-Кюри, филиал в Гливицах
Заведующий отделением: проф. доктор хаб. мед. Лешек Мишчик 9000 3
Резюме
Качество жизни больных раком половых органов, особенно раком яичников и раком эндометрия, снижается. У этих больных физические симптомы болезни влияют на прием больных и в целом на качество жизни. Все лечебные мероприятия, уменьшающие выраженность соматических симптомов, существенно влияют на качество жизни пациентов.Также можно увидеть взаимосвязь между возрастом и качеством жизни больных раком яичников. У пациенток менопаузального возраста качество жизни связано с соматическими симптомами, и эта сфера требует особого ухода, также отмечается более высокая интенсивность тревожности и эта группа требует большего внимания и поддержки в психологическом и эмоциональном плане. Большое значение имеет также надлежащая информация, предоставляемая медицинским персоналом, в том числе акушерками и медсестрами, участвующими в процессе лечения.Лица, проявляющие более высокую степень понимания, находчивости и сообразительности, легче оказываются в трудных ситуациях, лучше оценивают свое психосоциальное функционирование и общее качество своей жизни. Поэтому больные, полностью информированные, хорошо ориентирующиеся в своем заболевании и применяемом лечении, оценивают качество жизни значительно выше. В настоящее время оценка качества жизни становится важным элементом комплексной оценки состояния пациента. В случае больных раком яичников наблюдается тенденция к тому, что качество жизни являлось одним из существенных элементов эффективности, а влияние на ее величину являлось фактором формирования ее планирования.
Введение
Опухоли половых органов могут быть как доброкачественными (миома матки), так и злокачественными. Наиболее распространенными злокачественными новообразованиями репродуктивного органа являются: рак шейки матки (60% всех случаев рака половых органов), рак эндометрия, рак яичников, рак вульвы, рак влагалища, рак маточной трубы.
Рак шейки матки может иметь несколько эпителиальных форм (плоскоклеточный рак, железистый рак, папиллярный рак, смешанный рак) и иметь 4 стадии.Инфекция ВПЧ 16,18 является наиболее частой причиной развития рака шейки матки. Этот рак можно выявить на ранней стадии, когда возможно эффективное онкологическое лечение. Поэтому очень важно регулярно проходить профилактические осмотры, в том числе мазок Папаниколау. Диагностические исследования, полезные для выявления этого заболевания, включают: гинекологическое исследование, цитологическое исследование, возможно, кольпоскопическое исследование, гистопатологическое исследование иссечения шейки матки.В зависимости от клинической ситуации проводятся и другие исследования, такие как выскабливание шейки матки и полости матки, ультразвуковое исследование, урография, цистоскопия, гистероскопия, рентгенологическое исследование толстой кишки.
Рак эндометрия — это заболевание, которое чаще встречается у женщин в пери- и постменопаузе, у женщин с ожирением, гипертонией и диабетом. Большую роль в раннем выявлении этого новообразования играют регулярный гинекологический осмотр, а также трансвагинальное УЗИ (трансвагинальное), гистопатологическое исследование соскобов с шейки матки и полости матки, гистероскопическое исследование с биопсией эндометрия.
Опухоли репродуктивных органов являются одной из наиболее частых причин смерти женщин в постменопаузе, что является серьезной социальной проблемой. Заболеваемость этими новообразованиями имеет тенденцию к небольшому увеличению как среди населения Польши, так и в мире. Среди факторов, влияющих на повышение риска заболеваемости, например раком яичников, влияние которых можно было наблюдать годами, следует назвать следующие: диетические, экологические, биологические и генетические факторы. Другими не менее важными факторами являются количество доношенных беременностей, а также оральные контрацептивы.Заболеваемость раком яичников в Польше составляет 11 на 100 000 женщин. Подсчитано, что примерно от 5 до 10% от общего числа опухолей яичников связано с наличием мутаций в генах BRCA1/BRCA2. Мутации в генах BRCA1 и BRCA2 способствуют формированию не только опухолей молочной железы и яичников, но и других злокачественных опухолей. Возможности генетических тестов, используемых в генетических клиниках, позволяют эффективно диагностировать и наблюдать пациентов, отягощенных мутациями, способствующими развитию злокачественных новообразований.Выявление больных из группы повышенного риска, оказание им специализированной медицинской помощи и проведение диагностики на носительство генетических мутаций, способствующих процессу онкогенеза, становится эффективным инструментом профилактики и раннего выявления онкологических заболеваний, которые ежегодно диагностируются в более 3000 женщин в Польше (3, 7, 13, 15, 17).
По статистике Национального института рака в Бетесде (США), наиболее частым злокачественным новообразованием у женщин является рак молочной железы.Пожизненный риск его возникновения составляет более 10% (1, 3, 9). С другой стороны, рак яичников встречается сравнительно реже (около 1,8%), но смертность женщин от него относительно высока. Несмотря на прогресс, достигнутый в области визуализации и лабораторной диагностики, гинекологический осмотр и тщательно собранное интервью остаются важнейшими элементами процесса диагностики опухолей репродуктивного органа (4, 9, 12, 17, 20). Методы лечения этих онкологических заболеваний и их последствий могут снижать качество жизни, которое определяется соматическими, психическими и социальными факторами (3).Все лучшие и лучшие результаты лечения, выражающиеся, в том числе, в более длительной выживаемости, приводят к оценке качества жизни женщин после оперативного удаления матки. В начальный период интереса понятие «хорошая жизнь», состояние обладания считалось качеством жизни. В настоящее время подчеркивается ценность «быть» вместо «иметь», поэтому в качество жизни введены новые критерии, такие как: образование, свобода, здоровье и счастье (5, 7, 9, 13, 16, 18). ).
Здоровье как состояние полного, психического и социального благополучия (а не только отсутствие болезней) является наилучшим отражением качества жизни, в том числе (после качества жизни, связанного со здоровьем): физического состояния и подвижности, психического состояния , социальная ситуация (преимущественно экономическая) и соматические ощущения (13).Удаление матки в обществе, где она является «атрибутом женственности и материнства» - вызывает стресс, чувство стыда перед партнером, семьей, окружением, надрыв и страх возвращения к нормальной жизни, а также расставание семейно-брачная жизнь (1, 2, 6, 12, 15, 17). Женщины чувствуют себя неполноценными ( комплекс полуженщины - "комплекс полуженщины") и инвалидами - иначе, чем до операции и лучевой терапии. Меняется самооценка, снижается физическая подготовленность, а также возникает проблема качества жизни после операций и лечения, т.е.после лучевой или химиотерапии (11, 16, 19, 20).
Мы загрузили отрывок из статьи выше, к которой вы можете получить полный доступ.
У меня есть код доступа
19 90 015
зл. я выбираюполученный код необходимо ввести на странице статьи, на которую он был погашен
49 90 015
зл. я выбираю119 90 015
злотых я выбираюСсылки
1. Stempczyńska J, Potemski P: Опухоли яичников. [В:] Кордек Р., Яссем Дж., Краковски М., Езиорски А. (ред.): Онкология. Учебник для студентов и врачей. Медицинская пресса, Гданьск, 2003 г.; 190-195. 2. Markowska J: Гинекологическая онкология. Urban & Partner, Вроцлав, 2002 г.; 28-33. 3. Кржаковски М.: Клиническая онкология. Том 2. Боргис 2001; 140-141. 4. Джассем Дж. Паллиативная лучевая терапия, химиотерапия и гормональная терапия. [В:] Хебановски М., де Вальден-Галушко К., Жилич З. (ред.): Основы паллиативной помощи при опухолевых заболеваниях. PZWL, Варшава, 1998 г.; 148-157. 5. Дойл С., Крамп М., Пинтили М., Оза А.М.: Паллиативная химиотерапия оказывает паллиативное действие? Оценка ожиданий, результатов и затрат у женщин, получающих химиотерапию при прогрессирующем раке яичников. Дж. Клин Онкол, 2001 г.; 19: 1266-1274. 6. Урбански К.: Новые методы лечения распространенного рака яичников. Медицинское обновление. Медипресс 2003; доп. 2. 7. Conte PF, Cianci C, Gadducci A: Обновление в лечении прогрессирующей карциномы яичников.Crit Rev Oncol Hematol 1999; 32: 49-58. 8. Williams LL: Вторичная циторедукция злокачественных новообразований яичников. [В:] Маркманн М., Хоскинс В.Дж. (ред.): Рак яичников. Raven Press, Ne 130 www.pmp.viamedica.pl. 9. Маркманн М., Букман М.А.: Вторая линия лечения рака яичников. Онколог 2000; 5: 26-35. 10. Де Вальден-Галушко К. Проблемы качества паллиативной помощи. [В:] де Вальден-Галушко К. (ред.): Основы паллиативной помощи. PZWL, Варшава, 2004 г.; 284-293. 11. Майкович М.: Проблемы и перспективы оценки качества жизни при раке (критический подход). [В:] де Вальден-Галушко К. (ред.): Психоонкология. Библиотека польской психиатрии, Краков, 2000 г.; 141-148. 12. Czuszyńska Z: Качество жизни пациентов в терминальной стадии опухолевого заболевания. [В:] Хебановски М., де Вальден-Галушко К., Жилич З. (ред.): Основы паллиативной помощи при опухолевых заболеваниях. PZWL, Варшава, 1998 г.; 192-200. 13. Танака А., Ивамото Т., Канеясу Х., Петрини М.А.: Мысли и чувства пациентов с поздними стадиями рака: последствия для улучшения ухода за неизлечимыми.Nurs Health Sci 1999; 1: 189-193. 14. Afa-Zając A, Mess E, Gryboś M et al.: Качество жизни у женщин с карциномой половых органов. Adv Gin Exp Med 2005; 14: 151-156. 15. Хойнацка-Шавловска Г., Майкович М.: Качество жизни женщин, пролеченных по поводу злокачественных новообразований репродуктивных органов. [В:] де Вальден-Галушко К., Майкович М. (ред.): Качество жизни при опухолевых заболеваниях. Издательство Гданьского университета, Гданьск, 1994. 16. Majdak E, Mielcarek P, Kozaka J и др.: Возраст как фактор, влияющий на качество жизни женщин, получавших внутривенную химиотерапию при прогрессирующем раке яичников. Психоонкология 2002; 6: 31-35. 17. Козака Дж.: Качество жизни и чувство согласованности у женщин с раком яичников. Психоонкология 2002; 6: 13-19. 18. Батлер Л., Бэкон М., Кэри М. и др.: Определение взаимосвязи между токсичностью и качеством жизни в клинических испытаниях химиотерапии рака яичников.Дж. Клин Онкол, 2004 г.; 22: 2461-2468. 19. Бодурка-Беверс Д., Басен-Энбквист К., Кармак С.Л. и др.: Депрессия, тревога и качество жизни у пациентов с эпителиальным раком яичников. Гинекол Онкол 2000; 78: 302-308. 20. Фиш Л.С., Льюис Б.Е.: Вопросы качества жизни при лечении рака яичников. Семин Онкол 1999; 26 (Приложение 1): 32-39.
.90,000 EuroMedic Чтобы оправдать ваши ожидания, больница Euromedic предлагает лечение эмболизации: простаты и варикозного расширения вен, миомы матки и опухолей печени.
Прорыв в лечении доброкачественной гиперплазии предстательной железы и варикоцеле
Подсчитано, что более половины мужчин старше 60 лет страдают доброкачественной гиперплазией предстательной железы.
Его основными симптомами являются проблемы с мочеиспусканием, такие как императивные и частые позывы к мочеиспусканию, что очень неприятно, особенно ночью, слабая струя мочи и неполное опорожнение мочевого пузыря.Эти симптомы не только вызывают значительное ухудшение качества жизни, но и имеют важное значение для здоровья мужчины. До настоящего времени методом выбора является хирургическое вмешательство на предстательной железе, требующее общей анестезии и связанное с возможностью возникновения многочисленных серьезных осложнений, оказывающих фатальное влияние на жизнь мужчины, основными из которых являются: импотенция или другие нарушения половой функции и недержание мочи.
В настоящее время в Европе и Америке широким фронтом внедряется новый малоинвазивный метод лечения, инициированный хирургом-рентгенологом, профессором Мартиньшем Писко из Лиссабона, заключающийся в закрытии кровоснабжения гипертрофированной простаты, т.е. эмболизации простаты артерии.Эта процедура предполагает введение в сосуды специальных микрочастиц, питающих разросшуюся простату, закупоривающих мельчайшие сосуды в железе, вызывая ее ишемию и, как следствие, атрофию и уменьшение объема. Уменьшение железы приводит к облегчению симптомов, связанных с ее гипертрофией. Процедура требует только местной анестезии и кратковременного пребывания в стационаре до 12 часов. Это минимально инвазивная процедура, требующая только пункции артерии в паху.
Это настоящая революция в лечении этого неприятного, а в дальнейших последствиях и опасного для здоровья заболевания.
В настоящее время этим методом вылечено несколько тысяч пациентов по всему миру.
На базе отделения сосудистой хирургии и лаборатории интервенционной радиологии команда опытных врачей-специалистов и медсестер нашей больницы предлагает вам самый современный метод лечения, который вскоре станет стандартом.
Мы также лечим варикоцеле, которое является одной из причин мужского бесплодия, используя аналогичную малоинвазивную методику.
Миома матки состоит из гладкой мускулатуры, идентичной стенке матки. Целых 30 процентов страдают этим заболеванием. у женщин старше 30, а после 40 этот процент увеличивается даже до 40 процентов. Они редко встречаются поодиночке. Обычно их бывает несколько или даже десяток, что в крайних случаях может привести к искажению физиологической формы матки.По некоторым данным, существует склонность к наследованию этого недуга.
Первым и наиболее распространенным симптомом миомы является аномальное кровотечение. Они могут быть тяжелее и могут иметь более длительные периоды или кровотечения, совершенно не связанные с менструацией. Они приводят к малокровию, т.е. малокровию, иногда даже в тяжелой степени.
Другим симптомом, в зависимости от размера и локализации миомы, является боль в животе, нижней части живота или в области позвоночника, а также боль во время полового акта.
Еще одной проблемой является бесплодие, которое встречается у 2-10% людей. больных миомой. Даже если женщина забеременеет, ей грозят осложнения, выкидыш и проблемы во время самих родов.
Вт 0,5–3 процента В некоторых случаях миомы могут перерождаться в злокачественные опухоли или саркомы.
Хирургическое лечение миомы в настоящее время является наиболее часто используемым методом лечения. Объем этих процедур очень разнообразен – от гистерэктомии, т.е. удаления матки, до малоинвазивных щадящих процедур, таких как лапароскопическая хирургия или гистероскопия, позволяющих удалить сами миомы.
Несколько лет назад был разработан новый метод лечения, получивший наибольшую популярность в США и Западной Европе, заключающийся в эмболизации - закупорке артерий миомы, которая при лишении васкуляризации сокращается и спонтанно фиброзируется.
Процедура не травмирует пациента, безопасна и безболезненна. Из небольшого прокола в паху в маточную артерию вводят сосудистый катетер, т.е. тонкую трубку, по которой в сосуды опухоли под рентгенологическим контролем вводят специальные частицы.Их диаметр соответствует диаметру мелких сосудов миомы и не мешает кровотоку по артериям, питающим сам орган. Следствием их закрытия является ишемия, приводящая к атрофии и фиброзу опухоли. Исчезновение опухоли избавляет больного от недугов. женщины репродуктивного возраста могут забеременеть после такой операции, а статистика по количеству доношенных беременностей не отличается от таковой у здоровых женщин.
Пациент остается в больнице на одну ночь после процедуры и на следующий день после утреннего кофе может покинуть больницу.Процедуры, проводимые в отделении сосудистой хирургии Euromedic.
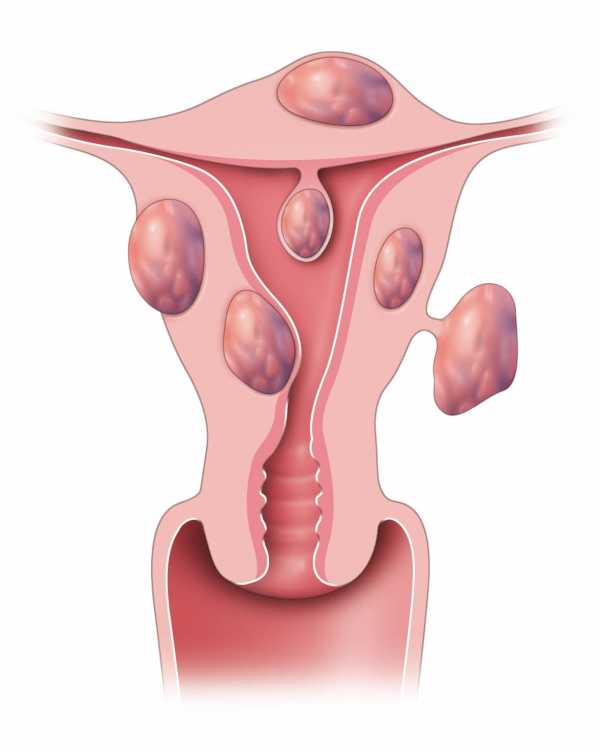
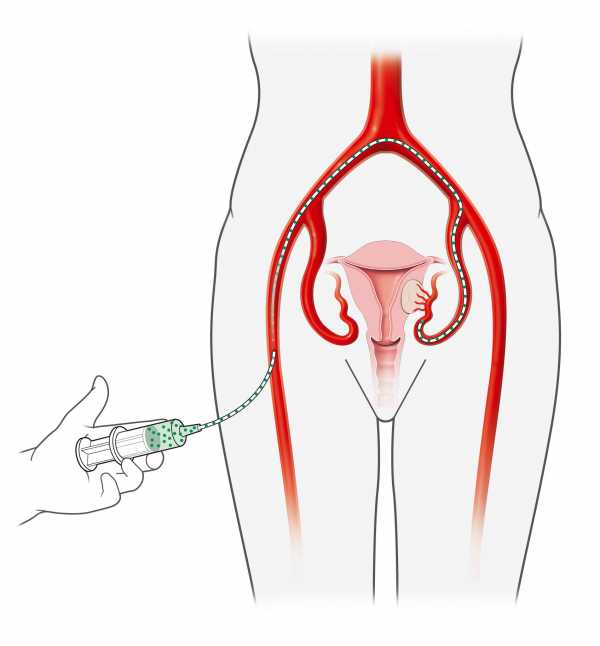
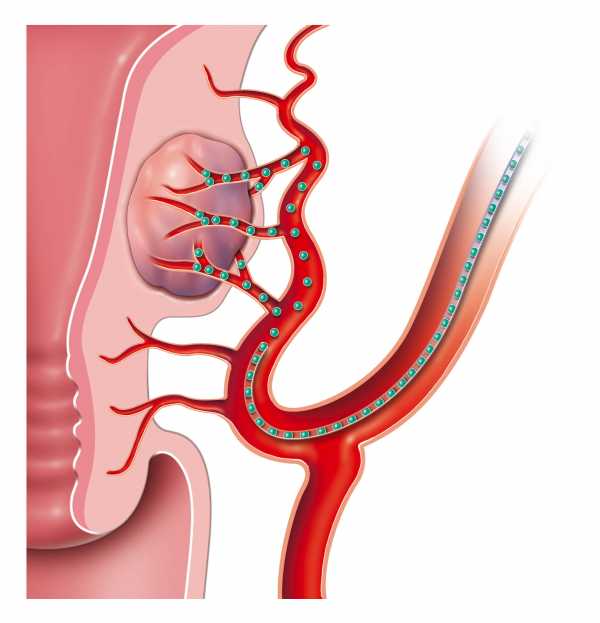
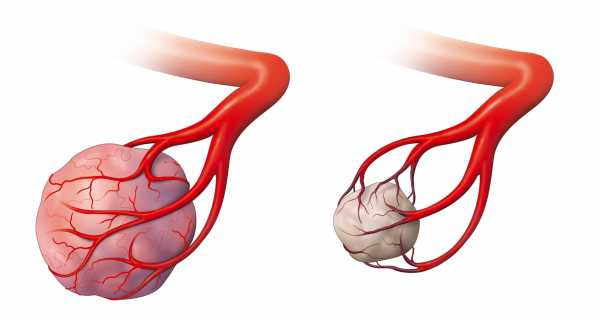
Минимально инвазивная процедура, проводимая хирургом-рентгенологом под контролем рентгена. Кратковременное пребывание в больнице. Возможно лечение изменений в других органах.
Химиоэмболизация — признанный метод лечения, направленный на подавление роста опухолей печени.
В настоящее время возможно лечение первичных опухолевых поражений печени с помощью хоэмиоэмболизации, к которым относятся:
Также возможно лечение метастазов в печень, таких как:
Химиоэмболизация может применяться как самостоятельная терапия, но также может сочетаться или дополняться другими методами лечения, такими как хирургическая резекция опухоли, лучевая терапия, термоабляция, криоабляция, или когда системная (внутривенная) химиотерапия невозможна используется из-за противопоказаний.
Отличие системной химиотерапии от химиоэмболизации заключается в том, что при внутривенной химиотерапии препарат в высокой концентрации в кровотоке действует одинаково как на раковые клетки, так и на здоровые ткани организма, а при химиоэмболизации концентрация препарата высока в опухолевых поражения, и минимальна в периферической крови, что снижает действие химиотерапевтического средства на здоровые участки тела и, таким образом, уменьшает возникновение побочных эффектов.Его особое применение - нерезектабельные опухолевые опухоли печени, не реагирующие на системную химиотерапию .
С его помощью также можно попытаться уменьшить размер нерезектабельной опухоли печени до размера, позволяющего провести операцию.
Лечение и описание метода
Процедура химиоэмболизации проводится в лаборатории интервенционной радиологии (лаборатории ангиографии) бригадой, состоящей из хирурга-радиолога, хирургической сестры и электрорадиолога, а также, в некоторых случаях, с участием анестезиолога.
Пациент лежит на спине.После местной анестезии производят пункцию артерии (чаще всего бедренной артерии в правом паху), которой предшествует небольшой разрез кожи. Затем его вводят в просвет артерии, т. н. пластиковый сосудистый футляр для обеспечения доступа во время процедуры и минимизации повреждения сосудов в месте инъекции. Затем с помощью сосудистого проводника через интродьюсер вводят сосудистый катетер, который через подвздошные артерии и аорту достигает чревного ствола и, наконец, печеночной артерии.Следующим этапом является артериография артерий печени с применением контрастного вещества, вводимого через этот катетер с целью точной локализации неопластической опухоли и установления пути к очагу поражения по печеночным артериям и микрокатетера, кончик которого помещают в сосуд, максимально приближенный к новообразованию. Через микрокатетер вводятся специально приготовленные эмболизирующие микрочастицы, пропитанные химиотерапевтическим средством (т.е.доксирубицин или иринотекан), которые, закупоривая микрососуды опухоли, перекрывают кровоснабжение, вызывая инфаркт и некроз неопластического очага, и дополнительно с помощью медленно высвобождающегося препарата тормозят рост опухоли. В конце процедуры, после контрольной артериографии, показывающей эффективность эмболизации, из сосудов удаляют катетеры и сосудистую оболочку, а место пункции фиксируют давящей повязкой. Лечение проводится под контролем рентгена. Давящую повязку снимают через несколько часов.Продолжительность пребывания больного в стационаре обычно не превышает 48 часов.
.