2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Ольга:
23.10.2014
Добрый день, уважаемый Доктор! У меня (35 лет ) в 31 неделю беременности произошла антенатальная гибель плода. Это была вторая беременность, вторые роды. Первые роды – кесарево сечение по причине крупного плода и тазового предлежания в 38 недель беременности при отхождении вод , живой здоровый мальчик, 4 120 г, 53 см, 8/9 по Апгар. Вторая желанная беременность в целом протекала хорошо, только в 1 триместре в 5-6 недель было кровотечение (алая кровь), лежала на сохранении 2 недели, курс лечения – дицинон, но-шпа, папаверин, витамин Е, утрожестан, валерьяна . После выписки через неделю в 9-10 недель вновь было кровотечение, но не такое обильное (один раз необильно алая кровь, затем коричневая мажущая), на сохранение не ложилась, пролечилась дома, доктор прописал транексам. Затем нормализовалось. Во время беременности по УЗИ, по анализам (общий, клинический анализ крови, биохимия крови, общий анализ мочи) , Д димер, гемостазиограмма, гинекологический мазок, мазок на ПЦР (всё отрицательно), ТОРЧ инфекции (нет иммунитета к токсоплазмозу и ВПГ 2 – сдавала в 30 недель повторно – инфекции не было) , гормоны щитовидной железы (ТТГ, Т3 св.
,Т4 св.) всё в целом нормально, единственное в 25 недель был низкий гемоглобин (95), назначили мальтофер на 1 месяц, после чего гемоглобин нормализовался (125). По данным гемостазиограммы были небольшие отклонения (повышение РКФМ) в 14 недель, и в 30 недель по гемостазиограмме отмечалось усиление свертывания крови по внешнему пути (высокий протромбиновый индекс, снижение МНО) по сравнению с прошлым анализом. Назначили курантила по 50 мг х 2 раза в сутки за 30 минут до еды - на 10 дней для улучшения микроциркуляции.
В течение беременности сильных заболеваний с высокой температурой не было, в 1 триместре не сильная ОРВИ (наморк, недомогание), в 15 недель от ребенка заразилась кишечным гриппом (в листе назначения педиатр написала диагноз ОРВИ с кишечн. Синдр), температура 37.4,недомогание,тошнота,рвота(3 раза),поноса особо не было, стул размягченный. Через 1,5 суток все прошло, принимала смекту. В 29 недель ребенок в садике заболел ветрянкой, сама я не заболела, переболела ранее в детстве.
 Артериальное давление в течение беременности было в норме– 110/70, вес набрала к 30 неделе 7-8- кг. Самочуствие в целом было хорошее, отеков не было. По скринингам риски низкие. В течение беременности с перерывами принимала Элевит, йодомарин. УЗИ в третьем триместре не успела сделать, должна была в 32-33 недели.
В 30 недель –по оценке КТГ - 7 балов, занижен бал из-за отсутствия амплитуды осцилляций (0 баллов), учитавая гемостазиограмму (писала выше), по назначению начала принимать куратнил по 1 табл. 2 раза в день. А через 5 дней на 31 неделе вечером заметила, что ребенок не шевелится, к утру вызвала скорую, в роддоме по УЗИ сердцебиения не было, через 2 дня вызвали роды, девочка родилась с весом 1 220 г , 41 см. Недавно получили результат гистологии, ребенок никаких пороков развития не имел, был абсолютно здоров. По протоколу патологоанатомический диагноз:
-Антенатальная асфиксия плода. Мацерация кожных покровов. Аутолиз внутренних органов. -Недоношенность. -Гипоплазия плаценты ППК = 0,20 (норма =0,23).
Артериальное давление в течение беременности было в норме– 110/70, вес набрала к 30 неделе 7-8- кг. Самочуствие в целом было хорошее, отеков не было. По скринингам риски низкие. В течение беременности с перерывами принимала Элевит, йодомарин. УЗИ в третьем триместре не успела сделать, должна была в 32-33 недели.
В 30 недель –по оценке КТГ - 7 балов, занижен бал из-за отсутствия амплитуды осцилляций (0 баллов), учитавая гемостазиограмму (писала выше), по назначению начала принимать куратнил по 1 табл. 2 раза в день. А через 5 дней на 31 неделе вечером заметила, что ребенок не шевелится, к утру вызвала скорую, в роддоме по УЗИ сердцебиения не было, через 2 дня вызвали роды, девочка родилась с весом 1 220 г , 41 см. Недавно получили результат гистологии, ребенок никаких пороков развития не имел, был абсолютно здоров. По протоколу патологоанатомический диагноз:
-Антенатальная асфиксия плода. Мацерация кожных покровов. Аутолиз внутренних органов. -Недоношенность. -Гипоплазия плаценты ППК = 0,20 (норма =0,23). -Состояние после краниотомии и эксцеребрации. Клиникопатологоанатомический эпикриз: Смерть недоношенного плода от 35 летней матери с ОАГА, от 2 беременности, протекавшей с угрозой прерывания, гриппом, от 2 преждевременных родов на 30 неделе, наступила в антенатальном периоде от асфиксии, обусловленной фетоплацентарной недостаточностью, вследствие гипоплазии плаценты.По результатм гистологии также указано Гипоплазия (ППК 0,20, N 0,23), преждевременное созревание ворсинчатого дерева, продуктивный хорионамнионный базальный децидуит.
О себе: хронический тонзитит, аутоиммунный тереоидит (гормоны щитовидной железы в норме, есть 2 небольших узелка около 0,5 мм), лечения не требует, только наблюдение, был гастрит, папилломавирус человека, был обнаруже неще в первую беременность, была поддержка имуноглобулином . По гинекологии – полип эндоментрия, удалили методом РДВ в апреле 2011 г., ранее была эрозия шейки (2001 г.) прижигали, молочница, абортов не было.
Доктор, прошу Вашего компетентного мнения – почему так резко случилась гибель на фоне не совсем критических показателей, в чем могла быть причина гипоплазии плаценты и соответственно гибели ребенка? Не могли ли перенесенные заболевания/инфекции повлиять? По результатм обследования можно ли было доктору понять, что есть плацентарная недостаточность/гипоплазия плаценты? По косвенным признакам может нужно было назначить дополнительные анализы/обследование? Если бы я сделала УЗИ ранее в 29-30 недель возможно ли было предотвратить трагедию? Как и где лучше планировать следующую беременность? Какие анализы порекомендуете сдавать? Большое спасибо за ответ! Очень жду!
-Состояние после краниотомии и эксцеребрации. Клиникопатологоанатомический эпикриз: Смерть недоношенного плода от 35 летней матери с ОАГА, от 2 беременности, протекавшей с угрозой прерывания, гриппом, от 2 преждевременных родов на 30 неделе, наступила в антенатальном периоде от асфиксии, обусловленной фетоплацентарной недостаточностью, вследствие гипоплазии плаценты.По результатм гистологии также указано Гипоплазия (ППК 0,20, N 0,23), преждевременное созревание ворсинчатого дерева, продуктивный хорионамнионный базальный децидуит.
О себе: хронический тонзитит, аутоиммунный тереоидит (гормоны щитовидной железы в норме, есть 2 небольших узелка около 0,5 мм), лечения не требует, только наблюдение, был гастрит, папилломавирус человека, был обнаруже неще в первую беременность, была поддержка имуноглобулином . По гинекологии – полип эндоментрия, удалили методом РДВ в апреле 2011 г., ранее была эрозия шейки (2001 г.) прижигали, молочница, абортов не было.
Доктор, прошу Вашего компетентного мнения – почему так резко случилась гибель на фоне не совсем критических показателей, в чем могла быть причина гипоплазии плаценты и соответственно гибели ребенка? Не могли ли перенесенные заболевания/инфекции повлиять? По результатм обследования можно ли было доктору понять, что есть плацентарная недостаточность/гипоплазия плаценты? По косвенным признакам может нужно было назначить дополнительные анализы/обследование? Если бы я сделала УЗИ ранее в 29-30 недель возможно ли было предотвратить трагедию? Как и где лучше планировать следующую беременность? Какие анализы порекомендуете сдавать? Большое спасибо за ответ! Очень жду!
Авторы отмечают необходимость более детальной оценки функционального состояния плаценты и вегетативных реакций у женщин с антенатальной гибелью плода. Это связано с тем, что неразвивающаяся беременность второго и третьего триместра представляет собой результат длительного течения плацентарной дисфункции, которая характеризуется выраженными изменениями агрегатного состояния крови, обмена веществ, иммунного статуса и системным эндотоксикозом. Последний требует проведения комплексной коррекции выявленных гемостатических нарушений с использованием свежезамороженной плазмы и эфферентных методов лечения, в частности энтеросорбции. Это позволяет снизить уровень кровопотери и уменьшить число оперативных вмешательств, в том числе гистерэктомий по поводу массивных кровотечений.
Это связано с тем, что неразвивающаяся беременность второго и третьего триместра представляет собой результат длительного течения плацентарной дисфункции, которая характеризуется выраженными изменениями агрегатного состояния крови, обмена веществ, иммунного статуса и системным эндотоксикозом. Последний требует проведения комплексной коррекции выявленных гемостатических нарушений с использованием свежезамороженной плазмы и эфферентных методов лечения, в частности энтеросорбции. Это позволяет снизить уровень кровопотери и уменьшить число оперативных вмешательств, в том числе гистерэктомий по поводу массивных кровотечений.
Таблица 1. Синтетическая активность плаценты, M ± m
Таблица 2. Некоторые показатели обмена веществ, M ± m
Таблица 3. Показатели перекисного окисления липидов и антиокислительных свойств плазмы, M ± m
Таблица 4. Состояние свертывающей системы крови, M ± m
Таблица 5. Состояние противосвертывающей системы крови, M ± m
Таблица 6. Показатели фибринолитической и антифибринолитической активности крови, M ± m
Показатели фибринолитической и антифибринолитической активности крови, M ± m
Таблица 7. Исходы родоразрешений беременных с мертвым плодом, %
В структуре невынашивания беременности одно из первых мест занимает неразвивающаяся беременность, частота которой остается стабильно высокой: от 2% в популяции в целом до 15–55% в различных когортах больных. Невынашивание беременности по типу несостоявшегося аборта (родов) наблюдается у 68,6% женщин в первом триместре, 21,3% – во втором триместре, 10,1% – в третьем триместре. За последние десятилетия во всем мире значительно снизился уровень неонатальной смертности, но уровень антенатальной гибели остается высоким и составляет почти 50% в структуре перинатальных потерь [1]. Это свидетельствует о том, что на современном этапе развития акушерства нет надежных способов оценки и коррекции внутриутробного состояния плода [2].
Антенатальная гибель плода и связанное с этим вторичное коагулопатическое кровотечение наравне с другими осложнениями беременности, такими как преэклампсия, задержка роста плода, преждевременная отслойка нормально расположенной плаценты, преждевременные роды, остаются основными причинами материнской и перинатальной заболеваемости и смертности [3, 4]. Частота патологической акушерской кровопотери при синдроме мертвого плода достигает, по некоторым данным, 21% [5].
Частота патологической акушерской кровопотери при синдроме мертвого плода достигает, по некоторым данным, 21% [5].
Согласно проведенным нами исследованиям, в большинстве случаев неразвивающаяся беременность второго и третьего триместра представляет собой результат длительного течения плацентарной дисфункции, которая характеризуется выраженными изменениями агрегатного состояния крови, обмена веществ, иммунного статуса и системным эндотоксикозом [6]. Ввиду возможных распространенных коагулопатических осложнений при постановке диагноза требуются тщательное лабораторное обследование и быстрая коррекция выявленных нарушений до родоразрешения.
В частности, нами проанализированы 147 историй родов женщин с мертвым плодом, по данным родильного дома № 1 Рязани (на долю антенатальной гибели плода за 15 лет пришлось 0,44%). Средний возраст женщин – 25,8 года. Первобеременные – 47,9%. Течение беременности в 89,6% случаев осложнилось ранним токсикозом, угрожающим прерыванием беременности, поздним гестозом и другими клиническими проявлениями плацентарной дисфункции. Это подтверждалось и результатами патогистологического исследования, указывающими в 70,8% случаев на патологию плаценты (в том числе на плацентарную недостаточность). У 37 беременных наблюдалась плацентарная недостаточность как в хронической, так и в острой форме. При этом хроническая форма доминировала (n = 30), а у семи женщин она переросла в острую в виде преждевременной отслойки нормально расположенной плаценты. Патологические процессы в плаценте в 64,6% случаев стали причиной внутриутробной гипоксии и асфиксии, вследствие чего и произошла антенатальная гибель плода. Кроме того, 2/3 обследуемых женщин перенесли различные заболевания воспалительного характера. В итоге у 14,6% беременных внутриутробная инфекция привела к гибели плода. Все это позволяет сделать вывод, что антенатальная гибель плода не происходит внезапно. Ей предшествует длительный период плацентарной дисфункции, который, естественно, не способствует организации и поддержанию адаптивных программ в организме беременной в соответствии с гестационными сроками.
Это подтверждалось и результатами патогистологического исследования, указывающими в 70,8% случаев на патологию плаценты (в том числе на плацентарную недостаточность). У 37 беременных наблюдалась плацентарная недостаточность как в хронической, так и в острой форме. При этом хроническая форма доминировала (n = 30), а у семи женщин она переросла в острую в виде преждевременной отслойки нормально расположенной плаценты. Патологические процессы в плаценте в 64,6% случаев стали причиной внутриутробной гипоксии и асфиксии, вследствие чего и произошла антенатальная гибель плода. Кроме того, 2/3 обследуемых женщин перенесли различные заболевания воспалительного характера. В итоге у 14,6% беременных внутриутробная инфекция привела к гибели плода. Все это позволяет сделать вывод, что антенатальная гибель плода не происходит внезапно. Ей предшествует длительный период плацентарной дисфункции, который, естественно, не способствует организации и поддержанию адаптивных программ в организме беременной в соответствии с гестационными сроками. Именно поэтому состояние адаптивных реакций, их вегетативные составляющие у женщин с антенатальной гибелью плода нуждаются в более детальном изучении. От этого зависят многие последующие действия врача, направленные на организацию родоразрешения, профилактику ряда грозных осложнений, которые нередко угрожают жизни беременной (массивные кровотечения, септические осложнения и др.).
Именно поэтому состояние адаптивных реакций, их вегетативные составляющие у женщин с антенатальной гибелью плода нуждаются в более детальном изучении. От этого зависят многие последующие действия врача, направленные на организацию родоразрешения, профилактику ряда грозных осложнений, которые нередко угрожают жизни беременной (массивные кровотечения, септические осложнения и др.).
Нами оценивались функциональное состояние плаценты и вегетативные реакции организма у женщин с антенатальной потерей плода и сравнивались со значениями здоровых беременных (38–40 недель), составивших контрольную группу. Специфические белки и фертильные факторы определяли с помощью иммуноферментных, моноклональных тест-систем (ТБГ-тест, ХГЧ-Фертитест-М, ПАМГ-1 и АМГФ-Фертитест-М). Биохимические показатели измерялись на анализаторе FP-901 фирмы Labsystems (Финляндия) с использованием реактивов фирмы Diasys (Германия), а также стандартными наборами реактивов фирмы Lahema (Чехия). Полученные данные анализировались с использованием пакета прикладных программ для обработки медико-биологических исследований Statgraphics 2. 6.
6.
У беременных с антенатальной гибелью плода синтетическая активность плаценты характеризовалась достоверным падением концентрации специфических белков в периферической крови (табл. 1). Их суммарное содержание было в 3,8 раза ниже, чем у здоровых беременных, что было обусловлено достоверным уменьшением уровня трофобластического бета-1 глобулина (ТБГ) (р
Состояние обмена веществ у женщин с мертвым плодом характеризовалось рядом особенностей (табл. 2). В отличие от здоровых беременных у них была достоверно уменьшена концентрация холестерина в крови на 8,2% (р
При этом отмечались значительные изменения антиокислительных свойств крови (табл. 3). Были резко снижены уровень общей антиокислительной активности (12,18 ± 0,95 против 20,20 ± 0,37%, р
Результатом изменений в углеводном и липидном обмене у беременных с мертвым плодом и накопления продуктов метаболизма перекисного окисления липидов стали существенные сдвиги в свертывающей системе (потребление свертывающих факторов) (табл. 4). Был достоверно снижен уровень фибриногена в крови (7,78 ± 0,91 против 13,41 ± 0,31 мкмоль/л, р
4). Был достоверно снижен уровень фибриногена в крови (7,78 ± 0,91 против 13,41 ± 0,31 мкмоль/л, р
В результате длительно существующей выраженной тромбинемии потреблялись и факторы противосвертывающей системы (табл. 5). Концентрация гепарина снизилась до 0,24 ± 0,02 Е/мл (0,33 ± 0,02 Е/мл в контроле, р
Активность плазминовой системы только имела тенденцию к увеличению, несмотря на достаточно большой прирост суммарной фибринолитической активности, активатора плазминогена и плазмина (на 31,9, 23,9 и 72,6% соответственно). Однако в силу выраженных индивидуальных колебаний показателей результаты были не достоверны (р > 0,05). Антиплазминовые факторы альфа-2-макроглобулин и альфа-1-антитрипсин были незначительно снижены (р > 0,05) по сравнению с контролем, чем, видимо, и обеспечивалось сдерживание плазминовой активности (табл. 6).
Таким образом, у женщин с антенатальной гибелью плода отмечается поражение синтетической активности плаценты, особенно ее плодовых отделов, что согласуется с данными других авторов [2]. Эти нарушения в синтезе специфических белков зоны беременности приводят к глубоким явлениям дисбаланса отдельных белков в их сумме. Резко возрастает удельный вес эндометриального белка ПАМГ, обладающего свойством стимулировать кататоксические адаптивные программы. Процессы плацентарной дисфункции, как следует из результатов анализа особенностей течения патологических беременностей, носят хронический характер. В результате длительного воздействия на адренергические структуры гипоталамуса происходит резкая активация кататоксических адаптивных программ с развитием типичных для этого процесса вегетативных реакций: увеличение активности перекисного окисления липидов, депрессия антиокислительных свойств крови, нарастание конечных продуктов перекисного окисления липидов в крови, прогрессивное потребление факторов противосвертывающей и свертывающей систем. Эти проявления в несколько раз превосходят те, которые обеспечивают начало родовой деятельности при доношенной беременности. Изменения в агрегатном состоянии крови были близки к критическим, а у ряда пациенток проявились коагулопатией третьей степени (синдромом диссеминированного внутрисосудистого свертывания).
Эти нарушения в синтезе специфических белков зоны беременности приводят к глубоким явлениям дисбаланса отдельных белков в их сумме. Резко возрастает удельный вес эндометриального белка ПАМГ, обладающего свойством стимулировать кататоксические адаптивные программы. Процессы плацентарной дисфункции, как следует из результатов анализа особенностей течения патологических беременностей, носят хронический характер. В результате длительного воздействия на адренергические структуры гипоталамуса происходит резкая активация кататоксических адаптивных программ с развитием типичных для этого процесса вегетативных реакций: увеличение активности перекисного окисления липидов, депрессия антиокислительных свойств крови, нарастание конечных продуктов перекисного окисления липидов в крови, прогрессивное потребление факторов противосвертывающей и свертывающей систем. Эти проявления в несколько раз превосходят те, которые обеспечивают начало родовой деятельности при доношенной беременности. Изменения в агрегатном состоянии крови были близки к критическим, а у ряда пациенток проявились коагулопатией третьей степени (синдромом диссеминированного внутрисосудистого свертывания). В отдельных наблюдениях гемодинамические расстройства в маточно-плацентарной области приобретают острый характер – происходит преждевременная отслойка нормально расположенной плаценты. Рассмотренные данные указывают на развитие своеобразной гиперадаптации, направленной на удаление мощного раздражителя (плода) путем мобилизации всех энергетических и иммунологических ресурсов. Это в конечном результате приводит к расстройству маточно-плацентарного кровообращения, ухудшению перфузии межворсинчатого пространства и внутриутробной гибели плода.
В отдельных наблюдениях гемодинамические расстройства в маточно-плацентарной области приобретают острый характер – происходит преждевременная отслойка нормально расположенной плаценты. Рассмотренные данные указывают на развитие своеобразной гиперадаптации, направленной на удаление мощного раздражителя (плода) путем мобилизации всех энергетических и иммунологических ресурсов. Это в конечном результате приводит к расстройству маточно-плацентарного кровообращения, ухудшению перфузии межворсинчатого пространства и внутриутробной гибели плода.
Причиной плацентарной дисфункции в 50% случаев становится инфекционное поражение [7], в котором задействована грамотрицательная микрофлора – источник эндотоксина (липополисахарида). Следствием дезадаптивных процессов, возникающих при плацентарной несостоятельности, становится нарушение обмена веществ с накоплением продуктов обмена (малонового диальдегида, гидроперекисей липидов и др.). Нарушенный обмен веществ, накопленные продукты перекисного окисления липидов и другие факторы резко изменяют агрегатное состояние крови с проявлением коагулопатии различной степени тяжести. При этом накапливаются продукты деградации фибрина. Все эти факторы (эндотоксин, продукты нарушенного обмена, продукты перекисного окисления липидов, продукты деградации фибрина и др.) представляют собой биохимические индикаторы эндотоксикоза [8].
При этом накапливаются продукты деградации фибрина. Все эти факторы (эндотоксин, продукты нарушенного обмена, продукты перекисного окисления липидов, продукты деградации фибрина и др.) представляют собой биохимические индикаторы эндотоксикоза [8].
С учетом системного эндотоксикоза при неразвивающейся беременности второго и третьего триместра требуется проводить комплексную коррекцию обнаруженных гемостатических нарушений с использованием свежезамороженной плазмы и эфферентных методов лечения. Перспективным направлением, используемым в последние годы в акушерской практике, является энтеросорбция Энтеросгелем [9].
Нами обследовано 99 женщин с неразвивающейся беременностью во втором и третьем триместре и длительностью пребывания мертвого плода в полости матки более двух суток. У всех женщин в день поступления, после элиминации плода и на пятые сутки после опорожнения матки оценивали показатели коагулограммы (фибриноген, протромбиновый индекс, фибриноген В, тромбиновое время, толерантность плазмы к гепарину, фибринолитическую активность, активность фибриназы, этаноловый тест). После чего были выделены три клинические группы.
После чего были выделены три клинические группы.
Первую группу составили 44 женщины с антенатальной гибелью плода, у которых не было патологических отклонений в системе гемостаза (контрольная группа).
Во вторую группу включены 40 женщин с антенатальной гибелью плода и нарушением гемостазиологических показателей, которые получали традиционную терапию до опорожнения матки (простагландины, антибиотикопрофилактику).
В третью группу вошли 15 женщин с антенатальной гибелью плода и патологическими отклонениями показателей гемостаза, которым наряду с общепринятой терапией проводилась комплексная подготовка к родоразрешению. Она включала переливание свежезамороженной плазмы до опорожнения матки (согласно приказу Минздрава России от 02.04.2013 № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов») и прием энтеросорбента Энтеросгель в дозе 15 г три раза в день per os с первых суток пребывания в стационаре и на протяжении пяти суток после элиминации плода.
Средний возраст женщин первой группы составил 27,7 года, причем треть женщин были старше 30 лет. Первородящих было 18, повторнородящих – 26. Срок беременности, при котором наступила антенатальная гибель плода, варьировался от 17 до 38 недель. У половины беременных длительность нахождения погибшего плода в полости матки насчитывала менее трех суток. У одной женщины в анамнезе были две неразвивающиеся беременности.
Средний возраст женщин второй группы равнялся 27,7 года, причем треть женщин были старше 30 лет. Первородящих было 18, повторнородящих – 22. Срок беременности находился в пределах от 16 до 38 недель. Только у 1/7 беременных длительность нахождения погибшего плода в полости матки до родоразрешения составила менее трех суток. Неразвивающейся беременности в анамнезе у данной группы женщин не отмечалось.
Средний возраст женщин третьей группы составил 27,7 года, причем почти половина (n = 7) были в возрасте старше 30 лет. Первородящих – 7, повторнородящих – 8. Срок беременности находился в пределах от 16 до 34 недель. Только у 1/3 беременных длительность нахождения погибшего плода в полости матки до родоразрешения была менее трех суток. У трех женщин в анамнезе отмечалась неразвивающаяся беременность, у одной – даже две неразвивающиеся беременности.
Срок беременности находился в пределах от 16 до 34 недель. Только у 1/3 беременных длительность нахождения погибшего плода в полости матки до родоразрешения была менее трех суток. У трех женщин в анамнезе отмечалась неразвивающаяся беременность, у одной – даже две неразвивающиеся беременности.
Исходом беременности в контрольной группе у 39 (88,6%) женщин стало самопроизвольное опорожнение матки (табл. 7). В пяти случаях пришлось прибегнуть к оперативному вмешательству: плодоразрушающей операции после расширения цервикального канала и амниотомии (n = 4) и экстирпации матки в связи с атоническим кровотечением после опорожнения матки (n = 1).
Во второй группе самопроизвольное прерывание беременности произошло у 28 (70%) женщин. Оперативные вмешательства в ходе освобождения матки от плода были проведены в 12 случаях, причем в пяти из них с удалением матки. Так, шести женщинам проведена плодоразрушающая операция, одной – кесарево сечение по поводу антенатальной гибели одного плода из двойни, ягодичного предлежания одного плода. В четырех случаях проведена экстирпация матки с плодом, в том числе у одной женщины по поводу сочетания антенатальной гибели плода с множественной миомой матки. У одной пациентки произведена экстирпация матки из-за атонического и гипокоагуляционного кровотечения после опорожнения матки.
В четырех случаях проведена экстирпация матки с плодом, в том числе у одной женщины по поводу сочетания антенатальной гибели плода с множественной миомой матки. У одной пациентки произведена экстирпация матки из-за атонического и гипокоагуляционного кровотечения после опорожнения матки.
В третьей группе самопроизвольное прерывание беременности наблюдалось в 11 (73,3%) случаях, и только четырем женщинам были проведены оперативные вмешательства: плодоразрушающая операция (n = 3) и экстирпация матки в связи с атоническим кровотечением после опорожнения матки (n = 1).
У 38 женщин первой группы, 27 женщин второй группы и 14 женщин третьей группы кровопотеря была компенсированной (до 400 мл). Кровопотеря от 450 до 2000 мл после опорожнения матки отмечена у шести женщин первой группы, 13 женщин второй группы, у одной женщины третьей группы. Как следует из полученных данных, патологическая кровопотеря прежде всего наблюдалась у женщин, не получавших комплексную терапию с использованием энтеросорбентов и свежезамороженной плазмы.
Таким образом, при антенатальной гибели плода формируется особая форма функциональной деятельности плаценты с резким изменением (снижением) синтетической активности синцитиотрофобласта и децидуальной оболочки. Функциональная несостоятельность плаценты приводит к перестройке адаптивных программ от синтоксических к кататоксическим, которая сопровождается изменением обмена веществ, агрегатного состояния крови, формированием системного эндотоксикоза. Применение комплексной подготовки к прерыванию беременности у женщин с антенатальной гибелью плода во втором и третьем триместре при диагностированных изменениях гемостаза (использование свежезамороженной плазмы и энтеросорбция Энтеросгелем) повысило эффективность лечения данной патологии. Снизился уровень кровопотери и уменьшилось число оперативных вмешательств, в том числе и гистерэктомий по поводу массивных кровотечений.
Мария Гиллам-Кракауэр; Clarence W.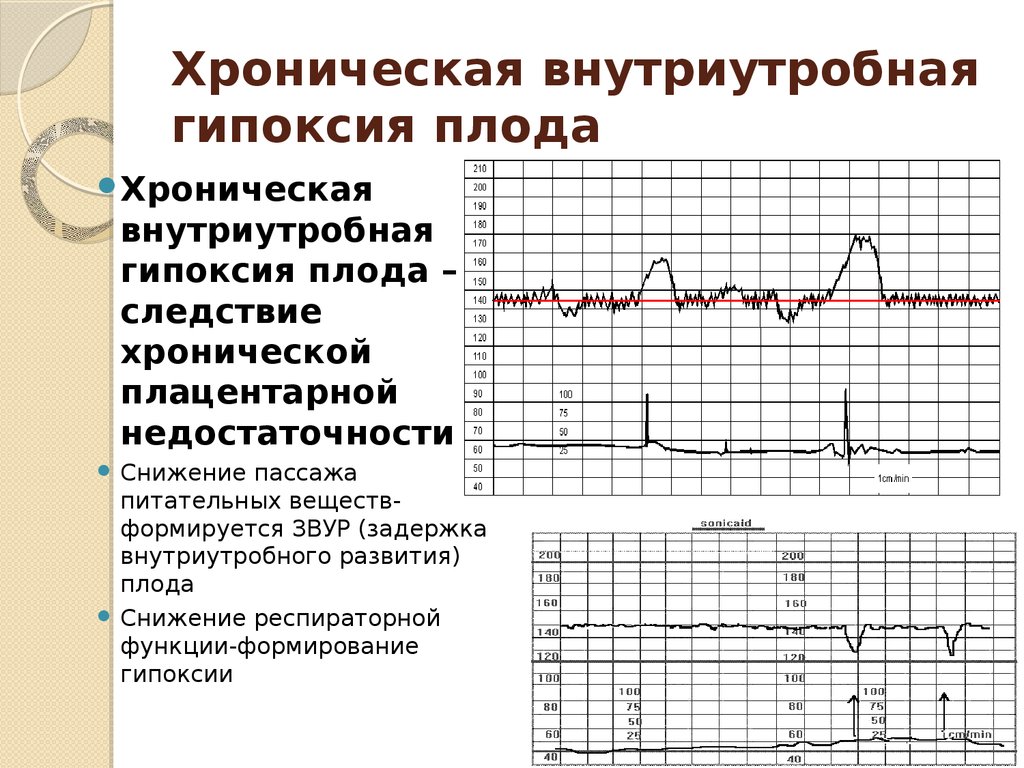 Gowen Jr.
Gowen Jr.
Информация об авторе
Последнее обновление: 22 августа 2022 г.
Перинатальная асфиксия — это отсутствие притока крови или газообмена к плоду или от него в период непосредственно перед, во время , или после процесса рождения. Перинатальная асфиксия может привести к серьезным системным и неврологическим последствиям из-за снижения кровотока и/или кислорода к плоду или младенцу в перипартальном периоде. Когда плацентарный (пренатальный) или легочный (немедленный послеродовой) газообмен нарушен или полностью прекращается, возникает частичная (гипоксия) или полная (аноксия) нехватка кислорода к жизненно важным органам. Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии. В этом мероприятии рассматриваются причины асфиксии при рождении, ее патофизиология и подчеркивается роль межпрофессиональной команды в ее лечении.
В этом мероприятии рассматриваются причины асфиксии при рождении, ее патофизиология и подчеркивается роль межпрофессиональной команды в ее лечении.
Цели:
Определите этиологию асфиксии при рождении.
Просмотрите представление пациента с родовой асфиксией.
Опишите доступные варианты лечения и ведения при асфиксии при рождении.
Объясните стратегии межпрофессиональной бригады по улучшению лечения и исходов у пациентов с асфиксией при рождении.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Перинатальная асфиксия — это отсутствие притока крови или газообмена к плоду или от него в период непосредственно перед, во время или после родового процесса. Перинатальная асфиксия может привести к серьезным системным и неврологическим последствиям из-за снижения кровотока и/или кислорода к плоду или младенцу в перипартальном периоде. Когда плацентарный (пренатальный) или легочный (немедленный послеродовой) газообмен нарушен или полностью прекращается, возникает частичная (гипоксия) или полная (аноксия) нехватка кислорода к жизненно важным органам. Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии.[1][2]
Когда плацентарный (пренатальный) или легочный (немедленный послеродовой) газообмен нарушен или полностью прекращается, возникает частичная (гипоксия) или полная (аноксия) нехватка кислорода к жизненно важным органам. Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии.[1][2]
Диагностические критерии гипоксически-ишемической энцефалопатии новорожденных следующие : через 10 минут с сохранением потребности в реанимации
Наличие полиорганной недостаточности
Клинические признаки энцефалопатии: гипотония, аномальные глазодвигательные или зрачковые движения, слабое или отсутствующее сосание, апноэ, гиперпноэ или клинические судороги
Неврологические нарушения не могут быть связаны с другой причиной (врожденная ошибка обмена веществ, генетическое заболевание, врожденное неврологическое расстройство, действие лекарств) , состояния матки (разрыв матки) или плаценты и пуповины (отслойка плаценты, узел или компрессия пуповины) и инфекция. Асфиксия может произойти до рождения или может возникнуть сразу после рождения у пациента с ослабленным здоровьем, требующего реанимации.[3][4][5]
Асфиксия может произойти до рождения или может возникнуть сразу после рождения у пациента с ослабленным здоровьем, требующего реанимации.[3][4][5]
Большинство случаев перинатальной асфиксии возникает во время родов, хотя 20% случаев возникают до родов, а другие случаи возникают в раннем постнатальном периоде. Перинатальная асфиксия может возникнуть из-за материнских событий (кровотечение, эмболия околоплодными водами, гемодинамический коллапс), плацентарных событий (острая отслойка), маточных событий (разрыв), событий пуповины (натяжение затылочного канатика, выпадение/отрыв пуповины) и интранатальной инфекции (материнская лихорадка). в работе). Для определения этиологии необходим тщательный акушерский и перинатальный анамнез.
Частота перинатальной асфиксии составляет два случая на 1000 рождений в развитых странах, но в развивающихся странах, где может быть ограничен доступ к медицинской помощи матерям и новорожденным, этот показатель в 10 раз выше. Из этих пораженных младенцев 15-20% умирают в неонатальном периоде, и до 25% выживших остаются с постоянным неврологическим дефицитом.[6]
Из этих пораженных младенцев 15-20% умирают в неонатальном периоде, и до 25% выживших остаются с постоянным неврологическим дефицитом.[6]
Различают три стадии поражения головного мозга при гипоксически-ишемической энцефалопатии. Во-первых, происходит немедленное первичное повреждение нейронов, возникающее из-за прекращения поступления кислорода и глюкозы в мозг. Это снижает АТФ и приводит к отказу АТФ-зависимого насоса NaK. Натрий входит в клетку, а затем вода, вызывая набухание клеток, широко распространенную деполяризацию и гибель клеток. Гибель и лизис клеток вызывают высвобождение глутамата, возбуждающей аминокислоты, которая вызывает увеличение внутриклеточного кальция и дальнейшую гибель клеток.
После непосредственного повреждения следует латентный период продолжительностью около шести часов, в течение которого происходит реперфузия, и некоторые клетки восстанавливаются.
Позднее вторичное повреждение нейронов происходит в течение следующих 24–48 часов, поскольку реперфузия приводит к притоку крови к поврежденным областям и из них, распространению токсичных нейротрансмиттеров и расширению пораженной области мозга.
Перинатальная асфиксия может привести к системным последствиям, включая неврологический инсульт, респираторный дистресс и легочную гипертензию, а также дисфункцию печени, миокарда и почек. В зависимости от тяжести и времени гипоксического инсульта у новорожденного с гипоксически-ишемической энцефалопатией вследствие перинатальной асфиксии могут наблюдаться различные неврологические симптомы. Использование стадирования Sarnat для энцефалопатии может быть полезным. На сарнатской стадии I, наименее тяжелой стадии, наблюдается генерализованный симпатический тонус, и новорожденный может быть гиперактивным с длительными периодами бодрствования, мидриазом и усилением глубоких сухожильных рефлексов. На стадии II по Сарнату новорожденный может быть вялым или оглушенным, со сниженным тонусом, сильным дистальным сгибанием и генерализованным парасимпатическим тонусом с миозом, брадикардией и повышенной секрецией. Судороги обычны на II стадии Сарнат. Сарнат Стадия III, наиболее тяжелая, характеризуется глубоким снижением уровня сознания, вялым тонусом, снижением глубоких сухожильных рефлексов и очень аномальной ЭЭГ. Клинические судороги менее распространены на III стадии Sarnat из-за глубокого повреждения головного мозга, препятствующего распространению клинических судорог.
Сарнат Стадия III, наиболее тяжелая, характеризуется глубоким снижением уровня сознания, вялым тонусом, снижением глубоких сухожильных рефлексов и очень аномальной ЭЭГ. Клинические судороги менее распространены на III стадии Sarnat из-за глубокого повреждения головного мозга, препятствующего распространению клинических судорог.
Рентгенограмма грудной клетки может определить необходимость интубации и/или терапии экзогенным сурфактантом. Газ артериальной крови полезен для диагностики респираторного и метаболического ацидоза и степени гипоксемии. Повреждение печени можно определить по уровням трансаминаз в сыворотке и факторам свертывания крови. Тропонин и CK-MB могут быть полезны для определения инфаркта миокарда, а креатинин и азот мочевины крови могут установить степень почечной дисфункции. Физиологически напряженные младенцы быстро истощают запасы глюкозы, и у них может развиться глубокая гипогликемия. Рекомендуются частые проверки уровня глюкозы в крови в критический период реанимации. [7][8][9]][8]
[7][8][9]][8]
Терапевтическая гипотермия — это лечение неонатальной гипоксически-ишемической энцефалопатии. После непосредственного первичного повреждения нейронов, во время которого происходит нарушение снабжения мозга кислородом и глюкозой, существует латентный период продолжительностью до 6 часов, прежде чем наступает вторичная фаза повреждения, когда поврежденные участки реперфузируются, а поврежденные клетки лизируются. высвобождение токсичных нейротрансмиттеров. Целью терапевтической гипотермии является вмешательство в латентный период и минимизация повреждения от вторичного повреждения нейронов. Терапевтическая гипотермия, начатая в течение шести часов после травмы, снижает смертность и тяжелую инвалидность с 62% до 48% и увеличивает выживаемость с нормальным исходом с 24% до 40% при количестве, необходимом для лечения, от шести до семи. Охлаждение всего тела, по-видимому, более эффективно снижает смертность, чем избирательное охлаждение головы, но оба метода эффективны для снижения тяжелой инвалидности и комбинированного исхода смерти и тяжелой инвалидности. Младенцы с умеренной энцефалопатией (стадия II по Сарнату) получают наибольшую пользу от терапевтической гипотермии. Важно отметить, что охлаждение, по-видимому, не снижает смертность за счет более серьезных неврологических нарушений у выживших. Побочные эффекты, связанные с терапевтической гипотермией, включают периферическую вазоконстрикцию, диурез, сердечную дисфункцию, аритмии, коагулопатию, тромбоцитопению, стридор, дисфункцию лейкоцитов, легочную гипертензию и некроз подкожной жировой клетчатки (отложения кальция в коже). Терапевтическая гипотермия может быть безопасно проведена с помощью специализированного оборудования и мониторинга в современных медицинских центрах. [10][11][12][13][14]
Младенцы с умеренной энцефалопатией (стадия II по Сарнату) получают наибольшую пользу от терапевтической гипотермии. Важно отметить, что охлаждение, по-видимому, не снижает смертность за счет более серьезных неврологических нарушений у выживших. Побочные эффекты, связанные с терапевтической гипотермией, включают периферическую вазоконстрикцию, диурез, сердечную дисфункцию, аритмии, коагулопатию, тромбоцитопению, стридор, дисфункцию лейкоцитов, легочную гипертензию и некроз подкожной жировой клетчатки (отложения кальция в коже). Терапевтическая гипотермия может быть безопасно проведена с помощью специализированного оборудования и мониторинга в современных медицинских центрах. [10][11][12][13][14]
Поддерживающее лечение дыхательной недостаточности, легочной гипертензии, коагулопатии и дисфункции миокарда. Младенцам с респираторным дистресс-синдромом и легочной гипертензией может потребоваться интубация, сурфактант, кислород и вдыхание оксида азота. Коагулопатию лечат разумным использованием продуктов крови для поддержания кислородной емкости и коагуляции. Дисфункция миокарда может привести к потребности в вазопрессорах. Нарушение функции почек может привести к олигурии или анурии; поэтому следует соблюдать осторожность при использовании кристаллоидной жидкости и продуктов крови.
Дисфункция миокарда может привести к потребности в вазопрессорах. Нарушение функции почек может привести к олигурии или анурии; поэтому следует соблюдать осторожность при использовании кристаллоидной жидкости и продуктов крови.
Опухоли головного мозга
Инфекции
. межпрофессиональная команда. Тем не менее, долгосрочный прогноз для этих детей трудно оценить. Сообщается, что в краткосрочной перспективе смертность от этого состояния превышает 30%, при этом большинство смертей происходит в течение первых нескольких дней после рождения. Те младенцы, которые выживают, часто остаются с неврологическим дефицитом от легкой до тяжелой степени, и они также в конечном итоге умирают от аспирации или системных инфекций. Было обнаружено, что у выживших в течение длительного времени был инвалидизирующий церебральный паралич, неадекватное умственное развитие или низкие психомоторные показатели, судороги, слепота и серьезные нарушения слуха. Ведение этих младенцев в долгосрочной перспективе сложно и непомерно дорого. [3][15](Уровень V)
Ведение этих младенцев в долгосрочной перспективе сложно и непомерно дорого. [3][15](Уровень V)
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Sugiura-Ogasawara M, Ebara T, Yamada Y, Shoji N, Matsuki T, Kano H, Kurihara T, Omori T, Tomizawa M, Miyata S, Kamijima M, Saitohima M ., Japan Environment, Children's Study Group (JECS). Неблагоприятная беременность и перинатальный исход у пациенток с привычным невынашиванием беременности: множественный анализ импутации с корректировкой показателя склонности, примененный к крупномасштабной когорте новорожденных Японского исследования окружающей среды и детей. Am J Reprod Immunol. 2019Январь;81(1):e13072. [Бесплатная статья PMC: PMC6646903] [PubMed: 30430678]
Hakobyan M, Dijkman KP, Laroche S, Naulaers G, Rijken M, Steiner K, van Straaten HLM, Swarte RMC, Teric Horst HJ, Zec Horst HJ A, Zonnenberg IA, Groenendaal F. Исходы младенцев с терапевтической гипотермией после перинатальной асфиксии и сепсиса с ранним началом. Неонатология. 2019;115(2):127-133. [PubMed: 30419568]
Исходы младенцев с терапевтической гипотермией после перинатальной асфиксии и сепсиса с ранним началом. Неонатология. 2019;115(2):127-133. [PubMed: 30419568]
Виароли Ф., Чунг П.Ю., О'Рейли М., Полглаз Г.Р., Пихлер Г., Шмельцер Г.М. Снижение травм головного мозга у недоношенных детей в родильном зале. Фронт Педиатр. 2018;6:290. [Бесплатная статья PMC: PMC6198082] [PubMed: 30386757]
Enweronu-Laryea CC, Andoh HD, Frimpong-Barfi A, Asenso-Boadi FM. Расходы родителей на стационарные неонатальные услуги при перинатальной асфиксии и низкой массе тела при рождении в Гане. ПЛОС Один. 2018;13(10):e0204410. [Бесплатная статья PMC: PMC6185862] [PubMed: 30312312]
Капая Х., Уильямс Р., Элтон Г., Анумба Д. Могут ли акушерские факторы риска предсказывать ацидемию плода при рождении? Ретроспективное исследование случай-контроль. Дж Беременность. 2018;2018:2195965. [Бесплатная статья PMC: PMC6139200] [PubMed: 30245882]

Odd D, Heep A, Luyt K, Draycott T. Гипоксически-ишемическая травма головного мозга: запланированные роды до интранатальных событий. J Неонатальная перинатальная медицина. 2017;10(4):347-353. [PubMed: 29286930]
Imai K, de Vries LS, Alderliesten T, Wagenaar N, van der Aa NE, Lequin MH, Benders MJNL, van Haastert IC, Groenendaal F. МРТ Изменения в таламусе и Базальные ганглии доношенных новорожденных с перинатальной асфиксией. Неонатология. 2018;114(3):253-260. [Бесплатная статья PMC: PMC6191878] [PubMed: 29961068]
Салас Дж., Текес А., Хванг М., Нортингтон Ф.Дж., Хуисман ТАГМ. Ультразвуковое исследование головы при неонатальном гипоксически-ишемическом повреждении и его имитаторах для клиницистов: обзор моделей повреждений и эволюции результатов с течением времени. Неонатология. 2018;114(3):185-197. [PubMed: 29936499]
Альсалем М., Зейнали Л.И., Мэтью Б., Кумар VHS. Уровни глюкозы в течение первых 24 часов после перинатальной гипоксии. Ам Дж. Перинатол. 2021 апр;38(5):490-496. [PubMed: 31683321]
Ам Дж. Перинатол. 2021 апр;38(5):490-496. [PubMed: 31683321]
Alsaleem M, Hpa N, Kumar VHS. Стридор у младенцев с гипоксически-ишемической энцефалопатией и гипотермией всего тела: серия случаев. J Неонатальная перинатальная медицина. 2020;13(4):463-468. [PubMed: 31985477]
Kebaya LMN, Kiruja J, Maina M, Kimani S, Kerubo C, McArthur A, Munn Z, Ayieko P. Основные рекомендации по реанимации новорожденных для медицинских работников в районной больнице Марагуа: a проект по внедрению лучших практик. JBI Database System Rev Implement Rep. 2018 Jul; 16 (7): 1564-1581. [Бесплатная статья PMC: PMC7116459] [PubMed: 29995715]
Саймон Л.В., Хашми М.Ф., Брэгг Б.Н. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 августа 2022 г. Оценка APGAR. [PubMed: 29262097]
Оливейра В., Сингхви Д.П., Монтальдо П., Лалли П.Дж., Мендоза Дж., Манеркар С.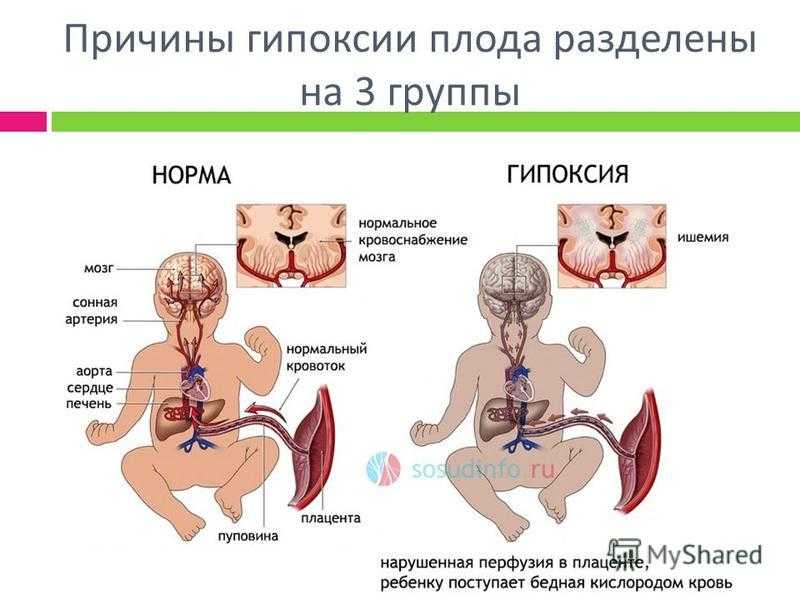 , Шанкаран С., Тайил С. Терапевтическая гипотермия при легкой неонатальной энцефалопатии: национальный обзор практики в Соединенное Королевство. Arch Dis Child Fetal Neonatal Ed. 2018 июль; 103 (4): F388-F390. [PubMed: 28942433]
, Шанкаран С., Тайил С. Терапевтическая гипотермия при легкой неонатальной энцефалопатии: национальный обзор практики в Соединенное Королевство. Arch Dis Child Fetal Neonatal Ed. 2018 июль; 103 (4): F388-F390. [PubMed: 28942433]
Альсалем М., Сааде Л., Эльберсон В., Кумар VHS. Некроз подкожного жира, редкий, но серьезный побочный эффект гипоксически-ишемической энцефалопатии и гипотермии всего тела. J Перинат Мед. 2019 26 ноября; 47 (9): 986-990. [PubMed: 31586967]
Райли С., Спайс Л.А., Пратер Л., Гарнер С.Л. Улучшение неонатальных исходов посредством глобального профессионального развития. Adv Неонатальный уход. 2019 фев; 19 (1): 56-64. [В паблике: 30148727]
Мария Гиллам-Кракауэр; Clarence W. Gowen Jr.
Информация об авторе
Последнее обновление: 22 августа 2022 г.
Перинатальная асфиксия — это отсутствие притока крови или газообмена к плоду или от него в период непосредственно перед, во время , или после процесса рождения. Перинатальная асфиксия может привести к серьезным системным и неврологическим последствиям из-за снижения кровотока и/или кислорода к плоду или младенцу в перипартальном периоде. Когда плацентарный (пренатальный) или легочный (немедленный послеродовой) газообмен нарушен или полностью прекращается, возникает частичная (гипоксия) или полная (аноксия) нехватка кислорода к жизненно важным органам. Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии. В этом мероприятии рассматриваются причины асфиксии при рождении, ее патофизиология и подчеркивается роль межпрофессиональной команды в ее лечении.
Перинатальная асфиксия может привести к серьезным системным и неврологическим последствиям из-за снижения кровотока и/или кислорода к плоду или младенцу в перипартальном периоде. Когда плацентарный (пренатальный) или легочный (немедленный послеродовой) газообмен нарушен или полностью прекращается, возникает частичная (гипоксия) или полная (аноксия) нехватка кислорода к жизненно важным органам. Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии. В этом мероприятии рассматриваются причины асфиксии при рождении, ее патофизиология и подчеркивается роль межпрофессиональной команды в ее лечении.
Цели:
Определите этиологию асфиксии при рождении.
Просмотрите представление пациента с родовой асфиксией.
Опишите доступные варианты лечения и ведения при асфиксии при рождении.
Объясните стратегии межпрофессиональной бригады по улучшению лечения и исходов у пациентов с асфиксией при рождении.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Перинатальная асфиксия — это отсутствие притока крови или газообмена к плоду или от него в период непосредственно перед, во время или после родового процесса. Перинатальная асфиксия может привести к серьезным системным и неврологическим последствиям из-за снижения кровотока и/или кислорода к плоду или младенцу в перипартальном периоде. Когда плацентарный (пренатальный) или легочный (немедленный послеродовой) газообмен нарушен или полностью прекращается, возникает частичная (гипоксия) или полная (аноксия) нехватка кислорода к жизненно важным органам. Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии.[1][2]
Это приводит к прогрессирующей гипоксемии и гиперкапнии. Если гипоксемия достаточно тяжелая, в тканях и жизненно важных органах (мышцах, печени, сердце и, в конечном счете, в мозге) возникает кислородный долг. Это приведет к анаэробному гликолизу и молочнокислому ацидозу. Неонатальная гипоксически-ишемическая энцефалопатия относится конкретно к неврологическим последствиям перинатальной асфиксии.[1][2]
Диагностические критерии гипоксически-ишемической энцефалопатии новорожденных следующие : через 10 минут с сохранением потребности в реанимации
Наличие полиорганной недостаточности
Клинические признаки энцефалопатии: гипотония, аномальные глазодвигательные или зрачковые движения, слабое или отсутствующее сосание, апноэ, гиперпноэ или клинические судороги
Неврологические нарушения не могут быть связаны с другой причиной (врожденная ошибка обмена веществ, генетическое заболевание, врожденное неврологическое расстройство, действие лекарств) , состояния матки (разрыв матки) или плаценты и пуповины (отслойка плаценты, узел или компрессия пуповины) и инфекция. Асфиксия может произойти до рождения или может возникнуть сразу после рождения у пациента с ослабленным здоровьем, требующего реанимации.[3][4][5]
Асфиксия может произойти до рождения или может возникнуть сразу после рождения у пациента с ослабленным здоровьем, требующего реанимации.[3][4][5]
Большинство случаев перинатальной асфиксии возникает во время родов, хотя 20% случаев возникают до родов, а другие случаи возникают в раннем постнатальном периоде. Перинатальная асфиксия может возникнуть из-за материнских событий (кровотечение, эмболия околоплодными водами, гемодинамический коллапс), плацентарных событий (острая отслойка), маточных событий (разрыв), событий пуповины (натяжение затылочного канатика, выпадение/отрыв пуповины) и интранатальной инфекции (материнская лихорадка). в работе). Для определения этиологии необходим тщательный акушерский и перинатальный анамнез.
Частота перинатальной асфиксии составляет два случая на 1000 рождений в развитых странах, но в развивающихся странах, где может быть ограничен доступ к медицинской помощи матерям и новорожденным, этот показатель в 10 раз выше. Из этих пораженных младенцев 15-20% умирают в неонатальном периоде, и до 25% выживших остаются с постоянным неврологическим дефицитом.[6]
Из этих пораженных младенцев 15-20% умирают в неонатальном периоде, и до 25% выживших остаются с постоянным неврологическим дефицитом.[6]
Различают три стадии поражения головного мозга при гипоксически-ишемической энцефалопатии. Во-первых, происходит немедленное первичное повреждение нейронов, возникающее из-за прекращения поступления кислорода и глюкозы в мозг. Это снижает АТФ и приводит к отказу АТФ-зависимого насоса NaK. Натрий входит в клетку, а затем вода, вызывая набухание клеток, широко распространенную деполяризацию и гибель клеток. Гибель и лизис клеток вызывают высвобождение глутамата, возбуждающей аминокислоты, которая вызывает увеличение внутриклеточного кальция и дальнейшую гибель клеток.
После непосредственного повреждения следует латентный период продолжительностью около шести часов, в течение которого происходит реперфузия, и некоторые клетки восстанавливаются.
Позднее вторичное повреждение нейронов происходит в течение следующих 24–48 часов, поскольку реперфузия приводит к притоку крови к поврежденным областям и из них, распространению токсичных нейротрансмиттеров и расширению пораженной области мозга.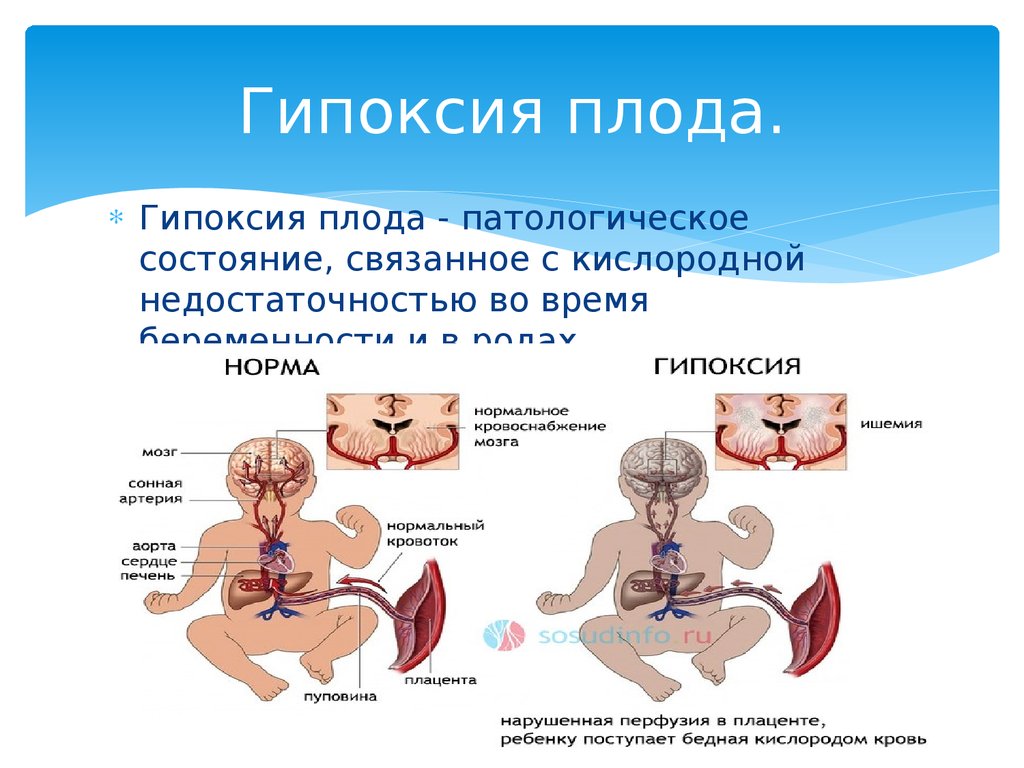
Перинатальная асфиксия может привести к системным последствиям, включая неврологический инсульт, респираторный дистресс и легочную гипертензию, а также дисфункцию печени, миокарда и почек. В зависимости от тяжести и времени гипоксического инсульта у новорожденного с гипоксически-ишемической энцефалопатией вследствие перинатальной асфиксии могут наблюдаться различные неврологические симптомы. Использование стадирования Sarnat для энцефалопатии может быть полезным. На сарнатской стадии I, наименее тяжелой стадии, наблюдается генерализованный симпатический тонус, и новорожденный может быть гиперактивным с длительными периодами бодрствования, мидриазом и усилением глубоких сухожильных рефлексов. На стадии II по Сарнату новорожденный может быть вялым или оглушенным, со сниженным тонусом, сильным дистальным сгибанием и генерализованным парасимпатическим тонусом с миозом, брадикардией и повышенной секрецией. Судороги обычны на II стадии Сарнат. Сарнат Стадия III, наиболее тяжелая, характеризуется глубоким снижением уровня сознания, вялым тонусом, снижением глубоких сухожильных рефлексов и очень аномальной ЭЭГ. Клинические судороги менее распространены на III стадии Sarnat из-за глубокого повреждения головного мозга, препятствующего распространению клинических судорог.
Сарнат Стадия III, наиболее тяжелая, характеризуется глубоким снижением уровня сознания, вялым тонусом, снижением глубоких сухожильных рефлексов и очень аномальной ЭЭГ. Клинические судороги менее распространены на III стадии Sarnat из-за глубокого повреждения головного мозга, препятствующего распространению клинических судорог.
Рентгенограмма грудной клетки может определить необходимость интубации и/или терапии экзогенным сурфактантом. Газ артериальной крови полезен для диагностики респираторного и метаболического ацидоза и степени гипоксемии. Повреждение печени можно определить по уровням трансаминаз в сыворотке и факторам свертывания крови. Тропонин и CK-MB могут быть полезны для определения инфаркта миокарда, а креатинин и азот мочевины крови могут установить степень почечной дисфункции. Физиологически напряженные младенцы быстро истощают запасы глюкозы, и у них может развиться глубокая гипогликемия. Рекомендуются частые проверки уровня глюкозы в крови в критический период реанимации.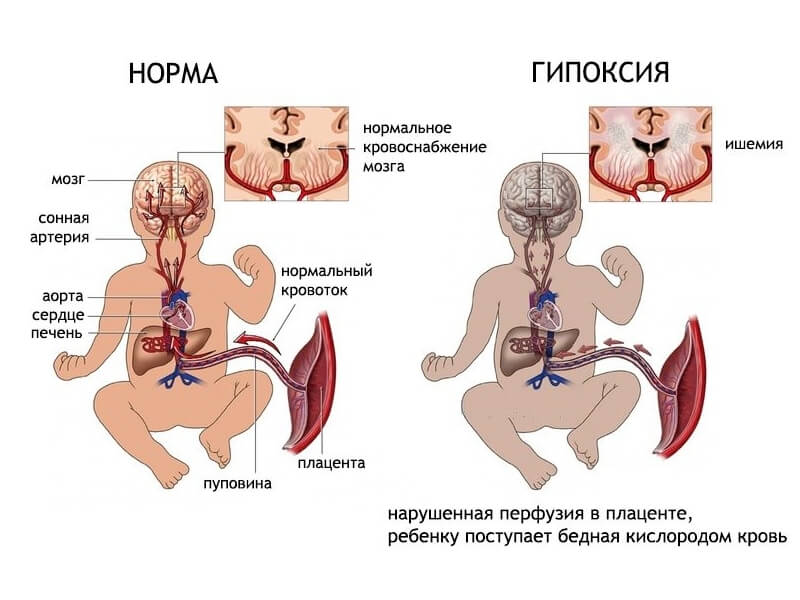 [7][8][9]][8]
[7][8][9]][8]
Терапевтическая гипотермия — это лечение неонатальной гипоксически-ишемической энцефалопатии. После непосредственного первичного повреждения нейронов, во время которого происходит нарушение снабжения мозга кислородом и глюкозой, существует латентный период продолжительностью до 6 часов, прежде чем наступает вторичная фаза повреждения, когда поврежденные участки реперфузируются, а поврежденные клетки лизируются. высвобождение токсичных нейротрансмиттеров. Целью терапевтической гипотермии является вмешательство в латентный период и минимизация повреждения от вторичного повреждения нейронов. Терапевтическая гипотермия, начатая в течение шести часов после травмы, снижает смертность и тяжелую инвалидность с 62% до 48% и увеличивает выживаемость с нормальным исходом с 24% до 40% при количестве, необходимом для лечения, от шести до семи. Охлаждение всего тела, по-видимому, более эффективно снижает смертность, чем избирательное охлаждение головы, но оба метода эффективны для снижения тяжелой инвалидности и комбинированного исхода смерти и тяжелой инвалидности. Младенцы с умеренной энцефалопатией (стадия II по Сарнату) получают наибольшую пользу от терапевтической гипотермии. Важно отметить, что охлаждение, по-видимому, не снижает смертность за счет более серьезных неврологических нарушений у выживших. Побочные эффекты, связанные с терапевтической гипотермией, включают периферическую вазоконстрикцию, диурез, сердечную дисфункцию, аритмии, коагулопатию, тромбоцитопению, стридор, дисфункцию лейкоцитов, легочную гипертензию и некроз подкожной жировой клетчатки (отложения кальция в коже). Терапевтическая гипотермия может быть безопасно проведена с помощью специализированного оборудования и мониторинга в современных медицинских центрах. [10][11][12][13][14]
Младенцы с умеренной энцефалопатией (стадия II по Сарнату) получают наибольшую пользу от терапевтической гипотермии. Важно отметить, что охлаждение, по-видимому, не снижает смертность за счет более серьезных неврологических нарушений у выживших. Побочные эффекты, связанные с терапевтической гипотермией, включают периферическую вазоконстрикцию, диурез, сердечную дисфункцию, аритмии, коагулопатию, тромбоцитопению, стридор, дисфункцию лейкоцитов, легочную гипертензию и некроз подкожной жировой клетчатки (отложения кальция в коже). Терапевтическая гипотермия может быть безопасно проведена с помощью специализированного оборудования и мониторинга в современных медицинских центрах. [10][11][12][13][14]
Поддерживающее лечение дыхательной недостаточности, легочной гипертензии, коагулопатии и дисфункции миокарда. Младенцам с респираторным дистресс-синдромом и легочной гипертензией может потребоваться интубация, сурфактант, кислород и вдыхание оксида азота. Коагулопатию лечат разумным использованием продуктов крови для поддержания кислородной емкости и коагуляции. Дисфункция миокарда может привести к потребности в вазопрессорах. Нарушение функции почек может привести к олигурии или анурии; поэтому следует соблюдать осторожность при использовании кристаллоидной жидкости и продуктов крови.
Дисфункция миокарда может привести к потребности в вазопрессорах. Нарушение функции почек может привести к олигурии или анурии; поэтому следует соблюдать осторожность при использовании кристаллоидной жидкости и продуктов крови.
Опухоли головного мозга
Инфекции
. межпрофессиональная команда. Тем не менее, долгосрочный прогноз для этих детей трудно оценить. Сообщается, что в краткосрочной перспективе смертность от этого состояния превышает 30%, при этом большинство смертей происходит в течение первых нескольких дней после рождения. Те младенцы, которые выживают, часто остаются с неврологическим дефицитом от легкой до тяжелой степени, и они также в конечном итоге умирают от аспирации или системных инфекций. Было обнаружено, что у выживших в течение длительного времени был инвалидизирующий церебральный паралич, неадекватное умственное развитие или низкие психомоторные показатели, судороги, слепота и серьезные нарушения слуха. Ведение этих младенцев в долгосрочной перспективе сложно и непомерно дорого. [3][15](Уровень V)
Ведение этих младенцев в долгосрочной перспективе сложно и непомерно дорого. [3][15](Уровень V)
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Sugiura-Ogasawara M, Ebara T, Yamada Y, Shoji N, Matsuki T, Kano H, Kurihara T, Omori T, Tomizawa M, Miyata S, Kamijima M, Saitohima M ., Japan Environment, Children's Study Group (JECS). Неблагоприятная беременность и перинатальный исход у пациенток с привычным невынашиванием беременности: множественный анализ импутации с корректировкой показателя склонности, примененный к крупномасштабной когорте новорожденных Японского исследования окружающей среды и детей. Am J Reprod Immunol. 2019Январь;81(1):e13072. [Бесплатная статья PMC: PMC6646903] [PubMed: 30430678]
Hakobyan M, Dijkman KP, Laroche S, Naulaers G, Rijken M, Steiner K, van Straaten HLM, Swarte RMC, Teric Horst HJ, Zec Horst HJ A, Zonnenberg IA, Groenendaal F. Исходы младенцев с терапевтической гипотермией после перинатальной асфиксии и сепсиса с ранним началом. Неонатология. 2019;115(2):127-133. [PubMed: 30419568]
Исходы младенцев с терапевтической гипотермией после перинатальной асфиксии и сепсиса с ранним началом. Неонатология. 2019;115(2):127-133. [PubMed: 30419568]
Виароли Ф., Чунг П.Ю., О'Рейли М., Полглаз Г.Р., Пихлер Г., Шмельцер Г.М. Снижение травм головного мозга у недоношенных детей в родильном зале. Фронт Педиатр. 2018;6:290. [Бесплатная статья PMC: PMC6198082] [PubMed: 30386757]
Enweronu-Laryea CC, Andoh HD, Frimpong-Barfi A, Asenso-Boadi FM. Расходы родителей на стационарные неонатальные услуги при перинатальной асфиксии и низкой массе тела при рождении в Гане. ПЛОС Один. 2018;13(10):e0204410. [Бесплатная статья PMC: PMC6185862] [PubMed: 30312312]
Капая Х., Уильямс Р., Элтон Г., Анумба Д. Могут ли акушерские факторы риска предсказывать ацидемию плода при рождении? Ретроспективное исследование случай-контроль. Дж Беременность. 2018;2018:2195965. [Бесплатная статья PMC: PMC6139200] [PubMed: 30245882]

Odd D, Heep A, Luyt K, Draycott T. Гипоксически-ишемическая травма головного мозга: запланированные роды до интранатальных событий. J Неонатальная перинатальная медицина. 2017;10(4):347-353. [PubMed: 29286930]
Imai K, de Vries LS, Alderliesten T, Wagenaar N, van der Aa NE, Lequin MH, Benders MJNL, van Haastert IC, Groenendaal F. МРТ Изменения в таламусе и Базальные ганглии доношенных новорожденных с перинатальной асфиксией. Неонатология. 2018;114(3):253-260. [Бесплатная статья PMC: PMC6191878] [PubMed: 29961068]
Салас Дж., Текес А., Хванг М., Нортингтон Ф.Дж., Хуисман ТАГМ. Ультразвуковое исследование головы при неонатальном гипоксически-ишемическом повреждении и его имитаторах для клиницистов: обзор моделей повреждений и эволюции результатов с течением времени. Неонатология. 2018;114(3):185-197. [PubMed: 29936499]
Альсалем М., Зейнали Л.И., Мэтью Б., Кумар VHS. Уровни глюкозы в течение первых 24 часов после перинатальной гипоксии. Ам Дж. Перинатол. 2021 апр;38(5):490-496. [PubMed: 31683321]
Ам Дж. Перинатол. 2021 апр;38(5):490-496. [PubMed: 31683321]
Alsaleem M, Hpa N, Kumar VHS. Стридор у младенцев с гипоксически-ишемической энцефалопатией и гипотермией всего тела: серия случаев. J Неонатальная перинатальная медицина. 2020;13(4):463-468. [PubMed: 31985477]
Kebaya LMN, Kiruja J, Maina M, Kimani S, Kerubo C, McArthur A, Munn Z, Ayieko P. Основные рекомендации по реанимации новорожденных для медицинских работников в районной больнице Марагуа: a проект по внедрению лучших практик. JBI Database System Rev Implement Rep. 2018 Jul; 16 (7): 1564-1581. [Бесплатная статья PMC: PMC7116459] [PubMed: 29995715]
Саймон Л.В., Хашми М.Ф., Брэгг Б.Н. StatPearls [Интернет]. Издательство StatPearls; Остров сокровищ (Флорида): 18 августа 2022 г. Оценка APGAR. [PubMed: 29262097]
Оливейра В., Сингхви Д.П., Монтальдо П., Лалли П.Дж., Мендоза Дж., Манеркар С.