2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Сегодня антибиотиками лечится большинство заболеваний. Однако очень мало людей знают о вреде и побочных эффектах этих лекарственных препаратов, чем опасно самолечение антибиотиками и какие вопросы следует задавать врачу, прежде чем начинать принимать эти лекарства.
Итак, ниже приведены основные правила, ознакомиться с которыми необходимо до начала проведения антибиотикотерапии.
1. Обязательно сообщите назначающему вам антибиотик врачу следующее:
2. Для предотвращения многих нежелательных эффектов самолечения, вы должны знать следующие правила:

3. При самолечении антибиотиками наиболее часто встречаются следующие осложнения:
Источник: http://medvestnik.by/
Ученые предложили стратегию правильной смены антибиотиков в процессе лечения, которая не позволяет бактериям к ним приспособиться.
У человека и инфекционных бактерий происходит напряженная гонка вооружений. Человек травит бактерии антибиотиком, а они довольно быстро приобретают мутации устойчивости и приспосабливаются к нему. Человек изобретает другой антибиотик, но и с ним история повторяется. Ситуация усугубляется тем, что очень многие принимают антибиотики без нужды и даже тогда, когда они явно не помогут, например при вирусных инфекциях. Резистентность к антибиотикам — один из самых серьезных глобальных вызовов современному здравоохранению. Если медицина не найдет принципиальный выход из этой ситуации, она окажется в кризисе.
Но пока человечество не изобрело что-то принципиально новое на замету антибиотикам, остается искать, как их правильно применять.
Такую практическую стратегию предлагают авторы статьи в журнале Science Translation Medicine. Они испытали ее в лаборатории на бактерии кишечной палочки E. сoli и убедились в ее эффективности.
Тест от ненужных антибиотиков
Ученые разработали тест, который улавливает в крови генетические маркеры любой вирусной инфекции. Это позволит...
20 сентября 10:59
Идея, в общем-то, не нова. Как отмечают авторы статьи, с 1950 года медики наблюдали, что,
когда какие-то патогенные бактерии приобретают резистентность к одному лекарственному препарату, они в то же время становятся более чувствительными к другому препарату.
Этот эффект они назвали «коллатеральной сенситивностью», что приблизительно можно перевести как «дополнительная чувствительность». Он давно известен, но, по утверждению авторов статьи, хорошо забыт.
Чтобы исследовать этот эффект в эксперименте, Лейла Имамович и ее коллеги с Факультета системной биологии Технического университета Дании проследили эволюцию E. сoli в процессе того, как бактерия приобретала устойчивость к 23 часто применяемым антибиотикам. Их интересовало, как резистентность бактерии к одному лекарству меняет ее ответ на другое лекарство.
сoli в процессе того, как бактерия приобретала устойчивость к 23 часто применяемым антибиотикам. Их интересовало, как резистентность бактерии к одному лекарству меняет ее ответ на другое лекарство.
Ученые наблюдали, что, когда E. сoli путем генетических изменений вырабатывала резистентность к одному антибиотику, она при этом становилась более чувствительной к действию нескольких других антибиотиков.
Изучив несколько сотен таких взаимодополнительных сочетаний, специалисты составили разветвленную сеть, связывающую все испытанные ими лекарственные средства.
Устойчивость к антибиотикам передалась от скотины
Человек заражается от скота золотистым стафилококком, который не берут антибиотики, увидели ученые по анализу...
03 июля 10:54
Руководствуясь найденными связями, ученые на модельном объекте попробовали использовать стратегию замены антибиотика. Например, когда кишечная палочка становилась устойчивой а антибиотику А, она в то же время лучше поддавалась действию антибиотика В, и быстрая замена А на В приводила к успеху. Если же бактерия успевала выработать устойчивость к В, его снова меняли на А. На генетическом уровне происходило вот что. При действии антибиотика А бактерии «дикого типа» погибали, но оставались устойчивые к А клоны, которые получали преимущество. Когда же антибиотик меняли на В, то все А-устойчивые клоны быстро погибали, и оставались клоны «дикого типа». В дальнейшем появлялись В-устойчивые клоны, которые начинали процветать. Тут надо было вернуться к прежнему лекарству и быстро подавить их антибиотиком А. И так далее, по циклу.
Если же бактерия успевала выработать устойчивость к В, его снова меняли на А. На генетическом уровне происходило вот что. При действии антибиотика А бактерии «дикого типа» погибали, но оставались устойчивые к А клоны, которые получали преимущество. Когда же антибиотик меняли на В, то все А-устойчивые клоны быстро погибали, и оставались клоны «дикого типа». В дальнейшем появлялись В-устойчивые клоны, которые начинали процветать. Тут надо было вернуться к прежнему лекарству и быстро подавить их антибиотиком А. И так далее, по циклу.
Такую циклическую атаку бактерии в конце концов не выдерживали. А главное, не наступала такая ситуация, когда вся популяция полностью состояла из устойчивых бактерий.
Такая стратегия (замена одного антибиотика на другой, к которому возникает коллатеральная сенситивность) делает возможность врачам идти на шаг впереди бактерии, объясняют специалисты. У нее нужно перехватить инициативу.
Казалось бы, врачи и так знают, что при лечении, когда один антибиотик перестает помогать, его надо менять на другой. Но они делают это вслепую, методом проб и ошибок: «поможет — не поможет». Предложенная стратегия позволяет подходить к смене антибиотика осознанно, менять его именно на тот, к которому повышается чувствительность. А затем снова возвращаться к первому, чтобы не менять лекарства до бесконечности.
Но они делают это вслепую, методом проб и ошибок: «поможет — не поможет». Предложенная стратегия позволяет подходить к смене антибиотика осознанно, менять его именно на тот, к которому повышается чувствительность. А затем снова возвращаться к первому, чтобы не менять лекарства до бесконечности.
Самый эффективный антибиотик
Испытав 663 000 различных веществ, ученые создали принципиально иные антибиотики. Они оказались в сто раз...
04 июня 11:36
Например, ученые показали, что антибиотики «Гентамицин» и «Цефуроксим» составляют подходящую пару для того, чтобы чередовать их в процессе лечения.
Когда бактерии вырабатывают резистентность к «Гентамицину», они становятся более чувствительными к «Цефуроксиму», и наоборот.
Авторы статьи подчеркивают, что полученные в эксперименте с кишечной палочкой результаты нужно, конечно, протестировать в экспериментах на животных, прежде чем применять эту стратегию в клинике. Но они рассчитывают, что она окажется реально полезной для лечения больных с хроническими инфекциями типа туберкулеза, которые требуют постоянного приема антибиотиков. Она также позволит существующим в настоящее время антибиотикам дольше «оставаться на арене» и не быть списанными из-за неэффективности.
Она также позволит существующим в настоящее время антибиотикам дольше «оставаться на арене» и не быть списанными из-за неэффективности.
Возможно, эта стратегия применима и к лечению рака.
Ведь когда врачи с помощью химиопрепаратов пытаются убить раковые клетки, последние также вырабатывают устойчивость и вынуждают медиков менять лекарство. Теперь это можно будет делать не вслепую.
Используя генетический надзор в режиме реального времени, исследователи обнаружили, что бактериальные инфекции быстро развивают устойчивость к антибиотикам только для того, чтобы эти генные мутации исчезли в течение нескольких дней после перехода на другое лечение.
Бактерии, устойчивые к антибиотикам или противомикробным препаратам (УПП), вызывают очень трудно поддающиеся лечению инфекции, истощая как деньги, так и ресурсы больниц. УПП развивается после системного лечения бактериальных инфекций различными ненужными антибиотиками. Бактериальные инфекции обычно лечат динамически, с быстрой сменой антибиотиков в середине лечения.
Бактериальные инфекции обычно лечат динамически, с быстрой сменой антибиотиков в середине лечения.
Одно исследование, опубликованное сегодня в журнале Nature Communications , было направлено на изучение последствий частого изменения антибиотикотерапии у отдельных пациентов. «Врачи часто пробуют определенный антибиотик в течение определенного времени, а затем переключаются на другой антибиотик, — сказал автор исследования Грегори Прибе, доктор медицинских наук, — но неизвестно, как смена терапии влияет на устойчивость к антибиотикам».
Чтобы отслеживать изменения и частоту мутаций AMR с течением времени, исследователи использовали новый метод, который они назвали глубоким секвенированием ампликонов, нацеленным на резистентность (RETRA-Seq). RETRA-Seq сочетает полногеномное секвенирование с глубоким секвенированием. «RETRA-Seq тестирует бактериальную популяцию в целом, поэтому он может обнаруживать эти редкие устойчивые к антибиотикам бактерии с гораздо более высокой чувствительностью, чем обычные клинические методы», — сказал Алекс МакАдам, доктор медицинских наук, соавтор исследования.
В ходе исследования было проанализировано образца Pseudomonas aeruginosa, образца, последовательно отобранных у 7 пациентов. Доноры образцов были госпитализированы в Бостонскую детскую больницу, и им потребовалась искусственная вентиляция легких в начале респираторной инфекции. Тестирование начинали в начале инфекции и продолжали в течение 4-11 дней во время курса лечения антибиотиками. Из образцов мокроты пациентов исследователи секвенировали 420 культур бактериальных колоний.
Исследователи обнаружили, что резистентность к антибиотикам в небольших масштабах возрастала и ослабевала по мере изменения методов лечения. Мутации гена P. aeruginosa быстро менялись, при этом мутации УПП появлялись после начала лечения антибиотиками и исчезали в течение нескольких дней после перехода на другое лечение.
Метод RETRA-Seq выявил редкие мутации резистентности, которые ранее не выявлялись с помощью секвенирования генов в культуре, проводимого клинически. Исследователи обнаружили, что устойчивость к противомикробным препаратам может увеличиться почти в 40 раз за 5-12 дней в ответ на изменение режима антибиотикотерапии пациентов.
Исследователи обнаружили, что устойчивость к противомикробным препаратам может увеличиться почти в 40 раз за 5-12 дней в ответ на изменение режима антибиотикотерапии пациентов.
Наши результаты показывают, что циклическое применение антибиотиков может быть более эффективным на уровне отдельных пациентов», — сказал Прибе. «Мы стремимся использовать геномный надзор для информирования о начальной антибиотикотерапии — как о типе антибиотика, так и о сроках — и затем информировать о смене антибиотика по мере изменения частоты мутаций устойчивости к антибиотикам».
Это исследование и метод RETRA-Seq могут проложить путь к выбору курса антибиотикотерапии, который не будет вызывать мутации гена устойчивости к противомикробным препаратам при опасных бактериальных инфекциях. Такие исследования жизненно важны для предотвращения растущей угрозы устойчивых к антибиотикам бактерий и укрепления рационального использования противомикробных препаратов.
Тимоти Хузар, 9 августа 2021 г. — факт проверен Анной Гилфорд, доктором философии.
— факт проверен Анной Гилфорд, доктором философии.
В новом исследовании исследователи показали, что цикличность антибиотиков, когда врачи переключаются между антибиотиками для преодоления устойчивости к антибиотикам, может быть неэффективной и неустойчивой стратегией.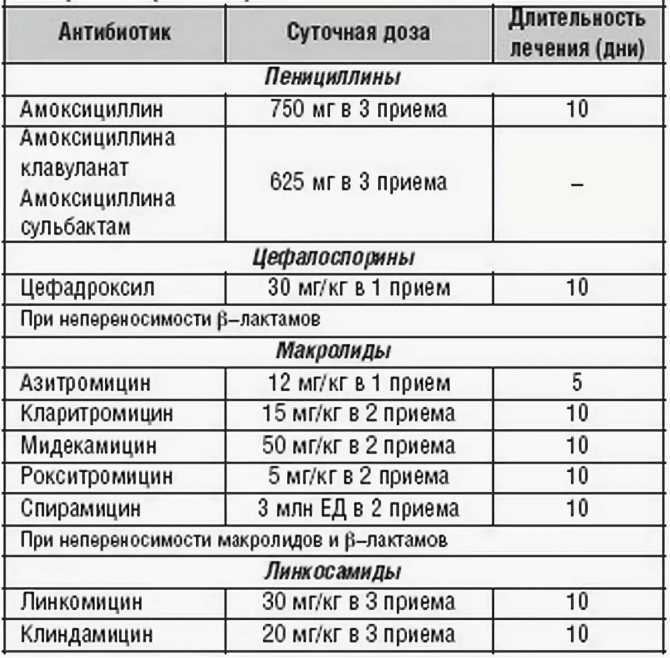
Однако в своем исследовании, опубликованном в The Lancet Microbe , исследователи обнаружили, что некоторые субпопуляции бактерий могут подходить для цикла антибиотиков в ограниченных случаях.
Антибиотики имеют решающее значение для лечения и профилактики бактериальных инфекций.
Использование микроорганизмов для защиты от инфекций было задокументировано в древнем Китае, Греции и Египте, а современное использование антибиотиков началось после открытия Александром Флемингом пенициллина в 1928 году. серьезные, растущие проблемы со здоровьем. Всемирная организация здравоохранения (ВОЗ) описывает устойчивость к антибиотикам как «одну из самых больших угроз для глобального здравоохранения, продовольственной безопасности и развития сегодня».
У бактерий может развиться резистентность при использовании антибиотиков. Однако растущая распространенность устойчивых бактерий является результатом ряда поддающихся изменению факторов.
Исследователи обнаружили, что устойчивость к антибиотикам усугубляется чрезмерным использованием антибиотиков, неправильным назначением и широким использованием этих препаратов в интенсивном животноводстве.
Также не хватает исследований новых антибиотиков, что обусловлено мотивом получения прибыли фармацевтической промышленностью, которая поощряет исследования в области лечения хронических заболеваний, а не лечебные методы лечения.
В соответствии с угрозами устойчивости к антибиотикам в США, отчет Центров по контролю и профилактике заболеваний (CDC) за 2019 год, бактерии и грибы, устойчивые к антибиотикам, ежегодно вызывают смерть около 35 000 человек.
Доктор Роберт Р. Редфилд, бывший директор CDC, говорит, что отчет «показывает нам, что наши коллективные усилия по остановке распространения микробов и предотвращению инфекций спасают жизни».
Ссылаясь на более раннюю версию документа, он отмечает, что «Отчет 2013 года побудил страну к критическим действиям и инвестициям в борьбу с устойчивостью к антибиотикам. Сегодняшний отчет демонстрирует заметный прогресс, но угроза по-прежнему реальна. Каждый из нас играет важную роль в борьбе с ним. Жизнь здесь, в США, и во всем мире зависит от этого».
Жизнь здесь, в США, и во всем мире зависит от этого».
Между тем, исследование, проведенное организацией Public Health England (PHE), показывает, что врачи ежедневно диагностируют 178 инфекций, устойчивых к противомикробным препаратам.
Профессор Изабель Оливер, директор Национальной инфекционной службы в PHE, говорит: «Мы хотим, чтобы общественность присоединилась к нам в борьбе с устойчивостью к противомикробным препаратам — прислушивайтесь к советам своего [семейного врача], фармацевта или медсестры и принимайте антибиотики только тогда, когда необходимый."
«Тревожно, что все больше инфекций становятся устойчивыми к этим жизненно важным лекарствам. Прием антибиотиков, когда они вам не нужны, может иметь серьезные последствия для вас и здоровья вашей семьи сейчас и в будущем».
Исследователи предположили, что одним из способов борьбы с устойчивостью к антибиотикам может быть выявление штаммов бактерий, которые становятся устойчивыми к одному антибиотику и в то же время становятся чувствительными к другому из-за одних и тех же эволюционных факторов.
В этих обстоятельствах чередование двух антибиотиков может отсрочить или подавить резистентность бактерий к лекарствам.
Однако исследования этого процесса дали неоднозначные результаты, и многие исследования, выявившие эту «сопутствующую чувствительность», были лабораторными исследований, а не исследований на живых животных.
Ученые выявили, что бактерии по-разному реагируют на антибиотики в зависимости от метаболических условий, в которых они находятся, и поэтому устойчивость бактерий в лаборатории может отличаться от устойчивости человека.
В беседе с Medical News Today д-р Эрик Райт из отдела биомедицинской информатики Университета Питтсбурга и соответствующий автор настоящего исследования сказал:
«Устойчивость к антибиотикам является распространенной проблемой в клинике . Первоначально мы намеревались найти пары антибиотиков, проявляющие колебательную чувствительность. То есть возбудитель [не может] быть устойчивым к обоим антибиотикам в паре одновременно. Мы назвали это непересекающимся сопротивлением, потому что непересекающееся множество является взаимоисключающим».
Мы назвали это непересекающимся сопротивлением, потому что непересекающееся множество является взаимоисключающим».
«Существование таких пар антибиотиков ожидается из-за явления, известного как побочная чувствительность: когда патоген адаптируется к одному лекарству, он может стать более чувствительным к другим лекарствам (побочная чувствительность) или может стать более устойчивым (кросс-чувствительность). сопротивление)."
«Ранее исследования показали, что между некоторыми парами антибиотиков существует побочная чувствительность [в лабораторных исследованиях]. Вопрос в том, приводит ли это к наблюдению дизъюнктного сопротивления в клинике. Если это произойдет, то мы потенциально могли бы использовать эти пары антибиотиков, чтобы избежать множественной лекарственной устойчивости».
В настоящей статье доктор Райт и соавтор Эндрю Бекли, аспирант того же факультета, хотели получить более точную реальную информацию о том, какие пары антибиотиков вызывают побочную чувствительность. Для этого они провели ретроспективное исследование 448 563 результатов тестов на чувствительность к противомикробным препаратам.
Для этого они провели ретроспективное исследование 448 563 результатов тестов на чувствительность к противомикробным препаратам.
Они получили данные из 23 больниц в период с января 2015 года по декабрь 2018 года. Все больницы были частью системы Медицинского центра Университета Питтсбурга.
Затем исследователи разработали метод подсчета баллов для выявления антибиотиков, которые были независимо устойчивыми, одновременно устойчивыми или раздельно устойчивыми — последний предлагает потенциал для циклического использования антибиотиков.
Исследователи обнаружили 69 пар антибиотиков, обладающих некоторыми свойствами непересекающейся резистентности субпопуляций шести наиболее распространенных бактериальных патогенов.
Однако на уровне видов этот показатель снизился до 6 из 875 пар антибиотиков — или всего 0,7% .
Напротив, более половины пар антибиотиков показали одновременную резистентность, а это означает, что бактерии, как правило, были устойчивы к обоим антибиотикам.
Кроме того, эта одновременная резистентность распространялась на тройные антибиотики в большей степени, чем предсказывали исследователи, основываясь на данных для пар антибиотиков. Это говорит о том, что по мере того, как бактерии вырабатывают устойчивость к одному антибиотику, они с большей вероятностью разовьют устойчивость к множеству других, считают исследователи.
Доктор Райт сказал MNT : «В основном мы обнаруживали одновременную резистентность между парами антибиотиков, что противоположно раздельной резистентности. Это означает, что эволюция устойчивости к антибиотикам порождает еще большую устойчивость к антибиотикам. Мы также показали, что это верно для комбинаций трех антибиотиков».
«На данном этапе исследования это было не то, что мы собирались найти. Но из предыдущих [лабораторных] экспериментов мы знали, что побочная чувствительность не всегда сохраняется у всех штаммов вида».
«К сожалению, в нашем наборе данных бактерии классифицируются только на уровне видов. Однако мы также знали, что устойчивость часто группируется на филогенетических деревьях, поскольку она передается по наследству. Таким образом, мы могли бы использовать устойчивость к антибиотикам в качестве маркера для классификации на уровне подвидов».
Однако мы также знали, что устойчивость часто группируется на филогенетических деревьях, поскольку она передается по наследству. Таким образом, мы могли бы использовать устойчивость к антибиотикам в качестве маркера для классификации на уровне подвидов».
«Мы повторили наш анализ субпопуляций видов, устойчивых к одному из препаратов в нашем наборе. Когда мы это сделали, было обнаружено 69 пар антибиотиков, проявляющих непересекающуюся резистентность».
Д-р Райт сообщил MNT , что хотя меньшее количество пар антибиотиков сохраняет непересекающуюся резистентность, 69 пар, идентифицированных на уровне подвидов, станут хорошей отправной точкой для дальнейших исследований.
«Одной из возможных стратегий борьбы с устойчивостью к антибиотикам является чередование разных антибиотиков. Чаще всего эта стратегия использовалась путем назначения разных антибиотиков разным пациентам в одной и той же больнице, либо через каждого второго пациента, либо через месяц».
«Эти стратегии переключения не смогли обуздать резистентность, но это может быть из-за неправильного выбора пар антибиотиков.