2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Аббревиатура СОЭ означает «скорость оседания эритроцитов», измеряемая миллиметрами в час. (В старых справочниках этот анализ назывался РОЭ). В основе исследования лежит процесс, обусловленный гравитационными силами. Поскольку эритроциты тяжелее других элементов крови, они первыми выпадают в осадок. Их подсчет в вертикально установленной пробирке через час и является основой анализа.
Скорость, с которой эритроциты опускаются на дно, зависит от многих факторов, как физиологических, так и патологических. Значения СОЭ отличаются в зависимости от возраста, пола. Изменения показателей возможны в связи с особенностями питания, прохождением пациентом курса лечения определенными видами медикаментозных препаратов, кортикостероидами, противовоспалительными средствами.
Знать, что показывает высокое СОЭ, особенно важно, так как превышение нормативов наиболее часто свидетельствует в пользу развития того или иного заболевания. Высокие цифры СОЭ могут свидетельствовать о наличии в организме онкопатологии, воспалительного процесса, инфекционного, ревматологического, анемии. Показатель будет превышать норму при инфаркте миокарда, травме, аллергии, беременности.
Несмотря на то, что СОЭ – неспецифичный показатель, диагностическая ценность исследования огромна. Она обусловлена его высокой чувствительностью. Изменение данного показателя отмечается уже на ранних стадиях развития патологического процесса, когда другие анализы еще не являются информативными, остаются в норме. Повышенный показатель СОЭ в анализе крови является поводом к продолжению обследования, уточнению ситуации.
Причины, почему значение параметра СОЭ повышается у женщин в норме:
У женщины после 50 лет увлечение СОЭ связано с гормональной перестройкой организма при приближении климакса.
У ребенка значение показателя СОЭ зависит от его возраста. У новорожденного максимальное значение – 2,8 мм/ч, что связано с очень низкой концентрацией белка в крови, и значит, отсутствием условий у эритроцитов для быстрого оседания. Поскольку с развитием ребенка вязкость крови увеличивается, к 14 годам этот показатель у девочек становится – 2-15 мм/ч, у мальчиков – 1-10 мм/ч.
Все нормативные показатели СОЭ имеются в специальной таблице, где они указаны в соответствии с полом и возрастом. При этом интерпретировать полученный ответ должен только врач, поскольку результат проведенного исследования может варьировать в любую сторону в зависимости от физиологических или патологических процессов. Для оценки ситуации специалист будет учитывать целый круг сопутствующих факторов. При этом нужно знать, что у 5% жителей Земли анализ показывает высокое СОЭ без видимых причин.
| Возраст | Норма, мм/ч |
| до 13 лет | 4-12 мм/ч |
| 13-18 лет | 3-18 мм/ч |
| 18-30 лет | 2-15 мм/ч |
| 30-40 лет | 2-20 мм/ч |
| 40-50 лет | 0-26 мм/ч |
| 50-60 лет | 0-26 мм/ч |
| после 60 лет | 2-55 мм/ч |
| При беременности | до 45 мм/ч |
20 января 2021 Ликбез Здоровье
Если в анализе крови есть отклонения, это не всегда говорит о заболевании.
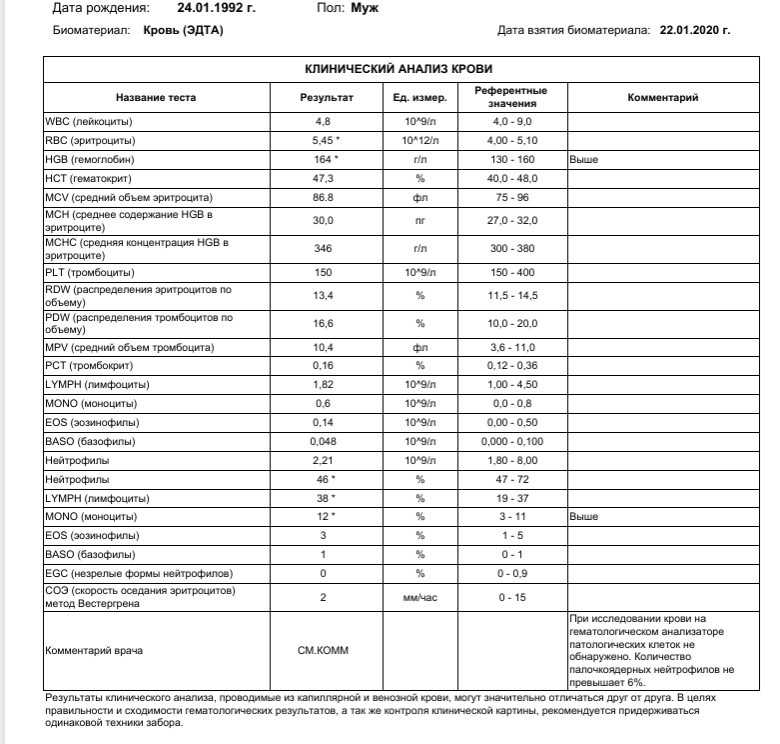
Скорость оседания эритроцитов, или СОЭ, — это часть общего анализа крови. Показатель зависит от состояния мембраны эритроцитов и присутствия в крови разных белков. СОЭ может изменяться по естественным причинам или указывать на воспалительный процесс в организме.
Какова норма СОЭ и как его определяют, мы уже рассказывали здесь. А в этой статье разберёмся, почему оно повышается и когда это опасно.
СОЭ зависит от особенностей оболочки эритроцитов и концентрации некоторых белков в крови. Иногда их количество изменяется, но это не связано с болезнью, а является нормой. Например, повышенные значения могут быть у следующих людей:
Иногда их количество изменяется, но это не связано с болезнью, а является нормой. Например, повышенные значения могут быть у следующих людей:
Это не значит, что не нужно обращать внимание на повышенное СОЭ. В некоторых случаях это признак заболеваний, поэтому лучше доверить расшифровку анализа терапевту.
Чаще всего увеличение скорости оседания эритроцитов связывают с различными воспалительными процессами. Но помните: показатель не помогает определить, какая болезнь у человека.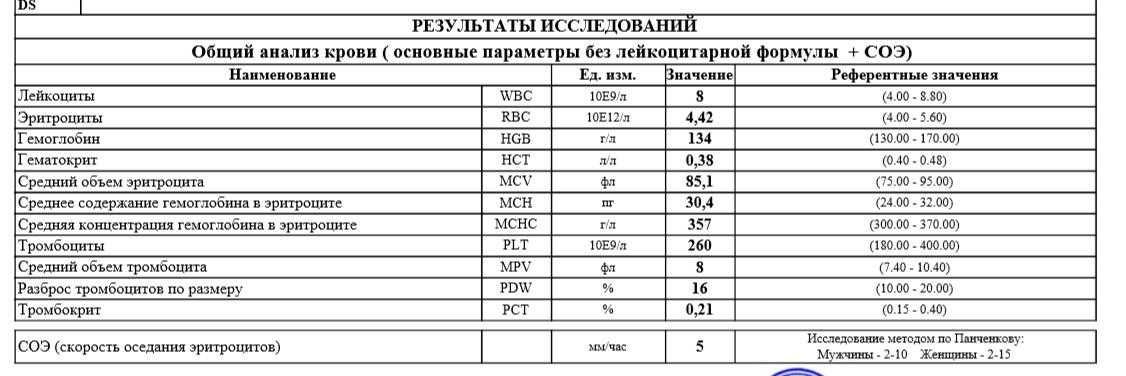 СОЭ нужно только для контроля состояния. А его повышение может указывать на определённую группу патологий.
СОЭ нужно только для контроля состояния. А его повышение может указывать на определённую группу патологий.
СОЭ увеличивается при любом инфекционном заболевании. Это может быть простая ОРВИ, острые воспалительные процессы в мочеполовых органах или кишечнике. После выздоровления этот показатель обычно постепенно снижается. Но у людей с хроническими или тяжёлыми инфекциями отклонения могут сохраняться долго. Например, при мононуклеозе, туберкулёзе.
При некоторых болезнях разрушаются и воспаляются ткани, но это не связано с действием микроорганизмов. К таким патологиям относятся:
Если у человека есть состояние, при котором иммунные клетки атакуют собственные ткани или чужеродные белки, это вызывает иммунные нарушения и приводит к увеличению СОЭ. Из-за патологии в крови становится больше иммуноглобулинов, белка фибриногена, которые участвуют в воспалительных реакциях и усиливают оседание эритроцитов.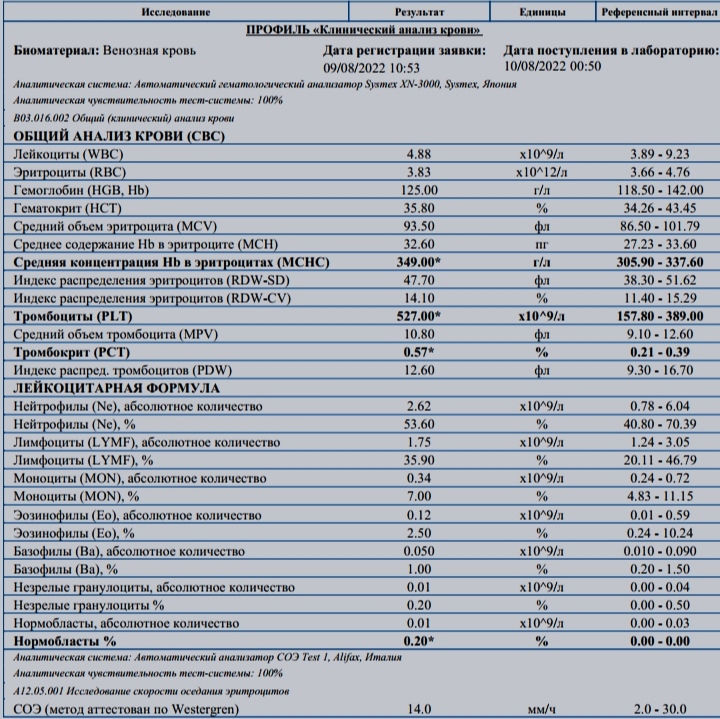
СОЭ может повышаться при сахарном диабете, аллергии и следующих аутоиммунных патологиях:
Изменения состава крови, формы или концентрации клеток могут привести к ускорению СОЭ. Это происходит в таких случаях:
При злокачественных опухолях в крови появляются различные антитела, воспалительные белки, токсичные вещества, которые являются результатом распада опухоли. Они значительно ускоряют СОЭ. Изменения в анализе крови появятся при миеломной болезни, остром лейкозе, лимфоме, раке простаты или другого органа.
Скорость оседания эритроцитов может увеличиться и по другим причинам. Иногда это происходит при повышенном холестерине, гипер- или гипотиреозе, дефиците белка. У некоторых людей повышение СОЭ — это побочное действие некоторых препаратов. Например, морфина, добавок витамина А, средств от давления.
Если человек во время планового медосмотра сдавал анализ крови и в нём нашли повышенное СОЭ, а других отклонений от нормы нет, скорее всего, это не страшно. Чтобы избавиться от сомнений, врач должен назначить повторный тест через несколько месяцев.
Но тем, у кого есть другие изменения в крови, может понадобиться дополнительное обследование. Какое — будет решать специалист, который заметил повышенное СОЭ.
Читайте также 🩸🩸🩸
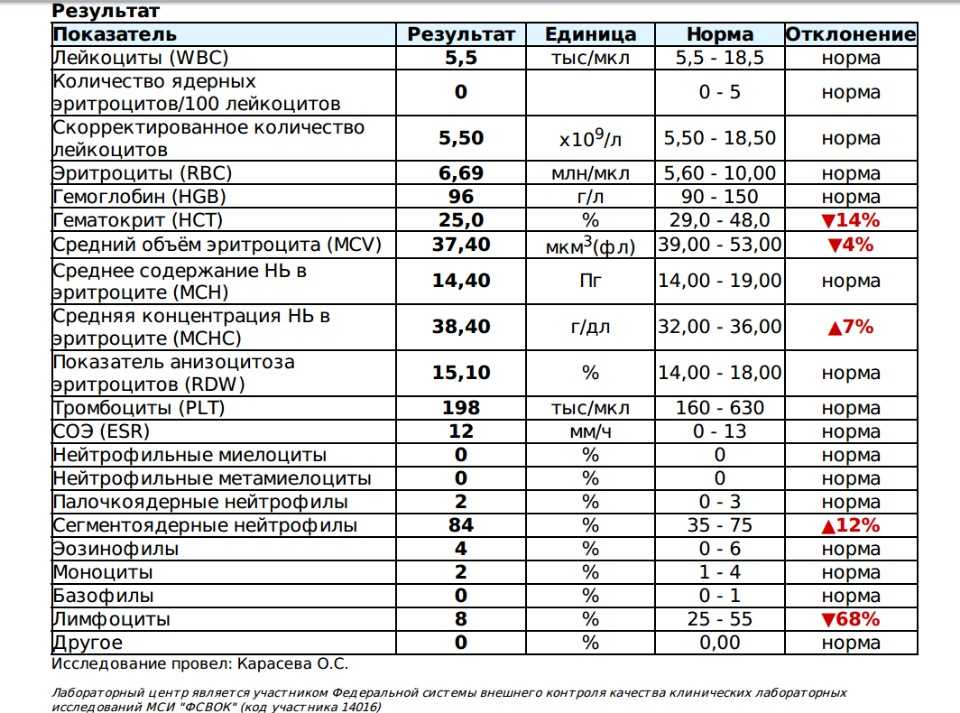
Тромбоцитемия – это заболевание, при котором костный мозг вырабатывает слишком много тромбоцитов. Тромбоциты — это фрагменты клеток крови, которые способствуют свертыванию крови. Слишком много тромбоцитов затрудняет нормальное свертывание крови. Это может привести к слишком большому или недостаточному свертыванию крови.
Тромбоциты — это фрагменты клеток крови, которые способствуют свертыванию крови. Слишком много тромбоцитов затрудняет нормальное свертывание крови. Это может привести к слишком большому или недостаточному свертыванию крови.
Единой причины тромбоцитемии может не быть. Считается, что это вызвано дефектами клеток костного мозга, производящих тромбоциты.
Симптомы тромбоцитемии включают:
Сгустки крови в артериях и венах, чаще всего в руках, ногах и головном мозге
Легко образующиеся синяки
Кровотечение из носа, десен и желудочно-кишечного тракта
Кровавый стул
Кровотечение после травмы или операции
Слабость
Головная боль и головокружение
Увеличение лимфатических узлов
Симптомы тромбоцитемии могут напоминать другие заболевания крови или проблемы со здоровьем. Всегда обращайтесь к поставщику медицинских услуг для постановки диагноза.
Всегда обращайтесь к поставщику медицинских услуг для постановки диагноза.
Доктор Келли Меткалф Пейт изучает, как тромбоциты в крови объединяются, чтобы остановить кровотечение и бороться с инфекцией. Ее команда изучает, влияет ли низкий уровень тромбоцитов на способность организма защищаться от ВИЧ.
Ваш лечащий врач изучит вашу историю болезни и проведет медицинский осмотр. У вас также могут быть тесты, такие как:
ОАК (общий анализ крови). Этот тест измеряет количество эритроцитов, лейкоцитов и тромбоцитов в крови.
Мазок крови. Этот тест проверяет ваши тромбоциты.
Аспирация или биопсия костного мозга. Это может быть сделано, чтобы проверить, здоров ли ваш костный мозг. Он включает в себя взятие небольшого образца жидкости костного мозга (аспирация) или твердой ткани костного мозга (так называемая основная биопсия). Образец проверяют под микроскопом.
Ваш лечащий врач определит наилучшее лечение на основе:
Ваш возраст, общее состояние здоровья и история болезни
Насколько ты болен
Насколько хорошо вы справляетесь с определенными лекарствами, методами лечения или терапией
Ожидаемая продолжительность состояния
Ваше мнение или предпочтение
Лечение может включать:
Химиотерапия. Чаще всего назначают с пероральным химиотерапевтическим препаратом (гидроксимочевиной) или интерфероном-альфа.
Чаще всего назначают с пероральным химиотерапевтическим препаратом (гидроксимочевиной) или интерфероном-альфа.
Тромбоцитоферез. Это процедура удаления лишних тромбоцитов из крови.
Вместе со своим лечащим врачом разработайте план лечения, отвечающий вашим потребностям.
Также важно:
Избегайте курения, которое может увеличить образование тромбов
Контроль других состояний здоровья, таких как высокий уровень холестерина, высокое кровяное давление и диабет
Избегайте продуктов, которые могут усилить кровотечение, включая такие лекарства, как аспирин.
Сообщите своему лечащему врачу, если заметите кровоподтеки или другие признаки кровотечения.
Тромбоцитемия заставляет ваше тело производить слишком много тромбоцитов в костном мозге.
Слишком много тромбоцитов может вызвать образование тромбов или кровотечение.
Симптомы включают сгустки крови и признаки кровотечения, такие как кровоподтеки, кровавый стул и слабость.
Единой причины заболевания может не быть. Считается, что это вызвано дефектами клеток костного мозга, производящих тромбоциты.
Лечение включает прием лекарств и удаление лишних тромбоцитов из крови.
Советы, которые помогут вам получить максимальную отдачу от посещения вашего поставщика медицинских услуг:
Знайте причину вашего визита и то, что вы хотите, чтобы произошло.
Перед посещением запишите вопросы, на которые вы хотите получить ответы.
Возьмите с собой кого-нибудь, кто поможет вам задавать вопросы и помнить, что говорит вам ваш врач.
При посещении запишите название нового диагноза и любых новых лекарств, методов лечения или тестов. Также запишите все новые инструкции, которые дает вам ваш врач.
Знайте, почему прописывается новое лекарство или лечение и как оно вам поможет. Также знайте, каковы побочные эффекты.
Спросите, можно ли вылечить ваше состояние другими способами.
Знайте, почему рекомендуется тест или процедура и что могут означать результаты.
Знайте, чего ожидать, если вы не примете лекарство или не пройдете тест или процедуру.
Если у вас запланирована повторная встреча, запишите дату, время и цель этой встречи.
Знайте, как вы можете связаться со своим поставщиком медицинских услуг, если у вас есть вопросы.
Гемофилия у детей
Нарушения свертывания крови
Тромбоз глубоких вен (ТГВ)
1. Cheng CF, Lian WS. Прооксидантные механизмы при кардиомиопатии с перегрузкой железом. Биомед Рез Инт. 2013;2013:740573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Cheng CF, Lian WS. Прооксидантные механизмы при кардиомиопатии с перегрузкой железом. Биомед Рез Инт. 2013;2013:740573. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Lakhal-Littleton S, Wolna M, Carr CA, et al. Сердечный ферропортин регулирует гомеостаз клеточного железа и важен для сердечной функции. Proc Natl Acad Sci USA. 2015;112:3164–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Скиннер С., Кенмур А.С. Гемохроматоз, проявляющийся застойной кардиомиопатией и реагирующий на венесекцию. Бр Харт Дж. 1973; 35: 466–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Cascales A, Sanchez-Vega B, Navarro N, et al. Клинические и генетические детерминанты антрациклин-индуцированного накопления железа в сердце. Int J Кардиол. 2012; 154: 282–6. [PubMed] [Google Scholar]
5. Furth PA, Futterweit W, Gorlin R. Рефрактерная бивентрикулярная сердечная недостаточность при вторичном гемохроматозе. Am J Med Sci. 1985;290:209–13. [PubMed] [Google Scholar]
6. Wasserman AJ, Richardson DW, Baird CL, et al. Сердечный гемохроматоз, симулирующий констриктивный перикардит. Am J Med. 1962; 32: 316–323. [PubMed] [Google Scholar]
Wasserman AJ, Richardson DW, Baird CL, et al. Сердечный гемохроматоз, симулирующий констриктивный перикардит. Am J Med. 1962; 32: 316–323. [PubMed] [Google Scholar]
7. Feely J, Counihan TB. Гемохроматоз в виде стенокардии, ответ на венесекцию. Br Med J. 1977; 2: 681–2. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Aronow WS, Meister L, Kent JR. Атриовентрикулярная блокада при семейном гемохроматозе лечится постоянным синхронным кардиостимулятором. Arch Intern Med. 1969;123:433–5. [PubMed] [Google Scholar]
9. Wu VC, Huang JW, Wu MS, et al. Влияние запасов железа на скорректированную дисперсию интервала QT у пациентов, находящихся на перитонеальном диализе. Am J почек Dis. 2004;44:720–8. [PubMed] [Google Scholar]
10. Роуз Р.А., Селлан М., Симпсон Дж.А. и соавт. Перегрузка железом снижает зависимые от CaV1.3 токи Ca2+ L-типа, что приводит к брадикардии, изменению электропроводности и мерцательной аритмии. Цирк Аритмия Электрофизиол. 2011; 118:174–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Клинтчар М., Стиллер Д. Внезапная сердечная смерть при наследственном гемохроматозе: недооцененная причина смерти? Международная юридическая медицина. 2004; 118: 174–7. [PubMed] [Google Scholar]
12. Campbell S, George DK, Robb SD, et al. Распространенность мутаций гена гемохроматоза на западе Шотландии и их связь с ишемической болезнью сердца. Сердце. 2003; 89: 1023–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Candore G, Balistreri CR, Lio D, et al. Связь между мутациями HFE и острым инфарктом миокарда: исследование пациентов из Северной и Южной Италии. Клетки крови Мол Дис. 2003; 31: 57–62. [PubMed] [Академия Google]
14. Schmitt B, Golub RM, Green R. Скрининг пациентов первичной медико-санитарной помощи на наследственный гемохроматоз с насыщением трансферрина и уровнем ферритина в сыворотке: систематический обзор для Американского колледжа врачей. Энн Интерн Мед. 2005; 143: 522–36. [PubMed] [Google Scholar]
15. Qaseem A, Aronson M, Fitterman N, et al. Подкомитет по оценке Американского колледжа врачей. Скрининг на наследственный гемохроматоз: руководство по клинической практике Американского колледжа врачей. Энн Интерн Мед. 2005; 143: 517–21. [PubMed] [Академия Google]
Qaseem A, Aronson M, Fitterman N, et al. Подкомитет по оценке Американского колледжа врачей. Скрининг на наследственный гемохроматоз: руководство по клинической практике Американского колледжа врачей. Энн Интерн Мед. 2005; 143: 517–21. [PubMed] [Академия Google]
16. Tran T, Eubanks SK, Schaffer KJ, et al. Секреция ферритина клетками гепатомы крыс и ее регуляция воспалительными цитокинами и железом. Кровь. 1997;90:4979–86. [PubMed] [Google Scholar]
17. Браунелл А., Лоусон С., Брозович М. Концентрация ферритина в сыворотке крови при серповидно-клеточном кризисе. Джей Клин Патол. 1986; 39: 253–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Balkan C, Tuluce SY, Basol G, et al. Взаимосвязь между уровнями NT-proBNP, перегрузкой железом и ранней стадией дисфункции миокарда у пациентов с большой бета-талассемией. Эхокардиография. 2012;29: 318–25. [PubMed] [Google Scholar]
19. Hahalis G, Manolis AS, Apostolopoulos D, et al. Правожелудочковая кардиомиопатия при большой бета-талассемии. Европейское сердце J. 2002; 23: 147–56. [PubMed] [Google Scholar]
Европейское сердце J. 2002; 23: 147–56. [PubMed] [Google Scholar]
20. Aessopos A, Farmakis D, Deftereos S, et al. Болезнь сердца талассемия: сравнительная оценка большой талассемии и промежуточной талассемии. Грудь. 2005; 127:1523–30. [PubMed] [Google Scholar]
21. Palka P, Macdonald G, Lange A, et al. Роль допплеровских индексов наполнения левого желудочка и допплеровской тканевой эхокардиографии в оценке поражения сердца при наследственном гемохроматозе. J Am Soc Эхокардиогр. 2002; 15:884–9.0. [PubMed] [Google Scholar]
22. Вуд Дж. К. Магнитно-резонансная томография для измерения перегрузки железом. Карр Опин Гематол. 2007; 14:183–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Маврогени С.И., Гоцис Э.Д., Маркуссис В. и соавт. Исследование времени релаксации T2 при перегрузке железом при бета-талассемии. МАГМА. 1998; 6: 7–12. [PubMed] [Google Scholar]
24. Anderson LJ, Holden S, Davis B, et al. Сердечно-сосудистый магнитно-резонансный T2-звезда (T2 *) для ранней диагностики перегрузки миокарда железом. Европейское сердце, Дж. 2001; 22: 2171–9.. [PubMed] [Google Scholar]
Европейское сердце, Дж. 2001; 22: 2171–9.. [PubMed] [Google Scholar]
25. Вуд Дж. К. История и текущее влияние магнитно-резонансной томографии сердца на лечение перегрузки железом. Тираж. 2009; 120:1937–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Pepe A, Positano V, Santarelli MF, et al. Мультисрезовый мультиэхо-Т2* кардиоваскулярный магнитный резонанс для обнаружения неоднородного распределения перегрузки миокарда железом. J Magn Reson Imaging. 2006; 23: 662–8. [PubMed] [Google Scholar]
27. Kirk P, Roughton M, Porter JB, et al. Кардиальный Т2* магнитный резонанс для прогнозирования сердечных осложнений при большой талассемии. Тираж. 2009 г.;120:1961–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Mavrogeni S, Gotsis E, Verganelakis D, et al. Влияние перегрузки железом на толерантность к физической нагрузке у больных талассемией с сердечной недостаточностью. Int J Cardiovasc Imaging. 2009; 25: 777–83. [PubMed] [Google Scholar]
29. Cheong B, Huber S, Muthupillai R, et al. Оценка перегрузки миокарда железом с помощью Т2* сердечно-сосудистой магнитно-резонансной томографии. Tex Heart Inst J. 2005; 32: 448–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Cheong B, Huber S, Muthupillai R, et al. Оценка перегрузки миокарда железом с помощью Т2* сердечно-сосудистой магнитно-резонансной томографии. Tex Heart Inst J. 2005; 32: 448–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Кремастинос Д.Т., Фармакис Д. Железоперегрузочная кардиомиопатия в клинической практике. Тираж. 2011;124:2253–63. [PubMed] [Google Scholar]
31. Gujjaosing DR, Tripodi DJ, Shizukuda Y. Кардиомиопатия, связанная с перегрузкой железом: лучшее понимание растущего расстройства. J Am Coll Кардиол. 2010;56:1001–12. [PMC free article] [PubMed] [Google Scholar]
32. Маврогени С., Маркусис-Маврогенис Г., Маркусис В., Колову Г. Новая роль магнитно-резонансной томографии сердечно-сосудистой системы в оценке метаболических кардиомиопатий. Горм Метаб Рез. 2015; 47: 623–32. [PubMed] [Академия Google]
33. Olson LJ, Edwards WD, Holmes DR, Jr, et al. Эндомиокардиальная биопсия при гемохроматозе: клинико-патологические корреляции в шести случаях. J Am Coll Кардиол. 1989; 13: 116–20. [PubMed] [Google Scholar]
J Am Coll Кардиол. 1989; 13: 116–20. [PubMed] [Google Scholar]
34. Cooper LT, Baughman KL, Feldman AM, et al. Роль эндомиокардиальной биопсии в лечении сердечно-сосудистых заболеваний: научное заявление Американской кардиологической ассоциации, Американского колледжа кардиологов и Европейского общества кардиологов, одобренное Американским обществом сердечной недостаточности и Обществом сердечной недостаточности Европейского общества кардиологии. Европейское сердце Дж. 2007; 28: 3076–9.3. [PubMed] [Google Scholar]
35. Rivers J, Garrahy P, Robinson W, et al. Обратимая сердечная дисфункция при гемохроматозе. Am Heart J. 1987; 113: 216–7. [PubMed] [Google Scholar]
36. Исли Р.М., младший, Скрайнер Б.Ф., младший, Ю П.Н. Обратимая кардиомиопатия, ассоциированная с гемохроматозом. N Engl J Med. 1972; 287: 866–7. [PubMed] [Google Scholar]
37. Niederau C, Fischer R, Sonnenberg A, et al. Выживаемость и причины смерти у больных с циррозом и без него с первичным гемохроматозом.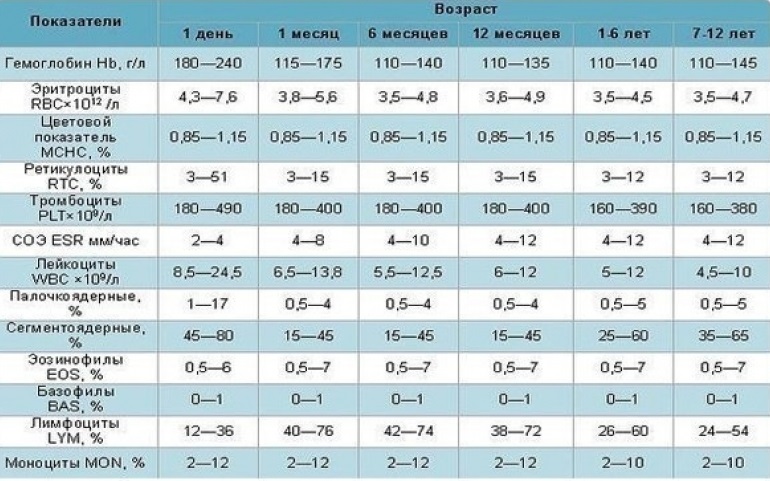 N Engl J Med. 1985;313:1256–62. [PubMed] [Google Scholar]
N Engl J Med. 1985;313:1256–62. [PubMed] [Google Scholar]
38. Рахко П.С., Салерни Р., Урецкий Б.Ф. Успешное устранение застойной кардиомиопатии из-за перегрузки железом с помощью хелатотерапии. J Am Coll Кардиол. 1986; 8: 436–40. [PubMed] [Google Scholar]
39. Barton JC, McDonnell SM, Adams PC, et al. Лечение гемохроматоза. Энн Интерн Мед. 1998; 129:932–9. [PubMed] [Google Scholar]
40. Джомова К., Валко М. Важность хелирования железа при окислительном стрессе, вызванном свободными радикалами, и заболеваниях человека. Курр Фарм Дез. 2011;17:3460–73. [PubMed] [Академия Google]
41. Кросби В.Х. Гемохроматоз. Лечение для облегчения травмы. Arch Intern Med. 1986; 146: 1910–1. [PubMed] [Google Scholar]
42. Yancy CW, Jessup M, Bozkurt B, et al. Руководство ACCF/AHA 2013 г. по лечению сердечной недостаточности: краткое изложение. Отчет Целевой группы Фонда Американского колледжа кардиологов/Американской кардиологической ассоциации по практическим рекомендациям.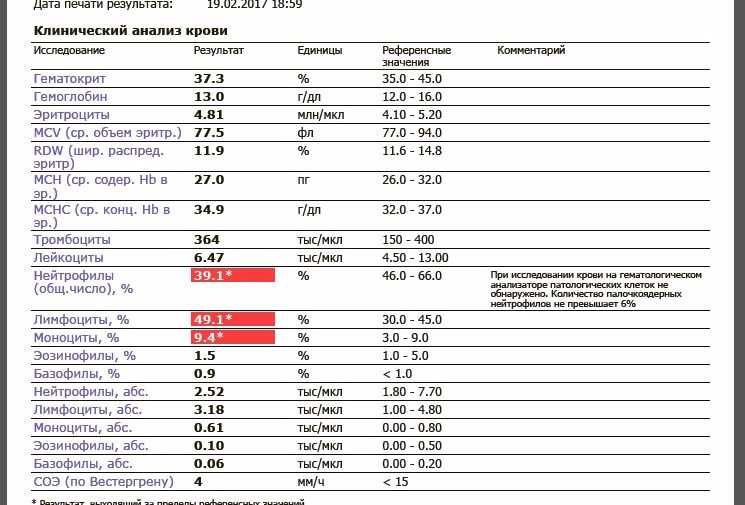 Разработан в сотрудничестве с Американским колледжем врачей-пульмонологов, Обществом сердечного ритма и Международным обществом трансплантации сердца и легких. Одобрено Американской ассоциацией сердечно-сосудистой и легочной реабилитации. J Am Coll Кардиол. 2013;62:1495–539. [Google Scholar]
Разработан в сотрудничестве с Американским колледжем врачей-пульмонологов, Обществом сердечного ритма и Международным обществом трансплантации сердца и легких. Одобрено Американской ассоциацией сердечно-сосудистой и легочной реабилитации. J Am Coll Кардиол. 2013;62:1495–539. [Google Scholar]
43. Adams PC, Barton JC. Как я лечу гемохроматоз. Кровь. 2010;116:317–25. [PubMed] [Google Scholar]
44. Пьетранджело А. Гемахроматоз без HFE. Гепатология. 2004; 39:21–9. [PubMed] [Google Scholar]
45. Bacon BR, Adams PC, Kowdley KV, et al. Американская ассоциация по изучению заболеваний печени. Диагностика и лечение гемохроматоза: практические рекомендации Американской ассоциации по изучению заболеваний печени, 2011 г. Гепатология. 2011;54:328–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Адамс П.С., Кертес А.Е., Вальберг Л.С. Скорость реаккумуляции железа после истощения запасов железа при наследственном гемохроматозе. Последствия венесекции. Дж. Клин Гастроэнтерол. 1993; 16: 207–10. [PubMed] [Google Scholar]
1993; 16: 207–10. [PubMed] [Google Scholar]
47. Shizukuda Y, Bolan CD, Tripodi DJ, et al. Значение сократительной функции левого предсердия у бессимптомных субъектов с наследственным гемохроматозом. Ам Джей Кардиол. 2006; 98: 954–9. [PubMed] [Google Scholar]
48. Dabestani A, Child JS, Henze E, et al. Первичный гемохроматоз: анатомо-физиологические особенности желудочков сердца и их реакция на флеботомию. Ам Джей Кардиол. 1984;54:153–159. [PubMed] [Google Scholar]
49. Cecchetti G, Binda A, Piperno A, et al. Сердечные изменения у 36 последовательных пациентов с идиопатическим гемохроматозом: полиграфическая и эхокардиографическая оценка. Европейское сердце J. 1991; 12: 224–30. [PubMed] [Google Scholar]
50. Fabio G, Minonzio F, Delbini P, et al. Купирование сердечных осложнений с помощью комбинированной терапии деферипроном и дефероксамином у больного тяжелой формой ювенильного гемохроматоза (ЮГ) Кровь. 2007;109: 362–4. [PubMed] [Google Scholar]
51. Kontoghiorghes GL, Eracleous E, Economides C, et al. Достижения в терапии перегрузки железом: перспективы эффективного использования деферипрона (L1), дефероксамина, новых экспериментальных хелаторов ICL670, GT56-252, LINA11 и их комбинаций. Курр Мед Хим. 2005; 12: 2663–81. [PubMed] [Google Scholar]
Kontoghiorghes GL, Eracleous E, Economides C, et al. Достижения в терапии перегрузки железом: перспективы эффективного использования деферипрона (L1), дефероксамина, новых экспериментальных хелаторов ICL670, GT56-252, LINA11 и их комбинаций. Курр Мед Хим. 2005; 12: 2663–81. [PubMed] [Google Scholar]
52. Glickstein H, El RB, Link G, et al. Действие хелаторов на клетки сердца, нагруженные железом: доступность внутриклеточного лабильного железа и функциональные последствия. Кровь. 2006;108:3195–203. [PubMed] [Google Scholar]
53. Kontoghiorghes GL, Kolnagou A, Peng CT, et al. Вопросы безопасности железохелатирующей терапии у пациентов с нормальным запасом железа, включая талассемию, нейродегенеративные, почечные и инфекционные заболевания. Экспертное заключение Drug Safe. 2010;9:201–6. [PubMed] [Google Scholar]
54. Olivieri NF, Brittenham GM. Железохелатирующая терапия и лечение талассемии. Кровь. 1997; 89: 739–61. [PubMed] [Google Scholar]
55. Мамтани М. , Кулкарни Х. Влияние хелаторов железа на железо миокарда и сердечную функцию при трансфузионно-зависимой талассемии: систематический обзор и метаанализ. Бр Дж Гематол. 2008; 141:882–90. [PubMed] [Google Scholar]
, Кулкарни Х. Влияние хелаторов железа на железо миокарда и сердечную функцию при трансфузионно-зависимой талассемии: систематический обзор и метаанализ. Бр Дж Гематол. 2008; 141:882–90. [PubMed] [Google Scholar]
56. Davis BA, O’Sullivan C, Jarritt PH, et al. Значение последовательного мониторинга фракции выброса левого желудочка при лечении большой талассемии. Кровь. 2004; 104: 263–9. [PubMed] [Google Scholar]
57. Anderson LJ, Westwood MA, Holden S, et al. Клиренс железа из миокарда во время купирования сидеротической кардиомиопатии с помощью внутривенного введения десфериоксамина: проспективное исследование с использованием Т2* сердечно-сосудистого магнитного резонанса. Бр Дж Гематол. 2004; 127:348–55. [PubMed] [Академия Google]
58. Pennell DJ, Carpenter JP, Roughton M, et al. Об улучшении фракции выброса при хелатировании железа при большой талассемии и риске сердечной недостаточности в будущем. J Cardiovasc Magn Reson. 2011;13:45.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59. Modell B, Khan M, Darlison M. Выживаемость при большой бета-талассемии в Великобритании: данные из UK Thalassemia Register. Ланцет. 2000;355:2051–2. [PubMed] [Google Scholar]
Modell B, Khan M, Darlison M. Выживаемость при большой бета-талассемии в Великобритании: данные из UK Thalassemia Register. Ланцет. 2000;355:2051–2. [PubMed] [Google Scholar]
60. Pepe A, Rossi G, Capra M, et al. Проспективное исследование МРТ T2* на содержание железа в сердце и печени у пациентов с большой талассемией, получавших деферазирокс, по сравнению с деферипроном и десфериоксамином в монотерапии (резюме 4267) Кровь. 2010;116:1731. [Академия Google]
61. Пепе А., Мелони А., Капра М. и др. Лечение деферасироксом, деферипроном и десфериоксамином у пациентов с тяжелой талассемией: сравнение сердечного железа и функции, определяемое количественной магнитно-резонансной томографией. Гематология. 2011;96:41–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Берис П. Введение: лечение талассемии. Семин Гематол. 1995;32:243.. [PubMed] [Google Scholar]
63. Farmaki K, Tzoumari I, Pappa C, et al. Нормализация общего содержания железа в организме с помощью очень интенсивного комбинированного хелатирования устраняет сердечные и эндокринные осложнения большой талассемии. Бр Дж Гематол. 2010; 148:466–75. [PubMed] [Академия Google]
Бр Дж Гематол. 2010; 148:466–75. [PubMed] [Академия Google]
64. Tanner MA, Galanello R, Dessi C, et al. Комбинированная хелаторная терапия при большой талассемии для лечения тяжелого сидероза миокарда с дисфункцией левого желудочка. J Cardiovasc Magn Reson. 2008;10:12.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Chirnomas D, Smith AL, Braunstein J, et al. Фармакокинетика деферасирокса у пациентов с адекватным и неадекватным ответом. Кровь. 2009; 114:4009–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
66. Cappellini MD, Cohen A, Piga A, et al. Фаза 3 исследования деферазирокса (ICL670), перорального хелатора железа один раз в день, у пациентов с бета-талассемией. Кровь. 2006; 107:3455–62. [PubMed] [Академия Google]
67. Pennell DJ, Porter JB, Cappellini MD, et al. Эффективность деферасирокса в снижении и предотвращении перегрузки сердца железом при бета-талассемии. Кровь. 2010; 115: 2364–71. [PubMed] [Google Scholar]
68. Cappellini MD, Bejaoui M, Agaoglu L, et al. Хелирование железа деферасироксом у взрослых и детей с большой талассемией: эффективность и безопасность в течение 5 лет наблюдения. Кровь. 2011; 118:884–93. [PubMed] [Google Scholar]
Хелирование железа деферасироксом у взрослых и детей с большой талассемией: эффективность и безопасность в течение 5 лет наблюдения. Кровь. 2011; 118:884–93. [PubMed] [Google Scholar]
69. Pennell DJ, Porter JB, Cappellini MD, et al. Деферасирокс в течение до 3 лет приводит к стойкому улучшению Т2* миокарда у больных с большой бета-талассемией. Гематология. 2012;97:842–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Wood JC, Kang BP, Thompson A, et al. Влияние деферасирокса на содержание железа в сердце при большой талассемии: влияние на общие запасы железа в организме. Кровь. 2010; 116: 537–43. [PubMed] [Google Scholar]
71. Borsari M, Gabbi C, Ghelfi F, et al. Силибин, новый железохелатирующий агент. Дж. Инорг Биохим. 2001; 85: 123–9. [PubMed] [Google Scholar]
72. Barton JC. Оценка препарата: деферитрин (GT-56-252; NaHBED) при нарушениях перегрузки железом. IDrugs. 2007; 10: 270–81. [PubMed] [Академия Google]
73. Harmatz P, Grady RW, Dragsten P, et al. Фаза 1b клинических испытаний дефероксамина, конъюгированного с крахмалом (40SD02): нового хелатора железа длительного действия. Бр Дж Гематол. 2007; 138: 374–81. [PubMed] [Google Scholar]
Фаза 1b клинических испытаний дефероксамина, конъюгированного с крахмалом (40SD02): нового хелатора железа длительного действия. Бр Дж Гематол. 2007; 138: 374–81. [PubMed] [Google Scholar]
74. Эль Сайед С.М., Абу-Талеб А., Махмуд Х.С. и соавт. Чрескожная экскреция железа и ферритина (через Al-hijamah) как новое лечение перегрузки железом при большой бета-талассемии, гемохроматозе и сидеробластной анемии. Мед Гипотезы. 2014; 83: 238–46. [PubMed] [Академия Google]
75. McLaran CJ, Bett JH, Nye JA, et al. Застойная кардиомиопатия и гемохроматоз — быстрое прогрессирование, возможно, ускоренное чрезмерным употреблением аскорбиновой кислоты. Aust NZ J Med. 1982; 12: 187–8. [PubMed] [Google Scholar]
76. Герберт В. Гемохроматоз и витамин С. Энн Intern Med. 1999; 131:475–6. [PubMed] [Google Scholar]
77. Milward EA, Baines SK, Knuiman MW, et al. Нецитрусовые фрукты как новые диетические модификаторы запасов железа в окружающей среде у людей с мутациями гена HFE или без них. Мэйо Клин Proc. 2008; 83: 543–9. [PubMed] [Google Scholar]
Мэйо Клин Proc. 2008; 83: 543–9. [PubMed] [Google Scholar]
78. Conrad ME, Barton JC. Анемия и кинетика железа при алкоголизме. Семин Гематол. 1980; 17: 149–63. [PubMed] [Google Scholar]
79. Селада А., Рудольф Х., Донат А. Влияние экспериментального хронического употребления алкоголя и дефицита фолиевой кислоты на усвоение железа. Кровь. 1979; 54: 906–15. [PubMed] [Google Scholar]
80. Mariani R, Pelucchi S, Perseghin P, et al. Эритроцитаферез плюс эритропоэтин: альтернативная терапия для отдельных пациентов с гемохроматозом и тяжелым поражением органов. Гематология. 2005;90: 717–8. [PubMed] [Google Scholar]
81. Kohan A, Niborski R, Daruich J, et al. Эритроцитаферез с рекомбинантным эритропоэтином человека в терапии наследственного гемохроматоза: новая альтернатива. Вокс Санг. 2000;79:40–5. [PubMed] [Google Scholar]
82. Muncunill J, Vaquer P, Galmes A, et al. При наследственном гемохроматозе аферез эритроцитов удаляет избыток железа в два раза быстрее, чем ручная флеботомия цельной крови.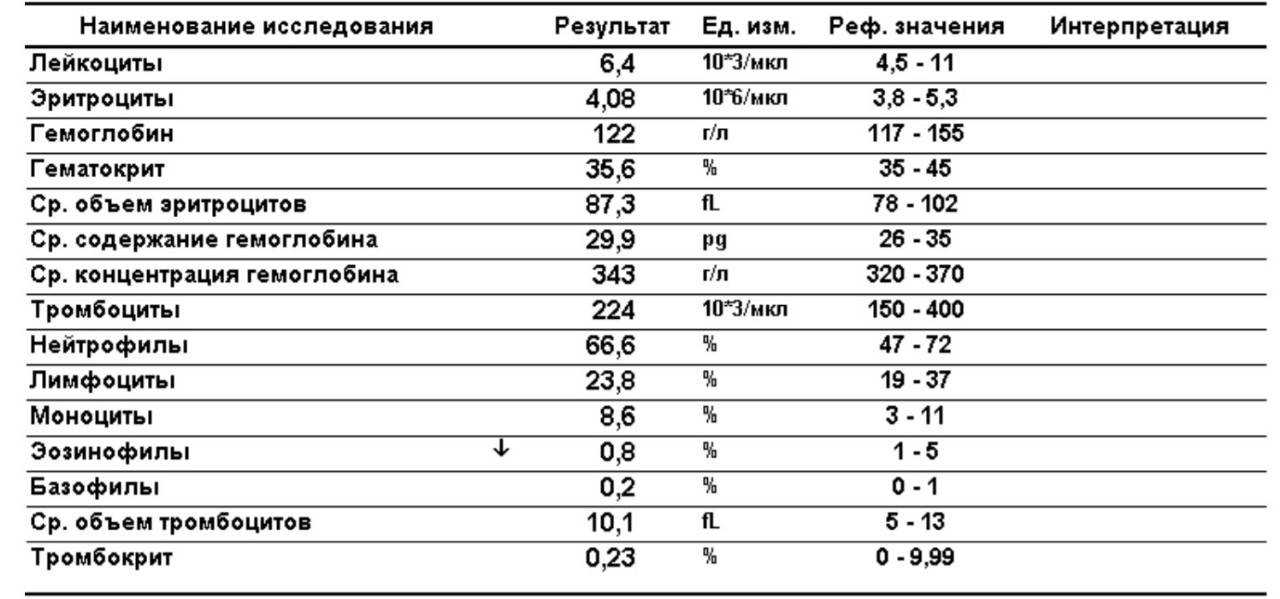 Джей Клин Афер. 2002; 17:88–92. [PubMed] [Google Scholar]
Джей Клин Афер. 2002; 17:88–92. [PubMed] [Google Scholar]
83. Rombout-Sestrienkova E, van Noord PA, van Deursen CT, et al. Терапевтический эритроцитаферез в сравнении с флеботомией при начальном лечении наследственного гемохроматоза — экспериментальное исследование. Transfus Apher Sci. 2007; 36: 261–7. [PubMed] [Академия Google]
84. Ромбоу-Сестриенкова Е., Де Йонге Н., Мартинакова К. и соавт. Терминальная стадия кардиомиопатии из-за наследственного гемохроматоза успешно лечится с помощью эритроцитафереза в сочетании с вспомогательным устройством для левого желудочка. Круговая сердечная недостаточность. 2014;7:541–3. [PubMed] [Google Scholar]
85. Pennell DJ, Udelson JE, Arai AE, et al. Сердечно-сосудистая функция и лечение при большой бета-талассемии: консенсусное заявление Американской кардиологической ассоциации. Тираж. 2013; 128: 281–308. [PubMed] [Академия Google]
86. Caines AE, Kpodonu J, Massad MG, et al. Трансплантация сердца у пациентов с кардиомиопатией, перегруженной железом.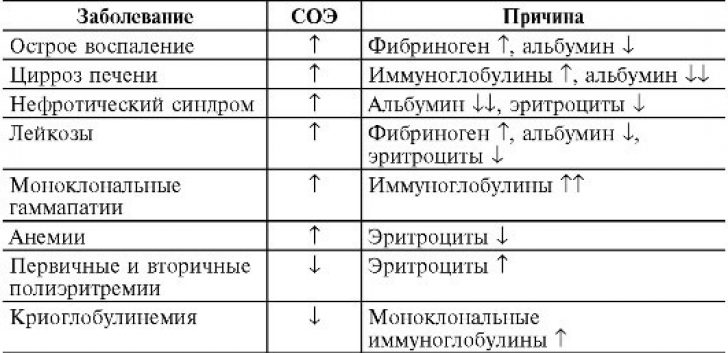 Трансплантация легкого сердца J. 2005; 24:486–8. [PubMed] [Google Scholar]
Трансплантация легкого сердца J. 2005; 24:486–8. [PubMed] [Google Scholar]
87. Jermyn R, Soe E, D’Alessandro D, et al. Сердечная недостаточность после трансплантации печени, требующая бивентрикулярного вспомогательного устройства. Кейс Rep Трансплантация. 2014;2014:946961. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Raichlin E, Daly RC, Rosen CB, et al. Комбинированная трансплантация сердца и печени: одноцентровый опыт. Трансплантация. 2009 г.;88:219–25. [PubMed] [Google Scholar]
89. Kuppahally SS, Hunt SA, Valantine HA, et al. Рецидив отложения железа в сердечном аллотрансплантате у пациента с гемохроматозом без HFE. Трансплантация легкого сердца J. 2006; 25: 144–147. [PubMed] [Google Scholar]
90. Гарсия-Манеро Г. Миелодиспластические синдромы: обновленная информация о диагностике, стратификации риска и лечении, 2012 г. Am J Гематол. 2012; 87: 692–701. [PubMed] [Google Scholar]
91. Bernaudin F, Socie G, Kuentz M, et al. SFGM-TC Долгосрочные результаты родственной миелоаблативной трансплантации стволовых клеток для лечения серповидно-клеточной анемии.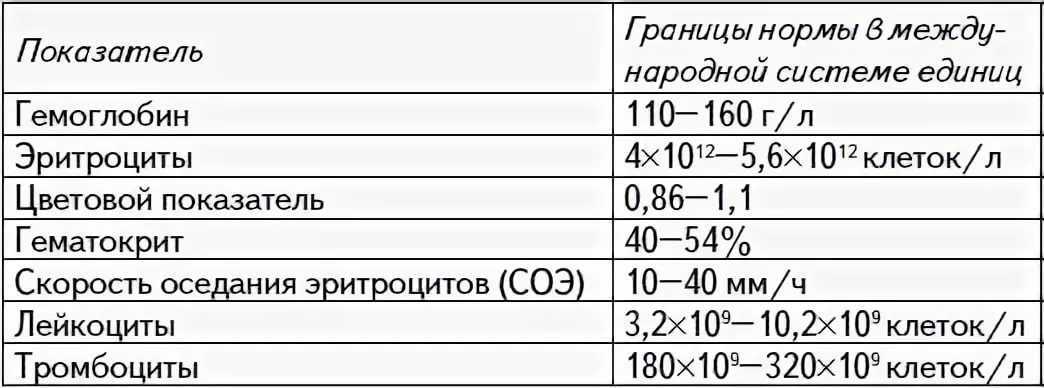 Кровь. 2007;110:2749–56. [PubMed] [Google Scholar]
Кровь. 2007;110:2749–56. [PubMed] [Google Scholar]
92. Elborai Y, Uwumugambi A, Lehmann L. Трансплантация гемопоэтических стволовых клеток при талассемии. Иммунотерапия. 2012;4:947–56. [PubMed] [Google Scholar]
93. Mugishima H, Ohga S, Ohara A, et al. Комитет по апластической анемии Японского общества детской гематологии. Трансплантация гемопоэтических стволовых клеток при анемии Даймонда-Блэкфана: отчет Комитета по апластической анемии Японского общества детской гематологии. Педиатр трансплантат. 2007; 11: 601–7. [PubMed] [Академия Google]
94. Oudit GY, Sun H, Trivieri MG, et al. Са2+-каналы L-типа обеспечивают основной путь поступления железа в кардиомиоциты при кардиомиопатии с перегрузкой железом. Нат Мед. 2003; 9: 1187–94. [PubMed] [Google Scholar]
95. Murphy CJ, Oudit GY. Железоперегрузочная кардиомиопатия: патофизиология, диагностика и лечение. Ошибка карты J. 2010;16:888–90. [PubMed] [Google Scholar]
96. Кумфу С., Чаттипакорн С., Шричайратанакул С. и соавт. Кальциевые каналы Т-типа как ворота для поглощения железа кардиомиоцитами бета-талассемических мышей. Евр Дж Гематол. 2011; 86: 156–66. [PubMed] [Академия Google]
и соавт. Кальциевые каналы Т-типа как ворота для поглощения железа кардиомиоцитами бета-талассемических мышей. Евр Дж Гематол. 2011; 86: 156–66. [PubMed] [Академия Google]
97. Кроу С., Бартфей В.Дж. Амлодипин снижает поглощение железа и образование свободных радикалов кислорода в сердце мышей с хронической перегрузкой железом. Биол Рез Нурс. 2002; 3: 189–97. [PubMed] [Google Scholar]
98. Kumfu S, Chattipakorn S, Chinda K, et al. Блокада кальциевых каналов Т-типа улучшает выживаемость и сердечно-сосудистую функцию у мышей, страдающих талассемией. Евр Дж Гематол. 2012; 88: 535–48. [PubMed] [Google Scholar]
99. Viatte L, Nicolas G, Lou DQ, et al. Хроническая индукция гепсидина вызывает гипосидеремию и изменяет характер клеточного накопления железа у мышей с гемохроматозом. Кровь. 2006;107:2952–8. [PubMed] [Google Scholar]
100. Brissot P, Bardou-Jacquet E, Jouanolic AM, et al. Заболевания железа генетического происхождения: меняющийся мир. Тренды Мол Мед. 2011;17:707–13. [PubMed] [Google Scholar]
2011;17:707–13. [PubMed] [Google Scholar]
101. Gardenghi S, Ramos P, Marongiu MF, et al. Гепсидин как терапевтическое средство для ограничения перегрузки железом и улучшения состояния при анемии у мышей с бета-талассемией. Джей Клин Инвест. 2010; 120:4466–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
102. Musallam KM, Cappellini MD, Wood JC, Taher AT. Перегрузка железом при талассемии, не зависящей от переливания крови: клиническая перспектива. Blood Rev. 2012; 26 (Приложение 1): S16–9. [PubMed] [Google Scholar]
103. Camaschella C. Лечение перегрузки железом. N Engl J Med. 2013;368:2325–7. [PubMed] [Google Scholar]
104. Ramos E, Ruchala P, Goodnough JB, et al. Минигепсидины предотвращают перегрузку железом у мышей с дефицитом гепсидина в модели тяжелого гемохроматоза. Кровь. 2012;12:3829–36. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Gelderman MP, Baek JH, Yalananoglu A, et al. Реверсия гемохроматоза с помощью апотрансферрина у нетрансфузированных и трансфузированных мышей Hbbth4/+ (гетерозиготная делеция гена глобина B1/B2).