2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Малярия – острое лихорадочное заболевание, вызываемое паразитами рода Plasmodium, которые передаются людям через укусы инфицированных самок комаров вида Anopheles. Существует пять видов паразитов, вызывающих малярию у человека, и два таких вида – P. falciparum и P. vivax – представляют собой наибольшую угрозу. P. falciparum является самым опасным для жизни малярийным паразитом, который больше всего распространен на африканском континенте. P. vivax – доминирующий малярийный паразит в большинстве стран за пределами Африки к югу от Сахары.
Первые симптомы малярии – лихорадка, головная боль и озноб – обычно появляются через 10–15 дней после укуса инфицированным комаром и могут быть слабовыраженными, что затрудняет выявление малярии. При отсутствии лечения малярия, вызванная P. falciparum, может в течение 24 часов развиться в тяжелую форму и привести к летальному исходу.
В 2020 г. риску малярии подвергалась почти половина населения в мире. Вероятность заражения малярией и развития тяжелой формы болезни значительно выше среди некоторых групп населения: младенцев, детей в возрасте до пяти лет, беременных женщин и лиц с ВИЧ/СПИДом, а также лиц с низким уровнем иммунитета, прибывающих в районы с интенсивной передачей малярии, в частности трудящихся-мигрантов, мобильных групп населения и лиц, совершающих поездки.
Согласно последнему изданию Всемирного доклада о малярии, в 2020 г. малярией во всем мире заболел 241 миллион человек по сравнению с 227 миллионами в 2019 г. Количество умерших от малярии в 2020 г. оценивается на уровне 627 000 человек, что на 69 000 больше по сравнению с предыдущим годом. Около двух третей дополнительных случаев смерти (47 000) являются следствием перебоев, вызванных пандемией COVID-19, однако остальная треть смертей (22 000) отражает недавние корректировки применяемой ВОЗ методологии расчета смертности от малярии (без учета перебоев в результате распространения COVID-19).
Новая методология учета причин смерти применялась в отношении 32 стран Африки к югу от Сахары, на долю которых приходится примерно 93% всех случаев смерти от малярии в мире. Благодаря применению этой методологии было установлено, что с 2000 г. малярия унесла жизни гораздо большего числа африканских детей, чем предполагалось ранее.
На Африканский регион ВОЗ по-прежнему приходится непропорционально высокая доля глобального бремени малярии. В 2020 г. в этом Регионе произошли 95% всех случаев заболевания малярией и 96% случаев смерти от нее. На долю детей в возрасте до пяти лет пришлось 80% всех случаев смерти от малярии в Регионе.
Более половины всех случае смерти от малярии в мире произошло в четырех африканских странах: Нигерии (31,9%), Демократической Республике Конго (13,2%), Объединенной Республике Танзания (4,1%) и Мозамбике (3,8%).
За последние два десятилетия повышение доступности рекомендованных ВОЗ средств и стратегий профилактики малярии, в том числе эффективных мер по борьбе с переносчиками и профилактических противомалярийных препаратов, во многом способствовало уменьшению глобального бремени этой болезни.
Борьба с переносчиками – обязательный компонент стратегий по борьбе с малярией и ее элиминации, поскольку позволяет эффективно предупреждать заражение и уменьшать передачу болезни. Двумя основными способами борьбы с переносчиками являются применение обработанных инсектицидом противомоскитных сеток (ОИС) и распыление инсектицидов остаточного действия внутри помещений (РИОДВП).
Успехам в борьбе с малярией угрожает формирующаяся у комаров Anopheles устойчивость к инсектицидам. Согласно последнему изданию Всемирного доклада о малярии, за период с 2010 по 2020 г. случаи устойчивости комаров как минимум к одному из четырех наиболее распространенных классов инсектицидов были зарегистрированы в 78 странах. В 29 странах была отмечена устойчивость комаров ко всем основным классам инсектицидов.
Профилактическая химиотерапия – метод предупреждения инфицирования малярией и его последствий исключительно с помощью лекарственных средств или в сочетании с другими мерами. Она включает в себя химиопрофилактику, интермиттирующую профилактическую терапию младенцев (ИПТм) и беременных (ИПТб), сезонную химиопрофилактику малярии (СХПМ) и массовое назначение препаратов (МНП). Эти безопасные и экономически эффективные стратегии призваны дополнять собой текущую деятельность по борьбе с малярией, в том числе меры по борьбе с переносчиками, оперативной диагностике случаев с подозрением на малярию и лечению больных с подтвержденным диагнозом противомалярийными препаратами.
Начиная с октября 2021 г. ВОЗ рекомендует также широко использовать среди детей, проживающих в районах с умеренным и высоким уровнем передачи малярии, вызванной P. falciparum, противомалярийную вакцину RTS,S/AS01. Вакцина доказала свою способность значительно снижать заболеваемость малярией, в частности и смертельной тяжелой формой малярии, среди детей младшего возраста.
Своевременная диагностика и лечение малярии помогают уменьшить тяжесть болезни и предотвратить смерть пациента, а также способствуют снижению интенсивности передачи малярии. ВОЗ рекомендует во всех случаях с подозрением на малярию подтверждать диагноз при помощи диагностического теста на выявление паразита (микроскопического исследования или диагностического экспресс-теста). Диагностический тест позволяет медицинским специалистам быстро отличить малярийную лихорадку от немалярийной, помогая правильно выбрать тактику лечения.
Наиболее эффективной из существующих схем лечения, особенно в случае малярии P. falciparum, является артемизинин-комбинированная терапия (АКТ). Основной задачей лечения является быстрое и полное удаление паразита Plasmodium из кровотока пациента, позволяющее избежать прогрессирования неосложненного случая в тяжелую форму, а также летального исхода.
Устойчивость к противомалярийным препаратам
В последние годы глобальным усилиям по борьбе с малярией начинает угрожать формирование устойчивости к противомалярийным препаратам, которое особенно характерно для подрегиона Большого Меконга. Для разработки стратегий лечения для эндемичных по малярии стран, а также для своевременного выявления устойчивости к препаратам и борьбы с ней требуется регулярный мониторинг эффективности лекарственных средств.
Дополнительную информацию о работе ВОЗ по решению проблемы устойчивости к противомалярийным препаратам можно найти на веб-странице о программе элиминации малярии в подрегионе Меконга.
Элиминация малярии определяется как достигнутое в результате целенаправленных действий прерывание местной передачи конкретного вида малярийного паразита в пределах определенного географического района. Предотвращение возобновления передачи инфекции требует непрерывных усилий.
В 2020 г. менее 100 случаев местной передачи заболевания было зарегистрировано в 26 странах, а в 2000 г. таких стран насчитывалось шесть. Страны, в которых в течение как минимум трех лет подряд не было зарегистрировано ни одного местного случая малярии, соответствуют критериям для подачи заявки в ВОЗ на сертификацию элиминации малярии. За последние два десятилетия Генеральным директором ВОЗ в качестве свободных от малярии было сертифицировано 11 стран.
Эпиднадзор за малярией предполагает непрерывный и систематический сбор, анализ и интерпретацию данных о малярии и использование таких данных в ходе планирования, реализации и оценки практических медико-санитарных мер. Совершенствование надзора за случаями заболевания малярией и смерти от нее помогает министерствам здравоохранения определять наиболее затронутые болезнью районы и группы населения и позволяет странам отслеживать меняющиеся тенденции заболеваемости. Надежные системы эпиднадзора за малярией также помогают странам разрабатывать эффективные меры по защите здоровья населения и оценивать результативность своих программ по борьбе с малярией.
Обновленная в 2021 г. Глобальная техническая стратегия ВОЗ по борьбе с малярией на 2016–2030 гг. устанавливает технические параметры работы во всех эндемичных по малярии странах. Она призвана направлять и обеспечивать поддержкой региональные и национальные программы в ходе их работы по противодействию малярии и достижению ее элиминации.
Эта стратегия ставит далеко идущие, но достижимые глобальные задачи, включая:
В соответствии со Стратегией Глобальная программа по борьбе с малярией обеспечивает координацию международных усилий ВОЗ по борьбе с малярией и достижению ее элиминации посредством:
Малярия известна с незапамятных времен. Упоминания об этой болезни встречаются на глиняных табличках из Месопотамии, молекулярные следы паразита, который ее вызывает, находили в древнеегипетских захоронениях, о ней писал Гомер в "Илиаде". Некоторые историки считают, что с появлением малярии на Апеннинском полуострове начался упадок Римской империи; итальянский регион Кампания, где расположен Неаполь, бедствовал до 1930-х годов, пока там не искоренили болезнь.
Малярию вызывают одноклеточные существа плазмодии, которые попадают в организм с укусом самки комара. Их известно несколько десятков видов. Одни заражают птиц, другие — рептилий, третьи — приматов. У людей за большинство случаев в ответе четыре плазмодия. Самый страшный из них — Plasmodium falciparum. Вероятно, предок этого паразита предпочитал горилл, но не позднее чем 10 тыс. лет назад обжился в человеке.
Считается, что из африканских джунглей малярия добралась по Нилу к побережью Средиземного моря, дальше распространилась на восток и в Грецию, из Греции — в Италию, а оттуда вместе с римскими легионами и купцами — до Британии и Дании. В прежние времена малярия встречалась и в России, на Кавказе, в Причерноморье и Поволжье. В наши дни малярией в России если и болеют, то приезжие из других стран, а большие "малярийные" комары, которых до жути боятся дети, — это безвредные караморы.
Только в XX веке болезнь унесла жизни 150–300 млн человек по всему миру. В последние годы от малярии умирают реже, но жертв все равно очень много. Сильнее всего от этой болезни страдают африканские страны южнее Сахары, где людей чаще, чем в других местах, заражает P. falciparum.
Как и у его родственников, у этого плазмодия чрезвычайно сложный жизненный цикл. Попав в кровь, его первая стадия, спорозоит, за полчаса-час добирается до печени. За раз в человека проникает восемь-десять спорозоитов. Но чтобы началась болезнь, иногда достаточно всего одного плазмодия в печени. В результате деления каждый способен произвести десятки тысяч потомков. В зависимости от вида плазмодия на это уходит от 5 до 25 дней.
На эту тему
На печеночной стадии паразиты выглядят иначе и называются мерозоитами. Вырвавшись, они нападают на красные кровяные клетки, эритроциты. Чтобы прицепиться и забраться внутрь, им нужно всего 30 секунд. Для питания мерозоиты используют гемоглобин, тот самый белок, который в нашем организме переносит кислород и углекислый газ.
В клетках крови развивается третья стадия паразита — трофозоит, каждый из них порождает еще 8–24 паразита. Часть из них инфицирует другие эритроциты. Остальные превращаются в мужские и женские клетки. Когда человека жалит комар, они попадают в насекомое, соединяются, проходят еще через несколько превращений. Так появляются новые спорозоиты, которые дожидаются, пока комар снова кого-нибудь не ужалит. Словом, по сравнению с плазмодием гусеницы, вырастающие в бабочек, — как утренник в детсаде после венского бала.
Болезнь дает о себе знать, когда лопаются эритроциты. Человека лихорадит, знобит, бросает в пот, кровь хуже переносит кислород. Часто малярия накатывает волнами раз в три-четыре дня, поскольку именно столько времени нужно новым плазмодиям, чтобы вырасти в эритроцитах, но с P. falciparum эти циклы почти не выражены.
В отличие от других плазмодиев, P. falciparum неразборчив и атакует как молодые, так и старые эритроциты. За двое суток количество паразитов увеличивается в 8–10 раз. Вдобавок из-за этого плазмодия забиваются мелкие кровеносные сосуды. В тяжелых случаях больной бредит, у него начинаются шок, конвульсии, желтуха, плохо работают легкие и почки. Если паразиты прилипли к сосудам в мозге, поражается и этот орган. Поэтому малярия, вызванная P. falciparum, намного чаще приводит к смерти.
Со временем вырабатывается иммунитет, но он не защищает полностью, а только облегчает болезнь. В Африке и других местах, где распространены плазмодии, малярией болеют по несколько раз в год. Если уехать из таких мест, иммунитет постепенно пропадает. Из-за этого же опасно сокращение программ по борьбе с малярией. Во второй половине XX века от них отказались на Мадагаскаре, и люди стали умирать чаще, чем до этих программ.
На эту тему
Поскольку организму нужно время, чтобы приспособиться к плазмодиям, наибольшую опасность они представляют для детей. У младенцев есть кое-какая защита благодаря антителам матери и высокому уровню гемоглобина, но к шести месяцам защита сходит на нет и снова появляется только к школьному возрасту. Именно поэтому двое из трех умерших — это дети до пяти лет.
От малярии есть лекарства. С XVII века ее лечили корой хинного дерева, в которой содержится горькое вещество хинин (чтобы перебить противный вкус, британцы разбавляли хининовые тоники джином — так появился популярный коктейль). В XX веке было получено похожее вещество под названием хлорохин, которое год назад проходило испытания как средство от COVID-19. Против малярии также используются производные хлорохина и еще несколько веществ, но плазмодии вырабатывают к ним устойчивость, как бактерии — к антибиотикам.
Сегодня наиболее эффективное средство — артемизинин, который в 1970-х годах китайские ученые выделили из полыни. В 2015 году за это была присуждена третья Нобелевская премия, связанная с малярией (четвертая, если считать награду за яд против насекомых ДДТ). Но еще до того, как химик Ту Юю отправился в Швецию за медалью, появились основания полагать, что артемизинин тоже перестанет действовать, как инсектициды перестают убивать комаров.
В борьбе с малярией пригодились бы вакцины, но с ними дело обстоит даже хуже, чем с лекарствами. Основная проблема — жизненный цикл плазмодиев. Для каждой стадии паразита иммунной системе приходится подбирать новое оружие. Вдобавок у плазмодия есть и другие приемы, чтобы обойти защиту хозяина, а сам он устроен намного сложнее вирусов, против которых действует большинство эффективных вакцин.
Разработанные вакцины-кандидаты готовят иммунную систему к борьбе с той или иной формой плазмодия, но одобрена только одна, да и то предварительно (23 апреля 2021 года Оксфордский университет объявил, что эффективность его препарата R21 составила 77%, но результат получен всего на нескольких сотнях человек, поэтому впереди новые исследования) . Она называется Mosquirix и была создана компанией GlaxoSmithKline еще в 1980-х годах. Вакцина прошла три этапа клинических испытаний, а сейчас идет четвертый этап в странах Африки.
В основе Mosquirix — белок с поверхности спорозоита. Иммунная система производит антитела, а когда с комариным укусом в кровь попадают настоящие спорозоиты, эти антитела их атакуют. Поскольку до попадания паразита в печень есть от силы час и всего один спорозоит может вызвать болезнь, антител требуется очень много — вакцину вводят трижды с перерывами в месяц, а потом еще раз.
На эту тему
Четыре дозы — лишь один недостаток Mosquirix. Результаты первых испытаний были многообещающие, но потом оказалось, что малышей полутора-трех месяцев от роду она почти не защищает, среди детей постарше сокращает заболеваемость всего на 39%, а число тяжелых случаев — на 29%. Это лучше, чем ничего, но не сравнится с большинством вакцин против других болезней. Вдобавок оказалось, что вакцинированные чаще заболевали менингитом, и в этой группе непропорционально чаще умирали девочки. Связь с вакциной установить не удалось, но объяснения тоже нет.
Четвертый этап клинических испытаний позволит собрать дополнительные данные о безопасности и эффективности вакцины, а пока основными средствами борьбы остаются ранняя диагностика, все еще действующие лекарства, противомоскитные сетки над кроватями, обработка жилья инсектицидами, сбор эпидемиологической информации.
За десятилетия все это спасло миллионы жизней. Но спасти можно было больше. По расчетам ВОЗ, на борьбу с малярией по всему миру нужно $5 млрд. Для сравнения: примерно столько же стоят игроки семи самых обеспеченных футбольных клубов чемпионата Англии. Хотя $5 млрд на всех не так уж много, в 2019 году на лечение и профилактику малярии потратили почти вдвое меньше. Новые лекарства и вакцины очень пригодились бы, но даже с тем, что есть сейчас, реально добиться лучших результатов.
Марат Кузаев
Об опасной инфекции, которую можно подхватить во время заграничного отдыха. Малярии. Буквально на днях ее жертвой стала юная россиянка, вернувшаяся с родителями из Танзании. Впрочем, болезнь распространена гораздо шире: от Индии и Вьетнама до Колумбии и Перу. Среди стран много традиционно популярных у наших туристов. По крайней мере в три можно отправиться без лишних формальностей и сейчас, во время пандемии.
Вот, например, Доминикана — достаточно только заполнить электронную анкету о состоянии здоровья. А власти Кении требуют свежий тест на COVID-19, как и Арабские Эмираты. Тем, кто собираются в теплые края, стоит помнить, коронавирус не единственная смертельная инфекция, хотя в первую очередь и думают о нем.
Счастливый отдых на райском острове Занзибар обернулся для семьи Мухиных трагедией. Незадолго до отъезда домой 15-летнюю Дашу на пляже укусил комар. Уже вернувшись в Вологду, она почувствовала недомогание. Врачи скорой заподозрили коронавирус — симптомы были похожи. Но диагноз не подтвердился. Дашу просто отпустили домой, и только на пятый день, когда ей стало совсем плохо, девочку отвезли в инфекционку.
«Мне доктор сказал, у нее малярия, мы ищем лекарства. Я Даше написала СМС: «Дашечка, ты в надежных руках, у тебя все получится!» Это было последнее мое сообщение, которое она прочитала», — рассказывает Елена Мухина, мама Даши.
Спасти Дашу не удалось. Раздавленные горем родители не знают, кого винить: турфирму, не предупредившую о смертельной опасности, или медиков, которые, по словам Елены, изначально знали: ребенок вернулся из Африки.
«Мне кажется, что все сейчас просто на COVID-19 и других диагнозов у нас просто нет. Два раза мы слышали такую вещь: радуйтесь, что у вас не COVID-19», — говорит женщина.
Еще одна недавняя жертва тропической малярии — Александр Донской. Тоже Занзибар, роскошные пляжи, остров черепах, потом сафари в материковой Танзании. Уже дома ошибочное подозрение на COVID-19, упущенное врачами время, как результат — смерть пациента.
«Вот эта вот картинка очень страшна для любого специалиста по малярии. Здесь огромное количество паразитов. На жаргоне тех, кто смотрит малярию, это называется «звездное небо», — поясняет профессор Института медицинской паразитологии и тропической медицины им. Е.И. Марциновского МГМУ им. И.М. Сеченова Евгений Морозов.
Так под микроскопом выглядят малярийные плазмодии — паразиты, которые поражают эритроциты человека. С кровью плазмодии разносятся по всему организму, быстро его разрушая.
«Если его начать лечить, то, скорее всего, проблемы никакой не будет, он будет успешно вылечен. Сейчас препараты действуют хорошо и быстро. А если его не начать лечить, то, видимо, это как раз тот случай, который мы наблюдали в последние недели — трагический случай гибели от тропической малярии», — отмечает ученый.
Одна из последних записей в Instagram Александра Донского. Сертификаты о прививках по прилете не требуются, отрицательный тест на коронавирус тоже не нужен. Зачем отпугивать строгими требованиями тех, кто только-только распробовал Танзанию и ее жемчужину — Занзибар?
«Если говорить про конкретные цифры, то в прошлом году туры в Танзанию — это было около 1% того, что мы продаем. В этом году уже около 7% в ноябре», — сообщает директор по маркетингу туристического агентства Евгений Гинзбург.
Об опасности тропической малярии турагентства предупреждают, что называется, между делом. Важно помнить самому: эффективной вакцины от этой болезни не существует. Репелленты и москитные сетки — это минимальный защитный набор. Кроме того, можно заранее провести профилактику.
«Это применение специальных препаратов, которые применяются или ежедневно или раз в неделю. Но при поездке в экваториальные страны лучше посоветоваться с врачом, чтобы уточнить дозировки, препараты, которые вам назначит врач», — говорит старший научный сотрудник ЦНИИ эпидемиологии Роспотребнадзора Марина Федорова.
Ежегодно в мире фиксируют до четверти миллиарда случаев малярии, в России — всего около 100, и все завозные. В нашей стране эта страшная болезнь считается побежденной. Отчасти поэтому лекарства от нее, и даже экспресс-тесты, есть далеко не во всех российских медучреждениях.
Так что опытные туристы советуют запасаться ими в поездке — в тропических странах эти препараты продаются на каждом шагу.
«Когда вы поедете туда путешествовать — первое, что вы должны сделать по приезду, это купить себе лекарство, купить тест. Если даже спустя неделю или 10 дней у вас начались нехорошие симптомы, то есть температура скачкообразная, первое, что вы должны подумать — что у вас малярия», — поясняет мотопутешественник Андрей Ключников.
Объездивший всю Африку, он знает, о чем говорит. С того света он выбрался только потому что вовремя попал во 2-ю инфекционную больницу Москвы.
«Восемь дней я был в коме. Восемь дней я ничего не помнил вообще, то есть я был вне жизни», — говорит он.
Чудом победив болезнь, — с таким количеством паразитов в крови шансы выжить были почти нулевые, — Андрей создал интернет-сообщество людей, пострадавших от малярии. Теперь они собирают запас лекарств, чтобы те, кому срочно понадобятся эти препараты, не тратили драгоценное время на поиски.
Вирус Зика переносится чёрными комарами (Aedes aegypti или Aedes albopictus), на теле которых имеются участки белых точек, которые выглядят, как белые полоски. Ножки этих комаров также полосатые. Эти же комары могут являться переносчиками таких заболеваний, как денге, вирус Чикунгунья, вирус жёлтой лихорадки. Эти комары как правило кусают в дневное время, чаще в ранние утренние или поздние вечерние часы. После первого появления вируса в регионе он может распространяться очень быстро.
Вирус Зика вызывает умеренную лихорадку, сыпь, «ломоту», обычно симптомы сохраняются в течение всего лишь нескольких дней. У многих лиц, заражённых вирусом Зика, не отмечается никакой патологической симптоматики. Если в вашем регионе распространены вирусы Зика, денге и чикунгунья, определить, каким именно вирусом заражён пациент, может быть сложно. Вирус Зика может быть крайне опасен для плода, если мать заразилась во время беременности.
Вирус Зика и беременность
Возможно, что вирус Зика опасен для плода, развавающегося в утробе матери. В Бразилии после вспышки Зика некоторые дети были рождены с серьёзными патологическими изменениями, а именно – микроцефалией, то есть уменьшением размера головы. Дети с микроцефалией могут умереть при рождении, а могут жить в течение долгих лет, но иметь трудности в физическом и умственном развитием. В связи с этим все женщины, а особенно женщины с подозрением на беременность, должны предпринимать меры, направленные на предупреждение комариных укусов при помощи одежды, которая полностью закрывает кожу, специальных репеллентов, москитных экранов и сеток.
Если вы планируете беременность, лучше всего дождаться, когда вирус Зика будет ликвидирован в вашем регионе. Одним из важных шагов для уменьшения неблагоприятных последствий, к которым может привести вирус Зика, является обеспечение всех женщин доступными методов контроля рождаемости.
Признаки вируса Зика
Зика как правило имеет не тяжёлое и непродолжительное течение от нескольких дней до 1 недели. Обычно самочувствие и состояние пациента с вирусом Зика не требуют его госпитализации.
Малярия, денге, чикунгунья и другие заболевания могут иметь схожую симптоматику. За исключением малярии, анализы на эти инфекции требуют временных и денежных затрат и осуществляются далеко не везде. Представители здравоохранения в вашей области должны обладать информацией, является ли ваш регион эндемичным по одному или более из этих заболеваний и возможно ли проведение диагностических тестов.
Что это: вирус Зика, денге, чикунгунья или малярия?
Эти заболевания имеют множество схожих признаков, таких как лихорадка, болевой синдром и сыпь. Кроме того, можно быть инфицированным сразу несколькими этими заболеваниями одновременно. Есть некоторые симптомы, которые помогают отличить одно заболевание от другого.
Малярия: Обычно начинается с озноба и головной боли, затем отмечается высокая лихорадка (40°С) в течение 2-3 дней. После этого у больного могут чередоваться периоды лихорадки и озноба. При малярии не бывает сыпи.
Денге: Сопровождается высокой лихорадкой (40°С), которая развивается внезапно и может сохраняться в течение недели. Обычно диагноз можно выставить при сочетании двух или более из вышеперечисленных признаков с лихорадкой: выраженные мышечные и суставные боли, головная боль и боль за глазами, тошнота или рвота, сыпь. Внимание необходимо обращать на рвоту с примесью крови, необычную отёчность или кровотечение из носа, дёсен или кожных покровов, так как эти симптомы могут говорить о наличии крайне опасного варианта денге, при котором требуется экстренная медицинская помощь.
Чикунгунья: Обычно сопровождается умеренным повышением температуры и выраженными болями в суставах кистей, стоп, коленях и спине. Болевой синдром может быть настолько сильным, что пациент принимает вынужденное согнутое положение и не может ходить. После купирования лихорадки суставная боль может сохраняться в течение нескольких недель и даже месяцев.
Зика: Сопровождается умеренной лихорадкой и, как правило, кожными высыпаниями. Также для этого заболевания типичен симптом раздражённых, или «розовых» глаз (конъюнктивит).
Лечение
Специфических методов лечения, а также вакцины для предотвращения вируса Зика не существует. Лечение включает в себя постельный режим, потребление больших объёмов жидкости и жаропонижающие средства (ацетоминофен или парацетамол) для купирования лихорадки и болевого синдрома. Если у пациента денге, а не Зика, использование ацетоминофена более безопасно, чем аспирин или ибупрофен, которые при денге могут приводить к неблагоприятным последствиям. Кроме того, аспирин и ибупрофен не показаны беременным женщинам, в то время как ацетаминофен безопасен для применения в этой категории.
Если вы больны и вас укусил комар, он может передать вирус другим людям со своим укусом. Именно поэтому одной из мер профилактики является защита больного от повторных укусов комара. Необходимо применять специальные противомоскитные сетки на кровати и оставаться вдали от источников воды (реки, колодцы, водяные насосы) в ранние утренние и вечерние часы, когда комары наиболее активны.
Когда необходимо обратиться к врачу
Лечить вирус Зика можно в домашних условиях, но в некоторых случаях крайне важно обратиться к врачу:
Информирование медицинских работников о случае заболевания поможет им определить, когда необходимо принять общественные меры для предотвращения распространения болезни.
Как комары переносят заболевание

Остановить заболевание, переносимое комарами, можно путём предотвращения укусов комаров и их размножения в домах и окружающей среде.
Профилактика комариных укусов
В отличие от малярийных комаров, комары, которые переносят вирус Зика, кусают преимущественно в дневные часы. Эти комары обычно обитают в тенистых, тёмных местах, например под столами и кроватями, или в углах помещений. Вы можете избежать комариных укусов следующими способами:
Кроватные сетки особенно эффективны против малярийных комаров, которые кусают по ночам, но они также могут предотвратить заражение вирусом Зика маленьких детей или тех, кто спит в дневные часы. Кроватные сетки также помогут защитить тех, кто уже болен, от повторных укусов и, тем самым, предотвратить передачу болезни другим людям. Лучше всего использовать москитные и кроватные сетки, обработанные инсектицидами. Для сохранения эффективности, их нужно повторно обрабатывать каждые 6-12 месяцев. Также не забывайте использовать сетку, если вы спите на открытом воздухе.
Предотвращение размножения комаров
Комары, которые переносят вирус Зика, денге и чикунгунью, размножаются в стоячей воде. Комар откладывает личинки даже в неглубоких тарелках с водой, где они выводятся в течение примерно 7 дней. Если раз в неделю избавляться от стоячей воды, размножение комаров прерывается, так как их личинки не выводятся. Для того чтобы предотвратить размножение комаров, необходимо:
Чтобы предотвратить заражение вирусом Зика, избавьтесь от мест, где комары могут размножаться, и держите хранилища воды закрытыми.
Общество может предотвратить заболевания, передающиеся с комариными укусами
Общество может помогать пожилым людям, инвалидам или семьям с низким уровнем доходов сделать запасы или необходимые для предотвращения комариных укусов изменения. Помогите вашим соседям содержать их участки и дома без стоячей воды для предотвращения размножения комаров (смотри выше). Как только комары найдут место для размножения, они могут инфицировать всех людей в обществе. Именно поэтому так важны повсеместные общественные меры профилактики.
Дорожные и другие водные коллекторы требуют особого внимания для предотвращения размножения комаров. Поддержание естественных водных путей и движения дождевой воды поможет избежать застаивания воды. Ухаживайте за землёй так, чтобы она впитывала воду или стекала ручьями, а не скапливалась с образованием мест, пригодных для размножения комаров. Сохраняйте бассейны водоёмов так, чтобы ток воды не нарушался. Не позволяйте воде образовывать на земле лужи, собираться на свалках или незанятых участках, а также следите, чтобы потоки воды не блокировались размытой почвой, листьями или другими загрязнениями. Общественное Руководство по Здоровой Окружающей Среде на сайте Hesperian содержит больше информации о контроле за комарами.
Удалите места, где могут размножаться комары, в вашем доме и в окружающей среде.
© www.hesperian.org
В журнале «Nature Reviews Immunology» за 2017 год Michelle N. Wykes, Sharon R. Lewin была представлена очень интересная статья, посвященная вопросу возможного применения checkpoint-ингибиторов с целью профилактики и лечения целого ряда инфекционных заболеваний. В данной статье описывается значение передачи сheckpoint-сигналов в случае заражения малярией, ВИЧ и вирусом гепатита В, а также туберкулеза (ТБ), а также возможности терапевтического воздействия на иммунные контрольные точки в условиях наличия инфекционного заболевания.
При развитии острых инфекций, таких как малярия, а также при хронических вирусных инфекциях, включая ВИЧ и вирус гепатита, наблюдается повышение активности точек иммунного контроля - белка запрограммированной клеточной гибели 1 (PD1) и цитотоксического Т-лимфоцитарного антигена 4 (CTLA4).
Успешное применение checkpoint-ингибиторов в терапии злокачественных новообразований дает основание авторам статьи предполагать, что использование препаратов данной группы также будет эффективным для профилактики и лечения ряда социально-значимых инфекционных заболеваний.
Молекулы иммунной контрольной точки являются ингибиторными рецепторами, экспрессируемыми на иммунных клетках, которые являются триггером иммуносупрессивных сигнальных путей. Опосредованная передача сигналов через данные молекулы может привести к истощению иммунных клеток (особенно Т-лимфоцитов). Истощение Т-клеток проявляется снижением их функции, устойчивой экспрессией молекул иммунной контрольной точки (например, белка запрограммированной клеточной гибели 1 (PD1)), плохим обратным ответом и транскрипционным состоянием, отличным от состояния нормально функционирующих эффекторных Т-лимфоцитов или Т-клеток памяти[3]. Существует множество типов активирующих и ингибиторных взаимодействий, которые возникают между антиген-представляющими клетками (АРС) и Т-клетками, и эти взаимодействия определяют характер иммунных реакций.
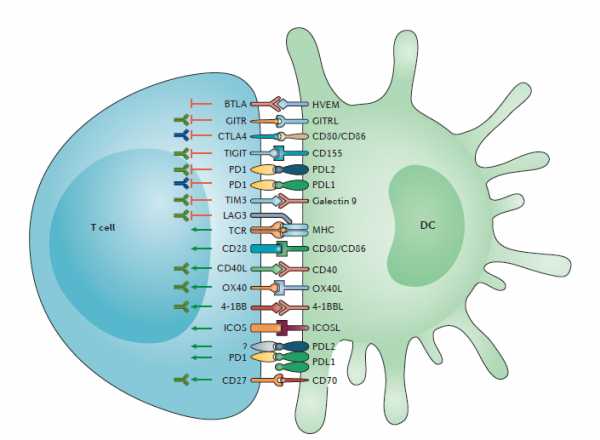
Рисунок 1 - Взаимодействие с антиген-представляющими клетками, регулирующими ответы Т-клеток (адаптировано Michelle N. Wykes et al., 2017).
Исследование иммуносупрессивных взаимодействий привело к клиническому развитию и внедрению новых методов лечения рака, которые увеличивают возможности использования специфических антител в качестве checkpoint-ингибиторов. Антитела, нацеленные на PD1 (Пембролизумаб, Ниволумаб), на цитотоксический Т-лимфоцитарный антиген 4 (CTLA4) (Ипилимумаб) и лиганд программированной гибели клеток 1 (PDL1) (Атезолизумаб, Авелумаб и Дурвалумаб), в настоящее время рекомендованы для монотерапии различных видов злокачественных опухолей. Кроме того, было показано, что комбинированная таргетная терапия, нацеленная на PD1 и CTLA4, является более эффективной, чем любая другая терапия меланомы[4], хотя также имеет токсическое воздействие на организм.
Основная проблема иммунотерапии заключается в том, чтобы понять, почему существуют различные ответы на лечение. На данный момент, идет поиск предиктивных «биомаркеров» благоприятного клинического ответа. Например, выявление экспрессии PDL1 на опухолевых клетках помогает в поиске тех пациентов, которые в наибольшей степени ответят на терапию, в которой используется блокаторы PD1 или PDL1[5]. Учитывая стоимость и токсичность использования checkpoint-ингибиторов, определение биомаркеров в настоящее время является главным приоритетом. Эффективность иммунотерапии в лечении инфекционных заболеваний изучена не так хорошо. Однако, предполагается, что она может быть использована для профилактики и лечения инфекционных заболеваний как в острой, так и в хронической фазах инфекции. Разработка вакцин для целого ряда инфекционных заболеваний, включая малярию, вирус гепатита B (HBV) и ВИЧ, может быть улучшена за счет использования checkpoint-ингибиторов. Учитывая, что резистентность к лекарственным средствам, применяемых для лечения малярии[10] и многих других инфекциях возрастает, что ВИЧ и HBV требуют лечения и контроля в течение всей жизни, рассматриваются новые возможные стратегии лечения этих инфекций. Кроме того, также требуется параллельный поиск биомаркеров, использование которых было бы возможно для выбора наиболее приемлемой терапии и установления временных рамок, когда применение иммунотерапии наиболее эффективно.
Таблица 1 - Сheckpoint-рецепторы
Checkpoint рецептор | Тип эффекторных клеток | Лиганд | Примечание |
TIM3 | Th2-клетки | Galectin 9 на APCs | Галектин 9 индуцирует внутриклеточный поток кальция, агрегацию и гибель клеток Th2 in vitro. Связь TIM3 и PD1 идентифицирует CD8 + Т-клетки у мышей с фенотипом истощения. |
LAG3 | Природные, индуцированные тимусом и индуцированные, адаптивные периферические клетки Treg | MHC II класса на APCs | LAG3 улучшает функцию клеток Treg. LAG3 и PD1 обычно выражены на анергических или истощенных Т-клетках, а комбинированная блокада может вылечить большинство мышей установленных опухолей, которые в значительной степени устойчивы к лечению одиночных антител |
CD96 и TIGIT | T-клетки и NK | CD155 на DCs | CD96 и TIGIT вызывают иммунодепрессию, конкурируя с CD226 для CD155. Слитый белок TIGIT-Fc ингибирует активацию Т-клеток, генерируя регуляторные DC. |
BTLA | Т и В-клетки
| HVEM, выраженный большинством гемопоэтических, эндотелиальных и эпителиальных клеток | Лигирование TNFSF14 с помощью HVEM может быть стимулирующим, тогда как связывание BTLA-HVEM считается кo-ингибирующим. BTLA была связана с дисфункцией Т-клеток во время рака, а двойная блокада BTLA и PD1 явно улучшает противоопухолевый иммунитет |
TNFSF14 | Интендативные адаптивные иммунные клетки, включая Т-клетки | ||
GITR | Тreg клетки на высоких уровнях, обычные Т-клетки на низких уровнях,
| GITRL на APCs | GITR играет ключевую роль, поддерживая клетки CD4 + CD25 + Treg. GITRL в основном экспрессируется на APC, и показано, что антитела к GITR способствуют противоопухолевому ответу через потерю стабильности линии клеток Treg |
VISTA | Гемопоэтические клетки | Неизвестно | Доклинические исследования с блокадой VISTA показывают многообещающее улучшение противоопухолевых ответов Т-клеток и улучшение выживаемости |
Малярия - это антропоноз, вызванный простейшими паразитами рода Plasmodium и передающийся человеку москитами рода Anopheles.
Большинство случаев малярии вызваны Plasmodium falciparum и Plasmodium vivax, а в 2015 году во всем мире насчитывалось 212 миллионов новых случаев малярии, из которых 429 000 человек были связаны только с P. Falciparum[11]. За последние 20 лет было разработано и клинически апробировано более 100 вакцин для борьбы с малярией. Большинство из них были специально разработаны для таргетного воздействия на паразитов в печеночной стадии или кровяной стадии развития. Данный метод был основан на индукции защитных антител и CD4 + Т-клеток, хотя несколько вакцин были разработаны для генерации CD8 + Т-клеточных ответов.
Лучший вариант вакцины, выявленной на сегодняшний день, является вакцина RTS, S / AS01E; однако, ее эффективность в первый год введения была только 43,6% , а к четвертому году использования снизилась до 16,8% [12]. Очевидно, что требуется поиск новой тактики лечения, нацеленной на механизмы иммунного воздействия на паразитов. В некоторых исследованиях было показано, что при малярии на стадии эритроцитарной шизогонии антитела играют ключевую роль в защите организма, о чем свидетельствует перенос сыворотки от иммунизированных взрослых детям[17]. Было установлено, что Т-хелперы1 (Th2) имеют ключевое значение для контроля над количеством паразитов в крови и, таким образом, для предотвращения развития инфекционного процесса [18, 19]. Антитела играют роль в уничтожении оставшихся паразитов [20]. Антитела и CD8+ Т-клетки принимают участие в формировании иммунитета, предотвращая повторное заражение [22]. Исследования также показали, что при малярии активируется апоптоз В-клеток [23] памяти из-за нарушения функций дендритных клеток (DC) [24]. Это может объяснить, почему применение вакцин не было успешным. И, вероятно, поэтому роль экспрессии PD1 в настоящее время расценивается как основной фактор в утрате иммунитета против малярии.
В ходе исследований в районах Мали и Кении, эндемичных по малярии, было обнаружено, что у людей, недавно инфицированных P. falciparum, повышена экспрессия PD1 на CD4+ [26, 27] и CD8+ T-клетках [27]. Аналогичным образом, повышение процента CD4+ T-клеток у людей с острыми фазами инфекции, вызванной P. vivax, P. falciparum имело место повышение экспрессии CTLA4, OX40, связанный с глюкокортикоидом TNFR-родственный белок и CD69 [28], что указывает на роль регуляторных T-клеток в подавлении иммунитета к малярии и показывает варианты потенциальных мишеней для управления контрольной точкой. Было показано, что в то время как PDL1, экспрессируемый на дендритных клетках, действительно ослабляет иммунные ответы против малярии, белок PDL2, экспрессируемый на тех же клетках, улучшает иммунные ответы, ингибируя взаимодействия PDL1-PD1 [9]. Примечательно, что во время острой фазы инфекционного процесса PD1, как было показано, обусловливал 95%-ную потерю числа и функциональной способности паразитоспецифических CD8+ Т-клеток, которые необходимы для борьбы с хроническим заболеванием [21]. Тем самым экспрессия белка PDL2 предохраняет от развития фатальных осложнений малярии (рис. 2).
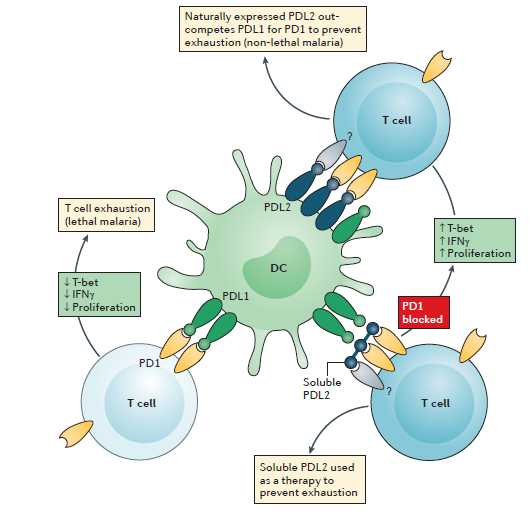
Рисунок 2 - PDL2 защищает от летальной малярии и обладает трансляционным потенциалом (адаптировано Michelle N. Wykes et al., 2017).
Было показано, что мультимерная форма PDL2, связанная с Fc-областью иммуноглобулина (PDL2-Fc) применима для нивелирования летальной инфекции и увеличивает шанс выживаемости после повторного инфицирования через несколько месяцев. Кроме того, комбинированная блокада ингибирующих молекул белка PDL1 и гена активации лимфоцитов 3 (LAG3) с антителами, ускорила выздоровление от острой нелетальной малярии в стадии эритроцитарной шизогонии, посредством улучшения функции CD4+клеток и увеличения титров антител [26]. Антитело-опосредованное инициирование передачи сигналов OX40 также увеличивало эффективность CD4+ T-хелперов, клеточного и гуморального иммунитета и, таким образом, улучшало эффективность уничтожения паразита при нелетальных формах малярийной инфекции [30].
Таким образом, отдельные белки контрольной точки способствуют развитию патогенеза малярии, и дальнейшее исследование их применения для терапевтических целей оправдано.
Эти методы лечения могут также иметь применение с целью «оживления» иммунных клеток, которые, как предполагается, не выполняют свою функцию у людей, проживающих в районах эндемичных по малярии [26,27]. Это даст возможность формировать стойкий иммунитет к малярии с помощью вакцин. Кроме того, использование checkpoint-ингибиторов может дополнять применение малярийных препаратов для выработки долгосрочного иммунитета, как это представлено на примере PDL2-Fc9.
Т-клеточное истощение является отличительной чертой многих хронических вирусных инфекций, включая ВИЧ. При отсутствии лечения ВИЧ-инфекции наблюдается повышенная экспрессия множественных белков иммунной контрольной точки, включая PD1, CTLA4, TIM3 и LAG3, как на CD4 +, так и на CD8 +клетках [36-38]. После АРТ экспрессия белков иммунной контрольной точки снижается, но остается повышенной по сравнению с контрольной группой, в которую входят люди, не имеющие ВИЧ-инфекции. Повышенная экспрессия PD1 преимущественно наблюдается в Т-клетках памяти, тогда как PD1 и CTLA4 экспрессируются регуляторными Т-клетками, а LAG3 экспрессируется в эффекторных Т-клетках памяти [41] (рис. 3).
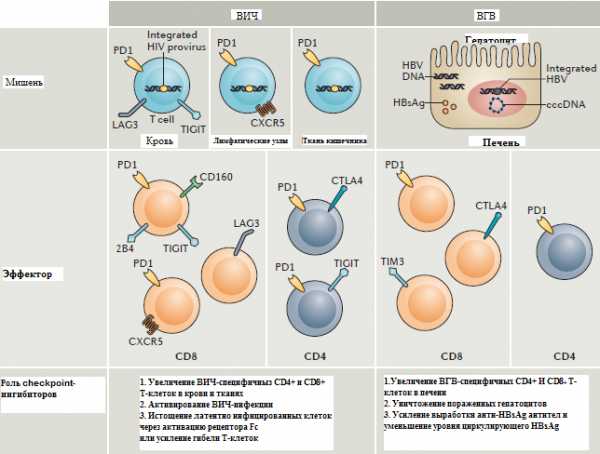
Рисунок 3 - Сheckpoints при ВИЧ-инфекции и инфекции вируса гепатита В (адаптировано Michelle N. Wykes et al., 2017).
Повышенные уровни экспрессии PD1 на общих и ВИЧ-специфических CD8+ Т-клетках при нелеченой ВИЧ-инфекции впервые были зарегистрированы более 10 лет назад.
В отсутствие AРТ увеличение экспрессии PD1 было связано с ускоренным снижением количества CD4+ Т-клеток в результате острой инфекции и нелеченой хронической инфекции. Многочисленные наблюдения продемонстрировали четкую связь между экспрессией PD1 на CD4+ или CD8+ Т-клетках и клиническим исходом.
Таблица 2 - Резюме доклинических или ex vivo исследований в области инфекционных заболеваний, сообщающих о преимуществах сheckpoint-ингибиторов
Инфекционное заболевание | Тип аффекторных клеток | Ингибиторные белки | Виды мишеней | Результаты |
ВИЧ | CD4+ и CD8+ T клетки | PD1, CTLA4, TIGIT и LAG3 | Люди и мыши | Увеличение ВИЧ-специфических CD8 + Т-клеток Проводятся клинические исследования при злокачественных новообразованиях |
ВГВ | CD4+ и CD8+ T клетки | PD1, CTLA4, 2B4 и TIM3 | Люди (ex vivo), мыши и сурки | PD1, CTLA4 и TIM3, экспрессируемые на CD4 + и CD8 + Т-клетках у пациентов с хронической инфекцией ВГВ PD1, CTLA4 и TIM3 улучшают функцию HBV-специфичных CD8 + Т-клеток in vitro |
ВГС | CD4+ и CD8+ T клетки | PD1 и PDL1 | Люди | Экспрессия PD1 повышается в отношении общего количества HCV-специфических CD8 + в периферической крови и печени пациентов с хронической инфекцией Блокада PDL1 восстанавливает функциональную компетентность CTL, специфичных для HCV, in vitro |
Туберкулез | CD4+ и CD8+ T клетки | TIM3 | Мыши | Блокада TIM3 восстанавливает функцию Т-клеток и улучшает бактериальный контроль, особенно у людей с хронической инфекцией |
Малярия | CD4+ и CD8+ T клетки; B клетки | PD1, PDL1, CTLA4, LAG3 и TIM3 | Мыши | Ускоренное уничтожение паразитов Выживание от летального заболевания Снижение заболеваемости церебральной малярией |
По результатам исследований, введение антиPD1 антитела SIV-инфицированным макакам-резус привело к быстрому увеличению вирус-специфических CD8+ Т-клеток с более высоким функциональным качеством и снижению передачи сигналов интерферона, улучшение проницаемости кишечника [56].
Возможно, что эффективный ответ Т-клеток на анти-PD1-антитело требует наличия антигена, и что, поскольку АРТ приводит к резкому сокращению вирусных антигенов, функциональный ответ на блокаду иммунной контрольной точки может быть ограничен в этой ситуации.
Данные исследований свидетельствуют о том, что анти-CTLA4 антитела оказывают существенное влияние на ВИЧ, которое сохраняется при проведении АРТ. В основе этого лежит другой механизм действия анти-PD1-антитела, что приводит к снижению РНК ВИЧ в ткани лимфатических узлов. У людей, инфицированных ВИЧ, LAG3 также высоко экспрессируется на CD4+ и CD8+ Т-клетках в лимфатических узлах и крови, и это явление напрямую связано с уровнями РНК ВИЧ в плазме, но обратно пропорционально количеству лимфоцитов CD4+ [59].
Блокада TIGIT и PD1 с анти-TIGIT и anti-PDL1 антителами ex vivo привела к значительному улучшению ВИЧ-специфической функции CD4+ T-клеток у людей, инфицированных ВИЧ, в том числе и на АРT [38].
В отличие от злокачественных клеток, которые обычно экспрессируют лиганды белков иммунной контрольной точки, таких как PDL1 [62], у людей, инфицированных ВИЧ, в том числе и при проведении АРТ, сами белки иммунной контрольной точки избирательно распознают клетки, инфицированные ВИЧ, которые сохраняются на фоне АРТ [63-64] (рис. 4).
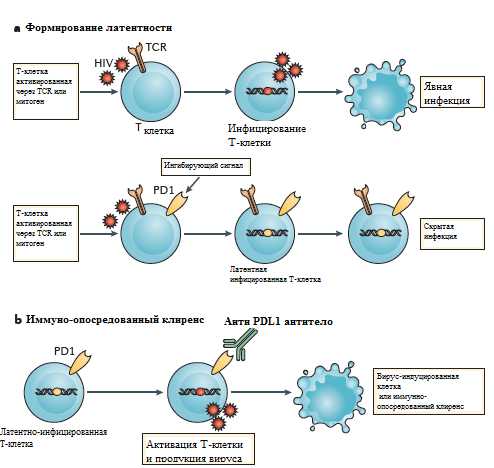
Рисунок 4 - Предполагаемая роль PD1 в формировании и изменении латентности ВИЧ (адаптировано Michelle N. Wykes et al., 2017).
Это наблюдение имеет большое значение для разработки метода по ликвидации резидуального вируса, который сохраняется, несмотря на проводимую АРТ, поскольку наличие инфицированных клеткок является основным препятствием для излечения. Многие исследования показали значительную корреляцию между частотой встречаемости PD1+ CD4+ T-клеток и PD1+ CD8+ T-клеток с различными маркерами устойчивости ВИЧ-инфекции к АРТ в крови [63,65,66], лимфатических узлах [67] и желудочно-кишечном тракте. Белки иммунной контрольной точки, отличные от PD1, также могут распознавать инфицированные клетки у лиц, получающих АРТ. В недавнем времени было показано, что ВИЧ может быть значительно обогащен клетками, полученными от людей, инфицированных ВИЧ и получающих AРT, которые экспрессировали PD1, TIGIT и LAG3 по сравнению с клетками, которые не экспрессировали ни один из этих белков [64](рис. 3). Внедрение CTLA4, опосредованное вирусным белком Nef, потенциально может играть роль в сохранении устойчивости ВИЧ в этих клетках [70]. Также было показано, что у человека с диагнозом «метастатическая меланома», инфицированного ВИЧ и получающего АРТ, наблюдается значительное увеличение связанной с клетками ВИЧ-РНК после лечения анти- CTLA4 антителами (Ипилимумаб) [71] и анти-PD1 антителами (Ниволумаб) [72]. Эти данные еще должны быть подтверждены в клинических исследованиях.
Изучение доза-зависимой фазы анти-PDL1-терапии было прекращено после введения самой низкой дозы 6 людям с ВИЧ-инфекцией получающим АРТ [73], в связи с развитием токсического воздействия на сетчатку. На сегодняшний день лишь немногие люди с ВИЧ-инфекцией получили зарегистрированные препараты сheckpoint-ингибиторов, поскольку лица с ВИЧ-инфекцией были исключены из исследования. Но в настоящее время использование данных препаратов для ВИЧ-инфицированных людей становится возможным.
Таким образом, сheckpoint-ингибиторы могут внести существенный вклад в достижение полного излечения от ВИЧ-инфекции и позволять людям безопасно прекращать АРТ.
При хронической инфекции HBV, не подвергавшейся лечению, общие и HBV-специфичные CD8 + Т-клетки экспрессируют высокие уровни PD1, CTLA4 и TIM3 [84-86], а при острой инфекции HBV циркулирующие и внутрипеченочные CD8+ Т-клетки экспрессируют высокие уровни PD1 [87].
Было показано, что наличие лиганда для PD1, PDL1 более высокий на циркулирующих CD14+ моноцитах и CD19+ B-клетках у лиц с хронической инфекцией HBV, циррозом печени и HCC и, следовательно, может способствовать постоянному Т-клеточному истощению [88]. Исследования показали, что дефекты функции Т-клеток при хронической инфекции HBV не ограничиваются увеличением экспрессии белков иммунной контрольной точки. Внутрипеченочные Т-клетки также проявляют повышенную экспрессию PD1 [87] и TIM3 [84]. Галектин (лиганд TIM3) также был активен на клетках Купфера, что, возможно, позволяет поддерживать внутрипеченочное Т-клеточное истощение [84]. Внутрипеченочные CD8+ Т-клетки также экспрессируют другие белки истощения, включая BTLA, и могут продуцировать IL-10, что дополнительно ингибирует функцию Т-клеток [92].
Исследования с использованием крови людей, страдающих с хроническим гепатитом В, продемонстрировали, что ингибирование PD1, CTLA4, 2B4 и TIM3 приводит к увеличению функции HBV-специфичных CD8+ Т-клеток [83,84,86,93–96]. Применение сheckpoint-ингибиторов в качестве как монотерапии, так и в сочетании с антивирусными препаратами, может увеличить продукцию HBV-специфичных CD8+ Т-клеток. А также влиять на выработку антител против HBsAg. Но при этом существуют значительные риски, в том числе повышенная инфильтрация ткани печени повторно активированными Т-клеткам, что может вызвать воспаление.
Установлено, что добавление анти-PDL1-антитела к вакцине и энтекавиру по сравнению с одной только вакциной и энтекавиром привело к значительному увеличению иммунологического и клинического ответа без развития гепатотоксичности [97]. Недавнее исследование open-label Ниволумаба (анти-PD1-Ат) с вакциной против HBV и без нее и 20 участниками с подавленной вирусной хронической инфекцией HBV показало, что Ниволумаб безопасен и хорошо переносится, а один участник подвергся сероконверсии HBsAg [99].
В настоящее время ведется множество клинических испытаний сheckpoint-ингибиторов у лиц с хроническим HBV. Таким образом, применение сheckpoint-ингибиторов играет важную роль в лечении вирусного гепатита В, ограничивая повреждение печени при острой инфекции и способствуя стабилизации процесса при хроническом HBV.
Для формирования невосприимчивости организма к M. tuberculosis необходимы CD4+ Т-клетки. Было обнаружено, что TBC-специфические CD4+ Т-клетки у лиц с активной туберкулезной инфекцией продуцируют IFNγ, IL2 и TNF и экспрессируют PD1. Было показано, что функционально истощенные ТМ3 + Т-клетки накапливаются при наличии хронической туберкулезной инфекции. Ингибирование TIM3 восстанавливает функции Т-клеток и улучшает контроль за бактериальной нагрузкой у лиц с хроническим течением туберкулеза. Комбинация препаратов, рутинно используемых для лечения туберкулеза, с сheckpoint-ингибиторами даст возможность формирования иммунитета развиваться, при этом, бактериальная нагрузка будет находиться под частичным контролем.
Лекарственная терапия малярии, ВИЧ-инфекции, вирусного гепатита В и туберкулеза в настоящее время является большой проблемой в связи с развитием полирезистентности микроорганизмов, при этом разработка эффективной вакцины зачастую невозможна. Поэтому применение сheckpoint-ингибиторов может оказаться абсолютно новой стратегией борьбы с хроническими инфекциями, для которых по-прежнему отсутствуют эффективные методы лечения, и возможности применения вакцин ограничены. Однако следует учесть, что применение данных препаратов в свою очередь имеет ограничения и побочные эффекты. В ряде исследований было выдвинуто предположение, что ингибирование иммунной контрольной точки также может быть использовано для лечения ряда инфекционных заболеваний, в том числе в терапии малярии, ВИЧ-инфекции, что несомненно требует подтверждения в клинических исследованиях.
www.nature.com/nri
Материал подготовлен НОИМТОиР: клинический ординатор Бриш Н.А.
опубликовано: 30.07.2020, 11:23 | изменено: 30.07.2020
Может ли укус комара стать причиной развития новой коронавирусной болезни? Давайте разбираться.
Каждый год сотни миллионов людей заболевают и больше полумиллиона человек умирают от болезней, распространяемых комарами.
Через укусы комаров могут передаваться вирусы?
Да, многие вирусы могут передаваться комарами.
Среди самых опасных-вирусы Зика, чикунгунья, возбудители желтой лихорадки и лихорадки Денге.
Малярия, вызывается не вирусом, а плазмодием, но также может передаваться через комаров.
Через укусы комаров передаются любые вирусы?
Нет, есть вирусы, которые комары не могут передавать, в том числе, вирус Эбола и вирус иммунодефицита человека (ВИЧ).
В случае с ВИЧ это объясняется низкой концентрацией вирусов, циркулирующих в крови зараженного человека, и комар просто не получает вирус при укусе.
Вирус- возбудитель опаснейшего заболевания- лихорадки Эбола не заражает комаров, даже когда ученые специально в лабораторных заражают комаров этим вирусом.
Во время вспышек Эболы в научных целях были собраны десятки тысяч кровососущих насекомых, и ни в одном из них не был обнаружен вирус.
Может ли новый коронавирус распространяться через комаров?
Однозначно – нет.
Возбудитель COVID-19 передается от человека к человеку через капли, когда инфицированные люди кашляют, чихают, либо касаются поверхностей, зараженных вирусом.
Нет никаких доказательств того, что коронавирус может распространяться через комаров, несмотря на то, вирус, хоть и в крайне малых концентрациях, обнаруживается в крови инфицированных людей.
Нет никаких доказательств того, что вирус способен заразить самого комара, даже если комар действительно получит достаточно высокую дозу вируса с кровью зараженного человека. А если комар не заражен, то и передача вируса следующему человеку, которого он укусит, невозможна.
Почему только некоторые вирусы передают комары?
Дело в том, что для этого должно совпасть несколько условий, к счастью, в случае с новым коронавирусом этого не происходит.
Когда комар кусает зараженного человека, он всасывает кровь, содержащую вирусы. Далее кровь поступает в кишечник комара.
В кишечнике насекомого вирус должен сначала заразить клетки, выстилающие кишку, и дальше распространиться по всем другим тканям комара.
Передать вирус при укусе комар может только и только тогда, когда вирус есть в его слюнных железах и слюне.
Но дорога вируса от кишечника комара до его слюнных желез дело долгое и непростое.
Далеко не всякий вирус способен успешно пройти этот путь, преодолев все барьеры.
1. Время.
Может занять от нескольких дней до недели, некоторые вирусы, в том числе и новый коронавирус, погибают намного раньше.
2. Клетки.
Для размножения вируса подходят строго определенные клетки, которых может не быть в теле насекомого. Так, новый коронавирус размножается преимущественно в клетках легочного эпителия человека, аналогичных которым у комара просто нет.
4. Концентрация.
Возбудители заболеваний, переносчиками которых могут быть кровососущие насекомые, циркулируют в крови инфицированного человека в довольно высокой концентрации. В результате, при укусе комар гарантированно получает с порцией крови достаточно много вирусных частиц. В случае с новым коронавирусом этого не происходит, возбудитель в крови есть, но его крайне мало, и вероятность того, что комар получит его с кровью стремится к нулю.
Таким образом для вирусов, которые эволюционно приспособились к пути от кишечника комара до его слюнных желез, сложностей не возникает, но не для новых вирусов.
Для коронавируса каждый из барьеров на этом пути становится непреодолимым.
Даже если предположить, что новый коронавирус попал в комара, он просто погибнет в его кишечнике и будет выделен, размножаться в клетках насекомого вирус физически не способен.
Следовательно, нет доказательств необходимости беспокоиться о передаче коронавируса через комаров.
По одной из версий, коронавирус перешел к человеку вследствие контакта с панголинами или летучими мышами в Юго-Восточной Азии. Вопрос дискуссионный, но случаи перехода вирусов из дикой природы в густонаселенные области действительно известны. При этом многие ученые связывают возникновение и распространение новых инфекционных заболеваний с освоением малоосвоенных лесов — такие примеры известны в тропиках. Нужно ли этого бояться, если мы живем в России? У меня для вас плохая новость: безоглядное, неконтролируемое освоение российских малонарушенных таежных лесов несет не меньшие, а, возможно, даже большие риски, чем появление неизвестных до сих пор болезней.
Например, мы точно знаем, что это повлияет на климат планеты, гидрологический режим Евразии и повлечет погодные сюрпризы, такие как паводки и засухи, которые уже происходят в нашей стране, причем даже одновременно: например, в прошлом году некоторые районы Иркутской области затопило, а в других горели леса. Сейчас, если принять меры, еще есть шанс предотвратить эти последствия. Но если бездействовать, то случится беда и невозможно будет придумать какое-то волшебное средство в виде вакцины — потребуются усилия и затраты, совершенно несопоставимые по масштабу с выгодой, которую сейчас Россия получает от продажи древесины, заготовленной в девственных лесах.
Распространение инфекционных заболеваний бывает связано с обезлесением и деградацией лесов в результате их освоения. Дикие звери и членистоногие, живущие в лесу, давно признаны естественным источником инфекций, потенциально опасных для человека. Наступление человека на леса создает условия для передачи заболеваний из-за учащения контактов с естественными источниками инфекций или из-за изменений естественной динамики инфекций вследствие воздействия человека на популяции переносчиков.
Реклама на Forbes
С лесами связаны источники многочисленных заболеваний, одни названия которых не обещают ничего хорошего: вирус Эбола, лихорадка денге, вирус Зика, хантавирусы, желтая лихорадка, малярия.
Однако стоит опасаться не только очередной вспышки неизвестной болезни, пришедшей из леса, а деградации лесов, потому что она затронет еще большее количество людей.
Пандемия коронавируса уже унесла жизни более 12 000 человек, и весь мир ввел беспрецедентные меры по борьбе с распространением вируса. При этом в 2015 году во время антропогенных лесных пожаров в Индонезии образовавшийся смог привел к преждевременной смерти более 100 000 человек в Индонезии, Малайзии и Сингапуре. Статистика роста смертности из-за отравления дымом лесных пожаров в России вообще не ведется. А если еще учесть высвобождение углерода, которое происходит из-за вырубки в России нетронутых человеком лесов и вклад этого процесса в глобальное потепление?
В мире в лесах живет по меньшей мере 250 млн человек. Для многих из них культурная самоидентификация глубоко связана с растительным и животным миром вокруг них. Археологические и этнографические свидетельства показывают, что леса были населены на протяжении тысячелетий. Культурная самоидентификация многих коренных народов, живущих в лесах, тесно связана с малонарушенными лесами. Деградация лесов делает традиционный образ жизни для них невозможным.
Несмотря на то что на Земле за последние 300 лет утрачено по крайней мере 35% площади лесов, они по-прежнему занимают большие территории общей площадью 40 млн кв. км, или примерно 31% суши. Но из сохранившихся лесов только 18% остаются в «диком», первозданном состоянии, где флора и фауна в естественном состоянии и развиваются по природным законам. Остальные 82% в той или иной степени подверглись деградации вследствие прямого воздействия хозяйственной деятельности: промышленных рубок, урбанизации, развития сельского хозяйства и строительства дорог.
Полезные функции малонарушенных лесов намного выше, чем любых других. Пока в России на государственном уровне их значимость и необходимость сохранения просто игнорируется. Для Минприроды России и Рослесхоза малонарушенные леса — это просто пока еще не освоенные леса, в которых нужно всячески стимулировать лесозаготовки. При этом ведомствами не признается, что сохранение еще не освоенных лесов позволяет предотвратить утрату важнейших природных ценностей.
В глобальной борьбе за климат, которую разнообразными методами ведут самые разные люди от школьницы Греты Тунберг до голливудской звезды Леонардо Ди Каприо, главным трофеем выступает сохраненный, не выброшенный в атмосферу углерод. Леса, особенно «дикие», не нарушенные промышленным освоением, как раз и являются для него одновременно «ловушкой» и «хранилищем». Сокращение таких лесов повышает выделение в атмосферу дополнительных объемов углерода в среднем на 25%.
Кроме того, по среднемировым значениям на участках, расположенных ближе 500 м от края леса, запас накопленного биомассой углерода в среднем на четверть меньше, чем на участках, расположенных дальше от края. При этом 70 % площади лесов мира уже располагается ближе 1 км от границы.
Малонарушенные леса напрямую влияют на образование облаков и объем выпадающих осадков: из воздуха, проходящего через них, выпадает как минимум в 2 раза больше осадков, которые переносятся облаками на дальние расстояния. При этом такие леса эффективно снижают последствия ливней: благодаря своей очень сложной структуре они переводят поверхностный сток в почвенный, что предотвращает наводнения. Деградация таких лесов, а тем паче их утрата может привести к увеличению числа засушливых и жарких дней, снижению интенсивности дождей и засушливым периодам.
Эти леса имеют особую значимость для сохранения биологического разнообразия. При этом рубки негативно влияют на численность многих видов животных, особенно тех, которым требуются большие территории для поддержания жизнеспособности популяций (например, хищников). Другая важная проблема — из-за строительства новых дорог к участкам лесозаготовки и других линейных объектов упрощается доступ в лес охотников и браконьеров. Например, линии ЛЭП и газопроводов не только несут свет и тепло в весьма отдаленные районы, но открывают огромные нетронутые пространства тайги для охоты со снегоходов.
Поэтому для сохранения биоразнообразия просто необходимо снижать темпы захвата лесных площадей под хозяйственную деятельность. Как показывает опыт, за первоначальным проникновением в лес следует стремительная деградация девственных лесов. Она происходит не только за счет утраты мест обитания животных и растений, но и других сопутствующих факторов — пожаров, охоты и браконьерства, выборочных рубок и экспансии чужеродных видов.
Пока в России малонарушенные лесные территории (МЛТ) не считаются стратегически ценными лесами. Несмотря на членство России в Международном союзе охраны природы, ратификацию Конвенции по биоразнообразию и добровольное участие в достижений Целей устойчивого развития ООН, понятие МЛТ не закреплено в российском законодательстве, и эти территории не относят к экологически ценным ландшафтам. Некоторые лесопромышленные компании и чиновники считают понятие МЛТ только тормозом для развития лесопромышленного комплекса — в их логике «дикие», ранее не освоенные леса необходимо срочно вырубать, пока лес там «не сгнил и не пропал». Любые действия в отношении сохранения таких территорий воспринимаются как международный заговор. Логика такая: если требования схемы FSC, например, мешают вырубать последние малонарушенные территории, то давайте создадим какую-нибудь свою, «карманную», лояльную схему лесной сертификации.
В нашей стране пока еще существуют обширные лесные территории, на которых нет признаков крупномасштабной хозяйственной деятельности и ее негативных последствий. Уничтожая без оглядки и без подготовки альтернатив малонарушенные лесные территории, россияне в прямом смысле рубят сук, на котором сидят. Как ни парадоксально, самое дикое, что делает сейчас человек — это уничтожение последних островков дикой природы. Надеюсь, что в ближайшее время мы сможем заняться лечением и этой болезни, иначе это для нас не пройдет без самых печальных последствий.
Малярия (малярия) считается одним из самых опасных заболеваний, передающихся паразитами человеку. Это заболевание вызывают паразиты Plasmodium . Паразиты передаются человеку через укусы инфицированных самок комаров Anopheles , известных как «переносчики малярии» . Существует 5 видов паразитов, вызывающих малярию у человека, 2 из которых относятся к P.falciparum и P. vivax - представляют наибольшую угрозу.
Также читайте: Новорожденный заражен вирусом, переносимым комарами
Согласно отчету ВОЗ (Всемирной организации здравоохранения) о малярии, в 2019 году во всем мире было зарегистрировано 229 миллионов случаев заболевания малярией. Из-за этого заболевания умерло 409 тысяч человек. люди. В 2018 году это было 228 миллионов и 405 тысяч соответственно., а в 2017 году — 231 млн и 416 тыс.
Данные за 2020 год указывают на 384 тыс. человек. жертв в Африке. На африканский регион по-прежнему приходится непропорционально большая доля глобального бремени малярии. В Африке 94% все болезни и смерти.
В 2019 г. на инфекции в следующих странах приходилось более половины всех случаев малярии в мире:
Дети в возрасте до 5 лет являются группой, наиболее подверженной малярии: в 2019 году на их долю приходилось 67%. (274 000) всех смертей от малярии в мире.
Малярия вызывается паразитами рода Plasmodium .Промежуточным хозяином для них являются комары, преимущественно мотыльки, поэтому большинство случаев малярии регистрируется в широтах, где встречается этот вид насекомых. Человек заражается как раз от промежуточного хозяина – укуса комара, который ранее выпил кровь зараженного человека. Именно в теле комара происходит дифференцировка и оплодотворение паразитов, которые попадают в кровь человека со слюной мотыльков.
Самые опасные виды паразитов для человека:
Однако наиболее распространенными паразитами, поражающими человека, являются серповидная чума (наиболее опасная) и подвижная чума.
В большинстве случаев малярия передается через укусы самок комаров Anopheles . Их семейство насчитывает около 400 различных видов, 30 из которых являются переносчиками малярии. Обычно все эти комары кусают между закатом и рассветом. Интенсивность передачи зависит от факторов, связанных с паразитом, переносчиком, человеком-хозяином и окружающей средой.
Комары Anopheles откладывают яйца в воду, затем вылупляются личинки, которые в конечном итоге становятся взрослыми комарами. Каждый вид комаров Anopheles имеет свою предпочтительную водную среду, например, некоторые предпочитают небольшие неглубокие пруды с пресной водой, такие как лужи и следы копыт, которых много в сезон дождей в тропических странах.
Передача комаров более интенсивна в местах, где продолжительность их жизни достаточно велика и где есть большие скопления людей. Передача также зависит от климатических условий, температуры и влажности окружающей среды.
Во многих местах вещание носит сезонный характер, достигая пика во время и вскоре после сезона дождей.Вспышки малярии могут возникать, когда климат и другие условия внезапно благоприятствуют передаче инфекции в районы, где у людей практически нет иммунитета к этой болезни.
Иммунитет человека является еще одним важным фактором, особенно среди взрослых в районах с умеренными и интенсивными условиями передачи. Частичный иммунитет вырабатывается в течение многих лет воздействия, и хотя он никогда не обеспечивает полной защиты, он снижает риск тяжелого заболевания.По этой причине большинство смертей от малярии в Африке приходится на детей младшего возраста.
См. Борьба с малярией в Камбодже.
До появления симптомов малярии (с момента заражения), что позволит диагностировать заболевание, должно пройти много времени, даже несколько десятков дней. Это так называемый инкубационный период малярии, а его продолжительность тесно связана с типом заражающего его паразита. К сожалению, первые симптомы этого заболевания не очень специфичны, поэтому его диагностика представляет проблему.
Симптомы малярии включают:
Со временем начинают проявляться другие симптомы, такие как:
Дополнительные симптомы малярии могут включать одышку, мышечную боль, боль в спине и нарушение сознания. При малярии организм больного постепенно разрушается. Также в зависимости от того, каким типом чумы заразился человек, т. е. в зависимости от продолжительности ее полового развития в клетках печени, селезенки и клеток крови инфицированного человека, приступы озноба и лихорадки возникают, например, каждые 3 или 4 дня.
Читайте: Грязные носки в борьбе с малярией
По данным Всемирной организации (ВОЗ), в 2018 году почти половина населения мира заразилась малярией. Большинство случаев малярии и случаев смерти зарегистрировано в странах Африки к югу от Сахары. Однако регионы Юго-Восточной Азии, Восточного Средиземноморья, западной части Тихого океана и Америки также подвержены риску.
Определенные группы населения подвержены гораздо большему риску заражения малярией. В том числе:
Редакция рекомендует: Как защитить себя от тропических болезней во время путешествия?
У больного с подозрением на малярию врач часто обнаруживает увеличение селезенки и печени. Кроме того, кожа и склеры больного слегка желтоватые, а моча значительно темнее нормы.
Большое значение в диагностике имеет врачебный опрос больного (развернутый), включающий сведения об эндемичных зонах, в которых он пребывал, и микроскопическое исследование крови, взятой из кончика пальца. Выполняется как тонкий мазок (с указанием вида чумы), так и анализ толстой капли крови (может подтвердить инвазию простейших) и окрашиваются, например, по методу Гимзы.
Лабораторные исследования при диагностике малярии выявляют низкую концентрацию лейкоцитов, а также анемию и тромбоцитопению. Уровни трансаминаз (АЛТ, АСТ), билирубина и лактатдегидрогеназы могут быть одновременно повышены. Если у больного дополнительно диагностируется гипогликемия – это симптом с неблагоприятным прогнозом.
Лечение малярии может проводить только врач, ведь принимаемые лекарства небезразличны для организма человека. Основным методом лечения малярии является прием препаратов, действующих против малярийных паразитов. В Польше больные этим заболеванием чаще всего лечатся в специализированных больницах, занимающихся этим типом тропической болезни. В такие центры обычно завозят препараты из-за границы, т.н. целевой импорт.
С другой стороны, в странах, где малярия является распространенной проблемой, существует множество противомалярийных препаратов. В настоящее время его лечат комбинацией многих препаратов, хотя бы один из которых должен быть синтетическим производным артемизинина (вещество, используемое, например, в китайских фитопрепаратах). Этот тип терапии известен как ACT для краткости и является официальным лечением, одобренным во многих тропических странах.
Кроме вышеназванного препарата большое значение имеет и поддерживающее лечение, в ходе которого больному назначают орошающие капельницы и жаропонижающие/противосудорожные средства.
При тяжелом течении заболевания необходимо внутривенное введение противомалярийных препаратов (это всегда нужно делать в больнице!).
Кроме того, в некоторых случаях необходимы переливание продуктов крови, а также диализ и респираторная поддержка с помощью аппарата ИВЛ.
Прием правильного вида лечения в короткие сроки приводит к полному выздоровлению, но только у 20% пациентов. пациенты. При заражении некоторыми видами спор необходимо дополнительно применять препараты, действующие против спящих форм паразитов, способных выжить в организме больного человека. Благодаря этому удается избежать рецидива малярии после лечения.
См.: Лазер обнаруживает малярию через кожу.
Большинство смертей от малярии связано как минимум с одним серьезным осложнением, в том числе:
Прочтите: Малярия изменяет костный мозг
Профилактика мазка состоит из:
Вас может заинтересовать:
Контент из медонета.pl предназначены для улучшения, а не замены контакта между пользователем веб-сайта и его врачом. Сайт предназначен только для информационных и образовательных целей. Прежде чем следовать специальным знаниям, в частности медицинским советам, содержащимся на нашем Веб-сайте, вы должны проконсультироваться с врачом. Администратор не несет никаких последствий, вытекающих из использования информации, содержащейся на Сайте. Нужна консультация врача или электронный рецепт? Зайди к галодоктору.pl, где можно получить онлайн-помощь - быстро, безопасно и не выходя из дома .
Компонент мыла и зубной пасты, триклозан может помочь в борьбе с все более распространенным типом лекарственно-устойчивой малярии, более известной как малярия.Открытия...
ПАП | ПАПЛихорадка Западного Нила была подтверждена у 13 человек из региона Севильи в Испании.Это вирусное заболевание, которое передается комарами.
ПАПКомаржице, которые сейчас нас жалят - из пастбищных видов злаков - вылупились из яиц, отложенных еще несколько лет назад. Из-за недавних проливных дождей - яйца...
ПАПТелемедицина до недавнего времени была лишь новинкой из будущего.Однако становится все более популярной формой контакта с врачом. Специалист во время собеседования ...
Татьяна НаклицкаяСтремительное распространение коронавируса COVID-19 и введение в стране ряда ограничений привели к тому, что медицинским учреждениям также пришлось провести реорганизацию...
Татьяна Наклицкая | Онет.Поездка в Южную Америку связана с риском заразиться различными экзотическими заболеваниями, от которых мы не застрахованы.Эти заболевания могут представлять серьезную угрозу... 900 27 Марта Павляк | Онет.
В США выявлено первое заражение новорожденного вирусом Зика.Малыш родился на Гавайях. Центр контроля заболеваний Атланты призывает беременных женщин ...
ПАП | ПАПОсобыми приметами этого сезона являются разноцветные листья, падающие с деревьев, переменчивая погода, все более короткий световой день и внезапный холод.Утечка...
2019-11-29 12:50

Малярия — самая популярная в мире тропическая болезнь с очень высоким уровнем смертности. Он представляет угрозу не только для жителей мест постоянной покраски, но и для туристов, выезжающих в эти места. Как не пропустить первые симптомы малярии? Как действовать при их появлении? Можно ли защититься от него во время поездки в тропики?
Малярия, в прошлом также известная как малярия или лихорадка, в настоящее время является самой распространенной паразитарной болезнью в мире .Встречается в районах с тропическим и субтропическим климатом. И, к сожалению, для него характерна очень высокая смертность среди заболевших. Ежегодно от малярии умирает от 1 до 3 миллионов человек, большинство из которых дети раннего возраста.
Малярия у человека вызывается одним из пяти видов малярийного паразита: бродячей чумой (Plasmodium vivax), полосатой чумой (Plasmodium malariae), серповидной чумой (Plasmodium falciparum), овальной чумой (Plasmodium ovale) или чума обезьян (Plasmodium knowlesi).Последнее некоторое время считалось, что оно вызывает малярию только у обезьян (макак), но сегодня мы знаем, что оно может вызывать и очень тяжелые формы заболевания у людей. Каждый из этих пяти видов паразитов передается от человека к человеку самкой комара Anopheles. Наиболее частым заболеванием человека является заражение подвижными спорами (Plasmodium vivax) или серповидно-клеточная анемия (Plasmodium falciparum). Наибольшую угрозу представляет серповидная чума (Plasmodium falciparum), поскольку она вызывает наиболее тяжелые формы инфекции, характеризующиеся высокой смертностью как у местного населения, так и у путешественников, приехавших в районы, пораженные малярией.
СМОТРИТЕ ТАКЖЕ: Клещи: как убрать? Чем опасен укус клеща?
Первые симптомы малярии обычно появляются через 10-14 дней после заражения. Начальную фазу заболевания легко спутать с простудой или гриппом. На этой стадии у больного появляются недомогание, слабость, мышечные и головные боли, лихорадка с ознобом и потливостью. Лихорадка может появляться периодически, волнообразно - с интервалом в сутки, каждые два-три дня, а может проявляться нерегулярно.Эти симптомы могут быть связаны с тошнотой, рвотой, диареей и желтухой.
Тяжелые формы болезни могут оказывать негативное влияние на здоровье - приводят к многочисленным поражениям внутренних органов, нарушению обмена веществ, поражению нервной системы, коме, а в наиболее тяжелых случаях и к летальному исходу.

При появлении первых тревожных симптомов у людей, побывавших в малярийных районах, необходимо как можно быстрее отреагировать.О таких лицах следует немедленно сообщить врачу, желательно специалисту в области тропической медицины. На основании симптомов, анамнеза путешествий пациента и микроскопического исследования крови пациент сможет правильно идентифицировать заболевание.
Своевременная диагностика и проведение соответствующего лечения увеличивают шансы на выздоровление и снижают смертность. В случае малярии даже один день промедления с началом необходимого лечения может привести к летальному исходу, поэтому важно как можно раньше распознать заболевание.
СМОТРИТЕ ТАКЖЕ: Болезнь Лайма – опасное заболевание. Как это лечится?
Полное выздоровление больного малярией возможно при своевременном проведении лечения. Его течение зависит от нескольких факторов, в том числе от состояния больного и доступности противомалярийных препаратов в определенных странах. Базисная терапия малярии основана на введении противомалярийных средств – для достижения наилучших результатов ВОЗ рекомендует использовать комбинацию нескольких препаратов с таким эффектом, т.н.ДЕЙСТВОВАТЬ. Нередко тяжелое состояние больных требует подключения капельного орошения или применения жаропонижающих и противосудорожных препаратов.
СМОТРИТЕ ТАКЖЕ: Мононуклеоз – симптомы и лечение
В течение нескольких десятилетий ведутся работы по разработке вакцины против малярии, результатом которых стало производство единственной пока вакцины РТС, S с адъювантом AS01. В 2019 году началась пилотная программа вакцинации 90 010 человек от малярии с использованием этой вакцины , которая продлится до 2022 года.Программа охватила три африканские страны - Гану, Малави и Кению.
В настоящее время наиболее важными элементами профилактики малярии по-прежнему считаются предотвращение укусов комаров путем надлежащей защиты спального места , например, использование пропитанных инсектицидами противомоскитных сеток, использование защитной одежды, репеллентов и проведение химиопрофилактики малярии. Он основан на профилактическом использовании пероральных противомалярийных препаратов пациентами, направляющимися в районы, где встречается это заболевание.Лекарства принимаются в дозах меньших, чем те, которые уже применялись во время самого лечения. В случае укуса инфицированным комаром препараты защищают человека от размножения и развития паразита в его организме.
Если вы собираетесь в ближайшее время отправиться в экзотические страны, поговорите об этом со своим лечащим врачом перед отъездом. Специалист посоветует, как подготовиться к этой поездке с точки зрения здоровья. Запишитесь на прием уже сегодня через сервис ЛекарзеБезКолейки.пл.
Поэтому уже на этапе планирования поездки в малярийные районы стоит обратиться к туристическому и тропическому врачу за соответствующими препаратами для химиопрофилактики. Кроме того, врач может выписать лекарства для самолечения в случае заболевания во время путешествия – особенно если оно происходит в местах, где трудно получить профессиональную медицинскую помощь. Следуйте всем инструкциям врача и информации, предоставленной производителем препарата.Для того чтобы такая химиопрофилактика была эффективной, ее следует начинать перед поездкой, применять на протяжении всего пребывания и продолжать достаточно длительное время после выезда из районов присутствия малярии.
СМОТРИТЕ ТАКЖЕ: Стрептококк – как им можно заразиться и как лечить?
Весь контент на Сайте, включая статьи на медицинские темы, предназначен только для информационных целей. Мы прилагаем все усилия, чтобы информация, содержащаяся в ней, была точной, правдивой и полной, однако мы не несем ответственности за результаты предпринятых на ее основании действий, в частности, эта информация ни в коем случае не может заменить визит к врачу .
.Одним из забытых инфекционных заболеваний, которое, к сожалению, начинает появляться, является болезнь Гейне-Медина, или острый распространенный детский паралич, или вирусное воспаление передних рогов спинного мозга.Это вирусное заболевание, вызываемое вирусом полиомиелита.
Как вирус полиомиелита или вирус переднего орнита попадает в организм?
Вирус полиомиелита попадает в организм фекально-оральным путем, а это значит, что вирус легко подхватить просто от грязных рук, которыми вы прикасаетесь ко рту. После проникновения в пищеварительную систему вирус проникает в эпителий кишечника, где начинает размножаться, продолжаясь обычно от 9 до 12 дней.Затем вирус попадает в кровоток и окружающие лимфатические узлы, что называется первичной виремией. Тогда организм может вырабатывать антитела против вируса, благодаря которым инфекция может быть подавлена (это выкидыш). Однако может случиться так, что выработка антител против вируса не состоится - тогда возникает вторичная виремия и вирусы начинают атаковать весь организм, в основном "находясь" в клетках центральной нервной системы (преимущественно передние рога спинной мозг и мост).
Как протекает болезнь Гейне-Медина?
Бывает, что течение заболевания полностью бессимптомное или имеет место заражение беременных с неспецифической симптоматикой. Существует также асептический менингит, который обычно проходит сам по себе и не вызывает осложнений. Однако может присутствовать и паралитическая форма, которую в свою очередь можно разделить на спинальную форму (поражаются в основном проксимальные группы мышц и нижних конечностей) и бульбарную (последняя представляет непосредственную угрозу жизни из-за вовлечения органов дыхания). центр и центр кровообращения в мозговом веществе).Вирус полиомиелита также может вызывать энцефалит, который обычно приводит к летальному исходу. У некоторых пациентов через много лет после болезни может развиться постпаралитический синдром.
Можно ли предотвратить начало болезни?
Да. Предотвратить вспышку заболевания можно, проводя прививки, которые входят в обязательный календарь прививок.
Еще одна болезнь, о которой все чаще говорят в связи с многочисленными путешествиями, — малярия.Кроме того, малярия поражает очень большое количество людей, живущих в Африке, — там это самое распространенное заразное заболевание.
Малярия — тропическая паразитарная болезнь, которая может быть острой или хронической. Его вызывают простейшие, принадлежащие к роду Plasmodium. У людей наиболее распространенными инфекциями являются подвижные споры (Plasmodium vivax) и серповидные споры (Plasmodium falciparum).
Переносчиком болезни является мотыльковый комар, который, кусая человека, «впрыскивает» в кровь простейших, ответственных за развитие болезни.
Каковы симптомы малярии?
Прежде всего нехарактерен первый симптом: лихорадка, иногда превышающая 40 градусов Цельсия, обычно с сильным ознобом. Очень часто другими симптомами, сопровождающими лихорадку, являются головная боль, тошнота, рвота, а в завершающей стадии приступа появляются обильное потоотделение и снижение лихорадки. Приступы лихорадки происходят каждые 72 часа (известная как третичная малярия) или каждые 96 часов (известная как малярия по четвергам). Другие симптомы, типичные для малярии, включают мышечные боли, кашель, одышку, нарушение сознания и неврологические симптомы.Как лечат малярию?
Для лечения малярии используются специальные противомалярийные препараты, в том числе хлорохин, хинин, мефлохин и комбинированные препараты (пириметамин с сульфадоксином и атактон с прованилом).
Что такое профилактика малярии?
Отправляясь в районы, эндемичные по малярии, следует помнить о репеллентах, т.е. жидкостях, отпугивающих комаров, и о сне под москитными сетками.Также важно использовать профилактические противомалярийные препараты перед поездкой и во время пребывания в эндемичных районах. Противомалярийную профилактику следует применять, прежде всего, при поездках в страны Африки южнее Сахары и на некоторые острова Тихого океана. Есть также районы, где малярия встречается в Азии, Южной и Центральной Америке. Поэтому перед поездкой в экзотические страны лучше всего обратиться в институт тропической медицины и медицины путешествий, где предоставят подробную информацию о безопасности и необходимости профилактики в отдельных странах.Еще одно инфекционное заболевание, о котором известно в последние годы (случаи этого заболевания зарегистрированы в Африке, Азии и Южной Америке), — чума.
Чума — острая инфекционная бактериальная болезнь грызунов и других мелких млекопитающих (хотя и значительно реже) и человека. Его вызывает бактерия под названием Yersinia pestis.
Как заразиться чумой?
Человек заражается чумой от блох, переносящих чумные палочки от зараженных грызунов (обычно крыс).Другой путь заражения – воздушно-капельный. Инкубационный период заболевания обычно составляет от двух до десяти дней.
Различают три типа чумы: бубонная форма, легочная форма и сепсисная форма. При бубонной форме отмечается высокая температура, озноб, увеличиваются подмышечные и паховые лимфатические узлы - они становятся очень болезненными, через несколько дней размягчаются и самопроизвольно прорываются. Кроме того, на коже присутствуют экхимозы, появляются неврологические симптомы и симптомы недостаточности кровообращения.При легочной форме вначале присутствует только сухой изнуряющий кашель, затем кашель становится влажным, появляется кровохарканье. Быстро развивается дыхательная и недостаточность кровообращения, что в свою очередь может привести к летальному исходу. При сепсисной форме течение электризуется с выраженными симптомами отравления и, к сожалению, быстро заканчивается летальным исходом.
Можно ли вылечить чуму?
Да. Для лечения чумы используются внутривенные антибиотики.Правильно и своевременно начатая антибактериальная терапия значительно снижает смертность от заболевания.
Есть ли профилактика чумы?
Да. Профилактика заключается в том, чтобы избегать контакта с дикими и мертвыми животными и ситуаций (преимущественно в эндемичных районах), при которых грызуны могут быть укушены (поэтому животных нельзя кормить). Также следует использовать средства от блох для домашних животных. Кроме того, люди, направляющиеся в районы, эндемичные по чуме, должны быть вакцинированы.
.Хотя, казалось бы, осведомленность о тропических болезнях уже высока, Национальный институт гигиены сообщает, что заболеваемость этим типом болезни в Польше продолжает расти. До 30-40% лихорадок, возникающих у больных после возвращения из отпуска, могут быть инфекционными и быть вызваны, например, малярией, лихорадкой денге или брюшным тифом. Узнайте, как проявляются самые распространенные тропические болезни и как их диагностировать.
Тропические болезни представляют собой группу болезней, встречающихся только в странах с тропическим климатом (или субтропиках, например, в Южной Африке, Марокко, Египте). Хотя большинство из них имеют там свой источник, они могут распространяться и в другие климатические зоны. Причины тропических болезней в этих регионах тесно связаны с экономическими условиями, плохой гигиеной и медицинским обслуживанием, наличием переносчиков, таких как комары, и даже способом приготовления некоторых продуктов.К тому же жаркий климат сам по себе благоприятствует развитию вирусов. Заражение происходит напрямую или через контакт с переносчиком, но сами заболевания обычно вызываются вирусами, бактериями, грибками или паразитами.
Список тропических болезней очень длинный и виды болезней различаются в зависимости от региона их возникновения. Вот почему так важно проверить, рекомендованы ли прививки в стране, в которую вы собираетесь ехать.
Это острое паразитарное заболевание, передающееся комарами . Особенно легко заразиться малярией в Центральной Африке, а также в Индонезии, Папуа-Новой Гвинее, Южной Азии и северной части Латинской Америки. Его основными симптомами являются приступы лихорадки, мышечные боли, тошнота, рвота и озноб. Малярию легко спутать с гриппом , но если вы испытываете симптомы вскоре после возвращения из отпуска, стоит пройти обследование.
Кровь можно проверить на малярию двумя способами . Качественно, что означает быстрый и предварительный анализ крови на паразитов и микроскопическое исследование. Это анализ цельной крови, который ищет наличие форм малярии в эритроцитах.
Вирус Зика, как и малярия, передается комарами . Самый большой его «ареал обитания» — Южная Америка (особенно ее северо-восточная часть), но распространен вирус также в Центральной Африке, Индии и Индонезии.Наиболее характерным симптомом инфекции Зика является небольшая красная сыпь и высокая температура. Кроме них, бывают мышечные боли, головные боли, светобоязнь и конъюнктивит.
Обнаружение вируса в сыворотке крови возможно примерно до 3 дней с момента появления симптомов инфекции или до 10 дней с потенциального момента заражения. Тест проверяет уровень иммуноглобулина IgM и иммуноглобулина G (IgG) с помощью теста ELISA.
По оценкам, в зоне лейшманиоза проживает 350 миллионов человек.В самой Европе это заболевание встречается практически по всему Средиземноморью и передается мухами, обитающими только в районах, где температура не опускается ниже 16 градусов по Цельсию. Лейшманиоз может принимать три формы: кожную (белая проказа), висцеральную (черная лихорадка) и слизисто-кожную, каждая из которых отличается. Все они, однако, отличаются болезненными волдырями и изъязвлениями в месте вынашивания.
Идентификация антител, специфичных к антигенам Leishmania spp.Метод ИФА является одним из методов диагностики всех видов лейшманиоза. Положительные и неопределенные результаты теста проверяются методом вестерн-блоттинга. Он позволяет определить специфичность антител по отношению к ряду белковых компонентов, характерных для антигена.
В основном встречается в Америке и передается грызунами . Он характеризуется быстро прогрессирующей дыхательной недостаточностью, для лечения которой требуется искусственная вентиляция легких и интубация. Даже в случаях интенсивного лечения летальность составляет 40%-60% и задержка в постановке диагноза значительно увеличивает ее.
Для выявления наличия хантавируса используются тесты IgM и IgG. ИФА. Оба антитела появляются через 10-14 дней после стихания острых симптомов заболевания. В тесте используется смесь антигенов серотипа ханта: вирус Хантаан, вирус Пуумала и вирус Добрава. Положительный результат теста свидетельствует об инфицировании одним из этих серотипов.
Тропическая болезнь, вызываемая однокамерным и многокамерным цепнем . В основном встречается в Мексике, Средиземноморье, на Ближнем и Дальнем Востоке, в Китае и Океании. Первые симптомы эхинококкоза легко могут остаться незамеченными. Признаком того, что мы имеем дело с заболеванием, являются боли в животе, возникающие только тогда, когда кисты становятся большими, даже до 30 см.
Тест заключается в определении уровня антител IgG, специфичных к антигенам Echinococcus granulosus, в сыворотке крови методом ИФА.У некоторых больных: 10% с кистами в печени и 40% с кистами в легких, а также у детей в возрасте 3-15 лет и больных с кистами в головном мозге и глазах уровень антител может быть неопределяемым или очень низким. Для повышения диагностической специфичности серологического теста положительный результат подтверждают методом вестерн-блоттинга.
Хотя это заболевание известно человечеству со второго века нашей эры, до сих пор не разработана эффективная вакцина или профилактика этого заболевания. Денге передается комарами Aedes, которые могут жалить своих жертв в любое время суток и года . Болезнь встречается более чем в 100 странах тропиков и в настоящее время является самой распространенной вирусной инфекцией, передаваемой насекомыми в мире. Наиболее уязвимы к болезни Денге дети, у которых еще не выработался полный иммунитет. Проявляется прежде всего высокой температурой, кореподобной сыпью, болями в мышцах и суставах. В крайних случаях это может даже привести к шоку и кровотечению.
Тесты заключаются в выявлении антител IgG и IgM, специфичных к вирусу денге, в крови пациента.Тест лучше всего проводить примерно на 3-4-й день болезни, так как именно тогда сероконверсия становится очевидной. Тем не менее, он будет сопровождать пациента до фазы заживления.
Вы можете заказать все перечисленные выше домашние анализы крови через наш веб-сайт. Все, что вам нужно сделать, это указать адрес, куда должен приехать наш специалист, выбрать подходящее время и дату, а все остальное мы сделаем за вас. Результаты теста будут доступны в режиме онлайн, а в случае сомнений проконсультируйтесь с нашим специалистом онлайн..
Используются различные классы противомалярийных препаратов. Согласно рекомендациям ВОЗ, лечение малярии должно включать комбинированную терапию, одним из компонентов которой является производное артемизинина. Комбинированная терапия предназначена для защиты от быстро растущей резистентности малярийных паразитов к производным артемизинина.
Мир: Малярия встречается в тропической и субтропической Азии, Африке, Южной и Центральной Америке и на островах юго-западной части Тихого океана, в основном в Африке к югу от Сахары.В 2017 году во всем мире было зарегистрировано 219 миллионов случаев, число летальных исходов составило 435 тысяч, в предыдущие годы количество случаев в течение года было аналогично 2017 году.
Европа: В настоящее время в европейских странах в основном регистрируются случаи завоза малярии из эндемичных районов. Иногда бывают случаи местной малярии в зоне, свободной от малярии (завезенная малярия, ятрогенная малярия или малярия багажа/аэропорта).
С 2009 года аборигенная малярия регистрируется в Греции и выделяется в Испании, Италии и Франции.
Польша: малярия была эндемичной в Польше с периодическими эпидемиями до середины 20-го века, в 1946-49 годах была последняя эпидемия малярии - число зарегистрированных случаев в 1948 году составило 9941 случай, а данные Отделение медицинской паразитологии Национального института гигиены за тот же год указывает на еще большее число случаев (свыше 13000).В конце 1950-х годов в результате противомалярийных мероприятий передача инфекции была полностью прекращена, а местная малярия в Польше ликвидирована. Официально в 1967 году Польша была сертифицирована ВОЗ как страна, свободная от малярии. С начала 1960-х годов в Польше регистрировались только случаи завозной малярии у людей, прибывших из районов, эндемичных по малярии.
Надзор за малярией ведется с самого начала, самые старые из сохранившихся данных относятся к 1919 году.Наибольшее количество случаев с начала регистрации было зафиксировано в 1921 г. - 52 965 случаев. После ликвидации аборигенной малярии число ежегодно регистрируемых завозных случаев не превышало 38,
.С 2005 г., после вступления Польши в ЕС, в эпиднадзоре за малярией действует определение случая. В 2009 году определение было расширено в соответствии с изменениями в европейском законодательстве и с тех пор остается неизменным.
Индивидуальные данные о заболеваемости: с 1990 года Санитарная инспекция собрала 90 010 индивидуальных данных о зарегистрированных для эпиднадзора случаях малярии., с 2018 года полные данные по отдельным случаям регистрируются в национальной электронной системе регистрации эпидемиологических опросов (СРЭО).
.Более 300 миллионов человек ежегодно заболевают малярией, многие из которых являются туристами, возвращающимися из Африки, Южной Америки и некоторых островов Океании. Малярия входит в тройку наиболее распространенных инфекционных заболеваний в мире, помимо СПИДа и туберкулеза. По оценкам, в настоящее время 45 процентов. человек в более чем ста странах мира живут в районах, подверженных риску малярии.Число новых случаев заболевания оценивается в 300-500 миллионов ежегодно, а количество смертей - в 1,5-2,7 миллиона ежегодно.
спорозоит
Спорозоиты, мигрирующие в цитоплазме кишечного эпителия.
посмотреть галереюСуществует пять видов, опасных для человека, т.е.:
Наиболее часто заражение происходит при подвижной споровой и серповидноклеточной анемии, вызывающей наиболее опасное и тяжелое состояние больного малярией.
Маленькие дети в возрасте до 5 лет, беременные женщины и лица с иммунодефицитом подвергаются наибольшему риску тяжелой малярии и опасных для жизни осложнений. Граждане Европы чаще всего заражаются при поездках в Кению, Конго, Танзанию, Мадагаскар, Мозамбик, Нигерию, Колумбию и Таиланд.
Статистические данные показывают, что более двух миллионов человек ежегодно умирают от малярии и ее осложнений. Заражение происходит через укус самки комара, питающейся человеческой кровью.Затем в организм человека вместе со слюной насекомого внедряются зародыши, которые затем размножаются в клетках печени. Зрелые простейшие атакуют в первую очередь эритроциты, что обусловливает большинство симптомов заболевания, но патологические изменения возникают и в других органах. Следует помнить, что достаточно всего одного укуса, чтобы заболеть, а комары чаще всего нападают перед закатом и восходом солнца! Иммунизация к малярии сохраняется после перенесенного заболевания, но не является постоянной, и возможно повторное заражение, но не в остром течении.
В Польше ежегодно регистрируется 50 случаев «завозной» малярии, в том числе часто тяжелых клинических форм, вызванных серповидно-клеточной анемией. Более того, довольно значительное число поляков лечится за границей, в малярийных районах или на обратном пути на родину. Вызывает тревогу высокий уровень смертности от тяжелой или невыявленной малярии. Хотя он составляет не более трех случаев в год, по сравнению с количеством заболевших он в 16 раз выше, чем в других странах Европы.
От момента заражения до появления типичных для заболевания симптомов, позволяющих диагностировать малярию, обычно должно пройти несколько, несколько или несколько десятков дней (от 8 до 40). Это время называется сезоном распространения малярии, и продолжительность этого времени зависит от типа чумы, поражающей его. Первые симптомы малярии неспецифичны и поэтому представляют серьезную диагностическую проблему. Высокая температура, превышающая 40 градусов Цельсия, в сочетании с ознобом, тошнотой, рвотой, головными болями всегда требует консультации врача.Завершающей стадией такого приступа является обильное потоотделение, резко падает температура тела.
спорозоит
Видимый отек лица из-за малярии.
посмотреть галереюВ зависимости от вида спор мы наблюдаем появление лихорадки каждые три-четыре дня (так называемые третьи и четвертые).Следует помнить, что течение малярии не всегда протекает по такой схеме, а это, в свою очередь, затрудняет диагностику. Всегда следует подробно описывать врачу свои симптомы и информировать его о недавних поездках за границу, поскольку информация, полученная от больного, является первоисточником для постановки диагноза и значительно сокращает время, необходимое для его постановки. Иногда дополнительными симптомами малярии могут быть: боль в мышцах, одышка, нарушение сознания, неврологическая симптоматика и боль в спине, что дополнительно вызывает много диагностических трудностей.
Невылеченная малярия может привести ко многим осложнениям. Повышенная деградация эритроцитов вызывает тяжелую анемию, что в свою очередь влечет за собой хроническую тканевую гипоксию, так как эритроциты являются основными переносчиками кислорода в организме человека. Место распада этих кровяных телец — селезенка — увеличивается в размерах, иногда настолько, что может разорваться. Больной малярией может впасть в кому, у него может развиться острая почечная недостаточность.Распространение паразита с током крови может привести к шоку, опасному для жизни. К поздним осложнениям малярии относятся: нефротический синдром, синдром гиперактивной малярии, гиперспленизм (так называемый синдром тропической спленомегалии) и фиброз внутреннего слоя сердечной мышцы (эндокарда).
Малярия, несомненно, опасное заболевание, которое необходимо каждый раз лечить. Как мы можем это сделать тогда? И что мы можем сделать, чтобы избежать малярии? Подчеркнем еще раз, что при планировании поездки в районы, где встречается малярия, мы должны обязательно посетить врача, который поможет нам выбрать правильный вид профилактики .Наиболее распространенным препаратом, используемым для предотвращения инфекции, является комбинированный препарат, представляющий собой комбинацию двух фармацевтических препаратов: атоваквона и прованила. С другой стороны, при диагностировании малярии необходимо лечение, которое в большей или меньшей степени удалит споры из организма. Для этой цели обычно используются следующие препараты: хлорохин, хинин, примахин, доксициклин и многие другие.
Чтобы предотвратить распространение малярии в районах, где она встречается, ликвидируйте места размножения комаров.Дополнительно дома опыляют инсектицидами и используют москитные сетки. Индивидуальная профилактика малярии заключается в недопущении контакта с комарами и назначении противомалярийных препаратов . Наиболее часто используемым лекарством от малярии является хлорохин. Однако он становится все менее и менее эффективным из-за распространения резистентности паразитов.
Из примерно 250 000 польских граждан, ежегодно приезжающих в малярийные зоны в туристических или деловых целях, значительная часть не знает о рисках для здоровья в стране назначения.Также не были проведены необходимые профилактические прививки и надлежащая химиопрофилактика малярии. Надлежащим, т. е. в правильной дозе и с применением препаратов, к которым возбудители малярии чувствительны в данной зоне и стране. Каждый из путешественников в т.н. тропические страны должны пройти медицинские осмотры перед отъездом и получить соответствующие профилактические меры в одной из клиник тропических болезней.
При профилактике малярии важно избегать контакта с комарами Anopheles в основном от заката до рассвета, в некоторых районах круглый год, а в некоторых районах только в сезон дождей или вскоре после него.Контакт с комарами затрудняется ношением соответствующей одежды в вечерние часы (длинные рукава и брюки, толстые носки) и нанесением репеллентов от комаров на открытые части тела, особенно на шею, руки и ноги. Квартиру следует обезопасить, поставив сетки на окна и входные двери, используя инсектициды (опилки, различные виды спреев, электрофумигаторы), кондиционирование воздуха и сон под москитными сетками, главное, чтобы комнаты не были свободны от комаров. Интенсивная работа во всем мире над противомалярийной вакциной далека от успеха.
Не ждите приема у врача. Воспользуйтесь консультациями со специалистами со всей Польши сегодня на abcZdrowie Найдите врача.
.Высокая температура, озноб и потливость являются первыми симптомами малярии (малярии), тропического паразитарного заболевания, вызываемого инфекционной малярией и передаваемого мотыльковым комаром ( Anopheles maculipennis ). Планируя поездку в тропические и субтропические регионы, помните о риске развития малярии, проконсультируйтесь с врачом о возможности приема противомалярийных препаратов, а при появлении симптомов заболевания своевременно лечите его.
Малярия — современное название тропической болезни, вызываемой простейшими — возбудителями малярии. Раньше его называли лихорадкой, имея в виду один из наиболее распространенных симптомов инфекции, то есть лихорадку с ознобом. Малярия диагностируется в основном в тропических и субтропических странах и у возвращающихся туристов, т.е. из таких стран и регионов, как Карибский бассейн, Мексика, Центральная Америка, Индийский субконтинент, страны Африки к югу от Сахары, Океания, Юго-Восточная Азия, Вьетнам, Камбоджа и Таиланд.В тропических странах благоприятные условия для развития бабочек – температура воздуха колеблется в пределах 16-33°С, а влажность воздуха выше 60%.
В Польше ежегодно лечат от малярии несколько десятков человек, обычно это туристы, возвращающиеся из регионов с высоким риском малярии. Из-за редкого возникновения малярии в Польше заболевание не всегда быстро диагностируется и правильно лечится, а случаи малярии у соотечественников чаще, чем в Западной Европе, заканчиваются летальным исходом.
>> Препараты от насекомых, аэрозоли, пластыри, пластыри и гели
малярия у людей обусловлено пятими видами Parasite плазмодиума :
Наиболее распространенными инфекциями являются подвижная спора (около 80% случаев малярии) и серповидная спора. Серповидноклеточная анемия вызывает наиболее тяжелую форму заболевания и чаще всего приводит к летальному исходу (хотя на ее долю приходится около 15% инфекций, на ее долю приходится около 90% летальных исходов у больных малярией).
Цикл развития малярийного паразита требует двух хозяев:
их кровь.Они перемещаются в клетки печени (гепатоциты), где трансформируются и размножаются в течение 1-3 недель (кровяные паразиты отсутствуют). На этой стадии больной еще не ощущает никаких симптомов заболевания. На следующем этапе паразит снова попадает в кровь, где атакует эритроциты (эритроциты). В этот момент появляются симптомы заболевания, в первую очередь высокая температура. Еще один укус самки комара сделает ее инфицированной и сможет передать болезнь дальше.
Первые симптомы малярии не очень специфичны, их легко спутать с гриппом или другими вирусными инфекциями.
Первые симптомы малярии:
В зависимости от того, с каким типом спор мы имеем дело, лихорадочные приступы возникают с разной частотой. Например, при подвижной или овальной малярии лихорадка возникает каждые 48 часов; для полосатой паразитарной малярии каждые 72 часа.
>> Противолихорадочные препараты, суппозитории, таблетки, сиропы
Со временем появляется больше симптомов, в том числе на разрушение эритроцитов:
Малярию можно заподозрить у людей с такими симптомами, побывавших в тропических странах.Важно отметить, что малярия может развиться только спустя длительное время после путешествия, поскольку некоторые виды простейших могут сохраняться в организме в латентной форме в течение нескольких месяцев, вплоть до 2 лет. Однако чаще всего симптомы малярии появляются через 10-14 дней после заражения.
У подавляющего большинства инфицированных малярийным паразитом симптомы проявляются в течение одного месяца после путешествия. Малярия редко проявляется спустя месяцы или годы после поездки в тропики.Тем не менее, всегда стоит информировать своего врача о более ранних, даже отдаленных посещениях районов, подверженных риску малярии.
Диагноз можно поставить только по симптомам, но обычно он подтверждается анализом крови. Мазки периферической крови чаще всего берут для проверки наличия простейших внутри эритроцитов.
У пациентов, инфицированных паразитом, также часто диагностируют:
Малярия проявляется также увеличением печени и селезенки, желтым оттенком кожи и белков глаз, а также темным цветом мочи.
Лечение малярии проводится в инфекционных отделениях тропических больниц и в основном заключается в приеме препаратов, активных в отношении малярийных паразитов. По рекомендации Всемирной организации здравоохранения в настоящее время в терапии используется комбинация нескольких препаратов
.Поддерживающая терапия состоит из капельниц для увлажнения организма, жаропонижающих и противосудорожных средств.В тяжелых случаях пациентам требуется респираторная поддержка и диализ.
Профилактика малярии при поездках в эндемичные районы включает:
Противомалярийный препарат, который используется как для лечения, так и для профилактики малярии — маларон. Защищает от опаснейшей серповидной чумы. Лечение следует начинать за 24-48 часов до прибытия в район малярии, а затем продолжать в течение всего пребывания и еще в течение семи дней после выезда из эндемического района.
