2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Это один из показателей инфицирования человека аскаридами (гельминтами, червями), вызывающими заболевание аскаридоз.
Синонимы русские
Антитела класса IgG к антигенам аскарид, специфические антитела класса IgG к аскаридозу, серологический маркер аскаридоза.
Синонимы английские
Antiascaris lumbricoides, IgG, ascaris specific antibodies, IgG.
Метод исследования
Иммуноферментный анализ (ИФА).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
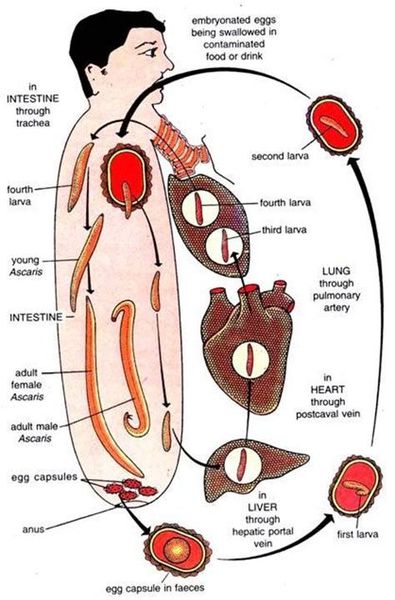
По различным данным, аскаридозом заражено около 1,27 млрд человек, или примерно ¼ населения, во всем мире. Возбудитель заболевания – аскарида человеческая (Ascaris lumbricoides), относящаяся к классу круглых червей. Заражение происходит при употреблении пищи (плохо помытых овощей, чаще корнеплодов), инфицированной яйцами аскарид, а также через грязные руки. Яйца аскарид попадают в тонкий кишечник, где из них выходят личинки. Те, в свою очередь, проникают через стенку кишки в кровоток и разносятся по всему организму, попадая в печень, сердце и легкие, где через стенки легочных капилляров проникают в альвеолы. Из дыхательных путей личинки мигрируют в полость рта и опять заглатываются. Личинка, вновь попавшая в кишечник, через 2,5-3 мес. развивается во взрослую особь. Взрослые аскариды обитают в тонкой кишке, где самки после оплодотворения откладывают около 200 000 яиц в сутки. Во внешнюю среду выделяются незрелые яйца гельминта, и созревание происходит лишь при благоприятной для их развития температуре и влажности. Общая продолжительность жизни аскариды – от 6 до 16 мес., поэтому наличие у одного человека аскарид в течение нескольких лет объясняется только повторным заражением.
Личинки, пребывая во внутренних органах, питаются сывороткой крови и эритроцитами. Осложнения аскаридоза: кишечная непроходимость, панкреатит, аппендицит, холангит, вызванные миграцией аскарид в другие органы (поджелудочную железу, желчный пузырь, толстый кишечник), где создаются условия для присоединения бактериальной инфекции.
Осложнения аскаридоза: кишечная непроходимость, панкреатит, аппендицит, холангит, вызванные миграцией аскарид в другие органы (поджелудочную железу, желчный пузырь, толстый кишечник), где создаются условия для присоединения бактериальной инфекции.
В выявлении аскаридоза важную роль играет лабораторная диагностика, и в частности иммунологический метод – определение специфических антител к аскаридам. Его можно применять как в миграционную, так и в кишечную стадию заболевания.
Кроме того, в кишечную стадию Ascaris lumbricoides, IgG, можно диагностировать с помощью анализа кала на яйца аскарид. Однако в некоторых случаях необходимо проводить данное исследование неоднократно, так как яйца аскариды выделяются не постоянно. Для разных сроков заболевания характерна эозинофилия периферической крови, СОЭ обычно тоже повышено. Количество лейкоцитов, как правило, нормальное, и лишь в случае присоединения бактериальной инфекции наблюдается лейкоцитоз.
Для чего используется исследование?
Иммунная система человека реагирует на аскарид производством специфических антител.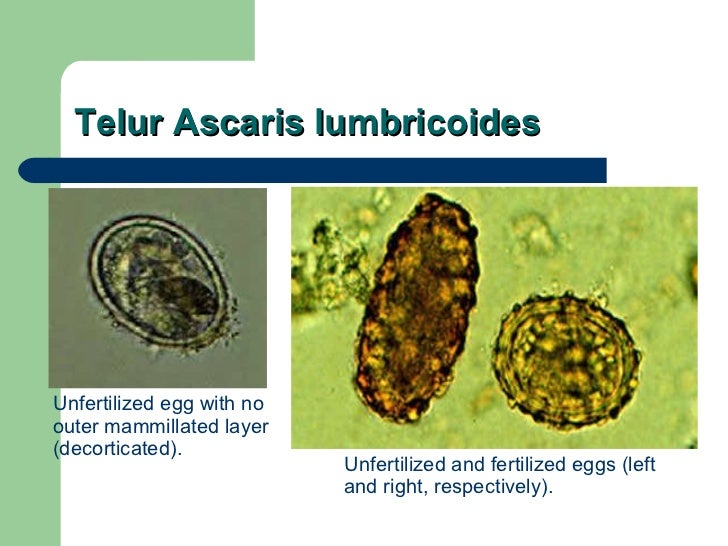 Вначале вырабатываются IgM, которые можно обнаружить только в течение 1-2 недель после инфицирования, далее их уровень опускается ниже определяемых значений. После IgM начинается выработка IgG, обеспечивающих иммунитет к реинвазии. Однако иммунитет этот нестойкий, и в случае излечения человека от аскаридоза уже через 3 месяца IgG обычно не выявляются. Таким образом, хотя диагноз не может быть поставлен только на основании определения титра Ascaris lumbricoides, IgG (результаты необходимо рассматривать вместе с анамнезом и клинической симптоматикой), ранняя диагностика позволяет начать терапию до появления осложнений аскаридоза.
Вначале вырабатываются IgM, которые можно обнаружить только в течение 1-2 недель после инфицирования, далее их уровень опускается ниже определяемых значений. После IgM начинается выработка IgG, обеспечивающих иммунитет к реинвазии. Однако иммунитет этот нестойкий, и в случае излечения человека от аскаридоза уже через 3 месяца IgG обычно не выявляются. Таким образом, хотя диагноз не может быть поставлен только на основании определения титра Ascaris lumbricoides, IgG (результаты необходимо рассматривать вместе с анамнезом и клинической симптоматикой), ранняя диагностика позволяет начать терапию до появления осложнений аскаридоза.
Кроме того, данный анализ помогает оценить эффективность лечения аскаридоза.
Когда назначается исследование?
При жалобах, позволяющих заподозрить аскаридоз.
В течении аскаридоза выделяют две фазы – раннюю (миграционную) и позднюю (кишечную). О ранней фазе могут свидетельствовать слабость, недомогание, головная боль, иногда лихорадка до 38 °С, увеличение печени, селезенки, лимфатических узлов, высыпания на коже, локальный или системный кожный зуд, признаки поражения легких (сухой кашель, одышка, боли в груди). В поздней фазе к ним добавляются симптомы поражения желудочно-кишечного тракта: расстройства аппетита, тошнота, жидкий стул или, напротив, запоры, боли в животе. Многие больные отмечают аллергию, трудно поддающуюся лечению, и упорную (длительную, устойчивую к терапии) железодефицитную анемию.
В поздней фазе к ним добавляются симптомы поражения желудочно-кишечного тракта: расстройства аппетита, тошнота, жидкий стул или, напротив, запоры, боли в животе. Многие больные отмечают аллергию, трудно поддающуюся лечению, и упорную (длительную, устойчивую к терапии) железодефицитную анемию.
Что означают результаты?
Референсные значения
Результат: отрицательный.
КП (коэффициент позитивности): 0 - 0,84.
Положительный результат
Отрицательный результат
Что может влиять на результат?
Кто назначает исследование?
Врач общей практики, терапевт, инфекционист, гастроэнтеролог, хирург.
Антитела к аскаридам lgG, Ascaris IgG количественный — количественное определение специфических антител класса IgG к Ascaris lumbricoides, которые вырабатываются иммунной системой в ответ на инфицирование возбудителем аскаридоза.
Аскаридоз — самое распространённое в мире паразитарное заболевание (гельминтоз), возбудителем является круглый червь аскарида (Ascaris lumbricoides, струнец), который паразитирует в тонком кишечнике человека. Заболевание чаще всего поражает детей, рабочих очистных сооружений, а также людей, занимающихся огородничеством.
Источник распространения инфекции — больной человек.
Механизм передачи — алиментарный, то есть посредством заражённой пищи и воды, а также бытовой. Большая вероятность инфицирования в летнее и осеннее время года, при употреблении немытых овощей, фруктов, ягод и столовой зелени с огородов, почва которых удобрена не обезвреженными фекалиями.
Место обитания аскариды — тонкий кишечник, где половозрелые самки начинают откладывать до 200 тысяч яиц каждый день. Выделяя при этом токсические продукты обмена веществ, которые отравляют организм и вызывают аллергию. Яйца с фекалиями, проникая во внешнюю среду, созревают на протяжении 10–15 дней, откуда вновь попадают к человеку при несоблюдении правила личной гигиены. Длина самок аскариды может достигать 40 см, самцов — до 25 см. Внешне они схожи с дождевыми червями, однако имеют беловато-жёлтую окраску.
Длина самок аскариды может достигать 40 см, самцов — до 25 см. Внешне они схожи с дождевыми червями, однако имеют беловато-жёлтую окраску.
Зрелые яйца аскариды попадая в организм тонкой кишке выводят личинки, которые мигрируют через стенку кишки в нижнюю полую вену, после чего в сосуды печени и лёгких, откуда переходят в альвеолы и бронхи. В лёгких они поднимаются по эпителию дыхательных путей в глотку и заглатываются в ЖКТ (желудочно-кишечный тракт). После повторного проникновения в тонкую кишку они в течение 3 месяцев становятся взрослыми паразитами, которые способны продуцировать яйца.
Жизненный цикл взрослой аскариды около года, затем она гибнет и вместе с испражнениями выводится наружу. Следственно выявление аскарид на протяжении нескольких лет у одного индивида является показателем повторного заражения.
Клиническая картина при аскаридозе
Выделяют такие фазы заболевания:

Основные клинические проявления аскаридоза: субфебрильная температура (незначительный подъём температуры тела на протяжении длительного времени), поражения лёгких (сухой кашель с незначительной мокротой, одышка, боли в груди), общее недомогание, головные боли, кожные высыпания, зуд, эозинофильные инфильтраты в лёгких, гиперлейкоцитоз, увеличение лимфатических узлов, печени и селезёнки.
Характерные симптомы кишечной стадии заболевания: тошнота, рвота, нарушение стула, боли в животе, нарушения в работе нервной системы: нарушение сна, головокружение, головная боль, истерики, судороги и т.п. Возможные осложнения аскаридоза: панкреатит, аппендицит, кишечная непроходимость.
Заболевание, зачастую, заканчивается полным выздоровлением. Инфицирование аскаридозом очень опасно во время беременности, так как вызывает гиповитаминозы, способствует аллергизации организма, приводит к отсутствию эффекта от вакцинации против дифтерии, столбняка, кори, полиомиелита.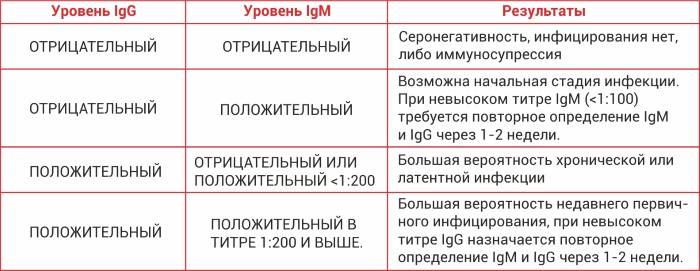 Обычно сопровождается дисбактериозом кишечника.
Обычно сопровождается дисбактериозом кишечника.
Антитела при аскаридозе
Серологическое исследование на выявление антител к аскаридам позволяет уже на ранней стадии диагностировать аскаридоз и начать терапию до появления осложнений заболевания. Анализ не является самостоятельным тестом, результаты целесообразно оценивать вместе с анамнезом и клинической картиной течения заболевания. У пациентов с иммунодефицитами и новорождённых, серологические данные имеют ограниченное значение.
Показания:
Подготовка
Кровь рекомендуется сдавать утром, в период с 8 до 11 часов. Взятие крови производится натощак, спустя 4–6 часов голодания. Допускается употребление воды без газа и сахара. Накануне сдачи исследования следует избегать пищевых перегрузок.
Интерпретация результатов
Единицы измерения: УЕ*
Положительный результат будет сопровождаться дополнительным комментарием с указанием коэффициента позитивности пробы (КП*):

Положительный результат:
Отрицательный результат:
Сомнительный результат:
*Коэффициент позитивности (КП) — это отношение оптической плотности пробы пациента к пороговому значению. КП — коэффициент позитивности, является универсальным показателем, применяемым в иммуноферментных тестах. КП характеризует степень позитивности исследуемой пробы и может быть полезен врачу для правильной интерпретации полученного результата. Поскольку коэффициент позитивности не коррелирует линейно с концентрацией антител в пробе, не рекомендуется использовать КП для динамического наблюдения за пациентами, в том числе контроля эффективности лечения.
1. Allen J E, Maizels RM. Иммунология гельминтозов. Int Arch Allergy Immunol. 1996; 109:3–10. [PubMed] [Google Scholar]
2. Al Shamma MR R, McSharry C, McLeod K, McCruden EM, Stack B. Роль белков теплового шока в муковисцидозном артрите. грудная клетка. 1997; 52: 1056–1059. [Бесплатная статья PMC] [PubMed] [Google Scholar]
грудная клетка. 1997; 52: 1056–1059. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Amiri P, Haak-Frendscho M, Robbins K, McKerrow JH, Stewart T, Jardieu P. Лечение антииммуноглобулином E снижает количество гельминтов и яйценоскость у Schistosoma mansoni -инфицированных нормальных мышей и мышей с нокаутом интерферона-гамма. J Эксперт Мед. 1994; 180:43–51. [Бесплатная статья PMC] [PubMed] [Google Scholar]
4. Корпет Ф. Множественное выравнивание последовательностей с иерархической кластеризацией. Нуклеиновые Кислоты Res. 1988; 16:10881–10890. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Dayhoff MO, Eck RV, Park CM. Модель эволюционных изменений в белках. В: Dayhoff MO, редактор. Атлас последовательности и структуры белков. Том. 5. Вашингтон, округ Колумбия: Национальный фонд биомедицинских исследований; 1972. стр. 89–99. [Google Scholar]
6. Dunne DW, Butterworth AE, Fulford AJ, Kariuki HC, Langley JG, Ouma H, Capron A, Pierce RJ, Sturrock RF.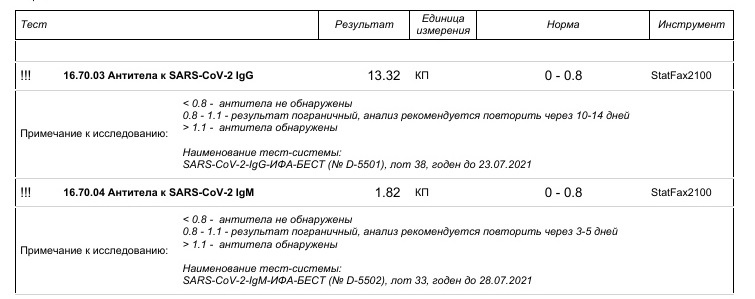 Иммунитет после лечения шистосомоза человека: связь между антителами IgE к взрослому червю антигены и устойчивость к реинфекции. Евр Дж Иммунол. 1992; 22:1483–1494. [PubMed] [Google Scholar]
Иммунитет после лечения шистосомоза человека: связь между антителами IgE к взрослому червю антигены и устойчивость к реинфекции. Евр Дж Иммунол. 1992; 22:1483–1494. [PubMed] [Google Scholar]
7. Else KJ, Finkelman FD, Maliszewski CR, Grencis RK. Цитокин-опосредованная регуляция хронической инфекции кишечных гельминтов. J Эксперт Мед. 1994;179:347–351. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Эриксен Л., Линд П., Нансен П., Роепсторф А., Урбан Дж. Ф. Устойчивость к Ascaris suum у производителей, откормочных и свиноматок, не подвергшихся воздействию паразитов и подверженных естественному воздействию. Вет Паразитол. 1992; 41: 137–149. [PubMed] [Google Scholar]
9. Eriksen L, Nansen P, Roepstorff A, Lind P, Nilsson O. Ответы на повторные прививки яиц Ascaris suum свиньям в период откорма. I. Изучение кинетики популяции червей. Паразитол рез. 1992;78:241–246. [PubMed] [Google Scholar]
10. Fraser EM, Christie J F, Kennedy M W. Гетерогенность среди инфицированных детей по репертуару антител IgE к антигенам паразитарной нематоды Ascaris . Int Arch Allergy Immunol. 1993; 100: 283–286. [PubMed] [Google Scholar]
Гетерогенность среди инфицированных детей по репертуару антител IgE к антигенам паразитарной нематоды Ascaris . Int Arch Allergy Immunol. 1993; 100: 283–286. [PubMed] [Google Scholar]
11. Gill SC, von Hippel PH. Расчет коэффициентов экстинкции белка на основе данных аминокислотной последовательности. Анальная биохимия. 1989; 182: 319–326. [PubMed] [Google Scholar]
12. Гренсис Р. К., Халтнер Л., Эльзе К. Дж. Защитный иммунитет хозяина к Trichinella Spiralis у мышей: активация субпопуляций Th-клеток и секреция лимфокинов у мышей с различными фенотипами ответа. Иммунология. 1991; 74: 329–332. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Hagan P, Blumenthal U J, Dunn D, Simpson A J G, Wilkins H A. Человеческие IgG, IgG4 и устойчивость к повторному заражению Schistosoma haematobium . Природа. 1991; 349: 243–245. [PubMed] [Google Scholar]
14. Hagel I, Lynch N R, di Prisco MC, Rojas E, Perez M, Alvarez N. Реинфекция Ascaris детей из трущоб: связь с реакцией IgE. Клин Эксп Иммунол. 1993; 94: 80–83. [PMC free article] [PubMed] [Google Scholar]
Клин Эксп Иммунол. 1993; 94: 80–83. [PMC free article] [PubMed] [Google Scholar]
15. Haswell-Elkins MR, Elkins DB, Anderson RM. Доказательства предрасположенности человека к заражению Ascaris , анкилостомозом, Enterobius и Trichuris в рыбацкая община Южной Индии. Паразитология. 1987; 95: 323–333. [PubMed] [Google Scholar]
16. Hill D E, Fetterer R H, Romanowski R D, Urban J F. Эффект иммунизации свиней Компоненты кутикулы Ascaris suum на развитие резистентности к парентеральной миграции во время контрольной инфекции. Вет Иммунол Иммунопатол. 1994; 42: 161–169. [PubMed] [Google Scholar]
17. Хокибара С., Такамото М., Томинага А., Такацу К., Сугане К. Выраженная эозинофилия у мышей, трансгенных по интерлейкину-5, не может предотвратить инфекцию Trichinella Spiralis . J Паразитол. 1997; 83: 1186–1189. [PubMed] [Google Scholar]
18. Holland CV, Asaolu S O, Crompton DW T, Stoddart RC, Macdonald R, Torimiro SEA. Эпидемиология Ascaris lumbricoides и другие передающиеся через почву гельминты у детей начальной школы из Иле-Ифе, Нигерия. Паразитология. 1989; 99: 275–285. [PubMed] [Google Scholar]
Эпидемиология Ascaris lumbricoides и другие передающиеся через почву гельминты у детей начальной школы из Иле-Ифе, Нигерия. Паразитология. 1989; 99: 275–285. [PubMed] [Google Scholar]
19. Jarrett E.E., Mackenzie S., Bennich H. «Неспецифический» IgE, индуцированный паразитами, не защищает от аллергических реакций. Природа. 1980; 282: 302–304. [PubMed] [Google Scholar]
20. Jarrett E.E., Miller H.R. P. Производство и активность IgE при гельминтозах. Прог Аллергия. 1982; 31: 178–233. [PubMed] [Академия Google]
21. Kaufmann SHE, Schoel B. Белки теплового шока как антигены иммунитета против инфекции и самоконтроля. В: Моримото Р.И., Тиссьер А., Георгопулос С., редакторы. Биология белков теплового шока и молекулярных шаперонов. Колд-Спринг-Харбор, Нью-Йорк: Лабораторное издательство Колд-Спринг-Харбор; 1994. С. 58–61. [Google Scholar]
22. Kennedy M W, Brass A, McCruden AB, Price NC, Kelly S M, Cooper A. Аллерген ABA-1 паразитической нематоды Ascaris suum : функция связывания жирных кислот и ретиноидов и структурная характеристика. Биохимия. 1995;34:6700–6710. [PubMed] [Google Scholar]
Биохимия. 1995;34:6700–6710. [PubMed] [Google Scholar]
23. Kennedy MW, Fraser EM, Christie JF. MHC класса II (I-A) области контроля репертуара антител IgE к аллергену ABA-1 нематоды Ascaris . Иммунология. 1991; 72: 577–579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Kennedy MW, Qureshi F. Стадийно-специфические секретируемые антигены паразитических личиночных стадий нематоды Ascaris . Иммунология. 1986; 58: 515–522. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Кеннеди М. В., Томлинсон Л. А., Фрейзер Э. М., Кристи Дж. Ф. Специфичность ответа антител на внутренние антигены Ascaris : гетерогенность у инфицированных людей и контроль MHC (H-2) репертуара у мышей. Клин Эксп Иммунол. 1990; 80: 219–224. [PMC free article] [PubMed] [Google Scholar]
26. Korenaga M, Hitoshi Y, Yamaguchi N, Sato Y, Takatsu K, Tada I. Роль интерлейкина-5 в защитном иммунитете к инфекции Strongyloides venezuelensis у мышей. Иммунология. 1994;72:502–507. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Иммунология. 1994;72:502–507. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Коренага М., Тада И. Роль ИЛ-5 в иммунных реакциях на нематод. Паразитол сегодня. 1994; 10: 234–236. [PubMed] [Google Scholar]
28. Линч Н. Р. Влияние социально-экономического уровня на глистную инфекцию и аллергическую реактивность в тропических странах. В: Moqbel R, редактор. Аллергия и иммунитет к гельминтозам: общие механизмы или разные пути? Лондон, Англия: Тейлор и Фрэнсис; 1992. С. 51–62. [Академия Google]
29. Lynch NR, Palenque M, Hagel I, DiPrisco MC. Клиническое улучшение астмы после антигельминтного лечения в условиях тропиков. Am J Respir Crit Care Med. 1997; 156: 50–54. [PubMed] [Google Scholar]
30. Майзелс Р. М., Банди Д. А. П., Селкирк М. Э., Смит Д. Ф., Андерсон Р. М. Иммунологическая модуляция и уклонение от паразитов-гельминтов в популяциях человека. Природа. 1993; 365: 797–805. [PubMed] [Google Scholar]
31. Миллер Х. Р. П. Защитная реакция слизистой оболочки против желудочно-кишечных нематод жвачных и экспериментальных животных. Вет Иммунол Иммунопатол. 1984;6:167–259. [PubMed] [Google Scholar]
Вет Иммунол Иммунопатол. 1984;6:167–259. [PubMed] [Google Scholar]
32. Needham C S, Lillywhite J E, Didier J E, Bianco A E, Bundy D A P. Временные изменения интенсивности инфекции Trichuris trichuria и реакции изотипов сыворотки у детей. Паразитология. 1994; 109: 197–200. [PubMed] [Google Scholar]
33. Огилви Б. М., де Савиньи Д. Иммунный ответ на нематод. В: Коэн С., Уоррен К.С., редакторы. Иммунология паразитарных инфекций. Оксфорд, Англия: Научные публикации Блэквелла; 1982. стр. 715–757. [Академия Google]
34. Палмер Д. Р., Холл А., Хак Р., Анвар К. С. Реакция антител на антигены Ascaris lumbricoides в исследовании случай-контроль хронически тяжело инфицированных бангладешских детей. Паразитология. 1995; 111: 385–393. [PubMed] [Google Scholar]
35. Парсонс Дж. К., Коффман Р. Л., Грив Р. Б. Антитела к интерлейкину-5 предотвращают эозинофилию крови и тканей, но не захват печени при мышином личиночном токсокарозе. Иммунол от паразитов. 1993; 15: 501–508. [PubMed] [Академия Google]
1993; 15: 501–508. [PubMed] [Академия Google]
35а. Prescott, R. (Кафедра клинических наук и иммунологии, Кейптаунский университет, Кейптаун, Южная Африка. Личное сообщение.
36. Pritchard DI. Иммунитет к гельминтам: слишком много IgE паразитов, а не хозяина) Parasite Immunol. 1993;15:5–9.[PubMed] [Google Scholar]
37. Pritchard DI, Quinnell R J, Walsh E A. Иммунитет человека к Necator americanus : IgE, масса паразита и плодовитость. Parasite Immunol., 1995; 17:71–75. [PubMed] [Google Scholar]
38. Rihet P, Demeure CE, Burgois A, Prata A, Dessein A J. Доказательства связи между устойчивостью человека к Schistosoma mansoni и высокими уровнями антиличиночного IgE. Евр Дж Иммунол. 1991; 21: 2679–2686. [PubMed] [Google Scholar]
39. Селкирк М.Э., Денхэм Д.А., Партоно Ф., Майзелс Р.М. Родственный тепловой шок-70 является важным иммуногеном при бругиозном филяриатозе. Дж Иммунол. 1989; 143: 299–308. [PubMed] [Google Scholar]
40. Шер С., Коффман Р. Л. Регулирование иммунитета к паразитам с помощью Т-клеток и цитокинов, полученных из Т-клеток. Анну Рев Иммунол. 1992;10:385–409. [PubMed] [Google Scholar]
Шер С., Коффман Р. Л. Регулирование иммунитета к паразитам с помощью Т-клеток и цитокинов, полученных из Т-клеток. Анну Рев Иммунол. 1992;10:385–409. [PubMed] [Google Scholar]
41. Shin E H, Osada Y, Chai J Y, Matsumoto N, Takatsu K, Kojima S. Защитная роль эозинофилов при инфекции Nippostrongylus brasiliensis . Int Arch Allergy Appl Immunol. 1997; 114:45–50. [PubMed] [Google Scholar]
42. Shirakawa T, Enomoto T, Shimazu S-I, Hopkin J M. Обратная связь между реакцией на туберкулин и атопическим расстройством. Наука. 1997; 275:77–79. [PubMed] [Google Scholar]
43. Spence H J, Moore J, Brass A, Kennedy M W. кДНК, кодирующая повторяющиеся единицы аллергена ABA-1 Ascaris. Мол Биохим Паразитол. 1993;57:339–344. [PubMed] [Google Scholar]
44. Tomlinson L A, Christie J F, Fraser EM, McLaughlin D, McIntosh AE, Kennedy M W. MHC ограничение репертуара антител секреторными антигенами и основным аллергеном нематодного паразита Аскариды . Дж Иммунол. 1989; 143: 2349–2356. [PubMed] [Google Scholar]
1989; 143: 2349–2356. [PubMed] [Google Scholar]
45. Урбан Дж. Ф., Ализаде Х., Романовский Р. Д. Ascaris suum : развитие кишечного иммунитета к инфекционным личинкам второй стадии у свиней. Опыт Паразитол. 1988;66:66–77. [PubMed] [Google Scholar]
46. Urban J F, Jr, Maliszewski CR, Madden KB, Katona IM, Finkelman FD. Лечение IL-4 может вылечить установившуюся желудочно-кишечную нематодную инфекцию у иммунокомпетентных и иммунодефицитных мышей. Дж Иммунол. 1995; 154:4675–4684. [PubMed] [Google Scholar]
47. Уорд А. М. Справочник по клинической иммунохимии. 5-е изд. Шеффилд, Англия: Типография Шеффилдского университета; 1996. Эталонные единицы белка; стр. 53–54. [Академия Google]
48. Язданбахш М., Пакстон В.А., Бранденбург А., Ванри Р., Ленс М., Партоно Ф., Майзелс Р.М., Селкирк М.Е. Дифференциальная изотипическая реактивность антител к специфическим антигенам при лимфатическом филяриатозе: gp15/400 преимущественно индуцирует иммуноглобулин Е (IgE), IgG4 и IgG2. Заразить иммун. 1995; 63: 3772–3779. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Заразить иммун. 1995; 63: 3772–3779. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D, et al. Гельминтозы, передающиеся через почву: аскаридоз, трихоцефалез, анкилостомоз. Ланцет . 2006 г., 6 мая. 367(9521):1521-32. [Ссылка QxMD MEDLINE].
Jourdan PM, Lamberton PHL, Fenwick A, Addiss DG. Гельминтозы, передающиеся через почву. Ланцет . 4 сентября 2017 г. [Ссылка на MEDLINE QxMD].
де Лима Корвино Д.Ф., Бхимджи СС. Аскаридоз. Январь 2018 г. [Ссылка QxMD MEDLINE]. [Полный текст].
Райт Дж. Э., Веркман М., Данн Дж. К., Андерсон Р. М. Текущие эпидемиологические данные о предрасположенности к гельминтозам человека высокой или низкой интенсивности: систематический обзор. Векторы-паразиты . 2018 31 января. 11 (1): 65. [Ссылка QxMD MEDLINE].
Векторы-паразиты . 2018 31 января. 11 (1): 65. [Ссылка QxMD MEDLINE].
Уокер М., Холл А, Басаньес М.Г. Индивидуальная предрасположенность, кластеризация домохозяйств и факторы риска заражения человека Ascaris lumbricoides: новые эпидемиологические данные. PLoS Negl Trop Dis . 2011 26 апреля. 5 (4): e1047. [Ссылка QxMD MEDLINE]. [Полный текст].
Шао К.С., Сюй М.Дж., Аласаад С. и др. Сравнительный анализ профилей микроРНК у взрослых Ascaris lumbricoides и Ascaris suum. BMC Vet Res . 2014 г., 27 апреля. doi: 10.1186/1746-6148-10-99.:10:99. [Ссылка QxMD MEDLINE]. [Полный текст].
Бетсон М., Неджсум П., Бендалл Р.П., Деб Р.М., Стотард М.Р. Молекулярная эпидемиология аскаридоза: глобальный взгляд на динамику передачи аскарид у людей и свиней. J Инфиц. дис. 2014;210(6):932. Epub 2014 31 марта . 2014, 15 сентября. [Ссылка на MEDLINE QxMD]. [Полный текст].
Epub 2014 31 марта . 2014, 15 сентября. [Ссылка на MEDLINE QxMD]. [Полный текст].
Хенигль М., Зеебер К., Валентин Т., Цоллнер-Швец И., Краузе Р. Легочный аскаридоз у пациентов из богатых стран: сдвиг в эпидемиологии?. Int J Infect Dis . 16 декабря 2012 г. (12): e888. [Ссылка QxMD MEDLINE].
Заметки с мест: аскаридоз, связанный со свиноводством – Мэн, 2010-2013 гг. MMWR Morb Mortal Wkly Rep . 2013 24 мая. 62(20):413. [Ссылка QxMD MEDLINE].
Пэн В., Юань К., Ху М. и др. Недавние исследования эпидемиологии и генетики аскарид в Китае с использованием молекулярных инструментов. Паразитология . 2007 март 134:325-30. [Ссылка QxMD MEDLINE].
Пэн В., Чжоу С., Гассер Р.Б. Профили яиц аскарид в фекалиях человека: биологические и эпидемиологические последствия. Паразитология . 2003 сен. 127:283-90. [Ссылка QxMD MEDLINE].
Паразитология . 2003 сен. 127:283-90. [Ссылка QxMD MEDLINE].
А. Пермин 1, Э. Хеннингсен, К. Д. Меррелл, А. Ропсторф, П. Нансен. Свиньи заражаются после употребления в пищу печени и легких кур, зараженных аскаридами свиного происхождения. Международный журнал по паразитологии . 30 июня 2000 г. [Ссылка на MEDLINE QxMD]. [Полный текст].
М С Хуроо 1. Аскаридоз. Гастроэнтерологические клиники Северной Америки . 1996, 25 сентября. [Ссылка на MEDLINE QxMD]. [Полный текст].
Глобальное здравоохранение, Отдел паразитарных заболеваний и малярии. Аскаридоз. Центр контроля и профилактики заболеваний CDC. Доступно на https://www.cdc.gov/parasites/ascariasis/biology.html. Доступ: 26 июля 2021 г.
К. Д. Муррелл 1, Л. Эриксен, П.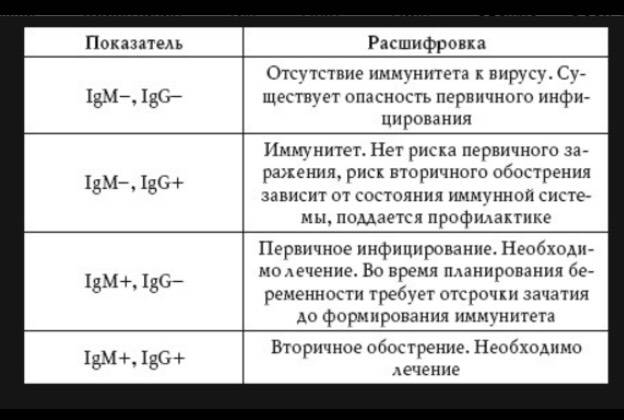 Нансен, Х. С. Слотвед, Т. Расмуссен. Ascaris suum: пересмотр пути ранней миграции и последствия для аскаридоза человека. Журнал паразитологии . Апрель 1997 г. [Ссылка QxMD MEDLINE]. [Полный текст].
Нансен, Х. С. Слотвед, Т. Расмуссен. Ascaris suum: пересмотр пути ранней миграции и последствия для аскаридоза человека. Журнал паразитологии . Апрель 1997 г. [Ссылка QxMD MEDLINE]. [Полный текст].
M M Reeder 1. Рентгенологическое и ультразвуковое исследование аскаридоза желудочно-кишечного, желчного и респираторного трактов. Семинары по рентгенологии . Январь 1998 г. [Ссылка QxMD MEDLINE]. [Полный текст].
Le Hesran JY, Akiana J, Ndiaye el HM, et al. Тяжелая атака малярии связана с высокой распространенностью инфекции Ascaris lumbricoides среди детей в сельских районах Сенегала. Trans R Soc Trop Med Hyg . 2004 г., июль 98 (7): 397-9. [Ссылка QxMD MEDLINE].
Geissler PW, Mwaniki D, Thiong F, et al. Геофагия как фактор риска заражения геогельминтами: продольное исследование кенийских младших школьников. Trans R Soc Trop Med Hyg . 1998 январь-февраль. 92(1):7-11. [Ссылка QxMD MEDLINE].
Trans R Soc Trop Med Hyg . 1998 январь-февраль. 92(1):7-11. [Ссылка QxMD MEDLINE].
Долд С, Голландия CV. Аскариды и аскаридоз. Микробы заражают . 2011 г. 13 июля (7): 632-7. [Ссылка QxMD MEDLINE].
Нейсум П., Паркер Э.Д., Фриденберг Дж. и др. Аскаридоз является зоонозом в Дании. Дж Клин Микробиол . 2005 март 43(3):1142-8. [Ссылка QxMD MEDLINE].
Bendall RP, Barlow M, Betson M, Stothard JR, Nejsum P. Зоонозный аскаридоз, Соединенное Королевство. Внезапное заражение Dis . 2011 17 (10) октября: 1964-6. [Ссылка QxMD MEDLINE].
PE Tietze 1, PH Tietze. Аскариды, Ascaris lumbricoides. Первичная медико-санитарная помощь . 1991 март [Ссылка QxMD MEDLINE]. [Полный текст].
Димерт Д.Дж. Аскаридоз. Геррант Р.Л., Веллер П.Ф., Уокер Д.Х. Тропические инфекционные болезни: принципы, возбудители и практика . 3-е изд. Сондерс Эльзевир, Филадельфия; 2011. с.794.
Мишель С. Старр 1, Сьюзен П. Монтгомери. Передающиеся через почву гельминтозы в Соединенных Штатах: систематический обзор - 1940-2010 гг. Американский журнал тропической медицины и гигиены . Октябрь 2011 г. [Ссылка QxMD MEDLINE]. [Полный текст].
Do TT, Molbak K, Phung DC, et al. Гельминтозы среди людей, использующих сточные воды и человеческие экскременты в пригородном сельском хозяйстве и аквакультуре в Ханое, Вьетнам. Trop Med Int Health . 2007 г., 12 декабря, Приложение 2:82-90. [Ссылка QxMD MEDLINE].
Halpenny CM, Paller C, Koski KG, Valdés VE, Scott ME. Региональные, бытовые и индивидуальные факторы, влияющие на динамику повторного заражения гельминтами, передающимися через почву, у детей дошкольного возраста из сельской коренной Панамы. PLoS Negl Trop Dis . 2013. 7(2):e2070. [Ссылка QxMD MEDLINE]. [Полный текст].
PLoS Negl Trop Dis . 2013. 7(2):e2070. [Ссылка QxMD MEDLINE]. [Полный текст].
Рэйчел Л. Пуллан 1, Дженнифер Л. Смит, Рашми Ясрасария, Саймон Дж. Брукер. Глобальные показатели инфицирования и бремени болезней, вызванных гельминтозами, передающимися через почву, в 2010 г. Паразиты и переносчики . 2014 21 января. [Ссылка на MEDLINE QxMD]. [Полный текст].
Марта Бетсон 1, Питер Нейсум 2, Ричард П. Бендалл 3, Ринки М. Деб 4, Дж. Рассел Стотард 4. Молекулярная эпидемиология аскаридоза: глобальный взгляд на динамику передачи аскарид у людей и свиней. Журнал инфекционных болезней . 2014, 15 сентября. [Ссылка на MEDLINE QxMD]. [Полный текст].
Данн Дж.С., Тернер Х.К., Тун А., Андерсон Р.М. Эпидемиологические обследования и исследования гельминтов, передающихся через почву, в Юго-Восточной Азии: систематический обзор. Векторы-паразиты . 2016 27 янв. 9:31. [Ссылка QxMD MEDLINE].
Векторы-паразиты . 2016 27 янв. 9:31. [Ссылка QxMD MEDLINE].
Oninla SO, Owa JA, Onayade AA, et al. Кишечные гельминтозы среди сельских и городских школьников на юго-западе Нигерии. Энн Троп Мед Паразитол . 2007 г., декабрь 101 (8): 705-13. [Ссылка QxMD MEDLINE].
Коити Изумикава 1, Ёсихиса Коно, Киничи Изумикава, Кохей Хара, Хироко Хаяси, Харухико Маруяма и др. Эозинофильная пневмония, вызванная мигрирующими висцеральными личинками, возможно, вызванная Ascaris suum: отчет о клиническом случае и обзор последних публикаций. Японский журнал инфекционных болезней . 2011. [Ссылка QxMD MEDLINE]. [Полный текст].
Chunhua Zhou 1, Min Li, Keng Yuan, Shoulong Deng, Weidong Peng. Свиная аскарида: важный источник аскаридоза человека в Китае. Инфекция, генетика и эволюция .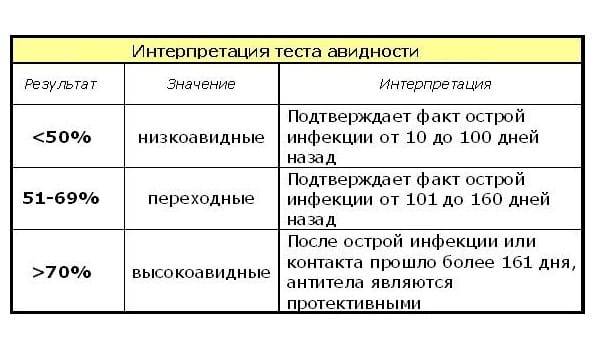 2012 авг;12. [Ссылка QxMD MEDLINE]. [Полный текст].
2012 авг;12. [Ссылка QxMD MEDLINE]. [Полный текст].
Лакхана Садаоу 1, Орануч Санпул 1 2, Иссарапонг Пхосук 1, Рутчани Родпай 1, Тонгжит Танчомнанг 2, Адулсак Виджит 3 и др. Молекулярная идентификация Ascaris lumbricoides и Ascaris suum, обнаруженных у людей и свиней в Таиланде, Лаосской Народно-Демократической Республике и Мьянме. Паразитологическое исследование . 2018 авг. [Ссылка на MEDLINE QxMD]. [Полный текст].
Ли Энн Миллер, Кейт Колби, Сьюзен Э. Мэннинг, Дональд Хениг, Элизабет МакЭвой, Сьюзан Монтгомери и др. Аскаридоз у людей и свиней на мелких фермах, штат Мэн, США, 2010-2013 гг. Новые инфекционные болезни . 2015 Фев; 21. [Ссылка QxMD MEDLINE]. [Полный текст].
Гангопадхьяй А.Н., Упадхьяя В.Д., Гупта Д.К. и др. Консервативное лечение аскаридной кишечной непроходимости. Индийский J Педиатр .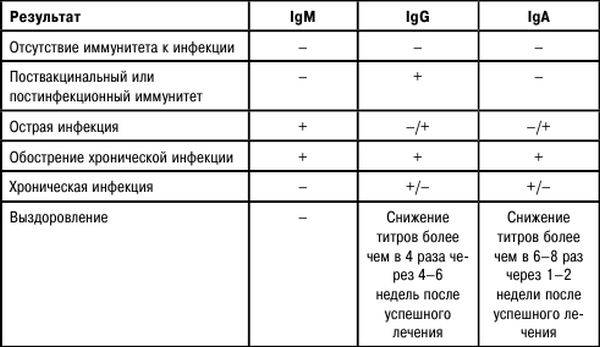 2007 г., декабрь 74 (12): 1085-7. [Ссылка QxMD MEDLINE].
2007 г., декабрь 74 (12): 1085-7. [Ссылка QxMD MEDLINE].
Ван дер Хук В., Де Н.В., Конрадсен Ф. и др. Текущее состояние передающихся через почву гельминтов во Вьетнаме. Общественное здравоохранение J Trop Med Юго-Восточной Азии . 2003. 34 Приложение 1:1-11. [Ссылка QxMD MEDLINE].
LOFFLER W. Транзиторные легочные инфильтраты с эозинофилией крови. Int Arch Allergy Appl Immunol . 1956. 8:54. [Ссылка QxMD MEDLINE]. [Полный текст].
Спиллманн РК. Легочный аскаридоз в тропических сообществах. Am J Trop Med Hyg . 1975. 24:791. [Ссылка QxMD MEDLINE]. [Полный текст].
Joob B, Wiwanitkit V. Синдром Леффлера, легочный аскаридоз, в Таиланде, редко или занижено?. J Грудной дис . 2012. 4:339. [Ссылка QxMD MEDLINE]. [Полный текст].
[Полный текст].
Дас АК. Печеночный и желчный аскаридоз. J Glob Infect Dis . 2014 6 апреля (2): 65-72. [Ссылка QxMD MEDLINE]. [Полный текст].
Sanai Fm, Аль-Карави, Массачусетс. Билиарный аскаридоз: отчет о сложном случае и обзор литературы. Саудовский журнал гастроэнтерологии . 2007/01. 13:25-32.
Шах О.Дж., Дар М.А., Вани Н.А. и др. Билиарный аскаридоз как причина постхолецистэктомического синдрома в эндемичной зоне. Копать Surg . 2004. 21(2):108-13; обсуждение 113. [Ссылка QxMD MEDLINE].
Saathoff E, Olsen A, Kvalsvig JD, et al. Характер заражения геогельминтами, влияние лечения альбендазолом и повторное заражение после лечения у школьников из сельской местности Квазулу-Наталь/Южная Африка. BMC Infect Dis . 2004 13 авг. 4:27. [Ссылка QxMD MEDLINE]. [Полный текст].
2004 13 авг. 4:27. [Ссылка QxMD MEDLINE]. [Полный текст].
Родригес Карнеро П., Эрнандес Матео П., Мартин-Гарре С., Гарсия Перес А., Дель Кампо Л. Неожиданные хозяева: визуализация паразитарных заболеваний. Insights Imaging . 2017 8 февраля (1): 101-125. [Ссылка QxMD MEDLINE].
Вани И. Аскаридоз желчного пузыря. Турк J Гастроэнтерол . 2011. 22(2):178-82. [Ссылка QxMD MEDLINE].
Medley GF, Turner HC, Baggaley RF, Holland C, Hollingsworth TD. Роль более чувствительной диагностики гельминтов в кампаниях массового введения лекарств: устранение и воздействие на здоровье. Ад Паразитол . 2016. 94:343-392. [Ссылка QxMD MEDLINE].
Хлаинг Т. Аскаридоз и недоедание у детей. Паразитология . 1993. [Ссылка QxMD MEDLINE].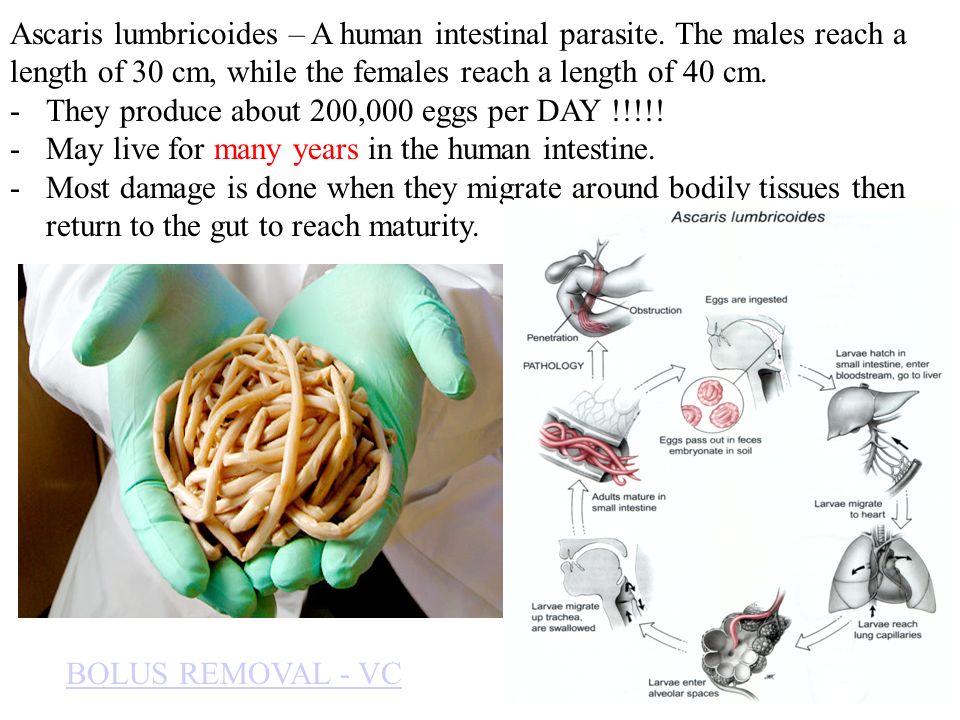 [Полный текст].
[Полный текст].
М. С. Хуроо, С. А. Заргар. Билиарный аскаридоз. Распространенная причина заболеваний желчевыводящих путей и поджелудочной железы в эндемичных районах. Гастроэнтерология . 1985. [Ссылка QxMD MEDLINE]. [Полный текст].
Лубис И.Н., Пасарибу С., Лубис К.П. Текущее состояние эффективности и действенности альбендазола и мебендазола для лечения Ascaris lumbricoides в Северо-Западной Индонезии. Asian Pac J Trop Med . 2012 5 августа (8): 605-9. [Ссылка QxMD MEDLINE].
Moser W, Schindler C, Keizer J. Эффективность рекомендуемых препаратов против гельминтов, передающихся через почву: систематический обзор и сетевой метаанализ. БМЖ . 2017 25 сентября. 358:j4307. [Ссылка QxMD MEDLINE].
Steinmann P, Utzinger J, Du ZW, Jiang JY, Chen JX, Hattendorf J, et al. Эффективность однократного и трехкратного приема альбендазола и мебендазола против передаваемых через почву гельминтов и Taenia spp.: рандомизированное контролируемое исследование. ПЛОС Один . 2011. 6 (9): e25003. [Ссылка QxMD MEDLINE].
Эффективность однократного и трехкратного приема альбендазола и мебендазола против передаваемых через почву гельминтов и Taenia spp.: рандомизированное контролируемое исследование. ПЛОС Один . 2011. 6 (9): e25003. [Ссылка QxMD MEDLINE].
Аскаридоз. Центры по контролю и профилактике заболеваний. Доступно на http://Centers for Disease Control and Prevention. Аскаридоз. https://www.cdc.gov/parasites/ascariasis/health_professionals/index.html#tx. Доступ: 08/09/2021.
Доннен П., Брассер Д., Драмикс М. и др. Добавление витамина А, но не дегельминтизация, улучшает рост недоедающих детей дошкольного возраста в восточной части Заира. Дж Нутр . 1998 авг. 128(8):1320-7. [Ссылка QxMD MEDLINE].
Гальван-Рамирес М.Л., Ривера Н., Лоэза М.Е. и др. Нитазоксанид в лечении Ascaris lumbricoides в сельской местности Колима, Мексика. Дж Гельминтол . 2007 Сентябрь 81 (3): 255-9. [Ссылка QxMD MEDLINE].
Дж Гельминтол . 2007 Сентябрь 81 (3): 255-9. [Ссылка QxMD MEDLINE].
Шуфорд К.В., Тернер Х.К., Андерсон Р.М. Соблюдение антигельминтного лечения в программах борьбы с забытыми тропическими болезнями: систематический обзор. Векторы-паразиты . 2016 27 янв. 9:29. [Ссылка QxMD MEDLINE].
Tyagi R, Maddirala AR, Elfawal M, Fischer C, Bulman CA, Rosa BA, et al. Низкомолекулярные ингибиторы метаболических ферментов, перепрофилированные в новый класс антигельминтных средств. ACS Infect Dis . 2018 13 июля. 4 (7): 1130-1145. [Ссылка QxMD MEDLINE].
Хуроо М.С. Аскаридоз. Gastroenterol Clin North Am . 1996 г., 25 сентября (3): 553-77. [Ссылка QxMD MEDLINE].
Мисра С.П., Двиведи М. Экстренное эндоскопическое лечение гастродуоденального и панкреатобилиарного аскаридоза. Эндоскопия . 1996 сен. 28 (7): 629-32. [Ссылка QxMD MEDLINE].
Эндоскопия . 1996 сен. 28 (7): 629-32. [Ссылка QxMD MEDLINE].
Финснес К.Д. Спазм гортани после общей анестезии, вызванный Ascaris lumbricoides. Acta Anaesthesiol Scand . 2013 авг. 57 (7): 944-5. [Ссылка QxMD MEDLINE].
Хосейн Г.М., Саха С., Бегум А. Влияние санитарии и санитарного просвещения на кишечные паразитарные инфекции среди детей младшего школьного возраста в Шерпуре, Бангладеш. Троп Док . 2003 г. 33 июля (3): 139-43. [Ссылка QxMD MEDLINE].
Strunz EC, Addiss DG, Stocks ME, Ogden S, Utzinger J, Freeman MC. Вода, санитария, гигиена и гельминтозы, передающиеся через почву: систематический обзор и метаанализ. ПЛОС Мед . 11 марта 2014 г. (3): e1001620. [Ссылка QxMD MEDLINE]. [Полный текст].
Габрие Дж. А., Руэда М.М., Каналес М., Дьоркос Т.В., Санчес А.Л. Школьная гигиена и дегельминтизация являются ключевыми защитными факторами для снижения передачи передаваемых через почву гельминтов среди школьников в Гондурасе. Векторы-паразиты . 2014 4 августа. 7 (1): 354. [Ссылка QxMD MEDLINE].
А., Руэда М.М., Каналес М., Дьоркос Т.В., Санчес А.Л. Школьная гигиена и дегельминтизация являются ключевыми защитными факторами для снижения передачи передаваемых через почву гельминтов среди школьников в Гондурасе. Векторы-паразиты . 2014 4 августа. 7 (1): 354. [Ссылка QxMD MEDLINE].
Тейлор-Робинсон Д.К., Мааян Н., Соарес-Вайзер К., Донеган С., Гарнер П. Препараты для дегельминтизации от передающихся через почву кишечных червей у детей: влияние на показатели питания, гемоглобин и успеваемость в школе. Кокрановская система базы данных, версия . 2012 14 ноября. 11:CD000371. [Ссылка QxMD MEDLINE].
Цудзи Н., Судзуки К., Касуга-Аоки Х. и др. Мыши, интраназально иммунизированные рекомбинантным 16-килодальтонным антигеном паразитов круглых червей Ascaris, защищены от миграции личинок Ascaris suum. Заразить Иммуном . 2003 г., сентябрь 71 (9): 5314-23. [Ссылка QxMD MEDLINE].
[Ссылка QxMD MEDLINE].
Zhan B, Beaumier CM, Briggs N, Jones KM, Keegan BP, Bottazzi ME, et al. Разработка поливалентной пангельминтной вакцины против нематодных инфекций, передающихся через почву. Вакцины Expert Rev . 2014 13 марта (3): 321-31. [Ссылка QxMD MEDLINE]. [Полный текст].
Левек Б., Истон А.В., Кулс П. и др. Оптимальные сроки послелечебного забора проб для оценки эффективности антигельминтных препаратов в отношении аскаридозов человека. Международный журнал паразитологических препаратов и лекарственной устойчивости . 2018. [Ссылка QxMD MEDLINE]. [Полный текст].
[Рекомендации] Всемирная организация здравоохранения. Профилактическая химиотерапия для борьбы с передающимися через почву гельминтозами в группах риска. ВОЗ. Доступно на http://www.who.int/nutrition/publications/guidelines/deworming/en/.