2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Ключевые слова: побочные эффекты лекарственных средств, лекарственно-индуцированная тахикардия типа «пируэт», тахикардия типа «пируэт», макролиды, внезапная сердечная смерть, антипсихотики, факторы риска
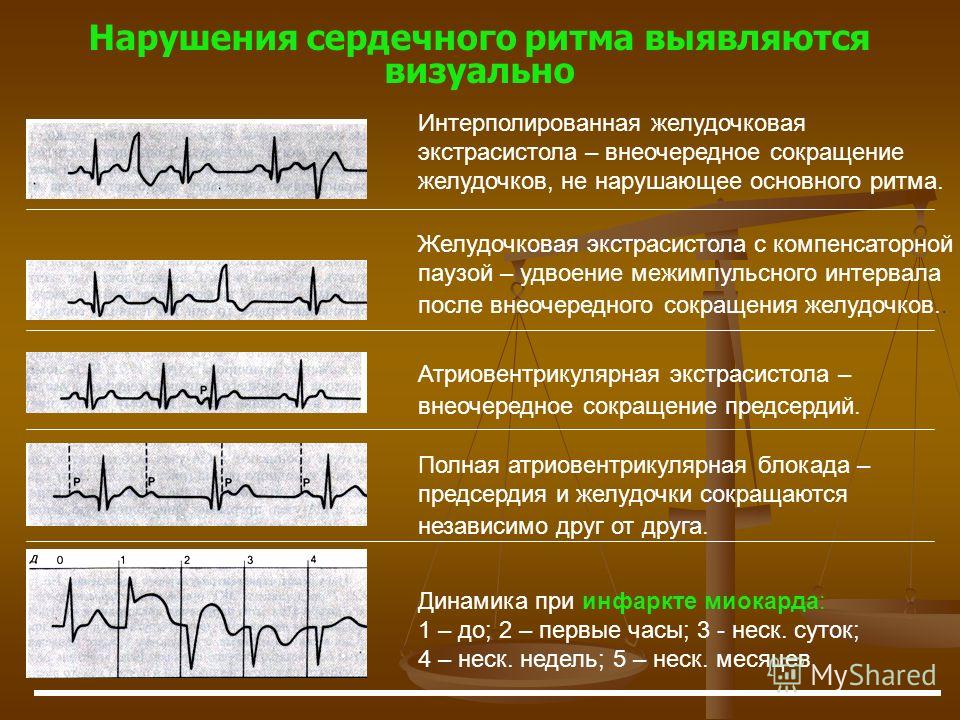
Полиморфная желудочковая тахикардия, или тахикардии типа «пируэт» (Torsades de Pointes, TdP), являясь потенциально жизнеугрожающей тахиаритмией, способной приводить к развитию внезапной сердечной смерти (ВСС), тесно ассоциирована с удлинением интервала QT [1, 2]. Известны две большие этиологические группы, обусловливающие развитие удлинения интервала QT и TdР: врожденные и приобретенные [3]. Среди приобретенных причин наиболее часто встречается лекарственно-обусловленное развитие удлинения интервала QT и TdР [4].
К настоящему времени известно, что препараты, способствующие пролонгации интервала QT и развитию TdР, имеются практически во всех существующих группах лекарственных средств (ЛС), составляя от 2 до 3% от общего числа используемых препаратов [5]. При этом распространенность лекарственно-индуцированного удлинения интервала QT и TdР в общей популяции остается неизвестной и требует дальнейшего изучения. В литературе имеются лишь данные, касающиеся распространенности лекарственно-индуцированного удлинения интервала QT и развития TdР в отдельных странах. Так, исследование Управления по контролю над лекарственными средствами и продуктами медицинского назначения Швеции (Swedish Medical Products Agency, MPA; Swedish) [6] предприняло попытку определить общее число случаев развития лекарственно-индуцированных желудочковых аритмий, наблюдая в течение 28 дней за 4,2 млн пациентов в 32 лечебных учреждениях. Были зафиксированы все эпизоды желудочковых аритмий, обусловленных ЛС и выявленных при поступлении, а также при мониторировании ЭКГ в процессе лечения. Полученный показатель составил 3,3 случая на 1 млн пациентов в течение 28-дневного срока наблюдения, или 4 случая на 100 тыс. человек в год. Другое шведское исследование, выполненное С. Astrom-Lilja et al.
 [7], проанализировав данные системы сообщений о побочных эффектах ЛС с 1991 по 2006 г., выявило, что из 61788 зафиксированных случаев, 101 был лекарственно-индуцированной TdР. Исследование G. Sarganas et al. [8] показало, что в 2014 г. в Берлине регистрировалось 2,5 случая лекарственно-индуцированного удлинения QT/TdР на 1 млн мужского населения города и 4 на 1 млн женского. А в популяционном исследовании на юго-западе Франции показатель развития лекарственно-индуцированной TdР оценивался в 5–7% от всех случаев желудочковых тахиаритмий или ВСС [9].
[7], проанализировав данные системы сообщений о побочных эффектах ЛС с 1991 по 2006 г., выявило, что из 61788 зафиксированных случаев, 101 был лекарственно-индуцированной TdР. Исследование G. Sarganas et al. [8] показало, что в 2014 г. в Берлине регистрировалось 2,5 случая лекарственно-индуцированного удлинения QT/TdР на 1 млн мужского населения города и 4 на 1 млн женского. А в популяционном исследовании на юго-западе Франции показатель развития лекарственно-индуцированной TdР оценивался в 5–7% от всех случаев желудочковых тахиаритмий или ВСС [9].
Имеются данные о том, что удлинение интервала QT наиболее распространено среди госпитализированных больных, особенно среди пациентов отделений интенсивной терапии [10], составив от 28 до 52% [11, 12]. Случаи развития TdP среди госпитализированных пациентов изучены гораздо меньше. D. Pickhamm et al. [13], наблюдавшие пациентов отделений интенсивной терапии в течение 2 месяцев, сообщают об 1 случае на 154 пациента (0,6%), что составило 1 из 16 случаев остановки сердечной деятельности в этих отделениях.
К наиболее известным и часто используемым как в амбулаторной, так и в стационарной практике группам ЛС, имеющим представителей, способствующих развитию удлинения интервала QT/TdР, относятся антиаритмики (IA-, IC- и III классов), антипсихотики, антидепрессанты, антибактериальные препараты (макролиды и фторхинолоны), антигистаминные средства, противоопухолевые, противогрибковые препараты, прокинетики, гиполипидемические средства, диуретики (кроме калий-сберегающих). Перечень ЛС, способствующих развитию TdP, постоянно обновляется, а усилия специалистов Аризонского университета (Arizona Center for Education and Research on Therapeutics, AzCERT), разработавших веб-сайт CredibleMeds.org, позволяют следить за актуальным списком препаратов, ассоциированных с развитием TdP. Все препараты, представленные на сайте, подразделены на группы в зависимости от того, ассоциированы ли они с известным, возможным или условным рисками развития удлинения QT/TdР. ЛС с известным риском – это ЛС, в отношении которых имеются существенные доказательства, подтверждающие их QT-удлиняющее действие и четкую связь с риском развития TdР, даже когда препараты принимаются четко в соответствии с инструкцией, указанной в официальной маркировке. Список ЛС с возможным риском включает ЛС, для которых имеются существенные доказательства, согласно которым они могут стать причиной удлинения интервала QT, но в настоящее время нет достаточных доказательств, что эти ЛС при использовании, согласно официальной маркировке, ассоциированы с риском возникновения TdР. Наконец, для ЛС с условным риском имеются существенные доказательства того, что их прием ассоциирован с риском TdР, но только при определенных условиях (например, передозировка ЛС, гипокалиемия, врожденное удлинение QT или в случае лекарственного взаимодействия). Перечни препаратов с известным, вероятным и возможным рисками развития TdР, а также число случаев развития TdP, ассоциированных с приемом того или иного препарата, представлены в табл.
ЛС с известным риском – это ЛС, в отношении которых имеются существенные доказательства, подтверждающие их QT-удлиняющее действие и четкую связь с риском развития TdР, даже когда препараты принимаются четко в соответствии с инструкцией, указанной в официальной маркировке. Список ЛС с возможным риском включает ЛС, для которых имеются существенные доказательства, согласно которым они могут стать причиной удлинения интервала QT, но в настоящее время нет достаточных доказательств, что эти ЛС при использовании, согласно официальной маркировке, ассоциированы с риском возникновения TdР. Наконец, для ЛС с условным риском имеются существенные доказательства того, что их прием ассоциирован с риском TdР, но только при определенных условиях (например, передозировка ЛС, гипокалиемия, врожденное удлинение QT или в случае лекарственного взаимодействия). Перечни препаратов с известным, вероятным и возможным рисками развития TdР, а также число случаев развития TdP, ассоциированных с приемом того или иного препарата, представлены в табл. 1–3.
1–3.
Известно, что использование отдельных антипсихотиков ассоциировано с повышенным риском ВСС в результате развития TdP [10]. Так, в популяционном исследовании типа случай–контроль S.M. Straus et al. [14] изучили 150 медицинских карт и обнаружили, что использование антипсихотических препаратов было ассоциировано со значительным увеличением риска ВСС (отношение шансов [ОШ] – 3,3; 95% доверительный интервал [ДИ] – 1,8–6,2), причем риск был наивысшим среди пациентов, получавших препараты бутирофенона (галоперидол).
О повышенном риске ВСС сообщили W.A. Ray et al. [15] по данным ретроспективного когортного исследования, причем риск был ассоциирован с использованием как типичных, так и атипичных антипсихотических препаратов, аналогичные результаты были получены и в других исследованиях [16, 17], а C.S. Wu et al. [18] обнаружили, что прием антипсихотических препаратов с наибольшей способностью к ингибированию IKr ассоциирован с самым высоким риском желудочковых аритмий и/или ВСС.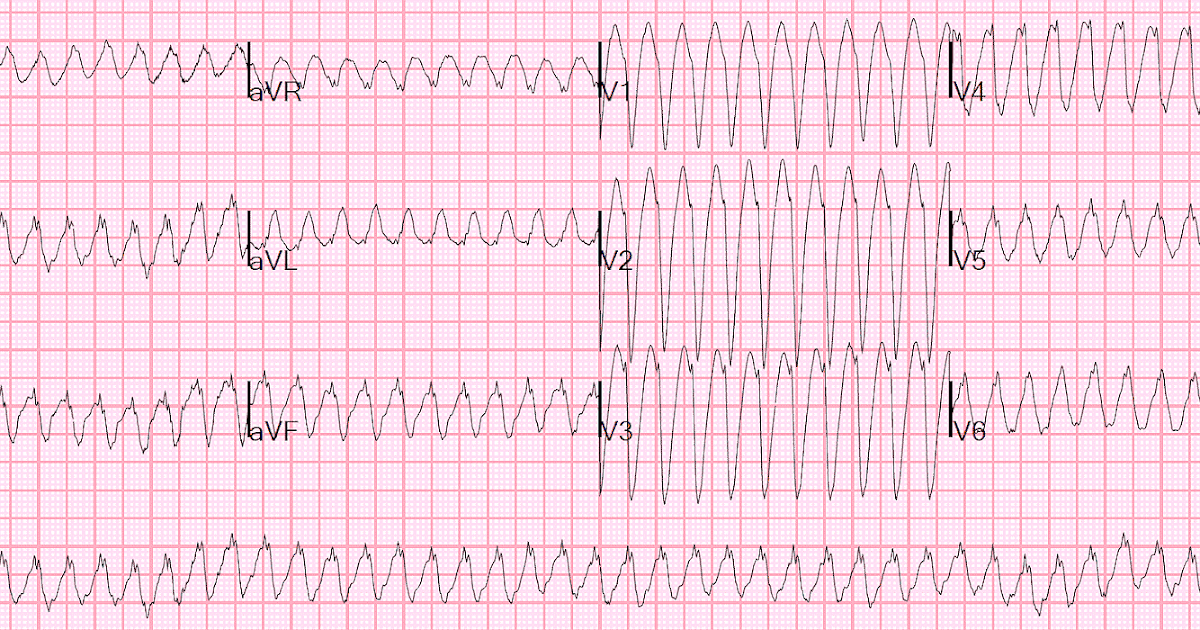 Мета-анализ F. Salvo et al. [19] показал, что разные антипсихотические средства были ассоциированы с различным уровнем риска развития ВВС и распределились следующим образом: тиоридазин>клозапин>риссперидон>галоперидол>оланзапин>кветиапин.
Мета-анализ F. Salvo et al. [19] показал, что разные антипсихотические средства были ассоциированы с различным уровнем риска развития ВВС и распределились следующим образом: тиоридазин>клозапин>риссперидон>галоперидол>оланзапин>кветиапин.
Прием макролидных антибиотиков также ассоциирован с повышенным риском ВСС. J.Y. Cheng et al. [20] провели мета-анализ 33 исследований, включивших почти 21 млн пациентов, оценивавших связь между приемом макролидных антибиотиков и сердечно-сосудистым риском. Было выявлено, что больные, принимавшие макролиды, имели повышенный риск ВВС или желудочковых тахиаритмий (2,42; 95% ДИ – 1,61–3,63), ВВС (2,52; 95% ДИ – 1,91–3,31) и сердечно-сосудистой смерти (1,31; 95% ДИ – 1,06–1,62) по сравнению с лицами, не принимавшими макролидные антибиотики.
В исследовании W.A. Ray et al. [21] было обнаружено, что в группе пациентов, получавших эритромицин, скорректированный показатель ВСС был в 2 раза выше, чем у лиц, не применявших данный препарат. Кроме того, скорректированная частота ВСС была в 5 раз выше среди пациентов, которые помимо эритромицина одновременно использовали и препараты, подавляющие активность ферментов системы цитохрома-P450. Аналогичное исследование пациентов, принимавших азитромицин, выявило у последних повышенный риск сердечно-сосудистой смерти (отношение рисков [ОР] – 2,88; 95% ДИ – 1,79–4,63; p<0,001) и смерти от всех причин (ОР – 1,85; 95% ДИ – 1,25–2,75; р<0,0021) по сравнению с пациентами, не принимавшими данный антибиотик [22]. Прием кларитромицина также ассоциирован с повышенным риском сердечно-сосудистых событий (госпитализация в связи с острым коронарным синдромом, декомпенсация сердечной недостаточности [СН], жизненно опасные нарушения ритма сердца или ВСС) [23].
Кроме того, скорректированная частота ВСС была в 5 раз выше среди пациентов, которые помимо эритромицина одновременно использовали и препараты, подавляющие активность ферментов системы цитохрома-P450. Аналогичное исследование пациентов, принимавших азитромицин, выявило у последних повышенный риск сердечно-сосудистой смерти (отношение рисков [ОР] – 2,88; 95% ДИ – 1,79–4,63; p<0,001) и смерти от всех причин (ОР – 1,85; 95% ДИ – 1,25–2,75; р<0,0021) по сравнению с пациентами, не принимавшими данный антибиотик [22]. Прием кларитромицина также ассоциирован с повышенным риском сердечно-сосудистых событий (госпитализация в связи с острым коронарным синдромом, декомпенсация сердечной недостаточности [СН], жизненно опасные нарушения ритма сердца или ВСС) [23].
Известно, что в основе механизма развития TdP лежит удлинение реполяризации желудочков, что приводит к увеличению продолжительности потенциала действия (ПД) и проявляется на ЭКГ удлинением интервала QTc [10]. Активация входящих деполяризующих токов и пролонгация ПД способствуют повышенной восприимчивости к ранней постдеполяризации, проявляющейся как деполяризационные колебания в напряжении мембраны во время фазы 2 или 3 ПД.
Активация входящих деполяризующих токов и пролонгация ПД способствуют повышенной восприимчивости к ранней постдеполяризации, проявляющейся как деполяризационные колебания в напряжении мембраны во время фазы 2 или 3 ПД.
В свою очередь возникновение ранних постдеполяризаций способно приводить к генерации преждевременных ПД, которые могут инициировать развитие TdР через механизм reentry («повторный вход»).
В основе удлинения реполяризации желудочков и увеличения продолжительности ПД лежит уменьшение выходящего или увеличение входящего тока во время фазы плато или фазы замедленной реполяризации ПД (или обеих) [10]. ЛC индуцируют TdP посредством ингибирования выходящего тока через специфические калиевые каналы (прежде всего быстрого компонента калиевого тока задержанного выпрямления [IКr]), что приводит к пролонгации ПД [10]. Некоторые ЛС (например, ибутилид) продлевают ПД желудочков также благодаря активации медленного натриевого тока (INa) во время 2-й фазы ПД [10]. Считается, что ранняя постдеполяризация, запускающая TdP, может быть вызвана повышенным входящим током кальция через кальциевые каналы, которые становятся реактивированными в результате увеличения продолжительности ПД.
Хотя ингибирование IКr и/или активация INa, а также удлинение реполяризации желудочков обязательны для развития TdP, наличия одних этих факторов оказывается недостаточно для возникновения аритмии. У многих пациентов, принимающих препараты, ингибирующие IКr, развивается удлинение интервала QTc, но не TdP.
В настоящее время исследователи полагают, что основным фактором, увеличивающим вероятность развития TdP, служит гетерогенность реполяризации (дисперсия реполяризации или рефрактерности) [1]. Известно, что сердечная мышца характеризуется электрической гетерогенностью и длительность ПД варьируется по трем основным типам желудочковых клеток (эпикардиальных, миокардиальных, эндокардиальных), различающихся по реполяризационным характеристикам в фазах 1 и 3 ПД [10]. Считается, что риск лекарственно-индуцированного TdP повышается у пациентов с повышенной трансмуральной гетерогенностью желудочковой реполяризации [10]. Кроме того, риск TdP может зависеть от нестабильности потенциала действия (быстрые колебания длительности потенциала действия) и степени триангуляции потенциала действия (замедление реполяризации, при которой ПД приобретает треугольную форму) [10].
Еще одной важной концепцией в отношении лекарственно-индуцированного TdP является т.н. резерв реполяризации [24]. Известно, что в нормальных условиях существует множество избыточных механизмов, которые поддерживают нормальную реполяризацию желудочков: IКr и другие токи реполяризации (медленный компонент калиевого тока задержанного выпрямления, INa, ток аномального выпрямления, транзиторный выходящий ток). Ингибирование IКr ЛС в присутствии неизменного резерва реполяризации редко приводит к TdP, т.к. избыточность реполяризационных токов минимизирует влияние ингибирования IКr. Однако при наличии факторов, уменьшающих резерв реполяризации (факторы риска развития TdP), ингибирование IКr может иметь гораздо большее влияние на удлинение желудочковой реполяризации и способствует развитию TdP.
Клинические симптомы, обусловленные развитием TdP, аналогичны таковым других тахиаритмий и основаны на увеличении частоты сердечных сокращений (ЧСС) с последующим изменением показателей артериального давления и сердечного выброса, проявляясь в виде эпизодов головокружения, сердцебиения, одышки, обморочного состояния, эпизода боли в грудной клетке (у пациентов с атеросклерозом коронарных артерий), а также судорог, гипотонии, либо TdP вообще не имеет каких-либо клинических проявлений [10]. Преходящие эпизоды TdP длительностью более 10 секунд сопровождаются развитием синкопальных состояний, однако отсутствие восстановления сердечного ритма в течение 1–2 минут может перерасти в фибрилляцию желудочков и привести к летальному исходу – ВСС. В течение последние двух десятков лет по причине развития ВСС в результате TdP с фармакологического рынка США были отозваны некоторые лекарственные препараты, в т.ч. терфенадин, астемизол, грепафлоксацин, цизаприд, левометадил и мезоридазин.
Преходящие эпизоды TdP длительностью более 10 секунд сопровождаются развитием синкопальных состояний, однако отсутствие восстановления сердечного ритма в течение 1–2 минут может перерасти в фибрилляцию желудочков и привести к летальному исходу – ВСС. В течение последние двух десятков лет по причине развития ВСС в результате TdP с фармакологического рынка США были отозваны некоторые лекарственные препараты, в т.ч. терфенадин, астемизол, грепафлоксацин, цизаприд, левометадил и мезоридазин.
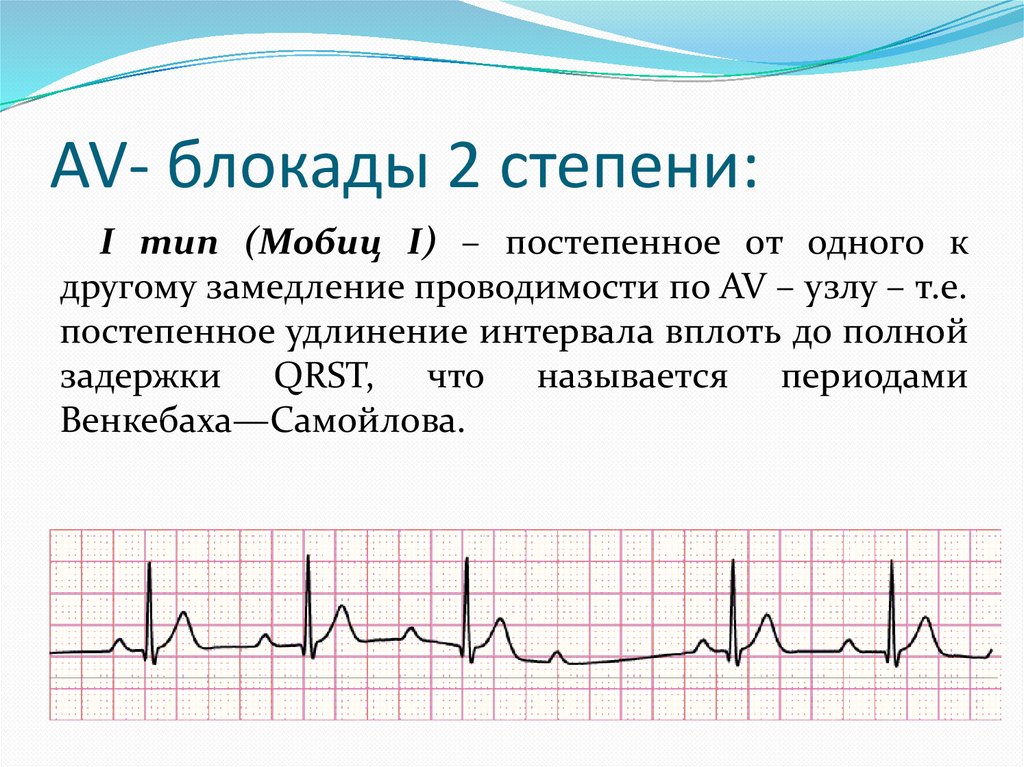
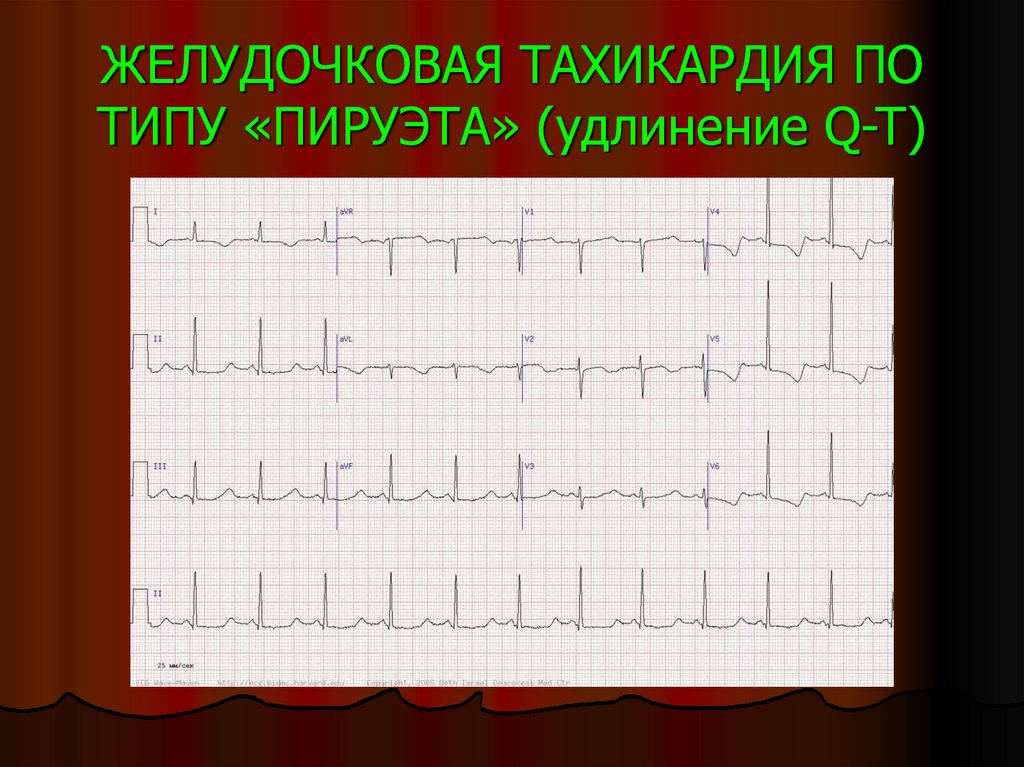
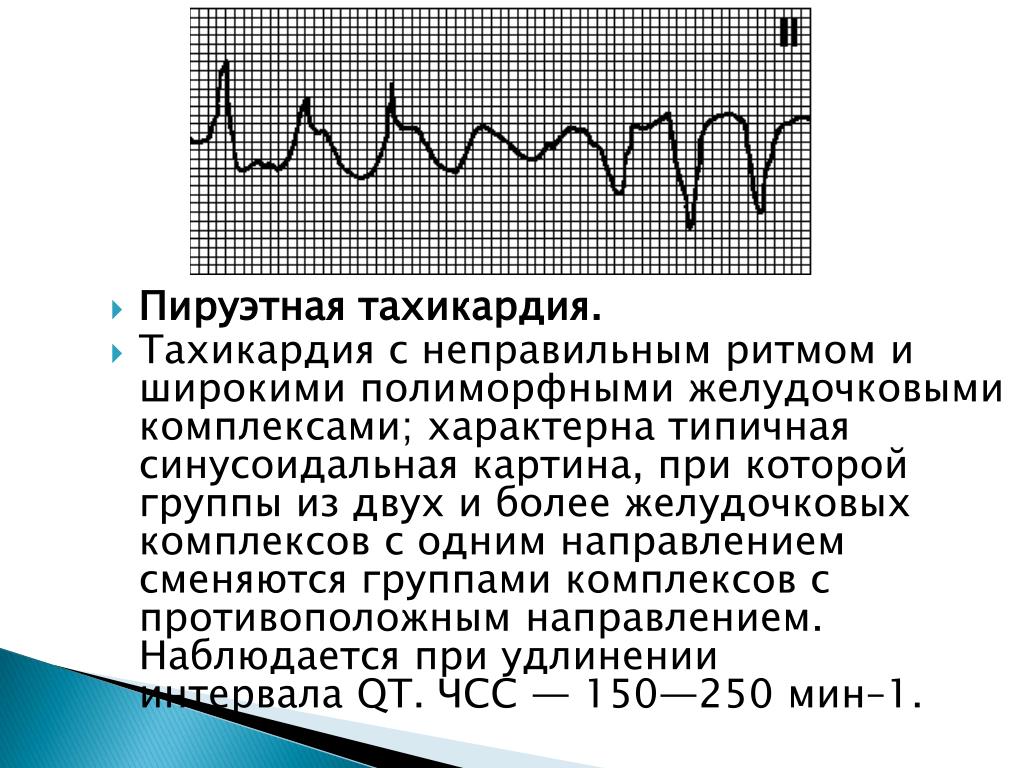
Диагностика TdP основана на ЭКГ-картине, регистрирующей полиморфную желудочковую тахикардию с неправильным ритмом и широкими полиморфными желудочковыми комплексами с меняющейся амплитудой (как бы закручивающейся вокруг изоэлектрической линии) со скоростью 160–240 в минуту в условиях продленного интервала QTс [10]. Кроме того, развитию TdP часто предшествует чередование интервалов RR типа «короткий–длинный–короткий», возникающее в результате развития преждевременного сокращения желудочков с последующей компенсаторной паузой, за которой и следует первый «залп» TdP.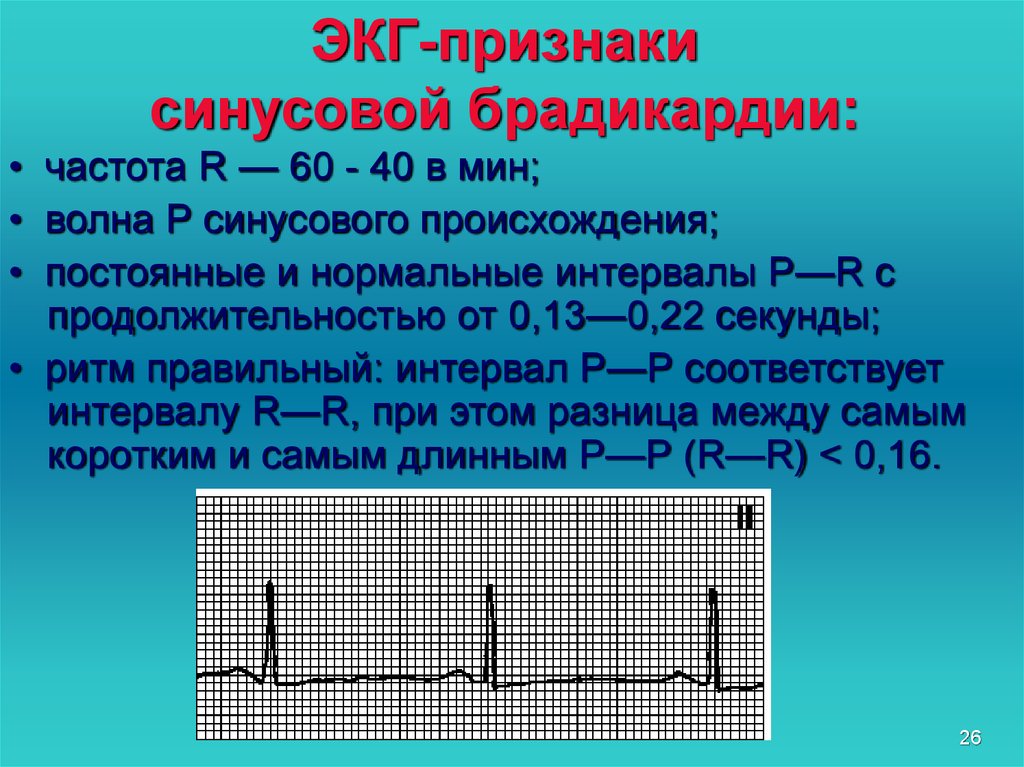
Определение интервала QT также имеет свои особенности. Необходимым считается определение не абсолютного показателя продолжительности интервала, а т.н. корригированного QT (QTc) [10]. Необходимость коррекции интервала QT обусловлена его обратной зависимостью от ЧСС: с увеличением ЧСС продолжительность интервала QT сокращается, и наоборот. С целью определения величины QTс наиболее часто используется формула Базетта (Bazett): QTc = QT√RR.
Дифференциальная диагностика лекарственно-индуцированной TdP подразумевает исключение других тахиаритмий (мерцательная аритмия, трепетание предсердий, предсердная тахикардия, рецидивирующая ариовентрикулярная узловая реципроктная тахикардия, не-TdR полиморфная желудочковая тахикардия, синусовая тахикардия, функциональная тахикардия, мономорфная желудочковая тахикардия, фибрилляция желудочков) и основана на анализе ЭКГ [10]. Так, наличие у пациента удлинения интервала QTc до или вскоре после эпизода полиморфной желудочковой тахикардии позволяет отличать TdP от не-TdP полиморфной желудочковой тахикардии.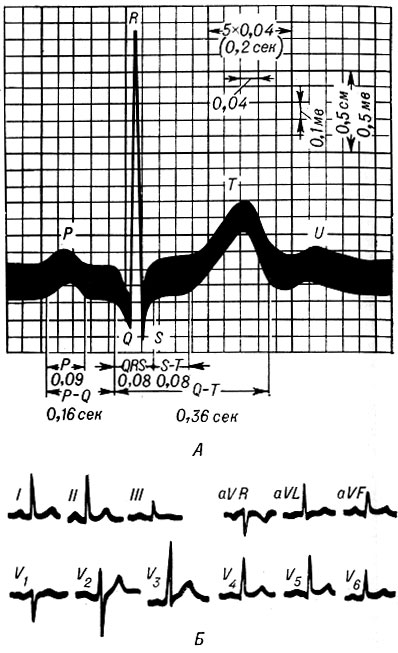
Важным критерием, позволяющим заподозрить лекарственно-индуцированный характер TdP, служит изучение перечня ЛС, используемых пациентом, с целью определения наличия препарата, способного вызывать TdP или по крайней мере обладающего способностью индуцировать удлинение интервала QTc [10]. И здесь необходимо помнить о зависимости развития TdP, ассоциированной с использованием того или иного ЛС, от способа приема препарата. Так, при использовании внутривенной лекарственной терапии развитие TdP, как правило, совпадает с ожидаемым временем пиковой концентрации препарата в плазме крови [10]. Например, многие случаи TdP, вызванной внутривенным введением эритромицина, имели место во время инфузии или в течение 30 минут после ее завершения [10]. TdP, индуцированная внутривенным введением галоперидола, наступает через 15–220 минут после инфузии, а ибутилида – через 2–60 минут после введения препарата [10]. В свою очередь TdP, вызванная пероральными формами ЛС, может быть отсрочена. Так, анализ 144 опубликованных статей, в которых в общей сложности описываются 249 пациентов, у которых развилась TdP [25], показал, что использование ЛС некардиологического профиля было ассоциировано с развитием 18% случаев, произошедших в течение первых 72 часов после начала пероральной терапии, 42% случаев произошли между 3-м и 30-м днями, а 40% – более чем через 30 дней после начала пероральной терапии.
Не менее важным диагностическим моментом считается оценка наличия у пациента сопутствующих факторов риска развития TdP, которые значительно увеличивают вероятность возникновения жизнеугрожающей тахиаритмии.
Лекарственно-индуцированная TdP чрезвычайно редко встречается у пациентов без сопутствующих факторов риска. Так, D. Zeltser et al. [25], проанализировав случаи развития лекарственно-индуцированных TdP у 249 пациентов, показали, что почти у 100% из них был по крайней мере 1 фактор риска, у 71% – по крайней мере 3 фактора.
В настоящее время известны следующие факторы риска развития лекарственно-индуцированной TdP [26–29]: пожилой возраст, брадикардия, одновременное применение >1 ЛС, способствующих развитию удлинения интервала QTc/TdP, повышение концентрации в плазме крови QT-удлиняющих ЛС вследствие лекарственного взаимодействия или неадекватной коррекции дозы при дисфункции почек/печени, женский пол, СН со сниженной фракцией выброса (ФВ), лекарственно-индуцированная TdP в анамнезе, гипокальциемия, гипокалиемия, гипомагниемия, увеличение интервала QTc на >60 мс по сравнению с исходным показателем, интервал QTс >500 мс, быстрая внутривенная инфузия ЛС, удлиняющих QTc, сепсис, наконец, самоудлинение интервала QTc на ЭКГ также определяется как фактор риска развития TdP.
В литературе представлено множество исследований, доказывающих заметное влияние факторов риска на вероятность развития TdP. Так, риск TdP заметно возрастает, когда интервал QTc превышает 500 мс, а при продолжительности интервала QTc <500 мс TdP возникает достаточно редко [26–29]. Также риск развития TdP возрастает, когда интервал QTc на фоне терапии увеличивается на >60 мс по сравнению с исходным значением [28]. Возвращаясь к исследованию [25], можно обнаружить, что из 249 пациентов с развившейся TdP, индуцированной ЛС, более двух третей были женщины, 41% имели заболевания сердечно-сосудистой системы (инфаркт миокарда, СН, кардиомиопатия), 28% – гипокалиемию, 19% – передозировку ЛС или отсутствие коррекции дозы при дисфункции печени/почек, 18% – отягощенный семейный анамнез по синдрому удлиненного интервала QT, лекарственно-индуцированный TdP/удлинение интервала QT в анамнезе, 35% – лекарственные взаимодействия.
Причины повышенного риска лекарственно-индуцированной TdP у лиц с наличием тех или иных факторов риска продолжают изучаться.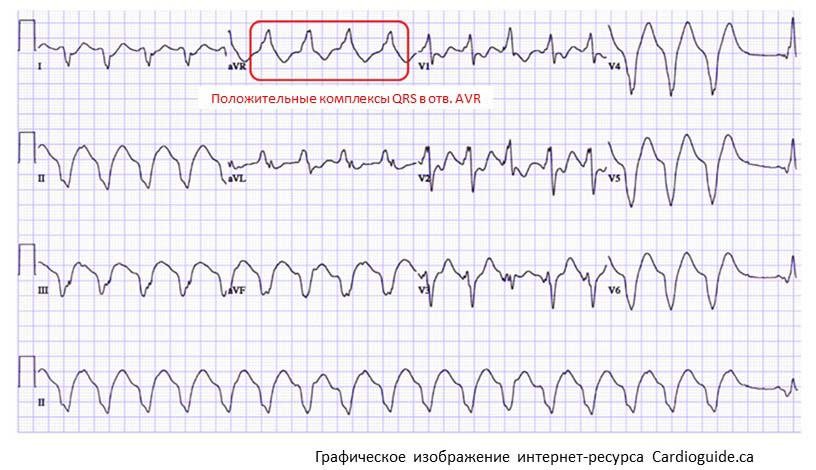 Предполагается, что у женщин повышенный риск развития TdP обусловлен проаритмогенным эффектом эстрогена, в то время как мужчины защищены антиаритмогенными эффектами тестостерона [30, 31]. Известно, что базовая продолжительность интервала OTc у женщин больше, чем у мужчин, что проявляется именно в период полового созревания [32, 33]. В исследовании R.R. Makkar et al. [34] из 332 пациентов с TdP, ассоциированной с приемом антиаритмических ЛС, 70% были женщинами. Другие исследования подтвердили предрасположенность женщин к развитию TdP, связанной с использованием азимилида, дофетилида, эритромицина, ибутилида, хинидина, соталола и терфенадина [35–38].
Предполагается, что у женщин повышенный риск развития TdP обусловлен проаритмогенным эффектом эстрогена, в то время как мужчины защищены антиаритмогенными эффектами тестостерона [30, 31]. Известно, что базовая продолжительность интервала OTc у женщин больше, чем у мужчин, что проявляется именно в период полового созревания [32, 33]. В исследовании R.R. Makkar et al. [34] из 332 пациентов с TdP, ассоциированной с приемом антиаритмических ЛС, 70% были женщинами. Другие исследования подтвердили предрасположенность женщин к развитию TdP, связанной с использованием азимилида, дофетилида, эритромицина, ибутилида, хинидина, соталола и терфенадина [35–38].
СН со сниженной ФВ является одним из основных факторов риска развития лекарственно-индуцированной TdP [10]. Механизмы, лежащие в основе повышенного риска развития TdP у этой группы пациентов, продолжают изучаться. Предполагается, что у лиц с СН со сниженной ФВ происходит подавление активности калиевых каналов, что способствует удлинению желудочковой реполяризации [10].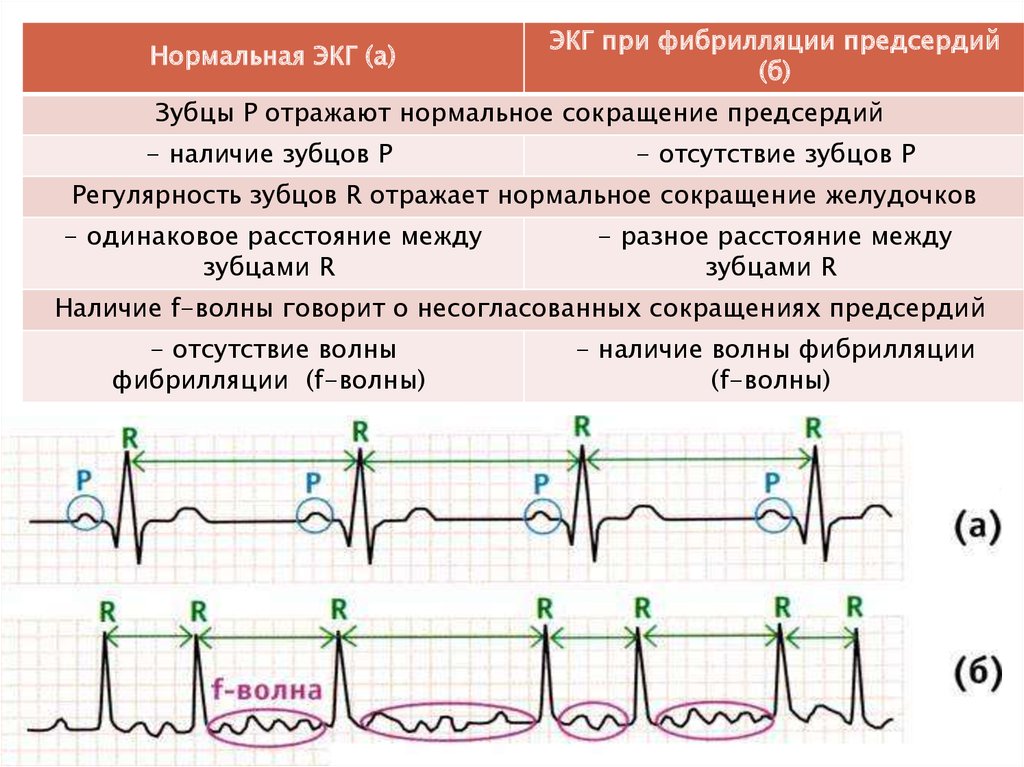
Важнейшим фактором риска является и повышение концентрации TdP-индуцирующих ЛС в плазме крови. Большинство случаев развития TdP, ассоциированных с использованием эритромицина или галоперидола, имели место после внутривенного введения препарата в результате более высоких пиковых концентраций в плазме крови [10]. Также развитию TdP способствовало отсутствие адекватной коррекции дозы ЛС при наличии заболевания почек в случаях терапии дофетилидом, левофлоксацином, прокаинамидом и соталолом [10]. Перечень препаратов, способствующих развитию TdP и требующих коррекции доз при использовании пациентами с заболеваниями почек/печени, представлен в табл. 4.
Лекарственные взаимодействия – важный фактор риска развития лекарственно-индуцированного TdP [10].
В литературе описаны многочисленные случаи TdP, развившегося в результате повышения концентрации в плазме ЛС, являвшегося субстратом для системы цитохрома-Р450, при использовании в комбинации с препаратом, ингибирующим ее активность. Так, база данных FDA США располагает сведениями о 25 случаях развития TdP, связанных с терфенадином, при этом 9 пациентов получали сопутствующую терапию кетоконазолом или итраконазолом, которые, как известно, ингибируют метаболизм терфенадина [38]. ЛС, связанные с риском развития TdP, являющиеся субстратом для системы цитохрома-P450, перечислены в табл. 4.
Так, база данных FDA США располагает сведениями о 25 случаях развития TdP, связанных с терфенадином, при этом 9 пациентов получали сопутствующую терапию кетоконазолом или итраконазолом, которые, как известно, ингибируют метаболизм терфенадина [38]. ЛС, связанные с риском развития TdP, являющиеся субстратом для системы цитохрома-P450, перечислены в табл. 4.
Считается, что использование комбинаций препаратов, пролонгирующих интервал QT, может увеличить риск развития TdP, хотя результаты исследований, посвященных данному вопросу, весьма противоречивы [39–42]. Известно, что одновременное применение нескольких препаратов, продлевающих интервал QТ, является относительно распространенным явлением. Так, ретроспективное когортное исследование L.H. Curtis et al. [39] показало, что из 1,1 млн пациентов с выписанным рецептом на QT-пролонгирующий препарат 9,4% получили рецепт на второй препарат, также продлевающий интервал QT или ухудшающий метаболизм QT-удлиняющего ЛС. А в исследовании K.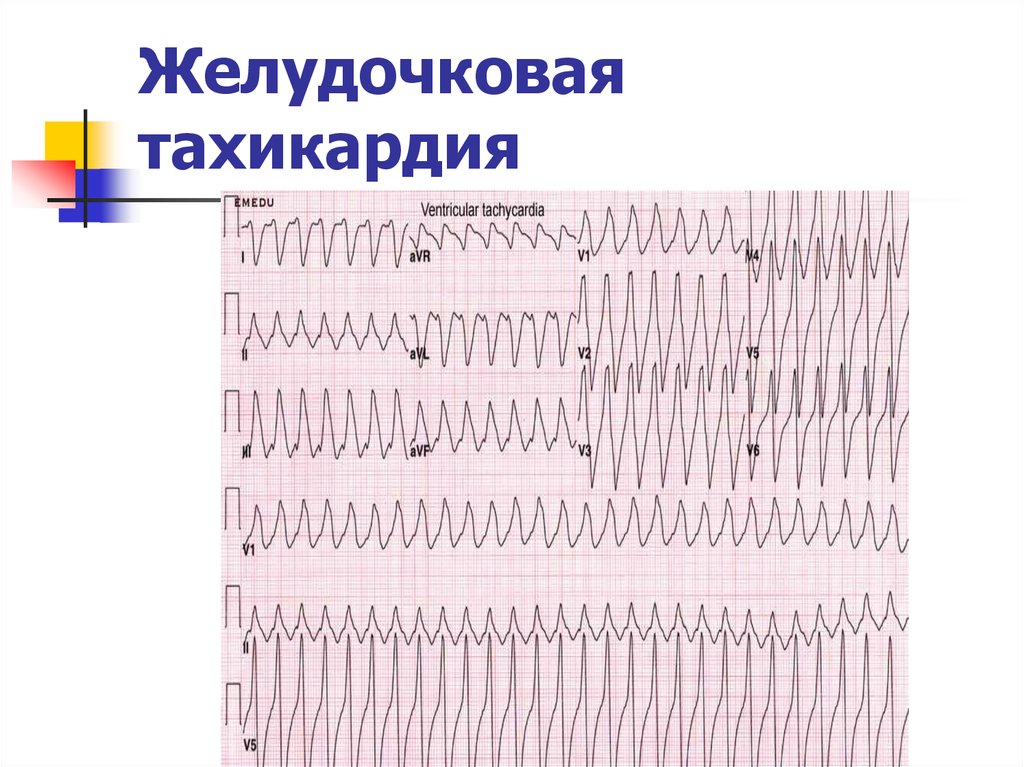 Y. Tay et al. [40] обнаружено, что 15% рецептов, выписанных в отделении неотложной помощи, включили ЛС, удлиняющие интервал QTс, при этом около 10% из них включили ≥2 препаратов, увеличивающих продолжительность интервала QTс.
Y. Tay et al. [40] обнаружено, что 15% рецептов, выписанных в отделении неотложной помощи, включили ЛС, удлиняющие интервал QTс, при этом около 10% из них включили ≥2 препаратов, увеличивающих продолжительность интервала QTс.
J.E. Tisdale et al. [29], проанализировав данные пациентов отделений интенсивной терапии, получавших ≥2 ЛС, удлиняющих интервал QTc, установили, что ОШ развития TdP у таких пациентов по сравнению с лицами, не получавшими терапии QT-удлиняющим ЛС, было равно 2,6 (95% ДИ – 1,9–5,6; р=0,02). Однако данных, свидетельствующих о том, что использование комбинации препаратов, удлиняющих интервал QTс или увеличивающих риск развития TdP, сопровождалось более высоким риском развития удлинения QTс/TdP по сравнению с монотерапией, получить не удалось [10]. В обзоре литературы [41] было показано, что назначение нескольких препаратов антипсихотического спектра не сопровождалось удлинением интервала QTc. В популяционном когортном исследовании M.N. Niemeijer et al. [42], в котором участвовали 13 тыс.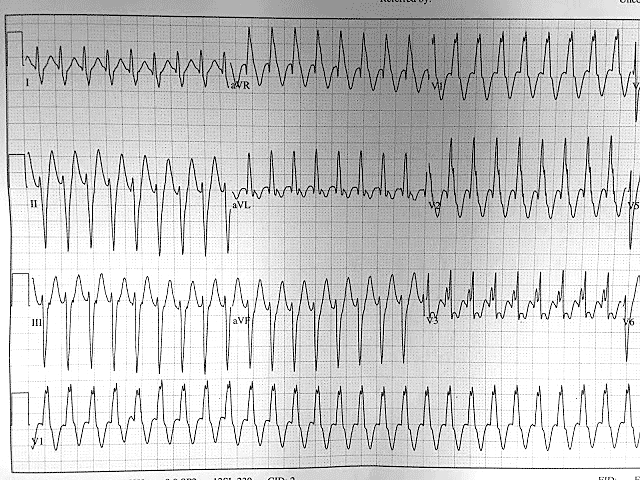 пациентов, обнаружено, что добавление к первоначальной терапии второго или третьего препарата, продлевающего интервал QTc, оказало очень небольшое дополнительное удлиняющее влияние на него.
пациентов, обнаружено, что добавление к первоначальной терапии второго или третьего препарата, продлевающего интервал QTc, оказало очень небольшое дополнительное удлиняющее влияние на него.
Опубликованные в литературе данные свидетельствуют о том, что у части пациентов с лекарственно-индуцированной TdP имелась генетическая предрасположенность [43, 44]. К настоящему времени выявлено 15 специфических генетических дефектов, лежащих в основе синдрома врожденного удлинения интервала QT [43]. Мутации генов, которые предрасполагают к развитию врожденного синдрома удлинения интервала QT, были обнаружены у 10–15% пациентов, перенесших TdP, индуцированную ЛС [44].
Риск развития лекарственно-обусловленной TdP может быть предупрежден путем выявления и минимизации влияния факторов риска, ассоциированных с развитием TdP [45]. При этом необходимо [10]:
Перед началом терапии препаратом, способствующим развитию TdP, пациенту следует выполнять ЭКГ в 12 отведениях с изучением продолжительности интервала QTc с последующим мониторированием ЭКГ, не допуская увеличения продолжительности интервала ≥500 мс [46]. Госпитализированным пациентам, получавшим препараты, способствующие развитию TdP, продолжительность интервала QTc следует контролировать ежедневно [46]. Пациентам, получавшим длительную пероральную терапию препаратами, способствующими развитию TdP, ЭКГ выполняется регулярно в сроки от 3 до 6 месяцев в зависимости от наличия или отсутствия других факторов риска [46].
Важную профилактическую роль играет осведомленность пациента, принимающего ЛС, способствующие развитию TdP, о таком их возможном побочном эффекте, как увеличение ЧСС, и необходимости получения консультации врача в случае увеличения ЧСС до 100–120 в минуту или появления эпизодов головокружения, беспокойства, усталости, слабости, одышки, боли в груди [10]. Пациентов, принимающих ЛС, способных вызывать TdP, следует предупреждать об опасности использования препаратов, отпускаемых без рецепта, без предварительной консультации с врачом.
Пациентов, принимающих ЛС, способных вызывать TdP, следует предупреждать об опасности использования препаратов, отпускаемых без рецепта, без предварительной консультации с врачом.
В случае развития TdР терапия препаратами, способствующими ее развитию, должна быть прекращена [47]. Гипокалиемия, гипомагниемия или гипокальциемия должны быть скорректированы с помощью внутривенного введения калия, магния или кальция соответственно. Гемодинамически нестабильным пациентам с TdP показана электроимпульсная терапия [47]. Пациентам с TdP и стабильной гемодинамикой показано внутривенное введение сульфата магния [10]. Для купирования TdP, развившейся на фоне брадикардии, эффективна временная кардиостимуляция, внутривенное введение изопреналина также может купировать TdP, увеличивая частоту сердечных сокращений и сокращая интервал QT [10].
Развитие TdP представляет серьезную опасность для жизни пациентов, ассоциируясь с повышенным риском развития ВСС.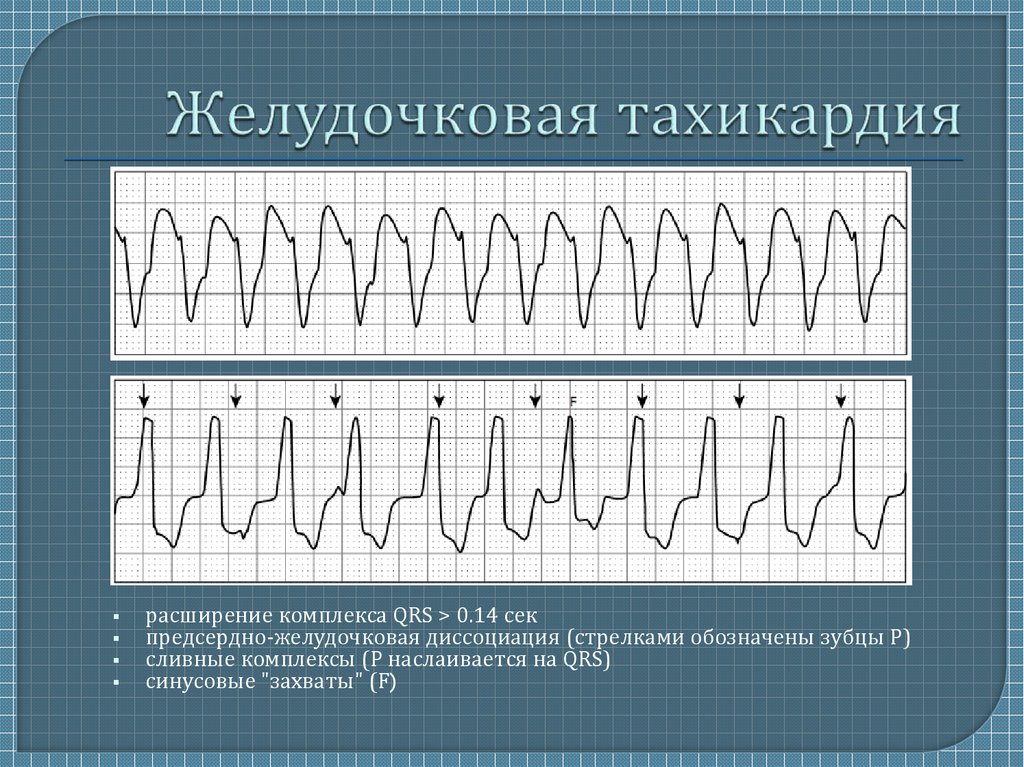 Большинство из известных в настоящее время фармакологических групп имеет представителей, обладающих способностью вызывать TdP. Именно из-за TdP-индуцирующего эффекта и развития ВСС использование некоторых из них было ограничено и даже запрещено (терфенадин, астемизол, грепафлоксацин и др.), в отношении других исследования продолжаются. Огромное значение в увеличении риска развития полиморфной желудочковой тахикардии у лиц, принимающих препараты, обладающие TdP-индуцирующим эффектом, играет наличие факторов риска TdP, что необходимо учитывать, назначая подобные ЛС. Большинство из факторов риска поддаются коррекции и должны быть скорректированы, что имеет важнейшее профилактическое значение, способствуя предотвращению развития TdP. Кроме того, своевременное информирование пациентов, направленное на формирование настороженности относительно возможности развития, особенностей проявления и способов предотвращения развития лекарственно-индуцированных TdP, имеет не меньшее профилактическое значение, требует соответствующих знаний и настороженности от практикующих врачей.
Большинство из известных в настоящее время фармакологических групп имеет представителей, обладающих способностью вызывать TdP. Именно из-за TdP-индуцирующего эффекта и развития ВСС использование некоторых из них было ограничено и даже запрещено (терфенадин, астемизол, грепафлоксацин и др.), в отношении других исследования продолжаются. Огромное значение в увеличении риска развития полиморфной желудочковой тахикардии у лиц, принимающих препараты, обладающие TdP-индуцирующим эффектом, играет наличие факторов риска TdP, что необходимо учитывать, назначая подобные ЛС. Большинство из факторов риска поддаются коррекции и должны быть скорректированы, что имеет важнейшее профилактическое значение, способствуя предотвращению развития TdP. Кроме того, своевременное информирование пациентов, направленное на формирование настороженности относительно возможности развития, особенностей проявления и способов предотвращения развития лекарственно-индуцированных TdP, имеет не меньшее профилактическое значение, требует соответствующих знаний и настороженности от практикующих врачей.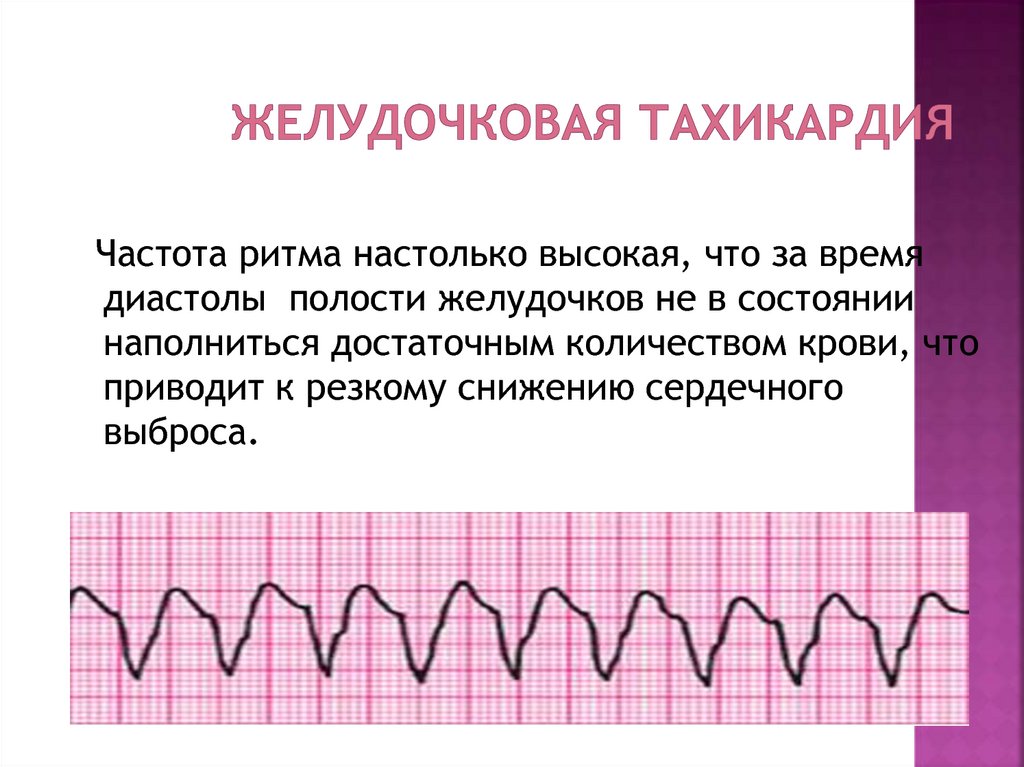
1. Trinkley K.E., Page II R.L., Lien H., et al. QT interval prolongation and the risk of torsades de pointes: essentials for clinicians. Curr Med Res Opin. 2013;29:1719–26. Doi: 10.1185/03007995.2013.840568. 2. Schwartz P.J., Woosley R.L. Predicting the unpredictable: drug-induced QT prolongation and torsades de pointes. J Am Coll Cardiol. 2016;67:1639–50. Doi: 10.1016/j.jacc.2015.12.063. 3. Остроумова О.Д. Удлинение интервала QT. РМЖ. 2001;18:750–54. 4. Woosley R.L., Heise C.W., Gallo T., et al. CredibleMeds. Avaiable from URL: https://crediblemeds.org/ 5. Yap Y.G., Camm A.J. Drug induced QT prolongation and torsades de pointes. Heart. 2003;89(11):1363–13. Doi: 10.1136/heart.89.11.1363. 6. Darpo B. Spectrum of drugs prolonging QT interval and the incidence of torsades de pointes. Eur Heart J. 2001;3(K):K70–80. Doi: 10.1016/S1520-765X. 7. Astrom-Lilja C., Odeberg J.M., Ekman E., et al. Drug-induced torsades de pointes: a review of the Swedish pharmacovigilance data-base. 8. Sarganas G., Garbe E., Klimpel A., et al. Epidemiology of symptomatic drug-induced long QT syndrome and torsade de pointes in Germany. Europace. 2014;6:101–8. Doi:10.1093/europace/eut214. 9. Molokhia M., Pathak A., Lapeyre-Mestre M., et al. Case ascertainment and estimated incidence of drug-induced long-QT syndrome: study in Southwest France. Br J Clin Pharmacol. 2008;66:386–95. Doi: 10.1111/j.1365-2125.2008.03229.x. 10. Tisdale J.E., Miller D.A. Drug-induced Diseases: Prevention, Detection, and Management. USA: American Society of Health-System Pharmacists. 2005. 870 p. 11. Tisdale J.E., Wroblewski H.A., Overholser B.R., et al. Prevalence of QT-interval prolongation in patients admitted to cardiac care units and frequency of subsequent administration of QT-interval prolonging drugs. Drug Saf. 2012;35:459–70. Doi: 10.2165/11598160-000000000-00000. 12. Hoogstraaten E., Rijkenberg S. 13. Pickham D., Helfenbein E., Shinn J.A., et al. High prevalence of corrected QT interval prolongation in acutely ill patients is associated with mortality: results of the QT in Practice (QTIP) study. Crit Care Med. 2012;40:394–99. Doi: 10.1097/CCM.0b013e318232db4a. 14. Straus S.M., Bleumink G.S., Dieleman J.P., et al. Antipsychotics and the risk of sudden cardiac death. Arch Intern Med. 2004;164:1293–97. Doi: 10.1001 / archinte.164.12.1293. 15. Ray W.A., Chung C.P., Murray K.T., et al. Atypical antipsychotic drugs and the risk of sudden cardiac death. N Engl J Med. 2009;360:225–35. Doi: 10.1056/NEJMoa0806994. 16. Jones M.E., Campbell G., Patel D., et al. Risk of mortality (including sudden cardiac death) and major cardiovascular events in users of olanzapine and other antipsychotics: a study with the General Practice Research Database. 17. Weeke P., Jensen A., Folke F., et al. Antipsychotics and associated risk of out-of-hospital cardiac arrest. Clin Pharmacol Ther. 2014;96:490–97. Doi: 10.1038/clpt.2011.368. 18. Wu C.S., Tsai Y.T., Tsai H.J. Antipsychotic drugs and the risk of ventricular arrhythmia and/or sudden cardiac death: a nation-wide case-crossover study. J Am Heart Assoc. 2015;4:e001568. Doi: 10.1161/JAHA.114.001568. 19. Salvo F., Pariente A., Shakir S., et al. Sudden cardiac and sudden unexected death related to antipsychotics: a meta-analysis of observational studies. Clin Pharmacol Ther. 2016;99:306–14. Doi: 10.1002/cpt.250. 20. Cheng J.Y., Nie X.Y., Chen X.M., et al. The role of macrolide antibiotics in increasing cardiovascular risk. J Am Coll Cardiol. 2015;66:2173–84. Doi: 10.1016/j.jacc.2015.09.029. 21. Ray W.A., Murray K.T., Meredith S., et al. Oral erythromycin and the risk of sudden death from cardiac causes. 22. Rao G.A., Mann J.R., Shoaibi A., et al. Azithromycin and levofloxacin use and increased risk of cardiac arrhythmia and death. Am Fam Med. 2014;12:121–27. Doi: 10.1370 / afm.1601. 23. Schembri S., Williamson P.A., Short P.M., et al. Cardiovascular events after clarithromycin use in lower respiratory tract infections: analysis of two prospective cohort studies. BMJ. 2013;346:f1235. Doi: 10.1136/bmj.f1235. 24. Alkan Y., Haefeli W.E., Burhenne J., et al. Voriconazole-induced QT interval prolongation and ventricular tachycardia: a nonconcentration-dependent adverse effect. Clin Infect Dis. 2004;39:e49–52. Doi: 10.1086/423275. 25. Zeltser D., Justo D., Halkin A., et al. Torsade de pointes due to noncardiac drugs: most patients have easily identifiable risk factors. Medicine. 2003;82:282–90. Doi:0.1097/01.md.0000085057.63483.9b. 26. Moss A.J., Schwartz P.J., Crampton R.S., et al. The long QT syndrome. 27. US Department of Health and Human Services (DHHS), Food and Drug Administration, Center for Drug Evaluation and Research *CDER), Center for Biologics Evaluation and Research (CBER). Guidance for industry. E14 clinical evaluation of QT/QTc interval prolongation and proarrhythmic potential for nonantiarrhythmic drugs. Rockville, MD: DHHS. 2005. 28. Pratt C.M., Al-Khalidi H.R., Brum J.M., et al. Cumulative experience of azimilide-associated torsades de pointes ventricular tachycardia in the 19 clinical studies comprising the azimilide database. J Am Coll Cardiol. 2006;48:471–77. 29. Tisdale J.E., Jaynes H.A., Kingery J.R., et al. Development and validation of a risk score to predict QT interval prolongation in hospitalized patients. Circ Cardiovasc Qual Outcomes. 2013;6:479–87. Doi:10.1161/CIRCOUTCOMES.113.000152. 30. Pham T.V., Rosen M.R. Sex, hormones, and repolarization. Cardiovasc Res. 31. Hreiche R., Morissette P., Turgeon J. Drug-induced long QT syndrome in women: review of current evidence and remaining gaps. Gend Med. 2008;5:124–35. Doi: 10.1016/j.genm.2008.05.005. 32. Ebert S.N., Liu X-K, Woosley R.L. Female gender as a risk factor for drug-induced cardiac arrhythmias: evaluation of clinical and experimental evidence. J Wornens Health. 1998;7:547–57. Doi: 10.1089/jwh.1998.7.547. 33. Rautaharju P.M., Zhou S.H., Wong S., et al. Sex differences in the evolution of the electrocardiographic QT interval with age. Can J Cardiol. 1992;8:690–95. 34. Makkar R.R., Fromm B.S., Steinman R.T., et al. Female gender as a risk factor for torsades de pointes associated with cardiovascular drugs. JAMA. 1993;270:2590–97. Doi:10.1001/jama.1993.03510210076031. 35. Drici M.D., Knollman B.C., Wang W-X., et al. Cardiac actions of erythromycin. Influence of female sex. JAMA. 1998;280:1774–6. Doi: 10. 36. Gowda R.M., Khan I.A., Punukollu G., et al. Female preponderance in ibutilide-induced torsade de pointes. Int J Cardiol. 2004;95:219–22. Doi:10.1016/j.ijcard.2003.04.034. 37. Roden D., Woosley R., Primm R. Incidence and clinical features of the quinidine-associated long-QT syndrome: implications for patient care. Am Heart J. 1986;111:1088–93. Doi:10.1016/0002-8703(86)90010-4. 38. Woosley R.L., Chen Y., Freiman J.P., et al. Mechanisms of the cardiotoxic actions of terfenadine. JAMA. 1993;269:1532–36. Doi: 10.1001 / jama.1993.03500120070028. 39. Curtis L.H., Ostbye T., Sendersky V., et al. Prescription of QT-prolonging drugs in a cohort of about 5 million outpatients. Am J Med. 2003;114:135–41. Doi: 10.1016/S0002-9343 (02)01455-9. 40. Tay K.Y., Ewald M.B., Bourgeois F.T. Use of QT-prolonging medications in US emergency departments, 1995-2009. Pharmacoepidemiol Drug Saf. 2014;23:9–17. Doi: 10.1002/pds.3455. 41. Takeuchi H. 42. Niemeijer M.N., van den Berg M.E., Franco O.H.,et al. Drugs and ventricular repolarization in a general population: the Rotterdam Study. Pharmacoepidemiol Drug Saf. 2015;24:1036–41. Doi: 10.1016/j.hrthm.2015.07.011. 43. Nakano Y., Shimizu W. Genetics of long-QT syndrome. J Hum Genet. 2016;61:51–5. Doi: 10.1038/jhg.2015.74. 44. Yang P., Kanki H., Drolet B., et al. Allelic variants in long-QT disease genes in patients with drug-associated torsades de pointes. Circulation. 2002;105:1943–48. Doi:10.1161/01.CIR.0000014448.19052.4C. 45. Остроумова О.Д., Голобородова И.В. Лекарственно-индуцированное удлинение интервала QT: распространенность, факторы риска, лечение и профилактика. Consilium medicum. 2019;5:62–67. 46. Drew B.J., Ackerman M.J., Punk M., еt al. On behalf of the American Heart Association Acute Cardiac Care Committee of the Council on Clintcal Cardiology, the Council on Cardiovascular Nursing, and the American College of Cardiology Poundation, Prevention of torsade de pointes in hospital settings: a acientific statement from the American Heart Association and the American College of Cardiology Foundation. 47. Neumar R.W., Otto C.W., Link M.S., et al. Part 8: adult advanced cardiovascular life support: 2010. American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2010;122(3):S729–67. Doi: 10.1161/CIRCULATIONAHA.110.970988. Pharmacoepidemiol Drug Saf. 2008;17:587–92. Doi: 10.1002/pds.1607.
Pharmacoepidemiol Drug Saf. 2008;17:587–92. Doi: 10.1002/pds.1607. , van der Voort P.H.J. Corrected QT-interval prolongation and variability in intensive care patients. J Crit Care. 2014;29:835–39. Doi: 10.1016/j.jcrc.2014.05.005.
, van der Voort P.H.J. Corrected QT-interval prolongation and variability in intensive care patients. J Crit Care. 2014;29:835–39. Doi: 10.1016/j.jcrc.2014.05.005.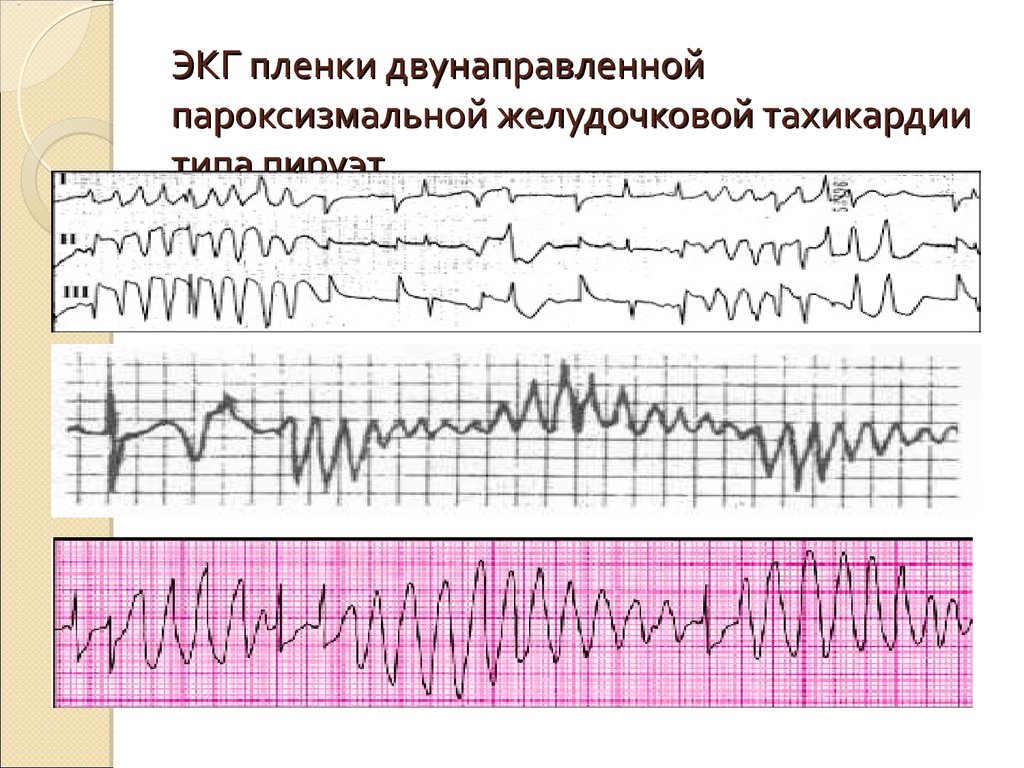 Cardiovasc Psychiatry Neurol. 2013;2013:647476. Doi: 10.1155/2013/647476.
Cardiovasc Psychiatry Neurol. 2013;2013:647476. Doi: 10.1155/2013/647476. N Engl J Med. 2004;351:1089–96. Doi:10.1056 / NEJMoa040582.
N Engl J Med. 2004;351:1089–96. Doi:10.1056 / NEJMoa040582. Prospective longitudinal study of 328 families. Circulation. 1991;84:1136–44.
Prospective longitudinal study of 328 families. Circulation. 1991;84:1136–44. 2002;53:740–51. Doi: 10.1016/S0008-6363 (01)00429-1.
2002;53:740–51. Doi: 10.1016/S0008-6363 (01)00429-1.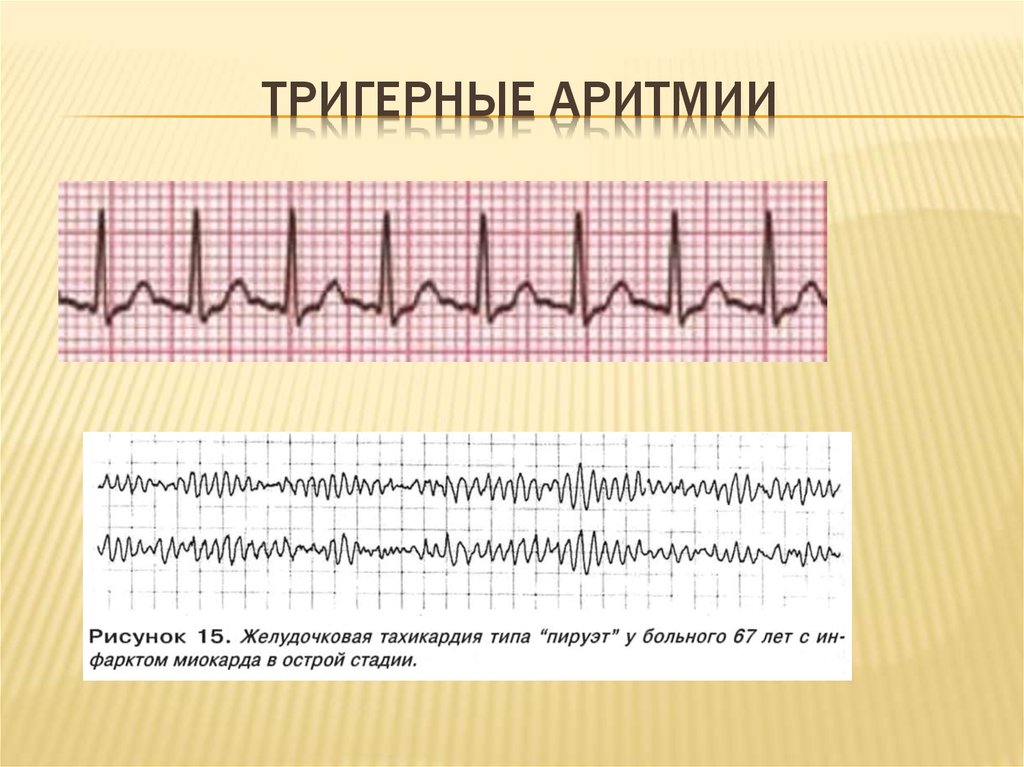 1001 / jama.280.20.1774.
1001 / jama.280.20.1774.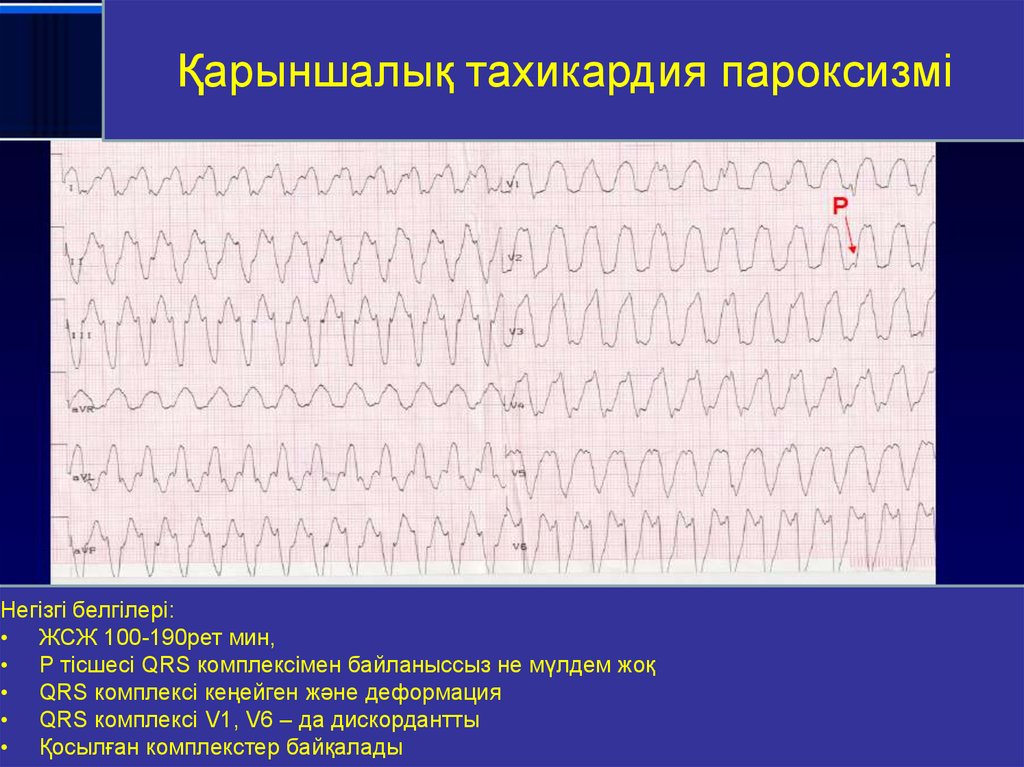 , Suzuki T., Remington G., et al. Antipsychotic polypharmacy and corrected QT interval: a systematic review. Can J Psychiatr. 2015;60:215–22. Doi: 10.1177/070674371506000503.
, Suzuki T., Remington G., et al. Antipsychotic polypharmacy and corrected QT interval: a systematic review. Can J Psychiatr. 2015;60:215–22. Doi: 10.1177/070674371506000503.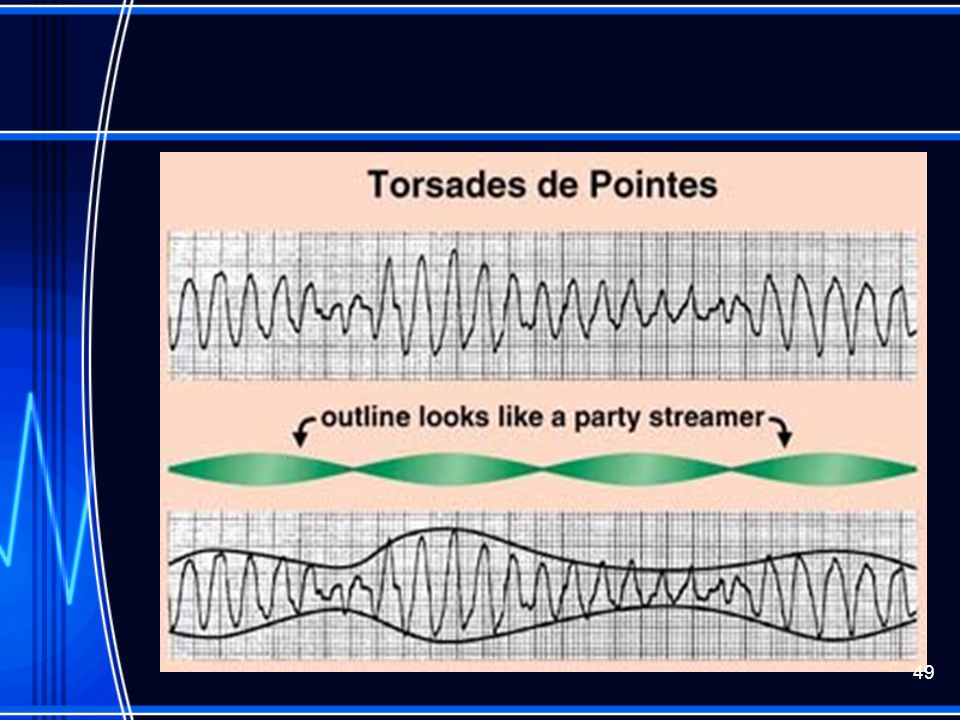 Circulation. 2010;121:1047–60.
Circulation. 2010;121:1047–60.
Автор для связи: О.Д. Остроумова, д.м.н., профессор кафедры факультетской терапии и профболезней, Московский государственный медико-стоматологический университет им. А.И. Евдокимова, Москва, Россия; е-mail: [email protected] ORCID:
Адрес: 127423, Россия, Москва, ул. Делегатская, 20/1
О.Д. Остроумова (Olga D. Ostroumova) https://orcid.org/0000-0002-0795-8225
И.В. Голобородова (Irina V. Goloborodova) https://orcid.org/0000-0003-4583-6330
|
|
17 мая 2021 г.
Отправить по:
 05.2021
05.2021 Каталожные номера
Исследование PIROUETTE показало, что пирфенидон полезен для уменьшения фиброза миокарда у пациентов с HFpEF.
Цель исследования состояла в том, чтобы сравнить пирфенидон, антифиброзный агент, с плацебо у пациентов с сердечной недостаточностью с сохраненной фракцией выброса (HFpEF).
Первичный результат, изменение внеклеточного объема миокарда (%) от исходного уровня до 52 недель составил -0,7 в группе пирфенидона по сравнению с 0,5 в группе плацебо (p = 0,009).
Вторичные исходы:
У пациентов с HFpEF пирфенидон оказался полезным. Это лекарство было связано с умеренным снижением миокардиального фиброза, по оценке МРТ сердца, по сравнению с плацебо. Клиническая значимость этого вывода неизвестна.
Клиническая значимость этого вывода неизвестна.
Представлено доктором Кристофером Миллером на виртуальной ежегодной научной сессии Американского колледжа кардиологов (ACC 2021), 17 мая 2021 г.
Отправить по:
Клинические темы: Антикоагулянтная терапия, гериатрическая кардиология, сердечная недостаточность и кардиомиопатии, неинвазивная визуализация, острая сердечная недостаточность, сердечная недостаточность и сердечные биомаркеры, магнитно-резонансная томография Диастола, Фиброз, Гериатрия, Сердечная недостаточность, Магнитно-резонансная томография, Натрийуретический пептид, головной мозг, Фрагменты пептидов, Объем удара
< Вернуться к списку
1. Butler J, Hamo CE, Udelson JE, O’Connor C, Sabbah HN, Metra M, et al. Переоценка клинических испытаний сердечной недостаточности II фазы: согласованные рекомендации. Цирк Сердечная недостаточность. 2017;10(4):e003800. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Butler J, Hamo CE, Udelson JE, O’Connor C, Sabbah HN, Metra M, et al. Переоценка клинических испытаний сердечной недостаточности II фазы: согласованные рекомендации. Цирк Сердечная недостаточность. 2017;10(4):e003800. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Vaduganathan M, Greene SJ, Ambrosy AP, Gheorghiade M, Butler J. Несоответствие между фазами II и III испытаний препаратов для лечения сердечной недостаточности. Нат Рев Кардиол. 2013;10(2):85–9.7. [PubMed] [Google Scholar]
3. Батлер Дж., Фонаров Г.К., Георгиаде М. Стратегии и возможности разработки лекарств при сердечной недостаточности. ДЖАМА. 2013;309(15):1593–1594. [PubMed] [Google Scholar]
4. Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, González-Juanatey JR, Harjola VP, Jankowska EA, Jessup M, Linde C, Nihoyannopoulos P, Parissis JT, Pieske B, Riley JP, Rosano GM, Ruilope LM, Ruschitzka F, Rutten FH, van der Meer P, авторы/члены рабочей группы. Рецензенты документа, 2016 г.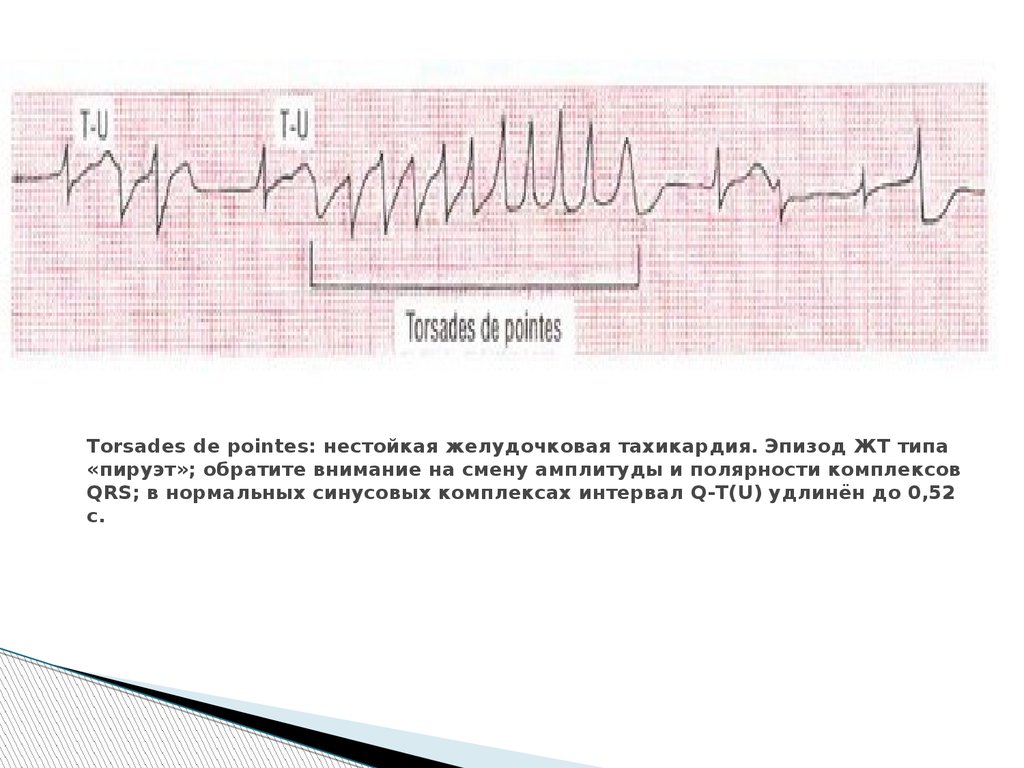 , рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности: рабочая группа по диагностике и лечению острой и хронической сердечной недостаточности Европейского общества кардиологов (ESC). Разработан при особом участии Ассоциации сердечной недостаточности (HFA) Европейского общества кардиологов. Сердечная недостаточность Eur J. 2016;18(8):891–975. [PubMed] [Google Scholar]
, рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности: рабочая группа по диагностике и лечению острой и хронической сердечной недостаточности Европейского общества кардиологов (ESC). Разработан при особом участии Ассоциации сердечной недостаточности (HFA) Европейского общества кардиологов. Сердечная недостаточность Eur J. 2016;18(8):891–975. [PubMed] [Google Scholar]
5. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE, Drazner MH, et al. Руководство ACCF/AHA 2013 г. по лечению сердечной недостаточности: краткое изложение. J Am Coll Кардиол. 2013;62(16):1495–1539. [PubMed] [Google Scholar]
6. Owan TE, Hodge DO, Herges RM, Jacobsen SJ, Roger VL, Redfield MM. Тенденции распространенности и исходов сердечной недостаточности с сохраненной фракцией выброса. N Engl J Med. 2006;355(3):251–259. [PubMed] [Академия Google]
7. Бхатия Р.С., Ту Дж.В., Ли Д.С., Остин П.С., Фанг Дж., Хаузи А., Гонг И., Лю П.П. Исход сердечной недостаточности с сохраненной фракцией выброса в популяционном исследовании.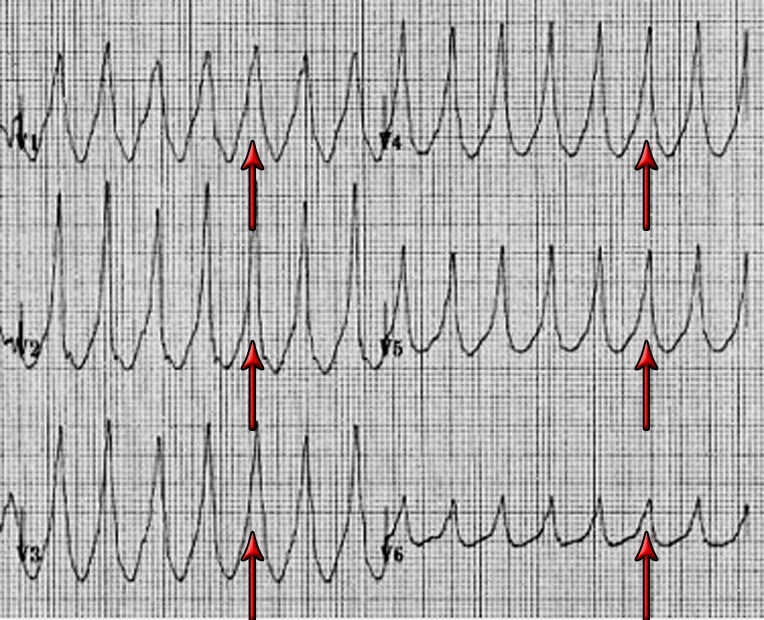 N Engl J Med. 2006;355(3):260–269. [PubMed] [Google Scholar]
N Engl J Med. 2006;355(3):260–269. [PubMed] [Google Scholar]
8. Steinberg BA, Zhao X, Heidenreich PA, Peterson ED, Bhatt DL, Cannon CP, Hernandez AF, Fonarow GC, Get With the Guidelines, Научно-консультативный комитет и исследователи Тенденции у пациентов, госпитализированных с сердцем недостаточность и сохраненная фракция выброса левого желудочка: распространенность, лечение и исходы. Тираж. 2012;126(1):65–75. [PubMed] [Академия Google]
9. Campbell RT, Jhund PS, Castagno D, Hawkins NM, Petrie MC, McMurray JJV. Что мы узнали о пациентах с сердечной недостаточностью и сохраненной фракцией выброса из DIG-PEF, CHARM-preserve и I-PRESERVE? J Am Coll Кардиол. 2012;60(23):2349–2356. [PubMed] [Google Scholar]
10. Yusuf S, Pfeffer MA, Swedberg K, Granger CB, Held P, McMurray JJV, et al. Эффекты кандесартана у пациентов с хронической сердечной недостаточностью и сохраненной фракцией выброса левого желудочка: исследование CHARM-Preserved. Ланцет. 2003;362(9386): 777–781. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
11. Питт Б., Пфеффер М.А., Ассманн С.Ф., Буано Р., Ананд И.С., Клаггетт Б., Клауселл Н., Десаи А.С., Диаз Р., Флег Дж.Л., Гордеев И., Харти Б., Хайтнер Дж.Ф., Kenwood CT, Lewis EF, O'Meara E, Probstfield JL, Shaburishvili T, Shah SJ, Solomon SD, Sweitzer NK, Yang S, McKinlay S, TOPCAT Исследователи Спиронолактон при сердечной недостаточности с сохраненной фракцией выброса. N Engl J Med. 2014;370(15):1383–1392. [PubMed] [Google Scholar]
12. Massie BM, Carson PE, McMurray JJ, Komajda M, McKelvie R, Zile MR, Anderson S, Donovan M, Iverson E, Staiger C, Ptaszynska A, I-PRESERVE Исследователи Irbesartan in пациенты с сердечной недостаточностью и сохранной фракцией выброса. N Engl J Med. 2008;359(23): 2456–2467. [PubMed] [Google Scholar]
13. Ahmed A, Rich MW, Fleg JL, Zile MR, Young JB, Kitzman DW, Love TE, Aronow WS, Adams KF, Jr, Gheorghiade M. Влияние дигоксина на заболеваемость и смертность при диастолической сердечной недостаточности: исследование исследовательской группы Ancillary Digitalis.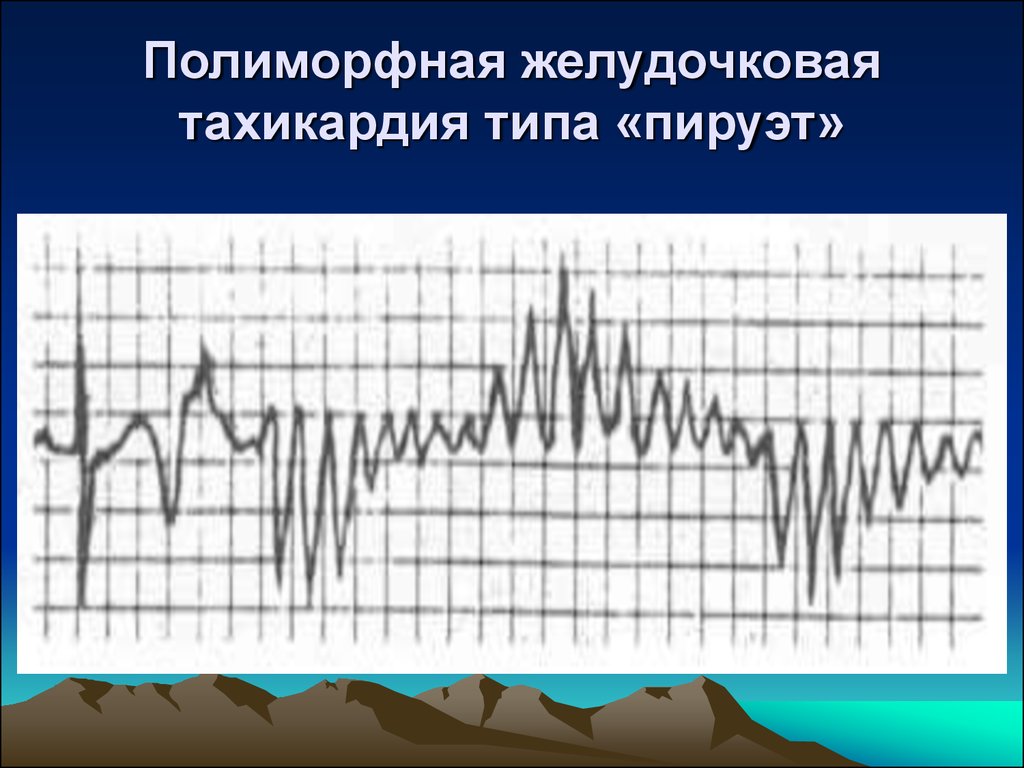 Тираж. 2006;114(5):397–403. [PMC free article] [PubMed] [Google Scholar]
Тираж. 2006;114(5):397–403. [PMC free article] [PubMed] [Google Scholar]
14. Клеланд Дж. Г., Тендера М., Адамус Дж., Фримантл Н., Полонски Л., Тейлор Дж., PEP-CHF Исследователи Периндоприл у пожилых людей с хронической сердечной недостаточностью (PEP- ХСН) исследование. Европейское сердце Дж. 2006; 27 (19)): 2338–2345. [PubMed] [Google Scholar]
15. Borbely A, van der Velden J, Papp Z, Bronzwaer JG, Edes I, Stienen GJ, et al. Жесткость кардиомиоцитов при диастолической сердечной недостаточности. Тираж. 2005;111(6):774–781. [PubMed] [Google Scholar]
16. van Heerebeek L, Borbely A, Niessen HW, Bronzwaer JG, van der Velden J, Stienen GJ, et al. Структура и функция миокарда различаются при систолической и диастолической сердечной недостаточности. Тираж. 2006; 113(16):1966–1973. [PubMed] [Академия Google]
17. van Heerebeek L, Hamdani N, Falcao-Pires I, Leite-Moreira AF, Begieneman MP, Bronzwaer JG, et al. Низкая активность миокардиальной протеинкиназы G при сердечной недостаточности с сохраненной фракцией выброса.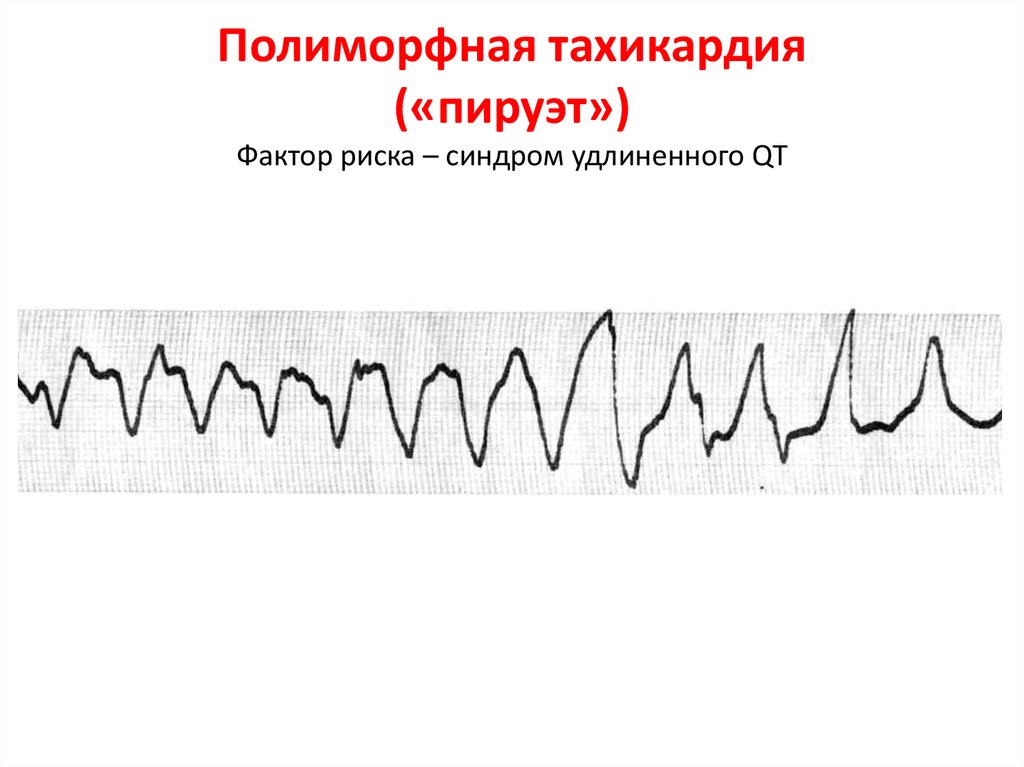 Тираж. 2012;126(7):830–839. [PubMed] [Google Scholar]
Тираж. 2012;126(7):830–839. [PubMed] [Google Scholar]
18. Zile MR, Baicu CF, Ikonomidis JS, Stroud RE, Nietert PJ, Bradshaw AD, et al. Жесткость миокарда у больных с сердечной недостаточностью и сохранной фракцией выброса: вклад коллагена и титина. Тираж. 2015;131(14):1247–1259. [Бесплатная статья PMC] [PubMed] [Google Scholar]
19. Роммель К.П., фон Редер М., Латусцинский К., Оберуек С., Блазек С., Фенглер К., Беслер С., Сандри М., Люкке С., Гутберлет М., Линке А., Шулер Г., Лурц П. Фракция внеклеточного объема для характеристики пациентов с сердечной недостаточностью и сохраненной фракцией выброса. J Am Coll Кардиол. 2016;67(15):1815–1825. [PubMed] [Google Scholar]
20. Шелберт Э.Б., Вонг Т.С., Георгиаде М. Подумайте о мелочах и изучите составляющие гипертрофии левого желудочка и сердечной недостаточности: кардиомиоциты по сравнению с фибробластами, коллагеном и капиллярами в интерстиции. Ассоциация J Am Heart. 2015;4(9):e002491. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Мохаммед С.Ф., Хуссейн С., Мирзоев С.А., Эдвардс В.Д., Малешевский Дж.Дж., Редфилд М.М. Коронарное микрососудистое разрежение и фиброз миокарда при сердечной недостаточности с сохраненной фракцией выброса. Тираж. 2015;131(6):550–559. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Мохаммед С.Ф., Хуссейн С., Мирзоев С.А., Эдвардс В.Д., Малешевский Дж.Дж., Редфилд М.М. Коронарное микрососудистое разрежение и фиброз миокарда при сердечной недостаточности с сохраненной фракцией выброса. Тираж. 2015;131(6):550–559. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Шелберт Э.Б., Фридман Ю., Вонг Т.С., Абу Дайя Х., Пилер К.М., Кадаккал А., Миллер К.А., Угандер М., Маанджа М., Келлман П., Шах Д.Дж., Абебе К.З., Саймон М.А., Кварта Г., Сенни М., Батлер Дж., Диез Дж., Редфилд М.М., Георгиаде М. Временная связь между фиброзом миокарда и сердечной недостаточностью с сохраненной фракцией выброса: связь с исходной тяжестью заболевания и последующим исходом. ДЖАМА Кардиол. 2017;2(9): 995–1006. [Бесплатная статья PMC] [PubMed] [Google Scholar]
23. Интерстициальный фиброз, функциональное состояние и исходы при сердечной недостаточности с сохраненной фракцией выброса: результаты проспективного исследования магнитно-резонансной томографии сердца. Циркулярная кардиоваскулярная визуализация. 2016;9(12):e005277. [PubMed]
2016;9(12):e005277. [PubMed]
24. Brilla CG, Funck RC, Rupp H. Опосредованная лизиноприлом регрессия миокардиального фиброза у пациентов с гипертонической болезнью сердца. Тираж. 2000;102(12):1388–1393. [PubMed] [Академия Google]
25. Диес Дж., Керехета Р., Лопес Б., Гонсалес А., Ларман М., Мартинес Убаго Дж.Л. Лозартан-зависимая регрессия миокардиального фиброза связана со снижением жесткости камеры левого желудочка у больных АГ. Тираж. 2002;105(21):2512–2517. [PubMed] [Google Scholar]
26. Изава Х., Мурохара Т., Нагата К., Исобе С., Асано Х., Амано Т., Ичихара С., Като Т., Ошима С., Мурасе Й., Иино С., Обата К., Нода А., Окумура К., Йокота М. Антагонизм к минералокортикоидным рецепторам улучшает диастолическую дисфункцию левого желудочка и фиброз миокарда у пациентов с легкими симптомами идиопатической дилатационной кардиомиопатии: пилотное исследование. Тираж. 2005;112(19): 2940–2945. [PubMed] [Google Scholar]
27. Schwartzkopff B, Brehm M, Mundhenke M, Strauer BE. Восстановление коронарных артериол после лечения периндоприлом при гипертонической болезни сердца. Гипертония. 2000;36(2):220–225. [PubMed] [Google Scholar]
Восстановление коронарных артериол после лечения периндоприлом при гипертонической болезни сердца. Гипертония. 2000;36(2):220–225. [PubMed] [Google Scholar]
28. Messroghli DR, Moon JC, Ferreira VM, Grosse-Wortmann L, He T, Kellman P, et al. Клинические рекомендации по кардиоваскулярному магнитно-резонансному картированию T1, T2, T2* и внеклеточного объема: консенсусное заявление Общества сердечно-сосудистого магнитного резонанса (SCMR), одобренное Европейской ассоциацией сердечно-сосудистой визуализации (EACVI) J Cardiovasc Magn Reson. 2017;19(1):75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Flett AS, Hayward MP, Ashworth MT, Hansen MS, Taylor AM, Elliott PM, McGregor C, Moon JC. Равновесный контрастный сердечно-сосудистый магнитный резонанс для измерения диффузного миокардиального фиброза: предварительная проверка на людях. Тираж. 2010;122(2):138–144. [PubMed] [Google Scholar]
30. Миллер К.А., Нэйш Дж.Х., Бишоп П., Куттс Г., Кларк Д., Чжао С., Рэй С.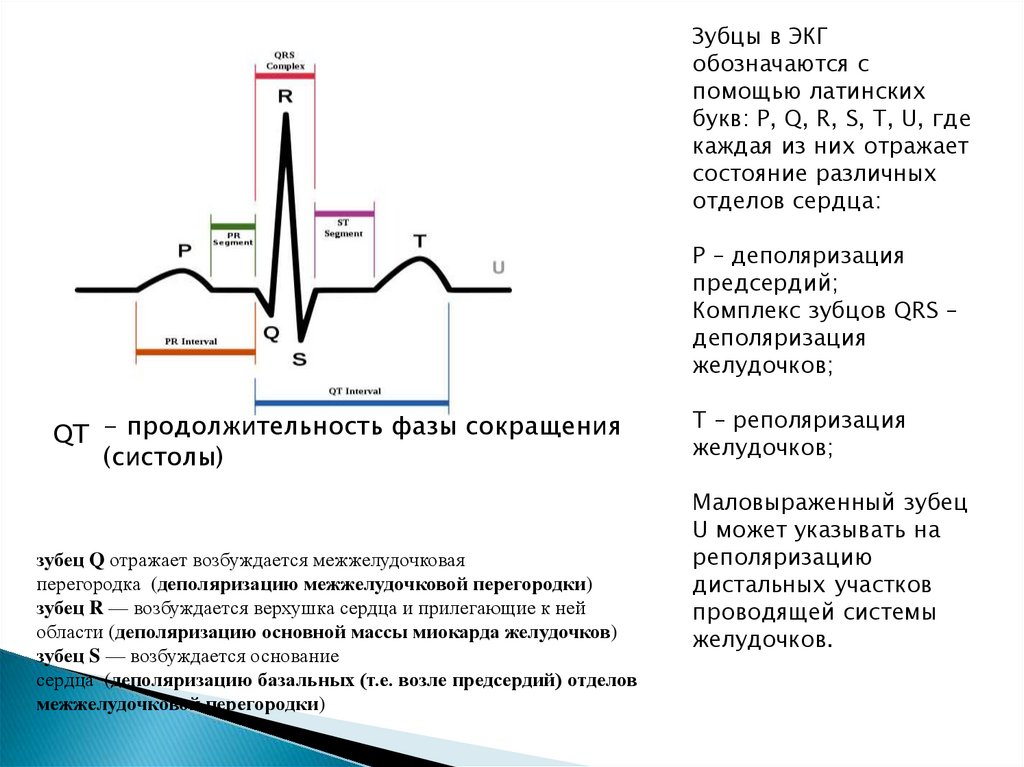 Г., Йонан Н., Уильямс С.Г., Флетт А.С., Мун Дж.С., Грейзер А., Паркер Г.Дж.М., Шмитт М. Всесторонняя проверка сердечно-сосудистых методов магнитного резонанса для оценки внеклеточного объема миокарда. Circ Cardiovas Imaging. 2013;6(3):373–383. [PubMed] [Академия Google]
Г., Йонан Н., Уильямс С.Г., Флетт А.С., Мун Дж.С., Грейзер А., Паркер Г.Дж.М., Шмитт М. Всесторонняя проверка сердечно-сосудистых методов магнитного резонанса для оценки внеклеточного объема миокарда. Circ Cardiovas Imaging. 2013;6(3):373–383. [PubMed] [Академия Google]
31. Хейдари Б., Абдулла С., Поттала Дж. В., Шах Р., Аббаси С., Мандри Д., Фрэнсис С. А., Лумиш Х., Гошхайра Б. Б., Хоффманн У., Аппельбаум Э., Фэн Дж. Х., Бланкштейн Р., Штайнер М., МакКоннелл Дж. П., Харрис В., Антман Э.М., Йерош-Херольд М., Квонг Р.Ю. Влияние этиловых эфиров омега-3 кислот на ремоделирование левого желудочка после острого инфаркта миокарда: рандомизированное клиническое исследование OMEGA-REMODEL. Тираж. 2016;134(5):378–391. [Статья бесплатно PMC] [PubMed] [Google Scholar]
32. Шелберт Э.Б., Саббах Х.Н., Батлер Дж., Георгиаде М. Использование внеклеточного объема сердечно-сосудистых магнитно-резонансных измерений миокардиального фиброза для разработки новых методов лечения. Циркулярная кардиоваскулярная визуализация.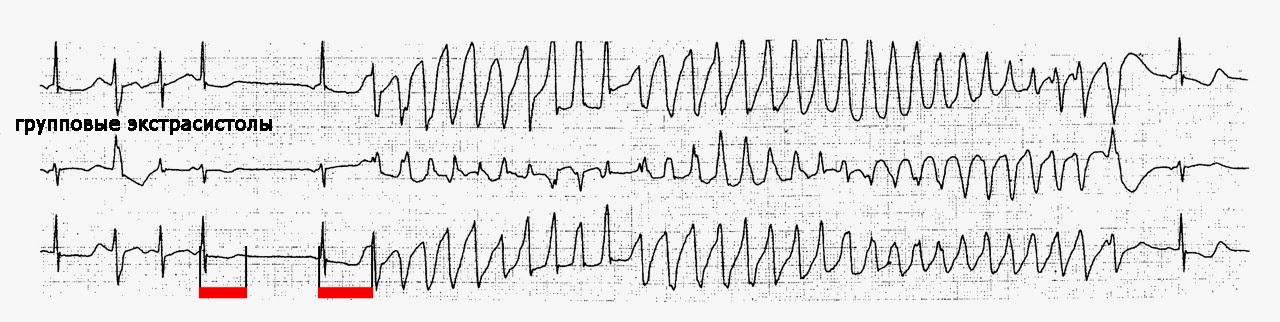 2017;10(6):e005619. [PubMed]
2017;10(6):e005619. [PubMed]
33. Ahmad T, Fiuzat M, Felker GM, O'Connor C. Новые биомаркеры при хронической сердечной недостаточности. Нат Рев Кардиол. 2012;9(6):347–359. [PubMed] [Google Scholar]
34. Обоката М., Кейн Г.К., Редди Ю.Н., Олсон Т.П., Меленовский В., Борлауг Б.А. Роль диастолического нагрузочного теста в оценке сердечной недостаточности с сохраненной фракцией выброса: симультанное инвазивно-эхокардиографическое исследование. Тираж. 2017;135(9):825–838. [Бесплатная статья PMC] [PubMed] [Google Scholar]
35. Танигучи Х., Эбина М., Кондо Ю., Огура Т., Адзума А., Суга М., Тагучи Ю., Такахаши Х., Наката К., Сато А., Такеучи М., Рагху G, Kudoh S, Nukiwa T, Группа клинических исследований пирфенидона в Японии Пирфенидон при идиопатическом легочном фиброзе. Европейское дыхание Дж. 2010; 35 (4): 821–829.. [PubMed] [Google Scholar]
36. King TE, Jr, Bradford WZ, Castro-Bernardini S, Fagan EA, Glaspole I, Glassberg MK, et al. Испытание фазы 3 пирфенидона у пациентов с идиопатическим легочным фиброзом.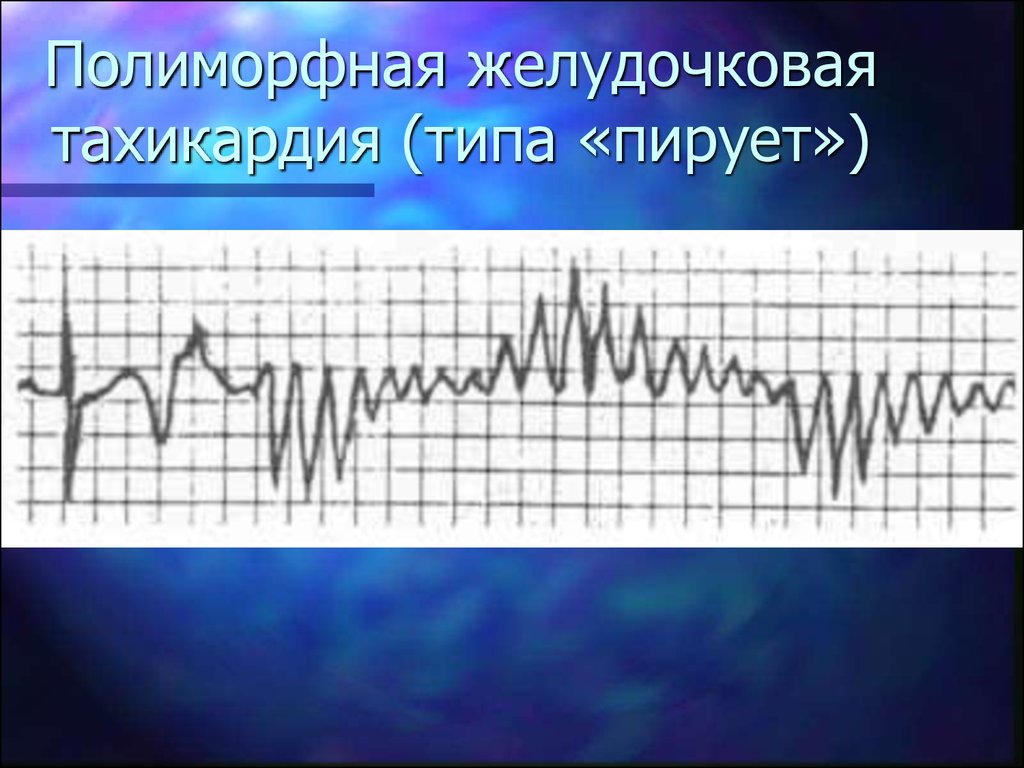 N Engl J Med. 2014;370(22):2083–2092. [PubMed] [Google Scholar]
N Engl J Med. 2014;370(22):2083–2092. [PubMed] [Google Scholar]
37. Noble PW, Albera C, Bradford WZ, Costabel U, Glassberg MK, Kardatzke D, King TE, Jr, Lancaster L, Sahn SA, Szwarcberg J, Valeyre D, du Bois RM. Пирфенидон у пациентов с идиопатическим легочным фиброзом (CAPACITY): два рандомизированных исследования. Ланцет. 2011;377(9779): 1760–1769. [PubMed] [Google Scholar]
38. Schaefer CJ, Ruhrmund DW, PAN L, Seiwert SD, Kossen K. Антифибротическая активность пирфенидона на животных моделях. Eur Respir Rev. 2011;20(120):85–97. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Conte E, Gili E, Fagone E, Fruciano M, Iemmolo M, Vancheri C. Влияние пирфенидона на пролиферацию, TGF-бета-индуцированную дифференцировку миофибробластов и фиброгенную активность первичных фибробластов легких человека. Eur J Pharm Sci. 2014; 58:13–19. [PubMed] [Google Scholar]
40. Канеко М., Иноуэ Х., Наказава Р., Адзума Н., Судзуки М., Ямаути С., Марголин С.Б., Цубота К. , Сайто И. Пирфенидон индуцирует молекулу межклеточной адгезии-1 (ICAM-1) подавление культивируемых синовиальных фибробластов человека. Клин Эксп Иммунол. 1998;113(1):72–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
, Сайто И. Пирфенидон индуцирует молекулу межклеточной адгезии-1 (ICAM-1) подавление культивируемых синовиальных фибробластов человека. Клин Эксп Иммунол. 1998;113(1):72–76. [Бесплатная статья PMC] [PubMed] [Google Scholar]
41. Shi Q, Liu X, Bai Y, Cui C, Li J, Li Y, Hu S, Wei Y. Влияние пирфенидона in vitro на сердечные фибробласты: пролиферация , дифференцировка миофибробластов, миграция и секреция цитокинов. ПЛОС ОДИН. 2011;6(11):e28134. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Wang Y, Wu Y, Chen J, Zhao S, Li H. Пирфенидон ослабляет сердечный фиброз в мышиной модели TAC-индуцированного ремоделирования левого желудочка путем подавления образования воспалительных процессов NLRP3. Кардиология. 2013;126(1):1–11. [PubMed] [Google Scholar]
43. Гири С.Н., Аль-Баяти М.А., Ду Х, Шелегле Э., Мор Ф.К., Марголин С.Б. Улучшение сердечной и почечной токсичности, вызванной доксорубицином, с помощью пирфенидона у крыс. Рак Chemother Pharmacol. 2004;53(2):141–150.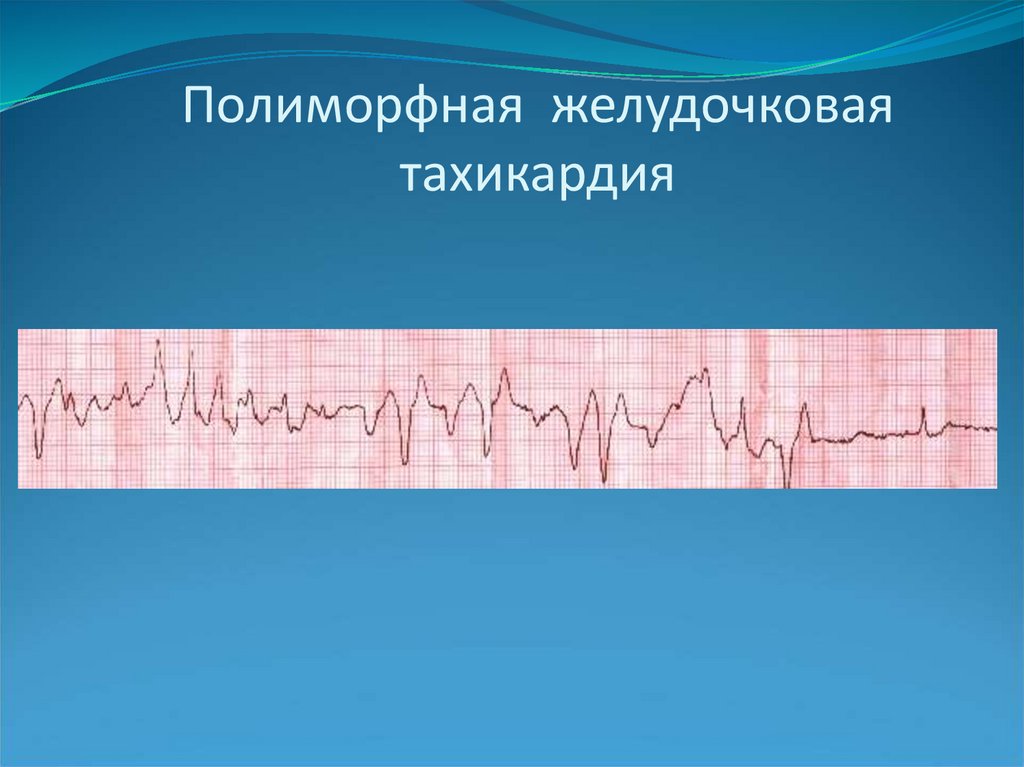 [PubMed] [Академия Google]
[PubMed] [Академия Google]
44. Ван Эрп С., Ирвин Н.Г., Хоуи А.Дж. Длительное введение пирфенидона улучшает сердечную функцию у мышей mdx. Мышечный нерв. 2006;34(3):327–334. [PubMed] [Google Scholar]
45. Lee KW, Everett TH, Rahmutula D, Guerra JM, Wilson E, Ding C, et al. Пирфенидон предотвращает развитие уязвимого субстрата для фибрилляции предсердий в собачьей модели сердечной недостаточности. Тираж. 2006;114(16):1703–1712. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46. Miric G, Dallemagne C, Endre Z, Margolin S, Taylor SM, Brown L. Обращение сердечного и почечного фиброза с помощью пирфенидона и спиронолактона у крыс со стрептозотоцином и диабетом. Бр Дж. Фармакол. 2001; 133(5):687–69.4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47. Mirkovic S, Seymour A-ML, Fenning A, Strachan A, Margolin SB, Taylor SM, Brown L. Ослабление сердечного фиброза пирфенидоном и амилоридом в DOCA-соли гипертензивные крысы. Бр Дж. Фармакол. 2002;135(4):961–968.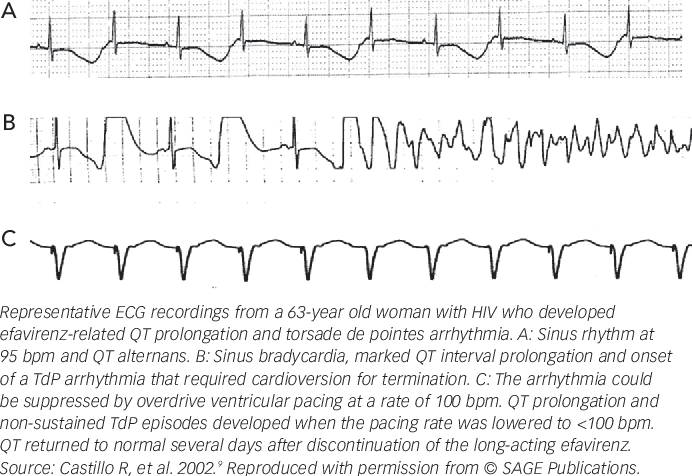 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
48. Yamazaki T, Yamashita N, Izumi Y, Nakamura Y, Shiota M, Hanatani A, Shimada K, Muro T, Iwao H, Yoshiyama M. Противофиброзный агент пирфенидон ингибирует гипертрофию сердца, вызванную ангиотензином II, у мышей. Гипертония Рез. 2012;35(1):34–40. [PubMed] [Академия Google]
49. Батлер Дж., Хамо К.Э., Удельсон Дж.Е., О'Коннор С., Саббах Х.Н., Метра М. и др. Переоценка клинических испытаний сердечной недостаточности II фазы: согласованные рекомендации. Круговая сердечная недостаточность. 2017;10(4):e003800. [Бесплатная статья PMC] [PubMed]
50. Nguyen DT, Ding C, Wilson E, Marcus GM, Olgin JE. Пирфенидон смягчает фиброз и дисфункцию левого желудочка после инфаркта миокарда и уменьшает аритмии. Сердечного ритма. 2010;7(10):1438–1445. [PubMed] [Google Scholar]
51. Огура Т., Адзума А., Иноуэ Ю., Танигути Х., Чида К., Бандо М., Ниими Ю., Какутани С., Суга М., Сугияма Ю., Кудо С., Нукива Т. Все дела постмаркетинговое наблюдение за 1371 пациентом, получавшим пирфенидон по поводу идиопатического легочного фиброза.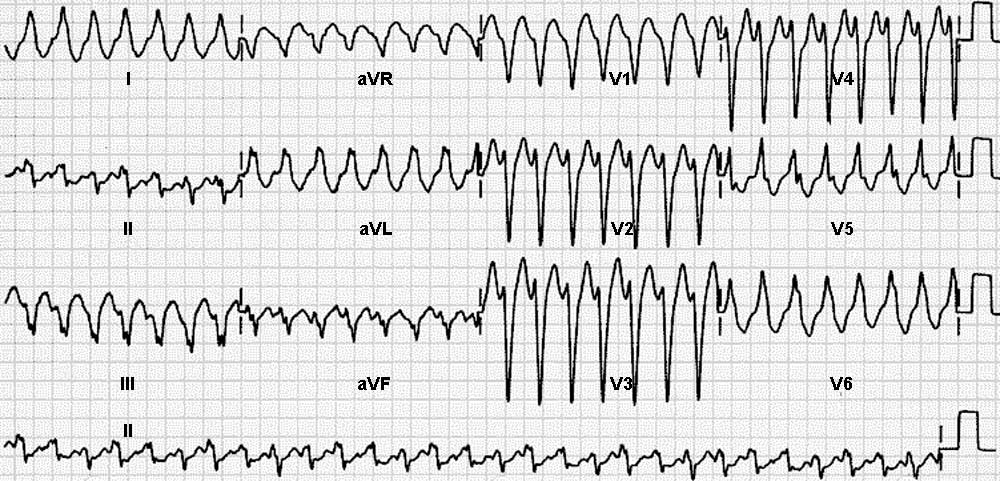 Респир Расследование. 2015;53(5):232–241. [PubMed] [Академия Google]
Респир Расследование. 2015;53(5):232–241. [PubMed] [Академия Google]
52. Phan TT, Abozguia K, Nallur Shivu G, Mahadevan G, Ahmed I, Williams L, Dwivedi G, Patel K, Steendijk P, Ashrafian H, Henning A, Frenneaux M. Сердечная недостаточность с сохраненной фракцией выброса характеризуется динамическое нарушение активного расслабления и сокращения левого желудочка при нагрузке и связанное с энергодефицитом миокарда. J Am Coll Кардиол. 2009;54(5):402–409. [PubMed] [Google Scholar]
53. Garg R, Rao AD, Baimas-George M, Hurwitz S, Foster C, Shah RV, Jerosch-Herold M, Kwong RY, di Carli MF, Adler GK. Блокада минералокортикоидных рецепторов улучшает коронарную микрососудистую функцию у лиц с сахарным диабетом 2 типа. Сахарный диабет. 2014;64(1):236–242. [Бесплатная статья PMC] [PubMed] [Google Scholar]
54. Хадсмит Л.Э., Нойбауэр С. Магнитно-резонансная спектроскопия при заболеваниях миокарда. JACC Cardiovasc Imaging. 2009;2(1):87–96. [PubMed] [Google Scholar]
55. Бидл Р.М., Уильямс Л.К., Кюль М., Боуотер С., Абозгия К., Лейва Ф., Юсеф З., Вагенмакерс А.Дж.М., Тис Ф., Горовиц Дж., Френно М.П. Улучшение сердечной энергетики пергексилином при сердечной недостаточности вследствие дилатационной кардиомиопатии. Сердечная недостаточность JACC. 2015;3(3):202–211. [PubMed] [Google Scholar]
Бидл Р.М., Уильямс Л.К., Кюль М., Боуотер С., Абозгия К., Лейва Ф., Юсеф З., Вагенмакерс А.Дж.М., Тис Ф., Горовиц Дж., Френно М.П. Улучшение сердечной энергетики пергексилином при сердечной недостаточности вследствие дилатационной кардиомиопатии. Сердечная недостаточность JACC. 2015;3(3):202–211. [PubMed] [Google Scholar]
56. Бидл Р.М., Уильямс Л.К., Абозгия К., Патель К., Леон Ф.Л., Юсеф З., Вагенмакерс А., Френно М.П. Метаболические манипуляции при хронической сердечной недостаточности: протокол исследования для рандомизированного контролируемого исследования. Испытания. 2011;12(1):140. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Abozguia K, Elliott P, McKenna W, Phan TT, Nallur-Shivu G, Ahmed I, Maher AR, Kaur K, Taylor J, Henning A, Ashrafian H, Watkins H, Frenneaux M. Метаболический модулятор пергексилин корректирует энергию дефицит и улучшает толерантность к физической нагрузке при симптоматической гипертрофической кардиомиопатии. Тираж. 2010;122(16):1562–1569. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
58. Lewis GA, Schelbert EB, Williams SG, Cunnington C, Ahmed F, McDonagh TA, et al. Биологические фенотипы сердечной недостаточности с сохраненной фракцией выброса. J Am Coll Кардиол. 2017;70(17):2186–2200. [PubMed] [Академия Google]
59. Сенни М., Паулюс В.Дж., Гавацци А., Фрейзер А.Г., Диез Дж., Соломон С.Д., Смит О.А., Гуацци М., Лам CSP, Маджиони А.П., Чоп К., Метра М., Хаммель С.Л., Эдельманн Ф., Амброзио Г., Стюарт Коутс А.Дж., Филиппатос Г.С., Георгиаде М., Анкер С.Д., Леви Д., Пфеффер М.А., Стоуг В.Г., Писке Б.М. Новые стратегии лечения сердечной недостаточности с сохраненной фракцией выброса: важность таргетной терапии фенотипов сердечной недостаточности. Европейское сердце J. 2014; 35 (40): 2797–2815. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Treibel TA, Kozor R, Schofield R, Benedetti G, Fontana M, Bhuva AN, Sheikh A, López B, Gonzalez A, Manisty C, Lloyd G, Kellman П., Диес Дж., Мун Дж. К. Обратное ремоделирование миокарда после протезирования клапана у пациентов с аортальным стенозом. J Am Coll Кардиол. 2018;71(8):860–871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
J Am Coll Кардиол. 2018;71(8):860–871. [Бесплатная статья PMC] [PubMed] [Google Scholar]
61. Фелкер Г.М., Анстром К.Дж., Адамс К.Ф., Езековиц Дж.А., Фьюзат М., Хьюстон-Миллер Н., Джануцци Дж.Л., младший, Марк Д.Б., Пина И.Л., Пассмор Г., Уэллан Д.Дж., Ян Х., Купер Л.С., Лейфер Э.С., Десвин-Никенс П., О'Коннор К.М. Влияние терапии под контролем натрийуретического пептида на госпитализацию или смертность от сердечно-сосудистых заболеваний у пациентов с высоким риском сердечной недостаточности и сниженной фракцией выброса: рандомизированное клиническое исследование. ДЖАМА. 2017;318(8):713–720. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Kelly JP, Mentz RJ, Mebazaa A, Voors AA, Butler J, Roessig L, Fiuzat M, Zannad F, Pitt B, O'Connor CM, Lam CSP . Клинические испытания отбора пациентов с сердечной недостаточностью с сохраненной фракцией выброса. J Am Coll Кардиол. 2015;65(16):1668–1682. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Соломон С.Д.