2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Подпишитесь на нашу рассылку ”Контекст”: она поможет вам разобраться в событиях.
Автор фото, Kirill Kukhmar/TASS
Российский минздрав утвердил перечень противопоказаний к вакцинам от Covid-19. Документ уточняет список и сроки действия противопоказаний к различным формам выпуска препаратов.
Бессрочно любые прививки от коронавируса противопоказаны людям с гиперчувствительностью к компонентам вакцины, с тяжелыми аллергическими реакциями в анамнезе, а также тем, у кого были тяжелые осложнения после прививки первым компонентом вакцины: анафилактический шок, судорожный синдром, повышение температуры выше 40 градусов, гиперемия и отек в месте инъекции, следует из текста приказа.
В документе уточняются временные противопоказания к вакцинации: это периоды острого течения сопутствующих заболеваний, обострения хронических заболеваний и две-четыре недели после выздоровления и наступления ремиссии.
Вакцинация от Covid-19 противопоказана при ОРВИ (даже в легкой степени тяжести) и острых инфекционных заболеваниях - до нормализации температуры.
Беременным и кормящим женщинам, следует из приказа, показана только вакцина "Гам-Ковид-Вак" (двухкомпонентный "Спутник V"). При этом "Спутник Лайт" (по сути это первый компонент обычного "Спутника"), "Гам-Ковид-Вак-Лио" (сухая форма вакцины), "Гам-Ковид-Вак-М" (препарат для подростков), а также "ЭпиВакКорона", "ЭпиВакКорона-Н" и "Ковивак" им противопоказаны.
Такое противопоказание - формальность, связанная с тем, что препараты не исследовали на беременных. "Спутник V", как утверждали в минздраве, проверяли на женщинах, которые забеременели в процессе клинических исследований. Влияние вакцины на плод также оценивали в доклинических исследованиях безопасности вакцины, говорили в минздраве.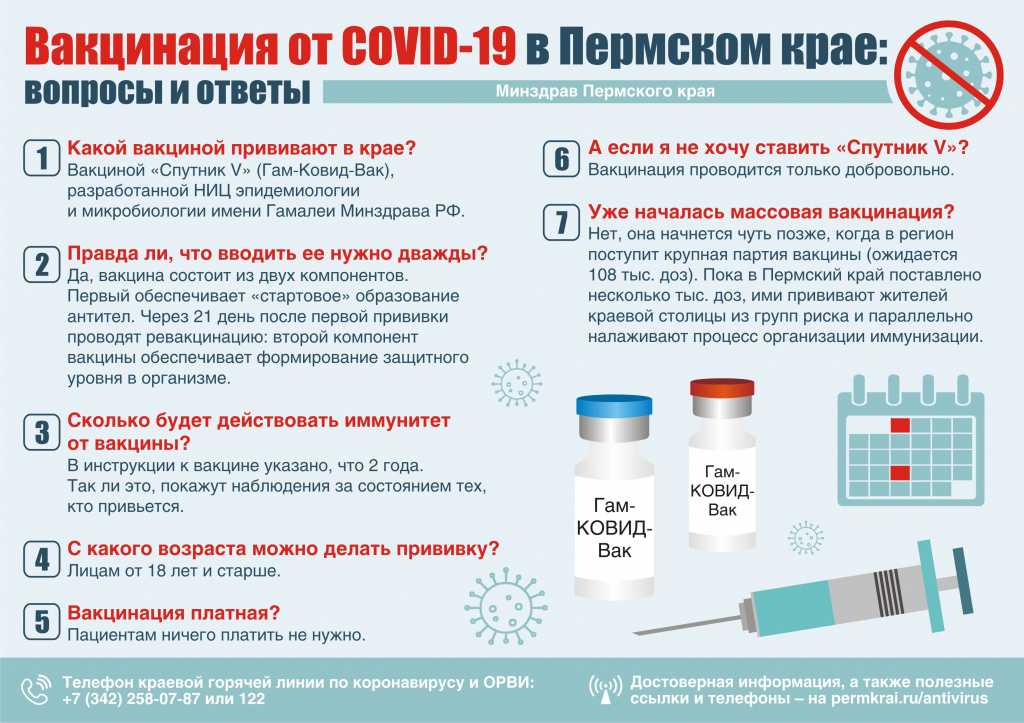
По этой же причине препараты "Гам-Ковид-Вак-Лио", "Гам-Ковид-Вак-М", "ЭпиВакКорона-Н" и "КовиВак" противопоказаны людям старше 60 лет. А для подростков от 12 до 17 лет допустимо использование исключительно вакцины "Гам-Ковид-Вак-М", так как она была создана специально для этой возрастной группы и проверена на ней, а дозировка вакцины для детей в пять раз меньше, чем для взрослых.
Пропустить Подкаст и продолжить чтение.
Подкаст
Что это было?
Мы быстро, просто и понятно объясняем, что случилось, почему это важно и что будет дальше.
эпизоды
Конец истории Подкаст
Как следует из наблюдений за привитыми вакцинами Pfizer и Moderna беременными в США, вакцинация безопасна для матери и ребенка, снижает риск заражения беременной и формирует антитела, которые могут защитить и ребенка.
Коронавирус особенно опасен не только для пожилых, но и для людей любого возраста с хроническими заболеваниями, а также для беременных. Доказано, что во время беременности выше вероятность тяжелого течения болезни, а следовательно и госпитализации. Коронавирусная инфекция значительно повышает риски преждевременных родов и госпитализации новорожденного.
Доказано, что во время беременности выше вероятность тяжелого течения болезни, а следовательно и госпитализации. Коронавирусная инфекция значительно повышает риски преждевременных родов и госпитализации новорожденного.
Опубликованное 13 января исследование Эдинбургского университета уточняет эти данные: там провели анализ 145 424 беременностей, вакцинации 18 399 беременных и 5653 подтвержденных случаев инфицирования ковидом во время беременности.
Исследование показало, что у женщин, заразившихся коронавирусом за 28 дней до родов или менее, чаще были преждевременные роды, мертворождение и смерти новорожденных. Среди невакцинированных женщин госпитализация потребовалась 19,5% заболевших, среди частично вакцинированных в госпитализации нуждались 8,3%, и лишь 5,1% - полностью привитых женщин.
77,4% случаев инфицирования коронавирусом во время беременности, согласно исследованию, пришлись на женщин, которые не были вакцинированы, при этом 11,5% были частично привиты, и 11,1% - полностью привиты.
"ЭпиВакКорону", "ЭпиВакКорону-Н" и "Ковивак", согласно новому приказу, запретили к применению пациентам со злокачественными новообразованиями. В инструкции к "ЭпиВакКороне" изначально значились новообразования и злокачественные заболевания крови в качестве противопоказания, а вот в инструкции к "КовиВаку" их не было.
"ЭпиВакКорону" и "КовиВак" не рекомендуют для применения этим категориям пациентов, так как нет подтверждения их эффективности, а для онкобольных ковид смертельно опасен, сказала в беседе с Би-би-си кандидат наук Школы биологических наук Эдинбургского университета Татьяна Дуднакова.
"По "Спутнику" есть две статьи по клиническим исследованиям, данные из Аргентины и еще несколько независимых исследований. Поэтому его рекомендуют как более надежный и более изученный вариант вакцины", - говорит биолог.
Приказ российского минздрава допускает наличие других противопоказаний в инструкциях к препаратам для профилактики коронавируса. Например, в инструкции к "ЭпиВакКороне" в противопоказаниях также значится первичный иммунодефицит (наследственные или приобретенные во внутриутробном периоде иммунодефицитные состояния). В самом приказе этого противопоказания нет.
Можно ли прививаться переболевшим и когда?
Запрета на вакцинацию от коронавируса для переболевших нет. Любой гражданин может сделать прививку, если у него нет противопоказаний, а с момента любого инфекционного заболевания прошло более двух недель.
Кто может сделать прививку?
Записаться и сделать прививку против COVID-19 можно, если вы:
— старше 18 лет;
— не болеете ОРВИ в момент вакцинации и не болели в последние две недели до нее;
— за последние 30 дней не делали прививок;
— не беременны и не кормите грудью (для женщин).
Какая вакцина будет применяться в нашем регионе?
Гам-Ковид-Вак (торговая марка «Спутник V»).
На данный момент бесплатная вакцинация против COVID-19 будет проводиться вакциной «Спутник V (Гам-Ковид-Вак)», разработанной Национальным исследовательским центром имени Н.Ф. Гамалеи Минздрава России. Она безопасна, потому что не содержит элементов коронавируса. В рамках проведения пострегистрационного исследования вакцины, в котором уже приняли участие более 20 тысяч человек, не было зафиксировано ни одного случая серьезных осложнений.
Как вакцина может повлиять на здоровье людей 65+?
Вакцина «Спутник V» прошла две стадии клинических испытаний, получила регистрацию, проходит пострегистрационные испытания. Никаких серьезных побочных эффектов не выявлено. Минздрав России при регистрации устанавливает требования к качеству вакцины, Минпромторг контролирует соблюдение требований к производству. Росздравнадзор контролирует качество вакцины, находящейся в обороте, в том числе проводя обязательный контроль качества каждой серии вакцины. Таким образом, качество вакцины гарантировано государством.
Таким образом, качество вакцины гарантировано государством.
Можно ли вакцинироваться при наличии антител?
Наличие антител не является противопоказанием для вакцинации.
Когда состоится массовая вакцинация населения?
Массовая вакцинация таймырцев от коронавируса начнется в конце января 2021 года.
Существуют ли противопоказания при вакцинации от COVID-19?
Противопоказания к введению вакцины против коронавирусной инфекции указаны в инструкциях по применению препарата.
Основные противопоказания - это гиперчувствительность к какому-либо компоненту вакцины, тяжелые аллергические реакции в анамнезе, обострение хронических заболеваний, беременность и период грудного вскармливания, возраст до 18.
Перед применением вакцины врач оценит состояние здоровья и примет решение о вакцинации или наличии противопоказаний к вакцинации против ковид.
Можно ли использовать вакцину для лечения уже заболевших людей?
Нет. Вакцина предназначена для профилактики заболевания. Если есть симптомы COVID-19, делать прививку нельзя.
Если есть симптомы COVID-19, делать прививку нельзя.
Можно ли употреблять алкоголь во время вакцинации от коронавируса?
При вакцинации от коронавирусной инфекции необходимо ограничить употребление алкоголя за три дня до процедуры и три дня после. Такие меры будут способствовать формированию иммунитета, который сможет противостоять болезни.
Чрезмерное употребление алкоголя способно значительно снизить иммунитет, а значит, и снизить эффективность от вакцинирования или вообще сделать его бессмысленным.
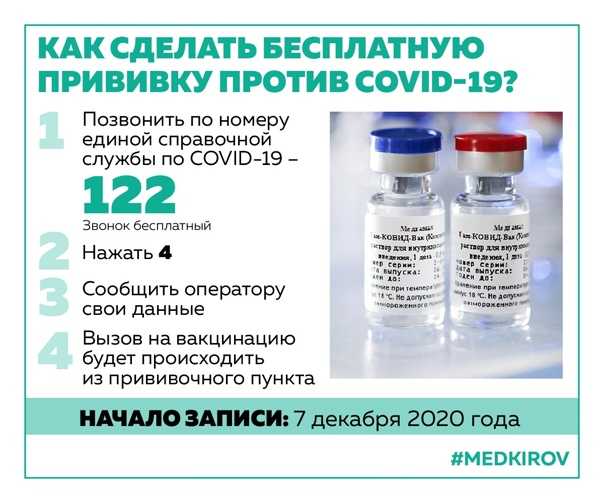
Где и как можно записаться на вакцинацию?
На вакцинацию против COVID-19можно записаться:
Куда обращаться за получением вакцины?
Необходимо обратиться в медицинскую организацию по месту жительства.
Бесплатна ли вакцина?
Вакцинация будет осуществляться бесплатно.
Безопасна ли вакцина?
Вакцина безопасна. Эффективность российской вакцины от коронавируса «Спутник V» по данным Минздрава РФ составляет более 90%.
Могут ли получить прививку жители других субъектов, работающие на территории ТДНМР вахтовым методом? Если могут, то куда обращаться?
Да, могут в условиях поликлиники, для этого необходимо записаться любым вышеуказанным способом. При этом необходимо учесть, что второй компонент вакцины – через 21 день!
Вакцинация от COVID-19 проводится по территориально-участковому принципу в медицинских организациях в соответствии с приказом Министерства здравоохранения и социального развития Российской Федерации от 15.05.2012 № 543н.
Является ли онкологическое заболевание противопоказанием для прививки от COVID-19?
Решение о вакцинации пациента с онкологическим заболеванием в каждом конкретном случае принимает лечащий врач.
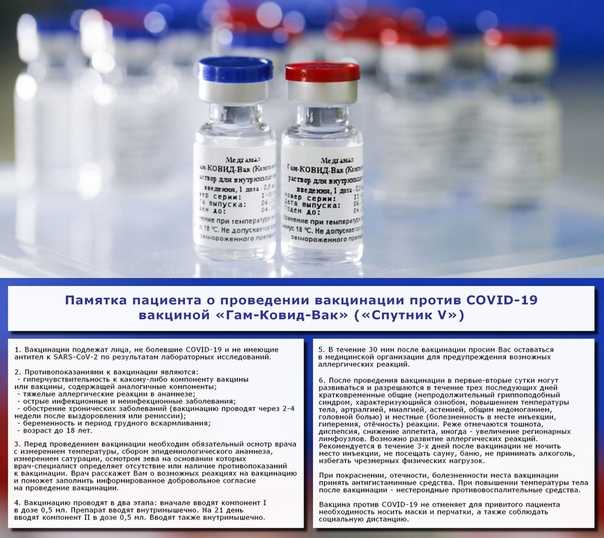
Обязательно ли делать прививки в два этапа: первую и повторную? Какой период должен пройти между вакцинацией?
Производителем вакцины Гам-Ковид-Вак торгового наименования «Спутник V» предусмотрена двукратная схема вакцинации с использованием компонентов I и II, которая позволяет сформировать стойкий иммунитет продолжительностью до двух лет.
В соответствии с инструкцией к вакцине Гам-Ковид-Вак вакцинацию проводят в два этапа: вначале компонентом I в дозе 0,5 мл внутримышечно, затем через 3 недели (21 день) компонентом II в дозе 0,5 мл внутримышечно.
Иммунитет начинает формироваться уже после первой прививки. Повторная прививка подстегивает иммунный ответ организма и дает более длительный эффект. Исследования доказывают, что двухступенчатая вакцинация дает иммунный ответ в 100% случаев. И такой иммунитет сильнее, чем у тех, кто переболел коронавирусом.
Какие могут быть негативные последствия от прививки? Существуют ли ограничения после вакцинации от COVID-19?
После проведения вакцинации в первые-вторые сутки могут развиваться и разрешаются в течение трех последующих дней
кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью)
местные (болезненность в месте инъекции, гиперемия, отёчность) реакции.
Реже отмечаются тошнота, диспепсия, снижение аппетита, иногда - увеличение регионарных лимфоузлов. Возможно развитие аллергических реакций.
Рекомендуется в течение 3-х дней после вакцинации не мочить место инъекции, не посещать сауну, баню, не принимать алкоголь, избегать чрезмерных физических нагрузок.
Вакцина против COVID-19 не отменяет для привитого пациента необходимость носить маски и перчатки, а также соблюдать социальную дистанцию.
Зачем нужна прививка? Можно ли обойтись без нее?
Врожденный иммунитет далеко не всегда способен противостоять возбудителям тяжелых и трудноизлечимых инфекционных заболеваний, таких как гепатит, столбняк, туберкулез, корь, полиомиелит и многие другие. Поскольку такие инфекции высоко контагиозны (заразны) и заболевшие люди могут заражать здоровых, одна из ключевых задач - остановить распространение инфекции, избежать эпидемии.
Вакцинация - это один из самых эффективных способов создания как индивидуального, так и коллективного иммунитета при многих инфекционных заболеваниях, в том числе при коронавирусной инфекции.
Безопасны ли вакцины?
Вакцины, прошедшие государственную регистрацию и официально разрешенные к применению, безопасны - этот факт признан регистрирующим органом, выдающим разрешение на их применение. Вакцинация против одного заболевания не ослабляет иммунный ответ человека на другое заболевание. Вакцинация не создает какие-либо дополнительные риски для человека, который был в контакте с инфекционным больным или находится в инкубационном периоде заболевания.
По всем возникающим вопросам можно проконсультироваться у лечащего врача.
Все ли прививки можно сделать бесплатно, по полису ОМС?
В России действует Национальный календарь профилактических прививок, в рамках которого прививки проводятся в определенном возрасте детям и взрослым. Включенные в календарь прививки застрахованным по ОМС делают бесплатно.
Иммунизация - самый эффективный способ защититься от многих инфекций!
. 2012;7(4):e35421.
2012;7(4):e35421.
doi: 10.1371/journal.pone.0035421. Epub 2012 20 апр.
Чиен-Тэ Ценг 1 , Елена Сбрана, Наоко Ивата-Йошикава, Патрик С. Ньюман, Таня Гаррон, Роберт Л. Атмар, Кларенс Дж. Питерс, Роберт Б. Коуч
Принадлежности
 1371/journal.pone.0035421
1371/journal.pone.0035421 Бесплатная статья ЧВК
Chien-Te Tseng et al. ПЛОС Один. 2012.
Бесплатная статья ЧВК
. 2012;7(4):e35421.
doi: 10.1371/journal.pone.0035421. Epub 2012 20 апр.
Чиен-Тэ Ценг 1 , Елена Сбрана, Наоко Ивата-Йошикава, Патрик С. Ньюман, Таня Гаррон, Роберт Л. Атмар, Кларенс Дж. Питерс, Роберт Б. Коуч
Задний план: Тяжелый острый респираторный синдром (ТОРС) возник в Китае в 2002 году и распространился на другие страны, прежде чем его удалось взять под контроль. Из-за опасений повторного появления или преднамеренного высвобождения коронавируса SARS была начата разработка вакцины. Оценка инактивированной цельновирусной вакцины у хорьков и нечеловекообразных приматов и вакцины с вирусоподобными частицами у мышей индуцировала защиту от инфекции, но у зараженных животных наблюдалось заболевание легких иммунопатологического типа.
Дизайн: Четыре вакцины-кандидата для человека с квасцовым адъювантом или без него были оценены на мышиной модели SARS, VLP-вакцина, вакцина, вводимая хорькам и NHP, еще одна цельновирусная вакцина и S-белок, продуцируемый рДНК. Мышей Balb/c или C57BL/6 вакцинировали внутримышечно. на 0-й и 28-й день и умерщвляли для измерения антител в сыворотке или заражали живым вирусом на 56-й день. На 58-й день зараженных мышей умерщвляли и получали легкие для вируса и гистопатологии.
Результаты: Все вакцины индуцировали нейтрализующие сыворотку антитела при увеличении доз и/или квасцов, значительно повышающих ответы. Значительное снижение SARS-CoV через два дня после заражения наблюдалось для всех вакцин и ранее живого SARS-CoV. У всех мышей наблюдались гистопатологические изменения в легких через два дня после заражения, включая всех животных, вакцинированных (Balb/C и C57BL/6) или получивших живой вирус, противогриппозную вакцину или PBS, что позволяет предположить, что инфекция имела место у всех.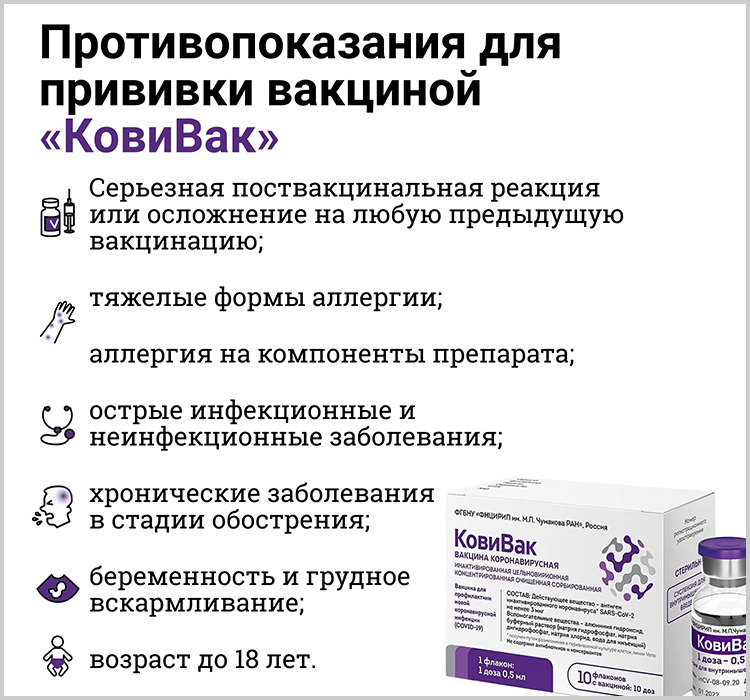 Гистопатология, наблюдаемая у животных, получивших одну из вакцин против SARS-CoV, всегда представляла собой иммунопатологию Th3-типа с выраженной эозинофильной инфильтрацией, подтвержденной специальным окрашиванием эозинофилов. В патологических изменениях, наблюдаемых во всех контрольных группах, не было заметного присутствия эозинофилов.
Гистопатология, наблюдаемая у животных, получивших одну из вакцин против SARS-CoV, всегда представляла собой иммунопатологию Th3-типа с выраженной эозинофильной инфильтрацией, подтвержденной специальным окрашиванием эозинофилов. В патологических изменениях, наблюдаемых во всех контрольных группах, не было заметного присутствия эозинофилов.
Выводы: Все эти вакцины против SARS-CoV индуцировали образование антител и защиту от заражения SARS-CoV. Однако контрольное заражение мышей, которым вводили любую из вакцин, приводило к возникновению иммунопатологии Th3-типа, предполагая индуцированную гиперчувствительность к компонентам SARS-CoV. Показана осторожность при переходе к применению вакцины против SARS-CoV у людей.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Рисунок 1. Сравнение трех вакцин против SARS-CoV…
Рисунок 1. Сравнение трех вакцин против SARS-CoV, эксперимент 1.
Сывороточные нейтрализующие (нейтральные) антитела и…
Рисунок 1. Сравнение трех вакцин против SARS-CoV, эксперимент 1. Сывороточные нейтрализующие (нейтральные) антитела и титры легочных вирусов для каждой группы дозировки вакцины. A. Средний геометрический титр сывороточных антител как log 2 и стандартная ошибка среднего (SE) на 56-й день для каждой группы дозировки вакцины. Семь-восемь мышей на группу. Вакцины: двойной инактивированный цельный вирус (DIV), рекомбинантный белок S (SV), вакцина на основе вирусоподобных частиц (VLP), с квасцами (+A). Пяти мышам в группе вводили внутримышечно по 0,1 мл вакцины в дни 0 и 28. B. Среднее геометрическое титра вируса (log 10 TCID 50 /г) и стандартную ошибку среднего значения (SE) в легких на 58-й день (через два дня после заражения SARS-CoV) для каждой группы дозировки вакцины. Анализы: A. GMT с квасцами по сравнению с без квасцов: DIV p>0,05, VLP p>05, SV p = 001. GMT для различных дозировок вакцины: DIV с квасцами p = ,007, DIV без квасцов p>0,05, SV с квасцами p = ,028, SV без квасцов p = ,01. Множественная регрессия: GMT увеличился для квасцов p = ,012 и дозы p<0,001, для квасцов SV только p = ,001. B. GMT для всех групп DIV не отличается p>0,05, GMT для группы SV без квасцов p 0,008 и с квасцами p 0,023. GMT для группы VLP не отличается p>.05.
Пяти мышам в группе вводили внутримышечно по 0,1 мл вакцины в дни 0 и 28. B. Среднее геометрическое титра вируса (log 10 TCID 50 /г) и стандартную ошибку среднего значения (SE) в легких на 58-й день (через два дня после заражения SARS-CoV) для каждой группы дозировки вакцины. Анализы: A. GMT с квасцами по сравнению с без квасцов: DIV p>0,05, VLP p>05, SV p = 001. GMT для различных дозировок вакцины: DIV с квасцами p = ,007, DIV без квасцов p>0,05, SV с квасцами p = ,028, SV без квасцов p = ,01. Множественная регрессия: GMT увеличился для квасцов p = ,012 и дозы p<0,001, для квасцов SV только p = ,001. B. GMT для всех групп DIV не отличается p>0,05, GMT для группы SV без квасцов p 0,008 и с квасцами p 0,023. GMT для группы VLP не отличается p>.05.
Рисунок 2. Сравнение вакцин трех SARS-CoV…
Рисунок 2. Сравнение трех вакцин против SARS-CoV, эксперимент 1.
Сравнение трех вакцин против SARS-CoV, эксперимент 1.
Средняя легочная клеточная инфильтрация/патологическое поражение…
Рисунок 2. Сравнение трех вакцин против SARS-CoV, эксперимент 1. Среднее значение патологии легочной клеточной инфильтрации/поражения и процент эозинофилов в инфильтратах для каждой группы дозировки вакцины через два дня после заражения SARS-CoV. A. Средняя оценка поражения и стандартная ошибка среднего (SE) для каждой группы дозировки вакцины. У всех мышей была обнаружена гистопатология легких. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Подсчет очков. 0 – нет патологии, 1 и 2 – (1) минимальная (2) умеренная перибронхиальная и периваскулярная клеточная инфильтрация, 3 и 4 – 1 и/или 2 плюс минимальный (3) или умеренный (4) эпителиально-клеточный некроз бронхиол с клеточным детритом в просвете. B. Средний процент эозинофилов при гистологической оценке для семи-восьми мышей в каждой группе дозировки вакцины. Среднее значение для каждой мыши представляет собой средний процент эозинофилов в пяти отдельных полях микроскопии срезов легкого. Анализы: A. Средние оценки поражений были разными p
Среднее значение для каждой мыши представляет собой средний процент эозинофилов в пяти отдельных полях микроскопии срезов легкого. Анализы: A. Средние оценки поражений были разными p
Рисунок 3. Более высокие дозы вакцины SV…
Рисунок 3. Сравнение более высоких доз вакцины SV плюс вакцины DIV и BPV, эксперимент 2.
Сывороточные нейтрализующие (нейтральные) антитела и титры легочных вирусов для каждой группы дозировки вакцины. A. Средний геометрический титр сывороточных антител и стандартная ошибка среднего (SE) на 56-й день для каждой группы дозировки вакцины. Пять мышей в группе получали внутримышечно по 0,1 мл вакцины на 0 и 28 день. дней после заражения SARS-CoV) для каждой группы дозировки вакцины. Семь-восемь мышей на группу. Вакцины: цельный вирус с двойной инактивацией (DIV), рекомбинантный белок S (SV), цельный вирус, инактивированный β-пропиолактоном (BPV) с квасцами (+А). Анализы: A. GMT с квасцами больше, чем без квасцов: SV p<0,001, DIV p = ,014. GMT для двух групп BPV различны p = ,039. Множественная регрессия: DIV и SV увеличивались с квасцами p≤0,01, дозировка не влияла p>0,05.
Пять мышей в группе получали внутримышечно по 0,1 мл вакцины на 0 и 28 день. дней после заражения SARS-CoV) для каждой группы дозировки вакцины. Семь-восемь мышей на группу. Вакцины: цельный вирус с двойной инактивацией (DIV), рекомбинантный белок S (SV), цельный вирус, инактивированный β-пропиолактоном (BPV) с квасцами (+А). Анализы: A. GMT с квасцами больше, чем без квасцов: SV p<0,001, DIV p = ,014. GMT для двух групп BPV различны p = ,039. Множественная регрессия: DIV и SV увеличивались с квасцами p≤0,01, дозировка не влияла p>0,05.
Рисунок 4. Более высокие дозы вакцины SV…
Рисунок 4. Сравнение более высоких доз вакцины SV плюс вакцины DIV и BPV, эксперимент 2.

Среднее значение патологии легочной клеточной инфильтрации/поражения и средний процент эозинофилов в инфильтратах для каждой группы дозировки вакцины через два дня после заражения SARS-CoV. A. Средняя оценка поражения и стандартная ошибка среднего (SE) для каждой группы дозировки вакцины. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка - 0 - нет определенной патологии, 1 - легкая перибронхиолярная и периваскулярная клеточная инфильтрация, 2 - умеренная перибронхиолярная и периваскулярная клеточная инфильтрация, 3 - тяжелая перибронхиолярная и периваскулярная клеточная инфильтрация с утолщением альвеолярных стенок, альвеолярной инфильтрацией и некрозом эпителиальных клеток бронхиол и дебрисом в просвет. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. B. Средний балл и стандартная ошибка среднего (SE) для эозинофилов в виде процента инфильтрирующих клеток для каждой группы дозировки вакцины. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка: 0 - 20% клеток. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. Анализы: A. Средние оценки поражений были разными p
Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка: 0 - 20% клеток. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. Анализы: A. Средние оценки поражений были разными p
Рисунок 5. Фотографии легочной ткани.
Представитель…
Рисунок 5. Фотографии легочной ткани.
Репрезентативные микрофотографии легочной ткани через два дня после заражения…
Рисунок 5. Фотографии легочной ткани. Репрезентативные микрофотографии легочной ткани через два дня после заражения мышей Balb/c вирусом SARS-CoV, которым ранее вводили вакцину против SARS-CoV. Срезы легких окрашивали отдельно гематоксилином и эозином (H&E) и иммуногистохимическим протоколом с использованием процедуры специфичного для эозинофилов окрашивания моноклональными антителами к основному основному белку эозинофилов. Хромоген DAB давал коричневое окрашивание эозинофилов. Процедура и антитела были любезно предоставлены лабораторией Ли, клиника Майо, Аризона. Колонка окраски H&E находится слева, а колонка окраски основного основного белка эозинофилов (EOS MBP) - справа. Вакцины: цельновирусная вакцина с двойной инактивацией (DIV), цельновирусная вакцина, инактивированная β-пропиолактоном (BPV). Как показано на изображениях, эозинофилы заметны (коричневое окрашивание DAB) во всех исследованных срезах. Воздействие SARS-CoV связано с выраженными воспалительными инфильтратами, характеризующимися преобладающим эозинофильным компонентом.
Хромоген DAB давал коричневое окрашивание эозинофилов. Процедура и антитела были любезно предоставлены лабораторией Ли, клиника Майо, Аризона. Колонка окраски H&E находится слева, а колонка окраски основного основного белка эозинофилов (EOS MBP) - справа. Вакцины: цельновирусная вакцина с двойной инактивацией (DIV), цельновирусная вакцина, инактивированная β-пропиолактоном (BPV). Как показано на изображениях, эозинофилы заметны (коричневое окрашивание DAB) во всех исследованных срезах. Воздействие SARS-CoV связано с выраженными воспалительными инфильтратами, характеризующимися преобладающим эозинофильным компонентом.
Рис. 6. Микрофотографии легочной ткани.
Представитель…
Рис. 6. Микрофотографии легочной ткани.
Репрезентативные микрофотографии легочной ткани невакцинированных незараженных мышей…
Рисунок 6. Микрофотографии легочной ткани.
Микрофотографии легочной ткани. Репрезентативные микрофотографии легочной ткани невакцинированных незараженных мышей (нормальных) и мышей Balb/c через два дня после заражения SARS-CoV, которым ранее вводили только PBS (без вакцины) или живой вирус. H&E и иммуногистохимическое окрашивание основного основного белка эозинофилов выполняли, как описано для фиг. 5. Колонка H&E находится слева, а колонка Eos MBP - справа. Показаны срезы от нормальных мышей (без вакцины или живого вируса) и мышей, которым вводили PBS (без вакцины) или живой SARS-CoV, а затем заражали SARS-CoV. Как показано на изображениях в среднем и нижнем ряду, хотя воздействие SARS-CoV вызывает воспалительные инфильтраты и накопление мусора в просвете бронхов, эозинофилы во всех группах остаются в пределах нормы.
Рисунок 7. Мышь и специфичность вакцины, эксперимент…
Рисунок 7.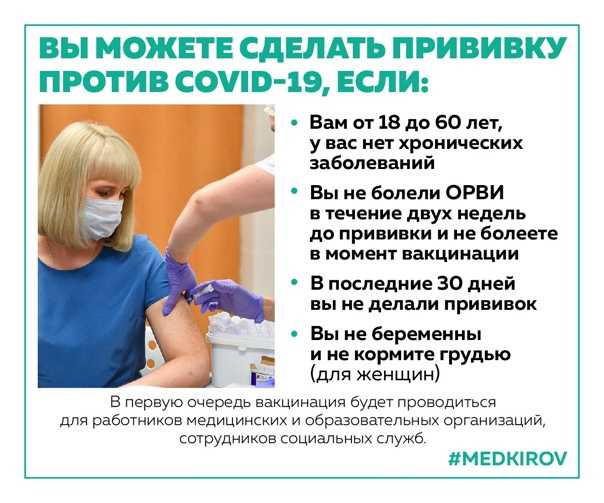 Мышь и специфичность вакцины, эксперимент 3.
Мышь и специфичность вакцины, эксперимент 3.
Сывороточные нейтрализующие (нейтральные) антитела и легочный вирус…
Рисунок 7. Специфичность мыши и вакцины, эксперимент 3. Сывороточные нейтрализующие (нейтральные) антитела и титры легочных вирусов для каждой группы дозировки вакцины. A. Средний геометрический титр антител в сыворотке и стандартная ошибка среднего (SE) на 56-й день для каждой группы дозировки вакцины для каждого штамма мышей (Balb/c или C57BL/6). Пять мышей в группе получали внутримышечно 0,1 мл вакцины в дни 0 и 28. B. Среднее геометрическое титра вируса (log 10 TCID 50 /g) и стандартная ошибка среднего (SE) в легких на 58-й день (через два дня после заражения SARS-CoV для каждой группы дозировки вакцины для каждой линии мышей. От семи до восьми мышей на группу. Вакцины : Двойной инактивированный цельный вирус, (DIV), цельный вирус, инактивированный β-пропиолактоном (BPV), с квасцами (+A) Анализы: A. Среднее время по Гринвичу для максимальной дозы DIV без квасцов больше для Balb/c, чем для C57BL/6 p = .008 но не для квасцов p>0,05 GMT для вакцины BPV и живого вируса не отличались для двух штаммов p>0,05 B. GMT для контрольных мышей PBS не отличались p>0,05 GMT для DIV без квасцов и BPV с квасцами выше для C57BL/6, чем для Balb/c p = ,004,
Среднее время по Гринвичу для максимальной дозы DIV без квасцов больше для Balb/c, чем для C57BL/6 p = .008 но не для квасцов p>0,05 GMT для вакцины BPV и живого вируса не отличались для двух штаммов p>0,05 B. GMT для контрольных мышей PBS не отличались p>0,05 GMT для DIV без квасцов и BPV с квасцами выше для C57BL/6, чем для Balb/c p = ,004,
Рисунок 8. Мышь и специфичность вакцины, эксперимент…
Рис. 8. Мышь и специфичность вакцины, эксперимент 3.
Среднее значение легочной клеточной инфильтрации/поражения патологии и процент…
Рисунок 8. Специфичность мыши и вакцины, эксперимент 3. Среднее значение патологии легочной клеточной инфильтрации/поражения и процент эозинофилов в инфильтратах для каждой группы дозировки вакцины для каждого штамма мышей (Balb/c или C57BL/6) через два дня после заражения SARS-CoV. A. Средняя оценка поражения и стандартная ошибка среднего (SE) для каждой группы дозировки вакцины. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка 0 – нет определенной патологии, 1 – легкая перибронхиальная и периваскулярная клеточная инфильтрация, 2 – умеренная перибронхиальная и периваскулярная клеточная инфильтрация, 3 – тяжелая перибронхиальная и периваскулярная клеточная инфильтрация с утолщением альвеолярных стенок, альвеолярная инфильтрация и некроз эпителиальных клеток бронхиол и детрит в просвет. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. B. Средний балл и стандартная ошибка среднего (SE) для эозинофилов в виде процента инфильтрирующих клеток для каждой группы дозировки вакцины. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка: 0 - 20% клеток. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. Анализы: A. Средние оценки поражений не различались p>0,05. B. Средние показатели эозинофилов различались с.
A. Средняя оценка поражения и стандартная ошибка среднего (SE) для каждой группы дозировки вакцины. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка 0 – нет определенной патологии, 1 – легкая перибронхиальная и периваскулярная клеточная инфильтрация, 2 – умеренная перибронхиальная и периваскулярная клеточная инфильтрация, 3 – тяжелая перибронхиальная и периваскулярная клеточная инфильтрация с утолщением альвеолярных стенок, альвеолярная инфильтрация и некроз эпителиальных клеток бронхиол и детрит в просвет. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. B. Средний балл и стандартная ошибка среднего (SE) для эозинофилов в виде процента инфильтрирующих клеток для каждой группы дозировки вакцины. Баллы представляют собой средние баллы для семи-восьми мышей в группе. Оценка: 0 - 20% клеток. Для каждого легкого мыши оценивали от десяти до 20 полей микроскопии. Анализы: A. Средние оценки поражений не различались p>0,05. B. Средние показатели эозинофилов различались с. 05.
05.
Рис. 9. Микрофотографии легочной ткани.
Представитель…
Рис. 9. Микрофотографии легочной ткани.
Репрезентативные микрофотографии легочной ткани через два дня после заражения…
Рисунок 9. Микрофотографии легочной ткани. Репрезентативные микрофотографии легочной ткани через два дня после заражения мышей Balb/c и C57BL/6, которым ранее вводили вакцину против SARS-CoV. Срезы легких отдельно окрашивали H&E (розовая и синяя микрофотографии) или иммуногистохимическим окрашиванием основного основного белка эозинофилов (синяя и коричневая микрофотографии). Срезы легких мышей Balb/c представлены в левой колонке, а линии C57BL/6 — в правой колонке; дважды инактивированная цельновирусная вакцина находится на четырех верхних панелях, а вакцины от мышей, получавших инактивированную β-пропиолактоном цельновирусную вакцину, — на четырех нижних панелях. Наблюдаемые патологические изменения (воспалительные инфильтраты) сходны в Balb/c и C57BL/6, а эозинофилы заметны в обеих группах.
Наблюдаемые патологические изменения (воспалительные инфильтраты) сходны в Balb/c и C57BL/6, а эозинофилы заметны в обеих группах.
См. это изображение и информацию об авторских правах в PMC
Влияние стимуляции Toll-подобных рецепторов на эозинофильную инфильтрацию в легких мышей BALB/c, иммунизированных УФ-инактивированной коронавирусной вакциной, связанной с тяжелым острым респираторным синдромом.
Ивата-Йошикава Н., Уда А., Судзуки Т., Цунэцугу-Ёкота Ю., Сато Ю., Морикава С., Таширо М., Сата Т., Хасэгава Х., Нагата Н. Ивата-Йошикава Н. и соавт. Дж Вирол. 2014 авг;88(15):8597-614. doi: 10.1128/ОВИ.00983-14. Эпаб 2014 21 мая. Дж Вирол. 2014. PMID: 24850731 Бесплатная статья ЧВК.
Рецептор-связывающий домен шиповидного белка SARS-CoV индуцирует долговременный защитный иммунитет в животной модели.
Ду Л., Чжао Г., Хе Ю., Го Ю., Чжэн Б.Дж., Цзян С., Чжоу Ю. Ду Л и др. вакцина. 2007 12 апреля; 25 (15): 2832-8. doi: 10.1016/j.vaccine.2006.10.031. Epub 2006 30 октября. вакцина. 2007. PMID: 17092615 Бесплатная статья ЧВК.
Вакцины против коронавируса, ассоциированного с тяжелым острым респираторным синдромом, в состав которых входят дельта-инулиновые адъюванты, обеспечивают усиленную защиту при уменьшении эозинофильной иммунопатологии легких.
Honda-Okubo Y, Barnard D, Ong CH, Peng BH, Tseng CT, Петровский Н. Хонда-Окубо Ю. и др. Дж Вирол. 2015 март;89(6):2995-3007. doi: 10.1128/ОВИ.02980-14. Epub 2014 17 декабря. Дж Вирол. 2015. PMID: 25520500 Бесплатная статья ЧВК.
S-белок с адъювантом наночастиц золота индуцирует сильный антиген-специфический ответ IgG против коронавирусной инфекции, связанной с тяжелым острым респираторным синдромом, но не может индуцировать защитные антитела и ограничивать эозинофильную инфильтрацию в легких.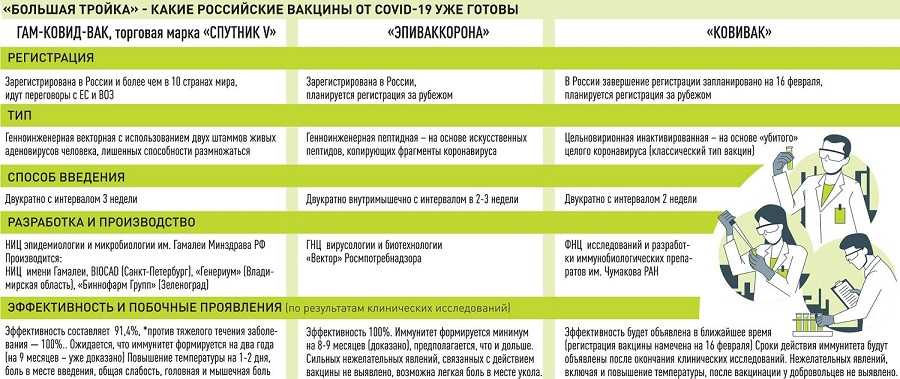
Секимукай Х., Ивата-Йошикава Н., Фукуши С., Тани Х., Катаока М., Судзуки Т., Хасэгава Х., Ниикура К., Араи К., Нагата Н. Секимукай Х. и др. Микробиол Иммунол. 2020 Январь; 64 (1): 33-51. дои: 10.1111/1348-0421.12754. Эпаб 201918 ноября. Микробиол Иммунол. 2020. PMID: 31692019 Бесплатная статья ЧВК.
Разработка вакцины против тяжелого острого респираторного синдрома: опыт вакцинации против коронавируса инфекционного бронхита птиц.
Кавана Д. Кавана Д. Авиан Патол. 2003 Декабрь; 32 (6): 567-82. дои: 10.1080/03079450310001621198. Авиан Патол. 2003. PMID: 14676007 Бесплатная статья ЧВК. Рассмотрение.
Посмотреть все похожие статьи
Результаты доклинического исследования на грызунах и рандомизированного, двойного слепого, плацебо-контролируемого исследования фазы 1/2 в параллельных группах вакцины против COVID-19 S-268019-a у взрослых японцев.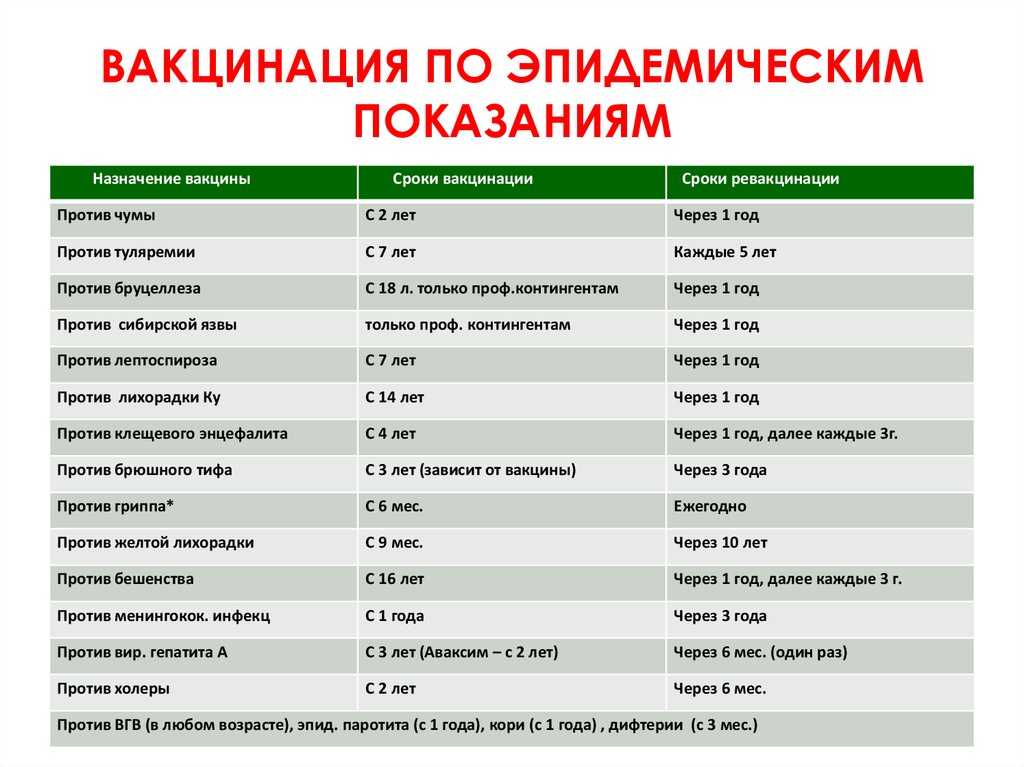
Сонояма Т., Ивата С., Синкай М., Ивата-Йошикава Н., Шива-Судо Н., Хемми Т., Айнаи А., Нагата Н., Мацунага Н., Тада Ю., Хомма Т., Омото С., Йококава Сибата Р., Игараши К., Судзуки Т., Хасэгава Х., Ариясу М. Сонояма Т. и др. вакцина. 2022 г., 16 декабря: S0264-410X(22)01540-7. doi: 10.1016/j.vaccine.2022.12.025. Онлайн перед печатью. вакцина. 2022. PMID: 36572603 Бесплатная статья ЧВК.
Вакцина с наночастицами RBD против SARS-CoV-2 с адъювантом Pam2CSK4 вызывает сильные гуморальные и клеточные иммунные ответы.
Цяо И, Чжан И, Чжан И, Дэн Дж, Чен А, Лю Б, Чжан И, Пан Т, Чжан В, Чжан Х, Хе Х. Цяо Ю и др. Фронт Иммунол. 2022 9 декабря; 13:992062. doi: 10.3389/fimmu.2022.992062. Электронная коллекция 2022. Фронт Иммунол. 2022. PMID: 36569949 Бесплатная статья ЧВК.
Разработка вакцины против зоонозных вирусных заболеваний, вызванных одноцепочечными РНК-вирусами с положительным смыслом, принадлежащими к семействам Coronaviridae и Togaviridae (обзор).
Бабаймарзангу С.С., Закер Х., Сулейманнежадбари Э., Гамчи Н.С., Каземиния М., Тариги С., Сейедян Х., Цацакис А., Спандидос Д.А., Маргина Д. Babaeimarzangou SS, et al. Эксперт Тер Мед. 2022 30 ноября; 25(1):42. дои: 10.3892/etm.2022.11741. Электронная коллекция 2023 янв. Эксперт Тер Мед. 2022. PMID: 36569444 Бесплатная статья ЧВК. Рассмотрение.
Доклиническая токсичность и иммуногенность вакцины против COVID-19 (ZF2001) у яванских обезьян.
Ян Х., Пань В., Чен Г., Хуан Э., Лу Ц., Чен Ю., Чен И., Ян З., Вэнь Л., Чжан С., Сюй С., Лев В., Дай Л., Ву С., Чжан Л. Ян Х и др. Вакцины (Базель). 2022 5 декабря; 10 (12): 2080. дои: 10.3390/вакцин10122080. Вакцины (Базель). 2022. PMID: 36560490 Бесплатная статья ЧВК.
Можно ли распространить триумф мРНК-вакцин против COVID-19 на другие вирусные инфекции человека и домашних животных?
Сехрават С. , Остерридер Н., Шмид Д.С., Роуз Б.Т. Сехрават С. и др. микробы заражают. 2022 23 ноября; 25 (1-2): 105078. doi: 10.1016/j.micinf.2022.105078. Онлайн перед печатью. микробы заражают. 2022. PMID: 36435367 Бесплатная статья ЧВК.
, Остерридер Н., Шмид Д.С., Роуз Б.Т. Сехрават С. и др. микробы заражают. 2022 23 ноября; 25 (1-2): 105078. doi: 10.1016/j.micinf.2022.105078. Онлайн перед печатью. микробы заражают. 2022. PMID: 36435367 Бесплатная статья ЧВК.
Просмотреть все статьи "Цитируется по"
 2003; 348: 1953–66. - пабмед
2003; 348: 1953–66. - пабмед 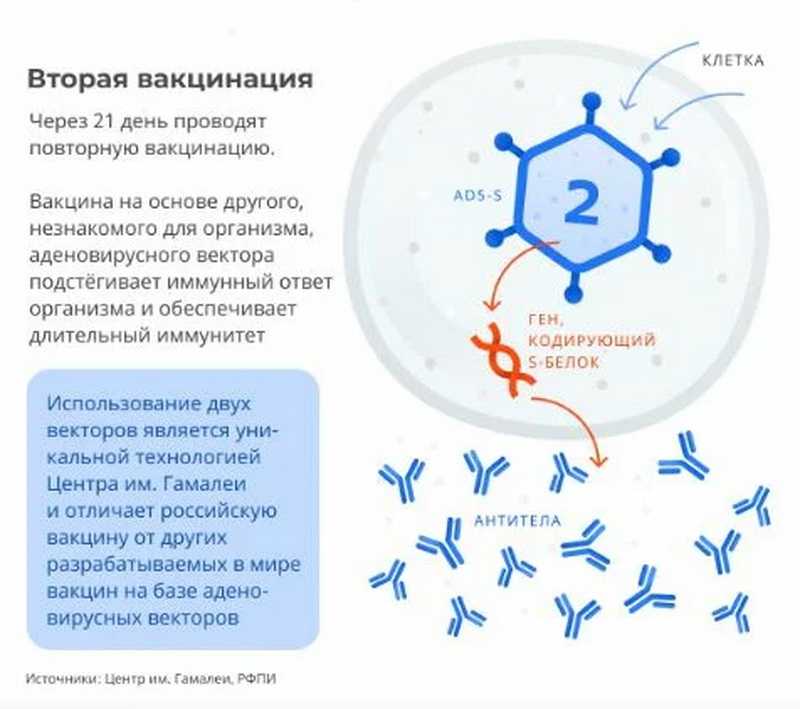 , Хуэй Д., Ву А., Чан П., Кэмерон П. и др. Крупная вспышка тяжелого острого респираторного синдрома в Гонконге. N Engl J Med. 2003; 348:1986–94. - пабмед
, Хуэй Д., Ву А., Чан П., Кэмерон П. и др. Крупная вспышка тяжелого острого респираторного синдрома в Гонконге. N Engl J Med. 2003; 348:1986–94. - пабмед Полнотекстовые ссылки
Публичная научная библиотека Бесплатная статья ЧВК
Процитируйте
Формат: ААД АПА МДА НЛМ
Добавить в коллекции
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Отправить на
1. Пейрис Дж. С., Гуан И., Юэн К.Ю. Острое респираторное заболевание. Нат Мед. 2004; 10: S88–97. 10.1038/nm1143 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Пейрис Дж. С., Гуан И., Юэн К.Ю. Острое респираторное заболевание. Нат Мед. 2004; 10: S88–97. 10.1038/nm1143 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Snijder EJ, Bredenbeek PJ, Dobbe JC, Thiel V, Ziebuhr J, Poon LLM, et al. Уникальные и консервативные черты генома и протеома коронавируса SARS, раннего отделения от линии коронавируса группы 2. Дж Мол Биол. 2003;331:991–1004. 10.1016/S0022-2836(03)00865-9 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Guan Y, Zheng BJ, He YQ, Liu XL, Zhuang ZX, Cheung CL и др. . Выделение и характеристика вирусов, связанных с коронавирусом SARS, от животных на юге Китая. Наука. 2003; 302: 276–8. 10.1126/science.1087139 [PubMed] [CrossRef] [Google Scholar]
4. Китайский консорциум молекулярной эпидемиологии SARS. Молекулярная эволюция коронавируса SARS в ходе эпидемии SARS в Китае. Наука. 2004; 303:1666–9.. 10.1126/science.1092002 [PubMed] [CrossRef] [Google Scholar]
5. Guan Y, Peiris JS, Zheng B, Poon LL, Chan KH, Zeng FY, et al. Молекулярная эпидемиология нового коронавируса, вызывающего тяжелый острый респираторный синдром. Ланцет. 2004; 363: 99–104. 10.1016/S0140-6736(03)15259-2 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Молекулярная эпидемиология нового коронавируса, вызывающего тяжелый острый респираторный синдром. Ланцет. 2004; 363: 99–104. 10.1016/S0140-6736(03)15259-2 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Yang ZY, Werner HC, Kong WP, Leung K, Traggiai E, Lanzavecchia A и др. . Уклонение от нейтрализации антител при появлении коронавирусов тяжелого острого респираторного синдрома. Proc Natl Acad Sci U S A. 2005; 102:797–801. 10.1073/pnas.0409065102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
7. Seto WH, Tsang D, Yung RWH, Ching TY, Ng TK, Ho M, et al. Эффективность мер предосторожности против воздушно-капельного и контактного воздействия в профилактике внутрибольничной передачи тяжелого острого респираторного синдрома (ТОРС). Ланцет. 2003; 361:1519–20. 10.1016/S0140-6736(03)13168-6 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
8. Xiong S, Wang YF, Zhang MY, Liu XJ, Zhang CH, Liu SS и др. . Иммуногенность инактивированной вакцины против SARS у мышей BALB/c. Иммунол Летт. 2004;95:139–43. 10.1016/j.imlet.2004.06.014 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Иммунол Летт. 2004;95:139–43. 10.1016/j.imlet.2004.06.014 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
9. He Y, Zhou Y, Siddiqui P, Jiang S. Инактивированная вакцина против SARS-CoV вызывает высокие титры спайка белок-специфические антитела, которые блокируют связывание с рецептором и проникновение вируса. Biochem Biophys Res Commun. 2004; 325:445–52. 10.1016/j.bbrc.2004.10.052 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
10. Chou TH, Wang S, Sakhatskyy PV, Mboudoudjeck I, Lawrence JM, Huang S, et al. Картирование эпитопов и анализ биологической функции антител, полученных при иммунизации мышей инактивированным китайским изолятом коронавируса, ассоциированного с тяжелым острым респираторным синдромом (SARS-CoV). Вирусология. 2005; 334:134–43. 10.1016/j.virol.2005.01.035 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Qu D, Zheng B, Yao X, Guan Y, Yuan ZH, Zhong NS, et al. Интраназальная иммунизация инактивированным SARS-CoV (SARS-ассоциированный коронавирус) индуцировала местные и сывороточные антитела у мышей. вакцина. 2005; 23:924–31. 10.1016/j.vaccine.2004.07.031 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
вакцина. 2005; 23:924–31. 10.1016/j.vaccine.2004.07.031 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
12. Marshall E, Enserink M. Medicine. К вакцинам против атипичной пневмонии призывают проявлять осторожность. Наука. 2004; 303:944–6. 10.1126/science.303.5660.944 [PubMed] [CrossRef] [Google Scholar]
13. Wang D, Lu J. Массивы гликанов привели к открытию аутоиммуногенной активности SARS-CoV. Физиол Геномика. 2004; 18: 245–8. 10.1152/physiolgenomics.00102.2004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
14. Холмс К.В. SARS-ассоциированный коронавирус. N Engl J Med. 2003; 348: 1948–51. 10.1056/NEJMp030078 [PubMed] [CrossRef] [Google Scholar]
15. Li WH, Moore MJ, Vasilieva NY, Sui JH, Wong SK, Berne AM, et al. Ангиотензинпревращающий фермент 2 является функциональным рецептором коронавируса SARS. Природа. 2003; 426:450–4. 10.1038/nature02145 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
16. Prabakaran P, Xiao X, Dimitrov DS. Модель структуры и функции ACE2 в качестве рецептора SARS-CoV. Biochem Biophys Res Commun. 2004; 314: 235–41. 10.1016/j.bbrc.2003.12.081 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Модель структуры и функции ACE2 в качестве рецептора SARS-CoV. Biochem Biophys Res Commun. 2004; 314: 235–41. 10.1016/j.bbrc.2003.12.081 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Wong SK, Li W, Moore MJ, Choe H, Farzan M. 193-аминокислотный фрагмент S-белка коронавируса SARS эффективно связывает ангиотензинпревращающий фермент 2. Дж. Биол. Хим. 2003; 279:3197–201. 10.1074/jbc.C300520200 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Xiao X, Chakraborti S, Dimitrov AS, Gramatikoff K, Dimitrov DS. S-гликопротеин SARS-CoV: экспрессия и функциональная характеристика. Biochem Biophys Res Commun. 2003; 312:1159–64. 10.1016/j.bbrc.2003.11.054 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Димитров ДС. Тайная жизнь ACE2 как рецептора вируса SARS. Клетка. 2003; 115: 652–3. 10.1016/S0092-8674(03)00976-0 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Yang ZY, Huang Y, Ganesh L, Leung K, Kong WP, Schwartz O и др. . pH-зависимое проникновение коронавируса тяжелого острого респираторного синдрома опосредуется шиповидным гликопротеином и усиливается переносом дендритных клеток через DC-SIGN. Дж Вирол. 2004; 78: 5642–50. 10.1128/ОВИ.78.11.5642-5650.2004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
. pH-зависимое проникновение коронавируса тяжелого острого респираторного синдрома опосредуется шиповидным гликопротеином и усиливается переносом дендритных клеток через DC-SIGN. Дж Вирол. 2004; 78: 5642–50. 10.1128/ОВИ.78.11.5642-5650.2004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
21. Jeffers SA, Tusell SM, Gillim-Ross L, Hemmila EM, Achenbach JE, Babcock GJ, et al. CD209L (L-SIGN) является рецептором коронавируса тяжелого острого респираторного синдрома. Proc Natl Acad Sci U S A. 2004; 101:15748–53. 10.1073/pnas.0403812101 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
22. Liu S, Xiao G, Chen Y, He Y, Niu J, Escalante C, et al. Взаимодействие между участками гептадного повтора 1 и 2 в спайковом белке коронавируса, связанного с SARS: значение для механизма слияния вирусов и идентификация ингибиторов слияния. Ланцет. 2004;363:938–47. 10.1016/S0140-6736(04)15788-7 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Tripet B, Howard MW, Jobling M, Holmes RK, Holmes KV, Hodges RS. Структурная характеристика ядра слитого белка S-шипа SARS-коронавируса. Дж. Биол. Хим. 2004; 279:20836–49. 10.1074/jbc.M400759200 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Tripet B, Howard MW, Jobling M, Holmes RK, Holmes KV, Hodges RS. Структурная характеристика ядра слитого белка S-шипа SARS-коронавируса. Дж. Биол. Хим. 2004; 279:20836–49. 10.1074/jbc.M400759200 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
24. Xu Y, Lou Z, Liu Y, Pang H, Tien P, Gao GF, et al. Кристаллическая структура ядра слитого белка шипа SARS-CoV. Дж. Биол. Хим. 2004;279: 49414–9. 10.1074/jbc.M408782200 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K, et al. ДНК-вакцина индуцирует нейтрализацию коронавируса SARS и защитный иммунитет у мышей. Природа. 2004; 428: 561–4. 10.1038/nature02463 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Wang S, Chou TH, Sakhatskyy PV, Huang S, Lawrence JM, Cao H, et al. Идентификация двух нейтрализующих областей на гликопротеине спайка коронавируса тяжелого острого респираторного синдрома, полученном из системы экспрессии млекопитающих. Дж Вирол. 2005;79: 1906–10. 10.1128/JVI.79.3.1906-1910.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Дж Вирол. 2005;79: 1906–10. 10.1128/JVI.79.3.1906-1910.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Keng CT, Zhang A, Shen S, Lip KM, Fielding BC, Tan TH, et al. Аминокислоты с 1055 по 1192 в области S2 белка коронавируса тяжелого острого респираторного синдрома индуцируют нейтрализующие антитела: последствия для разработки вакцин и противовирусных средств. Дж Вирол. 2005; 79: 3289–96. 10.1128/ОВИ.79.6.3289-3296.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Zhong X, Yang H, Guo ZF, Sin WY, Chen W, Xu J и соавт. Ответы В-клеток у пациентов, выздоровевших от тяжелого острого респираторного синдрома, нацелены на доминирующий сайт в домене S2 поверхностного шиповидного гликопротеина. Дж Вирол. 2005; 79: 3401–8. 10.1128/JVI.79.6.3401-3408.2005 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
29. Bisht H, Roberts A, Vogel L, Bukreyev A, Collins PL, Murphy BR, et al. Спайк-белок коронавируса тяжелого острого респираторного синдрома, экспрессируемый аттенуированным вирусом коровьей оспы, обеспечивает защитную иммунизацию мышей. Proc Natl Acad Sci U S A. 2004;101:6641–6. 10.1073/пнас.0401939101 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Proc Natl Acad Sci U S A. 2004;101:6641–6. 10.1073/пнас.0401939101 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Букреев А., Ламиранде Э.В., Буххольц Ю.Дж., Фогель Л.Н., Элкинс В.Р., Сент-Клер М. и соавт. Иммунизация слизистых оболочек африканских зеленых мартышек ( Cercopithecus aethiops ) аттенуированным вирусом парагриппа, экспрессирующим шиповидный белок коронавируса атипичной пневмонии, для профилактики атипичной пневмонии. Ланцет. 2004; 363:2122–7. 10.1016/S0140-6736(04)16501-X [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
31. He Y, Zhou Y, Wu H, Luo B, Chen J, Li W и др. . Выявление иммунодоминантных участков на шиповидном белке коронавируса тяжелого острого респираторного синдрома (ТОРС): значение для разработки диагностики ТОРС и вакцин. Дж Иммунол. 2004; 173:4050–7. [PubMed] [Академия Google]
32. Олсен К.В., Корапи В.В., Якобсон Р.Х., Симкинс Р.А., Саиф Л.Дж., Скотт Ф.В. Идентификация антигенных участков, опосредующих антителозависимое усиление инфекционности вируса инфекционного перитонита кошек. Джей Ген Вирол. 1993; 74: 745–9. 10.1099/0022-1317-74-4-745 [PubMed] [CrossRef] [Google Scholar]
Джей Ген Вирол. 1993; 74: 745–9. 10.1099/0022-1317-74-4-745 [PubMed] [CrossRef] [Google Scholar]
33. Jiang S, Lin K, Neurath AR. Усиление заражения вирусом иммунодефицита человека типа 1 (ВИЧ-1) с помощью антисыворотки к пептидам оболочечных гликопротеинов gp120/gp41. J Эксперт Мед. 1991; 174: 1557–63. 10.1084/jem.174.6.1557 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
34. Weingartl H, Czub M, Czub S, Neufeld J, Marszal P, Gren J, et al. Иммунизация рекомбинантной вакциной модифицированного вируса коровьей оспы на основе Анкары против тяжелого острого респираторного синдрома связана с усилением гепатита у хорьков. Дж Вирол. 2004; 78:12672–6. 10.1128/JVI.78.22.12672-12676.2004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
35. He Y, Zhu Q, Liu S, Zhou Y, Yang B, Li J, et al. Идентификация критической детерминанты нейтрализации коронавируса, связанного с тяжелым острым респираторным синдромом (ТОРС): важность для разработки вакцин против ТОРС. Вирусология. 2005; 334:74–82. 10.1016/j.virol.2005.01.034 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Вирусология. 2005; 334:74–82. 10.1016/j.virol.2005.01.034 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Chen Z, Zhang L, Qin C, Ba L, Yi CE, Zhang F, et al. Рекомбинантный модифицированный вирус осповакцины Анкара, экспрессирующий спайковый гликопротеин коронавируса тяжелого острого респираторного синдрома, индуцирует защитные нейтрализующие антитела, в первую очередь нацеленные на область связывания рецептора. Дж Вирол. 2005; 79: 2678–88. 10.1128/JVI.79.5.2678-2688.2005 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
37. He Y, Zhou Y, Liu S, Kou Z, Li W, Farzan M, et al. Рецептор-связывающий домен спайкового белка SARS-CoV индуцирует сильнодействующие нейтрализующие антитела: значение для разработки субъединичной вакцины. Biochem Biophys Res Commun. 2004; 324: 773–81. 10.1016/j.bbrc.2004.09.106 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. He Y, Lu H, Siddiqui P, Zhou Y, Jiang S. Рецептор-связывающий домен шиповидного белка коронавируса SARS содержит множественные конформации-зависимые эпитопы, индуцирующие сильнодействующие нейтрализующие антитела.