2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
COVID-19 ассоциируется с усилением свертываемости крови. У пациентов с COVID-19 часто повышен уровень Д-димера, высокая концентрация которого является предиктором смерти. Эксперты Международного общества специалистов по тромбозу и гемостазу (ISTH) полагают, что повышение уровня Д-димера в 3-4 раза у пациента с COVID-19 является самостоятельным показанием для госпитализации.
У пациентов с COVID-19 часто диагностируются как очевидные тромботические осложнения с выявлением крупных тромбов (причем не только в венах и легочных артериях, но и в сердце, сосудах головного мозга, почек, печени), так и признаки тромбоза на микроциркуляторном уровне, который прижизненно доказать довольно сложно. Часть исследователей предполагает, что при COVID-19 тромбоз микроциркуляторного русла может лежать в основе поражения многих органов вплоть до полиорганной недостаточности. Так, например, тромбоз сосудов почек может приводить к нарастающей почечной недостаточности, микроциркуляторного русла легких - к уугублению дыхательной недостаточности.
Интересно, что при поражении миокарда признаками воспаления и интерстициальным фиброзом вирусных частиц непосредственно в миокарде не обнаруживается. Исследователи предполагают, что повреждение миокарда может развиваться на фоне гипоксии, тромбоза микроциркуляторного русла и системной воспалительной реакции.
Механизм гиперкоагуляции у пациентов с COVID-19, предположительно, связан с выраженной эндотелиальной дисфункцией и индукцией агрегации тромбоцитов (эндотелий несет на себе рецепторы АПФ2 и является мишенью для вируса SARS-COV-2). Также опубликованы отдельные серии работ, в которых у пациентов с COVID-19 и массивным тромбозом выявлено повышение титров антител к фосфолипидам (https://www.nejm.org/doi/full/10.1056/NEJMc2007575), однако подобные транзиторные изменения могут носить неспецифический характер, поскольку часто выявляются при выраженной воспалительной реакции.
Сейчас назначение антикоагулянтов в профилактической дозе у госпитализированных пациентов с тяжелым течением COVID-19 с целью профилактики венозной тромбоэмболии стало практически повсеместной практикой; показано, что такая терапия снижает смертность у пациентов с COVID-19. Не определены четкие показания к назначению антикоагулянтов, до конца не решен вопрос, какие препараты при этом лучше использовать. Теоретически представляется, что нефракционированный гепарин, обладающий собственным противовоспалительным действием, может иметь определенные преимущества. Более того, есть мнение, что он может снижать связывание вирусных частиц с клетками-мишенями. С другой стороны, использование НФГ требует более частого визита медсестры к пациенту (несколько раз в сутки), что подвергает персонал большему риску. Поэтому во многих клиниках в США для профилактики ВТЭО применяют прямые пероральные антикоагулянты.
Не определены четкие показания к назначению антикоагулянтов, до конца не решен вопрос, какие препараты при этом лучше использовать. Теоретически представляется, что нефракционированный гепарин, обладающий собственным противовоспалительным действием, может иметь определенные преимущества. Более того, есть мнение, что он может снижать связывание вирусных частиц с клетками-мишенями. С другой стороны, использование НФГ требует более частого визита медсестры к пациенту (несколько раз в сутки), что подвергает персонал большему риску. Поэтому во многих клиниках в США для профилактики ВТЭО применяют прямые пероральные антикоагулянты.
Тем не менее, на сегодняшний момент экспертные сообщества рекомендуют использовать у тяжелых пациентов с COVID-19 низкомолекулярные гепарины. Так, ISTH рекомендует назначать НМГ в профилактической дозе всем пациентам, госпитализированным в связи с COVID-19, даже если они не находятся в реанимации (противопоказания - активное кровотечение, тромбоцитопения <25 -="" 1500="" 8="" p="">В последней версии временных рекомендаций Минздрава РФ по лечению пациентов с COVID-19 на этот счет сказано следующее: «Рекомендовано включать в схемы терапии таких пациентов препараты низкомолекулярного гепарина.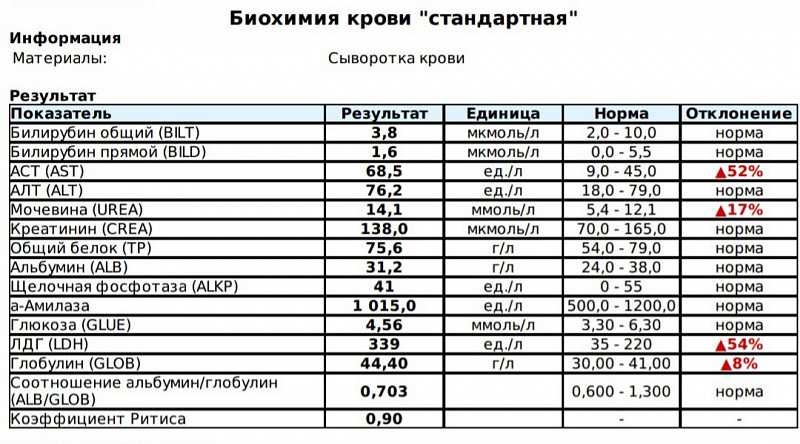 Критерием назначения препаратов могут быть совокупные изменения в общем анализе крови (тромбоцитопения) и коагулограмме (повышение уровня Д-димера, протромбинового времени) или риск развития коагулопатии, который был стратифицирован по шкале сепсис-индуцированной коагулопатии (СИК)» (https://static-1.rosminzdrav.ru/system/attachments/attaches/000/049/951/original/09042020_%D0%9C%D0%A0_COVID-19_v5.pdf).
Критерием назначения препаратов могут быть совокупные изменения в общем анализе крови (тромбоцитопения) и коагулограмме (повышение уровня Д-димера, протромбинового времени) или риск развития коагулопатии, который был стратифицирован по шкале сепсис-индуцированной коагулопатии (СИК)» (https://static-1.rosminzdrav.ru/system/attachments/attaches/000/049/951/original/09042020_%D0%9C%D0%A0_COVID-19_v5.pdf).
У тяжелых пациентов с COVID-19 частота тромботических осложнений остается высокой даже на фоне применения антикоагулянтов в профилактической дозе, поэтому некоторыми экспертами обсуждается возможность назначения антикоагулянтов в полной, лечебной дозе.
Учитывая отсутствие адекватной доказательной базы, тактика в отношении антикоагулянтной терапии у каждого тяжелого пациента с COVID-19 должна быть обсуждена индивидуально с учетом риска тромбозов и кровотечений.
Эксперты рекомендуют контролировать такие показатели, характеризующие свертывание крови, как протромбиновое время, уровень Д-димера, фибриногена, число тромбоцитов.
У пациентов с COVID-19 тяжелого течения достаточно часто развивается тромбоцитопения, однако геморрагические осложнения редки. Лабораторные признаки гипокоагуляции без кровотечения не требуют какой-либо коррекции.
Если у пациентов развивается большое кровотечение, эмпирически следует использовать свежезамороженную плазму (СЗП), по показаниям - эрмассу, далее тактика зависит от лабораторных показателей:
- при МНО>1,5 или увеличении АЧТВ более, чем в 1,5 раза - использовать СЗП
- если фибриноген менее 1,5 г/л - криопреципитат или концентрат фибриногена
- если тромбоциты менее 50 тыс/мкл - трансфузия тромбомассы
- при отсутствии признаков ДВС может быть использована также транексамовая кислота, - не следует использовать препараты рекомбинантного фактора VIIa.
По материалам:
 published: 25 March 25, 2020 (ссылка)
published: 25 March 25, 2020 (ссылка)Текст: Шахматова О.О.
Врач рассказал, какие анализы нужно сдать после COVID-19 - Газета.Ru | Новости
close
100%
Чтобы предупредить тяжелые последствия коронавируса, после выздоровления переболевшим необходимо сдать анализы на гемостаз, проверить скорость распада тромбов и пройти биохимические скрининги, сообщил «Газете.Ru» генеральный директор центра молекулярно-генетических исследований ДНКОМ Андрей Исаев.
«Самым частым осложнением после COVID-19 считается нарушение свертываемости крови, это обусловлено течением болезни. В результате у пациентов даже в довольно молодом возрасте после заболевания случаются сердечно-сосудистые катастрофы – инфаркты, инсульты. Поэтому в первую очередь мы рекомендуем пациентам сдать анализы на гемостаз: оценить свертывающую и противосвертывающую функцию крови», — рассказал он.
В результате у пациентов даже в довольно молодом возрасте после заболевания случаются сердечно-сосудистые катастрофы – инфаркты, инсульты. Поэтому в первую очередь мы рекомендуем пациентам сдать анализы на гемостаз: оценить свертывающую и противосвертывающую функцию крови», — рассказал он.
По его словам, необходимо также сдать анализ «Коагулограмма базовая», то есть проверить базовые позиции гемостаза: протромбиновое время, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ ), протромбин по Квику, тромбиновое время, фибриноген.
Рекомендуется проверить показатель D-димер, добавил врач. По нему можно судить о скорости распада тромбов. Если значения высоки, нужно проконсультироваться со специалистом по поводу приема антикоагулянтов.
«Нет смысла откладывать в долгий ящик измерение показателей гемостаза. По-хорошему, их нужно контролировать на этапе выписки амбулаторных больных, потому что это важный элемент в признании человека здоровым или нездоровым. Если показатели в норме, я бы рекомендовал сдать анализы повторно через две-три недели после выписки, и при отклонении от нормы обратиться к врачу», — пояснил Исаев.
Если показатели в норме, я бы рекомендовал сдать анализы повторно через две-три недели после выписки, и при отклонении от нормы обратиться к врачу», — пояснил Исаев.
После коронавируса часто нарушаются обменные процессы: в частности функции печени, почек, добавил врач. Иногда на фоне инфекции случаются миокардиты. Поэтому необходимо проверить такие показатели как АЛТ, АСТ – это маркеры как гепатита, так и миокардита. Для исключения развития миокардита смотрят также фермент ЛДГ (лактатдегидрогеназы). Функцию почек можно оценить по уровню мочевины и креатинина.
«Часто у пациентов после ковида нарушается метаболизм липидов, поэтому рекомендуется проверить уровень нитроглицеридов, холестерина, соотношение холестерина высокой и низкой плотностей, индекс атерогенности. В противном случае нарушение липидного обмена ведет к ускоренному развитию атеросклероза, формированию атеросклеротических бляшек и отдаленным негативным последствиям в виде сердечно-сосудистых заболеваний», — отметил Исаев.
Кроме того, уточнил он, коронавирус приводит к истощению резервов микроэлементов, которые активнее всего участвуют в иммунной функции – железа, цинка, меди. Поэтому стоит проверить и эти показатели, так как они участвуют в выработке лейкоцитов, которые являются щитом на пути вирусных инфекций.
Ранее вирусолог рассказал о возможном наступлении «эры омикрона» в России в январе.
Подписывайтесь на «Газету.Ru» в Новостях, Дзен и Telegram.
Чтобы сообщить об ошибке, выделите текст и нажмите Ctrl+Enter
Новости
Дзен
Telegram
Андрей Колесников
Свеча в темноте
О декабре, Хануке и Исааке Зингере
Георгий Бовт
Он просто отстал от времени
Вспоминая время дорогого Леонида Ильича
Алена Солнцева
Важнейшее из искусств
О новогоднем кинопрокате и о перспективе для кинотеатров
Дмитрий Воденников
Золотая труба неудачи
О тяжелой судьбе вундеркиндов
Мария Дегтерева
Баттл проигран
О том, почему русский рок мертв, а русский рэп — нет
Найдена ошибка?
Закрыть
Спасибо за ваше сообщение, мы скоро все поправим.
Продолжить чтение
На этой странице Изучить значение показателей коагуляции D-димера (DD), протромбинового времени (PT), активированного частичного тромбопластинового времени (APTT), тромбинового времени (TT) и фибриногена (Fg) в прогнозировании тяжести и прогноза COVID-19.. Методы . Всего было включено 115 пациентов с подтвержденным COVID-19, которые были госпитализированы в больницу Тянью Уханьского университета науки и технологий в период с 18 января 2020 г. по 5 марта 2020 г. Были протестированы динамические изменения DD, PT, АЧТВ и Fg, а также изучена корреляция с КТ, клиническими классификациями и прогнозом. Результаты . Нарушение свертываемости имело место на ранней стадии инфекции COVID-19, при этом у 50 (43,5%) пациентов наблюдалось повышение ДД и у 74 (64,3%) пациентов - повышение Fg. Уровни DD и Fg коррелировали с клинической классификацией. Среди 23 пациентов, которые умерли, у 18 было увеличение DD при первом лабораторном тесте, у 22 - увеличение DD при втором и третьем лабораторных тестах и у 18 - удлинение PT при третьем тесте. Результаты ROC-анализа риска смертности показали, что AUC DD составляли 0,742, 0,818 и 0,851 при трехкратном тестировании соответственно; ПВ составил 0,643, 0,824 и 0,9.37. Кроме того, по мере прогрессирования заболевания изменение КТ-изображения было тесно связано с увеличением значения DD (). Выводы . Коагуляционная дисфункция чаще возникает у тяжелых и критически больных пациентов.
по 5 марта 2020 г. Были протестированы динамические изменения DD, PT, АЧТВ и Fg, а также изучена корреляция с КТ, клиническими классификациями и прогнозом. Результаты . Нарушение свертываемости имело место на ранней стадии инфекции COVID-19, при этом у 50 (43,5%) пациентов наблюдалось повышение ДД и у 74 (64,3%) пациентов - повышение Fg. Уровни DD и Fg коррелировали с клинической классификацией. Среди 23 пациентов, которые умерли, у 18 было увеличение DD при первом лабораторном тесте, у 22 - увеличение DD при втором и третьем лабораторных тестах и у 18 - удлинение PT при третьем тесте. Результаты ROC-анализа риска смертности показали, что AUC DD составляли 0,742, 0,818 и 0,851 при трехкратном тестировании соответственно; ПВ составил 0,643, 0,824 и 0,9.37. Кроме того, по мере прогрессирования заболевания изменение КТ-изображения было тесно связано с увеличением значения DD (). Выводы . Коагуляционная дисфункция чаще возникает у тяжелых и критически больных пациентов. DD и PT могут быть использованы в качестве значимых показателей для прогнозирования смертности от COVID-19.
DD и PT могут быть использованы в качестве значимых показателей для прогнозирования смертности от COVID-19.
COVID-19, возникший в Ухане, провинция Хубэй, Китай, вызван коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2). Обычно он передается воздушно-капельным путем и при тесном контакте. Основным клиническим проявлением является поражение легких [1, 2]. Большинство больных имеют благоприятный прогноз, но у некоторых быстро прогрессируют тяжелые и критические состояния с респираторным дистресс-синдромом, нарушением свертывания крови, полиорганной недостаточностью и др. [3, 4]. Поэтому раннее определение степени тяжести очень важно для клинической диагностики и лечения COVID-19.. Обычно используемые клинические лабораторные показатели коагуляции, такие как D-димер (DD), протромбиновое время (PT), активированное частичное тромбопластиновое время (APTT), тромбиновое время (TT) и фибриноген (Fg), могут точно отражать состояние свертывания крови.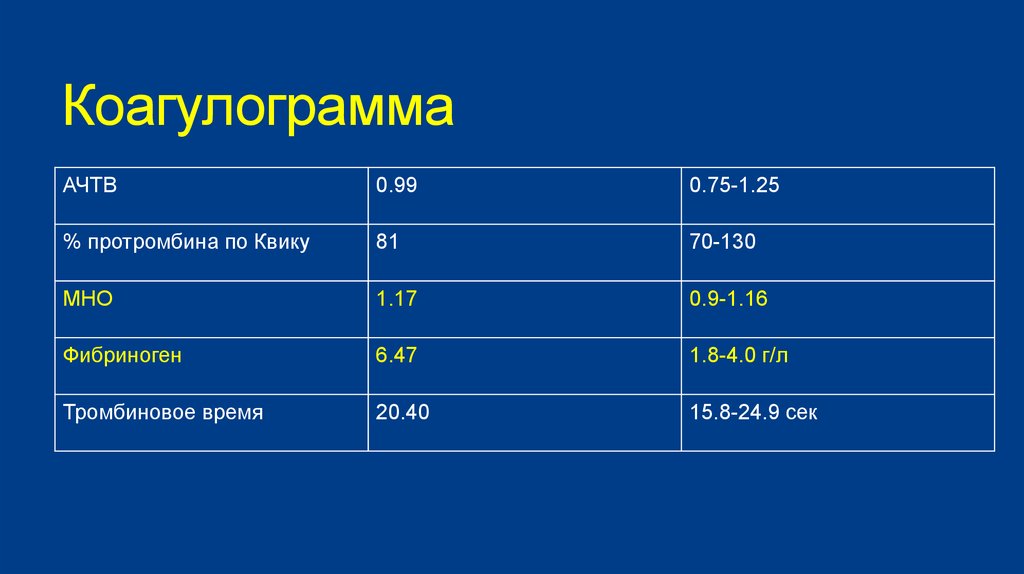 тело.
тело.
Целью отчета является исследование роли динамических изменений DD, PT, APTT, TT и Fg в прогнозировании тяжести и прогноза у пациентов с COVID-19.
Собрана информация о 115 пациентах с подтвержденным диагнозом COVID-19, которые были госпитализированы в больницу Тянью при Уханьском университете науки и технологий в период с 18 января 2020 г. по 5 марта 2020 г. Подтвержденные пациенты имели положительный результат теста на нуклеиновую кислоту SARS-CoV-2 с помощью флуоресцентной RT-PCR в реальном времени. Были проведены три оценки клинических заболеваний с использованием собранных лабораторных данных. Изучены случаи выписки из стационара, смерти и нахождения на лечении с длительностью госпитализации более 14 дней до 5 марта 2020 г. Были исключены случаи с неполными лабораторными данными или со сроком госпитализации менее 14 дней до 5 марта 2020 г. Это исследование было одобрено Наблюдательным советом по медицинской этике Уханьского университета науки и технологий (№ 202009). ).
).
В соответствии с Руководством по коронавирусной болезни 2019 г.: профилактика, контроль, диагностика и лечение, изданным Национальной комиссией здравоохранения Китайской Народной Республики, все случаи были разделены на четыре категории: легкие случаи, обычные случаи, тяжелые случаи, критические случаи. (1) Легкие случаи имели легкие клинические симптомы и отсутствие признаков пневмонии при визуализации. (2) Обычные случаи имели такие симптомы, как лихорадка и симптомы респираторного тракта, а проявления пневмонии можно было увидеть на изображениях. (3) В тяжелых случаях наблюдалось любое из следующего: респираторный дистресс, число вдохов/мин; насыщение кислородом менее 93% в состоянии покоя; или артериальное парциальное давление (). Пациенты с >50% прогрессированием поражения в течение 24-48 часов при легочной визуализации рассматривались как тяжелые случаи. (4) Критические случаи соответствовали любому из следующего: возникает дыхательная недостаточность и требуется искусственная вентиляция легких; возникает шок; или осложненная недостаточностью других органов, требующая наблюдения и лечения в отделении интенсивной терапии.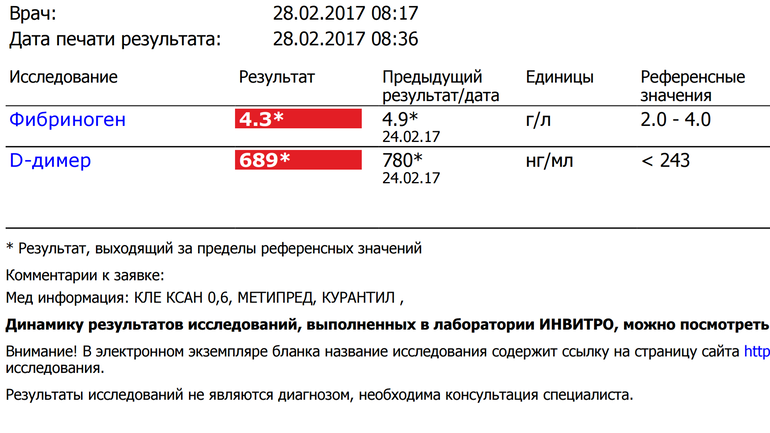
В зависимости от клинического прогрессирования исходы в конечных точках были разделены на четыре типа: выписка из стационара, улучшение, обострение и смерть.
Лабораторные данные были собраны в трех временных точках: госпитализация, 3–5 дней госпитализации и комбинированная конечная точка. Были получены DD, PT, APTT и Fg, которые были помечены как DD1-3, PT1-3, APTT1-3, TT1-3 и Fg1-3 соответственно. Между тем, были определены идентификация случая, идентификация изображений и исход болезни.
Статистический анализ проводили с использованием программного обеспечения SPSS 25.0. Описательная статистика включала средние значения и стандартные отклонения. Критерий Крускала-Уоллиса и критерий хи-квадрат независимой выборки использовались для анализа различий между группами. Кривая рабочих характеристик приемника (кривая ROC) использовалась для расчета площади под кривой (AUC) DD и PT с целью оценки чувствительности и специфичности этих факторов при прогнозировании смертности и выписки из больницы. Ранговый корреляционный анализ Спирмена использовался для измерения степени корреляции между иерархически упорядоченными переменными в этом исследовании. Значение <0,05 считалось статистически значимым.
Ранговый корреляционный анализ Спирмена использовался для измерения степени корреляции между иерархически упорядоченными переменными в этом исследовании. Значение <0,05 считалось статистически значимым.
Это было ретроспективное исследование серии случаев, и ни один пациент не участвовал в разработке дизайна исследования, постановке вопросов исследования или непосредственном определении результатов. Пациентов не просили дать совет по интерпретации или описанию результатов.
Среди 115 пациентов с COVID-19 средний возраст составлял (27-96) лет, мужчин было 66 (57,4%), женщин было 49(42,6%) случаев, а старше 60 лет было 78 (67,8%) случаев. На момент поступления легкие и обычные больные составляли 39 (33,9 %), тяжелые — 48 (41,7 %), критические — 28 (24,3 %) случаев (табл. 1). В этом исследовании больше пациентов были мужчинами, а больше пациентов старше 60 лет, что согласуется с предыдущим литературным отчетом [1].
Существуют значительные различия в DD1 между различными клиническими классификациями (). Тяжесть заболевания нарастала по мере увеличения DD1. У 81 (70,4%) больного Fg1 был повышен (табл. 2).
Значительная разница () и положительная корреляция были обнаружены между DD, PT и исходами в комбинированных конечных точках. Корреляция при третьем обнаружении была сильнее, чем при первом и втором обнаружении.
Среди 23 умерших пациентов у 18 (78,3%) случаев был повышен DD1, у 12 из 18 DD1 был выше в два раза (>1,10 мг/л), у 22 случаев повышен DD2 и DD3, у 21 из 22 был DD2 и DD3 два раз выше (>1,10 мг/л). В восьми случаях у пациентов с обострением имело место повышение DD2 и DD3 все выше (1,10 мг/л) (табл. 3).
Мы использовали анализ ROC-кривой для оценки диагностической ценности выписки из больницы и смертности у 115 пациентов. AUC DD1, DD2 и DD3 для прогнозирования выписки из больницы и смертности составляли 0,742, 0,818 и 0,851 соответственно (рис. 1(а)). AUC PT1, PT2 и PT3 для прогнозирования выписки из больницы и смертности составляли 0,643, 0,824 и 0,937 соответственно (рис. 1(b)).
AUC DD1, DD2 и DD3 для прогнозирования выписки из больницы и смертности составляли 0,742, 0,818 и 0,851 соответственно (рис. 1(а)). AUC PT1, PT2 и PT3 для прогнозирования выписки из больницы и смертности составляли 0,643, 0,824 и 0,937 соответственно (рис. 1(b)).
На ранней стадии заболевания корреляция между изменениями КТ-изображения и величиной DD не была очевидной; однако по мере прогрессирования заболевания изменение КТ было тесно связано с увеличением значения DD, и имелась достоверная статистическая разница (табл. 4).
Клиническое наблюдение показало, что аномальный фактор свертывания соответствовал результатам КТ. В данной работе в качестве примера был взят типичный пациент. Динамические изменения КТ органов грудной клетки и ДД были последовательными (рис. 2(а)). Увеличение ДД было связано с легочной эмболией, что было подтверждено КТА (рис. 2(б)).
COVID-19 — острое инфекционное заболевание, вызываемое коронавирусом нового типа (SARS-CoV-2). Начало COVID-19 в некоторых случаях проявляется лихорадкой легкой или тяжелой степени [4–6]. У некоторых пациентов может постепенно развиться одышка. Однако в тяжелых случаях заболевание быстро прогрессирует, у больных развивается тяжелый септический шок и они умирают [7–10]. Тяжесть и прогноз COVID-19 осложняются разнообразием симптомов, рентгенологических проявлений и прогрессирования заболевания. Особо следует отметить, что у некоторых тяжелых, критических и умерших пациентов отмечаются значительные нарушения свертывания крови [1, 4]. В седьмую редакцию COVID-19 добавлены патологические изменения болезни.План лечения, выданный Национальной комиссией здравоохранения Китая, в котором как вскрытие, так и гистопатологические исследования показывают наличие тромба или микротромба в легких, сердце, почках и/или печени.
Начало COVID-19 в некоторых случаях проявляется лихорадкой легкой или тяжелой степени [4–6]. У некоторых пациентов может постепенно развиться одышка. Однако в тяжелых случаях заболевание быстро прогрессирует, у больных развивается тяжелый септический шок и они умирают [7–10]. Тяжесть и прогноз COVID-19 осложняются разнообразием симптомов, рентгенологических проявлений и прогрессирования заболевания. Особо следует отметить, что у некоторых тяжелых, критических и умерших пациентов отмечаются значительные нарушения свертывания крови [1, 4]. В седьмую редакцию COVID-19 добавлены патологические изменения болезни.План лечения, выданный Национальной комиссией здравоохранения Китая, в котором как вскрытие, так и гистопатологические исследования показывают наличие тромба или микротромба в легких, сердце, почках и/или печени.
При попадании SARS-CoV-2 в организм через рецептор ангиотензинпревращающего фермента 2 (ACE2), адсорбированный на поверхности эпителиальных клеток слизистой оболочки [7, 8], его патоген-ассоциированный молекулярный паттерн (PAMP) может быть быстро распознан иммунная система, и иммунный ответ активируется для уничтожения вируса. Однако сверхактивированный иммунный ответ может вызвать цитокиновый шторм. В результате цитокиновый шторм вызывает повреждение эндотелия сосудов, активирует систему свертывания крови, ингибирует фибринолитическую и антикоагулянтную системы. Избыточные тромбозы в микрососудистой системе приводят к диссеминированному внутрисосудистому свертыванию (ДВС-синдрому) и, в конечном счете, к нарушению микроциркуляции и синдрому тяжелой полиорганной дисфункции [11]. Следовательно, раннее выявление и коррекция коагуляционной дисфункции может эффективно снизить смертность.
Однако сверхактивированный иммунный ответ может вызвать цитокиновый шторм. В результате цитокиновый шторм вызывает повреждение эндотелия сосудов, активирует систему свертывания крови, ингибирует фибринолитическую и антикоагулянтную системы. Избыточные тромбозы в микрососудистой системе приводят к диссеминированному внутрисосудистому свертыванию (ДВС-синдрому) и, в конечном счете, к нарушению микроциркуляции и синдрому тяжелой полиорганной дисфункции [11]. Следовательно, раннее выявление и коррекция коагуляционной дисфункции может эффективно снизить смертность.
Обычно используемые лабораторные показатели коагуляции включают DD, PT, АЧТВ и Fg. ДД является продуктом фибринолитической солюбилизации фибрина, а повышенный уровень ДД свидетельствует о наличии в организме состояния гиперкоагуляции и вторичного фибринолиза, что проявляется в повышении фибринолитической активности систем организма [12–15]. ПВ и АЧТВ являются экзогенными и эндогенными факторами свертывающей системы, которые могут быть использованы для ранней диагностики ДВС-синдрома. Fg представляет собой белок с коагуляционной функцией, синтезируемый печенью, который является важным веществом в процессах коагуляции и тромбоза. Высокий уровень Fg является важным показателем при различных тромботических заболеваниях. DD, PT, АЧТВ и Fg могут использоваться в качестве чувствительных индикаторов, отражающих различные степени коагуляционной дисфункции. Поэтому в данной статье исследование было сосредоточено на том, связаны ли эти показатели с тяжестью течения COVID-19..
Fg представляет собой белок с коагуляционной функцией, синтезируемый печенью, который является важным веществом в процессах коагуляции и тромбоза. Высокий уровень Fg является важным показателем при различных тромботических заболеваниях. DD, PT, АЧТВ и Fg могут использоваться в качестве чувствительных индикаторов, отражающих различные степени коагуляционной дисфункции. Поэтому в данной статье исследование было сосредоточено на том, связаны ли эти показатели с тяжестью течения COVID-19..
Результаты этого исследования показали, что DD и Fg можно использовать в качестве новых показателей для клинической классификации COVID-19. При первом тесте на ДД у 50 из 115 пациентов были обнаружены аномальные уровни ДД (>0,55 мг/л), что составляет 43,5% (50/115). Из 28 пациентов в критическом состоянии у 17 было значение >0,55 мг/л, что составляет 60,7%. (17/25), а в 14 случаях – в два раза выше нормы. 70,4% (81/115) пациентов с COVID-19 имели аномальную концентрацию Fg. Кроме того, отмечено, что уровень Fg был значительно повышен у пациентов с тяжелым и критическим состоянием, причем у 70,3% пациентов с тяжелым и критическим состоянием (52/74) >4,00 г/л. Результаты исследования показывают, что уровни DD и Fg значительно повышались у тяжелых и критически больных пациентов, а состояние некоторых пациентов ухудшалось во время лечения, что позволяет предположить, что COVID-19пациенты, особенно тяжелобольные, имеют высокий риск тромбоза, что согласуется с предыдущими сообщениями [1, 4].
Результаты исследования показывают, что уровни DD и Fg значительно повышались у тяжелых и критически больных пациентов, а состояние некоторых пациентов ухудшалось во время лечения, что позволяет предположить, что COVID-19пациенты, особенно тяжелобольные, имеют высокий риск тромбоза, что согласуется с предыдущими сообщениями [1, 4].
Кроме того, результаты этого исследования также показывают значительную корреляцию между факторами свертывания крови и исходом заболевания, предполагая, что DD, PT и АЧТВ могут служить диагностическими индикаторами прогрессирования заболевания. Среди 23 умерших пациентов 18 имели аномальный ДД в первом тесте, что составляет 78,3% (18/23), среди которых у 12 уровень ДД был в два раза выше нормального референтного значения. Во втором и третьем испытаниях было 8 обострений. Кроме того, среди 23 умерших пациентов в 21 случае уровень ДД был в два раза выше нормального референтного значения. В первом тесте PT было две аномалии (15 с) у 8 пациентов с ухудшением состояния, тогда как 5 аномалий (15 с) у 23 умерших пациентов. В то время как во втором и третьем тестах ПТ было 10 и 18 отклонений (> 15 сек) соответственно у 23 умерших пациентов. Постепенно увеличивающиеся уровни DD и PT предполагают значительную корреляцию с прогрессированием заболевания.
В то время как во втором и третьем тестах ПТ было 10 и 18 отклонений (> 15 сек) соответственно у 23 умерших пациентов. Постепенно увеличивающиеся уровни DD и PT предполагают значительную корреляцию с прогрессированием заболевания.
При использовании выписанных и умерших пациентов в качестве основы положительного деления анализ кривой ROC показал, что площади под кривой (AUC) составляли 0,742, 0,818 и 0,851 соответственно. При третьем тесте ПВ и АЧТВ значения AUC составили 0,937 и 0,856 соответственно, что указывает на то, что ПВ и АЧТВ имеют большое значение для прогноза заболевания.
По результатам исследования уровни D-димера, ПВ и АЧТВ были значительно выше, тогда как Fg у умерших был значительно ниже, чем у выживших, что свидетельствует о динамическом процессе свертывания крови у пациентов с COVID-19вероятно, состояние гиперкоагуляции с последующей активацией фибринолиза. В этом исследовании ПВ и АЧТВ удлинялись у 23 умерших пациентов, причем удлинение было более значительным во втором и третьем тестах, что указывало на переход пациентов из состояния высокой коагуляции в состояние фибринолиза из-за избыточного потребления факторов свертывания крови. Кроме того, результаты исследования показали, что DD, один из продуктов фибринолитической деградации, постепенно увеличивался на протяжении всего заболевания, что указывает на то, что пациенты, возможно, находились в гиперфибринолитическом состоянии, что согласуется с отчетом Chen et al. [16].
Кроме того, результаты исследования показали, что DD, один из продуктов фибринолитической деградации, постепенно увеличивался на протяжении всего заболевания, что указывает на то, что пациенты, возможно, находились в гиперфибринолитическом состоянии, что согласуется с отчетом Chen et al. [16].
КТ считается ценным инструментом диагностики и прогнозирования COVID-19. Результаты исследования показали, что ДД коррелирует с КТ в прогнозировании прогрессирования заболевания. В частности, повышенный уровень ДД указывает на состояние гиперкоагуляции и возможную тромбоэмболию легочной артерии, что может быть дополнительно подтверждено КТ-ангиографией (КТА).
Существует одно ограничение данного исследования, заключающееся в том, что оно проводилось в одном медицинском центре с отсутствием дизайна контрольной группы в связи со сложившейся ситуацией COVID-19.прорыв. В будущем исследователи должны объединиться с несколькими медицинскими центрами в этом районе и собрать контрольную группу, чтобы повысить надежность исследования.
В заключение, результаты этого исследования показали, что гиперкоагуляция, вероятно, присутствовала у пациентов с COVID-19 на ранней стадии. А гиперкоагуляция тесно связана с прогрессированием заболевания и клиническим исходом. Поэтому такие показатели коагуляции, как ДД и ПВ, следует контролировать как можно раньше с целью выявления тромботических осложнений. Крайне важно проводить профилактическое лечение, чтобы снизить риск тромбоэмболии и ДВС-синдрома, вторичного по отношению к нарушению свертываемости крови, тем самым снижая заболеваемость и смертность от COVID-19.- инфицированные пациенты.
Данные, использованные для поддержки результатов этого исследования, можно получить у соответствующего автора по запросу.
Все авторы сообщили об отсутствии конфликта интересов. Все авторы представили форму ICMJE для раскрытия потенциальных конфликтов интересов.
Hui Long, Lan Nie и Xiaochen Xiang внесли равный вклад в это исследование.
WJ Guan, ZY Ni, Y. Hu et al., «Клинические характеристики коронавирусной болезни 2019 года в Китае», The New England Journal of Medicine , vol. 382, нет. 18, стр. 1708–1720, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Чжу, Д. Чжан, В. Ван и др., «Новый коронавирус от пациентов с пневмонией в Китае, 2019 г.», The New England Journal of Medicine , vol. 382, нет. 2020. Т. 8. С. 727–733.
Посмотреть по адресу:
Сайт издателя | Google Scholar
W. Han, B. Quan, Y. Guo et al., «Курс клинической диагностики и лечения случая, инфицированного коронавирусной болезнью, 2019 г.», Journal of Medical Virology , vol. 92, нет. 5, стр. 461–463, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
N. Tang, D. Li, X. Wang и Z. Sun, «Аномальные параметры коагуляции связаны с плохим прогнозом у пациентов с новой коронавирусной пневмонией», Journal of Thrombosis and Haemostasis , vol. 18, нет. 4, стр. 844–847, 2020.
Tang, D. Li, X. Wang и Z. Sun, «Аномальные параметры коагуляции связаны с плохим прогнозом у пациентов с новой коронавирусной пневмонией», Journal of Thrombosis and Haemostasis , vol. 18, нет. 4, стр. 844–847, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. Huang, Y. Wang, X. Li et al., «Клинические особенности пациентов, инфицированных новым коронавирусом 2019 года в Ухане, Китай», The Lancet , vol. 395, нет. 10223, стр. 497–506, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. Ван, Б. Ху, К. Ху и др., «Клинические характеристики 138 госпитализированных пациентов с 2019 г.новая коронавирусная пневмония в Ухане, Китай», JAMA , vol. 323, нет. 11, с. 1061, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Ю. Ван, Дж. Шанг, Р. Грэм, Р. С. Барик и Ф. Ли, «Распознавание рецепторов новым коронавирусом из Уханя: анализ, основанный на десятилетних структурных исследованиях коронавируса атипичной пневмонии». Журнал вирусологии , том. 94, нет. 7, 2020.
Ван, Дж. Шанг, Р. Грэм, Р. С. Барик и Ф. Ли, «Распознавание рецепторов новым коронавирусом из Уханя: анализ, основанный на десятилетних структурных исследованиях коронавируса атипичной пневмонии». Журнал вирусологии , том. 94, нет. 7, 2020.
Посмотреть по адресу:
Сайт издателя | Академия Google
S. Kowalczuk, A. Bröer, N. Tietze, JM Vanslambrouck, JEJ Rasko и S. Bröer, «Белковый комплекс в мембране щеточной каемки объясняет аллель расстройства Хартнупа», The FASEB Journal , об. 22, нет. 8, стр. 2880–2887, 2008.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Б. Гейтс, «Реагирование на COVID-19 — пандемия, которая случается раз в столетие?» Медицинский журнал Новой Англии , том. 382, нет. 18, стр. 1677–1679., 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
T.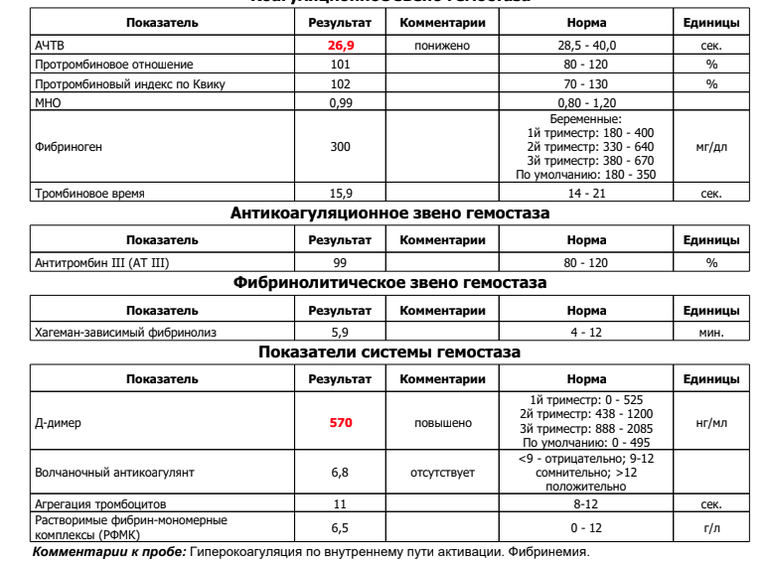 Zhou, Q. Liu, Z. Yang et al., «Предварительный прогноз основного числа репродукции уханьского нового коронавируса 2019-nCoV», Journal of Evidence-Based Medicine , vol. 13, нет. 1, стр. 3–7, 2020 г.
Zhou, Q. Liu, Z. Yang et al., «Предварительный прогноз основного числа репродукции уханьского нового коронавируса 2019-nCoV», Journal of Evidence-Based Medicine , vol. 13, нет. 1, стр. 3–7, 2020 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J. Cohen, «Иммунопатогенез сепсиса», Nature , vol. 420, нет. 6917, стр. 885–89.1, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
E. Giannitsis, J. Mair, C. Christersson et al., «Как использовать D-димер при неотложной сердечно-сосудистой помощи», European Heart Journal Acute Cardiovassal Care , vol. 6, нет. 1, pp. 69–80, 2016.
Посмотреть по адресу:
Google Scholar
C.V. Ramana, M.P. DeBerge, A. Kumar, C.S. γ в CD8 + Опосредованное Т-клетками повреждение легких опосредуется как Stat1-зависимыми, так и независимыми путями», American Journal of Physiology.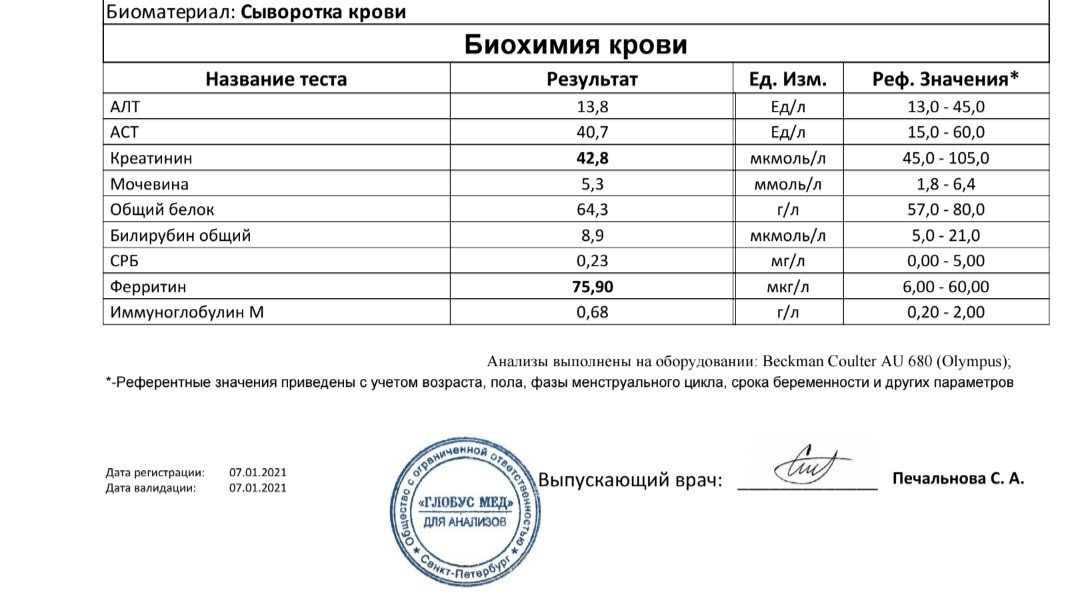 Клеточная и молекулярная физиология легких , том. 308, нет. 7, стр. L650–L657, 2015.
Клеточная и молекулярная физиология легких , том. 308, нет. 7, стр. L650–L657, 2015.
Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Беренс и В. С. Александер, «Цитокиновый контроль мегакариопоэза», Факторы роста , том. 36, нет. 3–4, стр. 89–103, 2018 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
Ю. Лю, А. А. Гейл, А. Уайлдер-Смит и Дж. Роклев, «Репродуктивное число COVID-19 выше по сравнению с коронавирусом SARS», Journal of Travel Medicine , vol. 27, нет. 2, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Чен, М. Чжоу, X. Донг и др., «Эпидемиологические и клинические характеристики 99 случаев новой коронавирусной пневмонии 2019 г. в Ухане, Китай: описательное исследование», The Lancet , том. 395, нет. 10223, стр. 507–513, 2020.
395, нет. 10223, стр. 507–513, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright © 2020 Hui Long et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
У пациентов в критическом состоянии часто возникает нарушение свертывания крови, что серьезно влияет на их прогноз. В этом ретроспективном исследовании изучались последствия изменений свертываемости крови у пациентов с коронавирусной болезнью 2019 года (COVID-19). Были проанализированы записи пациентов, поступивших с COVID-19 в период с 4 по 16 февраля 2020 года. Первичным исходом была внутрибольничная смерть. Всего было включено 85 пациентов, из которых 12 умерли в больнице. Протромбиновое время при поступлении (PT), международное нормализованное отношение (INR) и уровни D-димера и продуктов деградации фибрина/фибриногена (FDP) были значительно выше у невыживших, чем у выживших, в то время как обратное было верно для активности протромбинового времени. (PT-акт) и PaO 2 /FiO 2 . Многофакторная логистическая регрессия показала, что PT-act < 75% был независимо связан со смертностью. Площадь под кривыми рабочих характеристик приемника для PT-act, D-димера и FDP при поступлении может значительно предсказать смертность. AUC для PT-act были выше, чем для D-димера и FDP; однако существенной разницы не было. Через 2 недели лечения показатели коагуляции у выживших больных улучшились. COVID-19 часто сопровождается аномальной коагуляцией. PT-act при поступлении способен прогнозировать смертность у пациентов с COVID-19как и уровни D-димера и FDP. PT-act < 75% независимо связан со смертностью.
Всего было включено 85 пациентов, из которых 12 умерли в больнице. Протромбиновое время при поступлении (PT), международное нормализованное отношение (INR) и уровни D-димера и продуктов деградации фибрина/фибриногена (FDP) были значительно выше у невыживших, чем у выживших, в то время как обратное было верно для активности протромбинового времени. (PT-акт) и PaO 2 /FiO 2 . Многофакторная логистическая регрессия показала, что PT-act < 75% был независимо связан со смертностью. Площадь под кривыми рабочих характеристик приемника для PT-act, D-димера и FDP при поступлении может значительно предсказать смертность. AUC для PT-act были выше, чем для D-димера и FDP; однако существенной разницы не было. Через 2 недели лечения показатели коагуляции у выживших больных улучшились. COVID-19 часто сопровождается аномальной коагуляцией. PT-act при поступлении способен прогнозировать смертность у пациентов с COVID-19как и уровни D-димера и FDP. PT-act < 75% независимо связан со смертностью.
В декабре 2019 года в городе Ухань разразилась неизвестная пневмония, которая была подтверждена как острое респираторное инфекционное заболевание, вызванное коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2, ранее известное как 2019-nCoV). Впоследствии 11 февраля 2020 г. ВОЗ назвала это заболевание коронавирусной болезнью 2019 г. (COVID-19).широко распространилась и нанесла большой ущерб во многих странах мира.
Пневмония, особенно тяжелая пневмония, может привести к аномальной коагуляции [1, 2]. Недавно в некоторых исследованиях сообщалось, что тяжелая форма COVID-19 обычно осложняется коагулопатией, а повышенные уровни D-димера и продуктов деградации фибрина/фибриногена (FDP) были связаны с неблагоприятным прогнозом при тяжелой форме COVID-19 [3,4,5,6]. ]. SARS-CoV-2 может активировать врожденную иммунную систему для уничтожения вируса; однако чрезмерные иммунные реакции могут вызывать воспалительные бури, нарушать микроциркуляцию, активировать систему свертывания крови и приводить к диссеминированному внутрисосудистому свертыванию крови (ДВС-синдром).
Влияние нарушения свертывания крови на прогноз COVID-19 привлекает все большее внимание [3]. Однако исследования прогностических и прогностических значений параметров свертывания крови у пациентов с COVID-19 все еще ограничены. Цель этого ретроспективного исследования случай-контроль состояла в том, чтобы изучить прогностические значения параметров свертывания для внутрибольничной смертности у пациентов с COVID-19 и сравнить их. Кроме того, были исследованы независимые факторы риска смертности.
Мы провели ретроспективное когортное исследование пациентов с COVID-19, которые были госпитализированы в палаты третьей группы бригады медицинской помощи Чунцина в городе Ухань провинции Хубэй в Китае с 4 февраля 2020 г., по 16 февраля 2020 г.
Комитет по этике Детской больницы Чунцинского медицинского университета (Институциональный наблюдательный совет Детской больницы Чунцинского медицинского университета) одобрил это ретроспективное когортное исследование. Записи пациентов были анонимизированы до анализа.
Записи пациентов были анонимизированы до анализа.
С 4 февраля 2020 г. по 16 февраля 2020 г. последовательные пациенты в палатах с инфекцией SARS-CoV-2, подтвержденной анализом полимеразной цепной реакции с обратной транскрипцией (RT-PCR) в режиме реального времени из образцов мазков из носа и горла, и с пневмонией, подтвержденной компьютерной томографией (КТ) и тестом на коагуляцию, завершенным в течение 12 часов после поступления. Также были исключены пациенты со специфическими сердечно-сосудистыми заболеваниями, принимавшие антикоагулянты до поступления.
Коагуляционные тесты, которые включали протромбиновое время (ПВ), активность протромбинового времени (ПВ-акт), международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ), фибриноген (Фиб), D -димер, фибрин/ФДП и активность антитромбина III определяли с использованием автоматического анализатора коагуляции Sysmex CS5100 (Япония) и реактивов собственной разработки.
Исследуемые переменные: возраст, пол, индекс массы тела (ИМТ), сопутствующие заболевания, ПВ, ПВ-акт, МНО, АЧТВ, ТТ, Фиб, D-димер, ФДП, активность антитромбина III, PaO 2 /FiO 2 , подсчет лимфоцитов, подсчет тромбоцитов (PLT), компьютерная томография органов грудной клетки и применение профилактической антикоагулянтной терапии после госпитализации.
Первичным исходом была внутрибольничная смерть.
Данные были проанализированы с использованием SPSS 21.0 (SPSS Inc. Чикаго, Иллинойс, США). Непрерывные переменные показаны как медианы (межквартильные размахи, IQR), а категориальные данные показаны как проценты. Сравнение двух медиан было выполнено с использованием шкалы Манна-Уитни 9.0007 U , и сравнение процентных значений выполняли с помощью критерия хи-квадрат. Был проведен многофакторный анализ, чтобы определить, является ли PT-act <75% фактором риска смертности после корректировки других переменных. Кривые рабочих характеристик приемника (ROC) (MedCalc v15.11.4, Остенде, Бельгия) использовались для определения параметров свертывания крови при поступлении в качестве предикторов смертности. Средние параметры коагуляции при поступлении и через 2 недели сравнивали с помощью теста Вилкоксона. А Значение P <0,05 считалось статистически значимым для всех анализов.
Кривые рабочих характеристик приемника (ROC) (MedCalc v15.11.4, Остенде, Бельгия) использовались для определения параметров свертывания крови при поступлении в качестве предикторов смертности. Средние параметры коагуляции при поступлении и через 2 недели сравнивали с помощью теста Вилкоксона. А Значение P <0,05 считалось статистически значимым для всех анализов.
Всего за период исследования было госпитализировано 93 пациента, 85 из которых соответствовали критериям включения в данное исследование. Восемь пациентов были исключены в соответствии с критериями исключения. Медиана возраста больных составила 63,0 (54,5; 70,0) года с вариациями от 31 до 89 лет. Сорок восемь (48/85, 56,47%) пациентов были мужчинами, а 45 (45/85, 52,94%) пациентов имели по крайней мере одно хроническое сопутствующее заболевание. Гипертония (35,29%), диабет (14,12%) и ишемическая болезнь сердца (11,76%) были наиболее распространенными сопутствующими заболеваниями. Процент госпитализации PaO 2 /FiO 2 < 200 и СРБ > 80 мг/л у невыживших был значительно выше, чем у выживших. По сравнению с выжившими, количество лимфоцитов и тромбоцитов у невыживших было значительно ниже. Профилактическая антикоагулянтная терапия (эноксапарин, 40 мг 1 раз в сутки) применялась у 47 больных примерно в течение 5 дней после поступления. Сравнение демографических и клинических характеристик выживших и невыживших показано в Таблице 19.0003 Таблица 1 Демографические и клинические характеристики выживших и невыживших
Процент госпитализации PaO 2 /FiO 2 < 200 и СРБ > 80 мг/л у невыживших был значительно выше, чем у выживших. По сравнению с выжившими, количество лимфоцитов и тромбоцитов у невыживших было значительно ниже. Профилактическая антикоагулянтная терапия (эноксапарин, 40 мг 1 раз в сутки) применялась у 47 больных примерно в течение 5 дней после поступления. Сравнение демографических и клинических характеристик выживших и невыживших показано в Таблице 19.0003 Таблица 1 Демографические и клинические характеристики выживших и невыживших
Полноразмерная таблица
PT при поступлении, МНО и уровни D-димера и FDP были значительно выше у у невыживших, чем у выживших, тогда как для PT-act было наоборот (табл. 2). Между тем процент лиц с PT > 13 с, PT-act < 75%, D-димер > 0,55 мг/л и FDP > 5 мг/л был значительно выше у невыживших, чем у выживших (таблица 2).
Таблица 2. Сравнение параметров коагуляции у выживших и невыживших
Сравнение параметров коагуляции у выживших и невыживших Полноразмерная таблица
Одномерный и многомерный логистический регрессионный анализ был проведен для определения того, была ли госпитализация PT-act < 75% независимо связана со смертностью (таблица 3). При поступлении PT-act <75% (скорректированное отношение шансов (ОШ) = 25,623; 95% доверительный интервал (ДИ): 2,639–248,750; P = 0,005) был независимым фактором риска смертности, когда другие переменные контролировались.
Таблица 3 Одномерная и многомерная логистическая регрессия для выявления факторов риска при поступлении, связанных со смертностьюПолноразмерная таблица
Анализ площади под кривой (AUC) использовался для прогнозирования смертности. Прием PT-act D-димера и FDP мог прогнозировать смертность у пациентов с COVID-19 (табл. 4 и рис. 1). AUC для PT-act составила 0,905 (95% ДИ: от 0,822 до 0,958, P <0,001), для D-димера — 0,816 (95% ДИ: от 0,717 до 0,89). 1, P <0,001), а для FDP — 0,830 (95% ДИ: от 0,734 до 0,903, P <0,001) (таблица 4). AUC при приеме PT-act были выше, чем при приеме D-димера и FDP у пациентов с COVID-19; однако статистически значимых различий не было (AUC для PT-act по сравнению с AUC для D-димера, P = 0,216; AUC для PT-act по сравнению с AUC для FDP, P = 0,281). Пороговое значение 76%, полученное для площади РТ-акта, имело максимальную чувствительность (100%) и специфичность (78,08%) для прогнозирования летальности (табл. 4).
1, P <0,001), а для FDP — 0,830 (95% ДИ: от 0,734 до 0,903, P <0,001) (таблица 4). AUC при приеме PT-act были выше, чем при приеме D-димера и FDP у пациентов с COVID-19; однако статистически значимых различий не было (AUC для PT-act по сравнению с AUC для D-димера, P = 0,216; AUC для PT-act по сравнению с AUC для FDP, P = 0,281). Пороговое значение 76%, полученное для площади РТ-акта, имело максимальную чувствительность (100%) и специфичность (78,08%) для прогнозирования летальности (табл. 4).
Полноразмерная таблица
Рис. 1Кривые рабочих характеристик приемника для способности прогнозировать D-димер, FDP и PT-act госпитальная летальность у больных с COVID-19
В группе выживания ( n = 73) состояние больных улучшилось, и КТ грудной клетки также постепенно улучшалась.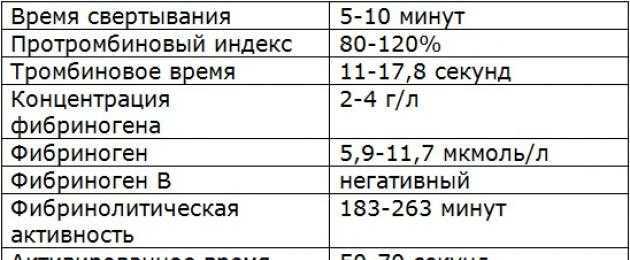 Четыре пациента чувствовали себя достаточно хорошо для выписки в течение 2 недель после поступления. Пятьдесят восемь госпитализированных выживших прошли тесты на коагуляцию через 2 недели после лечения. Через 2 недели после госпитализации ПВ, МНО, АЧТВ и ФИН были значительно ниже, чем в начале исследования, в то время как для ПВ-акт наблюдалось обратное (табл. 5). Кроме того, среди 12 пациентов, у которых при поступлении PT-act был <75%, у 10 пациентов значения PT-act стали выше 75% через 2 недели лечения (таблица 5).
Четыре пациента чувствовали себя достаточно хорошо для выписки в течение 2 недель после поступления. Пятьдесят восемь госпитализированных выживших прошли тесты на коагуляцию через 2 недели после лечения. Через 2 недели после госпитализации ПВ, МНО, АЧТВ и ФИН были значительно ниже, чем в начале исследования, в то время как для ПВ-акт наблюдалось обратное (табл. 5). Кроме того, среди 12 пациентов, у которых при поступлении PT-act был <75%, у 10 пациентов значения PT-act стали выше 75% через 2 недели лечения (таблица 5).
Полная таблица
Наконец, все выжившие ( n = 73) были выписаны.
Нарушение свертывания крови, по-видимому, является важной проблемой у пациентов с COVID-19. В последнее время некоторые исследователи проанализировали клинические и лабораторные данные о COVID-19 и обнаружили, что у пациентов с тяжелым течением заболевания часто отмечались удлинение ПВ, повышение уровня D-димера, низкий уровень фибриногена и ДВС-синдром [6, 7]. Воспалительные бури — признак тяжелой формы COVID-19. По сравнению с больными средней степени тяжести у больных тяжелой степени чаще отмечались одышка и лимфопения при заметно более высоких уровнях ИЛ-2Р, ИЛ-6, ИЛ-10 и ФНО-α [8]. Тяжелое воспалительное состояние, вторичное по отношению к COVID-19, приводит к тяжелым нарушениям гемостаза и заметному изменению параметров свертывания крови [4, 9, 10, 11]. Принято считать, что ухудшение показателей свертывания крови при течении болезни тесно связано с ухудшением течения COVID-19 и летальным исходом.
Воспалительные бури — признак тяжелой формы COVID-19. По сравнению с больными средней степени тяжести у больных тяжелой степени чаще отмечались одышка и лимфопения при заметно более высоких уровнях ИЛ-2Р, ИЛ-6, ИЛ-10 и ФНО-α [8]. Тяжелое воспалительное состояние, вторичное по отношению к COVID-19, приводит к тяжелым нарушениям гемостаза и заметному изменению параметров свертывания крови [4, 9, 10, 11]. Принято считать, что ухудшение показателей свертывания крови при течении болезни тесно связано с ухудшением течения COVID-19 и летальным исходом.
Как один из наиболее важных параметров, ПВ широко используется для оценки функции свертывания крови в клинике. Во многих исследованиях изучалось изменение ПВ у пациентов с COVID-19.[7,8,9, 12,13,14,15]. Чен и др. [8] показали, что PT существенно не отличался между тяжелыми и умеренными случаями COVID-19. Хан и др. [5] также сообщили, что не было существенной разницы в ПВ между пациентами с разной степенью тяжести COVID-19 и здоровым контролем. Однако в большем количестве исследований сообщалось, что тяжелые пациенты имели значительно более длительное ПВ по сравнению с нетяжелыми пациентами [16,17,18]. Кроме того, два исследования COVID-19 показали, что у невыживших были более высокие уровни PT, чем у выживших [6, 12]. Мы также обнаружили, что PT при поступлении был значительно выше у невыживших, чем у выживших, в то время как значения PT при поступлении у большинства пациентов (70/85, 82,35%) были в пределах нормы (9).до 13 с) в настоящем исследовании.
Однако в большем количестве исследований сообщалось, что тяжелые пациенты имели значительно более длительное ПВ по сравнению с нетяжелыми пациентами [16,17,18]. Кроме того, два исследования COVID-19 показали, что у невыживших были более высокие уровни PT, чем у выживших [6, 12]. Мы также обнаружили, что PT при поступлении был значительно выше у невыживших, чем у выживших, в то время как значения PT при поступлении у большинства пациентов (70/85, 82,35%) были в пределах нормы (9).до 13 с) в настоящем исследовании.
Следует отметить, что вариабельность реагентов тромбопластина может привести к большим межлабораторным различиям в результатах ПК. INR широко используется в клинике и позволяет сравнивать результаты разных лабораторий путем стандартизации различных реагентов: INR = (PT тест / PT нормальный ) ISI , где PT тест относится к PT значение пациента, PT нормальный относится к значению PT нормального контроля здоровья, а ISI указывает Международный индекс чувствительности используемого реагента тромбопластина. В настоящем исследовании мы обнаружили, что значения МНО были значительно выше у невыживших, чем у выживших; однако 97,65% значений МНО при поступлении находились в пределах нормы (0,76–1,24).
В настоящем исследовании мы обнаружили, что значения МНО были значительно выше у невыживших, чем у выживших; однако 97,65% значений МНО при поступлении находились в пределах нормы (0,76–1,24).
PT-act также предоставляет в качестве дополнения общую международную шкалу для отчетности PT. Формула расчета PT-act выглядит следующим образом: PT-act = [PT нормальный - (PT нормальный × 0,6)] / [PT тест - (PT нормальный × 0,6)] × 100%. ПВ-акт имеет то же клиническое значение, что и ПВ, и может точно отражать активность факторов свертывания крови II, V, VII и X. Снижение синтеза факторов свертывания крови, ДВС-синдрома и гиперфибринолиза могут значительно удлинять ПВ и снижать ПВ-акт. В этом исследовании PT-act был значительно ниже у невыживших, чем у выживших. Мы также показываем, что частота PT-акта <75% при поступлении была заметно высокой (91,67%) у невыживших, в то время как у выживших он составил 21,92%, а процент аномальных значений ПВ и МНО у невыживших составил 50% и 16,67% соответственно. Поэтому мы утверждаем, что PT-act может лучше отражать тяжесть состояния пациентов, чем PT и МНО.
Поэтому мы утверждаем, что PT-act может лучше отражать тяжесть состояния пациентов, чем PT и МНО.
В настоящее время существует только одно исследование, включающее PT-act у пациентов с COVID-19 [5]. Хан и др. [5] сообщили, что PT-act был ниже у пациентов с SARS-CoV-2 по сравнению со здоровым контролем и что PT-act снижался с увеличением тяжести заболевания; однако в этом исследовании не изучалось влияние PT-act на исход пациентов с COVID-19.. Исследователи не сосредоточились на PT-act, что может быть связано с тем, что PT-act не был общепринятым показателем функции свертывания крови в клинике, а некоторые больницы не проводили тестирование PT-act.
Многие исследования COVID-19 были сосредоточены на уровне D-димера. Пациенты с COVID-19 с уровнем D-димера ≥ 2,0 мкг/мл имели более высокую смертность, чем пациенты с уровнем D-димера <2,0 мкг/мл, и авторы утверждали, что D-димер может быть ранним и полезным маркером для улучшения управление COVID-19пациентов [19]. Другое исследование показало, что у 16 пациентов с ОРДС COVID-19 был повышен уровень D-димера (5,5 мкг/мл, межквартильный диапазон 2,5–6,5) [20].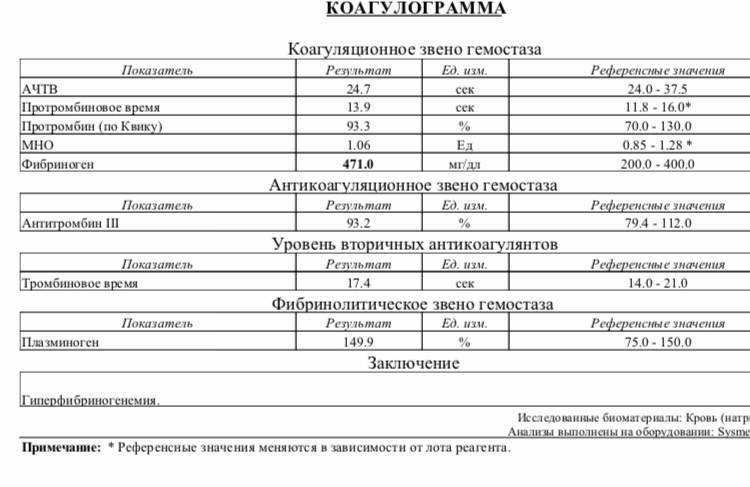 Метаанализ показал, что примерно у 37,2% пациентов с COVID-19 был повышен уровень D-димера [21]. Значительное повышение D-димера у пациентов с тяжелой новой коронавирусной пневмонией (NCP) было хорошим показателем для выявления групп с высоким риском венозной тромбоэмболии [13]. Танг и др. [6] обнаружили, что заметно повышенные уровни D-димера и FDP часто встречаются при смерти от NCP. Танг и др. [14] использовали гепарин для лечения пациентов и сообщили, что 28-дневная смертность у принимавших гепарин была ниже, чем у не принимавших гепарин, у пациентов с уровнями D-димера > 6 раз выше верхней границы нормы (32,8% против 52,4%). %, P = 0,017). Наше исследование показало, что уровни D-димера у 58,82% (50/85) пациентов с COVID-19 превышали верхнюю границу нормы (0,55 мг/л), а у невыживших уровень D-димера был значительно выше. уровня, чем выжившие.
Метаанализ показал, что примерно у 37,2% пациентов с COVID-19 был повышен уровень D-димера [21]. Значительное повышение D-димера у пациентов с тяжелой новой коронавирусной пневмонией (NCP) было хорошим показателем для выявления групп с высоким риском венозной тромбоэмболии [13]. Танг и др. [6] обнаружили, что заметно повышенные уровни D-димера и FDP часто встречаются при смерти от NCP. Танг и др. [14] использовали гепарин для лечения пациентов и сообщили, что 28-дневная смертность у принимавших гепарин была ниже, чем у не принимавших гепарин, у пациентов с уровнями D-димера > 6 раз выше верхней границы нормы (32,8% против 52,4%). %, P = 0,017). Наше исследование показало, что уровни D-димера у 58,82% (50/85) пациентов с COVID-19 превышали верхнюю границу нормы (0,55 мг/л), а у невыживших уровень D-димера был значительно выше. уровня, чем выжившие.
Многофакторный логистический регрессионный анализ показал, что PT-act при поступлении <75% был независимым фактором риска смертности у пациентов с COVID-19 в настоящем исследовании; однако прием D-димера > 0,55 мг/л не был независимым фактором риска смертности.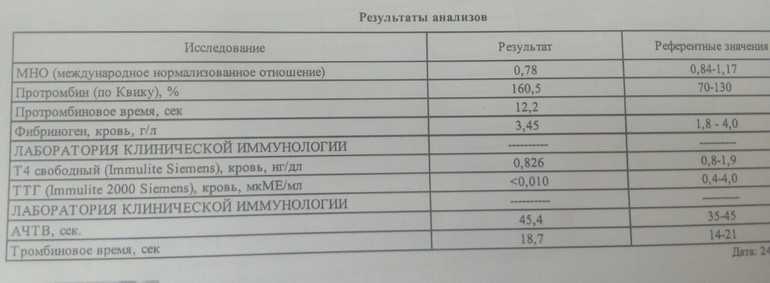 Чжоу и др. [12] сообщили, что многовариантная регрессия показала увеличение шансов внутрибольничной смерти, связанной с D-димером > 1 мкг/мл при поступлении. Лю и др. [22] обнаружили, что повышенный уровень D-димера при поступлении был тесно связан со смертью посредством многовариантной логистической регрессии. Ву и др. [23] также сообщили, что D-димер был связан с прогрессированием от ОРДС до смерти в двумерном регрессионном анализе Кокса. Конечно, различия между нашим исследованием и другими исследованиями могут быть связаны с различным дизайном исследования и скринингом индикаторов. Однако величине ПТ-акта при поступлении следует уделять должное внимание при лечении пациентов с COVID-19..
Чжоу и др. [12] сообщили, что многовариантная регрессия показала увеличение шансов внутрибольничной смерти, связанной с D-димером > 1 мкг/мл при поступлении. Лю и др. [22] обнаружили, что повышенный уровень D-димера при поступлении был тесно связан со смертью посредством многовариантной логистической регрессии. Ву и др. [23] также сообщили, что D-димер был связан с прогрессированием от ОРДС до смерти в двумерном регрессионном анализе Кокса. Конечно, различия между нашим исследованием и другими исследованиями могут быть связаны с различным дизайном исследования и скринингом индикаторов. Однако величине ПТ-акта при поступлении следует уделять должное внимание при лечении пациентов с COVID-19..
Точность параметров коагуляции для прогнозирования внутрибольничной летальности оценивалась с помощью анализа ROC-кривой. Мы обнаружили, что PT-act, D-димер и FDP являются значимыми предикторами смертности. В сочетании с тем фактом, что PT-act <75% является независимым фактором риска смерти пациента, мы утверждаем, что PT-act является полезным индексом для прогнозирования смерти пациента от COVID-19. Лю и др. [11] сообщили, что с использованием анализа ROC значения AUC для PT, FDP и D-димера при поступлении составляли 0,892, 0,81 и 0,809., соответственно, для прогнозирования госпитальной летальности у пациентов с COVID-19. Другое исследование COVID-19 также показало, что AUC PT и D-димера при поступлении составляли 0,643 и 0,742 для прогнозирования смертности, и они увеличивались до 0,937 и 0,851 соответственно в комбинированной конечной точке [22]. В сочетании с этими исследованиями мы утверждаем, что конкретные параметры свертывающей функции, включая PT-act при поступлении, могут эффективно прогнозировать прогноз пациентов с COVID-19. Хотя серийные измерения могут предоставить больше информации и направить лечение, тестирование параметров коагуляции при поступлении по-прежнему имеет то преимущество, что своевременно предоставляет врачам ключевую информацию и помогает врачам быстро назначить соответствующее лечение на ранней стадии госпитализации.
Лю и др. [11] сообщили, что с использованием анализа ROC значения AUC для PT, FDP и D-димера при поступлении составляли 0,892, 0,81 и 0,809., соответственно, для прогнозирования госпитальной летальности у пациентов с COVID-19. Другое исследование COVID-19 также показало, что AUC PT и D-димера при поступлении составляли 0,643 и 0,742 для прогнозирования смертности, и они увеличивались до 0,937 и 0,851 соответственно в комбинированной конечной точке [22]. В сочетании с этими исследованиями мы утверждаем, что конкретные параметры свертывающей функции, включая PT-act при поступлении, могут эффективно прогнозировать прогноз пациентов с COVID-19. Хотя серийные измерения могут предоставить больше информации и направить лечение, тестирование параметров коагуляции при поступлении по-прежнему имеет то преимущество, что своевременно предоставляет врачам ключевую информацию и помогает врачам быстро назначить соответствующее лечение на ранней стадии госпитализации.
Это исследование имеет несколько ограничений.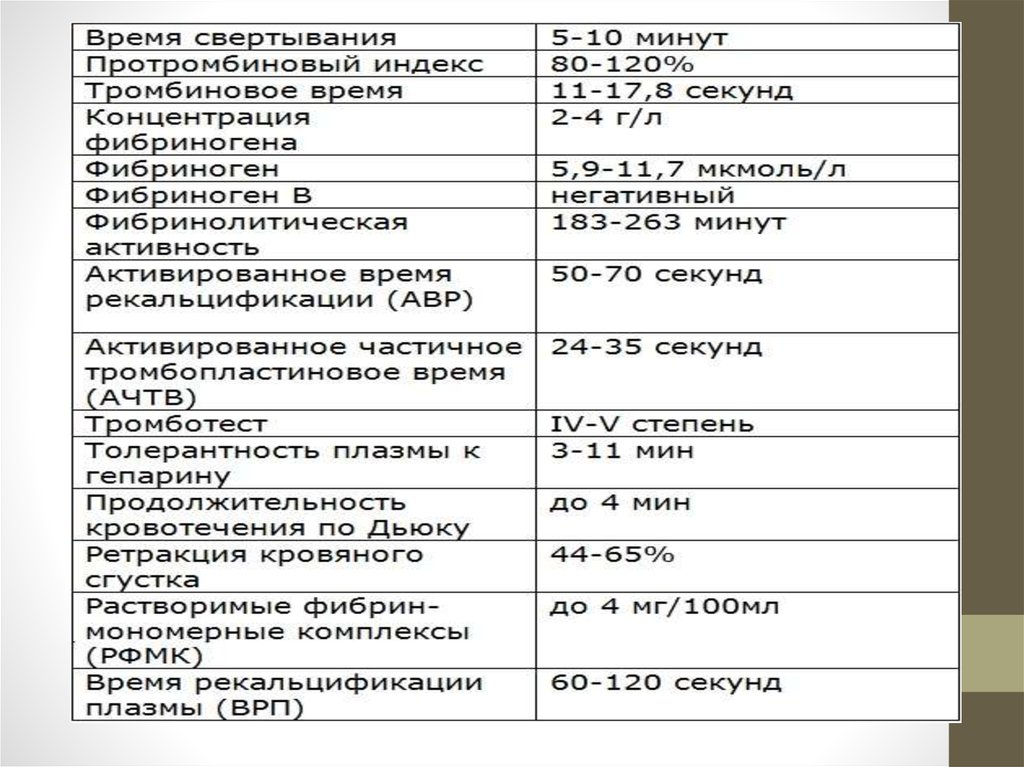 Во-первых, это ретроспективное исследование было ограничено факторами, присущими ретроспективному анализу. Во-вторых, это было одноцентровое ретроспективное исследование, и результаты могут быть нерепрезентативными из-за небольшого размера выборки. Тем не менее, это может быть первое клиническое исследование, посвященное прогностической ценности PT-act при поступлении для смертности у пациентов с COVID-19. Для проверки наших результатов необходимо многоцентровое исследование с большим размером выборки. В-третьих, мы собирали анализы крови только при поступлении и через 2 недели после госпитализации, что может неточно отражать непрерывные динамические изменения свертывания крови. В-четвертых, из-за отсутствия ультразвукового скрининга сосудов у нас нет данных о возникновении тромбов у больных. Наконец, относительно высокая смертность связана с тяжелым состоянием больных (при поступлении PaO 2 /FiO 2 из 68 пациентов было менее 300) и неадекватные ранние медицинские условия.
Во-первых, это ретроспективное исследование было ограничено факторами, присущими ретроспективному анализу. Во-вторых, это было одноцентровое ретроспективное исследование, и результаты могут быть нерепрезентативными из-за небольшого размера выборки. Тем не менее, это может быть первое клиническое исследование, посвященное прогностической ценности PT-act при поступлении для смертности у пациентов с COVID-19. Для проверки наших результатов необходимо многоцентровое исследование с большим размером выборки. В-третьих, мы собирали анализы крови только при поступлении и через 2 недели после госпитализации, что может неточно отражать непрерывные динамические изменения свертывания крови. В-четвертых, из-за отсутствия ультразвукового скрининга сосудов у нас нет данных о возникновении тромбов у больных. Наконец, относительно высокая смертность связана с тяжелым состоянием больных (при поступлении PaO 2 /FiO 2 из 68 пациентов было менее 300) и неадекватные ранние медицинские условия. Несмотря на эти ограничения, мы обнаружили, что PT-акт при поступлении имеет прогностическое и прогностическое значение, что может позволить клиницистам выявлять пациентов с COVID-19, которые находятся в группе высокого риска смерти на ранней стадии заболевания.
Несмотря на эти ограничения, мы обнаружили, что PT-акт при поступлении имеет прогностическое и прогностическое значение, что может позволить клиницистам выявлять пациентов с COVID-19, которые находятся в группе высокого риска смерти на ранней стадии заболевания.
Наконец, необходимо было указать, что 81 из 85 пациентов, включенных в настоящее исследование, также участвовали в другом исследовании [24], которое не включало коагуляцию.
COVID-19 часто сопровождается аномальной коагуляцией. PT-act при поступлении может прогнозировать смертность у пациентов с COVID-19, как и уровни D-димера и FDP. Более того, PT-act < 75% независимо связан со смертностью.
Все соответствующие данные находятся в документе.
Idell S (2003) Коагуляция, фибринолиз и отложение фибрина при остром повреждении легких. Crit Care Med 31 (4 Suppl): S213–S220.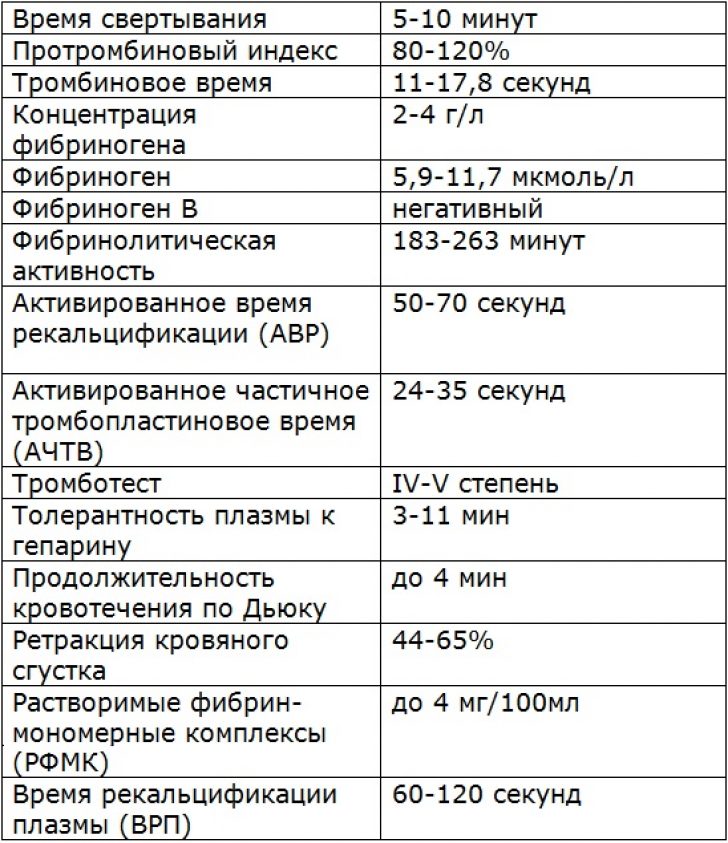 https://doi.org/10.1097/01.CCM.0000057846.21303.AB
https://doi.org/10.1097/01.CCM.0000057846.21303.AB
Артикул КАС пабмед Google Scholar
Welty-Wolf KE, Carraway MS, Ortel TL, Piantadosi CA (2002)Коагуляция и воспаление при остром повреждении легких. Thromb Haemost 88(1):17–25
CAS пабмед Google Scholar
Terpos E, Ntanasis-Stathopoulos I, Elalamy I, Kastritis E, Sergentanis TN, Politou M, Psaltopoulou T, Gerotziafas G, Dimopoulos MA (2020) Гематологические данные и осложнения COVID-19. Am J Hematol 95: 834–847. https://doi.org/10.1002/ajh.25829
Статья КАС пабмед Google Scholar
Panigada M, Bottino N, Tagliabue P, Grasselli G, Novembrino C, Chantarangkul V, Pesenti A, Peyvandi F, Tripodi A (2020) Гиперкоагуляция у пациентов с COVID-19 в отделении интенсивной терапии. Отчет о результатах тромбоэластографии и других параметрах гемостаза. Дж. Тромб Хемост 18: 1738–1742. https://doi.org/10.1111/jth.14850
Отчет о результатах тромбоэластографии и других параметрах гемостаза. Дж. Тромб Хемост 18: 1738–1742. https://doi.org/10.1111/jth.14850
Артикул КАС пабмед Google Scholar
Han H, Yang L, Liu R, Liu F, Wu KL, Li J, Liu XH, Zhu CL (2020) Выраженные изменения свертывания крови у пациентов с инфекцией SARS-CoV-2. Clin Chem Lab Med 58: 1116–1120. https://doi.org/10.1515/ccclm-2020-0188
Статья КАС пабмед Google Scholar
Tang N, Li D, Wang X, Sun Z (2020) Аномальные параметры коагуляции связаны с плохим прогнозом у пациентов с новой коронавирусной пневмонией. Дж. Тромб Хемост 18 (4): 844–847. https://doi.org/10.1111/jth.14768
Артикул КАС пабмед ПабМед Центральный Google Scholar
Яннис Д., Зиогас И.А., Джанни П. (2020) Нарушения свертывания крови у пациентов, инфицированных коронавирусом: COVID-19, SARS-CoV-1, MERS-CoV и уроки прошлого. Дж. Клин Вирол 127: 104362. https://doi.org/10.1016/j.jcv.2020.104362
(2020) Нарушения свертывания крови у пациентов, инфицированных коронавирусом: COVID-19, SARS-CoV-1, MERS-CoV и уроки прошлого. Дж. Клин Вирол 127: 104362. https://doi.org/10.1016/j.jcv.2020.104362
Статья КАС пабмед ПабМед Центральный Google Scholar
Чен Г, Ву Д, Го В, Цао И, Хуан Д, Ван Х, Ван Т, Чжан Х, Чен Х, Ю Х, Чжан Х, Чжан М, Ву С, Песня Дж, Чен Т, Хань М, Li S, Luo X, Zhao J, Ning Q (2020)Клинические и иммунологические особенности тяжелой и средней степени тяжести коронавирусной болезни, 2019 г. J Clin Invest 130(5):2620–2629. https://doi.org/10.1172/JCI137244
Статья КАС пабмед ПабМед Центральный Google Scholar
Чаухан А.Дж., Виффен Л.Дж., Браун Т.П. (2020) COVID-19: столкновение комплемента, путей коагуляции и воспаления. Джей Тромб Хемост. https://doi.org/10.1111/jth.14981
Fei Y, Tang N, Liu H, Cao W (2020) Дисфункция свертывания крови: отличительный признак COVID-19. Arch Pathol Lab Med 144: 1223–1229. https://doi.org/10.5858/arpa.2020-0324-SA
Статья пабмед Google Scholar
Liu Y, Gao W, Guo W, Guo Y, Shi M, Dong G, Ge Q, Zhu J, Lu J (2020) Выраженное нарушение свертывания крови тесно связано с воспалительной реакцией и может быть прогностическим показателем для Пациенты отделения интенсивной терапии с COVID-19. J Тромб Тромболизис. https://doi.org/10.1007/s11239-020-02174-9
Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X , Guan L, Wei Y, Li H, Wu X, Xu J, Tu S, Zhang Y, Chen H, Cao B (2020) Клиническое течение и факторы риска смертности взрослых стационарных пациентов с COVID-19 в Ухане, Китай: a ретроспективное когортное исследование. Ланцет 395 (10229): 1054–1062. https://doi.org/10.1016/S0140-6736(20)30566-3. Опечатка в: Lancet 395 (10229): 1038. https://doi.org/10.1016/S0140-6736(20)30606-1. Опечатка в: Ланцет 395(10229):1038. https://doi.org/10.1016/S0140-6736(20)30638-3
Опечатка в: Lancet 395 (10229): 1038. https://doi.org/10.1016/S0140-6736(20)30606-1. Опечатка в: Ланцет 395(10229):1038. https://doi.org/10.1016/S0140-6736(20)30638-3
Cui S, Chen S, Li X, Liu S, Wang F (2020) Распространенность венозной тромбоэмболии у пациентов с тяжелым новым коронавирусом пневмония. Дж. Тромб Хемост 18 (6): 1421–1424. https://doi.org/10.1111/jth.14830
Статья КАС пабмед Google Scholar
Tang N, Bai H, Chen X, Gong J, Li D, Sun Z (2020) Лечение антикоагулянтами связано со снижением смертности при тяжелой коронавирусной болезни 2019больных коагулопатией. Дж. Тромб Хемост 18 (5): 1094–1099. https://doi.org/10.1111/jth.14817
Статья КАС пабмед Google Scholar
Liu Q, Song NC, Zheng ZK, Li JS, Li SK (2020) Лабораторные данные и комбинированный многофакторный подход к прогнозированию смерти у пациентов с COVID-19 в критическом состоянии: ретроспективное исследование.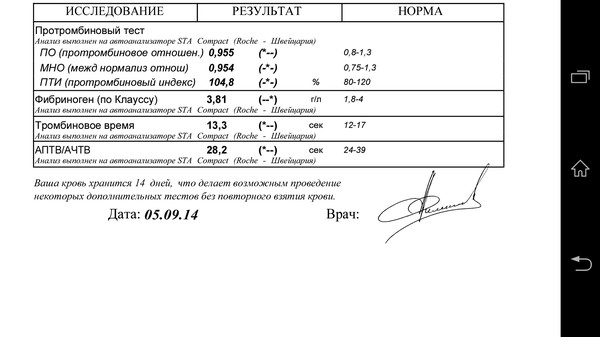 Эпидемиол Инфект 148:e129. https://doi.org/10.1017/S0950268820001442
Эпидемиол Инфект 148:e129. https://doi.org/10.1017/S0950268820001442
Статья КАС пабмед Google Scholar
Jin S, Jin Y, Xu B, Hong J, Yang X (2020) Распространенность и влияние дисфункции свертывания крови при COVID-19 в Китае: метаанализ [опубликовано в Интернете до печати, 17 июля 2020 г.]. Тромб Хемост. https://doi.org/10.1055/s-0040-1714369
Ляо Д., Чжоу Ф., Луо Л., Сюй М., Ван Х., Ся Дж., Гао И., Цай Л., Ван З., Инь П., Ван Y, Tang L, Deng J, Mei H, Hu Y (2020) Гематологические характеристики и факторы риска в классификации и оценке прогноза COVID-19: ретроспективное когортное исследование. Ланцет Haematol S2352-3026(20):30217–30219. https://doi.org/10.1016/S2352-3026(20)30217-9
Статья Google Scholar
Bao C, Tao X, Cui W, Yi B, Pan T, Young KH, Qian W (2020) Тромбоцитопения, индуцированная SARS-CoV-2, как важный биомаркер, значительно коррелирующий с аномальной функцией свертывания крови, повышенным риском внутрисосудистого образования тромбов и смертность у пациентов с COVID-19. Опыт Гематол Онкол 9:16. https://doi.org/10.1186/s40164-020-00172-4
Опыт Гематол Онкол 9:16. https://doi.org/10.1186/s40164-020-00172-4
Статья КАС пабмед ПабМед Центральный Google Scholar
Zhang L, Yan X, Fan Q, Liu H, Liu X, Liu Z, Zhang Z (2020) Уровни D-димера при поступлении для прогнозирования внутрибольничной смертности у пациентов с Covid-19. Дж. Тромб Хемост 18 (6): 1324–1329. https://doi.org/10.1111/jth.14859
Статья КАС пабмед Google Scholar
Рануччи М., Баллотта А., Ди Дедда У., Байшникова Е., Деи Поли М., Реста М., Фалько М., Альбано Г., Мениканти Л. (2020) Прокоагулянтный паттерн пациентов с острым респираторным дистресс-синдромом COVID-19. Дж. Тромб Хемост 18 (7): 1747–1751. https://doi.org/10.1111/jth.14854
Статья КАС пабмед Google Scholar
Zhu J, Ji P, Pang J, Zhong Z, Li H, He C, Zhang J, Zhao C (2020) Клинические характеристики 3062 COVID-19пациенты: метаанализ. J Med Virol 92: 1902–1914. https://doi.org/10.1002/jmv.25884
J Med Virol 92: 1902–1914. https://doi.org/10.1002/jmv.25884
Статья КАС пабмед Google Scholar
Long H, Nie L, Xiang X, Li H, Zhang X, Fu X, Ren H, Liu W, Wang Q, Wu Q (2020) D-димер и протромбиновое время являются важными показателями тяжелой формы COVID- 19 и плохой прогноз. Biomed Res Int 2020: 6159720–6159710. https://doi.org/10.1155/2020/6159720
Статья КАС пабмед ПабМед Центральный Google Scholar
Ву С, Чен С, Цай И, Ся Дж, Чжоу С, Сюй С, Хуан Х, Чжан Л, Чжоу С, Ду С, Чжан И, Сонг Дж, Ван С, Чао И, Ян З, Сюй J, Zhou X, Chen D, Xiong W, Xu L, Zhou F, Jiang J, Bai C, Zheng J, Song Y (2020) Факторы риска, связанные с острым респираторным дистресс-синдромом и смертью у пациентов с коронавирусной болезнью пневмонии 2019 года в Ухане , Китай. JAMA Intern Med 180 (7): 1–11. https://doi.org/10.1001/jamainternmed.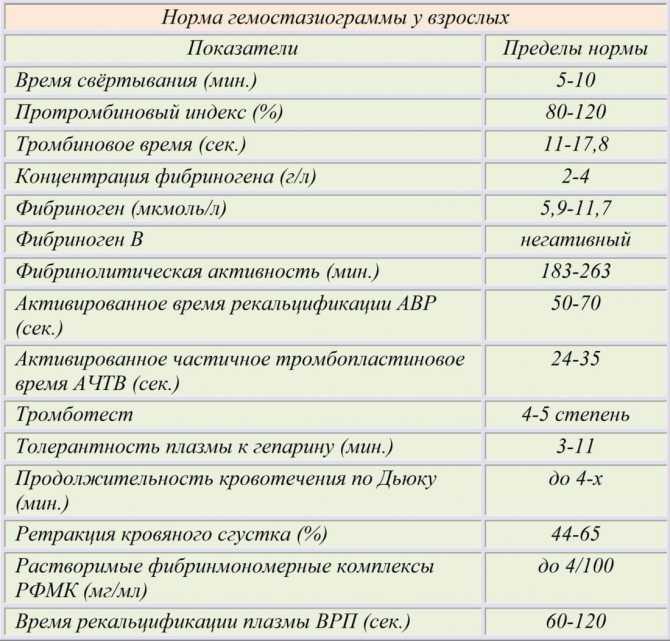 2020.0994
2020.0994
Статья КАС ПабМед Центральный Google Scholar
Fu YQ, Sun YL, Lu SW, Yang Y, Wang Y, Xu F (2020) Влияние анализа крови и иммунной функции на прогноз пациентов с COVID-19. medRxiv 2020.04.16.20067587. https://doi.org/10.1101/2020.04.16.20067587
Ссылки на скачивание
Проект клинических исследований COVID-19 в Чунцинском медицинском университете (грант № 0064) Автор
и информация об авторе
Отделение инфекционных заболеваний, Первая дочерняя больница Чунцинского медицинского университета, Чунцин, 400016, Китайская Народная Республика
Хун-чунь Луо
Отделение интенсивной терапии, Детская больница, Чунцинский медицинский университет, 136# Чжуншань Эр Road, Yu Zhong District, Chongqing, 400014, Китайская Народная Республика
Cheng-yan You, Si-wei Lu и Yue-qiang Fu
Ключевая лаборатория детского развития и расстройств Министерства образования, Чунцин, 400014, Народная Китайская Республика
Cheng-yan You, Si-wei Lu и Yue-qiang Fu
Национальный центр клинических исследований детского здоровья и детских расстройств (Чунцин), Чунцин, 400014, Китайская Народная Республика
Cheng-yan You, Si- Wei Lu & Yue-qiang Fu
Третья группа медицинской помощи из Чунцина в город Ухань, провинция Хубэй, Чунцин, Китайская Народная Республика
Yue-qiang Fu
Авторы
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
YF участвовал в разработке, сборе данных, управлении базой данных, статистическом анализе и координации.