2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Рак предстательной железы распространенное заболевание у мужчин старше 60 лет. Злокачественное заболевание поражает ткани предстательной железы, с ростом опухоль распространяется в регионарные лимфоузлы, в расположенные рядом с простатой ткани и органы. На поздних стадиях метастазы опухоли обнаруживаются в отдаленных органах и лимфоузлах. Рак предстательной железы развивается очень медленно, на раннем этапе его часто принимают за аденому простаты.
Выраженные симптомы появляются на поздней стадии развития рака, нередко выраженные симптомы становятся причиной первичного обращения больного к врачу. Смертность от рака простаты составляет около 8%, отмечается быстрый темп роста заболевания во всех странах мира.
Диагностика рака простаты начинается с осмотра у врача-уролога или онколога. Врач назначает ряд исследований, которые помогают определить наличие злокачественной опухоли, стадию развития рака, сопутствующие заболевания, тип злокачественной опухоли.
Рак предстательной железы МКБ 10 находится под кодом С61 – злокачественное новообразование предстательной железы.
Рак простаты код по МКБ 10 находится в классах С60-С63, куда включены злокачественные новообразования мужских половых органов, а также злокачественные новообразования кожи половых органов. МКБ 10 код представлен классами:
Рак простаты, код МКБ 10 используется для краткого описания диагноза пациента при оформлении медицинских документов. Код МКБ рак предстательной железы относится к социально опасным заболеваниям, которые находятся под кодами С00-С97.
Рак железы на ранней стадии протекает почти без симптомов, изредка беспокоя невыраженными проявлениями. Рак простаты развивается медленно, в течение длительного времени. Появление выраженных симптомов указывает на позднюю стадию заболевания. Из-за бессимптомности рака простаты его обнаружение нередко происходит на поздней стадии.
Рак простаты развивается медленно, в течение длительного времени. Появление выраженных симптомов указывает на позднюю стадию заболевания. Из-за бессимптомности рака простаты его обнаружение нередко происходит на поздней стадии.
Врачи рекомендуют после 45 лет регулярно проходить обследование на рак. Наиболее часто рак простаты диагностируют у мужчин в возрасте старше 60 лет, очень редко диагностируется у молодых мужчин. Раннее обнаружение рака простаты позволяет сохранить мужчине потенцию и способность удерживать мочу.
Факторов, влияющих на развитие рака простаты несколько:


Симптомы заболевания проявляются следующим образом:
В отдельных случаях симптомы рака простаты не проявляются. Симптомы рака простаты и аденомы (доброкачественной опухоли предстательной железы) похожи. При появлении первых признаков неблагополучия в области предстательной железы следует пройти исследования, чтобы исключить развитие рака простаты.
Химиотерапевтическое лечение – это воздействие сильных токсических веществ на клетки опухоли. Химиотерапия при раке простаты бывает нескольких видов:
Химиотерапия при раке простаты бывает нескольких видов:
Эти виды лечения также распространяются на химиотерапию при раке простаты с метастазами. Самым токсичным видом является красная химиотерапия. «Красной» химиотерапия при раке простаты называется из-за цвета используемых препаратов. Красная химиотерапия приводит к сильному снижению иммунитета, больной испытывает постоянную слабость, развиваются различные побочные эффекты.
Химиотерапия при раке простаты проводится несколькими способами: внутривенно, перорально, подкожно. Вид и дозы химиотерапевтического лекарства от рака предстательной железы подбираются врачом индивидуально для каждого пациента, в зависимости от стадии развития рака, состояния здоровья, возраста и других факторов.
В некоторых случаях химиотерапия вызывает различные тяжелые осложнения, врач отменяет или приостанавливает проведение лечения. Химиотерапевтическое лечение проводят в комплексе или как монолечение, а также перед хирургическим вмешательством или после него. Химиотерапию можно проходить амбулаторно или в стационаре. Химиотерапия может быть единственным альтернативным лечением, когда другие методы лечения рака не показали эффективности, нет других возможностей.
При раке простаты химиотерапию нередко назначают после гормонального лечения, которое перестало действовать на опухоль. Гормональная терапия, которая применяется при гормоночувствительных опухолях простаты, не приводит к полному излечению от рака. Такое лечение носит временный характер и не превышает 1-1,5 лет.
Временный эффект гормональной терапии связан с особенностями строения опухоли простаты. Опухоль простаты состоит из андрогеннезависимых, андрогензависимых, андрогенчувствительных клеток. Андрогеннезависимые клетки не требуют для своего роста андрогенов, андрогензависимые клетки нуждаются в андрогенной стимуляции для своего развития, андрогенчувствительные клетки замедляют свой рост при отсутствии андрогенов, но не погибают.
Гормональная терапия также может использоваться в составе комплексного лечения. Комплексное лечение (гормоны + химиотерапия) обладает более высокой эффективностью, чем каждый из методов в отдельности. Химия при раке простаты относится к паллиативным методам, направлена на замедление или прекращение роста раковой опухоли. Лучшим показателем эффективности химии считается падение уровня ПСА.
Показатель эффективности химиотерапии врач может определить после проведения 3-х курсов лечения. Больному в зависимости от стадии рака и переносимости лечения могут назначить 5 курсов химиотерапии рака простаты, может быть назначено до 10 курсов химиотерапии.
Химиотерапия при раке простаты назначается в определенных случаях:

ГР РПЖ (гормонорезистентный рак предстательной железы) – тяжелое заболевание, при котором лечение химиотерапевтическими препаратами неэффективно. Причинами неэффективности лечения химиопрепаратами становятся следующие факторы:
Считается, что при лечении рака предстательной железы химиотерапия используется только в определенных случаях, когда опухоль не поддается лечению другими методами. Химиотерапия помогает продлить жизнь больного на поздней стадии развития рака простаты.
На третьей стадии развития рака выживаемость больных составляет менее 40%. На этой стадии заболевания нарушаются функции мочеиспускания, дефекации, больной ощущает боль в области паха и промежности.
На третьей стадии рака простаты, когда в соседних органах и лимфатических узлах появляются метастазы опухоли, нельзя вылечить рак с помощью хирургической операции. Врач подбирает комбинированное лечение исходя из возраста, состояния здоровья пациента.
На этом этапе нередко применяют химиотерапию и лучевую терапию вместе с хирургическим лечением. На четвертой стадии развития рака предстательной железы химиотерапия служит для продления жизни больного, применяют другие методы, облегчающие состояние больного.
Начальная стадия рака простаты – это появление злокачественной опухоли в тканях органа. Сначала больной не ощущает развитие опухоли, новообразование начинает расти, постепенно появляются первые симптомы – увеличение предстательной железы, нарушение мочеиспускания, чувство дискомфорта и болезненности в области простаты, нарушение эрекции.
Злокачественная опухоль простаты дает метастазы на поздних стадиях развития. Третья стадия рака простаты характеризуется разрастанием опухоли за пределы предстательной железы, поражает соседние ткани и органы. Последняя стадия рака простаты характеризуется распространением опухоли на мочевой пузырь, мышцы мочевого пузыря, кишечник, метастазы опухоли обнаруживаются в лимфатических узлах, отдаленных органах, наиболее часто обнаруживаются в костях, легких, печени. Метастазы рака простаты появляются в процессе ангиогенеза опухоли.
Третья стадия рака простаты характеризуется разрастанием опухоли за пределы предстательной железы, поражает соседние ткани и органы. Последняя стадия рака простаты характеризуется распространением опухоли на мочевой пузырь, мышцы мочевого пузыря, кишечник, метастазы опухоли обнаруживаются в лимфатических узлах, отдаленных органах, наиболее часто обнаруживаются в костях, легких, печени. Метастазы рака простаты появляются в процессе ангиогенеза опухоли.
Ангиогенез – это образование в тканях опухоли новых кровеносных сосудов. В отличие от здоровых тканей ангиогенез в злокачественной опухоли идет беспрерывно и интенсивно. Злокачественная опухоль хорошо снабжается кровью, получает большое количество питательных веществ, обедняя питательное снабжение здоровой ткани.
Химиотерапия оказывает негативное влияние на состояние желудочно-кишечного тракта, кишечник, поджелудочную железу и печень. В период проведения химиотерапии следует снять нагрузку с органов пищеварения.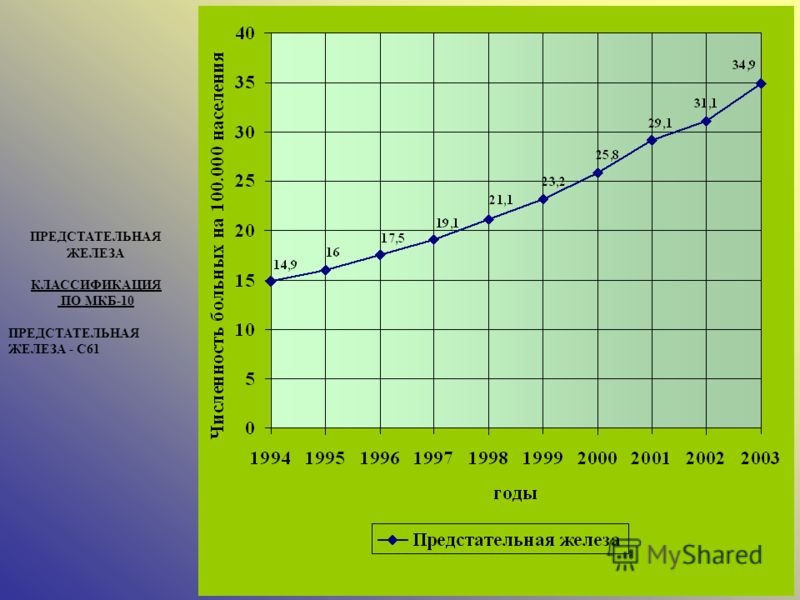 Необходимо ограничить потребление различных колбасных изделий, красного мяса, солений, копчений, кондитерских изделий, продуктов с высоким содержанием жира.
Необходимо ограничить потребление различных колбасных изделий, красного мяса, солений, копчений, кондитерских изделий, продуктов с высоким содержанием жира.
Вместо животных жиров следует употреблять растительные масла: оливковое, кунжутное, льняное. В питании должно быть больше морской рыбы: хека, минтая, скумбрии, лосося. Очень важно включать в рацион отруби, сухофрукты, овощи и фрукты. В рацион больного должны входить различные крупы, молочнокислые продукты с низким содержанием жира.
В Юсуповской больнице пациент сможет получить рекомендации по питанию больных онкологическими заболеваниями, пройти полное обследование, лечение. Юсуповская больница оснащена современным оборудованием, позволяющим определить развитие рака простаты на раннем этапе. К услугам пациентов врачи-урологи, онкологи и другие специалисты онкологического отделения. Записаться на консультацию к врачу можно по телефону.
 ..
.. Подобрать препарат можно с помощью фильтров. Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Чтобы увидеть в перечне лекарства, входящие в подгруппы, отметьте галочкой «включить препараты подгрупп». Нажав на иконку , можно добавить препарат в избранное и проверить на дубли и межлекарственные взаимодействия.
Полужирным начертанием выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан еженедельный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
Сбросить фильтры
включить препараты подгрупп
Фармгруппа* Все фармгруппы Алкилирующие средства Андрогены, антиандрогены Антиметаболиты БАДы — продукты растительного, животного или минерального происхождения Гормоны гипоталамуса, гипофиза, гонадотропины и их антагонисты Другие диагностические средства Другие противоопухолевые средства Другие синтетические антибактериальные средства Корректоры метаболизма костной и хрящевой ткани Противоопухолевые антибиотики Противоопухолевые гормональные средства и антагонисты гормонов Противоопухолевые средства Противоопухолевые средства растительного происхождения Радиопрофилактические и радиотерапевтические средства
Действующее вещество* Все ДВ Абиратерон Бикалутамид Бусерелин Винорелбин Гемцитабин Гозерелин Дегареликс Доксорубицин Доцетаксел Золедроновая кислота Кабазитаксел Лейпрорелин Митоксантрон Митомицин Нитроксолин Октреотид Олапариб Стронция хлорид [89Sr] Трипторелин Флутамид Фторурацил Циклофосфамид Ципротерон Цисплатин Эпирубицин
Лек. форма Все лек. формы имплантат капсула для подкожного введения пролонгированного действия капсулы концентрат для приготовления раствора для внутривенного и внутриплеврального введения концентрат для приготовления раствора для внутрисосудистого и внутрипузырного введения концентрат для приготовления раствора для инфузий лиофилизат для приготовления концентрата для приготовления раствора для инфузий лиофилизат для приготовления раствора для внутривенного введения лиофилизат для приготовления раствора для внутрисосудистого и внутрипузырного введения лиофилизат для приготовления раствора для инфузий лиофилизат для приготовления раствора для инъекций лиофилизат для приготовления раствора для подкожного введения лиофилизат для приготовления суспензии для внутримышечного введения пролонгированного действия лиофилизат для приготовления суспензии для внутримышечного введения с пролонгированным высвобождением лиофилизат для приготовления суспензии для внутримышечного и подкожного введения пролонгированного действия лиофилизат для приготовления суспензии для внутримышечного и подкожного введения с пролонгированным высвобождением микросферы для приготовления суспензии для внутримышечного введения пролонгированного действия порошок для приготовления раствора для внутривенного введения порошок для приготовления раствора для внутривенного и внутримышечного введения порошок для приготовления раствора для инъекций порошок для приготовления суспензии для внутримышечного и подкожного введения пролонгированного действия раствор для внутривенного введения раствор для внутривенного и подкожного введения раствор для внутримышечного введения (масляный) раствор для внутрисосудистого введения раствор для внутрисосудистого и внутриполостного введения раствор для инфузий раствор для инфузий и подкожного введения раствор для инъекций раствор для подкожного введения субстанция-порошок таблетки таблетки, покрытые оболочкой таблетки, покрытые пленочной оболочкой таблетки, покрытые сахарной оболочкой
форма Все лек. формы имплантат капсула для подкожного введения пролонгированного действия капсулы концентрат для приготовления раствора для внутривенного и внутриплеврального введения концентрат для приготовления раствора для внутрисосудистого и внутрипузырного введения концентрат для приготовления раствора для инфузий лиофилизат для приготовления концентрата для приготовления раствора для инфузий лиофилизат для приготовления раствора для внутривенного введения лиофилизат для приготовления раствора для внутрисосудистого и внутрипузырного введения лиофилизат для приготовления раствора для инфузий лиофилизат для приготовления раствора для инъекций лиофилизат для приготовления раствора для подкожного введения лиофилизат для приготовления суспензии для внутримышечного введения пролонгированного действия лиофилизат для приготовления суспензии для внутримышечного введения с пролонгированным высвобождением лиофилизат для приготовления суспензии для внутримышечного и подкожного введения пролонгированного действия лиофилизат для приготовления суспензии для внутримышечного и подкожного введения с пролонгированным высвобождением микросферы для приготовления суспензии для внутримышечного введения пролонгированного действия порошок для приготовления раствора для внутривенного введения порошок для приготовления раствора для внутривенного и внутримышечного введения порошок для приготовления раствора для инъекций порошок для приготовления суспензии для внутримышечного и подкожного введения пролонгированного действия раствор для внутривенного введения раствор для внутривенного и подкожного введения раствор для внутримышечного введения (масляный) раствор для внутрисосудистого введения раствор для внутрисосудистого и внутриполостного введения раствор для инфузий раствор для инфузий и подкожного введения раствор для инъекций раствор для подкожного введения субстанция-порошок таблетки таблетки, покрытые оболочкой таблетки, покрытые пленочной оболочкой таблетки, покрытые сахарной оболочкой
Дозировка Все дозировки 0. 01 г 0.02 г 0.05 мг/мл 0.1 мг 0.1 мг/мл 0.3 мг/мл 0.5 мг/мл 0.6 мг/мл 0.8 мг/мл 1 г 10 мг 10 мг/мл 10.8 мг 100 мг 100 мг/мл 100 мкг/мл 1000 мг 11.25 мг 120 мг 150 МБк 150 мг 2 мг 2 мг/мл 20 мг 20 мг/0.5 мл 20 мг/мл 200 мг 200 мкг/мл 22.5 мг 250 мг 3.6 мг 3.75 мг 30 мг 300 мкг/мл 4 мг 4 мг/100 мл 4 мг/5 мл 40 мг/мл 400 мг 45 мг 50 мг 50 мг/5 мл 50 мг/мл 50 мкг/мл 500 мг 500 мкг/мл 600 мкг/мл 7.5 мг 80 мг 80 мг/2 мл 80 мг/4 мл Без дозировки
01 г 0.02 г 0.05 мг/мл 0.1 мг 0.1 мг/мл 0.3 мг/мл 0.5 мг/мл 0.6 мг/мл 0.8 мг/мл 1 г 10 мг 10 мг/мл 10.8 мг 100 мг 100 мг/мл 100 мкг/мл 1000 мг 11.25 мг 120 мг 150 МБк 150 мг 2 мг 2 мг/мл 20 мг 20 мг/0.5 мл 20 мг/мл 200 мг 200 мкг/мл 22.5 мг 250 мг 3.6 мг 3.75 мг 30 мг 300 мкг/мл 4 мг 4 мг/100 мл 4 мг/5 мл 40 мг/мл 400 мг 45 мг 50 мг 50 мг/5 мл 50 мг/мл 50 мкг/мл 500 мг 500 мкг/мл 600 мкг/мл 7.5 мг 80 мг 80 мг/2 мл 80 мг/4 мл Без дозировки
Производитель Все производители АМВ ГмбХ Авексима Сибирь ООО Авентис Фарма (Дагенхэм) Айзант Драг Ресеч Солюшнз Пвт. Лтд Алмирал Продесфарма АстраЗенека Байер АГ Байер Веймар ГмбХ и Ко, КГ Байер Шеринг Фарма АГ Бакстер Онкология Белмедпрепараты РУП Биокад ЗАО Биосинтез ПАО Биохимик АО БратскХимСинтез ООО Брынцалов-А ПАО Верофарм АО Верофарм ОАО Верофарм ООО Д-р Редди`с Лабораторис Лтд. Деко компания Делфарм Лилль С.а.С. Джодас Экспоим Пвт. Диамед Индастриале Кимика Ипсен Фарма Биотек Ирбитский химико-фармацевтический завод ОАО Исследовательский Институт Химического Разнообразия АО (АО «ИИХР») Канонфарма продакшн ЗАО Келун-Казфарм ТОО Киова Хакко Когио Ко. Лтд Корден Фарма ГмбХ Кханделвал Лабораториз Пвт. Кэнджин биоФарма Инк Лаборатория ИМА С.А.И.С. Лаборатория Кравери С.А.И.С. Лаборатория Филаксис С.А. Лилли Франс Лэнс-Фарм ООО Лэнс-Фарм ООО [пос.Горки-10] МедиГене АГ Медрадиопрепарат завод ФГУП филиал Федерального центра по проектированию и развитию объектов ядерной медицины ФМБА России МираксБиоФарма ЗАО Натива ООО Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" ФГБУ МЗ РФ (НМИЦ онкологии им. Н.Н. Блохина МЗ РФ) Новартис Фарма Штейн АГ Озон ООО Омега Лабораториз ОнкоТаргет ООО Патеон Инк. Патеон Франс Плива Хрватска д.о.о. Прасфарма СЛ Пьер Фабр Медикамент Продакшн Р-Фарм АО Рентшлер Биотехнолоджи ГмбХ Рус-Мед Экспортс Прайвит Лимитед С.К. Синдан-Фарма С.р.Л. Сан Фармасьютикал Индастриз Лтд. Сан Фармасьютикал Медикеа Лтд. Санофи-Авентис Дойчланд ГмбХ Синдан-Фарма С.К С.р.Л. Сотекс ФармФирма Такеда Фармасьютикал Компани Татхимфармпрепараты АО Тева Тева Чек Индастриз с.р.о. Технология лекарств Толмар Инк Уралбиофарм ОАО Ф-Синтез ЗАО Фарева Унтерах ГмбХ Фарм-Синтез АО Фарм-Синтез ЗАО Фарм-Синтез ООО Фармасинтез АО Фармасинтез-Норд АО Фармасинтез-Тюмень ООО Фармахеми Фармидея ООО Фармославль АО Фармстандарт-УфаВИТА Фармэра ООО Фермент Фирма Ферринг ГмбХ Ферринг Интернешнл Сентер С.
Лтд Корден Фарма ГмбХ Кханделвал Лабораториз Пвт. Кэнджин биоФарма Инк Лаборатория ИМА С.А.И.С. Лаборатория Кравери С.А.И.С. Лаборатория Филаксис С.А. Лилли Франс Лэнс-Фарм ООО Лэнс-Фарм ООО [пос.Горки-10] МедиГене АГ Медрадиопрепарат завод ФГУП филиал Федерального центра по проектированию и развитию объектов ядерной медицины ФМБА России МираксБиоФарма ЗАО Натива ООО Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина" ФГБУ МЗ РФ (НМИЦ онкологии им. Н.Н. Блохина МЗ РФ) Новартис Фарма Штейн АГ Озон ООО Омега Лабораториз ОнкоТаргет ООО Патеон Инк. Патеон Франс Плива Хрватска д.о.о. Прасфарма СЛ Пьер Фабр Медикамент Продакшн Р-Фарм АО Рентшлер Биотехнолоджи ГмбХ Рус-Мед Экспортс Прайвит Лимитед С.К. Синдан-Фарма С.р.Л. Сан Фармасьютикал Индастриз Лтд. Сан Фармасьютикал Медикеа Лтд. Санофи-Авентис Дойчланд ГмбХ Синдан-Фарма С.К С.р.Л. Сотекс ФармФирма Такеда Фармасьютикал Компани Татхимфармпрепараты АО Тева Тева Чек Индастриз с.р.о. Технология лекарств Толмар Инк Уралбиофарм ОАО Ф-Синтез ЗАО Фарева Унтерах ГмбХ Фарм-Синтез АО Фарм-Синтез ЗАО Фарм-Синтез ООО Фармасинтез АО Фармасинтез-Норд АО Фармасинтез-Тюмень ООО Фармахеми Фармидея ООО Фармославль АО Фармстандарт-УфаВИТА Фармэра ООО Фермент Фирма Ферринг ГмбХ Ферринг Интернешнл Сентер С. А. Фрезениус Каби Онколоджи Лимитед Хаупт Фарма Амарег Хетеро Лабс Лимитед Шеринг АГ ЭббВи Дойчланд ГмбХ и Ко. КГ ЭббВи Лимитед Эбеве Фарма ЭкоФармПлюс АО Эллара ООО Эриохем
А. Фрезениус Каби Онколоджи Лимитед Хаупт Фарма Амарег Хетеро Лабс Лимитед Шеринг АГ ЭббВи Дойчланд ГмбХ и Ко. КГ ЭббВи Лимитед Эбеве Фарма ЭкоФармПлюс АО Эллара ООО Эриохем
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
. 2012 янв; 32 (2): 399-414.
doi: 10.1128/MCB.05958-11. Epub 2011 14 ноября.
Пек Йен Тан 1 , Ченг Вей Чанг, Керн Рей Чнг, К. Д. Сенали Абайратна Ванса, Винг-Кин Сунг, Эдвин Чунг
Принадлежности
Бесплатная статья ЧВК
Пек Йен Тан и соавт. Мол Селл Биол. 2012 Январь
Бесплатная статья ЧВК
. 2012 янв; 32 (2): 399-414.
doi: 10.1128/MCB.05958-11. Epub 2011 14 ноября.
Пек Йен Тан 1 , Ченг Вэй Чанг, Керн Рей Чнг, К. Д. Сенали Абайратна Ванса, Винг-Кин Сунг, Эдвин Чеунг
Д. Сенали Абайратна Ванса, Винг-Кин Сунг, Эдвин Чеунг
Ген NKX3-1 представляет собой гомеобоксный ген, необходимый для прогрессирования опухоли предстательной железы, но как он функционирует, неясно. Здесь, используя иммунопреципитацию хроматина в сочетании с массовым параллельным секвенированием (ChIP-seq), мы показали, что NKX3-1 совместно локализуется с рецептором андрогена (AR) в геноме рака предстательной железы. Мы обнаружили два различных механизма, с помощью которых NKX3-1 контролирует транскрипционную сеть AR при раке предстательной железы. Во-первых, NKX3-1 и AR напрямую регулируют друг друга в регуляторной петле прямой связи. Во-вторых, NKX3-1 сотрудничает с AR и FoxA1, чтобы опосредовать гены при распространенной и рецидивирующей карциноме предстательной железы. Гены, регулируемые NKX3-1 и AR, включают гены, обнаруженные в процессе «переноса белков», который интегрирует онкогенные сигнальные пути. Более того, мы демонстрируем, что NKX3-1, AR и FoxA1 способствуют выживанию клеток рака предстательной железы путем прямой активации RAB3B, члена семейства RAB GTPase. Наконец, мы показываем, что RAB3B сверхэкспрессируется у пациентов с раком простаты, предполагая, что RAB3B вместе с AR, FoxA1 и NKX3-1 являются важными регуляторами прогрессирования рака простаты. В совокупности наша работа подчеркивает новую иерархическую сеть регуляции транскрипции между NKX3-1, AR и сигнальным путем RAB GTPase, которая имеет решающее значение для генетико-молекулярно-фенотипической парадигмы при андрогензависимом раке простаты.
Мы обнаружили два различных механизма, с помощью которых NKX3-1 контролирует транскрипционную сеть AR при раке предстательной железы. Во-первых, NKX3-1 и AR напрямую регулируют друг друга в регуляторной петле прямой связи. Во-вторых, NKX3-1 сотрудничает с AR и FoxA1, чтобы опосредовать гены при распространенной и рецидивирующей карциноме предстательной железы. Гены, регулируемые NKX3-1 и AR, включают гены, обнаруженные в процессе «переноса белков», который интегрирует онкогенные сигнальные пути. Более того, мы демонстрируем, что NKX3-1, AR и FoxA1 способствуют выживанию клеток рака предстательной железы путем прямой активации RAB3B, члена семейства RAB GTPase. Наконец, мы показываем, что RAB3B сверхэкспрессируется у пациентов с раком простаты, предполагая, что RAB3B вместе с AR, FoxA1 и NKX3-1 являются важными регуляторами прогрессирования рака простаты. В совокупности наша работа подчеркивает новую иерархическую сеть регуляции транскрипции между NKX3-1, AR и сигнальным путем RAB GTPase, которая имеет решающее значение для генетико-молекулярно-фенотипической парадигмы при андрогензависимом раке простаты.
Рис. 1
Геномная характеристика БРАБ в…
Рис. 1
Геномная характеристика БРАБ в клетках рака предстательной железы. (A) Диаграмма Венна, изображающая…
Рисунок 1 Геномная характеристика БРАБ в клетках рака предстательной железы. (A) Диаграмма Венна, изображающая перекрытие пиков AR ChIP-seq, обработанных этанолом (EtOH) и DHT. (B) Сравнение средней плотности меток сайтов связывания, обнаруженных на картах связывания AR, обработанных EtOH и DHT, после учета разницы в глубине последовательности. (C) График рассеяния интенсивности метки ARBS между наборами данных, обработанными DHT и EtOH, после учета разницы в глубине последовательности. (D) Логотипы канонических ARE из базы данных Transfac (верхняя панель) и обогащенные в наших лучших 500 ARBS (± 50 п.н. от пика библиотеки DHT) с использованием MEME (нижняя панель). (E) Круговая диаграмма, иллюстрирующая доли ARBS, содержащих полный (максимум 3 мутации), половину (0 мутаций) или не содержащий ARE. (F) Графическое представление средней оценки сохранения последовательности PhastCons (выравнивание геномов 16 позвоночных с человеческим) для каждой позиции в окне размером 2000 п.н. вокруг пика ChIP-seq библиотеки AR, обработанной DHT, или вокруг случайно выбранной области генома. . (G) Предполагаемые ARBS субклонировали в вектор pGL4-TATA, трансфицировали в лишенные андрогенов клетки LNCaP, обрабатывали EtOH или 100 нМ DHT в течение 24 часов, а затем анализировали на активность люциферазы. Случайно выбранные сайты связывания ARBS также были мутированы при полной ARE. Данные представляют собой средние относительные световые единицы (RLU) для каждого сайта связывания AR по крайней мере из 3 независимых экспериментов.
(D) Логотипы канонических ARE из базы данных Transfac (верхняя панель) и обогащенные в наших лучших 500 ARBS (± 50 п.н. от пика библиотеки DHT) с использованием MEME (нижняя панель). (E) Круговая диаграмма, иллюстрирующая доли ARBS, содержащих полный (максимум 3 мутации), половину (0 мутаций) или не содержащий ARE. (F) Графическое представление средней оценки сохранения последовательности PhastCons (выравнивание геномов 16 позвоночных с человеческим) для каждой позиции в окне размером 2000 п.н. вокруг пика ChIP-seq библиотеки AR, обработанной DHT, или вокруг случайно выбранной области генома. . (G) Предполагаемые ARBS субклонировали в вектор pGL4-TATA, трансфицировали в лишенные андрогенов клетки LNCaP, обрабатывали EtOH или 100 нМ DHT в течение 24 часов, а затем анализировали на активность люциферазы. Случайно выбранные сайты связывания ARBS также были мутированы при полной ARE. Данные представляют собой средние относительные световые единицы (RLU) для каждого сайта связывания AR по крайней мере из 3 независимых экспериментов. (H) Пропорции ARBS в разных геномных местоположениях по отношению к ближайшим единицам транскрипции из базы данных Refseq. 5' проксимальнее относится к от 0 до 10 т.п.о. выше TSS, 5' дистально относится к >10 т.п.о. выше TSS; 3'-проксимальный относится к 0-10 т.п.о. ниже конца гена, а 3'-дистальный относится к >10 т.п.о. ниже конца гена. (I) Профиль экспрессии всех генов во времени при обработке ДГТ (3, 6, 12 и 24 ч) по сравнению с соответствующей обработкой этанолом. Индукция и репрессия представлены желтым и красным соответственно. На графике представлены скользящие средние по 1000 генов доли генов, по крайней мере, с одним ARBS в пределах 50 т.п.н. от TSS. Гены в каждый момент времени были отсортированы в соответствии с кратностью изменения при стимуляции DHT по сравнению с обработкой EtOH. синий, 3 ч; оранжевый, 6 ч; зеленый, 12 ч; красный, 24ч. Ассоциация ARBS с нерегулируемыми генами с кратностью изменения от 0,9 до1 и 1.1 в 12-часовой момент времени обработки использовали для определения 99% доверительного интервала t-статистики для доли скользящих средних генов со связыванием AR (желтая полоса).
(H) Пропорции ARBS в разных геномных местоположениях по отношению к ближайшим единицам транскрипции из базы данных Refseq. 5' проксимальнее относится к от 0 до 10 т.п.о. выше TSS, 5' дистально относится к >10 т.п.о. выше TSS; 3'-проксимальный относится к 0-10 т.п.о. ниже конца гена, а 3'-дистальный относится к >10 т.п.о. ниже конца гена. (I) Профиль экспрессии всех генов во времени при обработке ДГТ (3, 6, 12 и 24 ч) по сравнению с соответствующей обработкой этанолом. Индукция и репрессия представлены желтым и красным соответственно. На графике представлены скользящие средние по 1000 генов доли генов, по крайней мере, с одним ARBS в пределах 50 т.п.н. от TSS. Гены в каждый момент времени были отсортированы в соответствии с кратностью изменения при стимуляции DHT по сравнению с обработкой EtOH. синий, 3 ч; оранжевый, 6 ч; зеленый, 12 ч; красный, 24ч. Ассоциация ARBS с нерегулируемыми генами с кратностью изменения от 0,9 до1 и 1.1 в 12-часовой момент времени обработки использовали для определения 99% доверительного интервала t-статистики для доли скользящих средних генов со связыванием AR (желтая полоса).
Рис. 2
NKX3-1 — это новый совместный…
Рис. 2
NKX3-1 — новый совместный фактор AR. (A) CentDist выход…
Рис 2 NKX3-1 — новый совместный фактор AR. (A) Выход CentDist наиболее часто встречающихся мотивов семейства транскрипционных факторов из DHT-стимулированных пиков AR ChIP-seq. (B) Коробчатая диаграмма, сравнивающая уровни транскриптов NKX3-1 в нормальных образцах простаты и аденокарциномы простаты из базы данных микрочипов Oncomine (исследование Уоллеса и др. в базе данных). Данные дифференциальной экспрессии генов центрированы по медиане уровней экспрессии и нанесены на логарифмическую шкалу 9.0109 2 шкала. Значение P было рассчитано с использованием двухвыборочного теста Welch t . (C) Диаграмма Венна, иллюстрирующая перекрытие между стимулированными DHT пиками AR и NKX3-1 ChIP-seq. (D) Распределение меток EtOH или DHT NKX3-1 ChIP-seq сосредоточено вокруг пиков связывания AR (DHT). (E) GO-анализ андрогензависимых генов, совместно занятых AR и NKX3-1, в пределах 50 т.п.н. от TSS с использованием веб-инструмента Panther. *, порог был установлен на P значение 0,01. Обогащение кратности рассчитывали путем деления наблюдаемого количества генов на ожидаемое количество генов в одном и том же пути GO. Двусторонний точный критерий Фишера был выполнен для определения кратности обогащения в генах пути «транспорта белка», которые связаны только с AR, и генами, связанными как с AR, так и с NKX3-1. (F) Левая панель, анализ концептуальной карты Oncomine, иллюстрирующий сеть обогащения между андрогензависимыми генами, совместно занимаемыми AR и NKX3-1, и сигнатуры генов в различных подтипах карциномы простаты. Каждый узел представляет одно молекулярное понятие, при этом размер узла пропорционален количеству генов в каждом наборе генов.
(C) Диаграмма Венна, иллюстрирующая перекрытие между стимулированными DHT пиками AR и NKX3-1 ChIP-seq. (D) Распределение меток EtOH или DHT NKX3-1 ChIP-seq сосредоточено вокруг пиков связывания AR (DHT). (E) GO-анализ андрогензависимых генов, совместно занятых AR и NKX3-1, в пределах 50 т.п.н. от TSS с использованием веб-инструмента Panther. *, порог был установлен на P значение 0,01. Обогащение кратности рассчитывали путем деления наблюдаемого количества генов на ожидаемое количество генов в одном и том же пути GO. Двусторонний точный критерий Фишера был выполнен для определения кратности обогащения в генах пути «транспорта белка», которые связаны только с AR, и генами, связанными как с AR, так и с NKX3-1. (F) Левая панель, анализ концептуальной карты Oncomine, иллюстрирующий сеть обогащения между андрогензависимыми генами, совместно занимаемыми AR и NKX3-1, и сигнатуры генов в различных подтипах карциномы простаты. Каждый узел представляет одно молекулярное понятие, при этом размер узла пропорционален количеству генов в каждом наборе генов. Статистически значимое перекрытие ( P < 0,01) между генами в двух сцепленных узлах представлен ребром. Концепции были разделены на 5 основных кластеров, обозначенных разными цветами. Правая панель: уровень экспрессии 50 наиболее экспрессируемых генов в образцах карциномы предстательной железы из исследования Wallace et al. в базе данных Онкомайн (обозначен звездочкой на концептуальной карте).
Статистически значимое перекрытие ( P < 0,01) между генами в двух сцепленных узлах представлен ребром. Концепции были разделены на 5 основных кластеров, обозначенных разными цветами. Правая панель: уровень экспрессии 50 наиболее экспрессируемых генов в образцах карциномы предстательной железы из исследования Wallace et al. в базе данных Онкомайн (обозначен звездочкой на концептуальной карте).
Рис. 3
AR и NKX3-1 напрямую регулируют…
Рис. 3
AR и NKX3-1 напрямую регулируют друг друга в режиме прямой связи. АР, NKX3-1,…
Рис 3 AR и NKX3-1 напрямую регулируют друг друга в режиме прямой связи. AR, NKX3-1 и РНК Pol II совместно локализуются в энхансерной и промоторной областях гена NKX3-1. (A) Скриншоты пиков AR, NKX3-1 и РНК Pol II ChIP-seq, окружающих ген NKX3-1. (B) Проверка ChIP-qPCR AR и NKX3-1 на энхансере и промоторе гена NKX3-1. Обогащение ДНК представлено как процент иммунопреципитированного входного хроматина. Данные представляют собой средние значения ± стандартные ошибки средних (SEM) по крайней мере из трех независимых экспериментов. (C и D) Влияние молчания AR на уровень экспрессии NKX3-1. Истощенные по гормонам клетки LNCaP трансфицировали либо контрольной миРНК, либо миРНК, нацеленной на AR, перед обработкой EtOH или 10 нМ DHT в течение 8 часов. (C) Общая РНК была выделена и амплифицирована с праймерами RT-qPCR в реальном времени для AR и NKX3-1. Уровни экспрессии мРНК нормализовали относительно GAPDH (глицеральдегид-3-фосфатдегидрогеназы). (D) Вестерн-блоттинг, определяющий уровни белка AR, NKX3-1 и α-тубулина после трансфекции миРНК. AR и NKX3-1 совместно локализуют связывание внутри тела гена AR. (E) Скриншоты пиков AR и NKX3-1 ChIP-seq вокруг гена AR.
(A) Скриншоты пиков AR, NKX3-1 и РНК Pol II ChIP-seq, окружающих ген NKX3-1. (B) Проверка ChIP-qPCR AR и NKX3-1 на энхансере и промоторе гена NKX3-1. Обогащение ДНК представлено как процент иммунопреципитированного входного хроматина. Данные представляют собой средние значения ± стандартные ошибки средних (SEM) по крайней мере из трех независимых экспериментов. (C и D) Влияние молчания AR на уровень экспрессии NKX3-1. Истощенные по гормонам клетки LNCaP трансфицировали либо контрольной миРНК, либо миРНК, нацеленной на AR, перед обработкой EtOH или 10 нМ DHT в течение 8 часов. (C) Общая РНК была выделена и амплифицирована с праймерами RT-qPCR в реальном времени для AR и NKX3-1. Уровни экспрессии мРНК нормализовали относительно GAPDH (глицеральдегид-3-фосфатдегидрогеназы). (D) Вестерн-блоттинг, определяющий уровни белка AR, NKX3-1 и α-тубулина после трансфекции миРНК. AR и NKX3-1 совместно локализуют связывание внутри тела гена AR. (E) Скриншоты пиков AR и NKX3-1 ChIP-seq вокруг гена AR. (F) Проверка ChIP-qPCR пиков AR и NKX3-1 ChIP-seq во внутригенной области AR. Обогащение ДНК представлено как процент иммунопреципитированного входного хроматина. Данные показывают среднее значение ± стандартная ошибка среднего по крайней мере из трех независимых экспериментов. (G и H) Влияние истощения NKX3-1 на уровень экспрессии AR. Лишенные андрогена клетки LNCaP трансфицировали либо контрольной миРНК, либо миРНК, нацеленной на NKX3-1, перед обработкой EtOH или 10 нМ DHT в течение 8 часов. (G) Общая РНК была выделена и амплифицирована с использованием праймеров RT-qPCR в реальном времени для AR, NKX3-1 и GAPDH. Уровни экспрессии мРНК нормализовали по отношению к GAPDH. (H) Вестерн-анализ уровней белка AR, NKX3-1 и α-тубулина после нокдауна siRNA.
(F) Проверка ChIP-qPCR пиков AR и NKX3-1 ChIP-seq во внутригенной области AR. Обогащение ДНК представлено как процент иммунопреципитированного входного хроматина. Данные показывают среднее значение ± стандартная ошибка среднего по крайней мере из трех независимых экспериментов. (G и H) Влияние истощения NKX3-1 на уровень экспрессии AR. Лишенные андрогена клетки LNCaP трансфицировали либо контрольной миРНК, либо миРНК, нацеленной на NKX3-1, перед обработкой EtOH или 10 нМ DHT в течение 8 часов. (G) Общая РНК была выделена и амплифицирована с использованием праймеров RT-qPCR в реальном времени для AR, NKX3-1 и GAPDH. Уровни экспрессии мРНК нормализовали по отношению к GAPDH. (H) Вестерн-анализ уровней белка AR, NKX3-1 и α-тубулина после нокдауна siRNA.
Рис. 4
Андрогены стимулируют образование…
Рис. 4
4
Андроген стимулирует образование мультитранскрипционного комплекса, состоящего из NKX3-1, FoxA1 и…
Рис 4 Андроген стимулирует образование мультитранскрипционного комплекса, состоящего из NKX3-1, FoxA1 и AR. (A) Результат CentDist для наиболее часто встречающихся мотивов семейства факторов транскрипции в пиках NKX3-1 ChIP-seq, стимулированных DHT. (B) Тепловая карта интенсивности тегов AR (красный), NKX3-1 (синий) и FoxA1 (зеленый) ChIP-seq, отсортированная по интенсивности тегов NKX3-1 (DHT) (сверху вниз, от самого высокого к самому низкому) и центрированная на пиках AR (DHT) в окне размером 2 КБ. Цифры от 1 до 4 обозначают группы общих или уникальных идентифицированных сайтов связывания NKX3-1: 1, AR/NKX3-1/FoxA1; 2, АР/НКХ3-1; 3, NKX3-1/FoxA1; 4, только NKX3-1. (C) Доля сайтов связывания FoxA1, совместно связанных с AR и/или NKX3-1 при стимуляции DHT. (D) Скриншоты пиков AR, NKX3-1, FoxA1 и РНК Pol II ChIP-seq вокруг гена PSA. (E) ChIP-qPCR занятости AR, NKX3-1 и FoxA1 в областях энхансера и промотора PSA. Данные представляют собой средние значения ± стандартная ошибка среднего по крайней мере из 3 независимых анализов. (F) Взаимный последовательный повторный чип ChIP был выполнен для AR, FoxA1, NKX3-1 или IgG. Обогащение кратности представляет собой относительную распространенность области энхансера ПСА по сравнению со случайно выбранным контрольным участком генома. Данные показывают средние значения ± стандартная ошибка среднего по крайней мере из 3 независимых анализов. (G) Лишенные андрогена клетки LNCaP обрабатывали EtOH или 100 нМ DHT в течение 24 часов перед иммунопреципитацией лизатов цельных клеток с указанным антителом или IgG с последующим анализом вестерн-блоттинга (WB) с указанным антителом.
(E) ChIP-qPCR занятости AR, NKX3-1 и FoxA1 в областях энхансера и промотора PSA. Данные представляют собой средние значения ± стандартная ошибка среднего по крайней мере из 3 независимых анализов. (F) Взаимный последовательный повторный чип ChIP был выполнен для AR, FoxA1, NKX3-1 или IgG. Обогащение кратности представляет собой относительную распространенность области энхансера ПСА по сравнению со случайно выбранным контрольным участком генома. Данные показывают средние значения ± стандартная ошибка среднего по крайней мере из 3 независимых анализов. (G) Лишенные андрогена клетки LNCaP обрабатывали EtOH или 100 нМ DHT в течение 24 часов перед иммунопреципитацией лизатов цельных клеток с указанным антителом или IgG с последующим анализом вестерн-блоттинга (WB) с указанным антителом.
Рис. 5
NKX3-1 требуется для AR-зависимых…
Рис. 5
5
NKX3-1 необходим для AR-зависимой транскрипции и выживания клеток рака предстательной железы. (А) Схема…
Рис 5 NKX3-1 необходим для AR-зависимой транскрипции и выживания клеток рака предстательной железы. (A) Схематическая диаграмма репортерных конструкций, созданных и использованных в анализах переходной трансфекции. (B) Репортерную плазмиду ARBS дикого типа (WT) котрансфицировали экспрессионными конструкциями для AR, FoxA1 и/или NKX3-1 в лишенные андрогена клетки PC3. Клетки обрабатывали EtOH или 100 нМ DHT в течение 24 ч и оценивали активность люциферазы. (C) Мутации были получены в мотивах ARE, FKH или NKX в конструкции ARBS, как показано на панели A. Мутантные репортерные конструкции трансфицировали и исследовали на активность люциферазы, как описано для панели B. (D) Дикого типа и Мутантные конструкции ARBS, как показано на панели А, трансфицировали в лишенные андрогена клетки LNCaP. Клетки обрабатывали EtOH или 100 нМ DHT в течение 24 ч и оценивали активность люциферазы. Данные, представленные на панелях с B по D, представляют собой среднее значение RLU ± SEM из трех повторов. (E) AR, FoxA1 и NKX3-1 подавляли с помощью siRNA в различных комбинациях в клетках LNCaP при обработке EtOH или 100 нМ DHT в течение 72 часов. Клетки окрашивали йодидом пропидия и анализировали с помощью проточной цитометрии. Анализ представлен в виде процента клеточного апоптоза на основе процента от общего числа гейтированных клеток в суб-G 1 фаза. Данные представлены как среднее значение ± стандартная ошибка среднего из трех повторных экспериментов. Статистический анализ был проведен для различий между условиями EtOH и DHT с использованием критерия Стьюдента t (**, P <0,05). (F) Клетки LNCaP были лишены AR, NKX3-1 или FoxA1 в различных комбинациях, как описано для панели E, и проанализированы на активность каспазы-3. Собранные осадки клеток фиксировали и иммуноокрашивали FITC-конъюгированными антителами, распознающими активную форму каспазы-3.
Клетки обрабатывали EtOH или 100 нМ DHT в течение 24 ч и оценивали активность люциферазы. Данные, представленные на панелях с B по D, представляют собой среднее значение RLU ± SEM из трех повторов. (E) AR, FoxA1 и NKX3-1 подавляли с помощью siRNA в различных комбинациях в клетках LNCaP при обработке EtOH или 100 нМ DHT в течение 72 часов. Клетки окрашивали йодидом пропидия и анализировали с помощью проточной цитометрии. Анализ представлен в виде процента клеточного апоптоза на основе процента от общего числа гейтированных клеток в суб-G 1 фаза. Данные представлены как среднее значение ± стандартная ошибка среднего из трех повторных экспериментов. Статистический анализ был проведен для различий между условиями EtOH и DHT с использованием критерия Стьюдента t (**, P <0,05). (F) Клетки LNCaP были лишены AR, NKX3-1 или FoxA1 в различных комбинациях, как описано для панели E, и проанализированы на активность каспазы-3. Собранные осадки клеток фиксировали и иммуноокрашивали FITC-конъюгированными антителами, распознающими активную форму каспазы-3. Анализ проточной цитометрии представлен как относительная активность каспазы-3, основанная на проценте от общего числа гейтированных клеток с активной каспазой-3 при трансфекции мишень-специфической миРНК по сравнению с контрольной миРНК. Данные представлены как среднее значение ± стандартная ошибка среднего из трех повторных экспериментов. Статистический анализ различий между условиями этанола и дигидротестостерона проводили с использованием критерия Стьюдента 9.0111 t тест (**, P < 0,05).
Анализ проточной цитометрии представлен как относительная активность каспазы-3, основанная на проценте от общего числа гейтированных клеток с активной каспазой-3 при трансфекции мишень-специфической миРНК по сравнению с контрольной миРНК. Данные представлены как среднее значение ± стандартная ошибка среднего из трех повторных экспериментов. Статистический анализ различий между условиями этанола и дигидротестостерона проводили с использованием критерия Стьюдента 9.0111 t тест (**, P < 0,05).
Рис. 6
NKX3-1 способствует развитию клеток рака предстательной железы…
Рис. 6
NKX3-1 способствует выживанию клеток рака предстательной железы, сотрудничая с AR и FoxA1 до…
Рис. 6 NKX3-1 способствует выживанию клеток рака предстательной железы за счет взаимодействия с AR и FoxA1 для регулирования экспрессии гена RAB3B. (A) Профиль экспрессии генов RAB GTPase, связанных с NKX3-1 и AR, которые регулируются андрогенами, по данным нашего микрочипового анализа клеток LNCaP. Индукция и репрессия представлены желтым и красным соответственно. Все гены RAB совместно связаны с AR, NKX3-1 и FoxA1, если не указано иное. (B) Левая панель, уровни транскриптов генов RAB GTPase в нескольких исследованиях Oncomine. Красный и зеленый представляют избыточную и недостаточную экспрессию в аденокарциноме предстательной железы по сравнению с нормальными образцами соответственно. NA означает отсутствие данных об экспрессии соответствующего гена в аннотированном исследовании. * и **, P < 0,1 и P < 0,05 соответственно. Правая панель, прямоугольная диаграмма, сравнивающая уровни транскриптов RAB3B в образцах нормальной простаты и опухоли из исследования Wallace et al. в базе данных Онкомайн. Данные дифференциальной экспрессии генов центрированы по медиане уровней экспрессии и выражены по шкале log 2 .
(A) Профиль экспрессии генов RAB GTPase, связанных с NKX3-1 и AR, которые регулируются андрогенами, по данным нашего микрочипового анализа клеток LNCaP. Индукция и репрессия представлены желтым и красным соответственно. Все гены RAB совместно связаны с AR, NKX3-1 и FoxA1, если не указано иное. (B) Левая панель, уровни транскриптов генов RAB GTPase в нескольких исследованиях Oncomine. Красный и зеленый представляют избыточную и недостаточную экспрессию в аденокарциноме предстательной железы по сравнению с нормальными образцами соответственно. NA означает отсутствие данных об экспрессии соответствующего гена в аннотированном исследовании. * и **, P < 0,1 и P < 0,05 соответственно. Правая панель, прямоугольная диаграмма, сравнивающая уровни транскриптов RAB3B в образцах нормальной простаты и опухоли из исследования Wallace et al. в базе данных Онкомайн. Данные дифференциальной экспрессии генов центрированы по медиане уровней экспрессии и выражены по шкале log 2 ./Ukr/24/2.jpg) Значение P было рассчитано с использованием двухвыборочного теста Welch t . (C) Коробчатая диаграмма, иллюстрирующая уровни транскриптов RAB3B при различных типах рака из исследования Bittner et al. в базе данных микрочипов Oncomine. Данные дифференциальной экспрессии генов сосредоточены на медиане уровней экспрессии и выражены в логарифмическом масштабе 9.0109 2 шкала. В скобках указано количество образцов в каждой категории. (D) Скриншоты пиков AR, NKX3-1, FoxA1 и РНК Pol II ChIP-seq вокруг гена RAB3B. (E) ChIP-qPCR занятости AR, NKX3-1 и FoxA1 в области энхансера RAB3B. Данные представляют собой средние значения ± стандартная ошибка среднего по крайней мере из 3 независимых анализов. (F) Взаимный повторный чип на энхансере RAB3B был выполнен, как описано для фиг. 4F. (G) Анализ транзиторной трансфекции проводили, как описано для фиг. 5В, с репортерной плазмидой, содержащей RAB3B ARBS дикого типа. (H) Мотивы половины ARE, FKH и NKX в конструкции ARBS из панели G были мутированы и использованы в анализе транзиентной котрансфекции на клетках LNCaP, как описано для фиг.
Значение P было рассчитано с использованием двухвыборочного теста Welch t . (C) Коробчатая диаграмма, иллюстрирующая уровни транскриптов RAB3B при различных типах рака из исследования Bittner et al. в базе данных микрочипов Oncomine. Данные дифференциальной экспрессии генов сосредоточены на медиане уровней экспрессии и выражены в логарифмическом масштабе 9.0109 2 шкала. В скобках указано количество образцов в каждой категории. (D) Скриншоты пиков AR, NKX3-1, FoxA1 и РНК Pol II ChIP-seq вокруг гена RAB3B. (E) ChIP-qPCR занятости AR, NKX3-1 и FoxA1 в области энхансера RAB3B. Данные представляют собой средние значения ± стандартная ошибка среднего по крайней мере из 3 независимых анализов. (F) Взаимный повторный чип на энхансере RAB3B был выполнен, как описано для фиг. 4F. (G) Анализ транзиторной трансфекции проводили, как описано для фиг. 5В, с репортерной плазмидой, содержащей RAB3B ARBS дикого типа. (H) Мотивы половины ARE, FKH и NKX в конструкции ARBS из панели G были мутированы и использованы в анализе транзиентной котрансфекции на клетках LNCaP, как описано для фиг. 5D. (I) Конструкции ARBS дикого типа и мутантные конструкции из панели H котрансфицировали экспрессионными конструкциями для AR, FoxA1 и NKX3-1 в лишенные андрогенов клетки PC3, как описано для фиг. 5D. Данные, показанные на панелях G-I, представляют собой среднее значение RLU ± SEM для трех повторов. (J) Два разных дуплекса siRNA были разработаны для специфического и независимого нацеливания на ген RAB3B в клетках LNCaP. Эффективность нокдауна оценивали с помощью вестерн-блоттинга. (K) Окрашивание PI (левая панель) и активность каспазы-3 (правая панель), как описано для рис. 5E и F, на клетках LNCaP после нокдауна RAB3B. Для обоих анализов данные представлены как среднее значение ± стандартная ошибка среднего из трех повторов экспериментов. Статистический анализ различий между условиями этанола и дигидротестостерона проводили с использованием критерия Стьюдента 9.0111 t тест (**, P < 0,05).
5D. (I) Конструкции ARBS дикого типа и мутантные конструкции из панели H котрансфицировали экспрессионными конструкциями для AR, FoxA1 и NKX3-1 в лишенные андрогенов клетки PC3, как описано для фиг. 5D. Данные, показанные на панелях G-I, представляют собой среднее значение RLU ± SEM для трех повторов. (J) Два разных дуплекса siRNA были разработаны для специфического и независимого нацеливания на ген RAB3B в клетках LNCaP. Эффективность нокдауна оценивали с помощью вестерн-блоттинга. (K) Окрашивание PI (левая панель) и активность каспазы-3 (правая панель), как описано для рис. 5E и F, на клетках LNCaP после нокдауна RAB3B. Для обоих анализов данные представлены как среднее значение ± стандартная ошибка среднего из трех повторов экспериментов. Статистический анализ различий между условиями этанола и дигидротестостерона проводили с использованием критерия Стьюдента 9.0111 t тест (**, P < 0,05).
Рис. 7
7
NKX3-1 регулирует транскрипцию AR…
Рис. 7
NKX3-1 регулирует транскрипционную сеть AR с помощью двух различных механизмов. 1. В…
Рис 7NKX3-1 регулирует транскрипционную сеть AR с помощью двух различных механизмов. 1. В присутствии ДГТ NKX3-1, который чувствителен к андрогенам, напрямую активирует экспрессию AR, образуя регуляторный механизм прямой связи между двумя факторами. 2. NKX3-1 вместе с AR и FoxA1 образуют «энханцеосому», которая рекрутируется на специфические геномные элементы при передаче сигналов андрогенов. Это позволяет последующую загрузку модификаторов гистонов и ремоделеров хроматина, которые облегчают активность последующих генов.
См. это изображение и информацию об авторских правах в PMC
Андрогенная регуляция супрессора опухоли предстательной железы NKX3. 1 опосредуется его 3'-нетранслируемой областью.
1 опосредуется его 3'-нетранслируемой областью.
Томас М.А., Прис Д.М., Бентел Дж.М. Томас М.А. и соавт. Biochem J. 15 января 2010 г .; 425 (3): 575-83. дои: 10.1042/BJ20091109. Биохим Дж. 2010. PMID: 19886863
Транскрипционная сеть, включающая ERG и AR, управляет прогрессированием рака предстательной железы, опосредованным дистальным гомеобоксом-1.
Гоэл С., Бхатия В., Кунду С., Бисвас Т., Карскадон С., Гупта Н., Асим М., Моррисси С., Паланисами Н., Атик Б. Гоэл С. и др. Нац коммун. 2021 7 сентября; 12 (1): 5325. doi: 10.1038/s41467-021-25623-2. Нац коммун. 2021. PMID: 34493733 Бесплатная статья ЧВК.
Протеомное профилирование эндогенных рецепторов андрогенов выявляет геномный субкомплекс, участвующий в онкогенезе предстательной железы.
Стеллоо С., Неведомская Э., Ким Ю., Хукман Л., Блейервельд О.Б., Мирза Т., Весселс Л.Ф.А., ван Верден В.М., Алтелаар А.М., Бергман А.М., Цварт В. Стеллоо С. и др. Онкоген. 2018 18 января; 37 (3): 313-322. doi: 10.1038/onc.2017.330. Epub 2017 18 сентября. Онкоген. 2018. PMID: 28925401
Действие андрогенов на предстательную железу.
Ядав Н., Химерс Х.В. Ядав Н. и др. Минерва Урол Нефрол. 2012 март; 64(1):35-49. Минерва Урол Нефрол. 2012. PMID: 22402316 Обзор.
Формирование состояний хроматина при раке предстательной железы с помощью транскрипционных факторов Pioneer.
Хэнки В., Чен З., Ван К. Хэнки В. и др. Рак рез. 2020 15 июня; 80 (12): 2427-2436. дои: 10. 1158/0008-5472.CAN-19-3447. Epub 2020 24 февраля. Рак рез. 2020. PMID: 32094298 Бесплатная статья ЧВК. Обзор.
1158/0008-5472.CAN-19-3447. Epub 2020 24 февраля. Рак рез. 2020. PMID: 32094298 Бесплатная статья ЧВК. Обзор.
Посмотреть все похожие статьи
Основанная на изменении количества копий плазмы прогностическая и прогностическая оценка мультигенного риска метастатического устойчивого к кастрации рака предстательной железы.
Хуан Дж., Ду М., Супир А., Ван Л., Тан В., Калари К.Р., Килари Д., Пак Дж., Хуан К.С., Кохли М., Ван Л. Хуан Дж. и др. Раков (Базель). 2022 сен 28;14(19)):4714. doi: 10.3390/раки14194714. Раков (Базель). 2022. PMID: 36230636 Бесплатная статья ЧВК.
TRIM33 стимулирует рост опухоли предстательной железы, стабилизируя андрогенный рецептор от опосредованной Skp2 деградации.
Чен М., Лингадахалли С., Нарваде Н., Лэй К.М.К., Лю С., Чжао З., Чжэн И., Лу К., Тан А.Н., Пун TCW, Чунг Э. Чен М. и др. EMBO Rep. 3 августа 2022 г .; 23 (8): e53468. doi: 10.15252/embr.202153468. Epub 2022 4 июля. Представитель EMBO 2022 г. PMID: 35785414
Потенциальная роль экзосомальных белков в раке предстательной железы.
Фэн С., Лу К., Цзоу С., Цзоу Дж., Чжан Г. Фэн С. и др. Фронт Онкол. 2022 7 июня; 12:873296. doi: 10.3389/fonc.2022.873296. Электронная коллекция 2022. Фронт Онкол. 2022. PMID: 35747825 Бесплатная статья ЧВК. Обзор.
Всесторонний анализ профиля экспрессии генов, затронутых нейтрофильной внеклеточной ловушкой, в клетках рака желудка и клиническое значение передачи сигналов, связанных с lncRNA NEAT1.
Li C, Zou X, Cai Q, Li J, Yang S, Zhang A, Chen C, Zhu L. Ли С и др. Фронт Онкол. 2022 19 мая; 12:798531. doi: 10.3389/fonc.2022.798531. Электронная коллекция 2022. Фронт Онкол. 2022. PMID: 35664777 Бесплатная статья ЧВК.
Повышенная экспрессия RAB3B играет важную роль в химиорезистентности и метастатическом потенциале клеток гепатомы.
Цунэдоми Р., Йошимура К., Кимура Ю., Нишияма М., Фудзивара Н., Мацукума С., Канекиё С., Мацуи Х., Шиндо Ю., Ватанабэ Ю., Токумицу Ю., Йошида С., Иида М., Судзуки Н., Такеда С., Иока Т., Хазама С., Нагано Х. Цунэдоми Р. и соавт. БМК Рак. 2022 11 марта; 22 (1): 260. дои: 10.1186/s12885-022-09370-1. БМК Рак. 2022. PMID: 35277124 Бесплатная статья ЧВК.
Просмотреть все статьи "Цитируется по"
. 2007 ноябрь; 27 (21): 7538-50.
2007 ноябрь; 27 (21): 7538-50.
doi: 10.1128/MCB.00955-07. Epub 2007 20 августа.
Хуан Хуан Инь 1 , Клэр Поллок, Кирстен Трейси, Моника Чок, Филип Мартин, Майкл Оберст, Кэтлин Келли
Принадлежности
 1128/МКБ.00955-07
1128/МКБ.00955-07 Бесплатная статья ЧВК
Хуан Хуан Инь и др. Мол Селл Биол. 2007 ноябрь
Бесплатная статья ЧВК
. 2007 ноябрь; 27 (21): 7538-50.
doi: 10.1128/MCB.00955-07. Epub 2007 20 августа.
Хуан Хуан Инь 1 , Клэр Поллок, Кирстен Трейси, Моника Чок, Филип Мартин, Майкл Оберст, Кэтлин Келли
 , Rm. 1068, Бетесда, Мэриленд 20892, США.
, Rm. 1068, Бетесда, Мэриленд 20892, США. Отличительной чертой метастазирования является органоспецифичность; однако мало что известно об основных сигнальных путях, ответственных за колонизацию и рост опухолевых клеток в органах-мишенях. Поскольку активация рецептора тирозинкиназы часто связана с прогрессированием рака простаты, мы исследовали роль общего сигнального посредника, активированного Ras, в метастазировании рака простаты. Три эффекторных пути после Ras, Raf/внеклеточно регулируемая сигналом киназа (ERK), фосфатидилинозитол-3-киназа и факторы обмена гуаниновых нуклеотидов Ral (RalGEF) были проанализированы на предмет их способности стимулировать метастазирование онкогенного, неметастатического рака предстательной железы человека. клеточная линия DU145. Онкогенный Ras способствовал метастазированию DU145 во многие органы, включая кости и головной мозг. Активация пути Raf/ERK стимулировала метастатическую колонизацию головного мозга, в то время как активация пути RalGEF приводила к метастазам в костях, наиболее частому органу для метастазирования рака предстательной железы. Кроме того, потеря RalA в метастатической клеточной линии РС3 подавляла метастазирование в кости, но не влияла на рост подкожной опухоли. Потеря Ral, по-видимому, подавляла экспансивный рост клеток рака предстательной железы в костях, в то время как самонаведение и начальная колонизация были менее затронуты. Эти данные расширяют наше понимание функциональных ролей Ral-пути и позволяют идентифицировать сигнальные пути, важные для органоспецифического метастазирования.
клеточная линия DU145. Онкогенный Ras способствовал метастазированию DU145 во многие органы, включая кости и головной мозг. Активация пути Raf/ERK стимулировала метастатическую колонизацию головного мозга, в то время как активация пути RalGEF приводила к метастазам в костях, наиболее частому органу для метастазирования рака предстательной железы. Кроме того, потеря RalA в метастатической клеточной линии РС3 подавляла метастазирование в кости, но не влияла на рост подкожной опухоли. Потеря Ral, по-видимому, подавляла экспансивный рост клеток рака предстательной железы в костях, в то время как самонаведение и начальная колонизация были менее затронуты. Эти данные расширяют наше понимание функциональных ролей Ral-пути и позволяют идентифицировать сигнальные пути, важные для органоспецифического метастазирования.
РИС. 1.
Онкогенный Ras и эффектор Ras…
РИС. 1.
1.
Онкогенные Ras и эффекторные мутанты Ras активируют метастатический потенциал клеток DU145…
ИНЖИР. 1. Онкогенные Ras и эффекторные мутанты Ras активируют метастатический потенциал клеток DU145. (A) Вестерн-блот-анализ, показывающий экспрессию H-Ras, фосфорилированного Erk и активированного RalA в клетках DU145, экспрессирующих различные мутанты Ras. α-тубулин, общий Erk и общий RalA служили в качестве контроля загрузки соответственно. Белки в лизатах цельных клеток разделяли электрофорезом в полиакриламидном геле с додецилсульфатом натрия. Активированный RalA измеряли путем обнаружения связанного с RalBP1 RalA после иммунопреципитации. (B) Кривая Каплана-Мейера, показывающая выживаемость мышей, несущих различные клеточные линии DU145. Мышей умерщвляли после 10% потери массы тела, параплегии, дисбаланса или скручивания головы. Данные представляют собой процент выживаемости в зависимости от времени (дни). **, P <0,01 по результатам логарифмического рангового теста по сравнению с контрольной группой DU145EV. Не было никаких существенных различий между группами эффекторных мутантов DU145Ras V12 и DU145Ras V12 . n = от 10 до 12 мышей на группу. (C) Скорость роста опухоли in vivo после подкожной инъекции DU145Ras V12 и различных эффекторных мутантов Ras. Данные представляют собой объем опухоли (см 3 ) ± SE в зависимости от времени (дни). n = 10 опухолей на группу. (D) Скорость роста опухоли в кости после внутриберцовой инъекции. Данные представляют средний поток фотонов ± стандартная ошибка с течением времени. n = 10 голеней на группу. В скобках указано количество большеберцовых костей, в которых развились опухоли. Никаких существенных различий не было обнаружено с помощью двухстороннего дисперсионного анализа ( P > 0,1).
**, P <0,01 по результатам логарифмического рангового теста по сравнению с контрольной группой DU145EV. Не было никаких существенных различий между группами эффекторных мутантов DU145Ras V12 и DU145Ras V12 . n = от 10 до 12 мышей на группу. (C) Скорость роста опухоли in vivo после подкожной инъекции DU145Ras V12 и различных эффекторных мутантов Ras. Данные представляют собой объем опухоли (см 3 ) ± SE в зависимости от времени (дни). n = 10 опухолей на группу. (D) Скорость роста опухоли в кости после внутриберцовой инъекции. Данные представляют средний поток фотонов ± стандартная ошибка с течением времени. n = 10 голеней на группу. В скобках указано количество большеберцовых костей, в которых развились опухоли. Никаких существенных различий не было обнаружено с помощью двухстороннего дисперсионного анализа ( P > 0,1).
РИС. 2.
2.
Метастазы в головной мозг, образованные DU145Ras…
РИС. 2.
Метастазы в головной мозг, образованные DU145Ras V12 и различные эффекторные мутанты DU145Ras. (А) Маломощный…
ИНЖИР. 2. Метастазы в головной мозг, образованные DU145Ras V12 и различными эффекторными мутантами DU145Ras. (A) Микрофотография срезов головного мозга с низким увеличением, показывающая распределение множественных метастазов в мозг у мышей, несущих DU145Ras V12C40 , по сравнению с таковым у контрольных мышей DU145EV. Пруток, 1 мм. (B) Репрезентативные гистологические срезы метастазов в головной мозг мышей, несущих DU145Ras 9.0007 V12 и различные эффекторные мутанты Ras. Показаны цитокератин-18-положительные опухолевые клетки (коричневые) в головном мозге, выявленные с помощью иммуногистохимического окрашивания (50X). Пруток, 200 мкм. (C) Количество метастазов в головной мозг на мышь в каждой группе, определенное с помощью гистологических срезов. Выживаемость животных была такой, как показано на рис. 1В, а окончательные образцы собирали через 10 недель. n = от 10 до 12 мышей на группу. **, Р < 0,01.
Пруток, 200 мкм. (C) Количество метастазов в головной мозг на мышь в каждой группе, определенное с помощью гистологических срезов. Выживаемость животных была такой, как показано на рис. 1В, а окончательные образцы собирали через 10 недель. n = от 10 до 12 мышей на группу. **, Р < 0,01.
РИС. 3.
Ras и эффекторные мутации Ras, индуцированные…
РИС. 3.
Ras и эффекторные мутации Ras, индуцированные метастазами в кости. (A) Репрезентативные рентгенограммы задних конечностей…
ИНЖИР. 3. Метастазы в кости, индуцированные эффекторными мутациями Ras и Ras. (A) Репрезентативные рентгенограммы задних конечностей мышей, которым инъецировали различные популяции DU145 внутрисердечным путем. Разрушение кости было очевидным в DU145Ras В12 и ДУ145Рас В12Г37 по сравнению с группами ДУ145ЕВ, ДУ145Рас В12С35 и ДУ145Рас В12С40 . (B) Репрезентативные гистологические срезы большеберцовой кости мышей, несущих разные клеточные линии DU145. Опухоль заместила полость костного мозга в группе DU145Ras V12G37 . В группе DU145Ras V12 наблюдались массивная деструкция кости и большое опухолевое бремя. Относительно небольшие опухоли и меньшая деструкция кости были очевидны у DU145Ras 9.0007 В12С35 и ДУ145Рас В12С40 групп. В группе DU145EV опухолевых клеток обнаружено не было. Пруток, 1 мм. (C) Количество поражений костей, определенное на рентгенограммах, в зависимости от времени (дни). **, Р < 0,01; ***, P < 0,001 (по сравнению с контролем ДУ145ЭВ). (D) Гистоморфометрический анализ площади опухоли в длинных костях разных групп. *, Р < 0,05; ***, P < 0,001 (по сравнению с контролем ДУ145ЭВ).
Разрушение кости было очевидным в DU145Ras В12 и ДУ145Рас В12Г37 по сравнению с группами ДУ145ЕВ, ДУ145Рас В12С35 и ДУ145Рас В12С40 . (B) Репрезентативные гистологические срезы большеберцовой кости мышей, несущих разные клеточные линии DU145. Опухоль заместила полость костного мозга в группе DU145Ras V12G37 . В группе DU145Ras V12 наблюдались массивная деструкция кости и большое опухолевое бремя. Относительно небольшие опухоли и меньшая деструкция кости были очевидны у DU145Ras 9.0007 В12С35 и ДУ145Рас В12С40 групп. В группе DU145EV опухолевых клеток обнаружено не было. Пруток, 1 мм. (C) Количество поражений костей, определенное на рентгенограммах, в зависимости от времени (дни). **, Р < 0,01; ***, P < 0,001 (по сравнению с контролем ДУ145ЭВ). (D) Гистоморфометрический анализ площади опухоли в длинных костях разных групп. *, Р < 0,05; ***, P < 0,001 (по сравнению с контролем ДУ145ЭВ).
РИС. 4.
Количественное определение остановленных опухолевых клеток…
РИС. 4.
Количественное определение опухолевых клеток, арестованных в сосудистой сети головного мозга и костей. (А)…
ИНЖИР. 4. Количественное определение опухолевых клеток, задержанных в сосудистой сети головного мозга и костей. (A) Флуоресцентные клетки, указанные стрелками, показаны на поверхности большеберцовой кости, визуализированные с помощью флуоресцентной стереомикроскопии. Пруток, 100 мкм. (B) Флуоресцентные клетки в срезе головного мозга. (C) Среднее количество очагов на кость для DU145EV, DU145Ras В12 , ДУ145Рас В12Г37 , ДУ145Рас В12С35 . У каждой мыши подсчитывали четыре кости. (D) Среднее количество очагов на срез головного мозга для различных клеточных линий, производных DU145. От каждой мыши подсчитывали четыре среза. n = 3 мыши на группу. С помощью однофакторного дисперсионного анализа не было выявлено существенных различий ( P > 0,05).
(D) Среднее количество очагов на срез головного мозга для различных клеточных линий, производных DU145. От каждой мыши подсчитывали четыре среза. n = 3 мыши на группу. С помощью однофакторного дисперсионного анализа не было выявлено существенных различий ( P > 0,05).
РИС. 5.
Активация пути RalGEF…
РИС. 5.
Активация пути RalGEF необходима и достаточна для развития костей…
ИНЖИР. 5. Активация пути RalGEF необходима и достаточна для развития костных метастазов клетками DU145. (A) Иммуноблот-анализ экспрессии Ras, активированного RalA и фосфорилированного Erk в DU145EV, DU145Ras V12G37 puro, DU145RlfCAAX и DU145Ras V12G37 RalB N28 клеточных линий. Активированный RalA измеряли путем обнаружения связанного с RalBP1 RalA после иммунопреципитации. α-тубулин, общий RalA и общий Erk использовали в качестве контроля загрузки. (B) Процент мышей, у которых развились метастазы в кости через 6 недель после внутрисердечной инъекции. n = от 10 до 12 мышей на группу. (C) Иммуноблот-анализ уровней RalA и RalB в DU145Ras V12G37 после введения кшРНК. ShRNAs RalA помечены A1 и A2, а shRNAs RalB помечены B1 и B2. α-Тубулин используется в качестве контроля нагрузки. (D) RalA и RalB необходимы для метастатического роста опухоли в костях. ДУ145Рас 9Клетки 0007 V12G37 , экспрессирующие вышеупомянутые кшРНК против RalA и RalB, вводили внутрисердечно. Метастатический рост опухоли контролировали с помощью BLI. Линейный график показывает средний поток фотонов на животное в группе за 4-недельный период. n = 8 мышей в группе. Общее количество метастазов на 28-й неделе было следующим: PLKO ( n = 7), RalAshRNA1 ( n = 2), RalAshRNA2 ( n = 2) и RalBshRNA1 ( n = 3), RalBshRNA2.
Активированный RalA измеряли путем обнаружения связанного с RalBP1 RalA после иммунопреципитации. α-тубулин, общий RalA и общий Erk использовали в качестве контроля загрузки. (B) Процент мышей, у которых развились метастазы в кости через 6 недель после внутрисердечной инъекции. n = от 10 до 12 мышей на группу. (C) Иммуноблот-анализ уровней RalA и RalB в DU145Ras V12G37 после введения кшРНК. ShRNAs RalA помечены A1 и A2, а shRNAs RalB помечены B1 и B2. α-Тубулин используется в качестве контроля нагрузки. (D) RalA и RalB необходимы для метастатического роста опухоли в костях. ДУ145Рас 9Клетки 0007 V12G37 , экспрессирующие вышеупомянутые кшРНК против RalA и RalB, вводили внутрисердечно. Метастатический рост опухоли контролировали с помощью BLI. Линейный график показывает средний поток фотонов на животное в группе за 4-недельный период. n = 8 мышей в группе. Общее количество метастазов на 28-й неделе было следующим: PLKO ( n = 7), RalAshRNA1 ( n = 2), RalAshRNA2 ( n = 2) и RalBshRNA1 ( n = 3), RalBshRNA2. (5). *, P < 0,05 по сравнению с контролем EV.
(5). *, P < 0,05 по сравнению с контролем EV.
РИС. 6.
Восстановленный RalA ингибирует метастазирование…
РИС. 6.
Восстановленный RalA ингибирует метастазирование клеток PC3 в кости. (A) Обнаружение RalA…
ИНЖИР. 6. Восстановленный RalA ингибирует метастазирование клеток PC3 в кости. (A) Обнаружение RalA или RalB с помощью вестерн-блоттинга в клетках PC3, стабильно экспрессирующих кшРНК RalA (A1 и A2) или кшРНК RalB (B1 и B2), или в контроле EV. α-Тубулин служит в качестве контроля нагрузки. (B) RalA необходим для метастатического роста опухоли в костях. Клетки PC3, экспрессирующие вышеупомянутые кшРНК против RalA и RalB, вводили внутрисердечно. Метастатический рост опухоли контролировали с помощью BLI. Линейный график показывает средний поток фотонов на животное в группе за 6-недельный период. n = от 8 до 15 мышей на группу. У мышей, несущих RalA shRNA, наблюдалось значительно меньшее опухолевое бремя в костях, чем у контрольных мышей EV и мышей, несущих RalB shRNA. *, Р < 0,05; **, P <0,01 (по сравнению с контролем EV). (C) Репрезентативные гистологические срезы с окрашиванием гематоксилином и эозином разрезов нижней челюсти, взятых у мышей, которым вводили указанные клетки. Бары: верхняя панель, 50 мкм; нижняя панель, 10 мкм. Большие остеолитические опухолевые массы можно увидеть в челюстях мышей из контрольной группы EV и мышей, несущих RalB shRNA, которые замещают костный мозг, разрушают соседнюю кость и прорастают в окружающие мягкие ткани. Напротив, опухолевые клетки редко наблюдаются в полостях костного мозга челюсти животных, несущих RalA shRNA; иногда опухолевые клетки обнаруживаются в компартментах корня зуба, как показано на рисунке. (D) Иммуноблот-анализ уровней RalA в клетках, выделенных из подкожно выращенной опухоли (подкожно опухолевые изоляты) и клеточных линиях, не пассированных через животных (клеточные линии).
Линейный график показывает средний поток фотонов на животное в группе за 6-недельный период. n = от 8 до 15 мышей на группу. У мышей, несущих RalA shRNA, наблюдалось значительно меньшее опухолевое бремя в костях, чем у контрольных мышей EV и мышей, несущих RalB shRNA. *, Р < 0,05; **, P <0,01 (по сравнению с контролем EV). (C) Репрезентативные гистологические срезы с окрашиванием гематоксилином и эозином разрезов нижней челюсти, взятых у мышей, которым вводили указанные клетки. Бары: верхняя панель, 50 мкм; нижняя панель, 10 мкм. Большие остеолитические опухолевые массы можно увидеть в челюстях мышей из контрольной группы EV и мышей, несущих RalB shRNA, которые замещают костный мозг, разрушают соседнюю кость и прорастают в окружающие мягкие ткани. Напротив, опухолевые клетки редко наблюдаются в полостях костного мозга челюсти животных, несущих RalA shRNA; иногда опухолевые клетки обнаруживаются в компартментах корня зуба, как показано на рисунке. (D) Иммуноблот-анализ уровней RalA в клетках, выделенных из подкожно выращенной опухоли (подкожно опухолевые изоляты) и клеточных линиях, не пассированных через животных (клеточные линии). Опухоли выделяли у мышей, которым вводили указанную клеточную линию, и размножали in vitro. Иммуноблот показывает уровни RalA в трех контрольных опухолях EV и четырех опухолях, экспрессирующих кшРНК RalA. Тубулин используется здесь как контроль нагрузки. (E) Иммуноблот-анализ уровней RalA и RalB в клетках, выделенных из челюсти и длинных костей мышей, которым внутрисердечно вводили указанные клеточные линии. Опухоли выделяли у мышей и размножали in vitro. Тубулин используется здесь как контроль нагрузки.
Опухоли выделяли у мышей, которым вводили указанную клеточную линию, и размножали in vitro. Иммуноблот показывает уровни RalA в трех контрольных опухолях EV и четырех опухолях, экспрессирующих кшРНК RalA. Тубулин используется здесь как контроль нагрузки. (E) Иммуноблот-анализ уровней RalA и RalB в клетках, выделенных из челюсти и длинных костей мышей, которым внутрисердечно вводили указанные клеточные линии. Опухоли выделяли у мышей и размножали in vitro. Тубулин используется здесь как контроль нагрузки.
См. это изображение и информацию об авторских правах в PMC
Сигнальные пути, которые способствуют инвазии и метастазированию: критический и отчетливый вклад киназы, регулируемой внеклеточным сигналом, и путей фактора обмена гуанина, специфичного для Ral.
Уорд Ю., Ван В., Вудхаус Э., Линнойла И., Лиотта Л., Келли К. Уорд Ю. и др. Мол Селл Биол. 2001 Сентябрь; 21 (17): 5958-69. doi: 10.1128/MCB.21.17.5958-5969.2001. Мол Селл Биол. 2001. PMID: 11486034 Бесплатная статья ЧВК.
Уорд Ю. и др. Мол Селл Биол. 2001 Сентябрь; 21 (17): 5958-69. doi: 10.1128/MCB.21.17.5958-5969.2001. Мол Селл Биол. 2001. PMID: 11486034 Бесплатная статья ЧВК.
MAZ способствует метастазированию рака предстательной железы в кости посредством транскрипционной активации KRas-зависимого пути RalGEFs.
Ян К., Ланг С., У З., Дай Ю., Хе С., Го В., Хуан С., Ду Х., Рен Д., Пэн Х. Ян Кью и др. J Exp Clin Cancer Res. 2019 5 сентября; 38 (1): 391. дои: 10.1186/s13046-019-1374-х. J Exp Clin Cancer Res. 2019. PMID: 31488180 Бесплатная статья ЧВК.
Реовирусный онколиз: путь Ras/RalGEF/p38 диктует восприимчивость клетки-хозяина к реовирусной инфекции.
Норман К.Л., Хирасава К., Ян А.Д., Шилдс М.А., Ли П. В. Норман К.Л. и др. Proc Natl Acad Sci U S A. 2004 Jul 27;101(30):11099-104. doi: 10.1073/pnas.0404310101. Epub 2004 19 июля. Proc Natl Acad Sci U S A. 2004. PMID: 15263068 Бесплатная статья ЧВК.
В. Норман К.Л. и др. Proc Natl Acad Sci U S A. 2004 Jul 27;101(30):11099-104. doi: 10.1073/pnas.0404310101. Epub 2004 19 июля. Proc Natl Acad Sci U S A. 2004. PMID: 15263068 Бесплатная статья ЧВК.
Путь RalGEF/Ral: оценка возможности вмешательства при раке Ras.
Купер Дж.М., Бодеманн Б.О., Уайт М.А. Купер Дж. М. и соавт. Ферменты. 2013; 34 балла. Б: 137-56. doi: 10.1016/B978-0-12-420146-0.00006-8. Epub 2013 7 ноября. Ферменты. 2013. PMID: 25034103 Обзор.
Различные требования к онкогенезу Ras в клетках человека и мыши.
Хамад Н.М., Эльконин Дж.Х., Карноуб А.Е., Бай В., Рич Дж.Н., Абрахам Р.Т., Дер С.Дж., Счетчик СМ. Хамад Н.М. и соавт. Гены Дев. 2002 г., 15 августа; 16 (16): 2045–57. doi: 10.1101/gad.993902. Гены Дев. 2002. PMID: 12183360 Бесплатная статья ЧВК. Обзор.
doi: 10.1101/gad.993902. Гены Дев. 2002. PMID: 12183360 Бесплатная статья ЧВК. Обзор.
Посмотреть все похожие статьи
Загадка RAL: различные роли RALA и RALB в раке.
Ричардсон Д.С., Спехар Дж.М., Хан Д.Т., Чакраварти П.А., Сайзмор СТ. Ричардсон Д.С. и соавт. Клетки. 2022 14 мая; 11 (10): 1645. doi: 10.3390/cells11101645. Клетки. 2022. PMID: 35626682 Бесплатная статья ЧВК. Обзор.
Открытие новых терапевтических мишеней при раке яичников путем выявления значительно немутированных генов.
Аль-Фарси Х., Аль-Азвани И., Малек Дж.А., Чушан Л., Рафии А., Халаби Н.М. Аль-Фарси Х. и др. J Transl Med. 2022 26 мая; 20 (1): 244. дои: 10.1186/с12967-022-03440-5. J Transl Med. 2022. PMID: 35619151 Бесплатная статья ЧВК.
дои: 10.1186/с12967-022-03440-5. J Transl Med. 2022. PMID: 35619151 Бесплатная статья ЧВК.
TMPRSS2-ERG способствует возникновению рака предстательной железы путем подавления индуцированного онкогенами старения.
Фанг Л., Ли Д., Инь Дж., Пан Х., Йе Х., Боуман Дж., Капальдо Б., Келли К. Фанг Л. и др. Ген Рака Ther. 2022 октября; 29 (10): 1463-1476. doi: 10.1038/s41417-022-00454-5. Epub 2022 7 апр. Ген Рака Ther. 2022. PMID: 35393570 Бесплатная статья ЧВК.
Кальмодулин извлекает белок RalA семейства Ras из липидных бислоев путем взаимодействия с двумя мотивами, нацеленными на мембрану.
Чемберлен С.Г., Гольке А., Шафик А., Сквайрс И.Дж., Оуэн Д., Мотт Х.Р. Чемберлен С.Г. и соавт. Proc Natl Acad Sci U S A.