2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Бактериофаги – уникальные микроорганизмы. Их антибактериальная активность достигается внедрением в клетку возбудителя, последующим размножением и распадом бактерии. Для лечения бактериальных заболеваний могут применяться либо антибиотики, либо бактериофаги, либо проводят совместную терапию. В каких случаях необходимо назначать антибиотики, а когда – бактериофаги? Все ответы в нашей статье.
Одна из ключевых проблем, послужившая развитию антибиотикорезистентности бактерий, – неправильное применение антибиотиков или противомикробных препаратов.
Когда к врачу обращается пациент с острым течением заболевания, антибиотики в большинстве случаев назначают сразу, без предварительного определения чувствительности возбудителя.
Специалист назначает антибиотик исходя из собственного опыта, учитывая рекомендации по активности препарата в отношении бактерий, наиболее часто вызывающих данное заболевание. Выбор антибиотика зачастую продиктован клинической ситуацией: необходимо устранить острые симптомы воспаления, что возможно только при ликвидации микроорганизма как причины, его вызывающей. Одновременно с назначением антибиотика врач направляет на анализ по определению чувствительности возбудителя к антибактериальным препаратам и бактериофагам. Результаты анализа обычно готовы в течение 3–4-х дней.
Если врач по каким-либо причинам не назначил анализ на чувствительность к антибиотикам и бактериофагам, вы можете сделать его по своему желанию в клинической лаборатории, где проводят такие тесты.
Важные требования к подбору антибактериального препарата на первом этапе: правильная дозировка, узкий спектр активности. Корректное назначение антибиотика определяет возможность формирования к нему устойчивости у бактерий. К сожалению, часто случается наоборот: некорректно назначенный препарат катализирует процесс мутаций у бактерий и формирует устойчивость их к антибиотикам.
Резистентность к противомикробным средствам – серьезная проблема, представляющая угрозу для здоровья людей во всех регионах нашей планеты. Однако появление микроорганизмов, стойких к антибиотикам, послужило толчком к активному изучению бактериофагов.
Бактериофаги в отличие от антибактериальных препаратов воздействуют только на возбудителя заболевания, не затрагивая нормальную флору человеческого организма. Препараты бактериофагов можно принимать в сочетании с другими антибактериальными средствами, что усиливает противобактериальный эффект и позволяет снизить дозу антибиотика.
Совместное назначение бактериофагов с противовирусными препаратами противопоказано.
Чтобы достичь нужного эффекта при лечении любым антибактериальным препаратом и препаратом бактериофага, необходимо пройти тест на чувствительность возбудителя.
Метод серийных разведений
Антибиотик в различных разведениях помещают в жидкую питательную среду (бульон) или агар, куда добавляют бактериальную суспензию. По наличию или отсутствию роста микроорганизмов в питательной среде оценивают эффективность антибиотика, определяют его минимальную подавляющую концентрацию.Диско-диффузионный метод
В питательную среду с ранее внесенной бактериальной суспензией помещают бумажные диски с антибиотиками. Вследствие диффузии антибиотика происходит подавление роста микроорганизмов, и по диаметру зон задержки роста судят о чувствительности культуры.Е-тест
Это полоска, на которую нанесен градиент концентрации антибиотика. Исследование проводят аналогично диско-диффузионному методу.Метод слепого пятна
Классический тест на определение чувствительности к бактериофагам. В клинических лабораториях и на производстве применяют метод титрования. Выделенные из патологического содержимого бактерии засевают в питательную среду вместе с бактериофагом.Появление стерильных округлых пятен говорит о лизисе (растворении клеток) бактерий с образованием колоний бактериофагов. Просветление среды (формирование прозрачных зон) подтверждает чувствительность бактерий к бактериофагу.
По спектру действия выделяют моновалентные бактериофаги, которые лизируют бактерии одного вида, и поливалентные – разрушающие бактерии нескольких видов.
На бланке теста будут обозначения в виде букв R или S. R (Resistant) – резистентность бактерий к данному бактериофагу или антибиотику, S (Sensitive) – чувствительность возбудителя к препарату.
Если результат теста R, лечение данным фаговым препаратом неэффективно, S говорит о том, что бактериофаг или антибиотик можно назначать. Если возбудитель чувствителен к определенной группе антибиотиков и резистентен к бактериофагу, назначают антибактериальные препараты, и наоборот.
Тест на антибиотико- и фагочувствительность помогает определить, справится препарат с возбудителем инфекции или нет. Это важный показатель, на который ориентируются специалисты при выборе схемы лечения.
АО «НПО «Микроген» выпускает широкий спектр бактериофагов, что расширяет возможности фаготерапии и позволяет корректно подобрать препарат, к которому чувствительны патогенные бактерии.
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения: КОЕ/тампон.
Форма выдачи результатов
Результат содержит информацию о наличии или отсутствии роста этиологически значимых микроорганизмов, в т. ч. дрожжевых грибов, их количестве, родовой и/или видовой принадлежности.
При выявлении роста этиологически значимых бактерий в диагностическом титре проводят определение чувствительности к стандартному спектру антимикробных препаратов и бактериофагам.
Список АМП определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Выбор бактериофагов определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Определение вида грибов и постановка чувствительности к антимикотическим средствам в этот анализ не входит (при подозрении на грибковую инфекцию необходимо заказать тест № 442).В случае роста в нестерильных локусах (ротоглотка, нос/носоглотка) нормальной флоры, а в стерильных локусах (пазухи) – сопутствующей флоры (Streptococcus viridans group, Corynebacterium spр., коагулазонегативные стафилококки, микрококки и др.) на бланке результата исследования указывают род и вид микроорганизма, степень обсемененности и комментарий о принадлежности данных микроорганизмов к нормальной или сопутствующей флоре, в соответствии с локализацией; в этих случаях определение чувствительности к антимикробным препаратам и бактериофагам не проводят. При полном отсутствии роста выдают результат «роста микрофлоры не выявлено». В случае роста микроорганизмов, для которых отсутствует стандартизованная методика определения чувствительности и критерии оценки, а также в случае роста микроорганизмов, к которым не осуществляется промышленный выпуск препаратов бактериофагов, определение чувствительности невозможно, о чем дают соответствующие комментарии.
Внимание! Дозаказ определения чувствительности к расширенному спектру АМП невозможен, для этой цели назначают тест № 467-Р.Интерпретация
В большинстве случаев острых внебольничных инфекций этиология этих заболеваний включает ограниченный перечень потенциальных возбудителей, в том числе:
Отсутствие роста бактерий при наличии клинических проявлений может свидетельствовать о небактериальном характере инфекции. Не все острые инфекции дыхательных путей имеют бактериальную этиологию.
Часть инфекций (в педиатрической практике большая часть) вызывают вирусы, обнаружение которых при бактериологическом исследовании невозможно.
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения: КОЕ/тампон.
Форма выдачи результатов
Результат содержит информацию о наличии или отсутствии роста этиологически значимых микроорганизмов, в т. ч. дрожжевых грибов, их количестве, родовой и/или видовой принадлежности.
При выявлении роста этиологически значимых бактерий в диагностическом титре проводят определение чувствительности к стандартному спектру антимикробных препаратов и бактериофагам.
Список АМП определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Выбор бактериофагов определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Определение вида грибов и постановка чувствительности к антимикотическим средствам в этот анализ не входит (при подозрении на грибковую инфекцию необходимо заказать тест № 442).В случае роста в нестерильных локусах (ротоглотка, нос/носоглотка) нормальной флоры, а в стерильных локусах (пазухи) – сопутствующей флоры (Streptococcus viridans group, Corynebacterium spр., коагулазонегативные стафилококки, микрококки и др.) на бланке результата исследования указывают род и вид микроорганизма, степень обсемененности и комментарий о принадлежности данных микроорганизмов к нормальной или сопутствующей флоре, в соответствии с локализацией; в этих случаях определение чувствительности к антимикробным препаратам и бактериофагам не проводят. При полном отсутствии роста выдают результат «роста микрофлоры не выявлено». В случае роста микроорганизмов, для которых отсутствует стандартизованная методика определения чувствительности и критерии оценки, а также в случае роста микроорганизмов, к которым не осуществляется промышленный выпуск препаратов бактериофагов, определение чувствительности невозможно, о чем дают соответствующие комментарии.
Внимание! Дозаказ определения чувствительности к расширенному спектру АМП невозможен, для этой цели назначают тест № 467-Р.Интерпретация
В большинстве случаев острых внебольничных инфекций этиология этих заболеваний включает ограниченный перечень потенциальных возбудителей, в том числе:
Отсутствие роста бактерий при наличии клинических проявлений может свидетельствовать о небактериальном характере инфекции. Не все острые инфекции дыхательных путей имеют бактериальную этиологию.
Часть инфекций (в педиатрической практике большая часть) вызывают вирусы, обнаружение которых при бактериологическом исследовании невозможно.
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения: КОЕ/тампон.
Форма выдачи результатов
Результат содержит информацию о наличии или отсутствии роста этиологически значимых микроорганизмов, в т. ч. дрожжевых грибов, их количестве, родовой и/или видовой принадлежности.
При выявлении роста этиологически значимых бактерий в диагностическом титре проводят определение чувствительности к стандартному спектру антимикробных препаратов и бактериофагам.
Список АМП определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Выбор бактериофагов определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Определение вида грибов и постановка чувствительности к антимикотическим средствам в этот анализ не входит (при подозрении на грибковую инфекцию необходимо заказать тест № 442).В случае роста в нестерильных локусах (ротоглотка, нос/носоглотка) нормальной флоры, а в стерильных локусах (пазухи) – сопутствующей флоры (Streptococcus viridans group, Corynebacterium spр., коагулазонегативные стафилококки, микрококки и др.) на бланке результата исследования указывают род и вид микроорганизма, степень обсемененности и комментарий о принадлежности данных микроорганизмов к нормальной или сопутствующей флоре, в соответствии с локализацией; в этих случаях определение чувствительности к антимикробным препаратам и бактериофагам не проводят. При полном отсутствии роста выдают результат «роста микрофлоры не выявлено». В случае роста микроорганизмов, для которых отсутствует стандартизованная методика определения чувствительности и критерии оценки, а также в случае роста микроорганизмов, к которым не осуществляется промышленный выпуск препаратов бактериофагов, определение чувствительности невозможно, о чем дают соответствующие комментарии.
Внимание! Дозаказ определения чувствительности к расширенному спектру АМП невозможен, для этой цели назначают тест № 467-Р.Интерпретация
В большинстве случаев острых внебольничных инфекций этиология этих заболеваний включает ограниченный перечень потенциальных возбудителей, в том числе:
Отсутствие роста бактерий при наличии клинических проявлений может свидетельствовать о небактериальном характере инфекции. Не все острые инфекции дыхательных путей имеют бактериальную этиологию.
Часть инфекций (в педиатрической практике большая часть) вызывают вирусы, обнаружение которых при бактериологическом исследовании невозможно.
Интерпретация результатов
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Единицы измерения: КОЕ/тампон.
Форма выдачи результатов
Результат содержит информацию о наличии или отсутствии роста этиологически значимых микроорганизмов, в т. ч. дрожжевых грибов, их количестве, родовой и/или видовой принадлежности.
При выявлении роста этиологически значимых бактерий в диагностическом титре проводят определение чувствительности к стандартному спектру антимикробных препаратов и бактериофагам.
Список АМП определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Выбор бактериофагов определяется видом выявленных возбудителей, со списками можно ознакомиться здесь. Определение вида грибов и постановка чувствительности к антимикотическим средствам в этот анализ не входит (при подозрении на грибковую инфекцию необходимо заказать тест № 442).В случае роста в нестерильных локусах (ротоглотка, нос/носоглотка) нормальной флоры, а в стерильных локусах (пазухи) – сопутствующей флоры (Streptococcus viridans group, Corynebacterium spр., коагулазонегативные стафилококки, микрококки и др.) на бланке результата исследования указывают род и вид микроорганизма, степень обсемененности и комментарий о принадлежности данных микроорганизмов к нормальной или сопутствующей флоре, в соответствии с локализацией; в этих случаях определение чувствительности к антимикробным препаратам и бактериофагам не проводят. При полном отсутствии роста выдают результат «роста микрофлоры не выявлено». В случае роста микроорганизмов, для которых отсутствует стандартизованная методика определения чувствительности и критерии оценки, а также в случае роста микроорганизмов, к которым не осуществляется промышленный выпуск препаратов бактериофагов, определение чувствительности невозможно, о чем дают соответствующие комментарии.
Внимание! Дозаказ определения чувствительности к расширенному спектру АМП невозможен, для этой цели назначают тест № 467-Р.Интерпретация
В большинстве случаев острых внебольничных инфекций этиология этих заболеваний включает ограниченный перечень потенциальных возбудителей, в том числе:
Отсутствие роста бактерий при наличии клинических проявлений может свидетельствовать о небактериальном характере инфекции. Не все острые инфекции дыхательных путей имеют бактериальную этиологию.
Часть инфекций (в педиатрической практике большая часть) вызывают вирусы, обнаружение которых при бактериологическом исследовании невозможно.
Универсальное микробиологическое исследование, позволяющее определить наличие и основные культуральные свойства (титр, количество), чувствительность к основным группам антибактериальных препаратов) большинства аэробных микроорганизмов, растущих на обычных питательных средах. Для исследования подходит практически любой вид биологического материала. Анализ используют для микробиологической диагностики неспецифических инфекционных заболеваний, выявления возбудителей хронических инфекций, определения наиболее подходящего препарата для антибактериальной терапии. Чувствительность к антибиотикам для нормальной микрофлоры не определяется.
Список нормальной микрофлоры:
Указанные выше микроорганизмы относятся к постоянной нормальной микрофлоре и не требуют лечения антимикробными препаратами, т.к. при их отсутствии могут возникнуть проблемы «дисбактериоза» в указанных органах (снижение местного иммунитета, рецидивы хронических заболеваний) . Лечение этих микроорганизмов антибиотиками сравнимо, с лечением антибиотиками лакто- и бифидобактерий в кишечнике. При обнаружении микробиологическим методом микроорганизмов, составляющих нормальную микрофлору, или условно-патогенных микроорганизмов в титре менее диагностического не определяется чувствительность к антибиотикам и бактериофагам, так как это количество не является значимым и не требует лечения противомикробными препаратами.
Стоимость исследования
К оплате принимаются наличные и карты.
Для того, чтобы узнать, как сдавать анализы, нажмите курсором на иконку в графе "Как сдавать" напротив необходимого анализа
Отдельно оплачиваются
Забор крови из вены 275-00
Взятия материала для исследования (нос, зев, глаза, ухо, ) 270-00
Взятие материала для исследования (урогинекологический) 415-00
Исследование микрофлоры кишечника.
Исследование микрофлоры урогенитального тракта. (В данных анализах определяется наличие или отсутствие патогенной аэробной и факультативно-анаэробной микрофлоры.)
| Исследование | Цена | Как сдавать |
|---|---|---|
|
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к основному спектру антимикробных препаратов и бактериофагам (мазок/отделяемое из влагалища, мазок/отделяемое из цервикального канала; мазок/отделяемое из уретры, аспират полости матки; эякулят;секрет предстательной железы) |
по 1170-00 | Как сдавать |
|
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к расширенному спектру антимикробных препаратов и бактериофагам (мазок/отделяемое из влагалища, мазок/отделяемое из цервикального канала; мазок/отделяемое из уретры, аспират полости матки; эякулят;секрет предстательной железы) |
по 1420-00 | Как сдавать |
|
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к основному спектру антимикробных препаратов и бактериофагам (моча) |
1090-00 | Как сдавать |
|
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к расширенному спектру антимикробных препаратов и бактериофагам (моча) |
1355-00 | Как сдавать |
Исследование микрофлоры ротоглотки. (В данных анализах определяется наличие или отсутствие патогенной аэробной и факультативно-анаэробной микрофлоры.)
| Исследование | Цена | Как сдавать |
|---|---|---|
|
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к основному спектру антимикробных препаратов и бактериофагам (мазок\отделяемое ротоглотки; мазок\отделяемое носоглотки; мазок/отделяемое носовых ходов;мазок/отделяемое из наружного уха; мазок/отделяемое конъюнктивы глаза; мокрота) Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к расширенному спектру антимикробных препаратов и бактериофагам (мазок\отделяемое ротоглотки; мазок\отделяемое носоглотки; мазок/отделяемое носовых ходов;мазок/отделяемое из наружного уха; мазок/отделяемое конъюнктивы глаза; мокрота) |
по 1200-00 по 1510-00 |
Как сдавать |
Другие микробиологические исследования. (В данных анализах определяется наличие или отсутствие патогенной аэробной и факультативно-анаэробной микрофлоры.)
| Исследование | Цена | Как сдавать |
|---|---|---|
|
Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к основному спектру антимикробных препаратов и бактериофагам (Грудное молоко(правая железа, левая железа)) Микробиологическое (культуральное) исследование на аэробную и факультативно-анаэробную флору с определением чувствительности к расширенному спектру антимикробных препаратов и бактериофагам (Грудное молоко(правая железа, левая железа)) Подробнее |
по 1045-00 по 1385-00 |
Как сдавать |
© Боргис - Медицина Родзинная 6/2004, стр. 278-281
Эльжбета Мазур, Себастьян Клаг
Механизмы устойчивости бактерий
Механизмы устойчивости к противомикробным препаратам
от кафедры и кафедры медицинской микробиологии Люблинского медицинского университета
Заведующий кафедрой: проф. доктор хаб. Мария Козиол-Монтевка 9000 3
Резюме
Резистентность к противомикробным препаратам, особенно приобретенная, является одним из побочных эффектов антибактериальной терапии, представляющим собой растущую терапевтическую проблему.
В статье описаны:
1. Пути приобретения бактериями генов, кодирующих резистентность
2. Основные механизмы проявления резистентности и их клинические последствия.
Следствием все возрастающего и избирательного давления антибиотиков и химиотерапевтических средств, злоупотребления ими и неправильного применения является быстрое распространение лекарственно-устойчивых бактерий, в том числе полирезистентных штаммов, среди которых описаны штаммы, нечувствительные ни к одному из имеющихся препаратов.Это явление представляет собой глобальную проблему, затрагивающую бактерии как в обществе, так и в больничной среде. Это делает практически невозможным эффективное лечение инфекций без знания эпидемиологических данных о текущем уровне лекарственной чувствительности штаммов в данной среде (8). В последнее время описано множество механизмов развития резистентности, и их распространение среди бактерий представляет особую опасность для будущей терапии инфекций (4).
Устойчивость микробов к антибиотику (химиотерапевтическому агенту) – это когда средние ингибирующие концентрации микробной популяции in vitro выше, чем концентрации, достижимые in vivo (6).
Самый простой тип сопротивления - естественное сопротивление. Данный микроорганизм нечувствителен к антибиотику, обладает «врожденной» резистентностью к некоторым группам антибиотиков, либо потому, что у него нет определенной точки-мишени, либо потому, что эти антибиотики не проникают внутрь него (6, 10). Например, Pseudomonas aeruginosa и Staphylococcus epidermidis (1) по своей природе устойчивы ко многим химиотерапевтическим агентам.
Приобретенная резистентность является противоположностью естественной резистентности, т. е. возникает у бактерий, изначально чувствительных к данному химиотерапевтическому агенту.Приобретенную резистентность можно разделить на первичную и вторичную.
Первичная резистентность вызывается спонтанной мутацией и может возникать без контакта с препаратом. Этот тип устойчивости закодирован хромосомами и не может передаваться другим видам бактерий. Частота появления мутантных бактерий невелика, однако в присутствии антибиотика мутанты имеют преимущество перед остальной популяцией, выживают и превосходят по численности восприимчивые популяции. Они могут распространяться на другие экологические ниши у одного и того же человека или передаваться другим людям (10).
Механизмы, приводящие к развитию вторичной резистентности , развиваются в условиях контакта микроорганизма с антимикробным препаратом и значительно сложнее. Генетический механизм, лежащий в основе вторичной резистентности, в отличие от первичной резистентности, является внехромосомным. Ответственными за это явление являются гены, расположенные в кольцевых фрагментах ДНК в цитоплазме и называемые плазмидами. Одна плазмида может содержать гены устойчивости к нескольким различным химиотерапевтическим агентам.Плазмиды могут переносить гены устойчивости из одной бактериальной клетки в другую. Плазмидная передача осуществляется в основном путем конъюгации и трансдукции.
Во время конъюгации передача плазмиды происходит путем прямого контакта двух или более бактериальных клеток с продуцируемыми ими белковыми цепями. В процессе конъюгации могут участвовать бактерии различных видов и родов, часто филогенетически очень далеких друг от друга. Передача устойчивости от сапрофитных бактерий к патогенным бактериям таким образом особенно невыгодна.
Трансдукция – это процесс переноса плазмид из клетки-донора в клетку-реципиент с помощью бактериальных вирусов (бактериофагов). Этот процесс видоспецифичен, его примером является перенос плазмид, определяющих продукцию b-лактамаз внутри стафилококковых штаммов (6, 10).
90 002 гена резистентности также можно найти на 90 014 транспозонах. Это так называемые Прыгающие гены, то есть небольшие последовательности ДНК, способные интегрироваться с генетическим материалом как хромосом, так и плазмид (10).Транспозоны играют особую роль в развитии и распространении резистентности в условиях стационара (2, 5, 6).В эволюции множественной лекарственной устойчивости у бактерий важное значение имеют также интегроны , поскольку они могут располагаться как в бактериальных хромосомах, так и в плазмидах. Это специфический самотранслокационный тип специализированных носителей генетической информации, особым свойством которого является способность объединять гены резистентности в сборки (кассеты) и блокировать их перенос в клетку-реципиент (8).
В результате приобретения генов устойчивости бактерии становятся частично или полностью устойчивыми к данному антибиотику благодаря развитию нескольких основных эффекторных механизмов (6, 10):
А. Инактивация антибиотика ферментами, вырабатываемыми бактериями,
B. снижение проникновения препарата через клеточную стенку и мембрану бактерий или активное выкачивание антибиотика изнутри бактериальной клетки (так называемое транспортное сопротивление),
C. изменение количества или конформации рецептора (или/и его окружения) для химиотерапевтического агента.
Следует подчеркнуть, что каждый из вышеописанных механизмов резистентности может возникать одновременно у одной бактерии и что у одной бактерии может одновременно возникать несколько различных механизмов резистентности к одному химиотерапевтическому агенту (10).
Объявление. А.
Инактивация антибиотиков ферментами касается в основном широкой группы препаратов, имеющих в своей структуре b-лактамную связь (пенициллины, цефалоспорины, карбапенамы, монобактамы). Они расщепляются ферментами, вырабатываемыми бактериями (β-лактамазами).Другим примером такого типа устойчивости является ферментативная модификация структуры аминогликозидов (3, 11).
b-лактамазы составляют очень разнообразную группу из более чем 340 ферментов, продуцируемых как грамположительными, так и грамотрицательными бактериями. Они различаются расположением генов (хромосомы, плазмиды, транспозоны, интегроны) и типом их экспрессии (конститутивная, индуктивная), субстратным спектром и чувствительностью к ингибиторам. У грамположительных бактерий они являются типичными экзоферментами, которые при попадании в окружающую среду также могут защищать клетки других бактерий от действия антибиотиков.Такого явления не бывает у грамотрицательных бактерий, накапливающих эти ферменты в периплазматическом пространстве (8).
Введение в терапию препаратов с ингибитором β-лактамаз в сочетании с β-лактамным антибиотиком решило проблему ферментативной резистентности лишь временно. Оказалось, что бактериальные штаммы могут инактивировать ингибитор или в результате мутации вырабатывать количество фермента, способное преодолеть созданный ингибитором барьер.
Широкое использование b-лактамных антибиотиков при лечении пациентов с ослабленным иммунитетом и в отделениях интенсивной терапии привело к быстрой селекции штаммов, полирезистентных к этим антибиотикам.Это явление связано с появлением новых b-лактамаз с расширенным субстратным профилем (ESbL). На их наличие указывает сниженная чувствительность тестируемого микроорганизма к цефалоспоринам третьего поколения, проявляющаяся на антибиотикограмме. Гены ESbL могут переноситься на конъюгационных плазмидах, их активная передача возможна внутри близкородственных видов семейства Enterobacteriaceae . Проблема наличия БЛРС (+) штаммов E. coli и Klebsiella описана во многих странах и постепенно становится серьезной эпидемиологической проблемой (1, 5).
Мы загрузили отрывок из статьи выше, к которой вы можете получить полный доступ.
У меня есть код доступа
19 90 015
зл. я выбираю 90 100полученный код необходимо ввести на странице статьи, на которую он был погашен
49 90 015
зл. я выбираю 90 100119 90 015
злотых я выбираю 90 100Ссылки
1. Дзержановска Д., Еляшевич Ю.: Госпитальные инфекции. Wydawnictwo a-medica-press 1999. 2. Dzierżanowska D.: Устойчивые к антибиотикам бактерии в больнице. Новая Медицина 1997; 16: 18-22. 3. Дзержановская Д.: Принципы применения антибиотиков при лечении бактериальных инфекций. Микробиол Мед 2003; 2 (35): 3-14. 4. Hryniewicz W.: Бактериальная резистентность. Инфомедика (онлайн) 1998; 5. 5. Hryniewicz W.: Проблемы антибиотикорезистентности наиболее распространенных внутрибольничных возбудителей.Новая медицина 1998; 2: 23-29. 6. Янец В., Крупиньска Ю.: Фармакодинамика. PZWL 2003. 7. Мальм А. и др.: b-лактамазы, эффективное оружие бактерий в борьбе с b-лактамными антибиотиками. Альмаматер 2004; 4 (45): 158-165. 8. Мальм А. и др.: Лекарственная устойчивость бактерий. Альмаматер 2002; 2 (43): 128-135. 9. Мальм А. и др.: Метициллин-резистентные штаммы золотистого стафилококка. Алмаматер 2003; 3 (44): 64-69. 10. Мазур Е.: Предположения рациональной антибиотикотерапии.Семейная медицина 2002; 2 (18): 89-93. 11. Meszaros J. и др. Септические осложнения, этиология и принципы химиотерапии. Микробиол Мед 2001; 2 (27): 3-8.
.90 000 Антибиотики в эпоху растущей лекарственной устойчивости - Здислав Маркевич, Дорота Корсак, Магдалена Поповска (книга)Единственная актуальная книга на польском рынке, в которой всесторонне обсуждается тема антибиотикорезистентности и лекарственной устойчивости, то есть глобальная проблема 21 века - как с точки зрения истории, так и классификации по действию, механизмов резистентности, способов противодействия ей. , а также исследования, направленные на замену антибиотиков.
Книга будет адресована в первую очередь биологам, медикам, натуралистам, а также по тематике загрязнения окружающей среды антибиотиками и продуктами их разложения для студентов факультетов охраны окружающей среды.
Покровители СМИ:
Партнеры:
Антибиотики_82-83.пдф (пдф)
75 КБ
Антибиотики_300-301.pdf (pdf)
74 КБ
Антибиотики_56.pdf (pdf)
52 КБ
Антибиотики_82-83.pdf (pdf)
75 КБ
Антибиотики_300-301.пдф (пдф)
74 КБ
Антибиотики_56.pdf (pdf)
52 КБ
Узнать больше Увидеть меньше .| Вопрос | Ответить | |||
|---|---|---|---|---|
| начать учиться | природные вещества (продуцируемые бактериями или грибами), полусинтетические вещества (производные природных антибиотиков после химической модификации) или синтетические вещества (не имеющие природного образца в природе) с антимикробной активностью путем уничтожения или ингибирования размножения микроорганизмов | |||
| начать учиться | искусственные противомикробные вещества, в настоящее время классифицируемые как антибиотики | |||
| Антибиотики, подавляющие синтез клеточной стенки, начинают обучаться | В-лактамы – связываются с ПСБ (пенициллин-связывающими белками – транспептидазами и карбоксипептидазами) и ингибируют синтез протеогликанов.К ним относятся пенициллины, цефалоспорины, монобактамы, карбапанемы, цефамицины и ингибиторы В-лактамаз для предотвращения резистентности (клавулановая кислота, сульбактам и тазобактам). | |||
| Механизм ферментативной резистентности к β-лактамам приступим к изучению | у некоторых бактерий рецепторные белки индуцируют B-лактамазы (ферменты, гидролизующие B-лактамы) | |||
| Механизм резистентности β-лактамных рецепторов начать изучение | изменение конфигурации активного центра PBP снижает его сродство к антибиотику и обеспечивает синтез пептидогликана также в его присутствии. | |||
| механизмы резистентности к β-лактамам – пенициллиназы начинают обучаться | устойчивость к природным пенициллинам - у стафилококков, стрептококков, энтерококков, Moraxella cattarhalis, Neisseria sp., Haemophilus sp., Грам- | |||
| Механизмы резистентности к бета-лактамам - цефалоспориназы AmpC начинают обучаться | расщепляет почти все β-лактамы, кроме КАРБАПАНОВ и ЦЕФАЛОСПОРИНОВ IV ПОКОЛЕНИЯ, присутствующих в грам- | |||
| Механизмы резистентности к бета-лактамам - БЛРС (β-лактамазы расширенного спектра) начинают обучаться | устойчивость к большинству пенициллинов и цефалоспоринов, а также к монобактаму у грамотрицательных палочек, особенно у энтеробактерий | |||
| Механизмы резистентности к β-лактамам - MBL начинают учиться | Металло-бета-лактамазы с широким спектром действия, не действуют на монобактам, присутствуют в грамм | |||
| Механизмы резистентности к β-лактамам - KPC начинают учиться | В-лактамазы с чрезвычайно расширенным спектром действия, расщепляют все В-лактамы и устойчивы к действию ингибиторов В-лактамаз, присутствующих в грамположительных | |||
| Механизмы резистентности β-лактамных рецепторов - начало обучения PRP | в результате изменения белков, ответственных за биосинтез клеточной стенки бактерий, Streptococcus pneumoniae становится устойчивым к пенициллину, а чаще всего и к другим β-лактамам | |||
| Механизмы резистентности B-лактамных рецепторов - BLNAR начинают обучение | Устойчивость к ампициллину у Haemophilus influenzae, связанная с модификацией PBP | |||
| Механизмы резистентности β-лактамных рецепторов - MRSA / MRCNS начинают обучение | Устойчивость к метициллину (т.е. и к другим β-лактамам) у Staphyloccocus aureus, связанная с наличием белка, позволяющего бактериям синтезировать клеточную стенку в присутствии β-лактамов | |||
| Антибиотики, подавляющие синтез белка, начинают учиться | Тетрациклины - блокируют 30s и предотвращают удлинение пептидной цепи Макролиды и линкозамиды - обратимо блокируют 50s, предотвращают удлинение цепи Аминогликозиды - ингибируют трансляцию, блокируя 30s, также действуют на клеточную мембрану.Хлорамфеникол - блокирует 50-е Оксалидиноны - предотвращает образование 70-х | |||
| Антибиотики, подавляющие синтез ДНК, начинают учиться | Хинолоны - ингибируют активность гиразы и топоизомеразы IV. | |||
| Антибиотики, подавляющие синтез РНК, начинают обучаться | Рифампицин - ингибирует РНК-полимеразу | |||
| Мембраноразрушающие антибиотики начинают учиться | Полипептиды (полимиксин А-Е) - вызывают потерю герметичности мембран, используются только В и Е, т.к. остальные высокотоксичны, действуют на Грам- | |||
| Антибиотики, подавляющие синтез нуклеотидов, начинают обучаться | Сульфаниламиды - препятствуют синтезу фолиевой кислоты - ингибируют синтез пуринов Триметорпим - ингибитор дигидрофолатредуктазы | |||
| Действие антибиотиков - бактериостатическое начало обучения | тетрациклины, макролиды, кетолиды, сульфаниламиды, оксазолидиноны | |||
| Действие антибиотиков - бактерицидное начало обучения | аминогликозиды b-лактамы хлорамфеникол хинолоны гликопептиды (ингибируют синтез стенок) линкозамиды | |||
| начать учиться | Состояние, при котором антибиотик не оказывает противомикробного действия.Он может быть естественным, генетически детерминированным еще до введения антибиотиков и приобретенным у ранее чувствительных бактерий в результате спонтанных (или индуцированных) мутаций или переноса гена из другой клетки. | |||
| начать учиться | развитие резистентности к одному антибиотику влечет резистентность к другим из этой группы | |||
| Способы передачи сопротивления начать обучение | Вертикальный - от материнской клетки к дочерней Горизонтальный - переход от одной клетки к другой путем конъюгации (обмен веществом между клетками)и М. одного и того же вида), трансдукция (перенос материала между одними и теми же видами с помощью бактериофагов) или трансформация (прямой сбор материала из окружающей среды) | |||
| Методы тестирования восприимчивости начинают учиться | диско-диффузионный (качественный) – основан на диффузии антибиотика, содержащегося в диске, в субстрат. Размер зоны угнетения прямо пропорционален степени чувствительности бактерий к данному антибиотику (чувствительные, умеренно чувствительные, устойчивые) серийных разведений (количественные) - позволяет определить минимальную концентрацию антибиотика, подавляющую рост бактерий (МИК ) е-тест – сочетает в себе диффузию антибиотика в агар и определение МПК | |||
| начать учиться | Терапия основана на предположении о наиболее подходящем этиологическом агенте и его предполагаемой чувствительности к антибиотику. | |||
| начать учиться | Терапия, при которой подбор антибиотика осуществляется после составления антибиотикограммы на изолированный этиологический фактор. | |||
| Терапия первой линии – начните учиться | заключается в использовании антибиотика с доказанной безопасностью и эффективностью | |||
| начать учиться | «S» - чувствителен к стандартным дозам препарата «I» - умеренно чувствителен, МПК между чувствительным и резистентным «R» - резистентный | |||
| начать учиться | МБК - самая низкая бактерицидная концентрация МИК - самая низкая ингибирующая концентрация | |||
| начать учиться | угнетение роста бактерий, несмотря на снижение концентрации антибиотика ниже МИК, относится к аминогликозидам, макролидам, фторхинолонам, карбапенемам | |||
| начать учиться | Метод интерпретации МИК: разделите пограничную точку антибиотика для восприимчивого штамма на МИК тестируемого штамма.Чем выше MBQ, тем больше шансов на терапевтический успех. | |||
| начать учиться | Все они имеют в молекуле b-лактамное кольцо, отличаются малой токсичностью: цефалоспорины (1-е поколение - цефадроксил, цефалексин, цефазолин, 2-е поколение - цефаклор, цефуроксим, цефуроксим аксетил, 3-е поколение - цефиксим, цефотаксим, цефподоксим, Цефтазидепим 4-го поколения, Цефамицин - Цефокситин), Пенициллины (Аминопенициллины, Карбоксипенициллины, Натуральные, Уреидопенициллины и др.) монобактамы (азтреомам) карбапенемы (дорипенем, эртапенем, имипенем) ингибиторы b-лактамаз | |||
| Группы препаратов - гликопептиды начинают обучение | Ингибируют синтез пептидогликана, препятствуя его полимеризации, действуют только на Грам + ванкомицин, тейкопланин, телаванцин | |||
| Группа препаратов - аминогликозиды начинают изучать | Потенциально токсичен, активен только в отношении аэробных грамположительных, грамотрицательных кокков и микобактерий туберкулеза: амикацин гентамицин стрептомицин неомицин тобрамицин | |||
| Группа препаратов - тетрациклин и глицилциклин Начать изучение | Широкий спектр активности (грам+, грамм-, спирохеты, атипичные бактерии) доксициклин тетрациклин | |||
| начать учиться | Характерным признаком является быстрое и легкое нарастание резистентности, при большинстве инфекций являются препаратами второго ряда, обратимо блокируют 50-е, в основном действуют на Грам+, велико их действие на внутриклеточные бактерии (микоплазмы, хламидии, легионеллы). значение, эритромицин, спирамицин, азитромицин, телтромицин | |||
| Группа препаратов - стрептограмины начинают обучение | пристамицин Ia и Ib хинупристин дальфопристин | |||
| Группа препаратов - оксазолидиноны начинают изучать | Работает на Грамм + линезолид | |||
| начать учиться | действуют только на аэробные бактерии (стафилококки, стрептококки, энтерококки, гемофильные палочки, нейссерии) 1 поколение - налидиксовая кислота 2 поколение - ципрофлоксацин левофлоксацин 3 поколение - гатифлоксацин 4 поколение - моксифлоксацин | |||
| Группа препаратов - сульфаниламидные препараты Начать обучение | ||||
| Группа препаратов - нитроимидазол начать изучение | ||||
| Группа препаратов - нитрофураны начинают изучать | ||||
| Резистентность к β-лактамам у Enterobacteriaceae начинает учиться | оба типа карбапенемаз MBL и KPC должны быть обнаружены одновременно | |||
| Побочные эффекты β-лактамов начинают изучаться | Гиперчувствительность: немедленная (0-1ч) - шок, артериальная гипотензия, отек голосовой щели, бронхоспазм ускоренный (1-72ч) - отек голосовой щели, крапивница, бронхоспазм Поздняя (>72ч) - сыпь, интерстициальная НС, анемия, нейтропения, лекарственная лихорадка и др. . | |||
| начать учиться | Приобретенные в основном связаны с ингибированием транспорта в клетку и модификацией гиразы | |||
| Побочные эффекты хинолонов с чего начать изучение | диарея, тошнота, фотосенсибилизация, головная боль и головокружение, нарушение функции печени | |||
| Механизмы резистентности к аминогликозидам начинают изучаться | продукция аминоглокозидаз, модифицирующих молекулы этих препаратов, изменения рецепторов, снижение или инактивация активного транспорта | |||
| начать учиться | Штаммы энтерококков, устойчивые к высоким концентрациям аминогликозидов.(энтерококки естественным образом устойчивы к низким концентрациям) | |||
| побочные эффекты аминогликозидов начинают изучаться | ототоксичность нефротоксичность | |||
| начать учиться | Устойчивость к макролидам, линкозамидам, стрептограминам В у грам+кокков | |||
| Гликопептидная резистентность начать обучение | VRE - ванкомицинрезистентные энтерококки VISA - ванкомицинрезистентный aureus VRSA - ванкомицинрезистентный aureus GISA/GRSA - среднечувствительные и гликопептидрезистентные штаммы | |||
| Побочные эффекты гликопептидов с чего начать изучение | аллергические реакции, синдром красной шеи, лихорадка, ототоксичность, нефротоксичность | |||
| Побочные эффекты тетрациклинов начинают изучать | пищевой дискомфорт, эзофагит/изъязвление, поражение печени, фотосенсибилизация | |||
Скачать Методы обнаружения и идентификации бактерий...
Методы обнаружения и идентификации бактерий Dorota Żabicka Кафедра эпидемиологии и клинической микробиологии Национальный медицинский институт ВаршаваСтруктура бактериальной клетки
Микробиологический тест
Цель: выявление этиологического фактора инфекции и определение чувствительности к антибиотикам
Курс микробиологических исследований 0002
Сбор материала Исследование материала:
Классические методы Микроскопическое исследование Культура и идентификация микроорганизма Определение чувствительности бактерий к антибиотикам Сбор и перенос
Микроскопическое исследование Световой микроскоп Окрашенные препараты Метод Грама специальные методы, например,окраска на наличие спор
Clostridium tetani tetanus, споры на конце бактериальной клетки имеют форму палочки шлака
Бактериальная клеточная стенка Грамположительные бактерии
Грамотрицательные бактерии
Микроскопическое исследование
3 Neisseria
Микроскопическое исследование
Препарат с темным полем зрения (Treponema pallidum) Флуоресцентный микроскоп
Микроскопическое исследование Контрастное микроскоп фазовый
Candida
электронныйБактериальные культуры
Прикладные жидкие и твердые бактериологические среды
Культивирование проводят в условиях, наиболее подходящих для искомых микроорганизмов
Growth requirements of bacteria
Oxygen demand
Carbon source
0003
0003 O2 Анаэробные - менее 1-0,5% O2 Микроаэрофильные - смесь 5% O2, 10% CO2, 85% N2 Автотрофные - CO2 Гетеротрофные - аминокислоты, пептиды, сахара, липиды
Другие соединения, необходимые для роста
Неорганические соли витаминов
Физико -химические факторы
Температура
PH
Психофилы - Оптимальные 0-10 ° С - оптимальные 20-40 -м. C Большинство бактерий предпочитают нейтральный pH ~ 7.0
Осмотическое давление
Наиболее предпочтительные aw ~ 0,99
Рост культуры бактерий в жидкой среде
Посев и идентификация микроорганизмов Агаризованная среда обогащенная кровью - видимая зона гемолиза вокруг колонии
Выращивание микроорганизмов селективно
,БЛРС
VRE
Культура и идентификация микроорганизмов Идентификация микроорганизмов с помощью тестов, проведенных на
бациллах Культивирование и идентификация микроорганизмов Идентификация микроорганизмов3 с использованиемнаборы пробирок
готовые идентификационные тесты
Автоматические системы Автоматические системы используются для культивирования микроорганизмов (например,Bactec для посева крови) или для идентификации и определения антимикробной чувствительности ранее культивируемых микроорганизмов
VITEK 2 Compact BioMerieux
Phoenix BD Diagnostic Systems
VITEK 2 Compact System Автоматическая система для идентификации и определения антимикробной чувствительности ранее культивированных микроорганизмов
Определение чувствительности к антибиотикам
Определение методом разведения Готовые диагностические тесты для ручного считывания Определение с помощью автоматизированных систем
Определение чувствительности к антибиотикам и механизмов резистентности
) устойчивые ко всем -лактамным антибиотикам (MRSA)Иммунологические методы
Латекс, ИФА, гены бактерий (поверхностные белки, капсульные полисахариды, токсины) Позволяют обнаружить бактерии в материале, взятом от больного, или помогают в идентификации культивируемых бактерий Используются готовые ручные или автоматические тесты Латексная агглютинация
Иммунологические методы – ИФА
Иммунологические методы – автоматические системы
Система VIDAS
Новые методы, основанные на иммунологических методах
Спектрометрия MALDI-TOF
Спектрометрия MALDI-TOF
Спектрометрия MALDI-TOF
Молекулярные реакции, основанные на реальных коммерческих методах ПЦР - доступны ПЦР-тесты во времени в двух вариантах Набор реагентов для обнаружения бактерий, реакции в любом аппарате ПЦР или ПЦР в реальном времениM.tuberculosis и выявление эпидемиологически важных бактерий, например, MRSA или обнаружение бактериальных токсинов )
Метод ПЦР
ДНК
RULER 100 6018/99 6758/99 ATCC43300 ATCC 29213 RULER100
Метод ПЦР
MECA AGRES. время ПЦР-тесты
напр.GeneXpert
Scorpion Probes
Two types of Scorpion probes used in the GeneXpert series
Figures: Cepheid source
Integrated internal control in the reaction mixture
Mg
2+
target scorpion
target scorpion
scorpion
dCTP
dGTP dUTP
Internal Control (IC)
dATP
drawings source Cepheid
Microarrays
Bacteriophages - bacterial viruses
Bacteriophages
Bacteriophages
Bacteriophages
bacteriophages 9000
Typing bacteria to determine the relationship of изолированные штаммы
налет
Бактериофаги – применение для обнаружения и идентификации бактерий
Бактериофаги – применение для обнаружения и идентификации бактерий
Бактериофаги – применение для обнаружения и идентификации бактериотерапия
Спасибо за внимание
.1 МЕТОДЫ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ др н.мед. Дорота Жабицка Кафедра эпидемиологии и клинической микробиологии, Нар ...
МЕТОДЫ ОБНАРУЖЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ др н.мед. Дорота Жабицка Кафедра эпидемиологии и клинической микробиологии Национального медицинского института, ВаршаваМикробиология, то есть изучение микроорганизмов (вирусов, бактерий, простейших, дрожжеподобных и плесневых грибов), представляет собой обширную и динамично развивающуюся область знаний.Микроорганизмы присутствуют во всех средах, колонизируя как почву и воду, так и живые организмы. Понимание физиологии и генетики микроорганизмов и их взаимодействия с окружающей средой чрезвычайно важно как для профилактики инфекций человека и животных, так и для охраны окружающей среды и развития многих отраслей промышленности. Бактерии составляют самую многочисленную группу среди микроорганизмов по числу видов. Они одноклеточные прокариоты, то есть не имеют клеточного ядра.Вместо клеточного ядра у них есть встроенная в цитоплазму бактериальная хромосома (нуклеоид), построенная из одной кольцевой, запутанной, связанной с белком молекулы ДНК. Наружными оболочками бактериальной клетки являются: белково-липидная клеточная оболочка и клеточная стенка, придающая клетке форму, характерную для того или иного вида бактерий (шаровидную, цилиндрическую или спиралевидную). Некоторые виды бактерий также имеют полисахаридные оболочки для защиты от воздействия внешней среды (например,иммунной системы человека и животных), пилы, позволяющие им прикрепляться к колонизированным поверхностям, и жгутики, обеспечивающие движение бактерий. Определение наличия микроорганизмов и их идентификация в исследуемом материале, взятом от инфицированного человека или животного, или в образце, взятом из окружающей среды, является целью микробиологического исследования. Ход микробиологического исследования можно разделить на следующие этапы: сбор материала и транспортировка его в микробиологическую лабораторию; тестирование материалов с применением различных методов исследования.Сбор материала осуществляется с соблюдением принципов асептики, т. е. способом, исключающим контаминацию образца микроорганизмами из окружающей среды. Собранный материал транспортируют в стерильных контейнерах или в транспортных средах и буферах, соответствующих типу материала и используемым методам исследования. Методы, обычно используемые в микробиологических лабораториях, можно разделить на классические методы и молекулярные методы. К классическим методам относятся: микроскопическое исследование; культивирование и идентификация микроорганизмов на основе биохимических признаков; определение чувствительности культивируемых бактерий к антибиотикам; иммунологические методы.
1
Молекулярные методы используют различные методы для обнаружения характерных последовательностей ДНК или РНК микроорганизма. В настоящее время для обнаружения и идентификации бактерий все чаще используются новые методы, такие как MALDI-TOF-спектрометрия или методы с использованием бактериофагов. Все эти методы будут рассмотрены далее в этом исследовании.
МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ Микроскопическое исследование позволяет определить наличие бактерий в исследуемом материале и наблюдать за морфологией бактериальных клеток.В большинстве случаев этот тест является лишь первым шагом в идентификации микроорганизма, определяющим дальнейшие этапы микробиологического тестирования. В медицине в ряде случаев достаточно подготовки и исследования микроскопического препарата для выявления микроорганизма, вызвавшего инфекцию. Бывает, когда в материале, взятом у больного со специфическими клиническими симптомами, обнаруживаются микроорганизмы характерной, типичной формы. Примерами этого типа инфекции являются инфекции, передающиеся половым путем (сифилис, гонорея) или менингит, вызванный грибком Cryptococcus neoformans.В микробиологической лаборатории для микроскопических исследований обычно используют световой микроскоп с иммерсионным объективом с большими увеличениями (обычно 100х) и высокой разрешающей способностью (апертура 1,4-1,6). Чаще всего используются препараты, окрашенные различными
методами окрашивания.
Препараты
приготовленные
на
предметные стекла
микроскопические непосредственно из материала, взятого у больного, суспендированного в капле физиологического раствора (0,9% раствор NaCl) или в виде мазка взвеси культивируемых бактериальных клеток в капля солевого раствора.Затем предметные стекла высушивают на воздухе и фиксируют, нагревая препарат над пламенем. Наиболее распространенным методом окрашивания является метод Грама, который разделяет бактерии на две группы: грамположительные бактерии, окрашивающиеся в фиолетовый цвет, и грамотрицательные бактерии, окрашивающиеся в розовый цвет. Различия в окраске являются результатом различия в строении клеточной стенки обеих групп бактерий. Грамположительные бактерии имеют клеточную стенку, состоящую из толстого слоя пептидоглюкана (сложного полимера N-ацетилглюкозамина и N-ацетилураминовой кислоты, а также пептидных мостиков и боковых цепей) и частиц липотейхоевой кислоты (LTA), проникающих через пептидогликан.Клеточная стенка грамотрицательных бактерий имеет более сложное строение. Он состоит из тонкого слоя пептидогликана и внешней мембраны, соединенных мостиками из липопротеинов. Петидогликан и наружная мембрана разделены так называемой периплазматическое пространство. Наружная мембрана со структурой типичной белково-липидной мембраны во внешнем липидном слое содержит липополисахарид (ЛПС) с составом, характерным для отдельных видов грамотрицательных бактерий. Проникновение веществ через наружную мембрану возможно благодаря наличию белковых пориновых каналов.
2
Наряду с методом Грама наиболее распространенными методами окрашивания являются также специальные методы с использованием различных красителей, благодаря которым определяются специфические внутренние структуры бактериальной клетки (например, окрашивание на наличие спор) и отрицательное окрашивание, где чернила окрашивают поверхность предметного стекла для визуализации бактериальных оболочек (приготовление чернил). Флуоресцентная микроскопия — это метод, в основном используемый для обнаружения присутствия микроорганизмов непосредственно в материале, взятом у пациента.Приготовление предметных стекол, просматриваемых в люминесцентном микроскопе, заключается в нанесении на фиксированный препарат раствора антител, меченных флуоресцентным красителем, направленным против искомого микроорганизма, а затем тщательном отмывании антител, не связавшихся с микроорганизмами. При освещении препарата УФ-светом флуоресцентный краситель начинает светиться, а клетки характерной для данного вида формы видны только при соединении антител с организмом-мишенью.Влажные препараты используются значительно реже, чем окрашенные препараты, где приготовленный мазок накрывают покровным стеклом.Приготовленный таким образом препарат можно рассматривать под фазово-контрастным микроскопом, позволяющим наблюдать как форму, так и детали строения бактериальной клетки, или в микроскоп с темным полем зрения, где мелкие и спиральные лучше видны микроорганизмы в форме бледной формы (например, бледные спирохеты — бледная трепонема, бактерия, вызывающая сифилис). Просмотр препаратов в электронном микроскопе позволяет визуализировать детали строения микробных клеток: размер, форму, наличие и размеры пупырышек или жгутиков, а также внутриклеточных органелл, а также наблюдать за последующими фазами деления бактериальной клетки. .
КУЛЬТИВИРОВАНИЕ
И
ИДЕНТИФИКАЦИЯ
МИКРООРГАНИЗМ
НА
ОСНОВА
ОСОБЕННОСТИ
ОСОБЕННОСТИ
БИОХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ для выращивания микроорганизмов в желаемых условиях. Бактерии могут расти в самых разных условиях температуры, pH, влажности, осмотического давления и содержания кислорода. Рост бактерий наблюдался в интервале температур от 0°С (психрофилы) до 60°С (термофилы), при этом большинство видов достигали оптимальной температуры роста в диапазоне 20-40°С.Для большинства видов оптимальный рН нейтральный, в пределах 6,5-7,5, а осмотическое давление aw ~ 0,99. В зависимости от потребности в кислороде бактерии можно разделить на: аэробные бактерии, т. е. хорошо растут при наличии кислорода в таком количестве, как в атмосферном воздухе; анаэробные бактерии хорошо растут в присутствии 0,5-1% кислорода; микроаэрофильные бактерии, требующие для роста 5% кислорода и 10% углекислого газа. 3
Многие патогенные бактерии, такие как кишечная палочка или золотистый стафилококк, хорошо растут как в аэробных условиях, так и при пониженном содержании кислорода вплоть до анаэробных.В зависимости от вида микроорганизмов культивирование проводят: в организме восприимчивых к инфекции животных: например, спирохеты Treponema pallidum, размножающиеся в организме кроликов; использование культур клеток животных или человека: например, вирусов, некоторых внутриклеточно размножающихся бактерий, например Chlamydophila pneumoniae; на бактериальные клетки: бактериофаги; на жидких или твердых средах: большинство патогенных бактерий, экологические бактерии. Для роста бактериям требуется наличие источника углерода в виде CO2 для автотрофных видов или органических соединений в среде (сахара, аминокислоты, пептиды, липиды) для гетеротрофных видов, таких как патогенные бактерии.Все виды бактерий также требуют присутствия в среде неорганических солей и часто некоторых витаминов. Бактерии размножаются делением материнской клетки на две дочерние. Время культивирования для получения видимого роста бактерий зависит от скорости их размножения и может составлять от нескольких часов, как в случае большинства видов патогенных бактерий, до нескольких дней, как в случае Mycobacterium tuberculosos. Изменение количества бактериальных клеток в заданном объеме жидкой культуры можно представить в виде кривой, на которой после короткой фазы адаптации клеточного метаболизма к новым условиям (лаг-фазы) происходит логарифмический рост числа бактериальных клеток.С течением времени и истощением питательных веществ наступает стационарная фаза, когда наблюдается равновесие числа отмирающих клеток и новых, образующихся в результате клеточного деления, сменяется фазой отмирания культуры и снижения количество бактериальных клеток. На твердых средах бактерии растут в виде колоний, возникающих в результате деления одной исходной бактериальной клетки. В микробиологической диагностике инфекций, вызванных патогенными бактериями, используют несколько различных групп плотных бактериологических сред.Наиболее широко используются богатые питательные среды, обогащенные кровью, обеспечивающие оптимальные условия для роста подавляющего большинства видов бактерий. Некоторые виды бактерий продуцируют гемолизины, лизирующие эритроциты, что видно в виде яркой зоны вокруг бактериальных колоний. В дополнение к средам, обогащенным кровью, также используются богатые специальные среды, такие как агар Мюллера-Хинтона для оценки чувствительности к лекарственным средствам или шоколадные среды, обогащенные ингредиентами, которые способствуют росту определенных видов бактерий, например.Менингит Neisseria meningitidis. Также используются следующие среды:
4
селективные, содержащие ингредиенты, подавляющие рост определенных групп бактерий, например, агар МакКонки, подавляющий рост грамположительных кокков, или среды, содержащие антибиотики, подавляющие рост чувствительных бактерий к данному препарату; хромогенные среды, содержащие компоненты, которые при метаболизме бактериями придают характерную окраску бактериальным колониям определенных видов, напр.Среда CPS для культивирования бактерий, вызывающих воспаление мочевыводящих путей, позволяющая предварительно идентифицировать виды, вызывающие инфекцию, по цвету. Хромогенные среды с добавлением антибиотиков применяют также для скрининговых тестов с целью выявления у пациентов колоний в респираторном или желудочно-кишечном тракте антибиотикорезистентными бактериями, что является серьезной эпидемиологической проблемой в стационарах. Такие среды используются для обнаружения MRSA (метициллин-резистентных штаммов Staphylococcus aureus, то есть устойчивости ко всем антибиотикам
-
лактамов), выявления VRE (ванкомицин-резистентных штаммов энтерококков) и выявления GramBL-отрицательных штаммов (ES). ферменты, способные гидролизовать многие антибиотики - лактамы) или продуцирующие карбапенемазы (КПК, НДМ-1), расщепляющие карбапенемы.Первичная идентификация бактерий, растущих на плотных средах, основывается на оценке размера, формы и цвета колоний, а на кровяных средах также на наличии гемолиза. Выбор тестов для идентификации производится после оценки морфологии бактериальных клеток в препарате, окрашенном по Граму, и проведения простых тестов, например на способность продуцировать фермент каталазу, разлагающую перекись водорода. Точная идентификация вида осуществляется с использованием ряда твердых или жидких сред в пробирках, позволяющих обнаружить продукцию специфических ферментов (например,уреаза, разлагающая мочевину), или способность расти в присутствии одного сахара (например, среда с лактозой для проверки способности расщеплять лактозу). В настоящее время для идентификации и оценки лекарственной чувствительности микроорганизмов также возможно использование готовых наборов для визуального считывания или считывания в автоматических системах различных производителей (например, Phoenix BD Diagnostic Systems, VITEK 2 Compact BioMerieux). ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИЙ К АНТИБИОТИКАМ.эмпирическая терапия, т.е. терапия, подобранная в соответствии с анализом чувствительности к предлагаемому препарату всех видов бактерий, которые могут вызывать данный вид инфекции, и оценкой клинической эффективности лечения предлагаемым антибиотиком. Оценка лекарственной чувствительности бактерий, выращенных из материала, взятого от больного, позволяет ввести так называемую таргетная терапия, соответствующая профилю лекарственной чувствительности выращенного штамма. В лабораториях для определения чувствительности к противомикробным препаратам применяют следующие методы:
5
метод разведения, при котором в жидкую или твердую среду с антибиотиком в определенной концентрации добавляют одинаковое количество бактериальных клеток и оценивают рост в присутствии антибиотика; диффузионный метод, при котором антибиотик диффундирует с диска, пропитанного определенным количеством препарата, или с полоски, пропитанной градиентом антибиотика, в твердый субстрат, равномерно засеянный на поверхность взвесью бактерий с нормированным числом бактериальных клеток ; чтение осуществляется либо путем измерения диаметра зоны ингибирования вокруг диска, либо путем определения концентрации антибиотика, при которой появляется зона ингибирования вокруг полоски.Считываемое значение концентрации антибиотика, подавляющего рост испытуемых микроорганизмов, или диаметры зоны задержки роста вокруг диска сравнивают с пороговыми значениями для чувствительных и резистентных штаммов, а затем интерпретируют « чувствительный» или «резистентный» заносят в результат определения лекарственной чувствительности тестируемого штамма бактерий. В Польше уже много лет используются предельные значения в соответствии с рекомендациями американского CLSI (Институт клинических и лабораторных стандартов). С 2011 года рекомендации Европейского комитета поТестирование чувствительности EUCAST (Европейский комитет по тестированию чувствительности к противомикробным препаратам). Информация о рекомендациях по выбору тестов для определения чувствительности к противомикробным препаратам доступна на сайте Национального центра определения чувствительности к противомикробным препаратам www.korld.edu.pl, а информация об антибиотиках и лечении – на сайте Национальной программы защиты от антибиотиков www. .antybiotyki.pl и сайт национального консультанта в области медицинской микробиологии www.mikrobiologia.пл.
ИММУНОЛОГИЧЕСКИЕ МЕТОДЫ Иммунологические методы используют реакцию бактериальных антигенов с антителами против этих антигенов. Реакция происходит между антителами и целыми бактериальными клетками или поверхностными антигенами (капсульные сахара, поверхностные белки) или с токсинами, секретируемыми внеклеточно бактериями. Различные типы меток антител используются, чтобы помочь визуализировать возникновение иммунной реакции. В методе флуоресцентной микроскопии (описанном ранее в разделе «Методы микроскопии») маркером является флуоресцентный краситель.При методе латексной агглютинации на частицы латекса наносятся антитела, а соединение антител с бактериальными антигенами видно в виде комочков. Определение методом латекс-агглютинации чаще всего проводят на предметных стеклах, пластинках из темного стекла или специальных карточках с покрытием, прилагаемых к набору. В методах иммуноферментного анализа, часто называемых ИФА, антитела (если мы ищем бактериальные антигены в материале) или антигены (если мы ищем антитела в жидкостях организма пациента) метят ферментом и комбинацией антигена и антитела видны в виде цветной реакции, которая является результатом фермента, связанного с комплексом антиген-антитело на субстрате 6,
,, добавленном в реакционный раствор.Иммуноферментные анализы часто проводят в 96-луночных титрационных микропланшетах, а результат считывают визуально или с помощью спектрофотометрических ридеров. В диагностических лабораториях обычно используют автоматические системы различных производителей (VIDAS BioMerieux, Architect Abbott Laboratories, различные приборы Siemens), в которых определения проводят с помощью разнообразных иммунологических методов. Также постоянно появляются новые автоматические диагностические системы, отличающиеся только методом выявления иммунной реакции.
MATDI-TOF СПЕКТРОМЕТРИЯ В последние несколько лет масс-спектрометрия типа MALD-TOF становится методом, все более и более широко используемым в микробиологической диагностике. Метод основан на анализе белков, присутствующих в большом количестве, таких как рибосомные белки, и позволяет как идентифицировать микроорганизмы (бактерии, дрожжеподобные грибы, мицелиальные грибы), так и анализировать родство внутри изолятов одного вида. В микробиологических лабораториях наиболее часто используется система MALDI BioTyper от Bruker, которая позволяет надежно идентифицировать культивируемые микроорганизмы в течение нескольких минут для одного образца и прибл.1,5 часа для планшета на 96 образцов. Для идентификации достаточно материала, содержащего 105 бактериальных клеток (отдельная колония или образец жидкой культуры). Появились также первые сообщения о возможности выявления микробов непосредственно в образцах мочи, взятых у больного, или в образцах посевов крови. Недостатком метода является его высокая стоимость и невозможность определения чувствительности к антибиотикам культивируемых микроорганизмов. Более подробную информацию об этом методе можно найти на сайте www.bruker.pl
МОЛЕКУЛЯРНЫЕ МЕТОДЫ В микробиологической диагностике в основном используются методы, позволяющие дублировать гены без их клонирования, т.е. основанные на методе полимеразной цепной реакции, сокращенно ПЦР: Метод ПЦР был разработан в 1980-х годах, но был широко применялся в России во второй половине 90-х годов и заключается в многократном дублировании любой последовательности ДНК с использованием праймеров, т. е. коротких, длиной около 20 нуклеотидов, частиц ДНК, последовательность которых комплементарна конечным последовательностям синтезируемого фрагмента ДНК.Для обеспечения правильного протекания реакции в реакционной смеси помимо матрицы содержится избыток нуклеотидтрифосфатов и избыток реакционных праймеров, т.е. амплифицированная ДНК, выделенная из исследуемого образца (микробная культура, пациент). Реакция ПЦР состоит из следующих многократно повторяющихся (30-40 циклов) стадий: термическая денатурация тестируемой ДНК при температуре около 90°С; прикрепление грунтовок к шаблону при температуре, сниженной до 40-60°С; 7
полимераза, т.е. синтез новых цепей ДНК при 72 С с использованием специальной термостабильной полимеразы.Каждая реакция ПЦР проводится параллельно для тестируемых образцов и положительного и отрицательного контроля. Затем образец реакционной смеси подвергают электрофорезу для визуализации присутствия частиц ДНК определенного размера, соответствующего размеру фрагмента ДНК между праймерами. Разновидность метода ПЦР, т. е. ПЦР в реальном времени, проводимая в специальных приборах и с использованием правильно приготовленных праймеров, также называемых зондами, позволяет считывать результат ПЦР-реакции в ее ходе путем измерения флуоресценции пробы, которая пропорциональна количеству полученного продукта.Оба варианта метода, т.е. как классическая ПЦР, так и ПЦР в реальном времени, в настоящее время используются для определения наличия микроорганизмов (бактерий, вирусов, грибов) в исследуемом образце (кровь, спинномозговая жидкость), а также для выявления генов, кодирующих бактериальные токсины или гены, кодирующие бактериальные токсины, важные механизмы устойчивости к антибиотикам у культивируемых бактерий. На рынке доступны наборы реагентов от разных производителей, позволяющие проводить классические реакции ПЦР или в устройствах ПЦР в реальном времени после выделения ДНК из тестируемого образца.Однако выполнение этих определений требует соответствующего лабораторного оборудования и компетентного, обученного персонала. В последнее время также появились закрытые, простые в использовании и интерпретирующие реакционные наборы для анализа в устройствах ПЦР в реальном времени (например, GeneXpert от Cepheid), позволяющие обнаруживать значимые микроорганизмы в материале, взятом у пациента непосредственно персоналом в период с 1 по 2 ч. Неотложная помощь. Похоже, что ДНК-микрочипы также будут использоваться для обнаружения клинически значимых видов и штаммов бактерий в будущем.Микрочип представляет собой стеклянную или пластиковую пластину с регулярно расположенными фрагментами ДНК, представляющими собой зонды, которые в результате гибридизации обнаруживают комплементарные молекулы ДНК или РНК. Однако в настоящее время микрочипы в основном используются для изучения экспрессии генов. ИСПОЛЬЗОВАНИЕ БАКТЕРИОФАГОВ ДЛЯ ОБНАРУЖЕНИЯ БАКТЕРИЙ Бактериофаги — бактериальные вирусы, состоящие из нуклеиновых кислот (ДНК или, реже, РНК) и белков. Наиболее распространенные бактериофаги характеризуются сложным строением, в котором различают головку, содержащую двухцепочечную ДНК, и хвост, оканчивающийся различными структурами белковых рецепторов, которые позволяют бактериофагу прикрепляться к рецепторам на поверхности бактериальной клетки.Как правило, бактериофаги обладают высокой видоспецифичностью, а некоторые обладают способностью прикрепляться только к определенным штаммам бактерий. Типичный литический жизненный цикл бактериофагов состоит из следующих стадий: 1. прикрепление бактериофага к рецепторам на поверхности бактериальной клетки; 2. введение ДНК внутрь бактериальной клетки, белковый капсид остается снаружи;
8
3. репликация ДНК бактериофага и продукция капсидного белка, образование новых частиц бактериофага; 4.высвобождение потомства бактериофагов после лизиса бактериальной клетки. Некоторые из так называемых бактериофагов Доброкачественные бактериофаги могут переходить в состояние лизогении, которое представляет собой включение ДНК бактериофага в бактериальную хромосому, чаще всего в строго определенном месте, и размножение встроенного профага вместе с бактериальной хромосомой. Под влиянием различных раздражителей профаги могут освобождаться от бактериальной хромосомы и вступать в литический цикл. Доброкачественные бактериофаги в своей ДНК, помимо информации о структуре вирусных белков, могут также содержать гены, кодирующие бактериальные факторы вирулентности, такие как бактериальные токсины (например,холерный токсин — Vibrio cholerae, вызывающий водянистую диарею при холере). Бактериофаги использовались уже в 1950-х годах для селекции различных видов бактерий (например, Staphylococcus aureus, Pseudomonas aeruginosa) и в эпидемиологических исследованиях. Для типирования используют метод нанесения раствора, содержащего заданное количество частиц бактериофага, на полужидкую агаризованную среду, содержащую клетки тестируемого штамма бактерий.Лизис бактериальных клеток бактериофагами виден в виде так называемых бляшки, т.е. просветы бактериальной культуры в месте попадания взвеси бактериофага на поверхность агара. Типирование бактериофагов, в связи с высокой трудоемкостью и затратами, связанными с необходимостью поддержания фаговых лизатов и контрольных штаммов, а также низкой воспроизводимостью результатов, связанной с дифференциацией штаммов из-за фенотипа наличия специфических белковых рецепторов на поверхности испытуемого бактериального штамма, в настоящее время заменяется все более совершенными и быстрыми генетическими методами.В последние годы появился ряд публикаций, в которых сообщается о возможности использования бактериофагов для лечения инфекций, а также для обнаружения и идентификации бактерий. С учетом опубликованных результатов проведенных к настоящему времени экспериментов использование бактериофагов в терапии представляется перспективным, но требует дальнейших лабораторных и клинических исследований для оценки безопасности и эффективности такой терапии. Использование бактериофагов в составе биосенсоров, выявляющих наличие микроорганизмов в исследуемом образце, также перспективно и, как представляется, имеет больше шансов на быстрое применение в рутинных лабораторных исследованиях.В этом типе тестов в качестве детекторов присоединения бактериальных клеток, присутствующих в тестируемом образце, к специфичным для данного вида бактериофагам, связанным с сенсорные системы. В публикациях представлена возможность использования данного типа методов для выявления различных видов бактерий, в том числе патогенных, таких как Mycobacterium tuberculosis, Salmonella spp., бациллы сибирской язвы (Bacillus anthracis) или устойчивые к метициллину штаммы золотистого стафилококка (MRSA). 9
.Mgr Kornelia Dobrzaniecka
Определение наличия микроорганизмов и их идентификация в исследуемом материале, взятом от инфицированного человека или животного, или в образце, взятом из окружающей среды, является целью микробиологического исследования.
Микробиологическая диагностика - комплекс предлабораторных и лабораторных процедур, направленных на идентификацию микроорганизмов и определение их лекарственной чувствительности.
Предлабораторные процедуры включают: • определение типа анализируемого материала, • метод сбора клинического материала, • условия хранения и транспортировки.
Сбор материала: • Материал для исследования должен быть взят из места, где протекает болезненный процесс, • Количество материала должно быть достаточным для микробиологического анализа, • Образец должен быть доставлен в лабораторию в кратчайшие сроки по возможности, • материал должен быть хорошо промаркирован и к нему должна быть приложена полная документация, • образец клинического материала должен быть взят до применения лечения, а если это невозможно, информация о препаратах, вводимых пациенту, должна быть предоставил.
Лабораторные процедуры
Микроскопическое исследование прямого препарата, Посев материала на подходящую среду для получения чистых культур, Морфологические и микроскопические наблюдения полученных культур, Исследование физиологических свойств чистых культур, Иммунологические тесты, Определение чувствительности к антимикробным веществам, в том числе лекарственным.
Выделение и идентификация неизвестного микроорганизма: 1. Микроскопическое исследование
• Препарат, изготовленный непосредственно из клинического материала, взятого от больного (ПРЯМОЕ ПРИГОТОВЛЕНИЕ) Пример: мокрота - в случае туберкулеза, вагинальный мазок - оценка степени чистоты спинномозговой жидкости
• Препарат изготовлен из искусственных бактериальных колоний, выращенных на подложках
НЕПОСРЕДСТВЕННОЕ ПРИГОТОВЛЕНИЕ ОБЯЗАТЕЛЬНО НЕПОСРЕДСТВЕННО ИЗ СЛЕДУЮЩИХ КЛИНИЧЕСКИХ МАТЕРИАЛОВ • кожи и подкожной клетчатки • цервикального, влагалищного и уретрального секрета • спинномозговой жидкости, аспирина, мокроты легких • мазки из глаз • плевральная и перитонеальная жидкости
ПРЯМОЕ ПРИГОТОВЛЕНИЕ НЕ ПРОИЗВОДИМ ИЗ СЛЕДУЮЩИХ КЛИНИЧЕСКИХ МАТЕРИАЛОВ • Мазок из зева ИСКЛЮЧЕНИЯ: подозрение на дифтерийную ангину Плаута-Венсана, подозрение на грибковую инфекцию • кал новорожденных, подозрение на фекальную инфекцию
900 02 2.Посев материала на подходящую среду для получения одиночных колоний, необходимых для чистых культур: • •Редукционный посев на подходящую твердую среду. Серийное разведение исследуемого материала.
3. Макро- и микроскопическое исследование морфологии полученных культур.
Морфология пластинчатых колоний: Форма (круглая, спиральная, неправильная), Край (правильный, неправильный, зазубренный), Поперечное сечение (выпуклый, плоский, высокий, папиллярный, вросший), Размер, Цвет, Прозрачность, Структура, Консистенция, Запах , Подвеска
Цвет: 1.Простой •
Положительный,
•
Отрицательный,
2. Сложный •
Мет. Грамм,
•
Мет. Циль-Нильсен.
4. Исследование физиологических свойств чистых культур: • •
Культуральные исследования, Биохимические исследования.
Биохимические методы заключаются в определении способности микроорганизмов ассимилировать, ферментировать или разлагать определенные химические соединения.
Масс-спектрометрия MALDI-TOF Инструментом последнего поколения, используемым в клинической микробиологии для идентификации микроорганизмов, является масс-спектрометрия, т.н.MALDITOF MS (матричная лазерная десорбция/ионизация - времяпролетная масс-спектрометрия). Система классифицирует и идентифицирует микроорганизмы путем автоматического анализа их белкового профиля (молекулярный белковый отпечаток) и сравнения со спектрофотометрическими эталонными образцами, хранящимися в базе данных.
Примеры тестов в диагностическом цикле: Тест на каталазу. Каталаза — это фермент, расщепляющий токсичный для клеток h3O2 на h3O и кислород. На предметное стекло наносят каплю 3% раствора h3O2 и подвешивают в ней собранную колонию; пузырьки газа указывают на присутствие каталазы.
Каталазоположительные
Каталазоотрицательные
Micrococcus, Staphylococcus, Corynebacterium, Listeria, Enterobacteriaceae
Streptococcus, Enterococcus, Lactococcus, Peptostreptococcus, Peptulococcus, Peptulococcus
03. Коагулаза разрезает плазму крови кролика в присутствии активатора коагулазы, который трансформируется в тромбиноподобное соединение. Это соединение, действуя на фибриноген, превращает его в фибрин. Определение проводят методом пробирки.Для теста используется 24-часовая бактериальная культура. Плазму кролика смешивают в культуральной пробирке и инкубируют при 37°С в течение 1-4 часов. Отчетливый сгусток плазмы считается положительным результатом. Если через 4 часа положительный результат не обнаружен, тест следует оставить при комнатной температуре до следующего дня. Определение связанной коагулазы, т.н. «CF-фактор слипания», т.е. сдвиг фибриногена без участия активатора коагулазы. Тест проводят предметным методом путем смешивания взвешенных в капле стерильной воды микроорганизмов с каплей кроличьей плазмы.Результат считывается через 30 секунд. Возникновение агглютинации является положительным.
Коагулазоположительный
Коагулазоотрицательный
S. aureus, S. intermedius, S. hyicus подвиды Hyicus, S. schleiferi подвид Coagulans
S. saprophyticus, S. xylosus, S. gallinarum, S. epidermidis .haemolyticus, S.capitis, S.warneri, S.simulans, S.caprae, S.hominis
5. Иммунологические тесты
• Реакции, при которых происходит прямое связывание антигена с антителом (иммунофлуоресцентные, иммуноферментные и радиоиммунологические реакции), • Реакции с различными физико-химическими реакциями или дополнительными элементами (иммунопреципитация, иммуноэлектрофорез, реакция связывания комплемента)
СЕРОЛОГИЧЕСКИЕ МЕТОДЫ
Бескультуральные методы Прямые методы (для обнаружения антигена) Непрямые методы (для обнаружения антител)
Иммунологические реакции : преципитация-агглютинация иммунофлуоресцентный иммуноферментный (ИФА)
ЛАТЕКСНАЯ АГГЛЮТИНАЦИЯ Латексные микрочастицы с покрыты известными антителами, которые связываются со специфическими антигенами.Образуется видимая невооруженным глазом АГГЛЮТИНАЦИЯ.
отсутствие агглютинации отрицательная
агглютинация положительная
Streptococcus Серологические группы по схеме Лансфилда • Ребека Лансфилд в 1933 г. разработал схему серологической классификации β-гемолитических стрептококков. • Анализ основан на выявлении группоспецифических антигенов клеточной стенки. В основном это полисахариды. • Большинство этих антигенов имеют β-гемолитические стрептококки, некоторые α-гемолитические и негемолитические стрептококки.
A - S. pyogenes, несколько штаммов S. anginosus и S. constelatus B - S. agalactiae, C - S. dysgalactiae subsp. equisimilis, S. equi subsp. экви, С. экви подвид. zooepidemicus D - S. bovis (=equinus), Enterococcus faecalis, Enterococcus faecium, Streptococcus avium F - некоторые стрептококки группы S.milleri G - в т.ч. пиогенные стрептококки животных (S. canis)
Классификация и номенклатура Salmonella Род Salmonella делится на два вида: 1. Salmonella enterica, внутри которого выделяют шесть подвидов (подвидов):
• • • • •
S.энтерика подвид. enterica (серовары Typhimurium, London, Paratyphi B, Typhi, Enteritidis, Hadar, Mbandaka, Newport) S. enterica subsp. salamae S. enterica subsp. arizonae S. enterica subsp. diarizonae S. enterica subsp. houtenae S. enterica subsp. индика
2.
Salmonella bongori.
•
Серовары других пяти подвидов Salmonella enterica и серовары вида Salmonella bongori описываются антигенными паттернами. Принадлежность сыроделов к этим подвидам обозначается следующими символами: II - S.энтерика подвид. salamae IIIa - S. enterica subsp. arizonae IIIb - S. enterica subsp. diarizonae IV - S. enterica subsp. houtenae VI - S. enterica subsp. Indica V-S. bongori
Источник: http://www.pzh.gov.pl/page/fileadmin/user_upload/SchematWKM2007_01.pdf
Количество известных в настоящее время серологических вариантов (сероваров) у отдельных видов и подвидов Salmonella это: 1. Salmonella enterica
подвид enterica salamae arizonae diarizonae336 houtenae 73 indica
2.Salmonella bongori Всего:
1531 505 99
13 22
2557
В основе деления лежит дифференциация соматического (О-антиген) и цилиарного (Н-антиген) антигенов.
Метод иммуноферментного анализа – ИФА Основан на мечении, т.е. на связывании антигена или антитела с ферментом. Образовавшийся комплекс антиген-антитело-фермент обнаруживается при добавлении бесцветного субстрата, который при расщеплении ферментом дает окрашенный продукт. Цветовую реакцию считывают визуально или на спектрофотометре.Примеры: - Выявление антигенов ВГВ - Определение антител, специфичных к ВИЧ, ВГВ, ВГС, диагностика клещевого энцефалита - Определение титра антител, специфичных к Legionella pneumophila, Borrelia burgdorferii
МОЛЕКУЛЯРНЫЕ МЕТОДЫ Поиск нуклеиновых кислот в клинической образца или микробной культуры. • метод полимеразной цепной реакции (ПЦР) • гибридизация нуклеиновых кислот с использованием молекулярных зондов
6. Определение чувствительности к антимикробным веществам, в том числе к лекарственным.
Лекарственная чувствительность
Антибиотики (греч. anti — против, bios — жизнь) — природные органические соединения, вырабатываемые микроорганизмами; также синтетические или полусинтетические, применяемые в качестве препаратов против инфекций, вызванных патогенными микроорганизмами (чаще всего бактериями, но также грибами и простейшими). Химиотерапевтические средства – это соединения, созданные чисто химическим путем, им нет аналогов в природе.
Как это работает • Антибиотики действуют, вызывая гибель бактериальной клетки (бактерицидный эффект) или воздействуя на ее метаболизм таким образом, чтобы ограничить ее потенциал размножения (бактериостатический эффект).
Механизмы устойчивости бактерий к антибиотикам 1. Наружная мембрана грамотрицательных бактерий • мутации поринов 2. Ферментативная инактивация антибиотиков 3. Активная откачка антибиотиков из цитоплазмы - ЭФЛЮКС 4. Модификация мишеней антибиотиков 5. Регуляция резистентности экспрессия генов 6. Перенос генов устойчивости • Мутации существующих генов • Приобретение новых генов (внутри одного вида) - трансдукция (бактериофаги) - трансформация (например, S. pneumoniae - устойчивость к пенциклину) • Межвидовой и межгенеральный перенос генов устойчивости - плазмиды - conjugation transposons
Main groups of antibiotics and chemotherapeutic agents 1 B-lactams
penicillins, penicillins with inhibitors, cephalosporins / cefamycins, monobactams, trigamates, carbapenems, penems
2 Aminoglycosides
streptomycin, neomycin, kanamycin, gentamicin
, isepacylmycin , , изепацилмицин, , тацилмицин, , тацилмицин, доксициклин, тетрациклины a, minocyklina4 Makrolidy/ketolidy erytromycyna, spiramycyna, josamycyna cykliczny węglan erytromycyny (Dawercin), roksytromycyna, klarytromycyna, azytromycyna, dirytromycyna, trolitromycyna 5 Linkozamidy
linkomycyna, klindamycyna
6 Streptograminy
pristinamycyna, chinupristina, dalfopristina
7 Oksazolidynony
linezolid
8 Glikopeptydy
wankomycyna, teikoplanina
9 Chloramfenikol
detreomycyna
10 Polimiksyny
kolistyna
11 Rifamycyny
rifampicyna
12 Sulfonamidy
kotrimoksazol
13 Nitroimidazole
metronidazol, орнидазол
14 Нитрофураны
нитрофурантоин, фурагин, нифуроксазид
15 Хинолоны
пипемидовая кислота, норфлоксацин, пефлоксацин, ципрофлоксацин, офлоксацин, левоксифлоксацин, мароксифлоксацин, мароксифлоксацин oxacin
16 Fusidic acid 17 Polyene antifungal agents: nystatin, amphotericin B azole: fluconitride, itraconazole, ketoconazole, econazole, voriconazole antimetabolites: 5-fluorocytosine, indiviral drugs, gudiclovir
aciclovir, famanciclovir
ritonavir, saquinavir, stavudine, zalcitabine, zidovudine
Спектр действия
СПЕКТР ДЕЙСТВИЯ
УЗКИЙ СЕКТР - ОГРАНИЧЕННЫЙ E.G.ДЛЯ ЗЕРНА
ШИРОКИЙ СПЕКТР - ГРАММ (+) И ГРАММ (-) (+/- АНАЭРИДЫ)
БЕНЗИН ПЕНИЦИЛЛИН ВАНКОМИЦИН
ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЛИНЫ
ПОЛУСИНТЕТИЧЕСКИЕ ПЕНИЦИЛЫ микроорганизма 9000EM.
Лекарственная чувствительность: 1. Полуколичественный метод - АТБ, 2. Диффузионно-дисковый метод - тканевые диски, пропитанные антибиотиком, 3. Количественный метод - Е-тесты,
4.Автоматические системы
Е-тест - метод, применяемый для определения минимальной концентрации антибиотика (МПК), подавляющей рост микроорганизма. Используют полоски, пропитанные антибиотиком в градиенте концентрации. АТБ-полоска позволяет определить чувствительность тестируемых бактерий к антибиотикам в полужидкой среде. Диско-диффузионный метод - наиболее часто используемый метод, основанный на диффузии антибиотика, содержащегося в диске, в субстрат. Антибиотик диффундирует радиально, создавая градиент концентрации.
Сигнальные штаммы Во время пребывания в больнице у пациента может развиться инфекция, которая является прямым результатом госпитализации.Оно может проявляться после выписки из больницы и может касаться медицинского персонала или посетителей. Этиологическими факторами внутрибольничных инфекций могут быть как бактерии и вирусы, так и грибы и паразиты.
Перечень факторов тревоги, составляющий Приложение № 1 к Постановлению Министра здравоохранения 23 декабря 2011 г. о перечне тревожных факторов, регистрах госпитальных инфекций и тревожных факторов и отчетах о текущей эпидемиологической ситуации в стационаре (ЖурналЗаконов 2011 г., № 294, ст. 1741) 1. Staphylococcus aureus, устойчивый к метициллину (MRSA) или гликопептидам (VISA или VRSA) или оксазолидинонам. 2. Энтерококки (Enterococcus spp.), устойчивые к гликопептидам (VRE) или оксазолидинонам. 3. Грамотрицательные виды Enterobacteriaceae, продуцирующие бета-лактамазы с расширенным субстратным спектром (например, ESBL, AMPc, KPC) или устойчивые к карбапенемам или другим двум классам лекарств или полимиксинам. 4. Голубая масляная палочка (Pseudomonas aeruginosa), устойчивая к карбапенемам или другим двум группам препаратов или полимиксинам.5. Неферментирующие палочки рода Acinetobacter spp., устойчивые к карбапенемам или другим двум группам препаратов или полимиксинам. 6. Патогенные штаммы Clostridium difficile анаэробные и продуцируемые ими токсины А и В.
7. Clostridium perfringens анаэробные. 8. Расщепленная пневмония (Streptococcus pneumoniae), резистентная к цефалоспоринам третьего поколения или пенициллину. 9. Грибы Candida, устойчивые к флуконазолу или другим азольным или кандиновым препаратам. 10. Грибы аспергиллы.
11. Ротавирус (ротавирус). 12. Норовирус (норовирус). 13. Синцитиальный вирус (РСВ) 14. Вирус гепатита В 15. Вирус гепатита С 16. Вирус иммунодефицита человека (ВИЧ). 17. Биологические патогены, выделенные из крови или спинномозговой жидкости, ответственные за генерализованные или инвазивные инфекции.
.
Методы выявления и идентификации бактерий Dorota Żabicka Кафедра эпидемиологии и клинической микробиологии Национальный медицинский институт Варшава
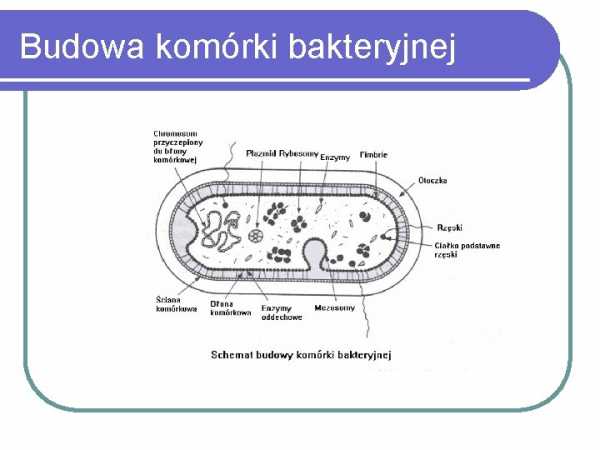
Структура бактериальной клетки

Микробиологическое исследование l Цель: выявление этиологического фактора инфекции и определение чувствительности к антибиотикам l Курс микробиологического исследования l l Сбор проб Исследование материала: l l Классические методы l Микроскопическое исследование l Посев и идентификация микроорганизма l Определение чувствительности бактерий к антибиотикам l Иммунологические методы Молекулярные методы

Сбор и перенос материала Тип транспортной среды и тип контейнеров подбираются в соответствии с типом материала и направлением исследования (бактерии, вирусы, наличие антител)
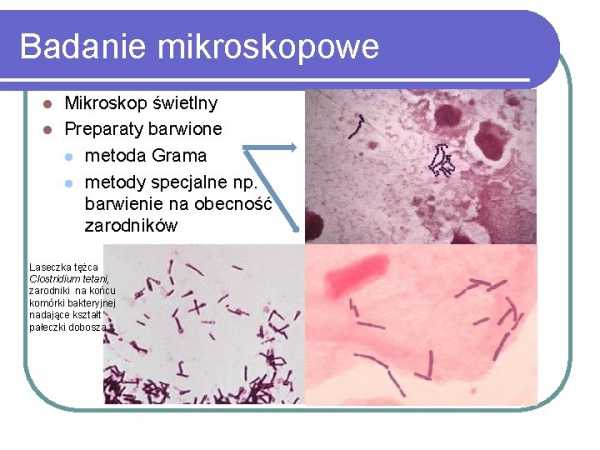
Микроскопическое исследование Световой микроскоп l Окрашенные образцы l Метод Грама l Специальные методы, напр.окрашивание спор l Clostridium tetani tetanus, споры на конце бактериальной клетки, придающие форму барабанщика
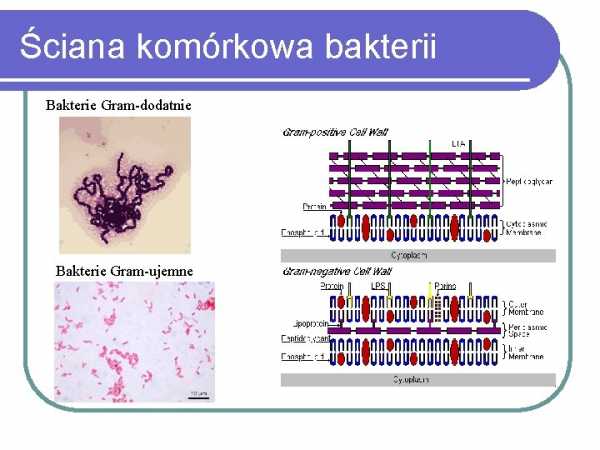
Бактериальная клеточная стенка Грамположительные бактерии Грамотрицательные бактерии
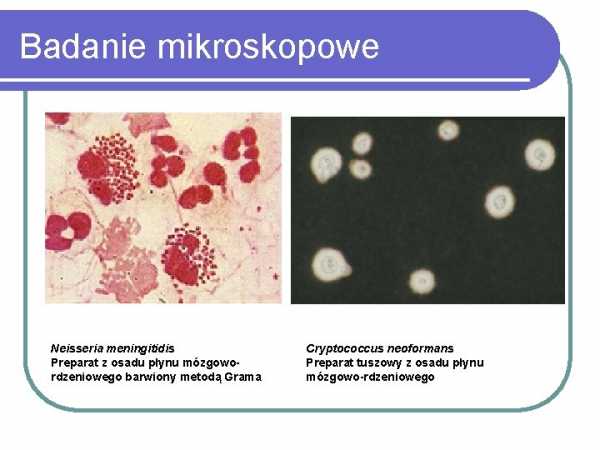
Микроскопическое исследование Neisseria meningitidis Препарат осадка спинномозговой жидкости, окрашенный по Граму Cryptococcus neoformans Препарат осадка спинномозговой жидкости
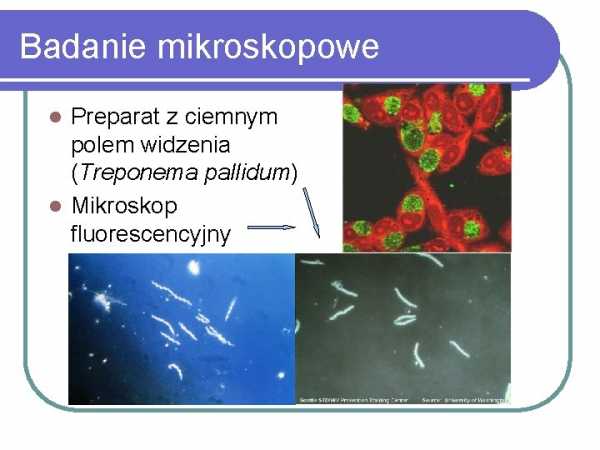
Микроскопическое исследование Препарат с темным полем зрения (Treponema pallidum) l Флуоресцентный микроскоп l
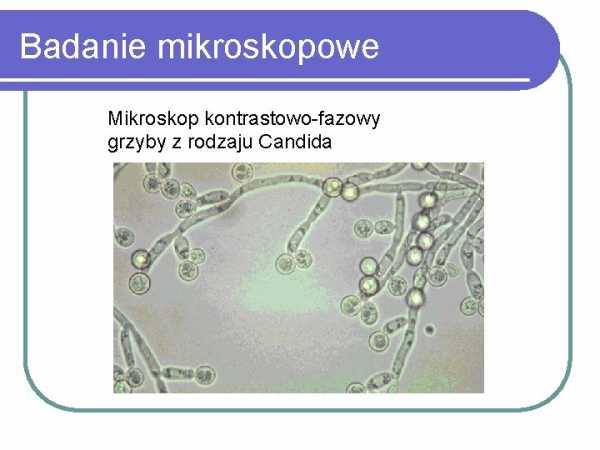
Микроскопическое исследование Фазоконтрастный микроскоп для выявления грибов рода Candida
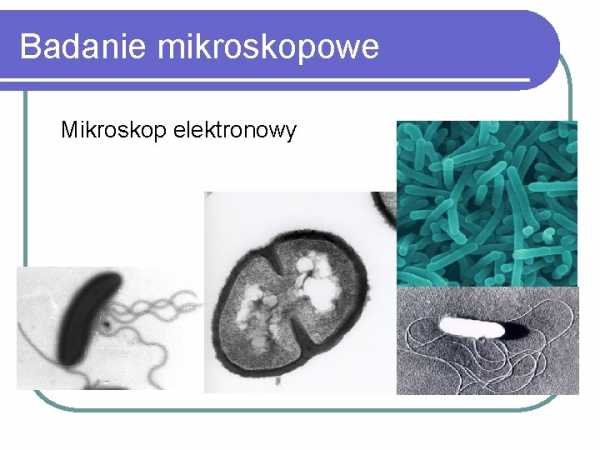
Микроскопическое исследование Электронный микроскоп

Бактериальная культура l Применяемые жидкие и твердые бактериологические среды l Культивирование в условиях, наиболее подходящих для целевых микроорганизмов l Время культивирования от нескольких часов (напр.колиформные бактерии, т. е. Escherichia coli) до нескольких дней (например, микобактерии туберкулеза, т. е. Mycobacterium tuberculosis)

Требования для роста бактерий l Потребность в кислороде l l Источник углерода l l l Аэробный – O 2 Анаэробный – менее 1–0,5 % O 2 Микроаэрофильный – смесь 5 % O 2, 10 % CO 2, 85 % N 2 Автотрофный – CO 2 Гетеротрофный – амино кислоты, пептиды, сахара, липиды Другие соединения, необходимые для роста l l Неорганические соли Витамины

Физические и химические факторы l Температура l l с.H l l Психрофилы - оптимум 0-10 С Мезофилы - оптимум 20-40 С Термофилы - оптимум 50-60 С Большинство бактерий предпочитают нейтральные значения р. Н ~ 7,0 Осмотическое давление l Большинство предпочитают aw ~ 0,99
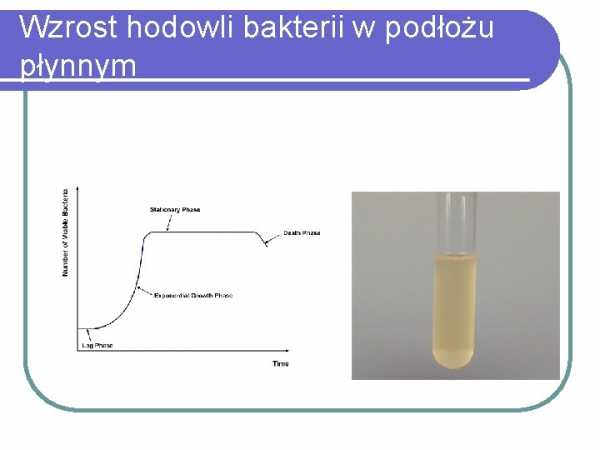
Рост культуры бактерий в жидкой среде
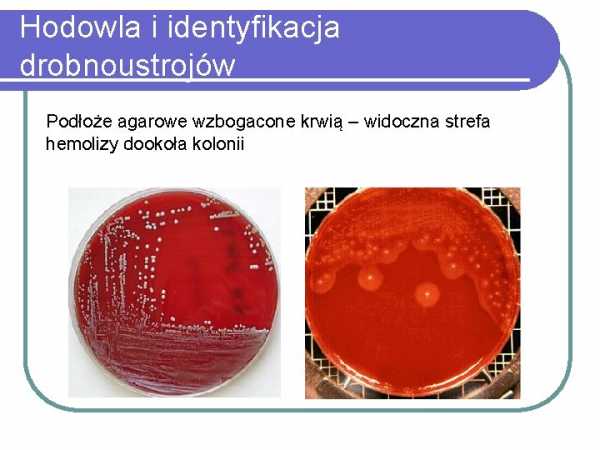
Культура и идентификация микроорганизмов Агаризованная среда, обогащенная кровью - видимая зона гемолиза вокруг колонии
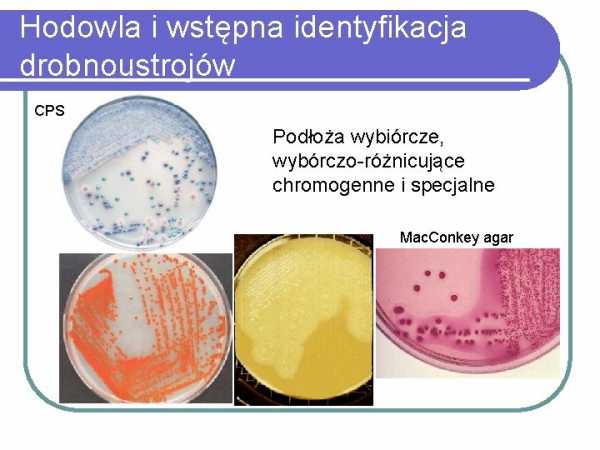
Культура и первичная идентификация микроорганизмов ХПС Селективные, хромогенные селективно-дифференцирующие и специальные среды Мак.Конки-агар
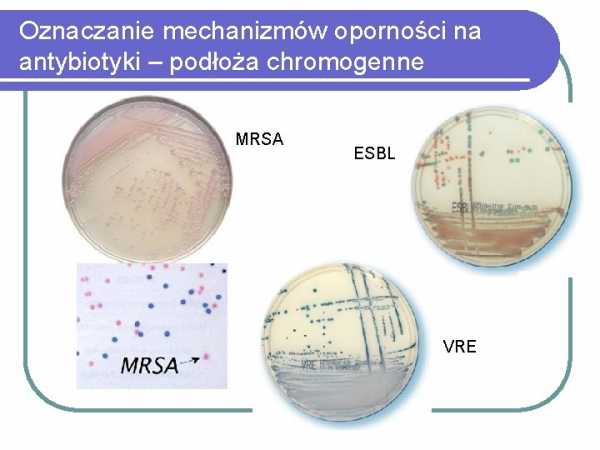
Определение механизмов устойчивости к антибиотикам – хромогенные субстраты MRSA ESBL VRE
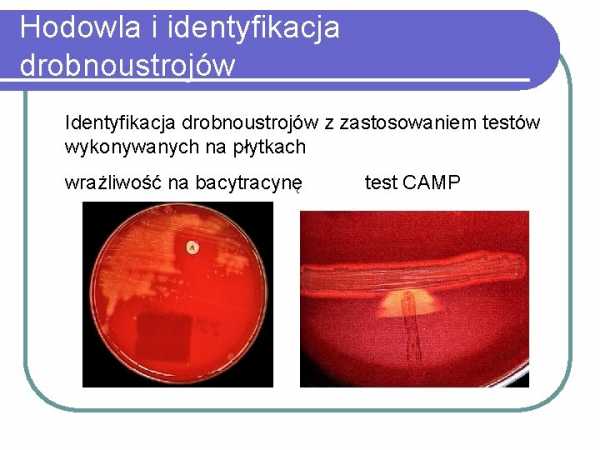
Культивирование и идентификация микроорганизмов Идентификация микроорганизмов с помощью анализов на чашках Тест на чувствительность к бацитрацину CAMP
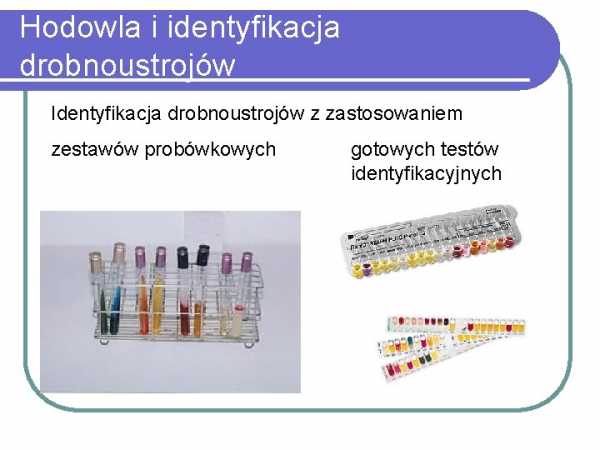
Культуры и идентификация микроорганизмов Идентификация микроорганизмов с использованием наборов для пробирок готовых идентификационных тестов

Автоматические системы используются для культивирования микроорганизмов (например,Bactec для посева крови) или для идентификации и определения антимикробной чувствительности ранее выращенных твердых микроорганизмов VITEK 2 Compact Bio. Диагностические системы Merieux Phoenix BD

VITEK 2 Compact System Автоматическая система для идентификации и определения антимикробной чувствительности микроорганизмов, ранее выращенных на твердых средах

Определение чувствительности к противомикробным препаратам l Определение методом разведения l Готовые диагностические тесты для ручного считывания l Определение с помощью автоматизированных систем

Определение лекарственной чувствительности и механизмов устойчивости к антибиотикам Диффузия с диска Антибиотическая среда Диффузия с полоски Штамм Staphylococcus aureus, устойчивый ко всем лактамным антибиотикам (MRSA)
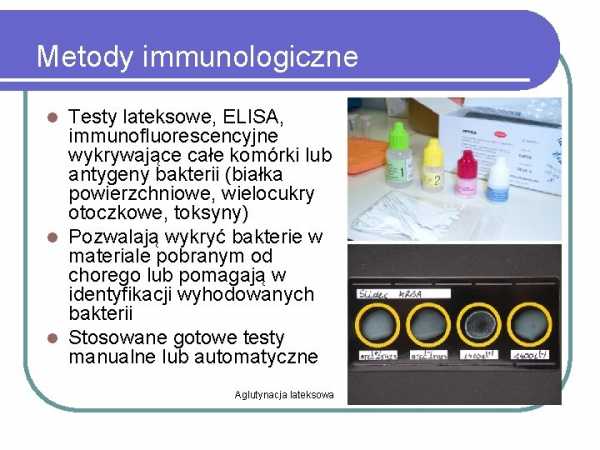
Иммунологические методы Латекс, ИФА, иммунофлюоресцентные тесты, выявляющие целые клетки или бактериальные антигены (поверхностные белки, капсулярные сахара, токсины) l Они позволяют обнаружить бактерии в материале, взятом от больного, или помогают в идентификации культивируемых бактерий l Использовать готовые проведены ручные или автоматические тесты l Латексная агглютинация
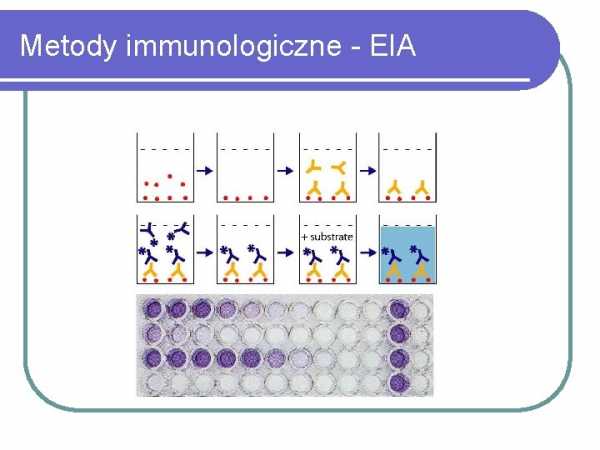
Иммунологические методы – ОВОС
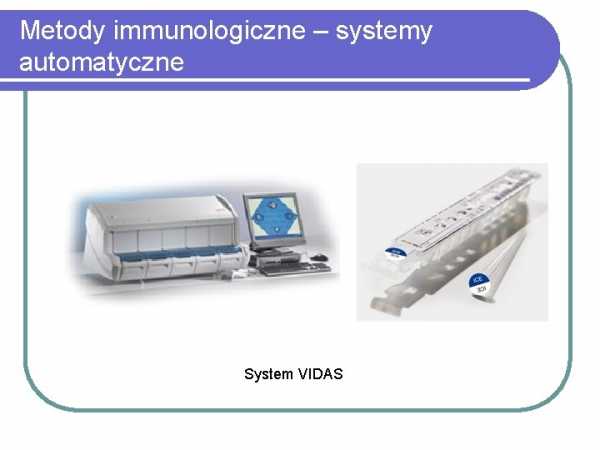
Иммунологические методы - автоматические системы Система VIDAS
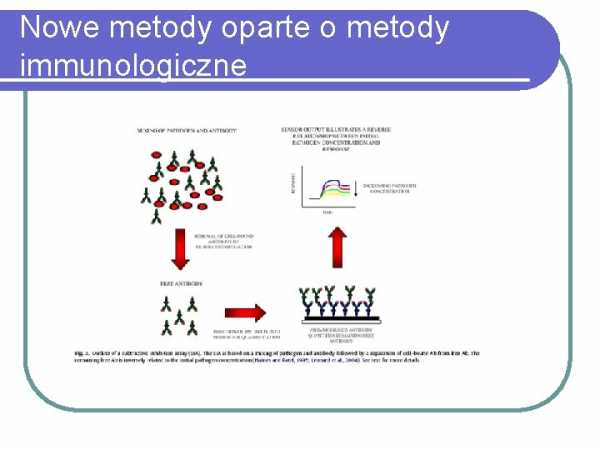
Новые методы, основанные на иммунологических методах
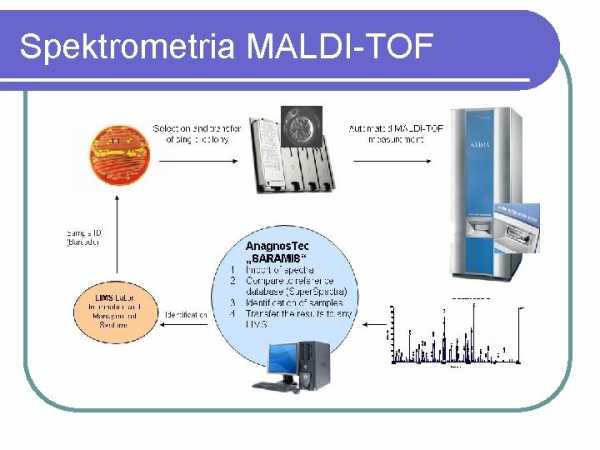
Спектрометрия MALDI-TOF
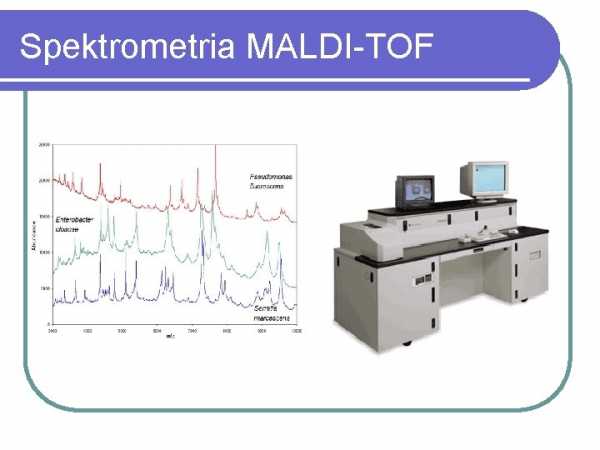
MALDI-TOF-спектрометрия
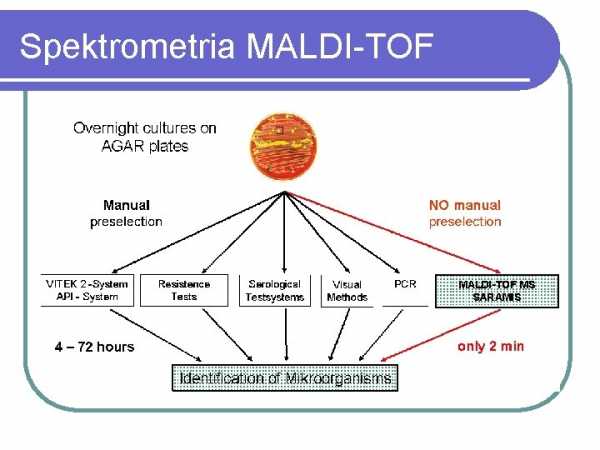
Спектрометрия MALDI-TOF

Молекулярные методы В основном используемые методы, основанные на реакциях ПЦР или ПЦР в реальном времени l Различные готовые коммерческие тесты, доступные в двух вариантах l Набор реагентов для обнаружения бактерий, реакции в любом аппарате для ПЦР или ПЦР в реальном времени l Наборы реагентов или закрытые диагностические системы, предназначенные для использования в аппаратах конкретной фирмы. l Тесты как на обнаружение бактерий, т.е.M.tuberculosis, а также идентификация эпидемиологически важных бактерий, например, MRSA или обнаружение бактериальных токсинов l
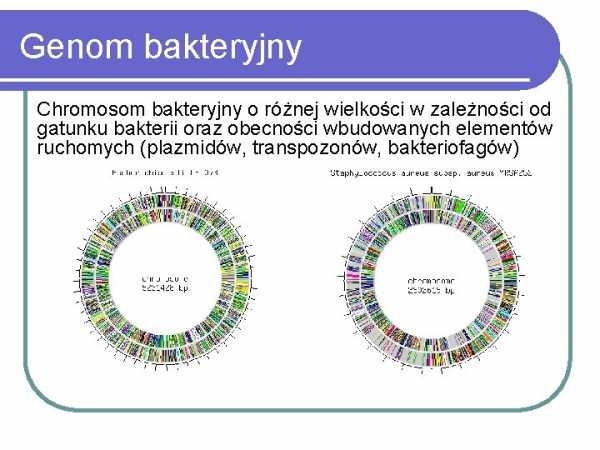
Бактериальный геном Бактериальная хромосома разного размера в зависимости от вида бактерий и наличия встроенных подвижных элементов (плазмид, транспозонов, бактериофагов)
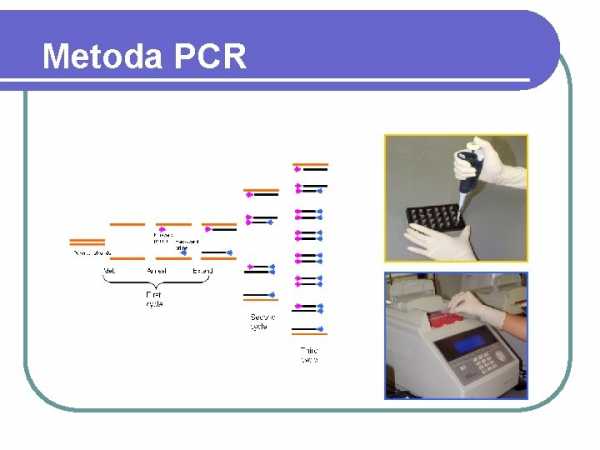
Метод ПЦР
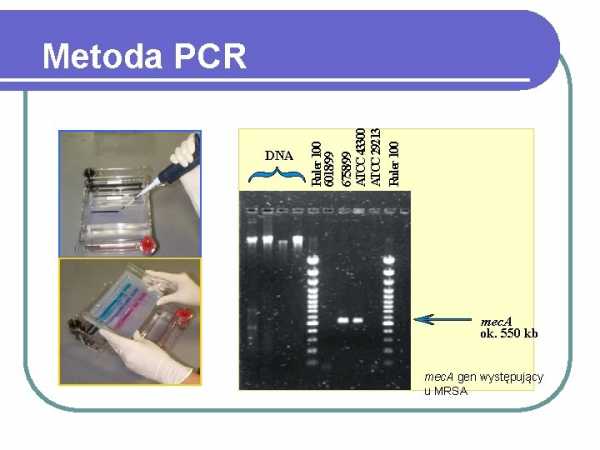
DNA Ruler 100 6018/99 6758/99 ATCC 43300 ATCC 29213 Ruler 100 PCR method mec A около 550 kb mec Ген, присутствующий в MRSA
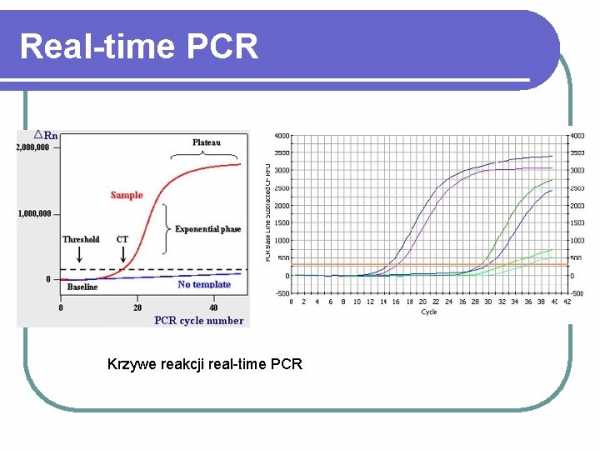
ПЦР в реальном времени Кривые реакции ПЦР в реальном времени

Быстрые молекулярные тестыГен. Эксперт
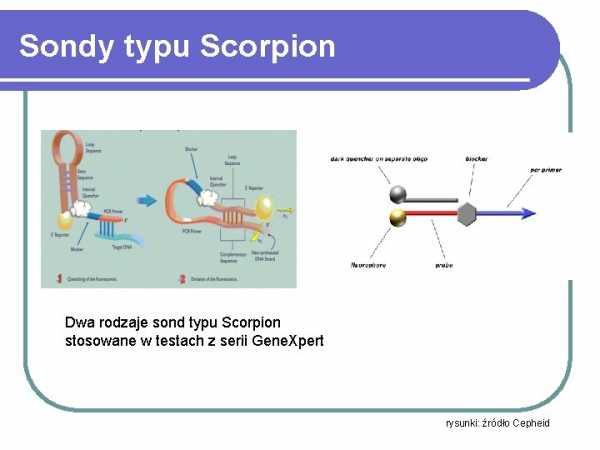
Зонды Scorpion Два типа зондов Scorpion, используемые в анализах серии Gene. Экспертные рисунки: источник Cepheid
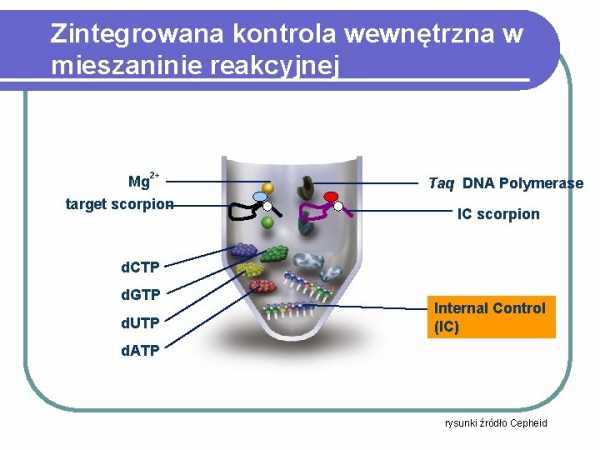
Интегрированный внутренний контроль в реакционной смеси Mg 2+ мишень скорпион Taq ДНК-полимераза IC скорпион d.CTP d.GTP d.Внутренний контроль UTP (IC) d.Чертежи ATP источник Cepheid
Микрочипы
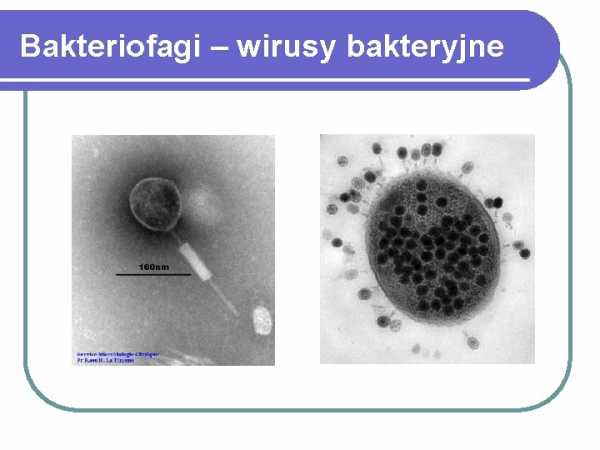
Бактериофаги - бактериальный вирус
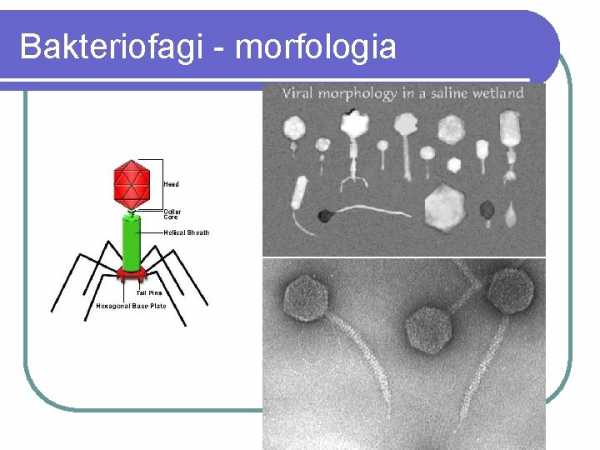
Бактериофаги – морфология
90 125Бактериофаги - жизненные циклы 9000 4 90 128
Бактериофаги – применение в диагностике l Типирование бактерий для определения родства выделенных штаммов бляшек
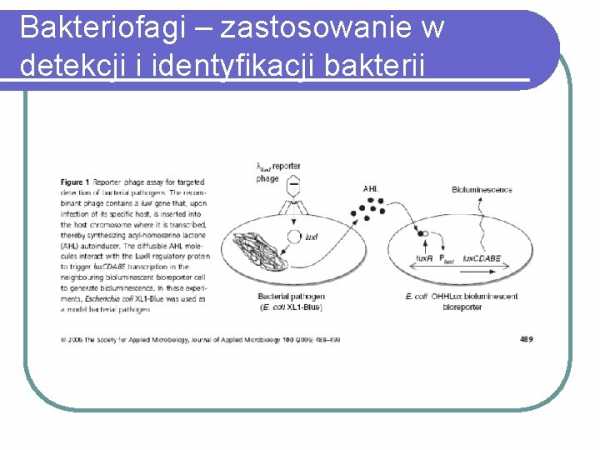
Бактериофаги – применение для обнаружения и идентификации бактерий
90 134Бактериофаги – применение для обнаружения и идентификации бактерий
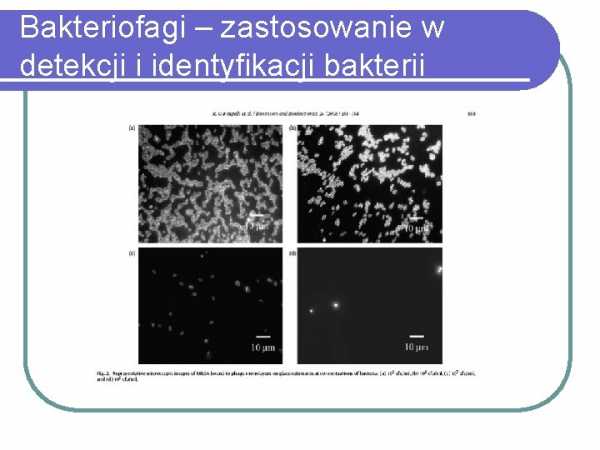
Бактериофаги – применение для обнаружения и идентификации бактерий
90 140Спасибо за внимание
.