2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
Глобулин, связывающий половые гормоны (ГСПГ), – это производимый печенью белок, который соединяется с тестостероном, дигидротестостероном (ДГТ) и эстрадиолом (эстрогеном) и транспортирует их в кровь в метаболически неактивной форме.
Синонимы русские
Cекс-стероид-связывающий глобулин, ГСПГ, СССГ, тестостерон-эстрадиол-связывающий глобулин.
Синонимы английские
Sex Hormone Binding Globulin, Testosterone, Free Testosterone, Bioavailable Testosterone.
Метод исследования
Электрохемилюминесцентный анализ.
Диапазон определения: 0,35 - 2000 нмоль/л.
Единицы измерения
Нмоль/л (наномоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
ГСПГ – белок, производимый печенью. Он связывается с тестостероном, дигидротестостероном (ДГТ) и эстрадиолом (эстрогеном) и переносит их в кровяное русло. Содержание ГСПГ в кровотоке зависит от возраста человека, пола, от интенсивности производства тестостерона либо эстрогенов. Кроме того, на уровень ГСПГ в крови влияют заболевания печени, гипертиреоз, гипотиреоз и повышенная масса тела.
Количество тестостерона, доступного для использования тканями организма, зависит от колебания уровня ГСПГ. В нормальном состоянии с ГСПГ связано от 40 % до 60 % тестостерона, а большая часть оставшегося – слабо соединена с альбумином. И только около 2 % свободного тестостерона непосредственно доступно для тканей.
Анализ на общий тестостерон не выявляет различий между связанным и несвязанным тестостероном – он лишь определяет количество гормона в целом. Во многих случаях его хватает, чтобы определить избыток или недостаток образования гормона в организме, однако если показатель ГСПГ отклоняется от нормального, то выявленный уровень общего тестостерона не является точным отражением количества гормона, доступного тканям организма.
В настоящее время анализ на ГСПГ используется не очень часто – в большинстве случаев анализы на общий и свободный тестостерон дают достаточно информации.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Референсные значения
|
Пол |
Возраст |
Референсные значения |
|
Женский |
Меньше 1 месяца |
11,8 - 51 нмоль/л |
|
1 месяц – 1 год |
50 - 181 нмоль/л |
|
|
1-4 лет |
51 - 158 нмоль/л |
|
|
4-7 лет |
48 - 142 нмоль/л |
|
|
7-10 лет |
31 - 103 нмоль/л |
|
|
10-13 лет |
20 - 100 нмоль/л |
|
|
13-16 лет |
16,6 - 77 нмоль/л |
|
|
16-20 лет |
9,3 - 75 нмоль/л |
|
|
20-50 лет |
32,4 - 128 нмоль/л |
|
|
Больше 50 лет |
27,1 - 128 нмоль/л |
|
|
Мужской |
Меньше 1 месяца |
10,8 - 71 нмоль/л |
|
1 месяц – 1 год |
60 - 209 нмоль/л |
|
|
1-4 лет |
42 - 156 нмоль/л |
|
|
4-7 лет |
39 - 146 нмоль/л |
|
|
7-10 лет |
38 - 114 нмоль/л |
|
|
10-13 лет |
32 - 93 нмоль/л |
|
|
13-16 лет |
13 - 63 нмоль/л |
|
|
16-20 лет |
10,6 - 54 нмоль/л |
|
|
20-50 лет |
18,3 - 54,1 нмоль/л |
|
|
Больше 50 лет |
20,6 - 76,7 нмоль/л |
При повышенном уровне ГСПГ вполне вероятно, что свободного тестостерона, доступного тканям, гораздо меньше того количества, которое показал тест на общий тестостерон. Если же концентрация ГСПГ понижена, то тестостерона, не связанного с ГСПГ, образуется больше его общего уровня.
Что может влиять на результат?
В повседневной медицинской практике исследование крови на тестостерон выполняют при подозрении на состояния гипогонадизма у мужчин, гирсутизме и вирилизме у женщин, преждевременном половом развитии (или его задержке) у детей, при подозрении на опухоль яичек у мужчин или яичников у женщин [1].
Типичные симптомы и проявления синдрома дефицита тестостерона (СДТ) у мужчин известны уже почти 70 лет, к ним относятся эректильная дисфункция, сниженное либидо, слабость, депрессия, беспокойство, раздражительность, нарушение концентрации внимания, суставные боли, ночная потливость, истончение и сухость кожи, преждевременное старение. Однако до сих пор неизвестно, почему между степенью проявлений СДТ и уровнем тестостерона и других андрогенов в крови нет хорошей корреляции [2].
В случаях, когда клинические проявления СДТ и уровень общего тестостерона (TT) в крови между собой не согласуются, для подтверждения диагноза гипогонадизма целесообразно проведение исследования на свободный тестостерон, не связанный с белками переносчиками, в первую очередь с глобулином, связывающим половые гормоны (ГСПГ) [3]. Прямые методы определения свободного тестостерона в крови сопряжены с техническими трудностями и не годятся для рутинного использования, вместо них предложены вычислительные методики оценки уровня свободного тестостерона (cFT) [1, 4-7]. Показано, что низкие значения cFT, даже при нормальных величинах ТТ, согласуются с симптомами СДТ и характерны для пожилых мужчин, тогда как нормальные значения cFT при низком ТТ не связаны с этими симптомами, и скорее характерны для молодых людей с ожирением [8].
В клинической практике широко распространены безэкстракционные методы определения ТТ на автоматических иммунохимических анализаторах (Roche, Siemens, Abbott). В ряде случаев достоверность получаемых при этом результатов ставится под сомнение [9]. Однако, предлагаемый в качестве альтернативы метод хромато-масс-спектрометрии еще недостаточно распространён в клинических лабораториях, и многие врачи не имеют чёткого представления об отличиях этого метода от иммунохимического анализа [10].
Сравнительное исследование крови на тестостерон (Таблица 1, Рис. 1) методами иммуно-хемилюминесценции (ИХЛ) и жидкостной хромато-масс-спектрометрии (ЖХ-МС) в полном согласии с ранее опубликованными данными показало, что максимальные отличия для низких значений тестостерона, характерных для женщин, достигают 100%, с тенденцией в сторону завышения результатом методом ИХЛ; для высоких значений тестостерона, характерных для здоровых мужчин, относительная ошибка меньше – около 55%, при этом метод ИХЛ склонен занижать результаты. Интересно, что в образцах контроля качества, которые получают пулированием сыворотки, метод ИХЛ систематически завышает результаты тестостерона [11].
Возможно, несогласованность лабораторных результатов ТТ, полученных иммунохимическими методами, и клинических проявлений при СДТ обусловлена именно аналитической ошибкой при определении ТТ.
Ошибка определения расчётной величины свободного тестостерона определяется суммой ошибок измерения концентрации белков переносчиков и их лигандов, а также ошибкой определения соответствующих констант связывания [5]. Наглядно оценить зависимость величины cFT от значений ГСПГ и ТТ позволяет номограмма по методу Вермюлена (Рис. 2). Очевидно, что расчетная величина cFT прямо пропорциональна концентрации ТТ, и, следовательно, для целей диагностики как по общему, так и по свободному тестостерону целесообразно использовать результаты референсного метода исследования, то есть ЖХ-МС. Альтернативой сывороточному тестостерону для оценки андрогенного статуса в клинических исследованиях может стать исследование концентрации тестостерона в слюне, которое выступает дополнительным критерием диагностики [12, 13].
Суммируя вышеизложенное, мы считаем, что в ближайшее время как метод выбора будет принят следующий диагностический алгоритм для оценки андрогенного статуса мужчин с подозрением на СДТ:
Таблица 1 Оценки согласованности измерений общего тестостерона методами ИХЛ и ЖХ-МС в сыворотке крови мужчин (М), женщин (Ж) и в образцах контроля качества (КК). Примечание: средняя разность характеризует систематическое расхождение, стандартное отклонение — степень разброса результатов.
| Группа | Ж | М | КК |
| N, чел. | 109 | 205 | 19 |
| Средняя разность (ЖХ-МС - ИХЛ), нмоль/л | -0,06 | 0,11 | -0,32 |
| Стандартное отклонение средней разности, нмоль/л | 0,42 | 0,25 | 0,24 |
Рис. 1 Диаграмма Бленда-Альтмана: сравнение двух методов (масс-спектрометрия и иммунохемилюминисценция) измерения тестостерона в сыворотке крови мужчин (М), женщин (Ж) и в образцах контроля качества (КК).
Рис. 2 Номограмма для определения свободного тестостерона в крови по Вермюлену при различных значениях входных переменных – глобулина, связывающего половые стероиды (ГСПГ) и общего тестостерона [14].
Литература
1. Emadi-Konjin, P., J. Bain, and I.L. Bromberg, Evaluation of an algorithm for calculation of serum "bioavailable" testosterone (BAT). Clin Biochem, 2003. 36(8): p. 591-6.
2. Carruthers, M., Testosterone deficiency syndrome: cellular and molecular mechanism of action. Curr Aging Sci, 2013. 6(1): p. 115-24.
3. Winters, S.J., D.E. Kelley, and B. Goodpaster, The analog free testosterone assay: are the results in men clinically useful? Clin Chem, 1998. 44(10): p. 2178-82.
4. Dunn, J.F., B.C. Nisula, and D. Rodbard, Transport of steroid hormones: binding of 21 endogenous steroids to both testosterone-binding globulin and corticosteroid-binding globulin in human plasma. J Clin Endocrinol Metab, 1981. 53(1): p. 58-68.
5. Sodergard, R., et al., Calculation of free and bound fractions of testosterone and estradiol-17 beta to human plasma proteins at body temperature. J Steroid Biochem, 1982. 16(6): p. 801-10.
6. Vermeulen, A., L. Verdonck, and J.M. Kaufman, A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab, 1999. 84(10): p. 3666-72.
7. Mazer, N.A., A novel spreadsheet method for calculating the free serum concentrations of testosterone, dihydrotestosterone, estradiol, estrone and cortisol: with illustrative examples from male and female populations. Steroids, 2009. 74(6): p. 512-519.
8. Antonio, L., et al., Low Free Testosterone Is Associated with Hypogonadal Signs and Symptoms in Men with Normal Total Testosterone. J Clin Endocrinol Metab, 2016. 101(7): p. 2647-57.
9. Herold, D.A. and R.L. Fitzgerald, Immunoassays for testosterone in women: better than a guess? Clin Chem, 2003. 49(8): p. 1250-1.
10. Taylor, A.E., B. Keevil, and I.T. Huhtaniemi, Mass spectrometry and immunoassay: how to measure steroid hormones today and tomorrow. Eur J Endocrinol, 2015. 173(2): p. D1-12.
11. Нижник, А.Н., Белов Д.А., Сименел Е.С. , Опыт диагностики нарушений стероидогенеза методом тандемной хромато-масс-спектрометрии среди пациентов Клиники АрхиМед [неопубликованные данные]
12. Goncharov, N., et al., Diagnostic significance of free salivary testosterone measurement using a direct luminescence immunoassay in healthy men and in patients with disorders of androgenic status. Aging Male, 2006. 9(2): p. 111-22.
13. Keevil, B.G., et al., Salivary testosterone measurement by liquid chromatography tandem mass spectrometry in adult males and females. Ann Clin Biochem, 2014. 51(Pt 3): p. 368-78.
14. Белов, Д.А., Калькулятор мужского тестостерона для ОС Windows (разработано в Клинике АрхиМед). 2016.
Белок класса глобулинов, который связывает и переносит половые стероидные гормоны, образуется печенью. Его основная функция — это регуляция активности тестостерона, дигидротестостерона и эстрадиола. В связанном состоянии они не могут участвовать в биохимических реакциях.
Концентрация ГСПГ в крови зависит от многих причин: от массы тела, возраста и пола человека, наличия заболеваний печени, щитовидной железы, от интенсивности выработки тестостерона или эстрогенов.
Если ГСПГ много, то возникают симптомы гормональной недостаточности, так как большинство половых стероидов инактивировано. При недостатке ГСПГ появляются признаки избытка гормонов, даже при их нормальном количестве в крови.
Терапевт;врач общей практики;эндокринолог;ортопед;ревматолог;нефролог;гастроэнтеролог.
Камышников В. С. Клиническая лабораторная диагностика (методы и трактовка лабораторных исследований): Руководство. — М.: МЕДпресс-информ, 2017. — 720 с.
Кишкун А.А. Клиническая лабораторная диагностика: Учебное пособие. — М: ГЭОТАР-Медиа, 2015. — 976 с.
1. Симптомы недостатка тестостерона у мужчин: снижение потенции, либидо.
2. Симптомы избытка мужских половых гормонов у женщин:
нарушение цикла;
избыточное оволосение лица и конечностей;
невынашивание беременности.
3. Обследование мужчин и женщин при бесплодии, облысении, упорном течении угревой сыпи, жирной себореи.
4. Несовпадение клинических признаков избытка или недостатка половых гормонов с данными анализов.
5. Диагностика синдрома поликистозных яичников и болезней, связанных с избыточным производством андрогенов.
6. Оценка гормонального статуса — вместе с анализами на свободный тестостерон, пролактин, эстрадиол, лютеинизирующий гормон.
Probl Endokrinol (Mosk). 2021; 67(2): 111–115.
Language: Russian | English
andНациональный медицинский исследовательский центр эндокринологии
Национальный медицинский исследовательский центр эндокринологии
Национальный медицинский исследовательский центр эндокринологии
Национальный медицинский исследовательский центр эндокринологии
Corresponding author.Copyright © Endocrinology Research Centre, 2021This work is licensed under a Creative Commons Attribution 4.0 License.
ОБОСНОВАНИЕ. Сегодня проблема гиперандрогении изучается преимущественно по отношению к женщинам, у мужчин этот вопрос практически не затрагивается, в то же время гиперандрогения у них может быть ассоциирована с развитием ряда заболеваний.ЦЕЛЬ. Охарактеризовать варианты физиологической гиперандрогении у мужчин.МАТЕРИАЛЫ И МЕТОДЫ. Сплошное одномоментное исследование 100 мужчин с гиперандрогенией. При проведении исследования оценивались объем и структура простаты, объем яичек; определялись уровни лютеинизирующего гормона (ЛГ), общего тестостерона, глобулина, связывающего половые гормоны (ГСПГ), с дальнейшим расчетом уровня свободного тестостерона по Vermeullen, и дигидротестостерона (ДГТ). По результатам анализа гормонального статуса пациентов с гиперандрогенией были сформированы 4 группы пациентов: 1-я — пациенты с повышенным уровнем общего тестостерона и ГСПГ; 2-я — пациенты с повышенным уровнем общего тестостерона и нормальным уровнем ГСПГ; 3-я — пациенты с повышенным уровнем общего тестостерона, ДГТ при нормальном уровне ГСПГ; 4-я — пациенты с повышенным уровнем ДГТ при нормальном уровне общего тестостерона и ГСПГ. Статистически значимыми считали различия между группами при p<0,05.РЕЗУЛЬТАТЫ. Возраст и объем простаты пациентов 1-й группы были статистически значимо выше, чем в остальных группах. Для этой группы, несмотря на высокий уровень общего тестостерона, не было характерно наличие жалоб на акне. Пациенты 2-й группы чаще жаловались на акне, но распространенность этого симптома даже в этой группе являлась статистически значимо более низкой, чем у пациентов 3-й группы. При этом частота встречаемости алопеции была статистически значимо ниже во 2-й группе, чем у пациентов как 3-й, так и 4-й групп. Пациенты 3-й группы имели самые яркие клинические проявления гиперандрогении. Для 4-й группы была характерна алопеция.ЗАКЛЮЧЕНИЕ. Повышение уровня андрогенов может выявляться в любом возрасте. При этом у мужчин старшей возрастной группы повышение уровня общего тестостерона может быть обусловлено увеличением секреции ГСПГ и не сопровождаться повышением уровня свободного тестостерона. У молодых пациентов клинические проявления гиперандрогении могут отличаться: для пациентов с повышенным уровнем ДГТ характерна андрогенная алопеция; акне характерно для мужчин с повышенным уровнем общего и свободного тестостерона, а повышение ДГТ усугубляет эту проблему.
Keywords: гиперандрогения, тестостерон, дигидротестостерон, мужчины
BACKGROUND: Today the problem of hyperandrogenism in women is a widely studied and discussed while same issue in relation to men is barely raised. In clinical practice, hyperandrogenism can be the cause of a number of diseases.AIM: Provide characterization the variations of physiological hyperandrogenism in men.MATERIALS AND METHODS: Сontinuous cross-sectional study of 100 men with hyperandrogenism. The study assessed the volume and structure of the prostate, the volume of the testicles; the levels of luteinizing hormone (LH), total testosterone, sex hormone binding globulin (SHBG) were determined with further calculation of the level of free testosterone according to Vermeullen, and dihydrotestosterone (DHT). Based on the results of the analysis of the hormonal status of patients with hyperandrogenism, 4 groups of patients were formed: 1-patients with increased total testosterone and SHBG levels; 2-patients with elevated total testosterone levels and normal SHBG levels; 3-patients with an increased level of total testosterone, DHT with a normal level of SHBG; 4-patients with an increased level of DHT with normal levels of total testosterone and SHBG. The difference between groups of patients was determined, a p-value <0.05 was considered statistically significant.RESULTS: The age and volume of the prostate in group 1 patients were statistically significantly higher than in the other groups. This group, despite the high level of total testosterone, was not characterized by complaints of acne. Group 2 patients complained of acne more often, but the prevalence of this symptom even in this group was statistically significantly lower than in group 3 patients. At the same time, the frequency of occurrence of alopecia was statistically significantly lower in group 2 than in patients of both groups 3 and 4. Patients of group 3 had the most striking clinical manifestations of hyperandrogenism. Group 4 was characterized by alopecia.CONCLUSION: An increase of androgen levels can be detected at any age. At the same time, in men of the older age group, an increase in the level of total testosterone may be due to an increase in the secretion of SHBG and not be accompanied by an increase in the level of free testosterone. In young patients, the clinical manifestations of hyperandrogenism may differ: patients with elevated DHT levels are characterized by androgenic alopecia; acne is common in men with elevated total and free testosterone levels, and increased DHT exacerbates the problem.
Термин «гиперандрогения» подразумевает избыточный синтез андрогенных гормонов [1]. Несмотря на то что подобное состояние может развиваться у лиц обоего пола, в настоящее время это понятие используется преимущественно по отношению к женщинам. Сегодня проблема гиперандрогении у женщин — широко изучаемый и обсуждаемый вопрос, затрагивающийся на каждой конференции репродуктивного здоровья, в то время как по отношению к мужчинам этот вопрос практически не затрагивается.
Если рассматривать гиперандрогению как самостоятельную нозологическую единицу, то можно условно выделить физиологическую гиперандрогению — обусловленную гиперпродукцией тестостерона и/или дигидротестостерона (ДГТ) при нормальном уровне лютеинизирующего гормона (ЛГ) и патологическую — сопровождающуюся подавлением ЛГ, обусловленным серьезной сопутствующей соматической патологией надпочечников, яичек или приемом лекарственных средств с андрогенным эффектом, анаболических стероидов [2]. Отдельным видом гиперандрогении является повышение андрогенов у мужчин с андрогенпродуцирующими опухолями яичек или надпочечников [3][4]. В нашем исследовании охарактеризованы варианты физиологической гиперандрогении у мужчин.
Охарактеризовать варианты физиологической гиперандрогении у мужчин.
Место и время проведения исследования
ФГБУ «НМИЦ эндокринологии» Министерства здравоохранения РФ, Москва. Исследование выполнено в период с сентября 2020 г. по январь 2021 г.
Изучаемые популяции
Формирование групп проводилось из пациентов, обратившихся за медицинской помощью в ФГБУ «НМИЦ эндокринологии» Министерства здравоохранения РФ.
Критериями включения являлись мужской пол; возраст старше 18 лет; повышенные уровни общего тестостерона и/или ДГТ; нормальный уровень ЛГ.
Критериями невключения являлись новообразования гипоталамо-гипофизарной области, яичек, надпочечников; врожденная дисфункция коры надпочечников; использование любых препаратов из групп антиэстрогенов, эстрогенов, гестагенов, ингибиторов ароматазы, антиандрогенов, гонадотропинов, анаболических стероидов, ингибиторов стероидогенеза; алкоголизм/наркомания; сахарный диабет 1 и 2 типов; синдром гиперкортицизма.
Критерии исключения — не предусматривались.
Всего в исследование были включены 100 пациентов, возраст 26 (минимум 18; максимум 58) лет.
Способ формирования выборки из изучаемой популяции
Выборка формировалась сплошным способом.
Дизайн исследования
Сплошное одномоментное исследование мужчин с повышенным уровнем общего тестостерона и/или ДГТ.
Методы
При проведении исследования оценивались объем и структура простаты, объем яичек с помощью УЗИ на аппарате Aplio 500 № 416508; определялись уровни ЛГ (норма 2,5–11,0 ЕД/л), общего тестостерона (норма 12,0–30,0 нмоль/л), глобулина, связывающего половые гормоны (ГСПГ) (норма 12–65 нмоль/л), ДГТ (норма 250–990 пг/мл) на автоматическом анализаторе Vitros ECi (Johnson and Johnson (Великобритания)) методом усиленной хемилюминесценции. Уровень свободного тестостерона определялся расчетным методом по Vermeullen (норма 243–900 пмоль/л) [5]. Анализ гормонального статуса пациентов с гиперандрогенией позволил сформировать 4 группы пациентов по лабораторным признакам.
1. Пациенты с повышенным уровнем общего тестостерона и ГСПГ (n=12).
2. Пациенты с повышенным уровнем общего тестостерона и нормальным уровнем ГСПГ (n=15).
3. Пациенты с повышенным уровнем общего тестостерона, ДГТ при нормальном уровне ГСПГ (n=11).
4. Пациенты с повышенным уровнем ДГТ при нормальных уровнях общего тестостерона и ГСПГ (n=62).
Статистический анализ
Принципы расчета размера выборки
Исследование пилотное. Размер выборки предварительно не рассчитывался.
Методы статистического анализа данных
Полученные данные обработаны с использованием пакета статистических программ STATISTICA 13.0 (StatSoft Inc., США) [6]. Различия между группами определялись с использованием U-критерия Манна–Уитни для количественных признаков и точного критерия Фишера — для качественных. Различия между группами считались статистически значимыми при р<0,05.
Этическая экспертиза
Исследование одобрено Локальным этическим комитетом ФГБУ «НМИЦ эндокринологии» Минздрава России (протокол № 17 от 28.10.2020).
При сравнении групп были выявлены статистически значимые различия в ряде показателей (). Первая группа пациентов статистически значимо отличалась от остальных групп пациентов более старшим возрастом, также для этих пациентов было характерно наличие избыточной массы тела. Объем простаты мужчин этой группы статистически значимо превышал таковой у мужчин других групп. Кроме того, для этой группы пациентов, несмотря на высокий уровень общего тестостерона (уровень свободного тестостерона был статистически значимо ниже по сравнению с таковым у пациентов 2-й и 3-й группы, но выше, чем у мужчин 4-й группы), не было характерно наличие жалоб на акне. Алопеция также встречалась редко.
Таблица 1. Характеристика групп пациентов с гиперандрогенией. Представлены медианы и границы интерквартильного отрезка
| Параметр | 1 гр. (n=12) | 2 гр. (n=15) | 3 гр. (n=11) | 4 гр. (n=62) | 1–2 | 1–3 | 1–4 | 2–3 | 2–4 | 3–4 |
| Возраст | 50[ 46; 55 ] | 23[ 20; 25 ] | 23[ 21; 25 ] | 27[ 25; 28 ] | <0,001 | <0,001 | <0,001 | 0,83 | <0,001 | <0,001 |
| ИМТ, кг/м2 | 27,2[ 26,3; 27,8 ] | 24,2[ 23,2; 26,4 ] | 24,1[ 22,9; 25,4 ] | 24,8[ 23,2; 27,1 ] | 0,002 | 0,006 | 0,005 | 0,85 | 0,47 | 0,54 |
| Билатеральный объем яичек, мл | 20[ 18; 22 ] | 22[ 19; 24 ] | 21[ 20; 23 ] | 22[ 20; 23 ] | 0,34 | 0,41 | 0,22 | 0,79 | 0,92 | 0,77 |
| Объем простаты, мл | 26[ 24; 29 ] | 18[ 16; 19 ] | 20[ 18; 22 ] | 18[ 17; 21 ] | <0,001 | <0,001 | <0,001 | 0,07 | 0,60 | 0,12 |
| ЛГ, ЕД/л | 3,7[ 3,0; 4,5 ] | 4,2[ 3,3; 5,0 ] | 4,0[ 2,9; 4,6 ] | 3,9[ 3,1; 4,9 ] | 0,51 | 0,83 | 0,61 | 0,44 | 0,69 | 0,49 |
| ГСПГ, нмоль/л | 79,4[ 74,7; 91,1 ] | 32,9[ 26,7; 45,3 ] | 30,6[ 23,2; 38,1 ] | 29,1[ 23,4; 37,8 ] | <0,001 | <0,001 | <0,001 | 0,39 | 0,18 | 0,88 |
| Общий тестостерон, нмоль/л | 38,2[ 36,1; 42,9 ] | 36,2[ 34,9; 38,2] | 38,1[ 34,9; 39,4 ] | 15,8[ 13,6; 19,3 ] | 0,09 | 0,41 | <0,001 | 0,21 | <0,001 | <0,001 |
| Свободный тестостерон, пмоль/л | 505[ 421; 590 ] | 929[ 757; 1000 ] | 1000[ 910; 1100 ] | 369[ 288; 448 ] | <0,001 | <0,001 | <0,001 | 0,148 | <0,001 | <0,001 |
| ДГТ, пг/мл | 700[ 645; 836 ] | 789[ 720; 890 ] | 2805[ 1980; 3621 ] | 2496[ 2208; 2896 ] | 0,06 | <0,001 | <0,001 | 0,001 | <0,001 | 0,26 |
| Акне, % | 0 | 67 | 100 | 31 | <0,001 | <0,001 | 0,029 | 0,05 | 0,016 | <0,001 |
| Алопеция % | 25 | 13 | 82 | 93 | 0,63 | 0,012 | <0,001 | <0,001 | <0,001 | 0,22 |
| Изменения простаты объемные, % | 8 | 0 | 0 | 0 | <0,001 | 0,001 | <0,001 | 1,0 | 1,0 | 1,0 |
| Изменения простаты диффузные, % | 25 | 13 | 18 | 18 | 0,63 | 1,0 | 0,69 | 1,0 | 1,0 | 1,0 |
Напротив, пациенты 2-й группы предъявляли жалобы на акне, но распространенность этого симптома даже в этой группе являлась статистически значимо более низкой, нежели у пациентов 3-й группы. При этом частота встречаемости алопеции была существенно ниже, чем у пациентов как 3-й, так и 4-й групп.
Пациенты с повышенным уровнем общего тестостерона и ДГТ (3-я группа) имели самые яркие клинические проявления гиперандрогении. Все пациенты из этой группы предъявляли жалобы на наличие акне, а также на усиленное выпадение волос на голове.
Для пациентов 4-й группы также была характерна алопеция. Жалобы на наличие акне присутствовали, но их частота статистически значимо различалась по сравнению с 1-й группой в сторону увеличения, а по сравнению с другими группами — в сторону уменьшения. Для мужчин 4-й группы были характерны статистически значимо меньшие уровни свободного тестостерона по сравнению с пациентами других групп.
Репрезентативность выборок
Оценить репрезентативность выборки по отношению к общей популяции не представляется возможным, поскольку формирование выборки проводилось сплошным методом из пациентов, наблюдавшихся только в федеральном научном центре.
Сопоставление с другими публикациями
В клинической практике гиперандрогения может быть причиной развития ряда заболеваний [7]. Повышение уровня тестостерона, ДГТ или генетически обусловленная чувствительность рецепторов к андрогенам может приводить к развитию такого заболевания, как андрогенная алопеция [8]. В нашем исследовании она была выявлена у мужчин с повышенным уровнем ДГТ вне зависимости от уровня тестостерона, что согласуется с современной концепцией влияния повышенного уровня ДГТ на развитие андрогенной алопеции [9]. Так, в исследовании H. Schweikert и соавт. было продемонстрировано, что волосяные фолликулы и кожа волосистой части головы больных андрогенной алопецией содержат ДГТ в более высоких концентрациях, чем образцы здоровых тканей [10]. При определении концентрации ДГТ и тестостерона у 52 пациентов обоих полов с ранней андрогенной алопецией статистически значимого повышения обнаружено не было, однако авторы выявили существенное увеличение соотношения ДГТ/тестостерон [11].
Еще одним заболеванием, в развитии которого большое значение может иметь гиперандрогения, является угревая болезнь [12]. Под воздействием андрогенов увеличивается объем кожного сала, в котором снижается концентрация незаменимой альфа-линоленовой кислоты — основного регулятора дифференцировки кератиноцитов протока сально-волосяного фолликула, что проявляется появлением открытых и закрытых комедонов и создает благоприятные условия для размножения микрофлоры [13]. По результатам проведенного исследования акне было характерно для мужчин с повышенным уровнем общего и свободного тестостерона, при этом наличие повышенного уровня ДГТ приводило к увеличению распространенности акне, вплоть до 100% случаев. Однако эта ситуация не распространялась на мужчин из 1-й группы, поскольку у них повышенный уровень общего тестостерона, строго говоря, не был признаком гиперандрогении, а обусловлен повышением уровня ГСПГ. При этом уровень свободного тестостерона, который отражает степень андрогенной насыщенности организма, был статистически значимо ниже, чем наблюдаемый во 2-й и 3-й группах. Хотя уровень этого показателя статистически значимо превышал таковой в 4-й группе, величины уровня свободного тестостерона, полученные у мужчин как 1-й, так и 4-й групп, находились в пределах референсных значений. Повышение уровня ГСПГ характерно для мужчин старшей возрастной группы, при этом в пожилом возрасте у мужчин оно чаще приводит к развитию дефицита тестостерона [14]. В случае если у пациентов с возрастом секреция общего тестостерона не нарушается, то и повышение ГСПГ не приводит к дефициту свободного тестостерона — он остается в пределах референсных значений.
Характерным признаком пациентов 1-й группы также было увеличение объема предстательной железы, что может объясняться возрастом пациентов. Исследователями было продемонстрировано наличие ассоциации между возрастом мужчины и развитием доброкачественной гиперплазии предстательной железы [15]. У молодых пациентов, включенных в наше исследование, несмотря на повышенные уровни андрогенов, каких-либо изменений объема или структуры предстательной железы выявлено не было.
Клиническая значимость результатов
Полученные результаты имеют значение для клинической практики, поскольку позволяют производить дифференциальную диагностику различных вариантов гиперандрогении, что необходимо для персонификации лечения. Выявление при обследовании пожилых мужчин повышенного уровня общего тестостерона обуславливает необходимость оценки уровня ГСПГ с дальнейшим расчетом уровня свободного тестостерона, что при получении величин этого показателя, укладывающихся в референсный интервал, позволит исключить гиперандрогению у пациента.
Ограничения исследования
Ограничениями исследования являются проблемы с репрезентативностью выборки в отношении общей популяции (сформирована только из пациентов крупного федерального центра), а также использование в исследовании не прямого метода определения свободного тестостерона, а расчетной методики.
Направления дальнейших исследований
В продолжение проведенного исследования планируется изучить факторы риска, характерные для разных вариантов гиперандрогений, связанные со стероидогенезом.
Повышение уровня андрогенов может выявляться в любом возрасте. При этом у мужчин старшей возрастной группы повышение уровня общего тестостерона может не свидетельствовать о гиперандрогении, а обусловливаться увеличением секреции ГСПГ и не сопровождаться повышением уровня свободного тестостерона. У молодых пациентов клинические проявления гиперандрогении зависят от ее варианта. Так, для пациентов с повышенным уровнем ДГТ была характерна андрогенная алопеция. Акне было характерно для мужчин с повышенным уровнем общего и свободного тестостерона, хотя повышение ДГТ также усугубляло эту проблему.
The authors declare that there are no conflicts of interest present.
Белок плазмы крови, участвующий в связывании и транспорте половых гормонов.
Имеется несколько синонимов названия этого белка: секс-стероид связывающий глобулин, андроген-связывающий глобулин, половой стероид-связывающий глобулин, sex hormone-binding globulin. Этот гликопротеин, синтезирующийся в печени; молекулярный вес его около 80 000 - 100 000 дальтон, молекула имеет 1 связывающий участок для стероидных гормонов. ГСПГ связывает тестостерон и 5-дигидротестостерон с высоким сродством и эстрадиол несколько слабее.
Тестостерон циркулирует преимущественно в виде связанного с ГСПГ, в меньшей степени с альбумином и кортизол-связывающим глобулином. Поскольку вариации содержания белков-переносчиков могут влиять на концентрацию тестостерона в циркуляции, содержание ГСПГ обычно определяют в дополнение к измерению общего тестостерона. Уровень синтеза ГСПГ в печени зависит от половых гормонов: эстрогены увеличивают, а андрогены снижают его продукцию. Поэтому содержание ГСПГ у женщин почти вдвое выше, чем у мужчин. При снижении продукции эстрадиола общее содержание гормона и концентрация свободного гормона в крови снижаются параллельно.
При снижении продукции андрогенов увеличение продукции ГСПГ обуславливает сохранение на постоянном уровне общего тестостерона, хотя концентрация свободного гормона снижается. Поэтому уровень общего тестостерона плазмы может быть парадоксально нормальным при ранних стадиях тестикулярных заболеваний. Сниженные уровни ГСПГ часто находят при гирсутизме, acne vulgaris и синдроме поликистозных яичников. При гирсутизме описывают снижение ГСПГ примерно у 30% обследованных женщин.
Уровень ГСПГ на поздних стадиях беременности или после введения эстрогенов может быть существенно увеличен. Введение андрогенов часто сочетается со сниженным уровнем ГСПГ. Индекс свободного тестостерона (Free androgen index, FAI), рассчитывающийся как отношение общего тестостерона к ГСПГ в %, коррелирует с содержанием биологически доступного свободного тестостерона и применяется в качестве полезного индикатора патологического статуса андрогенов.
После 60 лет содержание ГСПГ растёт примерно на 1,2% в год, таким образом, с возрастом уровень биологически доступного тестостерона снижается в большей степени, чем уровень общего тестостерона.
Подготовка:
Между последним приёмом пищи и взятием крови проходит не менее 8 часов (желательно - не менее 12 часов).
Показания:
У обоих полов
У женщин
У мужчин
Повышение уровня ГСПГ:
Снижение уровня ГСПГ:
Тестостерон – ключевой андроген, который несет ответственность за формирование мужского организма и влияет на репродуктивную функцию - принимает участие в процессе сперматогенеза.
Оволосение согласно мужскому типу, грубый тембр голоса - это всё «заслуга» тестостерона. Кроме того, он увеличивает плотность костных тканей, обладает жиросжигающим эффектом и увеличивает объемы мышечной массы за счет ускорения процессов синтеза белка.Тестостерон усиливает половое влечение мужчин и может становиться причиной высокой агрессивности. Наиболее активный андроген — свободный тестостерон, вырабатывается клетками семенников, является продуктом периферического метаболизма. Небольшой биосинтез данного гормона возможен корой надпочечников.
При завышенных показателях тестостерона нередко наблюдаются следующие проявления:
- внезапные и сильные приступы гнева;
- избыточное оволосение тела;
- угревые гнойные высыпания.
Если тестостерона недостаточно, то существует риск формирования остеопороза, снижение либидо, ухудшение интеллектуальной деятельности, возникновение эректильных дисфункций и мужского бесплодия.
Чтобы получить достоверную картину о мужском гормональном статусе при подозрении на бесплодие, необходимо проверить не только уровень андрогенов, но и целого ряда других гормонов.
Определение гормонального статуса обязательно включает выявление уровня концентрации следующих гормонов:
- ФСГ;
- тестостерон;
- ЛГ.
К сведению В яичках у мужчин есть два вида клеток: клетки Сертоли и клетки Лейдига. В клетках Лейдига происходит синтез мужских половых гормонов, в клетках Сертоли – сперматозоидов. Эти процессы регулируются гормонами гипофиза, расположенного в головном мозге - фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ).
ФСГ – это основной регулятор сперматогенеза, его уровень в крови показывает, способны ли яички производить нормальные сперматозоиды.
ЛГ – это основной и единственный стимулятор производства и секреции тестостерона в клетках Лейдига яичек. Гормон гипофиза пролактин воздействует вместе с ЛГ на клетки Лейдига и участвует в процессе сперматогенеза. При повышении его уровня в крови – так называемом синдроме гиперпролактинемии – происходит подавление выработки тестостерона и, соответственно, сперматогенеза.
Тиреотропный гормон ТТГ – другой гормон гипофиза, в норме активатор синтеза пролактина. При некоторых заболеваниях щитовидной железы может повышаться уровень пролактина, и как следствие, снижаться уровень общего тестостерона.
Пролактин отвечает за то, чтобы яички успешно выполняли свою сперматогенную функцию. При нормальном уровне гормона они продуцируют достаточное количество сперматозоидов с правильным строением и подвижностью, достаточной для проникновения в женскую яйцеклетку и ее оплодотворения.
Эстрадиол - гормон, который синтезируется в яичках и в жировой ткани, участвует в регуляции синтеза ФСГ и ЛГ, и в норме также необходим для нормального созревания сперматозоидов. Повышение уровня эстрадиола в крови – гиперэстрогенемия, приводит к снижению синтеза ФСГ и ЛГ. Гиперэстрогенемия возможна при заболеваниях яичек и при ожирении.
ГсПГ – это белок глобулин, который образуется в печени, и при некоторых заболеваниях и состояниях, сопровождающихся поражением печени, может происходить снижение уровня ГсПГ, и, соответственно, уровня общего тестостерона. Происходит это также при сахарном диабете второго типа и при ожирении.
Кроме того при ожирении происходит снижение чувствительности клеток к тестостерону, а также снижается синтез ЛГ в гипофизе. В жировой ткани содержится фермент ароматаза, за счет которой тестостерон превращается в эстрадиол, и, как следствие уровень общего тестостерона снижается.
Макрофаги представляют собой иммунные клетки, а пенистые клетки представляют собой макрофаги, поглотившие окисленные липопротеины низкой плотности (ЛПНП).ЛПНП называется плохой холестерин. Бляшка, особенно нестойкая, состоит из макрофагов и пенистых клеток.
Участники проекта использовали культуры мышиных макрофагов и соответствующие мышиные модели для идентификации молекул, участвующих в их образовании. Одной особенно полезной моделью является мышь с отрицательным рецептором ЛПНП (LDLR), у которой ген биосинтеза N-деацетилазы/N-ацетилглюкозамин-N-сульфотрансферазы 1 (Ndst1) неактивен.
Роль протеогликанов гепарансульфата макрофагов (HSPG) исследовали на мышах с дефицитом Ndst1.У этих мышей сульфатирование HSPG было снижено на 30%. Их скрещивали с мышами, лишенными LDLR, и их потомство получали диету с высоким содержанием жиров для дальнейшего анализа бляшек и макрофагов. Наблюдалось двукратное увеличение атеросклеротических бляшек и прогрессирующие атеросклеротические поражения с явно более высоким содержанием макрофагов.
Снижение сульфатации также повышает экспрессию воспалительных генов, в частности ACAT2. Повышение уровня АСАТ приводило к увеличению активности фермента АСАТ и усилению образования пенистых клеток.Снижение сульфатирования HSPG в макрофагах также увеличивает передачу сигналов интерферона типа I.
Результаты показывают, что HSPG макрофагов защищает артерии и поддерживает относительную неактивность рецептора интерферона типа 1. Дальнейшие исследования показали, что другой протеогликан (синдекан-4) влияет на преобразование пенистых клеток и изменения в адипоцитах HS, которые сыграли значительную роль в ожирении, вызванном диетой.
Результаты, полученные партнерами по проекту, демонстрируют защитную роль HSPG макрофагов и показывают, как изменения в сульфурировании HSPG могут влиять на сердечно-сосудистые заболевания, связанные с атеросклерозом.Это должно способствовать созданию маркеров для диагностики и мониторинга прогрессирования атеросклероза, ассоциированного с ССЗ, а также определения эффективности лечения.
Источник: www.cordis.europa.eu
Пожалуйста, ознакомьтесь с информацией об обработке персональных данных на Сайте.
Нажимая на кнопку «Перейти на сайт» или закрывая это окно кнопкой «x», вы даете согласие на обработку ваших персональных данных, как описано ниже. Поэтому мы просим вас прочитать эту информацию и сделать осознанный выбор, прежде чем вы зайдете на Веб-сайт.
На что ты согласен?
На этом веб-сайте мы используем файлы cookie (так называемые «файлы cookie») для статистических целей, чтобы обеспечить безопасность на Веб-сайте, улучшение наших услуг, запоминание тех, которые вы выбираете настройки, чтобы упростить использование веб-сайта. Используя наш веб-сайт, без изменения настроек веб-браузера для автоматической обработки файлов cookies, вы даете согласие на их хранение в памяти вашего устройства для указанных целей ниже.В этом случае этот веб-сайт установит файлы cookie, как только он загрузится. Помните, что вы можете самостоятельно управлять файлами cookie и отозвать свое согласие на их использование в любое время. хранения на вашем устройстве. Дополнительная информация о файлах cookie и правилах обработки персональные данные и их объем можно найти в нашей Политике конфиденциальности.
Мы используем предоставленный инструмент Smartlook для сохранения путей взаимодействия с нашим Веб-сайтом. через Smartlook Lidicka 2030/20, 602 00 Брно, Чехия.Это средство, которое спасает активности пользователей на нашем веб-сайте и позволяет им воспроизводить свое поведение во время сеанса. благодаря записи. Собранные ими данные анализируются нашими программистами с целью повышения качества предоставляемых нами услуг, адаптируя Веб-сайт к потребностям Пользователей, в том числе проверка ошибок и решение технических проблем. Они собираются с помощью инструмента Smartlook. информация об активности Пользователей на нашем Веб-сайте, т. е. дата и время посещений, открытых подстраницы и количество кликов.
Вы не хотите, чтобы Smartlook записывала вас, помните, что вы можете отказаться от мониторинга, ранее выраженное в любое время отозвать на сайте https://www.smartlook.com/opt-out или https://medicalprogress.pl/polityka-prywatnosci. Вы можете дать согласие на мониторинг Smartlook вашей активности на веб-сайте, отказаться от его выражения и отозвать свое согласие, вы также можете в Настройки.
Что вы получаете?
Лучшее качество страницы. Мы показываем вам более качественный контент, и благодаря собранным данным мы можем постоянно его улучшать.
С нами ваши данные в безопасности. Вы можете отозвать свое согласие на обработку данных в любое время. Вы можете прочитать больше в Политике конфиденциальности.
Кто является контролером ваших персональных данных и каких данных касается их обработка?
Администратором ваших персональных данных в связи с использованием Сайта являемся мы, т.е.Медицинский Прогресс Роберта Вебера со штаб-квартирой во Вроцлаве по адресу: Аллея Кастанова 3а-5, 53-125 Вроцлав (Медикал Прогресс).
Для обработки могут использоваться, в частности, следующие данные: ваш IP-адрес, тип браузеры, тип операционной системы, дата и время использования Сайта, количество подключений, открытых Подстраницы веб-сайта, количество кликов, а также другая информация об использовании страниц. веб-сайты Сайта, полученные на основе файлов cookie и приложения Smartlook.Более информацию об объеме обрабатываемых данных можно найти в нашей Политике конфиденциальности.
Какова цель обработки ваших данных?
Мы будем обрабатывать ваши данные, полученные на нашем Веб-сайте, с помощью файлов cookie с целью: предоставление возможности использования Веб-сайта, улучшение качества наших услуг и их адаптация к потребностям Пользователей, сбор информации о том, как использовать Веб-сайт, персонализация пользовательского интерфейса, проверка ошибок и решение технических проблем, обеспечение безопасности, т.е.для обнаружения мошенничества при аутентификации в Веб-сайт, а также для статистических целей прямой маркетинг собственных продуктов или услуг и отстаивать наши требования и защищать наши права [узнать больше] (основа: наш законный интерес).
Мы будем обрабатывать данные, полученные на нашем Веб-сайте, с помощью приложения Smartlook с целью улучшение качества предоставляемых услуг, адаптация Сайта к потребностям Пользователей, проверка ошибок и решение технических проблем [узнать больше] (основание: ваше согласие).
Вы можете управлять своим согласием, включая его отзыв, на странице https://www.smartlook.com/opt-out. или https://medicalprogress.pl/polityka-prywatnosci. Подробности о предоставлении согласия и его отзыве, а также об отказе в согласии можно найти в Настройках.
Для некоторых наших сервисов основанием для обработки ваших персональных данных может быть согласие, о котором вы всегда будете проинформированы.
Подробная информация о правилах обработки персональных данных физических лиц, использующих Сайт, содержится в Политике конфиденциальности.
Каковы ваши права в отношении обработки персональных данных?
Вы имеете право доступа к своим данным и право требовать их исправления, удаления, передавать или ограничивать их обработку.
В той мере, в какой основанием для обработки ваших персональных данных является правовая предпосылка законные интересы администратора, вы имеете право возражать против обработка ваших персональных данных. В частности, вы имеете право возражать против обработка данных в целях прямого маркетинга.
В той мере, в какой основанием для обработки ваших персональных данных является согласие, вы имеете право отозвать согласие.Отзыв согласия не влияет на законность обработки, которая осуществлялась на основании согласия до его отзыва.
Вы также имеете право подать жалобу в надзорный орган, занимающийся вопросами безопасности. персональных данных, который является председателем Управления по защите персональных данных.
Дополнительная информация о правах, связанных с обработкой ваших персональных данных на Сайте можно найти в Политике конфиденциальности.
К кому можно обратиться для получения дополнительной информации об обработке персональных данных компанией «Медикал Прогресс»?
Если у вас есть вопросы, связанные с обработкой ваших персональных данных на Сайте, вы можете свяжитесь с нами по электронной почте по следующему адресу: [email protected].
.1 ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НЕПРАВИЛЬНЫМ ОБМЕНОМ СЛОЖНЫХ ЛИПИДОВ
2 Сфинголипидозы Сфинголипидозы — группа лизосомных болезней накопления, обусловленных генетической недостаточностью лизосомальных ферментов, приводящих к изменениям катаболизма сфинголипидов.Существует три основных класса, которые включают: сфингомиелин: полученные из церамида с фосфорилхолином в качестве гидрофильной группы Цереброзиды: полученные из церамида с одним остатком сахара (галактоза или глюкоза) Ганглиозиды: полученные из церамида с олигосахаридной цепью и одной или несколькими сиаловыми кислоты.
3
4 Болезнь Гоше Наиболее частая лизосомальная болезнь накопления липидов Тип I – наиболее частая форма (связанная с нормальной продолжительностью жизни) Патогенез: дефицит β-глюкоцереброзидазы (β-глюкозидазы) накопление глюкоцереброзида в головном мозге, печени, селезенке Они различаются в зависимости от точного подтипа болезни Гоше: Тип I: хроническая ненейронопатическая болезнь Гоше (1/рождение) Тип II: острая нейропатическая болезнь Гоше (1/рождение) Тип III: подострая нейропатическая болезнь Гоше (1/рождение) Все типы: Гепатоспленомегалия Кости: ломкость, остеопороз длинных костей, некроз бедра Нарушения со стороны крови: анемия, тромбоцитопения Легочные симптомы Задержка роста
5 Сфинголипидоз
6 Болезнь Гоше Тип I или клеток Гоше), что приводит к увеличению их количества и к пролиферации клеток, изменению их структуры и функции Субстрат, поступающий в макрофаги в больших количествах, поступает в основном из клеточных мембран (фагоцитоз) Увеличение селезенки и печени II Тип Острый нейродегенерация: субстрат образуется из ганглиозидов, синтезируемых в нейронах, накапливается в ЭПР, повреждает кальциевые каналы, гибель нервной клетки. Смерть до 2 лет. Тип III: постепенное появление симптомов, включая нейродегенерацию. фибробластахброз лейкоциты или фибробласты Клетки Гоше: богатые липидами макрофаги с увеличенной цитоплазмой с морщинистыми тканеподобными включениями под микроскопом Лечение: рекомбинантная глюкоцереброзидаза
7 Цитоплазма клеток Гоше приобретает вид смятого листа бумаги за счет увеличения и удлинения лизосом, заполненных глюкоцереброзидом.Болезнь Гоше Увеличение печени и селезенки, остеолитические дефекты длинных костей, умственная отсталость у детей.
8 Болезнь Нимана-Пика Этиология: наследственное аутосомно-рецессивное заболевание Эпидемиология: чаще встречается у еврейского населения ашкенази Патогенез: Типы А и В: генетический дефицит сфингомиелиназы накопление сфингомиелина Тип С: дефектные белки NPC (главным образом NPC1) отложение неэтерифицированного холестерина и гликозилированного холестерина эндосомно-лизосомальный компартмент клеток Клинические признаки: Тип А - младенческий нейропатический: поражение нервной системы и кахексия Смерть в первые годы жизни Тип В ненейронопатический, хронический (у больных сохраняется остаточная активность сфингомиелиназы): патологический процесс поражает преимущественно макрофаги, включая весь ретикуло-эндотелиальный Гепатоспленомегалия Тип С (1/рожденных) смерть в возрасте до 12 лет: Патологический процесс затрагивает как макрофаги, так и нервную систему Гепатоспленомегалия Неврологические симптомы: снижение мышечного тонуса и задержка развития двигательных функций Прогрессирующая нейродегенерация (тип А и С) Желто-вишневое пятно на сетчатке Диагностика Световая микроскопия: нагруженные липидами макрофаги (пенистые клетки) в костном мозге, селезенке и печени Электронная микроскопия: зебровые тельца, являются аномальной конфигурацией миелиноидных мембран в виде параллельных палисадных бляшек в лизосомоподобных органеллах (ang.лизосомоподобные запасающие органеллы) Лечение: в основном поддерживающее
9 Сфинголипидоз
10 БОЛЕЗНЬ НИМАННЫ-ПИККА Дефицит сфингомиелиназы Увеличение печени и селезенки, заполненных липидами Тяжелая умственная отсталость и нейродегенеративный вид, смерть в раннем детстве (тип А) сфингомиин. Для типов А и В уровни сфингомиелиназы можно измерить в образце крови.Чтобы диагностировать тип C, образец кожи может помочь определить, затронут ли переносчик с помощью филиппинского теста, который обнаруживает накопление неэтерифицированного холестерина посредством флуоресцентного окрашивания.
11 Метахроматическая лейкодистрофия Этиология: наследственное заболевание, аутосомно-рецессивное Патогенез: Дефицит арилсульфатазы А (отщепляет остатки сульфата от сфинголипидов) Накопление цереброзида сульфата в нервной и ненейрональной ткани демиелинизация центральной и периферической клиническая заторможенность нервной системы: Заторможенная нервная система. Память Атаксия (нарушение координации тела) Гипотензия и гипорефлексия (частичная потеря рефлексов) Атрофия зрительного нерва Потеря зрения Вялый паралич (вызванный поражением периферических нервов) с последующим спастическим параличом (большие участки тела) Детский и подростковый возраст: Атаксия Деменция Периферическая невропатия Лечение : поддерживающая в связи с неспособностью ферментного белка преодолевать гематоэнцефалический барьер
12 Сфинголипидоз
13 Сфинголипидоз История болезни I Восьмимесячного мальчика родители направили к врачу с запах постепенной потери контроля над шеей и неспособность перевернуться в течение последних 2 месяцев.За это время у него было несколько эпизодов отсутствия реакции с пустым взглядом и трепетом век. Его родители говорят, что иногда он не оборачивается, когда его окликают, но его пугают громкие звуки. Не поддерживает зрительный контакт. В возрасте 5 месяцев он может переворачиваться с живота на спину и еще не начал сидеть или ползать. Его родители еврейского происхождения ашкенази. Неврологический осмотр показывает генерализованную гипотензию. Глубокие рефлексы (сухожилия) оцениваются на 3+ с обеих сторон.Подошвенный рефлекс показывает двусторонний разгибательный ответ. Офтальмоскопия показывает ярко-красные пятна с обеих сторон (так называемый эффект вишни). Остальные тесты не показывают каких-либо отклонений. Что из следующего является наиболее вероятной причиной симптомов у этого пациента?
14 Сфинголипидозы История болезни I, вопросы A. Дефицит сфингомиелиназы B. Мутация транспортера кассеты, связывающей АТФ C. Дефицит арилсульфатазы A D D. Дефицит α-галактозидазы A E. Дефицит галактоцереброзидазы F.Дефицит β-гексоаминидазы А
15 Сфинголипипидоз Болезнь Тея-Сакса, симптомы F. Дефицит β-гексоаминидазы А У младенца наблюдаются следующие симптомы: задержка развития регресс достигнутых вех (неспособность переворачиваться, несмотря на достижение этой вехи тремя месяцами ранее) приступы игнорирование (эпизоды невосприимчивости пустых глаз) снижение зрительного контакта гипотония чрезмерная реакция на удивление в результате слуховой гиперчувствительности постепенная потеря слуха (отсутствие реакции на зов) двусторонние ярко-красные (вишнево-красные) пятна на сетчатке глаза
16 Сфинголипидоз История болезни I, правильный ответ F.Дефицит β-гексоаминидазы А Дефицит β-гексоаминидазы А является причиной болезни Тея-Сакса, редкого неврологического заболевания, вызывающего внутриклеточное накопление ганглиозидов GM2 в нервных клетках, что приводит к прогрессирующей нейродегенерации, начинающейся примерно в возрасте 6 месяцев с началом обледенения воздействие на сетчатку глаза. Распространенность этого заболевания у лиц еврейского происхождения ашкенази чаще обусловлена двумя факторами: 1) эффектом основателя (американские евреи-ашкенази происходят из небольших групп, приехавших в Америку в середине XIX века) и 2) сильная культурная изоляция.Терапии нет, и лечение в основном поддерживающее. Обычно больные умирают от респираторных инфекций в возрасте до 5 лет.
17 Сфинголипидоз Случай I, нормальная реакция β-гексоаминидазы А Существует два изофермента: А и В. Дефицит изофермента А вызывает болезнь Тея-Сакса, а недостаток обеих изоформ приводит к развитию болезни Сандхоффа. Наиболее распространенная форма болезни Тея-Сакса связана с мутацией гена HEXA, расположенного на хромосоме 15, кодирующего α-субъединицу.Эта мутация продуцирует терминирующий кодон, а у гомозиготных пациентов гексоаминидаза вообще отсутствует. Наследование одной копии мутантного и одного нормального гена приводит к носительству. Обычно у таких людей не развиваются клинические симптомы заболевания. По оценкам, в Польше средний показатель живорождений составляет 1 или даже меньше. Лишь значительный рост заболеваемости регистрируется в еврейской популяции ашкенази, где в среднем каждые 30 человек являются носителями дефектного гена, а частота заболевания составляет 1 случай на 300.
18 Сфинголипидоз Дефицит β-гексоаминидазы А У здоровых людей гексоаминидаза А присутствует во всех тканях, включая кровь. Его дефицит вызывает накопление ганглиозидов GM2. Наиболее сильное накопление происходит в центральной и вегетативной нервной системе и в сетчатке. Симптомы: умственная отсталость, мышечная слабость, слепота.
19 Сфинголипидозы Болезнь Тея-Сакса Этиология: наследственное аутосомно-рецессивное заболевание Эпидемиология: чаще встречается у еврейского населения ашкенази Патогенез: дефицит гексоаминидазы А внутриклеточное накопление ганглиозида GM2 прогрессирующая нейродегенерация.В зависимости от того, когда появляются первые симптомы, различают: Классическую инфантильную форму (менее 0,5% случаев) Ювенильную форму (2,5% случаев) Взрослую форму (наблюдают более чем в 10% случаев) Клинические признаки: Задержка развития Быстрота снижение физической и умственной работоспособности с 6-го месяца жизни; Пациенты обычно умирают в возрасте около 4 лет Вишневое макулярное пятно Гипотензия Судороги Нарушение слуха и зрения Примечание: нет гепатоспеномегалии (по сравнению с болезнью Ниманна-Пика) Диагностика: лизосомы кожицы лука Лечение: поддерживающее
20 Сфинголипидоз Болезнь Тая-Саха, диагностика и лечение Диагноз болезни Тея-Сакса основывается на молекулярных тестах ДНК, биохимической активности ферментативной активности гексоаминидазы А и цитологических лизосомах.Генетическое тестирование может подтвердить диагноз, обнаружив мутацию в гене HEXA, ответственном за заболевание. Такие тесты следует проводить на людях, состоящих в родстве с пациентом. Пренатальные тесты на болезнь Тея-Сакса можно проводить примерно на 11-й неделе беременности, биопсию ворсин хориона или примерно на 16-й неделе беременности с помощью амниоцентеза. Проверка психомоторики, наблюдение. Магнитно-резонансная томография. В настоящее время лечение в основном основано на купировании симптомов, возникающих у больных.
21 Сфинголипидоз А.Дефицит сфингомиелиназы Дефицит сфингомиелиназы является причиной болезни Ниманна-Пика - сфинголипидоза, которая приводит к нейродегенерации в раннем возрасте. Это более распространено среди евреев-ашкенази. Хотя у пациентов с этим заболеванием также наблюдаются симптомы вишнево-красных пятен, задержка развития и регрессия; отсутствие гепатоспленомегалии делает диагноз маловероятным. Описание клинического случая I, объяснение ответа B. Мутация переносчика кассеты, связывающей АТФ Мутации переносчика кассеты, связывающей АТФ, вызывают адренолейкодистрофию.Хотя двигательные нарушения, снижение когнитивных функций и прогрессирующая потеря слуха/зрения также могут наблюдаться у пациентов с адренолейкодистрофией, возраст начала болезни намного старше (между 4-8 годами). Скорее всего, у вас также появятся признаки недостаточности надпочечников, включая тошноту, рвоту и изменение цвета. Кроме того, для этого состояния не характерны вишнево-красные пятна на сетчатке глаза.
22 Сфинголипидоз C. Дефицит арилсульфатазы А Дефицит арилсульфатазы А вызывает метахроматическую лейкодистрофию – сфинголипидоз, который также может приводить к задержке и регрессу развития, гипотензии начиная с 6-месячного возраста, что сходно с симптомами у данного больного.Однако метахроматическая лейкодистрофия связана не с ярко-красными пятнами на сетчатке, а скорее с атрофией зрительного нерва. D. Дефицит α-галактозидазы А Дефицит α-галактозидазы А вызывает болезнь Фабри, которая обычно приводит к сильной боли в дистальных отделах конечностей (из-за периферической невропатии) и ангиокератоме, начинающейся примерно в возрасте лет. Большинство пациентов в возрасте от 30 до 40 лет страдают почечной недостаточностью и сердечно-сосудистыми заболеваниями. Диагноз болезни Фабри не объясняет ни задержку развития у этого пациента, начавшуюся в возрасте 6 месяцев, ни появление ярко-красных макулярных пятен, гипотензии и абсансов.E. Дефицит галактоцереброзидазы Описание болезни I, объяснение реакции Дефицит лизосомальной галактоцереброзидазы вызывает болезнь Краббе - сфинголипидоз, который может вызвать задержку или регресс развития, сходные с двигательными симптомами, наблюдаемыми в этом случае. Однако у пациентов с болезнью Краббе, как правило, гипертонус, а не гипотонус, и у них нет ярко-красных пятен на сетчатке. Вместо этого наблюдается нарушение зрения, вторичное по отношению к атрофии зрительного нерва и периферической невропатии.
23 Сфинголипидоз История болезни II Мужчина 43-х лет госпитализирован в связи с обезвоживанием в связи с рвотой и болями в животе в течение 3 дней. При поступлении он находился в состоянии алкогольного опьянения. У больного 5 лет ороговевшие гемангиомы преимущественно вокруг тазобедренного пояса и на всем туловище и в проксимальных отделах конечностей. Через несколько лет появились сильные боли в конечностях, боли в животе, головные боли и головокружение, пота не было.По этой причине мужчина неоднократно госпитализировался в отделения внутренних болезней, неврологии и кардиологии. Имеются кожные поражения по типу ангиокератом (небольшие ороговевающие ангиомы кожи) на коже живота, паха, промежности и бедер. Анализ мочи в норме; сывороточный тест: мочевина 8,1 ммоль/л; креатинин 179,8 мкмоль/л; СКФ 38 мл/мин/1,73 м 2 ; АСТ 59,1 МЕ/мл, АлАТ 26,4 МЕ/мл; СРБ 15,4 мг/л. Эхокардиография выявила значительную, симметричную гипертрофию сердечной мышцы (левого и правого желудочков) при отсутствии артериальной гипертензии.
24 Сфинголипидозы История болезни II, вопросы A. Дефицит сфингомиелиназы B. Мутация переносчика АТФ-связывающей кассеты C. Дефицит A арилсульфатазы A D. Дефицит α-галактозидазы A E. Дефицит галактоцереброзидазы A F. Дефицит β-гексоаминидазы A 25 Сфинголипид A дефицит II
, правильный ответ D. Дефицит α-галактозидазы А Болезнь Фабри: симптомы, этиология Эхокардиографическая картина в сочетании с типичным поражением кожи, а также характерным анамнезом и наличием гипертрофии сердца и изменениями перегрузки на ЭКГ, особенностями почечной неудача позволила установить первоначальный диагноз болезни Фабри, что подтверждалось достоверным снижением активности фермента α-галактозидазы А в лейкоцитах.α-gal A представляет собой гомодимерный гликопротеин, кодируемый геном GLA, который расположен на длинном плече Х-хромосомы. Многочисленные мутации GLA связаны со сдвигом рамки считывания, что приводит к значительному снижению или отсутствию активности фермента α-gal A.26 Сфинголипидоз По мере накопления глоботриаозилцерамида (субстрата α-галактозидазы) нарастают клинические симптомы, большая часть которых связана с сосудистой системой. Накапливающийся субстрат также повреждает периферическую нервную систему, нарушая, помимо прочего, нормальное потоотделение, что приводит к непереносимости высоких температур и физических нагрузок.
27 Болезнь Фабри Этиология: рецессивное наследственное заболевание, сцепленное с Х-хромосомой Эпидемиология: типичное начало заболевания в детстве, но может встречаться и у взрослых в возрасте от 60 до 80 лет Только полные симптомы у мальчиков Патогенез: недостаточность α-галактозидазы Накопление тригексозид церамид (глоботриаозилцерамид) в эндотелии сосудов (преимущественно капилляров) и его влияние на пролиферацию гладкой мускулатуры стенок крупных сосудов нарушения, затрагивающие многие системы органов, накапливающийся субстрат также повреждает периферическую нервную систему Клинические признаки: Ранние симптомы : Периодически возникающая дизестезия кистей и стоп (жжение, покалывание), проявляющаяся жгучими, изматывающими болями в кистях и стопах (кризы Фабри), ангидроз или гипогидроз (нарушения нормального потоотделения, приводящие к непереносимости высоких температур и физической нагрузки). красновато-фиолетовый мочевая кожная сыпь) Помутнение роговицы, катаракта Поздние симптомы: Кардиомиопатия (не связанная напрямую с накоплением гликосфинголипидов в сердце) Цереброваскулярные изменения (транзиторная ишемическая атака, инсульт) Нефропатия Фабри (накопление субстрата в почечных клубочках приводит к микроальбуминурии и в конечном итоге к полной почечная недостаточность на пятом десятилетии жизни) Лечение: заместительная ферментная терапия α-галактозидазой А
28 Сфинголипидоз Болезнь Фабри, диагностика Использование ферментного теста (обычно проводится на лейкоцитах) для измерения уровня активности α-галактозидазы.Ферментный тест не является надежным в диагностике заболевания у женщин из-за случайного характера инактивации Х-хромосомы Молекулярно-генетический анализ гена GLA является наиболее точным методом диагностики у женщин, особенно если мутации уже выявлены в мужской семье члены. МРТ позволяет точно оценить массу и толщину левого желудочка, а также гипертрофию. Эхокардиографическое исследование. Биопсия почки также может свидетельствовать о болезни Фабри, если замечено чрезмерное накопление липидов.
29 Сфинголипидоз Болезнь Фабри, лечение Метод лечения – генно-инженерная α-галактозидаза А путем внутривенного вливания. Существует два препарата: агалсидаза бета (Fabrazyme от Genzyme) и агалсидаза альфа (Replagal от TKT). Оба препарата доступны в Польше. Ген Симптомы Частота Характеристики ГЛК Сильные боли в руках и ногах (акропарестезии), боли в животе, нарушения дефекации, кожные и сосудистые изменения (ангиокератомы).1: Cer-Glc-Gal- Α-галактозидаза + Gal Globotriaozylceramide
30 Сфинголипидоз История болезни III Мальчик 2-х лет доставлен в отделение неотложной помощи родителями в связи с лихорадкой и повторяющимися эпизодами судорожных движений конечностей в последнее время. 6 часов. Беременность и роды протекали без осложнений, до 1 года развитие было нормальным. Родители сообщают, что в течение последнего года он постепенно терял речь, зрение и двигательные навыки. За это время он трижды попадал в больницу по поводу миоклонических судорог.При физикальном обследовании выявлен гипертонус верхних и нижних конечностей. При осмотре глазного дна выявляется бледная бледность зрительного нерва с обеих сторон. МРТ головного мозга показывает атрофию головного мозга и гиперинтенсивность перивентрикулярных и подкорковых областей. Через два дня после поступления больной умирает. Гистопатологическое исследование головного мозга показывает агрегацию глобоидных клеток и потерю глиальных клеток. Состояние больного, скорее всего, было вызвано дефицитом какого-либо из перечисленных ферментов?
31 Сфинголипидоз История болезни III, вопросы A.Дефицит сфингомиелиназы B. Мутация переносчика АТФ-связывающей кассеты C. Дефицит арилсульфатазы A D. Дефицит α-галактозидазы A E. Дефицит галактоцереброзидазы F. Дефицит β-гексоаминидазы A
32 Сфинголипидоз Симптомы случая III, нормальная геллактазная болезнь E В большинстве случаев первые симптомы повышенной чувствительности к раздражителям можно заметить уже в возрасте около 3 месяцев. В 6-месячном возрасте у младенцев проявляется спастичность.В конце первого года жизни присоединяется слепота и значительное ухудшение слуха. Заболевание быстро прогрессирует и приводит к летальному исходу в возрасте 2 лет. Отмечается скопление многоядерных глобоидных клеток в центральной нервной системе, полная потеря миелина и обширный глиоз в белом веществе.
33 Метахроматическая лейкодистрофия галактоцереброзидаза Болезнь Ниманна-Пика Болезнь Краббе Болезнь Фарбера В основе заболевания лежит дефицит активности β-галактозидазы, фермента, который в норме расщепляет галактозилцерамид на церамид и галактозу; субстратом для этого фермента также является галактозилсфингозин, накопление которого приводит к разрушению олигодендроцитов.
34 Сфинголипидозы Болезнь Краббе Этиология: наследственное заболевание, аутосомно-рецессивное Патогенез: отсутствие или снижение активности лизосомных ферментов: галактоцереброзидаза (GALC) накопление психозина (галактозилсфингозин, продукт деградации цитотоксического миелина) + образование галактоцереброзидов психические и двигательные нарушения Задержка развития Периферическая невропатия Ригидность конечностей Спастичность (повышенный мышечный тонус или ригидность) с осевой слабостью Потеря зрения (атрофия зрительного нерва) Диагностика: глобоидные клетки: крупные многоядерные макрофаги, нагруженные гликолипидами, сгруппированные в белом веществе головного мозга Лечение: трансплантация стволовых клеток может улучшить прогноз только до появления симптомов после появления симптомов возможно поддерживающее лечение
35 Сфинголипидоз Болезнь Краббе, диагностика, лечение e Неонатальный скрининг на болезнь Краббе включает тестирование высушенных клеток крови на активность фермента GALC Молекулярный анализ на мутации фермента GALC Несколько испытаний лечения включали трансплантацию костного мозга Ген Симптомы Частота Характеристики GALC Гиперчувствительность к стимулам 1 / β-галактозидаза: полиморфное нарушение спастичности Глобоидные клетки Галцерамид - галактоза + церамид Полная потеря миелина Обширный глиоз в белом веществе
36 Сфинголипидоз Наследование Патогенез Основные признаки Болезнь Гоше Болезнь Краббе Болезнь Тея-Сакса Лейкодистрофия Фабри Метахроматическое заболевание Аутосомно-рецидивное Аутосомно-недавнее Аутосомно-недавнее Аутосомно-Х-сцепленное рецессивное Аутосомно-рецессивное Аутосомно-рецессивное β-глюкоцереброзидаза глюкоцереброзид Галактоцереброзидаза галактоцереброзид Гексоаминидаза A Ганглиозид GM2 α-галактозидаза A церамидотригексозид Арилсульфатаза А цереброзида сульфат сфингомиелиназа сфингомиелин Гепатоспленомегалия Остеопороз длинных костей Цитопения крови Клетки Гоше Периферическая невропатия Потеря зрения и слуха Глобоидные клетки Прогрессирующая нейродегенерация Симптомы вишнево-красного пятна Лизосомоз ранние симптомы кожи стоп Температура) Ангиокератомы (кожные и сосудистые изменения) Поздние симптомы: Кардиомиопатия Нефропатия Атаксия Деменция Прогрессирующая нейродегенерация Вишневое красное пятно желтое Гепатоспленомегалия Пенистые клетки
37 Сфинголипидоз
38 Нарушения липидов включают широкий спектр нарушений липидного обмена.Обычно они характеризуются повышенным уровнем холестерина, триглицеридов и/или липопротеинов в крови из-за повышенного риска (или текущего) сердечно-сосудистого заболевания. Большинство нарушений липидного обмена передаются через нездоровый образ жизни (ожирение, малоподвижный образ жизни, алкоголизм). Врожденные причины встречаются реже, например, семейная гипертриглицеридемия, связанная с необычно высоким уровнем триглицеридов, что значительно увеличивает риск панкреатита, и семейная гиперхолестеринемия, вызывающая ранние атеросклеротические осложнения.Нарушения липидов обычно обнаруживаются во время рутинных лабораторных тестов, таких как скрининг сердечно-сосудистых факторов риска. Липидный профиль крови включает общий холестерин, ЛПНП, ЛПВП и триглицериды.
39 Определения Следующие термины часто используются взаимозаменяемо, поскольку они имеют общие причины и связаны с повышенным риском атеросклероза и сердечно-сосудистых заболеваний, но имеют разные значения: Дислипидемия: аномальные уровни липопротеинов (ЛПНП и ЛПВП) в сочетании с повышенным риск системного заболевания сердечно-сосудистой системы или текущего сердечно-сосудистого заболевания.Гиперлипидемия: повышение уровня липидов в крови (общего холестерина, холестерина ЛПНП, триглицеридов). Гиперхолестеринемия: повышение общего холестерина > 200 мг/дл. Гипертриглицеридемия: повышение уровня триглицеридов. Гиперлипопротеинемия: повышенный уровень определенного липопротеина. Дислипидемия является основным фактором риска атеросклеротических сердечно-сосудистых заболеваний.
40 Гиперлипидемические фенотипы Фредриксона, их первопричины и частота. ГЛП гиперлипопротеинемия.
41 Гиполипопротеинемии Абеталипопротеинемия Семейная недостаточность β-липопротеинов Болезнь Танжера, дефицит «рыбий глаз» Дефицит апоа и гиперлипопротеинемии Семейный Тип I Тип IIa Тип III Тип IV Тип V Семейная гиперальфалипопротеинемия Дефицит семейства ацил-липопротеинов 9Семейство ацил-липопротеинов типа 2 по Фреденофенотипу 49000 I IIa IIb III IV Заболевание Семейная гиперхиломикронемия Семейная гиперхолестеринемия Семейная комплексная гиперлипидемия Семейная дисбеталипопротеинемия Частота Редкая форма 10% 1 15% 5% 70% Семейная гипертриглицеридемия Наследственный аутосомно-доминантный липопротеин Аутосомно-доминантный аутосомно-липопротеиновый C-II Дефектные рецепторы ЛПНП или дефектный ApoB-100 Дефектный ApoE Гиперпродукция ЛПОНП в печени Клинические симптомы Желтые пятна Гепатоспленомегалия Рецидивирующие эпизоды острого панкреатита и/или б Боли в животе Липемия сетчатки (изменения сетчатки глаза) Сужение желчных протоков Нет повышенного риска атеросклероза Преждевременный атеросклероз Липоидный/старческий дуги (отложения на внешнем крае роговицы) Бугристые желтые пятна/сухожилия типа IIа Ксантелазма (плоское веко) желтые) при типе IIa и IIb Хиломикроны Хиломикроны ЛПНП ЛПНП и ЛПОНП Преждевременный атеросклероз Преждевременный атеросклероз Желтые ладонные пучки и бугорчатые желтые пятна на локтях и коленях Остатки ЛПОНП и хиломикронов Преждевременный атеросклероз Папулезные желтые пятна Кремовый панкреатит Прозрачный Непрозрачный Облачный
43 История болезни I 8-недельный старый младенец мужского пола, ранее здоровый, был доставлен в отделение неотложной помощи, потому что мать заметила, что в течение 2 дней кожа ребенка была бледной и пахла это напоминало запах алкоголика.У ребенка отмечалось снижение аппетита, повышенная сонливость и повышение температуры, которые мать лечила парацетамолом. Фекалии и моча были в норме. Венозная кровь имела розовый цвет, консистенцию молочного коктейля. Первоначально лаборатория не могла обработать образец крови из-за его необычной консистенции. Панель липидов натощак была явно ненормальной: Триглицериды: мг/дл; стандарт: мг/дл Концентрация хиломикронов: мг/дл; норма: 0 мг/дл Концентрация холестерина: 1056 мг/дл; стандарт: мг/дл.Сыворотка больного ГЛП I типа. Накопление хиломикронов вызывает очень тяжелую липемию.
44 История болезни I, вопросы a) Какие дополнительные лабораторные исследования следует провести? б) Какие лечебные рекомендации могли бы нормализовать состояние больного? в) Опишите механизм и фермент, дефект которого мог привести к симптомам, подобным описанным?
45 Гиперлипопротеинемия I типа – этиология гиперхиломикронемии, ген У данного пациента: Гиперлипопротеинемия I типа – гиперхиломикронемия Семейная недостаточность ЛПЛ (семейная хиломикронемия) Вариант I: Семейная недостаточность липопротеинлипазы (ЛПЛ) – наследственное клиническое заболевание – редкое наследственное заболевание только у гомозиготных случаи (1:)
46 Гиперлипопротеинемия I типа - этиология гиперхиломикронемии, ген У данного пациента: Тип I - гиперхиломикронемия Семейный дефицит LPL (семейная хиломикронемия) Вариант II: Семейный дефицит аполипопротеина C-II (очень апо C-II) редко ( несколько случаев), наследуется, как указано выше, обусловленная мутацией гена, кодирующего Apo C-II
47 Гиперлипопротеинемия I типа – этиология гиперхиломикронемии, протеиновая липопротеинлипаза расщепляет хиломикронные ТАГ на глицерин и СЖК, которые затем включаются в липиды тканей или окисляются в качестве источника энергии в сердцевина капилляров расположена в стенке капилляров, т.к. жирная кислота, селезенка, легкие, почки, аорта, диафрагма, молочная железа в период лактации, фосфолипиды и аполипопротеин С-II необходимы для активности ЛПЛ-липазы в результате липопротеинлипазы остатки хиломикронов и ЛПОНП (ИДЛ)
48 Тип I гиперлипопротеинемия - Этиология гиперлипопротеинемии, белок Ацил Ацил LPL PFA Ацил Ацил OH LPL PFA OH Ацил OH триацилглицерин 1,2-диацилглицерол 2-моноацилглицерол моноацилглицерол гидролаза FFA Липопротеинлипаза Секретируется в поверхность сосудов жировой ткани в сердце и эндотелии (особенно в эндотелиальной ткани) циркулирует в хиломикронах и ЛПОНП до жирных кислот и глицерина, которые могут поглощаться клетками Активируется инсулином OH OH OH глицерин
49 Гиперлипопротеинемия I типа - Белок этиологии гиперхиломикронемии, механизм Действие LPL зависит от многих регуляторы, как положительные (зеленый), так и отрицательные (красный).LMF1 отвечает за правильную сборку и сборку LPL, тогда как Sel1L стабилизирует LPL. Комплекс LPL-LMF1 транспортируется из паренхиматозных клеток в эндотелиальные клетки просвета капилляра, где он связывается с GPIHBP1. Апо C-II является важным кофактором для активации LPL, в то время как апо C-I и апо C-III могут ингибировать липолиз. Apo A-V стабилизирует комплекс LPL-apoC-II, помогая ему связываться с поверхностью эндотелиальных клеток посредством HSPG. ANGPTL 3, 4 и 8: все ингибируют LPL, но в разных тканевых слоях.Во время гидролиза ТАГ СЖК и МАГ поглощаются клетками для метаболизма или накопления энергии. GPIHBP1 - заякоренный белок гликозилфосфатидилинозитола (GPI), связывающийся с липопротеинами высокой плотности; протеогликан HSPG с гепарансульфатом; ANGPTL - ангиопоэтиноподобные белки.
50 Гиперлипопротеинемия I типа – гиперхиломикронемия Симптомы Очень медленное выведение хиломикронов и ЛПОНП из кровотока, что приводит к их накоплению в плазме (уровень ТАГ > 500 мг/дл).Клиническим последствием является панкреатит. Симптомы: боль в животе, панкреатит, желтые пучки на коже и сетчатке (липемия сетчатки), увеличение печени и селезенки, наличие пенистых клеток в костном мозге. Lipemia retinalis (изменения сетчатки глаза)
51 Гиперлипопротеинемия I типа - Диагностическая гиперхиломикронемия Анализы крови могут выявить снижение активности фермента липопротеинлипазы в плазме после внутривенного введения гепарина. Диагноз семейной недостаточности LPL может быть подтвержден молекулярно-генетическим тестированием мутаций в гене LPL.Молекулярно-генетическое тестирование доступно в коммерческих и академических исследовательских лабораториях.
52 Гиперлипопротеинемия I типа - лечение гиперхиломикронемии Лечение - диета с низким содержанием жиров, сахара, отказ от алкоголя. Препарат Глибера содержит вариант LPLS447X гена липопротеинлипазы человека (LPL) в составе вектора. Вектор содержит белковую оболочку (капсид), полученную из аденоассоциированного вируса серотипа 1 (AAV1), промотор цитомегаловируса (CMV), посттранскрипционный регуляторный элемент (WHV) вируса гепатита американских сурков (WHV) и производные инвертированных концевых повторов. от ААВ2.Глибера производится с использованием клеток насекомых и технологии рекомбинации бакуловирусов. Глибера приобрела известность как лекарство на миллион долларов и оказалась неэффективной по ряду причин. Его стоимость в сочетании с редкостью заболевания и отсутствием одобрения в США привели к тому, что через два года препарат был отозван с рынка ЕС. К 2018 году только 31 человек во всем мире получал Глиберу.
53 История болезни II (a) Ранее здоровый 16-летний мальчик обратился к врачу с 5-дневной историей болей в задней части левой лодыжки.Его мать перенесла сердечный приступ в возрасте 54 лет. ИМТ у 16-летнего подростка 23 кг/м 2 . Над левой задней пяточной костью болезненность и твердая 3-сантиметровая припухлость телесного цвета, перемещающаяся вместе с левым ахилловым сухожилием. Показана микрофотография биопсии узла. Биопсия очага поражения показывает многочисленные пенистые клетки, насыщенные липидами, с большими включениями холестерина, что свидетельствует о ксантомах.
54 А.Семейная гиперхолестеринемия B. Гиперхиломикронемия C. Гиперлипопротеинемия III типа D. Гиперлипидемия IV типа История болезни II (a), вопросы B. Наследственные причины гипертриглицеридемии включают гиперлипидемию I типа (гиперхиломикронемия), гиперлипопротеинемию III типа и гиперлипидемию IV типа (без гиперлипидемии IV типа) ) это не связано с желтухой ахиллова сухожилия. C. Гиперлипопротеинемия III типа связана с ранним атеросклерозом, но желтуха чаще встречается в ладонных складках, чем в ахилловом сухожилии, наблюдаемом у этого пациента.D. Гиперлипидемия может проявляться в виде желтых высыпаний, но не объясняет преждевременный атеросклероз, как показано на примере матери пациента.
55 Гиперлипопротеинемия II типа – семейная гиперхолестеринемия Этиология, ген Семейная гиперхолестеринемия соответствует классификации гиперлипопротеинемии Фредриксона II с типом IIa и типом IIb. Тип IIa характеризуется избирательным повышением уровня липопротеинов ЛПНП, тогда как тип IIb характеризуется повышением уровня липопротеинов ЛПНП и ЛПОНП и триглицеридов.У больного: Гиперлипопротеинемия типа IIа - семейная гиперхолестеринемия (АД) Нарушение поглощения (интернализации) ЛПНП клетками из-за отсутствия рецепторов ЛПНП на клеточной поверхности или их аномальной структуры (рецепторы с низким сродством). Причины: - мутации в гене, расположенном на хромосоме 19, кодирующем рецептор ЛПНП - мутации в гене аполипопротеина В, мутации в гене PCSK9 или гене. У больного: Гиперлипопротеинемия IIb типа - семейная комплексная гиперлипидемия (АД).
56 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Симптомы Пожелтение сухожилий у анализируемого пациента указывает на особенно высокие уровни ЛПНП и часто связано с семейной гиперхолестеринемией, при которой наблюдается чрезвычайно повышенный уровень ЛПНП из-за нарушения передачи сигналов и разрушения рецепторов ЛПНП.Другие кожные проявления гиперлипидемии включают желтые пучки, липидный ободок роговицы и желтизну сухожилий. В случае семейной гиперхолестеринемии сигналом о нарушении липидного обмена является так называемый желтые пучки. Это изменения, проявляющиеся в виде комочков, в которых скапливается холестерин. Они появляются под кожей в различных местах тела в виде желтух, чаще всего в уголках век или вокруг ахилловых сухожилий. Другим признаком гиперхолестеринемии может быть так называемый старческий лимб роговицы, т. е. узкая полоска, окружающая зрачок глаза, где сходятся роговица, конъюнктива и склера.
57 История болезни II (b) 35-летний мужчина с сильной загрудинной болью, продолжавшейся около 2 часов, был доставлен машиной скорой помощи в местную больницу. Больной также почувствовал одышку (затрудненное дыхание), почувствовал тошноту и обильно потел. Пациенты сообщают об эпизодах болей в груди, вызванных физическими упражнениями, в последние несколько месяцев, но они были менее сильными и непродолжительными.Больной выкуривает 2-3 пачки сигарет в день, редко употребляет алкоголь и правильно питается. Его дополнительная физическая активность ограничивается прогулками по выходным. Артериальное давление пациента было нормальным. Согласно семейному анамнезу, его отец и мать умерли от болезни сердца в возрасте 45 и 39 лет соответственно. Больная мать и младший брат (31 год) здоровы. Физикальное обследование: пациент бледный, на коже липкий пот, боли в груди, высокое кровяное давление и учащенное дыхание.Видны отложения липидов (желтые пучки, желтые пятна) по периферии его роговицы и под кожей на веках и вокруг них (ксантелазмы). В его сухожилиях не было замечено желтизны (ксантомы).
58 История болезни II (b) Электрокардиограмма пациента указывает на инфаркт миокарда. Ангиография выявляет участки выраженного стеноза (сужения) нескольких коронарных артерий. Первоначальные результаты (натощак) из клинической лаборатории показали: Пациент Референтный диапазон Тропонин + 0 Общий холестерин 365 мг/дл <200 Холестерин ЛПНП 304 мг/дл <130 Холестерин ЛПВП 38 мг/дл> 45 Триглицериды 115 мг/дл <150 Пациент Гетерозигота выявляется семейная гиперхолестеринемия, также известная как гиперлипидемия типа IIa.Пациенты с гетерозиготной формой этого заболевания имеют примерно 50% от нормы количества функциональных рецепторов ЛПНП и гиперхолестеринемию (в 2-3 раза выше нормы), что увеличивает у них риск (> 50%) развития ИБС. Необратимый некроз клеток миокарда в результате ишемии обусловлен окклюзией кровеносного сосуда, чаще всего тромбом. Больному давали кислород, сосудорасширяющее, обезболивающие, тромболитические препараты и антикоагулянты. План долгосрочного лечения включает:К ним относятся препараты, снижающие уровень холестерина (статины, секвестранты желчных кислот и никотиновая кислота), ежедневный прием аспирина, бета-блокаторы, правильное питание, физические упражнения и отказ от курения.
59 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия, этиология белка, механизм Семейная гиперхолестеринемия - генетическое заболевание (аутосомно-доминантное), возникающее в результате мутации одного или обоих аллелей гена рецептора ЛПНП. У гомозигот протекает более тяжело, чем у гетерозигот.Клеточное поглощение ЛПНП нарушено, что повышает уровень холестерина в крови Гомозиготные: холестерин ЛПНП > 400 мг/дл (> 10,4 ммоль/л) (атеросклероз у детей) Гетерозиготы: холестерин ЛПНП > 190 мг/дл (> 4,9 ммоль/л) ( атеросклероз взрослых) Нормальный уровень LDL-Chol: мг/дл. Примечание: СГ встречается только у <5% пациентов с гиперхолестеринемией.
60 Гиперлипопротеинемия типа IIa – семейная гиперхолестеринемия Симптомы Симптомы (касается прибл.50% родственников 1-й степени родства): ксантомы сухожилий, преждевременное возникновение ИБС, генерализованный атеросклероз. рождения у них в 2-3 раза выше концентрация холестерина в крови (мг/дл), желтизна сухожилий обычно развивается после 20 лет, а атеросклероз после 30 лет (гл.ишемическая болезнь 4-5 десятка), гомозиготы с рождения имеют необычно высокую концентрацию холестерина (мг/дл), желтушность сухожилий и желтизна кожи обычно появляются в первые четыре года жизни. Коронарный атеросклероз, приводящий к инфаркту миокарда, обычно появляется в возрасте до 20 лет.
61 Причиной СГ является наличие сотен различных мутаций в гене рецептора ЛПНП, которые влияют на количество и/или функцию рецептора и, следовательно, на ограниченную способность удалять ЛПНП и содержащийся в нем холестерин из крови.В результате повышается концентрация ЛПНП и общего холестерина в крови, а холестерин откладывается в сосудистой стенке и в коже. СГ характеризуется повышенным риском развития сердечно-сосудистых заболеваний. Тип IIа гиперлипопротеинемии - семейная гиперхолестеринемия (СГ) Этиология, белок, механизм, судьба ЛПНП Дефект аполипопротеина В-100, являющегося лигандом рецептора ЛПНП, нарушает связывание липопротеинов ЛПНП с их рецепторами, что приводит к нарушению катаболизма липопротеидов низкой плотности в печени.
62 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Этиология белок, механизм, судьба ЛПНП Рецептор ЛПНП (apob100-e рецептор) Рецептор ЛПНП ЛПНП регулирует синтез и уровень холестерина в плазме Рецепторы ЛПНП Бесконечная редуктаза ГМГ-КоА Эфиры ЛПНП Холестерин АКосомы Амиокислоты
63 Гиперлипопротеинемия типа IIa – семейная гиперхолестеринемия Этиология, белок, механизм Мутации в гене рецептора ЛПНП Класс I – рецепторный белок не синтезируется и в клетках отсутствуют рецепторы ЛПНП.Класс II - связан с нарушением транспорта рецепторов ЛПНП от эндоплазматического ретикулума к клеточной мембране.Класс III - возникают дефектные рецепторы, не связывающиеся с частицами ЛПНП. Класс IV - они основаны на дефекте интернализации рецептора ЛПНП в клетку после его связывания с молекулой липопротеина.
64 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Этиология Белок, механизм, судьба ЛПНП PCSK9 - субтилизин/кексин пропротеинконвертаза, тип 9 (пропротеинконвертаза субтилизин/кексин тип 9), PCSK9 прикрепляется к рецептору ЛПНП в его внутренней части и лизирует деградацию.Наличие мутации гена PCSK9 связано с повышенной деградационной активностью этого белка по отношению к рецепторам ЛПНП.
65 История болезни II (б), вопросы 1. Какой фенотип следует ожидать у человека с врожденным дефектом аполипопротеина В-100 по сравнению с человеком с врожденным дефектом рецептора ЛПНП? 2. Почему больному прописали аспирин? 3. Одна из причин, по которой люди должны бросить курить и начать заниматься спортом, заключается в том, что это повышает уровень ЛПВП, а повышенный уровень ЛПВП снижает риск ишемической болезни сердца.Как повышение уровня ЛПВП снижает риск ишемической болезни сердца?
66 История болезни II (b), вопросы Какой фенотип следует ожидать при врожденном дефекте аполипопротеина B-100 по сравнению с врожденным дефектом рецептора ЛПНП? Фенотип будет тот же. В случае врожденного дефекта apob-100 рецепторы ЛПНП многочисленны и функционируют нормально, но лиганд рецептора изменен таким образом, что связывание с рецептором нарушено.Уменьшение связывания лиганда с рецептором приводит к повышению уровня ЛПНП в крови и гиперхолестеринемии. Примечание. Тот же фенотип будет наблюдаться у людей с мутацией приобретения функции PCSK9, протеазой, которая снижает рециркуляцию рецептора ЛПНП и, таким образом, увеличивает деградацию рецептора ЛПНП.
67 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия диагностика, диагностика Выявление пациентов с семейной гиперхолестеринемией: генетические тесты ближайших родственников пациента помогут выявить тех, кто нуждается в лечении.Согласно европейским рекомендациям по ведению дислипидемии, следующие критерии должны побуждать врачей к оценке пациента на наличие СГ: общий холестерин > 310 мг/дл или холестерин ЛПНП > 190 мг/дл у взрослого пациента или взрослых членов семьи; преждевременная коронарная недостаточность. заболевание артерий у пациента или членов его семьи (мужчины <55 лет, женщины <60 лет) желтизна сухожилий у пациента или членов семьи преждевременная сердечная смерть у членов семьи Окончательное решение путем секвенирования генов LDLR, PCSK9, APOB
68 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Диагностика, диагностика
69 Атеросклеротические липидные факторы Расчет холестерина ЛПНП по формуле Фридавальда (только для концентрации ТГ <400 мг/дл): мг/дл: хол.Фракция ЛПНП = общий хол. хол. ТГ ЛПВП/5 фракция в ммоль/л: хол. Фракция ЛПНП = общий хол. хол. Фракция ТГ ЛПВП/2,2 Хотя низкий уровень холестерина ЛПВП считается независимым фактором риска ИБС, его целевое значение не установлено из-за отсутствия терапевтического вмешательства. При уровне ЛПВП > 60 мг/дл, пока функция печени в норме, риск снижается. Расчет отношения ЛПНП/ЛПВП может быть полезен при оценке риска ССЗ: ЛПНП/ЛПВП <3 низкий сердечно-сосудистый риск ЛПВП/ЛПВП 3 4 промежуточный сердечно-сосудистый риск ЛПНП/ЛПВП> 4 высокий сердечно-сосудистый риск Рассчитывается из всех факторов риска для общего сердечно-сосудистого риска ( SCORE) является основой для определения требуемых целевых значений ЛПНП.70 Атеросклеротические липидные факторы Классификация липидов и липопротеинов согласно NCEP (Национальная образовательная программа по холестерину) * Концентрация ТГ в диапазоне мг/дл является фактором риска атеросклероза ** Концентрация ТГ > 1000 мг/дл является фактором риска острого воспаление поджелудочной железы
71 История болезни II (б), вопросы Почему больному прописали аспирин? Аспирин необратимо ингибирует циклооксигеназу (ЦОГ) и, таким образом, синтез простагландинов (PG), таких как PGI 2, в эндотелиальных клетках сосудов и тромбоксанов (TX), таких как TXA 2, в активированных тромбоцитах.TXA 2 способствует сужению сосудов и образованию бляшек, в то время как PGI 2 ингибирует эти процессы. Поскольку у тромбоцитов нет ядер, они не могут преодолеть ингибирование синтеза ТХ за счет производства большего количества ЦОГ, в то время как у эндотелиальных клеток есть ядра. Следовательно, аспирин ингибирует образование тромбов, предотвращая выработку ТХА 2 на протяжении всей оставшейся жизни тромбоцитов.
72 История болезни II (b), вопросы Одна из причин, по которой вы призываете бросить курить и заниматься спортом, заключается в том, что это повышает уровень ЛПВП, а повышенный уровень ЛПВП снижает риск ишемической болезни сердца.Как повышение уровня ЛПВП снижает риск ишемической болезни сердца? ЛПВП участвует в обратном транспорте холестерина. ЛПВП забирает холестерин из тканей, отличных от печени (периферических, например, эндотелия артерий), и переносит его в печень. Белок ABCA1 опосредует транспорт холестерина к ЛПВП. Холестерин этерифицируется внеклеточным лецитином: холестеринацилтрансферазой (LCAT), активатором которой является апоа-1. Удаление холестерина из эндотелиальных клеток предотвращает его накопление (в виде холестерина или эфиров холестерина), что снижает риск развития ишемической болезни сердца.
73 Метаболизм ЛПВП
74 Стенка ЛПВП Защитные свойства ЛПВП при ишемической болезни сердца Моноциты ХЭ ЛПВП ЛПВП UC апоа-и Нативная Эстераза ЛПВП oxldl PL UC ABCA1 Пенистые клетки oxldl Эндотелиальные клетки oxldl = окисленные LDL = окисленные LDL = окисленные LDL холестерин UC = неэтерифицированный холестерин Неожиданный холестерин CE = сложный эфир холестерина = общий холестерин ЛОКТАЛЬНАЯ КИШКА БЛОКИРУЕТ РЕЗОРБЦИЮ СТАТИНОВ МИЛКИСЛОТ (АТОРВСТАТИН, ПРСТАТИН, РОЗУСТАТИН, СИМВАСТАТИН, ФЛУСТАТИН, СИМВАСТАТИН, СИМВАСТАТИН) СИСТЕМЫ ГМГ-КоА ЭВОЛОКУМАБ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К PCSK9 БЛОКИРОВКА PCSK9 ВЗАИМОДЕЙСТВИЕ С LDL-R
76 Гиперлипопротеинемия типа IIa – лечение семейной гиперхолестеринемии
77 Абсорбция холестерина типа IIa путем снижения абсорбции холестерина холестерином крови в кишечнике путем снижения холестерина всасывание холестерином крови в кишечнике, блокирование белка NPC1L1 (белок Ниманна-Пика С-подобного 1) транслокатора стеролов, присутствующего в апикальной мембране энтероцитов.
78 Гиперлипопротеинемия типа IIa – семейная гиперхолестеринемия Лечение, вопросы Статины оказывают благотворное влияние на пациентов с гиперхолестеринемией, поскольку: A. Они ингибируют регулируемую скорость-лимитирующую реакцию синтеза холестерина de novo путем ингибирования редуктазы гидроксиметилглутарилкоэнзима А (ГМГ-КоА). B. Они снижают экспрессию гена рецептора ЛПНП, предотвращая замещение белка-2, связывающего регуляторный элемент стерола (SREBP-2), связанного с белком, активирующим гидролиз SREBP (SREBP-2).белок, активирующий расщепление SREBP; SCAP) от эндоплазматического ретикулума к мембране аппарата Гольджи. C. Интенсифицируют окисление до CO 2 и H 2 O. D. Нарушают всасывание желчных кислот (ЖК) в кишечно-печеночной циркуляции и тем самым стимулируют захват печенью холестерина из крови для синтеза ЖК. E. Они снижают уровень холестерина за счет увеличения синтеза стероидных гормонов и витамина D.
79 Статины оказывают благотворное влияние на пациентов с гиперхолестеринемией, поскольку: A.Они ингибируют регулируемую скорость-лимитирующую реакцию синтеза холестерина de novo путем ингибирования гидроксиметилглутарил-кофермента А-редуктазы (ГМГ-КоА). Тем самым они предотвращают зависимое от НАДФН восстановление ГМГ-КоА до мавалоната и снижают синтез холестерина. Индуцированное статинами снижение синтеза холестерина приводит к перемещению белка SREBP-2, связанного с белком SCAP, с мембраны эндоплазматического ретикулума на мембрану Гольджи. SREBP-2 гидролизуется с образованием фактора транскрипции, который перемещается в ядро клетки и связывается с регулируемой стеролами последовательностью, расположенной выше генов ГМГ-КоА-редуктазы и рецептора ЛПНП, увеличивая их экспрессию.Стероидные гормоны синтезируются из холестерина, а витамин D образуется в коже из промежуточного соединения пути биосинтеза холестерина (7-дегидрохолестерин). Следовательно, ингибирование синтеза холестерина снижает синтез желчных кислот. Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Лечение, вопросы
80 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Лечение, вопросы Белки SREBP регулируют транскрипцию многих генов, ответственных за поглощение и метаболизм холестерина и других липидов в клетках.Активация SREBP ингибируется белком INSIG (ген, индуцированный инсулином), который, как следует из его названия, индуцируется инсулином и встречается в эндоплазматическом ретикулуме. INSIG также стимулирует деградацию HMG-CoA-редуктазы. Инсулин представляет собой гормон, который стимулирует образование активной формы SREBP, тем самым увеличивая экспрессию генов, связанных с липогенезом или метаболизмом холестерина. Таким образом, это действие противоположно действию INSIG.Индукция инсулином белка INSIG может действовать как пост-продукционный контроль (сайленсинг собственного сигнала).
81 Гиперлипопротеинемия типа IIa - семейная гиперхолестеринемия Лечение, вопросы Желчные кислоты (ЖК) в тонком кишечнике, такие как холестирамин, препятствуют абсорбции солей желчи печенью и, следовательно, увеличивают их выведение. Затем печень поглощает холестерин через рецептор ЛПНП и использует его для синтеза БА, что снижает уровень холестерина в крови.
82 Эволокумаб Гиперлипопротеинемия типа IIa - лечение семейной гиперхолестеринемии Моноклональные антитела против pcsk9, блокирующие взаимодействие PCSK9 с ИНГИБИТОРОМ LDL-R PCSK9 Первое полностью человеческое моноклональное антитело IgG, зарегистрированное для лечения гиперхолестеринемии и смешанной семейной гиперхолестеринемии. Концентрация PCSK9 в сыворотке предсказывает риск сердечно-сосудистых заболеваний.
83 Гиперлипопротеинемия типа IIa – лечение семейной гиперхолестеринемии Ингибиторы белков-переносчиков эфиров холестерина (СЕТР) Их основное действие заключается в ингибировании функции белка-переносчика эфиров холестерина (СЕТР) от ЛПВП к ЛПНП и ЛПОНП, что, как ожидается, приведет к увеличению концентрации ЛПВП в плазме и, следовательно, дополнительно снижают риск атеросклероза. Препараты на этапе клинических испытаний.
84 История болезни III 35-летний мужчина обратился к врачу в связи с несколькими эпизодами сдавливающей подкожной боли в грудной клетке во время физической нагрузки в течение последних 6 недель.Боль появляется, когда он совершает утреннюю пробежку, и исчезает, когда он замедляет ходьбу. Пациент обеспокоен тем, что двое его дядей умерли от сердечного приступа в начале 1950-х годов. ЭКГ не показывает никаких отклонений. Физикальное обследование показывает желтые пятна на обеих руках, анализы липидов в сыворотке крови показывают: Общий холестерин 650 мг/дл Холестерин ЛПВП 40 мг/дл Холестерин ЛПНП 185 мг/дл Триглицериды 800 мг/дл Остатки хиломикронов повышены
85 История болезни III, вопросы Какой из следующее является наиболее вероятной причиной симптомов этого пациента? А ТАКЖЕ.Гиперпродукция ЛПОНП в печени B. Снижение аполипопротеина A-1 C. Дефектный аполипопротеин B-100 D. Снижение аполипопротеина B-48 E. Снижение аполипопротеина C-II F. Дефектный аполипопротеин E
86 Гиперлипопротеинемия III типа, семейная дисбеталемия, этиология ген Пациент со стабильной стенокардией, пучками желтых ладоней, гиперхолестеринемией, хиломикронемией и семейным анамнезом раннего инфаркта миокарда предполагает диагноз семейной гиперлипидемии III типа.Другие названия: семейная гиперлипопротеинемия III типа, болезнь β-диапазона, болезнь, нарушение удаления остатка.
87 Гиперлипопротеинемия III типа, семейная дисбеталипопротеинемия, симптомы Наиболее полезными физическими симптомами являются кожные и подкожные клубочки, а также сухожильная желтуха. Пациенты могут заметить бугорки на поверхности разгибателей локтевого и коленного суставов, которые могут рассасываться и рецидивировать. Осмотр глаза может выявить дугу роговицы и, в случае тяжелой гипертриглицеридемии, липемию сетчатки.Сухожильные желтые пятна при дисбеталипопротеинемии в основном локализуются в ахилловых сухожилиях.
88 Гиперлипопротеинемия III типа, семейная дисбеталипопротеинемия, симптомы Симптомы Симптомы Симптомы могут не проявляться до 20 лет и старше. Желтые отложения жирового вещества в коже, называемые ксантомами, могут появляться на веках, ладонях, подошвах ног или сухожилиях коленей и локтей. Атеросклероз развивается в раннем возрасте. Сначала это может проявляться болью в груди (стенокардия) или снижением кровоснабжения определенных частей тела, что приводит к транзиторным ишемическим атакам в головном мозге или заболеваниям периферических артерий с перемежающейся хромотой.
89 У этого пациента: Гиперлипопротеинемия III типа, семейная дисбеталипопротеинемия, История болезни, этиология, ген Гиперлипопротеинемия III типа Семейная дисбеталипопротеинемия, болезнь с широким β-диапазоном, остаточная болезнь удаления хиломикронов, семейная дисбеталипопротеинемия, связанная с апопротеином, индуцированным муто-муто-муто, приводит к повышенный уровень ЛПНП при ранних атеросклеротических осложнениях (сердечно-сосудистых заболеваниях). Наиболее распространенной генетической причиной является гомозиготность 2-го варианта апоэ при отсутствии оставшегося апоэ.Эти данные свидетельствуют о том, что мутации в домене связывания рецепторов необходимы для развития гиперлипидемии. Нарушение связывания апоэ2 с LDLR является причиной его ассоциации с гиперлипопротеинемией III типа.
90 Гиперлипопротеинемия III типа, семейная дисбеталипопротеинемия, История болезни, этиология, белок, механизм Причина - мутации в апо Е (изоформы, множественные гены), наличие только Е2 (частота 1:2000). Заболевание появляется в зрелом возрасте при наличии других генетических или экологических факторов и встречается в 2-3 раза чаще у мужчин, чем у женщин (обычно старше 20 лет).С.). Особенности: широкая полоса, характерная для остаточных молекул, повышенная концентрация остаточных хиломикронов и остатков ВЛД, вызывающая значительное повышение уровня холестерина (мг/дл) и триглицеридов (мг/дл). Симптомы: желтые узелки на кистях и вокруг коленных и локтевых суставов атеросклероз магистральной артерии и ее ветвей и в периферических артериях повышенный риск ожирения, подагры и нарушения толерантности к глюкозе
91 Гиперлипопротеинемия III типа, семейная дисбеталипопротеемия, протеинемия, протеинемия , , механизм
92 Гиперлипопротеинемия III типа, семейная дисбеталипопротеинемия, История болезни, этиология, белок, механизм Помимо того, что апоэ играет важную роль в транспорте липидов, апоэ имеет много других функций: изучена структура 299 аминокислот, домен связывания рецепторов, домен связывания липидов Апоэ человека существует в трех изоформах (апоэ2, апое3 и апое4), и этот полиморфизм влияет на риск заболевания у носителей.Частоты аллелей 2, 3 и 4 в человеческой популяции составляют примерно 7%, 78% и 14% соответственно. ApoE3 считается исходной формой и связан с нормальным уровнем холестерина в плазме, в то время как изоформы apoe2 и apoe4 имеют измененные функции и связаны с возникновением гиперлипидемического атеросклероза. Эти аномальные уровни липидов в плазме и распределение липопротеинов связаны с повышенным риском сердечно-сосудистых заболеваний.
93 Белковый цикл апоЕ гиперлипопротеинемия III типа, семейная дисбеталипопротеинемия, клинический случай, этиология, белок, механизм 1.Образуется в гепатоцитах, головном мозге, селезенке, макрофагах, легких, надпочечниках, яичниках, почках и мышцах. 2. Он переходит в ЛПВП, затем в хиломикроны и ЛПОНП и с их остатками, а не только в ЛПНП; 3. На поверхности гепатоцитов он связывается с: рецептором липопротеинов низкой плотности (LDLR), LDLR-родственным белком (LRP), HSPG также опосредует некоторое поглощение , механизм ApoE связывается с: рецептором липопротеинов низкой плотности (LDLR) белком, родственным LDLR (LRP) HSPG также опосредует поглощение
95 Гиперлипопротеинемия типа III, семейная дисбеталипопротеинемия, диагностика, лечение обычно не доступны в лабораториях ELISA-тесты.Фармакологическое лечение в сочетании со снижением веса и диетой с низким содержанием холестерина. Гены АРОЕ. Симптомы Недостаточное очищение печени от остаточных хиломикронов из-за аномалий строения апоэ. У пациентов наблюдается дефицит изоформ Е3 и Е4, и имеется только Е2, который не реагирует с рецептором. Частота 1: Характеристика Повышение концентрации остаточных хиломикронов и остаточных ЛПОНП с плотностью <1,019 (β-ЛПОНП) вызывает гиперхолестеринемию (формирование желтухи и атеросклероза).
96 История болезни Больной 47 лет поступил в больницу с болью в груди.Три года назад у него был диагностирован сахарный диабет 2 типа, и он регулярно принимал метформин и ситаглиптин. В апреле 2016 года перенес ишемический инсульт. Уровень холестерина тогда был 1044 мг/дл. Пациент прекратил гиполипидемическую терапию (20 мг аторвастатина/сут) через 3 месяца лечения в 11:30 у больного появились сильные боли в грудной клетке. Результаты: Уровень холестерина при выписке составил 448,6 мг/дл. Диагноз: ИБС, острый инфаркт миокарда, более тяжелой локализации.Ангиопластика со стентированием правой коронарной артерии Ишемический инсульт. Гипертония. Сахарный диабет 2 типа Пищевое ожирение.
97 Семейная гипертриглицеридемия История болезни, этиология, механизм У этого пациента: Гиперлипопротеинемия IV типа (семейная гипертриглицеридемия) – это наиболее распространенный тип гиперлипопротеинемии в Польше, им страдают даже 20% взрослых. Семейная гипертриглицеридемия: (множественные генные мутации, частота 1:500), первичным метаболическим дефектом может быть резистентность клеток к инсулину.Причина – высокий уровень эндогенных триацилглицеролов (>500 мг/дл), вызванный повышением содержания ЛПОНП из-за длительного неправильного питания (чрезмерное потребление углеводов) или употребления алкоголя. На этом фоне синдром может развиваться в виде атеросклероза, ожирения, сахарного диабета и панкреатита. Симптомы: ожирение, нарушение толерантности к углеводам, увеличение печени и селезенки, множественные желтые пучки, липидные отложения в сетчатке.
98 Семейная гипертриглицеридемия История болезни, симптомы Этот относительно распространенный фенотип характеризуется высокой концентрацией ТГ из-за изолированного повышения уровня частиц ЛПОНП.Это связано как с перепроизводством, так и со снижением элиминации этих липопротеинов. Концентрации ТГ между 300 и 900 мг/дл (3,4 и 9,9 мм) за счет изолированного роста частиц ЛПОНП наблюдаются примерно у 5% взрослых. Низкий уровень холестерина ЛПВП часто связан с семейной гипертриглицеридемией. При более высоком диапазоне ТГ сыворотка может казаться мутной из-за присутствия крупных частиц ЛПОНП. Семейная гипертриглицеридемия связана с повышенным риском сердечно-сосудистых заболеваний, ожирения, инсулинорезистентности или явного сахарного диабета, а также связана с артериальной гипертензией и гиперурикемией.При дополнительном метаболическом стрессе у пациентов с семейной гипертриглицеридемией может развиться смешанная (тип V) гиперлипидемия с хиломикронемией натощак. Мультигенный ген Симптомы Перепроизводство ЛПОНП часто связано с непереносимостью глюкозы и гиперинсулинемией или снижением деградации ЛПОНП Частота 1/20 Характеристики Концентрация холестерина увеличивается с увеличением концентрации ЛПОНП. Уровни ЛПНП и ЛПВП часто ниже нормального диапазона. Этот тип профиля липопротеинов обычно связан с ишемической болезнью сердца, диабетом II типа, ожирением, алкоголизмом и приемом прогестагенных гормонов.
99 Лечение семейной гипертриглицеридемии Лечение состоит из изменения образа жизни и приема лекарств: снижение веса, диета (сложные сахара вместо простых, ограничение потребления насыщенных жирных кислот, диета с низким содержанием холестерина). Фармакологическое лечение тяжелой гипертриглицеридемии включает фибраты, омега-3 полиненасыщенные жирные кислоты (рыбий жир) и статины. Метод лечения зависит от уровня триглицеридов: у пациентов с уровнем триглицеридов 2,3-5,6 ммоль/л (мг/дл) рекомендуется начинать терапию статинами, если холестерин ЛПНП выше целевого, или фибратами, если ХС-ЛПНП соответствует целевое значение.Основная цель – снизить риск сердечно-сосудистых заболеваний. У пациентов с уровнем триглицеридов 5,6 ммоль/л (500 мг/дл) рекомендуется начинать терапию фибратами в сочетании с этиловыми эфирами омега-3 для профилактики острого панкреатита и, во-вторых, для снижения риска сердечно-сосудистых заболеваний. Предусмотрен запрет на употребление алкоголя и строгая обезжиренная диета, улучшение гликемического контроля у диабетиков и отказ от терапии эстрогенами.У пациентов с уровнем триглицеридов 1,7, 2,3 ммоль/л (мг/дл) снижение уровня триглицеридов не является непосредственной целью фармакотерапии. Приоритетом является достижение целевых показателей холестерина ЛПНП с помощью статинов, чтобы снизить риск сердечно-сосудистых заболеваний.
100 Семейная гиперлипопротеинемия (тип V) смешанная гиперлипидемия - повышение концентрации хиломикронов и ЛПОНП (частота 1:10, множественные генные мутации) значительное повышение уровня ХС и ТАГ (>200 мг/дл) первичная причина - избыточная продукция ЛПОНП в печени отсутствует возможность распада избытка ЛПОНП вызывает гипертриглицеридемию (ТАГ > 200 мг/дл) часть ЛПОНП превращается в ЛПНП (сд-ЛПНП), но они не могут должным образом метаболизироваться, что вызывает повышение уровня холестерина в ходе алкоголизма, плохо проводимого сахарного диабета, ожирения под влиянием вышеперечисленных факторов гиперлипопротеинемия IV типа может переходить в V электрофореграммы липопротеинов плазмы у больных проявляют изменчивость во времени Симптомы (касается ок.50% родственников 1-й степени родства): ожирение и непереносимость глюкозы, метаболический синдром повышение концентрации мочевой кислоты гепатоспленомегалия преждевременное развитие атеросклероза наиболее частая причина ишемической болезни сердца
101 Семейная гиперальфалипопротеинемия Очень редко встречается у лиц с повышенным уровнем антигенов -атерогенные ЛПВП. Концентрация фракции ЛПВП регулируется генетическими, гормональными факторами и факторами окружающей среды, а также влиянием некоторых химических веществ и лекарств (например, пестицидов). Семейная гиперальфалипопротеинемия Повышение уровня ЛПВП Редкое состояние, которое может способствовать здоровью и долголетию
102 Дефицит печеночной липазы Дефицит печеночной липазы Дефицит этого фермента приводит к накоплению больших ТАГ-богатых ЛПВП и остаточных ЛПОНП.Желтуха, ишемическая болезнь сердца
103 Семейная недостаточность лецитин-холестерол-ацилтрансферазы (ЛХАТ) Семейная недостаточность лецитин-холестерол-ацилтрансферазы (ЛХАТ) Отсутствие ЛХАТ приводит к блокированию ретранспорта холестерина. Остаточные ЛПВП с дискоидальной структурой неспособны поглощать и этерифицировать холестерин. Плазменные концентрации эфиров холестерина и лизолецитина низкие. Различают атипичную фракцию ЛПНП (также обнаруживаемую у пациентов с холестазом) и атипичные ЛПОНП (различные по размеру).Вместо ЛПВП появляются две разные фракции липопротеинов. лецитин ЛХАТ лизолецитин + + холестерин, этерифицированный свободный холестерин Лецитин: Холестеролацилтрансфераза (ЛХАТ) ЛХАТ: трансформация диска в сферу Свободный холестерин Сложные эфиры холестерина Нативные ЛПВП ЛХАТ Зрелые КЭ ЛПВП Фосфолипиды плюс сложные эфиры холестерина Холестеразы (CEipyls) ) Болезнь Норум (семейный дефицит ЛХАТ) Особенности: - врожденный дефицит ЛХАТ в крови в результате нарушения синтеза или секреции фермента - снижение концентрации эфиров холестерина во всех фракциях липопротеинов с сопутствующим повышением концентрации лецитина - общего холестерина незначительно снижены, триглицериды в норме - изменения состава всех фракций липопротеидов: разные по величине ЛПНП и ЛПОНП, вместо нормальных ЛПВП появляются две разные фракции липопротеидов Симптомы: - гемолитическая анемия и протеинурия - почечная недостаточность - помутнение роговицы
1 05 Гиполипопротеинемия Абеталипопротеинемия Семейная недостаточность β-липопротеинов Болезнь мандаринов, болезнь рыбьего глаза, апо-дефицит и семейные гиперлипопротеинемии Тип I Тип IIa Тип III Тип IV Тип V Семейная гиперальфалипопротеинемия Абеталипопротеинемия Особенности: - аутосомно-рецессивное наследование - врожденное, полное отсутствие апопротеина В-48, генетически детерминированное отсутствие МТР (анг.микросомальные транспортные белки) - в плазме отсутствуют хиломикроны, ЛПОНП, ЛПНП и ЛПНП - достоверно снижена концентрация триглицеридов, холестерина и фосфолипидов - на электрофореграмме только одна α-полоса, соответствующая фракции ЛПВП Симптомы: - снижено всасывание жиров и витамины А, D, Е и К - многочисленные капли жира в эпителии кишечника, кишечное содержимое перегружено непереваренным жиром - диарея в первые годы жизни - мышечная слабость и спастические мышечные сокращения, нарушения равновесия - неврологические и зрительные расстройства в результате холестерина дефицит витамина Е (демиелинизация нервов, дефекты поля зрения, куриная слепота, дегенерация пигмента сетчатки) — укорочение жизни эритроцитов (акантоцитоз) в результате повышенного содержания холестерина в мембранах эритроцитов.
107 Переваривание и всасывание жиров Соли желчных кислот Соли желчных кислот МТП (микросомальный транспортный белок) Млечные сосуды Лимфа в верхней полой вене Холестерин + триглицериды + белки Эмульсия Мицелы хиломикроны Аппарат Гольджи Крупные капли желудочного жира Гладкая сетка Просвет тонкой кишки Клетки тонкая кишка Жидкая ткань Желчные соли покрывают жировые капли Липаза и колипаза поджелудочной железы расщепляют ТАГ до МАГ и жирных кислот, содержащихся в мицеллах МАГ и кв.толстый. покидают мицеллы и диффундируют в клетку Абсорбированный жир объединяет холестерин с холестерином и белками, транспортируется с образованием хиломикронов в клетки Хиломикроны удаляются лимфатической системой
108
109 Абеталипопротеинемия или ген MTTP Симптомы связывание апоВ с липидами (нет синтеза апоб-100 и апоб-48) Частота 100 во всем мире Характеристика Редко, низкая концентрация ацилглицерина в крови, кишечнике и печени накапливает ацилглицеролы.Кишечная мальабсорбция. Ранняя смерть, которую можно предотвратить введением высоких доз жирорастворимых витаминов. PDI M MTP представляет собой гетеродимер двух разных субъединиц. Субъединица P была идентифицирована как вездесущая шаперондисульфидизомераза (PDI) эндоплазматического ретикулума (ER), в то время как более крупная субъединица M принадлежит к семейству больших белков-переносчиков липидов (LLTP). PDI способствует правильному образованию дисульфидных связей во время биосинтеза образующихся белков.PDI катализирует образование дисульфидных связей. Каталитическая функция теряется, когда DI связан с субъединицей M. Сам по себе PDI не обладает активностью переноса липидов. Нековалентное связывание субъединицы М с PDI образует полнофункциональный липидный транспортный комплекс, MTP.
110 Гипобеталипопротеинемия Признаки: - аутосомно-доминантное наследование - мутации различных генов, кодирующих апопротеин В, приводящие к уменьшению содержания или полному их отсутствию вместе с соответствующими фракциями липопротеинов - гетерозиготы (частота от 1/500 до 1/1000) - клинически здоровые, снижен только до ок.25% - 50% ХС ЛПНП и низкий уровень фосфолипидов, ХС ЛПВП нормальный или слегка повышенный - гомозиготный - такой же, как при абеталипопротеинемии Общий ХС от 25 до 70 мг/дл, в том числе ХС ЛПНП от 0 до 21 мг/дл Фракция ЛПВП нормальная или слегка сниженная Отсутствие хиломикронов после жирной пищи Симптомы: - неврологические симптомы и акантоцитоз, сходные с абеталипопротеинемией
111 Болезнь Танжера (семейный дефицит ЛПВП) Генетическое заболевание, наследуемое по аутосомно-рецессивному типу.Основной причиной является мутация в гене ABCA1 (АТФ-связывающая кассета-1) на хромосоме 9, который кодирует транспортный белок холестерина и фосфолипиды из клетки, что приводит к снижению концентрации и дефектному построению ЛПВП. Признаки: - накопление эфиров холестерина в гистиоцитах многих органов - четко сниженная концентрация общего холестерина, триглицериды обычно несколько повышены, фосфолипиды снижены до 30-50% - нет α-полосы, соответствующей фракции ЛПВП при электрофорезе Клинические симптомы: желтые или оранжевые небные миндалины, сходные оболочки слизистой оболочки зева и прямой кишки - отложение липидов в фибробластах роговицы, слизистой оболочки толстой кишки, миелиновых оболочек (мышечная слабость, нарушение чувствительности) - умеренное увеличение селезенки, лимфатических узлов, печени
112 Болезнь Танжера ( семейный дефицит ЛПВП) Семейный дефицит β-липопротеинов Болезнь мандаринов, болезнь «рыбий глаз», дефицит апо-i Во всех случаях уровень ЛПВП низкий или отсутствует вообще Атеросклероз в пожилом возрасте (причиной мандариновой болезни является мутация в ген, кодирующий апоа-i или ABCA1) A-I аполипопротеин A-I; рецептор ABCA1 A1, содержащий АТФ-связывающую кассету; Рецептор ABCG1 G1, содержащий АТФ-связывающую кассету; холестерин С; сложные эфиры холестерина СЕ; LCAT лецитин-ацилтрансфераза: холестерин; PL фосфолипид; SR-B1 B1-очистительный рецептор.
113
114
115
.МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЗАВЕРШЕНИЕ 2017
1. Микроспутник это:
- предложения с коротким мотивом, повторяющимся в тандеме 2-ряд
- В-меркаптоэтанол
3. Какой из следующих генов не является протоонкогеном: p53
4. Мутация, при которой ген встречается при синдроме Ли-Фраумени: TP53
5.Glybera:
-препарат на основе RAAV для лечения семейной недостаточности липопротеинлипазы
(LPLD)
6. Коэффициент поглощения 0,5. Можно сделать вывод, что образец ДНК
контаминирован:
-фенолами
7.МиРНК можно выделить с помощью: Тризола
назначение комплекса RISC:
- комплекс из белков и РНК, который участвует в подавлении экспрессии генов в процессе
РНК-интерференции.
10. Какой ретровирус вызывает злокачественную опухоль у человека:
-HCV
11. Что делает формалин в препарате для анализа ДНК
а) гидролиз фосфодиэфирных связей
б) сшивание
в) ДНК фракционируется
г) ДНК не теряет своей аналитической ценности
12. Благодаря этому мы можем получать рекомбинантные гены rAAV
- упаковка клеток НЕК 293
13. Между какими стадиями отсутствует контроль клеточного цикла:
А) между G1 и S
B ) между метафазой и анафазой
C) между G2 и M
D) между G0 и g1
14.Отметить неверно, для непрямых методов диагностики при выявлении новообразований
включают:
A) FISH
B) секвенирование по Сагнеру
C) ОТ-ПЦР
D) массив CGH
-
:16. Кумасси бриллиантовый синий
окрашивание – происходит стойкое окрашивание
17. Опухолевые клетки характеризуются:
A) они мелкие и недифференцированные
B) обладают высоким потенциалом репликации
В) имеют явные изменения ядра, цитоскелета и мембраны
.Опубликовано Marucha 30 марта 2020 г. (понедельник)
Пандемия COVID-19 может убить 40 миллионов человек к концу 2020 года, если бы не меры по предотвращению распространения болезни, сообщает Имперский колледж Лондона.
Цифра в 140 миллионов, например, была бы куда более впечатляющей.
Возвращаясь к конкретным фактам. Госпожа Малгожата Розенек пошла на прогулку, о чем позже подробно рассказала в социальных сетях: «Когда мы гуляли с собаками, мы никого не встретили, в том числе и на пляже.Мы вернулись, а там никого не было».

Предыдущий: https://marucha.wordpress.com/2020/03/27/wolne-tematy-21-2020/
Следующий: https://marucha.wordpress.com/2020/04/02/wolne-tematy- 23-2020
Гаёвы Маруча
Нравится Загрузка...
Эта запись была опубликована 2020-03-30 (понедельник) @ 19:05:43 и размещена в разделе Разное. Вы можете следить за любыми ответами на эту запись через RSS 2.0 кормить. И комментарии и запросы в настоящий момент закрыты.
Извините, форма комментариев в настоящее время закрыта.
.Гормональный баланс очень важен для организма каждого человека. Именно гормоны регулируют практически все жизненные процессы. Отклонение от нормы сильно влияет на здоровье человека. Не менее важен ГСПГ (гормон). Он необходим как мужчинам, так и женщинам. Только в зависимости от пола различаются его уровень и значимость.
GSBG расшифровывается как «Глобулин, связывающий половые гормоны». Это вещество связывает тестостерон, который высвобождается в кровь.Стоит отметить, что он сам по себе является белковым веществом, и его связь с тестостероном известна как «синтез ГСПГ». «Идет выработка тканевого глобулина печени. процессы замедляются с возрастом.
Считается, что мужской организм сильнее влияет на гормоны, чем женский. Дело в том, что при повышении значительно повышается уровень эстрогена (женского гормона). И если женщина не сразу замечает отклонения в своем организме, то у мужчин при сильном росте грудь увеличивается и жировая ткань начинает распределяться по женскому типу.
Почему в организме отклонение? На этот вопрос нельзя ответить с уверенностью. Повышение и снижение уровня ГСПГ происходит из-за различных патологий.
Содержание любого вещества в организме человека напрямую зависит от пола и возраста больного. ГСГ — белок плазмы крови — не исключение.
| Возраст (годы) | Стандарт для женщин (NMOL / L) | Стандарт для мужчин (NMOL / L) | |
| 0-2 | <64 | <97 | |
| 2- | <97 | ||
| . 4 | 33-135 | 27-110 | |
| 4-6 | 23-100 | 37-148 | |
| 6-8 | 30-121 | 20-114 | |
| 8 -10 | 26-128 | 38-132 | |
| 10-12 | 16-112 | 21-150 | |
| 12-14 | 19-89 | 13-102 | |
| 14-60 | 18-114 | 13-71 | |
| 60-70 | 17-140 | 15-61 | |
| 70-90 | 39-154 | 15-85 |
Как правило, установлен срок сдачи анализа на определение уровня глобулина, связывающего половые гормоны, встречается редко.Он определяет наличие патологий основного тестостерона. ШГС практически не несет нагрузки. Однако бывают и ситуации, когда определение этого вещества в крови мужчин просто необходимо.
Врачи рекомендуют сдать этот анализ людям, у которых появились первые признаки проблем с половой системой, наблюдается снижение либидо, а также проблемы с зачатием детей.
Белок плазмы SHBG (определяющий его уровень в крови) назначают также при уровне тестостерона в организме мужчины в пределах нормы и наличии различных нарушений.
К внешним отклонениям можно отнести акне, хронические воспалительные процессы предстательной железы, ожирение, увеличение молочных желез, снижение мышечной массы и т.д. Все эти симптомы, как правило, говорят о гормональном нарушении.
Важно помнить, что любое гормональное отклонение свидетельствует о ряде заболеваний. Низкий ШГГ (гормон) - что это такое у мужчин и какими патологиями проявляется?
Важно, что иногда на уровень этого белка влияет и прием человеком гормональных препаратов. Поэтому врачи советуют перед сдачей анализа в обязательном порядке отказаться от любых лекарств, а лучше в течение нескольких дней.
Высокий ГСПГ (гормон) - что это такое у мужчин и какие еще заболевания наблюдаются? Повышенный уровень гормона чаще всего устанавливается при таких патологиях, как гипертиреоз, ВИЧ, СПИД, гепатит.Однако о таких недугах становится известно еще до сдачи крови на определение уровня гормонов.
Стоит отметить, что опытные врачи назначают мужчинам, кроме измерения глобулина в крови, еще и тест на количество тестостерона. Если диагноз действительно имеется, то в мужском организме при высоком индексе GSPG будет мало тестостерона, а если глобулина, наоборот, недостаточно, то тестостерон присутствует в избытке.
Все белки в организме человека синтезируются в печени.Когда у человека здоровая печень и гормоны, как правило, проблем не возникает.
В женском организме гораздо больше эстрогенов, чем тестостерона. Первый гормон увеличивает синтез глобулина, а второй снижает его. Следовательно, гормона HSPG в избытке у представительниц прекрасного пола. За что отвечает это вещество у женщин?
Существует несколько факторов, которые могут исказить результаты анализа.В этом случае ГСПГ (гормон) повышается или понижается в крови. Что это такое у женщин и как избежать плохого результата?
Часто врачи назначают тест на ИСТ вместо теста на ГСПГ (гормон). Что это такое для женщин, будет рассказано ниже.
Для определения генитально-связывающего глобулина используют только венозную кровь (не более 10 мл). Забор производится только натощак.Запрещено употреблять даже чай и кофе, но не исключается и вода при необходимости. В течение дня лучше исключить физические и эмоциональные нагрузки. Не следует употреблять алкоголь и курить накануне. В течение трех дней запрещено употреблять гормоны и заниматься сексом.
Как было сказано ранее, анализ, предназначенный для определения уровня глобулина, назначается очень редко. Женщинам чаще назначают определение уровня ИСТ (индекс свободного тестостерона).На основании лабораторных анализов можно точно определить количество мужских гормонов в организме.
Как правило, такой тест полностью заменяет анализ ГСПГ (гормонов), но не всегда. Чаще всего тестостерон у женщин повышен, но если это число ниже нормы, то назначается анализ на определение уровня глобулина, связывающего половые гормоны.
Теперь необходимо определить, какие патологии ГСПГ (гормона) могут быть снижены или повышены.
Высокий уровень глобулина, как правило, бывает в следующих случаях:
Низкое соотношение белков крови говорит:
Для определения точного уровня белка в крови Настоятельно рекомендуется несколько раз сдать анализ на ГСПГ (гормон). Только на основании нескольких лабораторных исследований опытный врач может заподозрить диагноз. Стоит отметить, что повышение или понижение глобулина крови – это только симптом заболевания, необходимо найти и лечить настоящую причину изменения.
При выявлении высокого уровня белка в крови назначают препараты для его снижения.Все они называются кортикостероидами. Эти препараты могут быть назначены в виде инъекций или таблеток. Статины назначают для повышения ГСПГ.
Если человеческий глобулин ниже или выше нормы, то сначала должна быть назначена развернутая диагностика. Необходимо обследовать щитовидную железу, органы малого таза и брюшную полость.
После того, как у кого-то возникло нарушение уровня GSPG в крови, рекомендуется контролировать этот показатель до конца жизни и поддерживать уровень эстрогена в пределах нормы.Уровень эстрогена у мужчин и женщин разный. Стоит отметить, что если в крови повышены эстрогены, глобулин тоже будет повышен. Эстроген тормозит нормальный рост мышц. Тело с годами не дряблеет, и человек теряет физические силы.
Некоторые препараты, повышающие уровень ГСПГ в крови и нормализующие показатель тестостерона:
Препараты, снижающие показатель глобулинов крови:
Коллаген и кальций-связывающий белок 1 EGF (CCBE1) необходим для лимфангиогенеза. Было показано, что его C-концевой коллагеноподобный домен необходим для активации основного лимфангиогенного фактора роста VEGF-C (сосудистый эндотелиальный фактор роста-C) вместе с протеазой ADAMTS3 (A-дезинтегрин и металлопротеиназа с тромбоспондиновыми мотивами-3).Однако было неясно, как N-концевой домен CCBE1 способствует лимфангиогенной передаче сигналов. Здесь мы показываем, что для эффективной активации VEGF-C требуется его С-концевой домен как in vitro, так и в модели трансгенных мышей. N-концевой EGF-подобный домен CCBE1 усиливал передачу сигналов VEGFR-3 за счет совместной локализации pro-VEGF-C с его активирующей протеазой на лимфатических поверхностях эндотелиальных клеток. В то время как количества ADAMTS3 были ограничены, протеолитическая активация про-VEGF-C поддерживалась N-концевым доменом CCBE1, но не его C-концевым доменом.Единственная аминокислотная замена в ADAMTS3, выявленная у пациента с лимфедемой, была связана с аномальной локализацией CCBE1. Эти результаты показывают, что CCBE1 способствует передаче сигналов VEGFR-3 и лимфангиогенезу посредством различных механизмов, независимо опосредованных двумя доменами CCBE1: путем усиления активности расщепления ADAMTS3 и облегчения совместной локализации VEGF-C и ADAMTS3. Эти новые идеи должны быть полезны при разработке новых терапевтических стратегий, направленных на лимфангиогенез, индуцированный VEGF-C/VEGFR-3.
Фактор роста эндотелия сосудов С (VEGF-C), основной эффектор лимфангиогенеза, необходим для развития лимфатических сосудов у эмбрионов мыши и необходим для большинства процессов лимфангиогенеза у взрослых 1, 2, 3 . VEGF-C опосредует свои сигналы, связывая и активируя рецепторы сосудистого эндотелиального фактора роста VEGFR-3 и VEGFR-2 4 . VEGF-C синтезируется в виде молекулы-предшественника, в которой центральный домен гомологии VEGF (VHD) окружен пропептидами на амино-конце (N) и карбокси (C).Оба пропептида удаляются протеолитически во время продукции активной («зрелой») формы VEGF-C4. Сродство VEGF-C к лимфангиогенному рецептору VEGFR-3 увеличивается с каждым протеолитическим расщеплением, и полученный зрелый белок может также активировать главный ангиогенный рецептор VEGFR-2 4 .
Исследования мутанта VEGF-C с дефицитом С-концевого пропептида (vegfc um18 ) предполагают роль С-концевого пропептида в развитии лимфатических сосудов 5 , и аналогичная мутация была обнаружена у пациента с лимфедемой Милроя 6 .Однако, поскольку мутант VEGF- C18 также проявляет секреторный дефект, ассоциированный фенотип может не отражать все функции С-концевого пропептида. Аденовирусная доставка химерного белка, в котором N- и С-концевые пропептиды VEGF-C фланкировали VHD VEGF-A, приводила к более плотной и мелкозернистой сети лимфатических капилляров, чем VEGF-A 165 , хотя подробный механизм не известен. поступило сообщение 7 .
Мутации, нарушающие передачу лимфангиогенного сигнала, обнаружены в VEGFR-3 и его лиганде VEGF-C; эти мутанты вызывают наследственную лимфедему типа 1А и 1D, 8, 9 соответственно.Недавно мутации в гене CCBE1 (домены эпидермального фактора роста коллагена и кальция) были обнаружены в подгруппе пациентов с синдромом лимфангиэктазии-лимфедемы Hennekam 10 . В соответствии с этими данными делеция Ccbe1 или Vegfc у мышей полностью останавливает развитие лимфатической системы на эмбриональный день (E) 10, 5 11, 12, 13 .
CCBE1 представляет собой секретируемый белок, содержащий N-концевой домен с тремя EGF-подобными повторами для связывания кальция и C-концевой домен с двумя коллагеноподобными повторами 10 .Большинство известных мутаций CCBE1 у человека обнаруживаются в N-концевом EGF-подобном повторе 10, 14 . В моделях рыбок данио и клеточных культур мутации в N-концевом домене переносятся лучше, чем мутации в С-концевом домене 10, 15 . Недавние исследования показали, что дезинтеграция и металлопротеиназа с мотивами тромбоспондина-3 (ADAMTS3) наиболее эффективно активируют VEGF-C в комплексе с CCBE1 11, 15, 16 . Фенотип мышей, отобранных Adamts3, дополнительно подтвердил важность ADAMTS3 для развития лимфатической системы 17 .Активация VEGF-C через ADAMTS3 ускоряется С-концевым коллагеноподобным доменом CCBE1 . Как у мышей с нокаутом Ccbe1, так и у мышей с отсутствием C-концевого коллагеноподобного домена лимфатические структуры полностью отсутствовали, в то время как у мышей с отсутствием N-концевого EGF-подобного домена наблюдались некоторые кластеры лимфатических эндотелиальных клеток (LEC), которые не могли образуют смежные структуры, указывая на то, что N-концевой домен CCBE1 участвует в организации и миграции LEC 15 .
Ранее мы показали, что CCBE1-опосредованная активация про-VEGF-C может происходить непосредственно на поверхности эндотелиальных клеток 16 . Поскольку про-VEGF-C взаимодействует с гепарансульфатпротеогликанами (HSPG) 18 , мы предположили, что совместная локализация про-VEGF-C, CCBE1 и ADAMTS3 на клеточной поверхности может быть необходима для эффективного расщепления про-VEGF. -C для образования зрелого активного VEGF-C, и что N-концевой домен CCBE1 и C-концевой домен VEGF-C могут играть главную роль в этом совместном расположении.
В этом исследовании мы проанализировали распределение VEGF-C, CCBE1 и ADAMTS3 после секреции, участие различных доменов в локализации этих белков и влияние мутантов с делецией домена VEGF-C и CCBE1 на активацию VEGFR-3.
Чтобы исследовать связь VEGF-C с ECM, мы создали различные формы и делеционные мутанты домена VEGF-C (схематически показано на рис. 1a, дополнительная рис. S1).Pro-VEGF-C связывался с ECM, депонированным фибробластами NIH-3T3 (рис. 1b), но не с бесклеточным покровным стеклом (рис. 1d). С-концевой домен VEGF-C (VEGF-C-CT) продемонстрировал связывание с ЕСМ, очень похожее на про-VEGF-C (рис. 1e), в то время как для зрелого VEGF-C не было обнаружено связывания или было обнаружено очень слабое связывание (рис. 1g) или N-концевой пропептид VEGF-C (VEGF-C-NT, фиг. 1f). Мы получили аналогичный результат, когда отложение матрикса происходило одновременно с включением VEGF-C клетками Cos-7, трансфицированными VEGF-C (дополнительная фиг.с S2b по f). Отложение ECM клетками Cos-7 или NIH-3T3 было подтверждено иммуноокрашиванием фибронектина после децеллюляризации (дополнительная рис. S2g). В опытах с изолированными белками связывание pro-VEGF-C было наиболее эффективным и зависимым от концентрации по отношению к фибронектину и в меньшей степени к коллагену I (рис. 1з). Более того, VEGF-C высвобождался из матрицы, депонированной фибробластами, при добавлении гепарина или ADAMTS3 (рис. 1i).
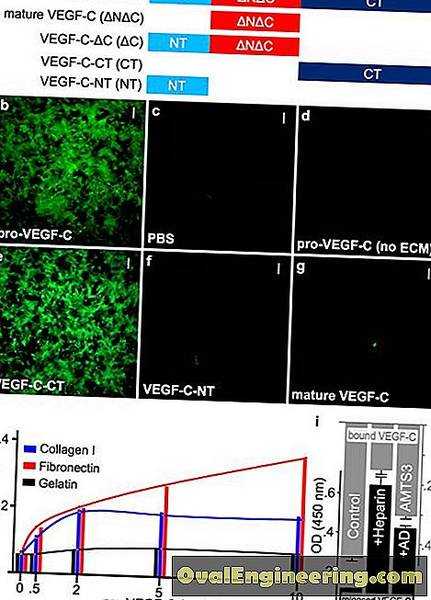
Pro-VEGF-C связывается с внеклеточным матриксом через С-концевой домен.( a ) Схематическое изображение доменных структур различных форм VEGF-C, используемых для продукции белка и получения трансгенных мышей. NT, N-концевой пропептид; ΔNΔC, зрелый VEGF-C (состоящий в основном из домена гомологии VEGF) и CT, С-концевой пропептид. ( b - g ) После удаления клеток и инкубации с различными рекомбинантными белками связанный с ECM VEGF-C визуализировали с помощью антисыворотки против VEGF-C 6 (которая выявляет все формы VEGF-C). Pro-VEGF-C ( b ) и С-концевой домен VEGF-C ( e ) связываются с депонированным ВКМ, в то время как для N-концевого домена VEGF-C ( f) связывания не обнаружено. ) или формы зрелого домена VEGF-C ( г ).PBS ( c ) и про-VEGF-C, используемые для желатинизированных покровных стекол без отложения матрицы ( d ), использовали в качестве контролей. ( h ) Pro-VEGF-C эффективно и специфически связывается с фибронектином и, в меньшей степени, с коллагеном I. В отличие от коллагена I фибронектин, по-видимому, способен неспецифически связывать дополнительные про-VEGF-C после насыщения специфических участков. привязки. ( и ) Твердофазный анализ связывания VEGF-C, высвобождаемого из бесклеточного ЕСМ.VEGF-C эффективно высвобождается из ECM, депонированного клетками Cos-7, экспрессирующими VEGF-C, после инкубации с рекомбинантным ADAMTS3 или гепарином, но только небольшое количество VEGF-C высвобождается с D-MEM/0,1% BSA (контроль). Шкала баров: 50 мкм.
Полноразмерное изображение
Мутированная рыбка данио , которая экспрессирует укороченный VEGF-C без С-концевого домена (vegfc um18 ), имеет лимфатические аномалии, указывающие на то, что С-концевой домен играет важную роль в развитии лимфатической системы 5 .Чтобы исследовать лимфангиогенный потенциал С-концевого домена VEGF-C, мы создали трансгенных мышей, которые сверхэкспрессируют в первичных эпидермальных кератиноцитах либо С-концевой домен VEGF-C (VEGF-C-CT), либо VEGF-C без C. -терминальный домен (VEGF-C-ΔC), находящийся под контролем промотора кератина 14 (K14). Экспрессия обоих трансгенов была подтверждена с помощью ОТ-ПЦР (дополнительная фигура S3a) и иммуногистохимически для белков, кодируемых трансгенами (дополнительная фигура S3b).
Лимфатическая гиперплазия была видна в коже мышей K14-VEGF-C-ΔC по сравнению с их однопометниками дикого типа при анализе с помощью окрашивания кожи Lyve-1 или Vegfr3 по всей поверхности (рис.2a, d, количественная оценка на рис. 2e и S4e, S4h) и иммуногистохимия срезов кожи Lyve-1 (рис. S4a, S4d). Кожные лимфатические сосуды мышей K14-VEGF-C-ΔC были функциональными, что определялось флуоресцентной микролимфангиографией (фиг. 2g).
С-конец VEGF-C усиливает лимфангиогенный ответ на VEGF-C, но сам по себе подавляет лимфангиогенез. Иммунофлюоресцентное окрашивание кожи уха Lyve-1 на коже уха из K14-VEGF-C-ΔC ( a ), K14-VEGF-C-CT ( b ), K14-VEGF-C-ΔC x K14- VEGF-C-CT ( c ) и однопометные мыши дикого типа (WT) ( d ).( e ) Количественное определение положительного участка Lyve-1 в коже уха, окрашенного по всей коже. ** Р <0,01; п ≥ 4; Масштабная линейка: 150 мкм. ( f ) Количественная оценка положительных ответвлений сосудов Lyve-1 на поле. ** Р <0,01; n ≥ 4. ( г - j ) Флуоресцентная микролимангиография ушей взрослых мышей. Место инъекции декстрана FITC указано белой стрелкой. ( k ) Pro-VEGF-C (0,25 мкг/мл) индуцирует умеренную выживаемость клеток Ba/F3-hVEGFR-3/EpoR, возможно, опосредованную эндогенными протеазами.Однако добавление VEGF-C-CT (0,6 мкг/мл, 10-кратный молярный избыток) было эффективным в ингибировании опосредованного про-VEGF-C выживания.
Полноразмерное изображение
Удивительно, но в коже взрослых мышей было меньше лимфатических сосудов, которые экспрессировали С-концевой домен VEGF-C, чем в коже их братьев и сестер дикого типа (рис. 2b, d, количественно на рис. 2e), а лимфатическая сеть имела меньше точек ветвления (рис. 2b, d, количественная оценка на рис. 2f, дополнительные рис. S4f, S4h).Флуоресцентная микролимфография показала, что лишь немногие из этих лимфатических сосудов функционировали (рис. 2h). Однако наиболее тяжелая лимфатическая гиперплазия наблюдалась в коже двойных трансгенных мышей K14-VEGF-C-ΔC x K14-VEGF-C-CT (рис. 2c и дополнительные рис. S4c, S4g, количественная оценка на рис. 2e). Это было видно и при флуоресцентной микролимфографии (рис. 2и). Почти полное ингибирование активности про-VEGF-C при 10-кратном молярном избытке С-концевого домена VEGF-C также наблюдалось in vitro с использованием биоанализа, который измеряет выживаемость клеток Ba/F3 через химерный рецептор VEGFR-3/EpoR ( Инжир.2к). Система кровообращения не претерпела значительных изменений в коже ни одной из этих трансгенных мышей (рис. Дополнительные S5a, S5b).
Чтобы понять, почему С-концевой домен VEGF-C усиливает лимфангиогенез в контексте VEGF-C-ΔC, но ингибирует лимфангиогенез при экспрессии отдельно, мы исследовали комплементацию VEGF-C-CT и VEGF-C-ΔC в витро. Когда VEGF-C экспрессировали с полноразмерной кДНК в клетках Т 293, процессинг эндогенно экспрессируемыми протеазами приводил к зрелому VEGF-C (фиг.3, переулок 4, желтая стрелка) 4 . При экспрессии укороченного мутанта VEGF-C-ΔC, в котором отсутствует С-концевой домен, активация VEGF-C ингибировалась (дорожка 2, желтая стрелка указывает на сильно уменьшенную полосу) и накапливался незрелый VEGF-C (дорожка 2, пурпурная стрелка) . Однако при совместной экспрессии С-концевого домена активационный блок частично повышается и может образовываться зрелый VEGF-C (дорожка 6, желтая стрелка). Важно отметить, что связывание как незрелого, так и зрелого VEGF-C с его рецептором VEGFR-3 сохранялось благодаря наличию С-концевого домена (сравните полосы, указанные зелеными стрелками).Это спасение происходило, когда С-концевой домен VEGF-C экспрессировался как часть полноразмерной полипептидной цепи VEGF-C (дорожка 11) или как отдельная полипептидная цепь, которая дополняла укороченную мутацию VEGF-C-ΔC (дорожка 13). . Та же картина наблюдалась независимо от того, были ли белки разделены в невосстанавливающих (рис. 3) или восстанавливающих условиях (дополнительная рис. S6).
С-конец VEGF-C восстанавливает протеолитический процессинг и связывание рецептора VEGF-C-ΔC in vitro.Преобразование про-VEGF-C (пурпурная стрелка) в зрелый VEGF-C (желтые стрелки) и способность связываться с VEGFR-3 (зеленые стрелки) снижаются, когда С-конец исключен из VEGF-C. Расщепление VEGF-C (дорожка 6) и характер его связывания с VEGFR-3 (дорожка 13) нормализуются, когда VEGF-C-ΔC коэкспрессируется с VEGF-C-CT. Метаболически меченые белки осаждали из кондиционированной среды трансфицированных клеток Т 293 слитыми белками VEGFR-3-Ig, антисывороткой 882 или антителом против V5 (VEGF-C-CT помечен V5) и анализировали с помощью 12% SDS-PAGE при редуцирующие и невосстанавливающие условия.Вестерн-блоты в полный рост показаны на дополнительном рисунке S12.
Полноразмерное изображение
Поскольку С-концевой домен VEGF-C оказался необходимым для активации VEGF-C, мы обратились к белкам CCBE1 и ADAMTS3. ADAMTS3 активирует VEGF-C16, а CCBE1 является обязательным компонентом активационного комплекса 11 . Наши предыдущие наблюдения показали, что эффективная и быстрая активация VEGF-C происходит на клеточных поверхностях, и поэтому мы предположили, что ADAMTS3 и/или CCBE1 могут влиять на распределение VEGF-C.
Было показано, чтоCCBE1 экспрессируется в подмножестве Prox-1-позитивных клеток во время раннего эмбрионального развития мышей (E9.5) 19 и LEC-положительных для Prox1 кожи человека 20 . Транскриптомный анализ выявил примерно в три раза более высокие уровни экспрессии CCBE1 в LEC, чем в эндотелиальных клетках кровеносных сосудов (BEC) 21 . Предполагалось, что CCBE1 располагается в ВКМ после секреции, по-видимому, из-за его сродства к витронектину 12 .Однако окрашивание тканей мышей антителами CCBE1, Prox-1 и Lyve-1 показало, что CCBE1 находится в основном на поверхности LEC (рис. 4а). Слабое окрашивание CCBE1 также наблюдалось на BEC. CCBE1 был высвобожден с культивируемых поверхностей LEC путем обработки высоким содержанием соли и обнаружен с помощью Western / ELISA (дополнительная фигура S7d). Поскольку также неэндотелиальные клетки могут продуцировать CCBE1 in vivo, мы провели количественную ПЦР (рис. 4b, дополнительная рис. S8) и Вестерн-блоттинг (рис. 4c) супернатантов культивируемых клеток, чтобы идентифицировать типы клеток, продуцирующие CCBE1.Мы обнаружили, что эндотелиальные клетки, особенно LEC, экспрессируют значительное количество CCBE1. Однако самые высокие уровни экспрессии были обнаружены в фибробластах (например, в клеточной линии фибробластов легкого MRC-5) и в клеточной линии рака молочной железы человека DU4475 22 . В твердофазных анализах связывания мы обнаружили, что CCBE1 специфически связывается с VEGFR-3 и что это связывание зависит от присутствия первых N-концевых Ig-подобных доменов, которые составляют связывающую VEGF-C/VEGF-D часть VEGFR. -3 (рис. 4г). Когда клетки Cos-7 трансфицировали векторами экспрессии для CCBE1 и ADAMTS3, и ADAMTS3, и CCBE1 были локализованы на поверхности клетки (дополнительная фиг.С7а, С7б). Подобно про-VEGF-C, ADAMTS3 может высвобождаться с поверхности клетки путем добавления гепарина (дополнительные рисунки S7b, S7c).
CCBE1 экспрессируется в фибробластах и лимфоидных эндотелиальных клетках и располагается на поверхности лимфатических эндотелиальных клеток. ( a ) Локализация CCBE1 на поверхности лимфоидных эндотелиальных клеток (LEC) в коже уха мыши (окрашивание всей поверхности), задней части кожи и кишечнике (срезы), как показано при совместном окрашивании Prox-1 или Lyve-1.Экспрессию CCBE1 анализировали с помощью количественной ПЦР ( b ) и вестерн-блоттинга ( c ). Полноразмерные пятна показаны на дополнительном чертеже S12. Среди проанализированных первичных клеточных линий CCBE1 экспрессировался с помощью LEC и HUVEC. Из протестированных клеточных линий MRC-5 (фибробласты) и DU4475 (рак молочной железы) показали самую высокую экспрессию CCBE1. ( d ) В анализе с очищенными белками N-концевой домен CCBE1 (CCBE1-175) связывается с иммобилизованным VEGFR-3 и витронектином. Связывание с VEGFR-3 требует присутствия связывающих VEGF-C доменов VEGFR-3 (иммуноглобулинподобные домены 1-3).Шкала баров: 100 мкм.
Полноразмерное изображение
Поскольку и pro-VEGF-C, и CCBE1 взаимодействуют с VEGFR-3, мы исследовали, как взаимодействие pro-VEGF-C и CCBE1 влияет на распределение pro-VEGF-C. Мы стимулировали эндотелиальные клетки свиной аорты, экспрессирующие VEGFR-3 (PAE), про-VEGF-C с N-концевым доменом CCBE1 или без него (CCBE1-175).После стимуляции в присутствии CCBE1-175 концентрация про-VEGF-C снижалась в жидкой фазе (рис. 5а, левая панель). Примечательно, что концентрация про-VEGF-C в супернатанте клеток PAE, не экспрессирующих VEGFR-3, также снижалась, что свидетельствует о связывании с HSPG (рис. 5а, правая панель). К нашему удивлению, анализы с очищенными про-VEGF-C, CCBE1 и VEGFR-3 показали, что N-концевой домен CCBE1 конкурирует с про-VEGF-C за связывание VEGFR-3 (дополнительная рис. S9a).
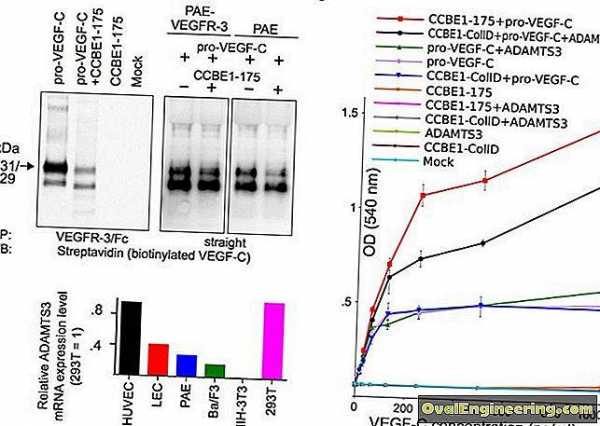
N-концевой домен CCBE1 влияет на распределение и активность про-VEGF-C в клеточных анализах.( a ) Клетки PAE, экспрессирующие VEGFR-3, подвергали воздействию биотинилированного про-VEGF-C с N-концевым доменом CCBE1 и без него (CCBE1-175). Анализ супернатанта после инкубации показывает значительное снижение количества про-VEGF-C после инкубации с CCBE1-175. На левой панели остаточный VEGF-C в супернатанте был иммунопреципитирован растворимым рецептором VEGFR-3 (VEGFR-3/Fc) перед анализом. Обратите внимание, что истощена только верхняя полоса про-VEGF-C. ( b ) Сравнение уровней экспрессии ADAMTS3 с помощью количественной ПЦР.Уровни экспрессии различных типов клеток нормализовали до Т-клеток 293. Обратите внимание, что все протестированные клеточные линии, за исключением клеток NIH-3T3, в некоторой степени экспрессируют ADAMTS3. Две разные пары праймеров дали сходные результаты (данные показаны для пары праймеров 1). ( c ) Рекомбинантный CCBE1-175 усиливает действие про-VEGF-C на клетки Ba/F3-hVEGFR-3/EpoR по сравнению с одним про-VEGF-C или смесью про-VEGF-C и C- терминальный домен CCBE1 (CCBE1-CollD). Увеличение количества ADAMTS3 путем добавления среды, кондиционированной ADAMTS3, также делает этот анализ чувствительным к обнаружению активности CCBE1-CollD.Обратите внимание, что все пять элементов управления накладываются друг на друга. Полноразмерные пятна показаны на дополнительном чертеже S13.
Полноразмерное изображение
Чтобы исследовать влияние N-концевого домена CCBE1 на передачу сигналов VEGFR-3, мы хотели определить анализы, которые различают активности N-концевого и C-концевого доменов CCBE1. Сначала мы сравнили экспрессию ADAMTS3 на клеточной панели с помощью количественной ПЦР. Мы наблюдали экспрессию ADAMTS3 в HUVEC, LEC, Ba/F3-hVEGFR-3/EpoR и в клетках PAE, стабильно экспрессирующих VEGFR-3 (PAE-VEGFR-3) (рис.5б). Однако мы не обнаружили какой-либо экспрессии ADAMTS3 в фибробластах NIH-3T3. Поскольку клетки Ba/F3-hVEGFR-3/EpoR и PAE-VEGFR-3 очень мало экспрессировали ADAMTS3, мы выбрали эти клетки для анализа активности N-концевого домена CCBE1. Стоит отметить, что N-концевой домен CCBE1 (CCBE1-175) сильно способствовал выживанию клеток Ba/F3-hVEGFR-3/EpoR при совместном использовании с pro-VEGF-C, в то время как использование C-концевого домена CCBE1 ( CCBE1-CollD) вместе с про-VEGF-C не вызывали какого-либо заметного увеличения выживаемости по сравнению с одним про-VEGF-C (фиг.5в). Чтобы проверить, может ли недостаточное количество ADAMTS3 быть причиной отсутствия ответа на CollD CCBE1, мы добавили 5 мкл кондиционированной среды ADAMTS3. Это повышало активность про-VEGF-C в присутствии CCBE1-CollD до уровней, сравнимых с активностью про-VEGF-C в присутствии CCBE1-175. Кроме того, мы стимулировали клетки PAE, стабильно экспрессирующие VEGFR-3 pro-VEGF-C, что приводило к очень слабому фосфорилированию VEGFR-3 (дополнительный рисунок S9b, дорожка 3) по сравнению с фосфорилированием, индуцированным зрелым VEGF-C (дополнительный рисунок S9b, дорожка 2) .Однако при совместном использовании CCBE1-175 и про-VEGF-C наблюдалось повышенное фосфорилирование VEGFR-3 (дополнительная рис. S9b, Pas 5). Напротив, CCBE1-CollD индуцировал лишь слабое фосфорилирование при инкубации вместе с про-VEGF-C (дополнительная рис. S9b, Pas 7).
Затем мы проверили свойства варианта Adamts3, который имеет гетерозиготную замену аргинин 565 → глутамин (R565Q) в мотиве ADAMTS3 тромбоспондина типа 1 (TSP-1) (рис.6а). Этот аллель первоначально был идентифицирован как редкий гетерозиготный полиморфизм у пациента с лимфедемой и 6 здоровых членов исследуемой семьи, а также у 236 из 120 650 аллелей (0, 1956%) в базе данных Exome Aggregation Consortium (ExAC) 23 . Сначала мы сравнили влияние варианта ADAMTS3 WT и варианта R565Q на активацию про-VEGF-C. Обе формы ADAMTS3 поддерживали процессинг pro-VEGF-C при совместной трансфекции в 293 Т-клетки (рис. 6b, слева) или при совместной инкубации кондиционированных супернатантов (рис.6б, справа). Поскольку в предыдущих исследованиях 11, 16 было показано, что ADAMTS3 взаимодействует с CCBE1, мы хотели посмотреть, влияет ли замена R565Q на это взаимодействие. Путем совместной иммунопреципитации кондиционированных сред из 293 Т-клеток, трансфицированных CCBE1 и ADAMTS3, мы обнаружили сильное взаимодействие между CCBE1 и ADAMTS3 дикого типа, в то время как взаимодействие между CCBE1 и заменой R565Q оказалось намного слабее (рис. Дополнительный S10, полоса 2 по сравнению с полосой 3).
Замена R565Q в ADAMTS3 нарушает взаимодействие ADAMTS3 с CCBE1. ( a ) Схематическая структура домена ADAMTS3 (Uniprot) и расположение замены R565Q. TSP-1: тромбоспондин 1; PLAC: протеаза и лакунин. ( b ) Вариант R565Q ADAMTS3 активирует про-VEGF-C, а также ADAMTS3 дикого типа как при совместной экспрессии в 293 T-клетках с VEGF-C (слева), так и при смешанной кондиционированной среде (CM) из индивидуально трансфицированных 293 T-клеток (Хорошо).( c ) Более высокие количества CCBE1 присутствуют в кондиционированной среде варианта ADAMTS3-R565Q или ложно-трансфицированных клеток по сравнению с кондиционированной средой клеток дикого типа, трансфицированных ADAMTS3. Белок CCBE1 секретируется в виде основного белка массой приблизительно 45-50 кДа и в виде хондроитинилированной полосы рассеяния приблизительно 100 кДа 11, 16. Полноразмерные пятна показаны на дополнительной фигуре S13.
Полноразмерное изображение
Снижение способности замены R565Q ADAMTS3 к совместному осаждению с CCBE1 не было связано с более низкими уровнями CCBE1 в супернатанте клеточной культуры.Напротив, уровень CCBE1 в супернатантах клеток, трансфицированных ADAMTS3-R565Q, был выше, чем в супернатантах клеток, трансфицированных ADAMTS3 дикого типа (рис. 6c, средняя и правая линии). Отсутствие взаимодействия замены R565Q ADAMTS3 с CCBE1 приводило к смещению с клеточной поверхности, связанному со свободным CCBE1. Это было очевидно, потому что ложно-трансфицированные культуры, которые продуцировали только низкие (эндогенные) количества ADAMTS3, демонстрировали такие же высокие уровни свободного CCBE1, как и клетки, трансфицированные вариантом ADAMTS3 R565Q (фиг.6в, левая строка).
Наши результаты показывают, что про-VEGF-C становится локализованным из-за его С-концевого домена во внеклеточном матриксе (ECM), особенно в фибронектине и на клеточной поверхности. Точно так же CCBE1 находится в LEC через N-концевой домен. Поскольку активация про-VEGF-C с помощью ADAMTS3 зависит от сборки расщепляющего комплекса, содержащего CCBE1, ADAMTS3 и про-VEGF-C11, совместная локализация этих компонентов на клеточной поверхности значительно увеличивает вероятность активации VEGF-C. что согласуется с предыдущими наблюдениями о том, что активация VEGF-C на клеточной поверхности повышается более эффективно, чем в растворимой фазе 16 , и что активация может усиливаться N-концевым доменом CCBE1 12, 16, 24 .
Снижение лимфангиогенного потенциала С-конца VEGF-C в модели трансгенных мышей, вероятно, связано с тем фактом, что эффективная активация (т.е. N-концевое расщепление) VEGF-C зависит от присутствия его С-конца. , как показано в анализах комплементации in vitro. Используя мутант, устойчивый к расщеплению С-конца, Bui et al. показали, что N-концевое расщепление может происходить независимо от С-концевого расщепления 11 . Как для про-VEGF-C дикого типа, так и для устойчивого к расщеплению мутанта, использованного Bui et al.С-конец все еще присоединен к белку, тогда как у делеционного мутанта, который мы анализировали in vivo и in vitro, он отсутствует. Следовательно, присутствие (ковалентно или нековалентно связанного) С-конца, по-видимому, необходимо для эффективной активации VEGF-C путем удаления его N-концевого пропептида. Сверхэкспрессия С-концевого домена VEGF-C у трансгенных мышей уменьшала количество лимфатических сосудов по сравнению с братьями и сестрами из помета дикого типа. У этих мышей С-концевой домен VEGF-C, вероятно, ингибирует эндогенную активацию VEGF-C, конкурируя с С-концевым доменом про-VEGF-C за сборку комплекса расщепления.Такое ингибирование также можно продемонстрировать с помощью клеточного анализа Ba/F3-VEGFR-3/EpoR (рис. 2k).
N-концевой домен CCBE1 способствовал иммобилизации pro-VEGF-C из растворимой фазы на поверхности эндотелиальных клеток независимо от присутствия VEGFR-3. Напротив, в анализах с очищенными белками про-VEGF-C он конкурировал с CCBE1 за прямое связывание с VEGFR-3. Однако чистый эффект CCBE1 на клеточной поверхности увеличивает локальную концентрацию VEGF-C, чему также способствуют нейропилин- 16 , синдекан-4 18 и интегрин β-1 25, 26 , которые стабилизируют VEGFR -3/VEGF-C взаимодействие.В дополнение к прямой активации про-VEGF-C16, связанного с VEGFR-3, значительная часть про-VEGF-C может сначала взаимодействовать с CCBE1 и ADAMTS3 независимо от VEGFR-3 на участках клеточной поверхности, содержащих синдекан-4 18 , а зрелый VEGF после расщепления -C будет активировать соседний VEGFR-3.
Присутствие комплекса активации CCBE1/ADAMTS3 может определять, образует ли VEGF-C градиент фактора роста или действует ненаправленным образом. Активация про-VEGF-C на поверхности LEC обеспечивает преимущественно ненаправленный митогенный сигнал, в то время как продукция зрелого VEGF-C из секвестрированного в ECM про-VEGF-C может обеспечивать обучающий градиент для формирования и моделирования сети, аналогично как градиенты VEGF-A работают в ангиогенезе 27, 28 .Такой инструктивный сигнал, по-видимому, отсутствует у мышей, у которых отсутствуют EGF-подобные домены CCBE1. У этих мышей LEC они могут группироваться, но не могут собираться в функциональную сеть , которая сильно отличается от мышей, лишенных коллагеноподобного домена CCBE1, и фенотипически имитирует полную делецию гена Ccbe1. Во время развития высвобождение VEGF-C из ВКМ, вероятно, опосредуется исключительно ADAMTS3, поскольку делеция гена Adamts3 останавливает весь лимфангиогенез 17 .Однако другие протеазы, такие как плазмин 29 , вероятно, участвуют в восстановлении тканей и патологическом лимфангиогенезе.
В анализах фосфорилирования VEGFR-3 и Ba/F3-hVEGFR-3/EpoR С-концевой домен CCBE1 не проявлял значительной активности, в то время как N-концевой домен CCBE1 повышал фосфорилирование VEGF-C VEGFR-3 и стимулировали выживание клеток. Низкие количества ADAMTS3, экспрессируемые клетками PAE и Ba/F3, по-видимому, отличают функцию усиления расщепления С-концевого домена CCBE1.Хотя количества ADAMTS3 ограничены, их коллокализация с VEGF-C и CCBE1, по-видимому, необходима для значимой активации VEGF-C. Добавление экзогенного ADAMTS3 позволило обнаружить активность С-концевого домена ССВЕ1 в анализе активации VEGF-C. Интересно, что добавление CCBE1-CollD вместе с про-VEGF-C не увеличивало активацию про-VEGF-C выше фоновых уровней. Полное отсутствие ADAMTS3 исключает обнаружение активности всех форм CCBE1. Действительно, стимуляция про-VEGF-C клеток NIH-3T3/hVEGFR-3, не имеющих обнаруживаемого ADAMTS3, не приводила к многократному увеличению фосфорилирования VEGFR-3, независимо от того, N-концевой или С-концевой домен CCBE1 (неопубликованное исследование автора). данные).
Присутствие мотива TSP-1 в ADAMTS3 предполагает его связь с клеточной поверхностью, что подтверждается нашими данными вестерн-блоттинга. Это дополнительно способствовало бы преимущественной установке комплекса расщепления на клеточных поверхностях. Сообщалось, что мотив TSP-1 ADAMTS4 связывается со своим партнером по взаимодействию с клеточной поверхностью CD36 30 . Мы не наблюдали каких-либо различий в процессинге VEGF-C между Т-клетками 293, трансфицированными VEGF-C, и ADAMTS3 дикого типа или мутантным вектором ADAMTS3-R565Q, но CCBE1 не удалось соединиться с клеточной поверхностью в трансфицированной клетке ADAMTS3-R565Q.
Остаток R565 сохраняется среди всех членов семейства ADAMTS и между видами (дополнительная фигура S11). Мутация R368H гомологичной аминокислоты в ADAMTS13, которая расщепляет фактор фон Виллебранда, была одним аллелем сложной гетерозиготной формы врожденной тромботической тромбоцитопенической пурпуры 31 . До сих пор все анализы мутанта ADAMTS13 in vitro показали только эффекты на синтез, секрецию или каталитическую активность. Хотя мы не сравнивали ферментативную активность или секрецию мутантных белков R565Q с белками дикого типа, наши данные предполагают изменение внеклеточной локализации как потенциальный механизм заболевания.Поскольку аллель R565Q ADAMTS3 был гетерозиготным у пациента и поскольку он не отменял полностью взаимодействие ADAMTS3 с CCBE1, он может не объяснять фенотип лимфедемы, предполагая, что он действует как модификатор фенотипа лимфедемы в этой семье.
На основании нашего текущего исследования и результатов Bui, Johns and Roukens 11, 15, 18 мы предлагаем улучшенную модель активации VEGF-C (рис. 7). Согласно нашей модели, VEGF-C и CCBE1 12 секвестрированы в ECM и на клеточной поверхности.Для инициации лимфангиогенеза сначала запускается про-VEGF-C. Мобилизованный протеазой VEGF-C будет немедленно доступен для передачи сигнала, в то время как про-VEGF-C может либо активироваться во внеклеточном пространстве, либо перемещаться на поверхность эндотелиальных клеток, где он может быть эффективно активирован комплексом CCBE1/протеаза. В зависимости от того, состоит ли этот расщепляющий комплекс из VEGFR-3 или HSPG, VEGF-C может немедленно начать передачу сигналов или сначала потребуется транслокация из HSPG в VEGFR-3.
Схематическое изображение активации VEGF-C на основе текущих экспериментальных данных. Протеолитическое расщепление pro-VEGF-C одновременно активирует и мобилизует VEGF-C. Мы предлагаем четыре различных режима активации VEGF-C: 1. Активация VEGF-C 16 , связанного с VEGFR-3; 2. Активация HSPG-связанного VEGF-C18; 3. Активация VEGF-C в растворимой фазе 11 ; и 4. Активация VEGF-C, связанная с ЕСМ. После протеолитической активации связанный с VEGF-C VEGFR-3 может немедленно начать передачу сигналов (режим активации № 1), в то время как связанный с HSPG VEGF- C18 должен сначала переключиться на VEGFR-3 (режим активации № 2).Хотя активация VEGF-C происходит в растворе (режим активации № 3), локализация про-VEGF-C, CCBE1 и ADAMTS3 указывает на то, что значительная часть активации VEGF-C связана с ЕСМ (режим активации № 4) или клетками. поверхности (режимы активации №4) №1 и №2). В режиме активации № 2 показано, что про-VEGF-C обрабатывается во время присоединения HSPG. Однако про-VEGF-C вполне может мигрировать сначала от HSPG к VEGFR-3 и активироваться во время связывания VEGFR-3. Роль CCBE1 двояка: он ускоряет протеолитическое расщепление (опосредовано его С-концевым доменом) и локализует про-VEGF-C для эффективного образования тримерного активационного комплекса (опосредовано его N-концевым доменом).
Полноразмерное изображение
Мы предполагаем, что разные места активации VEGF-C могут определять миграцию по сравнению с активностью, способствующей пролиферации VEGF-C. Зрелый VEGF-C имеет более низкое сродство к гепарину, чем про-VEGF- C18 . Его высвобождение из отложений ВКМ может иметь важное значение для создания градиента, тем самым направляя и организуя лимфангиогенный ответ, в то время как активация про-VEGF-C на поверхности лимфатических эндотелиальных клеток не обеспечивает градиента фактора роста для миграции, а просто служит сигнал к пролиферации и выживанию ЛОЖЬ ВНИЗ.
Определение активации VEGF-C важно не только для понимания развития лимфатической системы, но и для понимания ангиогенеза опухоли, поскольку зрелый VEGF-C также способен активировать сигнальный путь VEGFR-2 и поскольку некоторые опухоли могут ускользать от ангиогенеза терапии с использованием VEGF-C вместо VEGF-A 32 . Остается понять, может ли ингибирование активации VEGF-C обеспечить стратегию лечения таких видов рака.
Трансфекции и процедуры 293 T и Cos-7 выполняли, как описано в 16 .
Ba/F3-hVEGFR-3/EpoR 33 проводили с кондиционированной средой для культивирования клеток или рекомбинантными белками, как описано 34 . Для анализа ингибирования VEGF-C 0,25 мкг/мл про-VEGF-C смешивали с 0,6 мкг/мл (10-кратный молярный избыток) VEGF-C-CT. Аналогично, для тестирования эффектов VEGF-C, опосредованных CCBE1-175, использовали CCBE1-175 и CCBE1-CollD в концентрации 10 мкг/мл и про-VEGF-C в концентрации 1 мкг/мл.293 Т-клетки трансфицировали плазмидой, кодирующей ADAMTS3, и использовали 5 мкл кондиционированной среды на каждую тестовую лунку.
Стимуляцию фосфорилирования VEGFR-3 проводили в чашках для культивирования клеток диаметром 60 мм (~ 1 миллион клеток/чашку), как описано 16 , с N-концевым доменом ΔNNC-VEGF-C, про-VEGF-C, CCBE1 (CCBE1 -175) и С-концевой домен CCBE1 (CCBE1-CollD) в концентрациях 0, 02, 0, 4, 5 и 5 мкг/мл соответственно в 0,5-1 мл D-MEM/0,1% БСА.
293 Т-клетки трансфицировали плазмидами, кодирующими полноразмерные VEGF-C, VEGF-C-ΔC, VEGF-C-CT, как VEGF-C-ΔC, так и VEGF-C-CT, а также пустой плазмидой и метаболически меченными [ 35 S]-цистеин/[ 35 S]-метионин (PerkinElmer, Waltham, MA). Через 48 часов супернатанты собирали и иммунопреципитированные белки разделяли с помощью SDS-PAGE и визуализировали с помощью авторадиографии.
Подробнее см. в разделе «Дополнительная информация».
Экспрессионные кассеты K14-VEGF-C-ΔC и K14-VEGF-C-CT вводили в оплодотворенные ооциты мышей FVB/N. Мышей генотипировали с помощью ПЦР хвостовой ДНК с использованием 5' прямого праймера. -GCTCTGGGTTCCAGGTTCCACTGG-3? А поменять начала 5? -CGTCTTGCTGAGGTAGCTCGTGC-3? -VEGF-C-CT). Трансгенную экспрессию подтверждали с помощью RT-PCR эмбриональной РНК кожи с использованием праймеров для генотипирования. Для дальнейшего анализа были отобраны три линии-основателя из обоих трансгенных штаммов.Национальный совет по экспериментам на животных провинциального управления Южной Финляндии одобрил все эксперименты на животных, проведенные в рамках этого исследования, и все эксперименты на животных проводились в соответствии с инструкциями и правилами. Мышей содержали в индивидуально вентилируемых клетках с материалами для обогащения в учреждении, контролируемом в соответствии с руководящими принципами и рекомендациями Федерации европейских лабораторий зоотехники.
Антисыворотка против VEGF-C 635, Антисыворотка против VEGF-C 882 4 , Антитела против VEGF-C (R&D Systems, Миннеаполис, Миннесота, AF752), Антитела против V5 (Invitrogen, Carlsbad, CA, # 46 -0705), антитела к фосфотирозину 4G10 (Merck Millipore, Billerica, MA), антитела к CCBE1 (Atlas Antibodies AB, Стокгольм, Швеция, # HPA041374) и антитела к ADAMTS3 (Санта-Крус, Даллас, Техас, sc-21486 ) их использовали как для иммунопреципитации, так и для вестерн-блоттинга.Антитела против VEGFR-3 (Santa Cruz, sc-321), химерные VEGFR-3/Fc 33 и стрептактинсептарозу (IBA, Göttingen, Germany) использовали только для иммунопреципитации. Конъюгат стрептактин-HRP (IBA, № 2-1502-001) использовали для вестерн-блоттинга. Для окрашивания использовали следующие антитела; поликлональные кроличьи антимышиные Lyve-1 13 , козьи античеловеческие PROX1 (R&D Systems, AF2727), антифибронектин (SIGMA, F3648), антисыворотки к VEGF-C 6, анти-CCBE1, антигипокаликсин (R&D Systems, AF1556) и козий антимышиный VEGFR-3 (R&D Systems, AF743).Первичные антитела выявляли с помощью соответствующих конъюгатов антител Alexa Fluor 488, 594 или 647 (Molecular Probes).
выполняли, как описано в 36 с , с использованием антител Lyve-1, CCBE1 и VEGFR-3, а затем конъюгированных вторичных антител Alexa 488, 594 и 647 (Molecular Probes, Invitrogen, Life Technologies, Карлсбад, Калифорния).
парафиновых срезов иммуноокрашивали антителами Lyve-1 с использованием набора для усиления сигнала тирамида (NEN Life Sciences/PerkinElmer Life and Analytical Sciences, Бостон, Массачусетс).Для иммунофлуоресцентного окрашивания сосудов использовали антитела к субокалоксину.
Площадь, покрытая лимфатическими сосудами (микрофотографии целых срезов, окрашенных Lyve-1, 6 микрофотографий/мышей), и количество субокалксиновых сосудов определяли количественно с помощью программного обеспечения ImageJ. Точки разветвления лимфатических сосудов на поле подсчитывали вручную. Для количественной оценки использовали по 4-6 мышей каждого генотипа. Для визуализации функциональных лимфатических сосудов использовали декстран, конъюгированный с FITC (2000 кДа, Sigma-Aldrich, St.Louis, Миссури) вводили внутрикожно в ухо, и с помощью флуоресцентной микроскопии визуализировали лимфатическое поглощение красителя.
Для обнаружения CCBE1 в лимфатических сосудах образцы тканей (задняя кожа и кишечник) были собраны у мышей C57BL/6J в возрасте 7-8 недель. Иммунофлуоресцентное окрашивание проводили на парафиновых срезах с использованием антител к CCBE1, Lyve-1, Prox-1 и подокалаксину и соответствующих вторичных антител, конъюгированных с Alexa (Molecular Probes).
Образцы были визуализированы с помощью эпифлуоресцентного микроскопа AxioImager.Z2 и конфокального микроскопа Zeiss LSM 780.
клеток NIH-3T3 или Cos-7 выращивали на покровных стеклах, покрытых 0,1% желатином, в 24- или 48-луночных культуральных планшетах в течение до 8 дней, меняя среду (с добавлением аскорбиновой кислоты, 50 мкг/мл, SIGMA) каждые 48 дней. часы. Клетки осторожно удаляли, как описано 12 , или, альтернативно, путем инкубации клеток с 20 мМ Nh5OH, 5 мМ ЭДТА при комнатной температуре при осторожном вращении планшета, так что неповрежденный ЕСМ оставался на покровных стеклах.ЕСМ инкубировали с 4 мкг/мл про-VEGF-C или 4-кратным молярным избытком других белков VEGF-C в течение ночи при 4°С с последующей фиксацией 4% PFA и блокированием 1% BSA в PBS в течение 1 часа при РТ. Затем покровные стекла иммуногистохимически окрашивали антисывороткой против VEGF-C 6 (1:200) и против фибронектина (1:200), а затем вторичным конъюгированным антителом Alexa 488. Флуоресцентные изображения получали с использованием эпифлуоресцентного микроскопа AxioImager.Z2 ( Carl Zeiss AG, Оберкохен, Германия).
293 T, 293 F, Cos-7, мышиный эмбриональный фибробласт (MEF, подарок Томи Мякеля, Университет Хельсинки), 293T-CCBE1-StrepIII 16 , PAE-VEGFR-3 37 , Ba/F3-hVEGFR -3/EpoR Cells 33 и NIH-3T3 выращивали в D-MEM 10% FCS. Клетки MRC-5 выращивали в E-MEM 10% FCS. LEC и HUVEC были приобретены у Promocell (Heidelberg, Германия) и поддерживались в соответствии с инструкциями поставщика.
293T-CCBE1-StrepIII трансфицировали конструкциями ADAMTS3, ADAMST3-R565Q или имитации экспрессии.Через 24 часа среду меняли на D-MEM/0,2% BSA. Через 48 часов ADAMTS3 иммунопреципитировали из кондиционированных сред антителами/белком G-сефарозой или стрептактин-сефарозой. Затем иммунопреципитаты разделяли с помощью SDS-PAGE и определяли с использованием стрептактина-HRP.
Были проведены твердофазные анализы связывания для определения относительного связывания CCBE1-175 с VEGFR-3. 96-луночные планшеты для микротитрования (Maxisorp, Nunc) покрывали рекомбинантным витронектином-Fc 38 , различными слитыми белками VEGFR-3/IgG человека или BSA в концентрации 20 мкг/мл в PBS в течение ночи при 4°C.Затем планшеты тщательно промывали PBS и блокировали 2% BSA в течение 2 часов при комнатной температуре. CCBE1-175-V5 (10 мкг/мл в PBS) связывали с планшетами с покрытием в течение ночи при 4°C в присутствии 1 мМ CaCl 2 . Планшеты промывали 0,05% Tween-20/PBS (PBST), блокировали 5% BSA/PBST (PBSTB) в течение 1 часа при комнатной температуре и затем инкубировали в течение 2 часов с антителом против V5 (1:500 в PBSTB). Планшеты промывали PBST и затем инкубировали с анти-мышиным HRP (1:500 в PBSTB) в течение 1 часа при комнатной температуре. После тщательной промывки PBS планшеты инкубировали в TMB (Thermo Scientific) в течение 7 минут с последующим добавлением 1 М HCl для остановки реакции.Планшеты считывали при 450 нм.
Для количественной оценки связывания про-VEGF-C с матриксными белками для покрытия использовали коллаген типа 1 (BD Biosciences, № 354249), желатин (SIGMA, G1890) или фибронектин (SIGMA, F08952) (в PBS в концентрации 20 мкг/мл). . Для обнаружения VEGF-C использовали антисыворотку 6 (1:2000) против VEGF-C.
Анализ высвобождения про-VEGF-C из ЕСМ проводили путем трансфекции клеток Cos-7 плазмидами, кодирующими полноразмерный VEGF-C, в 96-луночных планшетах. Через 24 часа после трансфекции среду для культивирования клеток заменяли на D-MEM/0.2% BSA и через 72 часа после трансфекции среду удаляли и лунки промывали PBS с последующей децеллюляризацией 20 мМ NH 4 OH, 5 мМ EDTA в PBS в течение 10 минут при комнатной температуре. Лунки промывали PBS и инкубировали с 5 мкг/мл ADAMTS3 или 100 мкг/мл гепарина в D-MEM/0,2% BSA в течение 2 часов при 37°С. После инкубации количества VEGF-C количественно определяли отдельно для остаточного VEGF-C в бесклеточном матриксе (на том же планшете) и высвобожденного VEGF-C в супернатанте (на отдельном 96-луночном планшете Maxisorp после иммобилизации в течение ночи). .Промывку, блокирование и обнаружение проводили так же, как и для анализов твердофазного связывания.
выполняли, как описано 16 . Для получения дополнительной информации см. дополнительную информацию.
Для выявления белка CCBE1 в супернатантах первичных клеток и клеточных линий на чашки диаметром 10 см высевали равное количество клеток. Через 24 часа среду меняли на D-MEM/1% FCS и клетки инкубировали еще 48 часов.Собирали супернатанты и иммунопреципитировали CCBE1, разделяли с помощью SDS-PAGE и визуализировали с помощью вестерн-блоттинга.
Данные были проанализированы с использованием программного обеспечения для статистического анализа GraphPad Prism (версия 6). Данные представлены как среднее значение ± стандартное отклонение. Значимость различий определяли с помощью однофакторного дисперсионного анализа с последующим апостериорным тестом Тьюки. Все статистические тесты были двусторонними. При сравнении двух средних использовали непарный критерий Стьюдента. Данные считались значимыми при Р<0.05.
Мы благодарим Таню Лаакконен, Тапио Тайнолу и Энни Исокангас за отличную техническую помощь и управление лабораторией. Мы также благодарим Отделение визуализации Biomedicum, Основной центр переноса генов и клеточной терапии AAV Биоцентра Финляндии, а также Центр лабораторных животных Университета Хельсинки за профессиональные услуги. Авторы также благодарят Геномную платформу Лувенского университета в Брюсселе за анализ секвенирования следующего поколения.Академия Финляндии (номера грантов 202852, 204312, 265982, 272683, 273612 и 273817), Европейский исследовательский совет (ERC-2010-AdG-268804, Marie Curie Actions FP7/2007-2013REA 317250), Фонд Ледук (11CVD03), и Финский фонд сердечно-сосудистых исследований получили признание за финансирование. Лаборатория Йелча получила дальнейшую поддержку Фонда Джейн и Аатоса Эркко, Онкологического общества Финляндии, Фонда Магнуса Эрнрута и Фонда К. Альбина Йоханссона. Интегрированная докторская программа наук о жизни поддерживала заработную плату SKJ.Лаборатория Виккула финансируется за счет гранта Бельгийской программы межуниверситетских полюсов притяжения научной политики (BELSPO-IAP) в рамках проекта IAP p7/43-BeMGI, Fonds de la recherche Scientifique-FNRS (T.0026.14) и FRFS- ВЕЛБИО (WELBIO-CR-2015A).
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и положения сообщества.Если вы обнаружите что-либо оскорбительное или несовместимое с нашими условиями или правилами, отметьте это как неприемлемое.
.