2011-2017 © МБУЗ ГКП № 7, г.Челябинск.
11.10.2021
Дисбактериоз — это изменение привычной микрофлоры организма человека. Данная болезнь проявляется из-за врожденных аномалий желудочно-кишечного тракта, кишечных инфекций, облучения или перенесенной операции. Но все-таки главной причиной появления этого недуга является употребление разных антибиотиков.
Характерными признаками дисбактериоза являются:
Главное составляющее лечение — это правильное питание.
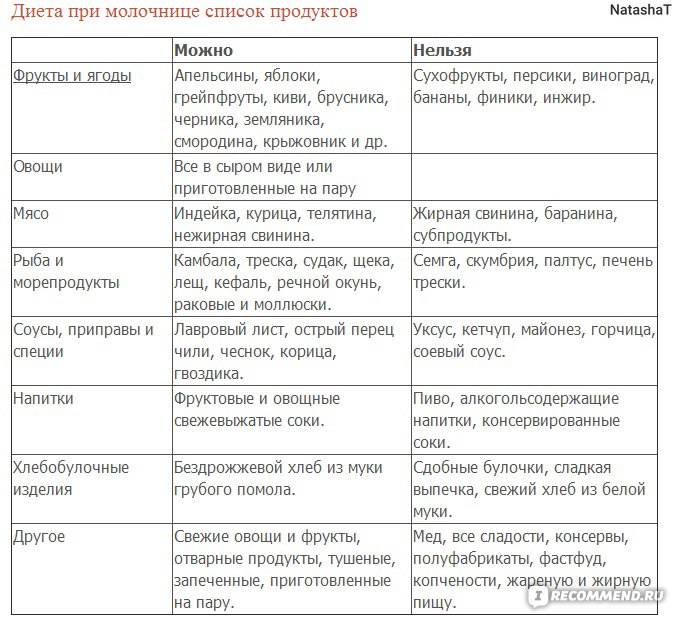
Лечение питанием не имеет в виду, полное ограничение количества порции или соблюдение временных промежутков ее приема. Кушать можно, сколько хочется, и когда захочется. Просто слушайте свой организм, потому что он лучший ваш советчик.
Для развития нормальной микрофлоры кишечника в рацион должны входить продукты или препараты с содержанием бифидобактерий или лактобактерий, которые восстановят микрофлору. К ним относятся картофельный, рисовый, тыквенный экстракты, а также морковный сок и молочная сыворотка.
При синегнойном нарушении нужно есть, как можно больше красного сладкого перца и черную смородину.
При стафилококковом — чеснок, землянику, чернику, малину.
При протейном обострении для питания подойдут малина, клюква, чеснок.
При кандиозном — помогут мята, фенхель, брусника, черемша. При гнилостном воспалении, под рукой нужно иметь тмин, бруснику и смородину.
При обострении главными блюдами должны быть: протертые каши, для удобства можно использовать блендер, супы на воде или слабом бульоне, кисели из черники и вишни, сухари, крепкий чай. Постепенно можно добавлять разварную рыбу, паровые котлеты, протертый творог, мясные фрикадельки.
Опубликовано в Питание и диеты Премиум Клиник
Масса микрофлоры желудочно-кишечного тракта составляет 2,5 кг. Нормальная кишечная микрофлора выполняет ряд функций в организме человека. Она является антагонистической по отношению к патогенной и условно патогенной, что предупреждает развитие острой кишечной инфекции, синтезирует витамины, активирует иммунитет.
Термин «дисбактериоз кишечника» включает:
 coli (с ферментативной недостаточностью или гемолизирующими свойствами).
coli (с ферментативной недостаточностью или гемолизирующими свойствами).Следует отметить, что дисбактериоз (синонимы избыточный бактериальный рост в кишечнике, дисбиоз) не является самостоятельным заболеванием и возникает у пациентов на фоне разных состояний и заболеваний, что следует учитывать в процессе выработки тактики лечения.
По статистике дисбактериоз чаще всего касается маленьких детей или женщин.
Огромное количество трудоспособного активного населения допускает нарушения в режиме питания (в современном ритме жизни человек порой заменяет полноценный завтрак, который должен проходить в неторопливой атмосфере, перекусами на бегу), испытывает частые и хронические стрессы, ведёт прием лекарственных препаратов.
Неправильно спланированное питание, как правило, сочетается с нервной нагрузкой в течение рабочего дня и неблагоприятными факторами: пробки по пути на работу, очереди, стрессы.
В итоге, один из этих факторов, либо их сочетание, становится причиной возникновения множества болезней ЖКТ, в том числе и дисбактериоза.
Клинические проявления дисбактериоза включают местные (кишечные) симптомы, а также системные нарушения, обусловленные транслокацией кишечной микрофлоры во внутреннюю среду организма (лимфатические узлы-мезадениты, мочевыводящая система-пиелонефрит, печень-стеатоз, цирроз, холестаз).

Дисбактериоз делится на 4 степени:
Окончательно диагностировать данное заболевание можно только с помощью бактериологического посева или биохимического анализа. В первом случае на питательную среду высеивается кал и в течение недели специалисты получают результат соотношения бактерий. Во втором случае выявляется количество жирных кислот, а также отдел, в котором произошло нарушение и его стадия.
Одно из направлений в диагностике дисбактериоза- исследование содержания в выдыхаемом воздухе различных метаболитов, которые продуцируются с участием кишечных бактерий. Кроме того, в настоящее время внедряются в практику химические методы, позволяющие определять виды бактерий и грибов в разных средах с использованием газовой хроматографии.
Медицинский центр «АРМЕД» располагает собственной сертифицированной лабораторией. Для выявления дисбактериоза пациенту будет необходимо сдать ряд анализов, перечень которых дас ваш лечащий врач.
Терапия больных дисбактериозом включает лечение основного заболевания (на фоне которого развился дисбактериоз) и восстановление нормального состава кишечных бактерий.
В целом лечение состоит из:
Назначается диета с учётом типа диспепсии, моторных нарушений и основного заболевания.
Чтобы лечение проходило эффективнее, нужно обязательно соблюдать правила: есть небольшими порциями, но каждые 3 часа, исключить белый хлеб, солёную и жирную пищу. Напитки употреблять после приёма пищи спустя полчаса.
Таким образом, проблема дисбактериоза кишечника остаётся актуальной. Явление дисбактериоза следует рассматривать как вторичное состояние, требующее уточнение причин его развития. Лечебная тактика корректируется с учётом с основного заболевания.
Для предотвращения такого недуга как дисбактериоз к лечению нужно подходить комплексно, а также при возникновении первых признаков обратиться к врачу.
При обнаружении симптомов дисбактериоза записывайтесь на приём гастроэнтеролога в медицинском центре «АРМЕД» по телефону 8 (862) 254-55-55, мы находимся в г. Сочи по адресу: ул. Гагарина д.19 а.
[1] Финкельштейн Э. А., Трогдон Дж.Г., Коэн Дж.В., Дитц В. Годовые медицинские расходы, связанные с ожирением: оценки по плательщикам и услугам. Health Aff [Интернет] 2009 г. [цитировано 26 сентября 2016 г.]; 28:w822-31. Доступно по адресу: http://content.healthaffairs.org/cgi/doi/10.1377/hlthaff.28.5.w822; http://dx.doi.org/10.1377/hlthaff.28.5.w822 [PubMed] [CrossRef] [CrossRef] [Google Scholar]
А., Трогдон Дж.Г., Коэн Дж.В., Дитц В. Годовые медицинские расходы, связанные с ожирением: оценки по плательщикам и услугам. Health Aff [Интернет] 2009 г. [цитировано 26 сентября 2016 г.]; 28:w822-31. Доступно по адресу: http://content.healthaffairs.org/cgi/doi/10.1377/hlthaff.28.5.w822; http://dx.doi.org/10.1377/hlthaff.28.5.w822 [PubMed] [CrossRef] [CrossRef] [Google Scholar]
[2] Ogden CL, Carroll MD, Curtin LR, McDowell MA, Tabak CJ, Флегал КМ. Распространенность избыточного веса и ожирения в США, 19 лет99–2004. JAMA [Интернет] 2006. [цитировано 26 сентября 2016 года]; 295:1549-55. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16595758; PMID: 16595758; http://dx.doi.org/10.1001/jama.295.13.1549 [PubMed] [CrossRef] [Google Scholar]
[3] Lagier J-C, Million M, Hugon P, Armougom F, Raoult D. Микробиота кишечника человека: репертуар и вариации. Front Cell Infect Microbiol [Интернет], 2012 г. [цитируется по состоянию на 26 сентября 2016 г.]; 2:136. Доступно по адресу: http://www. ncbi.nlm.nih.gov/pubmed/23130351; PMID: 23130351; http://dx.doi.org/ 10.3389/fcimb.2012.00136 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ncbi.nlm.nih.gov/pubmed/23130351; PMID: 23130351; http://dx.doi.org/ 10.3389/fcimb.2012.00136 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[4] Mandal RS, Saha S, Das S. Метагеномные исследования микробиоты кишечника. Genomics Proteomics Bioinformatics [Интернет], 2015 г. [цитируется 26 сентября 2016 г.]; 13:148-58. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26184859; PMID: 26184859; http://dx.doi.org/10.1016/j.gpb.2015.02.005 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[5] Леоне В., Гиббонс С.М., Мартинес К., Хатчисон А.Л. , Хуан Э.Ю., Чам С.М., Пьер Дж.Ф., Хенеган А.Ф., Надимпалли А., Хьюберт Н. и др.. Влияние суточных колебаний кишечных микробов и питания с высоким содержанием жиров на функцию циркадных часов и метаболизм хозяина. Cell Host Microbe [Интернет], 2015 г. [цитировано 26 сентября 2016 г.]; 17:681-9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25891358; PMID: 25891358; http://dx.doi.org/ 10.1016/j.chom. 2015.03.006 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2015.03.006 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[6] Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JFWM, Dallinga-Thie GM, Ackermans MT, Serlie MJ, Oozeer R и др.. Перенос кишечной микробиоты от худощавых доноров повышает чувствительность к инсулину у лиц с метаболическим синдромом. Гастроэнтерология [Интернет] 2012. [цитировано 26 сентября 2016 г.]; 143:913-6.e7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/22728514; http://dx.doi.org/ 10.1053/j.gastro.2012.06.031 [PubMed] [CrossRef] [Google Scholar]
[7] Turnbaugh PJ, Ridaura VK, Faith JJ, Rey FE, Knight R, Gordon JI. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных гнотобиотических мышах. Sci Transl Med [Интернет] 2009. [цитировано 26 сентября 2016 г.]; 1:6ra14. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/20368178; PMID: 20368178; http://dx.doi.org/10.1126/scitranslmed.3000322 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[8] Работ С. , Мембрез М., Брюно А., Жерар П., Харах Т., Мозер М., Раймонд Ф., Мансурян Р., Чоу С.Дж. Безмикробные мыши C57BL/6J устойчивы к резистентности к инсулину, вызванной диетой с высоким содержанием жиров, и имеют измененный метаболизм холестерина. FASEB J [Интернет] 2010. [цитировано 26 сентября 2016 г.]; 24:4948-59. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/20724524; PMID: 20724524; http://dx.doi.org/ 10.1096/fj.10-164921 [PubMed] [CrossRef] [Google Scholar]
, Мембрез М., Брюно А., Жерар П., Харах Т., Мозер М., Раймонд Ф., Мансурян Р., Чоу С.Дж. Безмикробные мыши C57BL/6J устойчивы к резистентности к инсулину, вызванной диетой с высоким содержанием жиров, и имеют измененный метаболизм холестерина. FASEB J [Интернет] 2010. [цитировано 26 сентября 2016 г.]; 24:4948-59. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/20724524; PMID: 20724524; http://dx.doi.org/ 10.1096/fj.10-164921 [PubMed] [CrossRef] [Google Scholar]
[9] Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Связанный с ожирением кишечный микробиом с повышенной способностью собирать энергию. Nature [Интернет], 2006 г. [цитировано 20 июня 2016 г.]; 444:1027-131. Доступно по адресу: http://www.nature.com/doifinder/10.1038/nature05414; PMID: 17183312; http://dx.doi.org/10.1038/nature05414 [PubMed] [CrossRef] [Google Scholar]
[10] Бекхед Ф., Лей Р.Э., Зонненбург Дж.Л., Петерсон Д.А., Гордон Дж.И. Хозяин-бактериальный мутуализм в кишечнике человека. Science [Интернет], 2005 г. [цитировано 26 сентября 2016 г.]; 307:1915-20. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/15790844; http://dx.doi.org/10.1126/science.1104816 [PubMed] [CrossRef] [Google Scholar]
Science [Интернет], 2005 г. [цитировано 26 сентября 2016 г.]; 307:1915-20. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/15790844; http://dx.doi.org/10.1126/science.1104816 [PubMed] [CrossRef] [Google Scholar]
[11] Savage DC. Микробная экология желудочно-кишечного тракта. Annu Rev Microbiol [Интернет] 1977. [цитировано 9 ноября 2016 г.]; 31:107-33. Доступно по адресу: http://www.annualreviews.org/doi/10.1146/annurev.mi.31.100177.000543; PMID: 334036; http://dx.doi.org/10.1146/annurev.mi.31.100177.000543 [PubMed] [CrossRef] [Google Scholar]
[12] Sender R, Fuchs S, Milo R, Bianconi E, Piovesan A, Facchin F, Beraudi A, Casadei R, Frabetti F, Savage D и др.. Пересмотренные оценки количества клеток человека и бактерий в организме. PLOS Biol [Интернет] 2016. [цитировано 8 ноября 2016]; 14:e1002533. Доступно по адресу: http://dx.plos.org/10.1371/journal.pbio.1002533; PMID: 27541692; [13] Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight РД, Гордон Дж.И. Ожирение изменяет микробную экологию кишечника. Proc Natl Acad Sci U S A [Интернет], 2005 г. [цитировано 26 сентября 2016 г.]; 102:11070-5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16033867; PMID: 16033867; http://dx.doi.org/10.1073/pnas.0504978102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Proc Natl Acad Sci U S A [Интернет], 2005 г. [цитировано 26 сентября 2016 г.]; 102:11070-5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/16033867; PMID: 16033867; http://dx.doi.org/10.1073/pnas.0504978102 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[14] Sze MA, Schloss PD. В поисках сигнала в шуме: новый взгляд на ожирение и микробиом. MBio [Интернет], 2016 г. [цитировано 9 ноября 2016 г.]; 7:e01018-16. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/27555308; PMID: 27555308; [15] Shen W, Gaskins HR, McIntosh MK. Влияние пищевых жиров на кишечные микробы, воспаление, барьерную функцию и метаболические результаты. J Nutr Biochem [Интернет] 2014. [цитировано 26 сентября 2016 года]; 25:270-80. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2435579.3; PMID: 24355793; http://dx.doi.org/10.1016/j.jnutbio.2013.09.009 [PubMed] [CrossRef] [Google Scholar]
[16] Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: кишечные микробы человека, связанные с ожирением. Nature [Интернет], 2006 г. [цитировано 26 сентября 2016 г.]; 444:1022-3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/17183309; PMID: 17183309; http://dx.doi.org/ 10.1038/4441022a [PubMed] [CrossRef] [Google Scholar]
Nature [Интернет], 2006 г. [цитировано 26 сентября 2016 г.]; 444:1022-3. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/17183309; PMID: 17183309; http://dx.doi.org/ 10.1038/4441022a [PubMed] [CrossRef] [Google Scholar]
[17] Wang L, Li P, Tang Z, Yan X, Feng B. Структурная модуляция микробиоты кишечника и взаимосвязь с массой тела: сравнительная оценка лечения лираглутидом и саксаглиптином. Sci Rep [Интернет] 2016. [цитировано 26 сентября 2016 г.]; 6:33251. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/27633081; PMID: 27633081; http://dx.doi.org/ 10.1038/srep33251 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[18] Пальеха А., Кашани А., Аллин К.Х., Нильсен Т., Чжан С., Ли И., Брач Т., Лян С., Фенг К., Йоргенсен Н.Б. и др.. Желудочное шунтирование по Ру у пациентов с морбидным ожирением вызывает быстрые и стойкие изменения индивидуальной микробиоты кишечника. Genome Med [Интернет] 2016. [цитировано 26 сентября 2016 г.]; 8:67. Доступно по адресу: http://www. ncbi.nlm.nih.gov/pubmed/27306058; PMID: 27306058; http://dx.doi.org/ 10.1186/s13073-016-0312-1 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ncbi.nlm.nih.gov/pubmed/27306058; PMID: 27306058; http://dx.doi.org/ 10.1186/s13073-016-0312-1 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[19] Лиу А.П., Пазюк М., Луевано Дж.М., Машини С., Тернбо П.Дж., Каплан Л.М. Сохраняющиеся сдвиги в микробиоте кишечника из-за обходного желудочного анастомоза снижают массу тела хозяина и ожирение. Sci Transl Med [Интернет] 2013. [цитировано 26 сентября 2016 г.]; 5:178ra41. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23536013; PMID: 23536013; http://dx.doi.org/10.1126/scitranslmed.3005687 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[20] Fei N, Zhao L. Оппортунистический патоген, выделенный из кишечника тучного человека, вызывает ожирение у стерильных мышей. ISME J [Интернет] 2013. [цитировано 26 сентября 2016 года]; 7:880-4. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2323529.2; PMID: 23235292; http://dx.doi.org/ 10.1038/ismej.2012.153 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[21] Woting A, Pfeiffer N, Loh G, Klaus S, Blaut M. Clostridium ramosum способствует ожирению, вызванному диетой с высоким содержанием жиров, у гнотобиотических моделей мышей. MBio [Интернет], 2014 г. [цитировано 26 сентября 2016 г.]; 5:e01530-14. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25271283; PMID: 25271283; http://dx.doi.org/ 10.1128/mBio.01530-14 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Clostridium ramosum способствует ожирению, вызванному диетой с высоким содержанием жиров, у гнотобиотических моделей мышей. MBio [Интернет], 2014 г. [цитировано 26 сентября 2016 г.]; 5:e01530-14. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25271283; PMID: 25271283; http://dx.doi.org/ 10.1128/mBio.01530-14 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[22] Камеяма К., Ито К. Колонизация кишечника бактерией Lachnospiraceae способствует развитию диабета у мышей с ожирением. Microbes Environ [Интернет] 2014. [цитировано 26 сентября 2016 года]; 29:427-30. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25283478; PMID: 25283478; http://dx.doi.org/ 10.1264/jsme2.ME14054 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[23] Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Биндельс Л.Б., Гио И., Дерриен М., Муччиоли Г.Г., Делзенн Н.М. и др.. Взаимодействия между Akkermansia muciniphila и кишечным эпителием контролируют вызванное диетой ожирение. Proc Natl Acad Sci U S A [Интернет], 2013 г. [цитировано 26 сентября 2016 г.]; 110:9066-71. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23671105; PMID: 23671105; http://dx.doi.org/ 10.1073/pnas.1219451110 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Proc Natl Acad Sci U S A [Интернет], 2013 г. [цитировано 26 сентября 2016 г.]; 110:9066-71. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23671105; PMID: 23671105; http://dx.doi.org/ 10.1073/pnas.1219451110 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[24] Schneeberger M, Everard A, Gómez-Valadés AG, Matamoros S, Ramirez С., Делзенн Н.М., Гомис Р., Кларет М., Кани П.Д. Akkermansia muciniphila обратно коррелирует с началом воспаления, изменением метаболизма жировой ткани и метаболическими нарушениями при ожирении у мышей. Sci Rep [Интернет] 2015. [цитировано 26 сентября 2016 г.]; 5:16643. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26563823; PMID: 26563823; http://dx.doi.org/ 10.1038/srep16643 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[25] Ремели М., Хиппе Б., Геретшлегер И., Стегмайер С., Хефингер И., Хасльбергер А. Увеличение разнообразия микробиоты кишечника и количества Faecalibacterium prausnitzii и Akkermansia после голодания: пилотное исследование. Wien Klin Wochenschr [Интернет] 2015. [цитировано 26 сентября 2016 г.]; 127:394-8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25763563; PMID: 25763563; http://dx.doi.org/ 10.1007/s00508-015-0755-1 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Wien Klin Wochenschr [Интернет] 2015. [цитировано 26 сентября 2016 г.]; 127:394-8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25763563; PMID: 25763563; http://dx.doi.org/ 10.1007/s00508-015-0755-1 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[26] Dao MC, Everard A, Aron-Wisnewsky J, Соколовска Н., Прифти Э., Вергер Э.О., Кайзер Б.Д., Левенес Ф., Шиллу Дж., Хойлс Л. и др.. Akkermansia muciniphila и улучшение метаболического здоровья во время диетического вмешательства при ожирении: связь с богатством кишечного микробиома и экологией. Gut [Интернет] 2016. [цитировано 26 сентября 2016 года]; 65:426-36. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/261009.28; PMID: 26100928; http://dx.doi.org/10.1136/gutjnl-2014-30877824336217 [PubMed] [Google Scholar]
[27] David LA, Maurice CF, Carmody RN, Gootenberg DB, Button JE, Wolfe BE, Ling A V, Девлин А.С., Варма Ю., Фишбах М.А. и др.. Диета быстро и воспроизводимо изменяет микробиом кишечника человека. Nature [Интернет], 2014 г. [цитировано 26 сентября 2016 г.]; 505:559-63. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/24336217; PMID: 24336217; http://dx.doi.org/ 10.1038/nature12820 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Nature [Интернет], 2014 г. [цитировано 26 сентября 2016 г.]; 505:559-63. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/24336217; PMID: 24336217; http://dx.doi.org/ 10.1038/nature12820 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[28] Кармоди Р.Н., Гербер Г.К., Луевано Дж.М., Гатти Д.М., Сомес Л., Свенсон К.Л., Тернбо П.Дж. Диета доминирует над генотипом хозяина в формировании микробиоты кишечника мышей. Клеточный микроб-хозяин [Интернет] 2015 г. [цитировано 26 сентября 2016 г.]; 17:72-84. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25532804; PMID: 25532804; [29] Huang EY, Leone VA, Devkota S, Wang Y , Брэди М.Дж., Чанг Э.Б. Состав пищевого источника жира формирует архитектуру кишечной микробиоты и изменяет медиаторы воспаления хозяина в жировой ткани мыши. JPEN J Parenter Enteral Nutr [Интернет] 2013. [цитировано 26 сентября 2016]; 37:746-54. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23639.897; PMID: 23639897; http://dx.doi.org/ 10. 1177/0148607113486931 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1177/0148607113486931 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[30] Devkota S, Wang Y, Musch MW, Leone V, Fehlner-Peach H, Надимпалли А., Антонопулос Д.А., Джабри Б., Чанг Э.Б. Таурохолевая кислота, индуцированная диетическим жиром, способствует распространению патобионтов и колиту у мышей Il10-/-. Nature [Интернет], 2012 г. [цитировано 26 сентября 2016 г.]; 487:104-8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/22722865; PMID:22722865 [бесплатная статья PMC] [PubMed] [Google Scholar]
[31] Цезарь Р., Тремароли В., Ковачева-Датчари П., Кани П.Д., Бэкхед Ф. Перекрестные помехи между кишечной микробиотой и диетическими липидами усугубляют воспаление WAT посредством передачи сигналов TLR. Cell Metab [Интернет] 2015. [цитировано 26 сентября 2016 года]; 22:658-68. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26321659; PMID: 26321659; http://dx.doi.org/10.1016/j.cmet.2015.07.026 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[32] Henriques J, Dick JR, Tocher DR, Bell JG . Пищевая ценность продуктов из лосося, доступных у крупных розничных продавцов в Великобритании: содержание и состав ПНЖК с длинной цепью n-3. Br J Nutr [Интернет] 2014. [цитировано 26 сентября 2016 года]; 112:964-75. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25017007; PMID: 25017007; http://dx.doi.org/10.1017/S0007114514001603 [PubMed] [CrossRef] [Google Scholar]
Пищевая ценность продуктов из лосося, доступных у крупных розничных продавцов в Великобритании: содержание и состав ПНЖК с длинной цепью n-3. Br J Nutr [Интернет] 2014. [цитировано 26 сентября 2016 года]; 112:964-75. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25017007; PMID: 25017007; http://dx.doi.org/10.1017/S0007114514001603 [PubMed] [CrossRef] [Google Scholar]
[33] Пирилло А., Катапано А.Л. Полиненасыщенные жирные кислоты омега-3 в лечении атерогенной дислипидемии. Atheroscler Suppl [Интернет] 2013. [цитировано 26 сентября 2016 года]; 14:237-42. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23958479; PMID: 23958479; http://dx.doi.org/10.1016/S1567-5688(13)70004-7 [PubMed] [CrossRef] [Google Scholar]
[34] Папаниколау Ю., Брукс Дж., Рейдер С., Фулгони В.Л. Взрослые люди в США не соблюдают рекомендуемые уровни потребления рыбы и омега-3 жирных кислот: результаты анализа с использованием данных наблюдений NHANES 2003-2008. Nutr J [Интернет], 2014 г. [цитировано 26 сентября 2016 г.]; 13:31. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/24694001; PMID: 24694001; http://dx.doi.org/ 10.1186/1475-2891-13-31 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[цитировано 26 сентября 2016 г.]; 13:31. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/24694001; PMID: 24694001; http://dx.doi.org/ 10.1186/1475-2891-13-31 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[35] Lam YY, Ha CWY, Hoffmann JMA, Oscarsson J , Динудом А., Мазер Т.Дж., Кук Д.И., Хант Н.Х., Катерсон И.Д., Холмс А.Дж. и др.. Влияние профиля пищевых жиров на проницаемость кишечника и микробиоту и их взаимосвязь с метаболическими изменениями у мышей. Ожирение (Серебряная весна) [Интернет], 2015 г. [цитировано 26 сентября 2016 г.]; 23:1429-39. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26053244; PMID: 26053244; http://dx.doi.org/10.1002/oby.21122 [PubMed] [CrossRef] [Google Scholar]
[36] Cummings JH, Jenkins DJ, Wiggins HS. Измерение среднего времени прохождения пищевых остатков через кишечник человека. Gut [Интернет] 1976. [цитировано 26 сентября 2016 г.]; 17:210-8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/1269989; PMID:1269989; http://dx. doi.org/10.1136/gut.17.3.210 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1136/gut.17.3.210 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[37] Коэн Э., Крэгг М., деФонсека Дж., Хайт А., Розенберг М., Чжоу Б. Статистический обзор данных о потреблении макронутриентов в США, 1965-2011 гг.: американцы соблюдают диетические рекомендации, что совпало с ростом ожирения. Nutrition [Интернет], 2015 г. [цитировано 26 сентября 2016 г.]; 31:727-32. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25837220; http://dx.doi.org/10.1016/j.nut.2015.02.007 [PubMed] [CrossRef] [Google Scholar]
[38] Howe A, Ringus DL, Williams RJ, Choo Z-N, Greenwald SM, Owens С.М., Коулман М.Л., Мейер Ф., Чанг Э.Б. Дивергентные реакции вирусных и бактериальных сообществ в микробиоме кишечника на диетические нарушения у мышей. ISME J [Интернет] 2016. [цитировано 26 сентября 2016 года]; 10:1217-27. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26473721; PMID: 26473721; http://dx.doi.org/10.1038/ismej.2015.183 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[39] Гербер Г. К., Ондердонк А.Б., Брай Л. Вывод динамических сигнатур микробов в сложных экосистемах-хозяевах. PLoS Comput Biol [Интернет] 2012. [цитировано 26 сентября 2016 года]; 8:e1002624. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/22876171; PMID: 22876171; [40] Sonnenburg ED, Smits SA, Тихонов M, Higginbottom SK, Wingreen Н.С., Зонненбург Дж.Л. Вызванное диетой вымирание кишечной микробиоты на протяжении поколений. Nature [Интернет], 2016 г. [цитировано 26 сентября 2016 г.]; 529: 212-5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26762459; PMID: 26762459; http://dx.doi.org/ 10.1038/nature16504 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
К., Ондердонк А.Б., Брай Л. Вывод динамических сигнатур микробов в сложных экосистемах-хозяевах. PLoS Comput Biol [Интернет] 2012. [цитировано 26 сентября 2016 года]; 8:e1002624. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/22876171; PMID: 22876171; [40] Sonnenburg ED, Smits SA, Тихонов M, Higginbottom SK, Wingreen Н.С., Зонненбург Дж.Л. Вызванное диетой вымирание кишечной микробиоты на протяжении поколений. Nature [Интернет], 2016 г. [цитировано 26 сентября 2016 г.]; 529: 212-5. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26762459; PMID: 26762459; http://dx.doi.org/ 10.1038/nature16504 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[41] Bäckhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A , Семенкович В.Ф., Гордон Д.И. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci U S A [Интернет] 2004. [цитировано 26 сентября 2016 г.]; 101:15718-23. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/15505215; http://dx. doi.org/10.1073/pnas.0407076101 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
doi.org/10.1073/pnas.0407076101 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[42] Бекхед Ф., Манчестер Дж. К., Семенкович С. Ф., Гордон Дж. И. Механизмы, лежащие в основе устойчивости к диетическому ожирению у безмикробных мышей. Proc Natl Acad Sci U S A [Интернет], 2007 г. [цитировано 26 сентября 2016 г.]; 104:979-84. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/17210919; http://dx.doi.org/ 10.1073/pnas.0605374104 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[43] Ojeda P, Bobe A, Dolan K, Leone V, Martinez K. Пищевая модуляция микробиоты кишечника - влияние на патофизиологию метаболических заболеваний. J Nutr Biochem [Интернет] 2016. [цитировано 26 сентября 2016 года]; 28:191-200. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26372091; PMID: 26372091; [44] De Vadder F, Kovatcheva-Datchary P, Goncalves D , Винера Дж., Зитун С., Дюшан А., Бекхед Ф., Митье Г. Метаболиты, генерируемые микробиотой, способствуют метаболическим преимуществам через нервные цепи кишечника и мозга. Клетка 2014; 156:84-96; PMID: 24412651; http://dx.doi.org/10.1016/j.cell.2013.12.016 [PubMed] [CrossRef] [Google Scholar]
Клетка 2014; 156:84-96; PMID: 24412651; http://dx.doi.org/10.1016/j.cell.2013.12.016 [PubMed] [CrossRef] [Google Scholar]
[45] McNelis JC, Lee YS, Mayoral R, van der Kant R, Johnson AMF, Wollam J, Olefsky JM. GPR43 усиливает функцию β-клеток при ожирении. Диабет [Интернет], 2015 г. [цитировано 26 сентября 2016 г.]; 64:3203-17. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26023106; PMID: 26023106; http://dx.doi.org/ 10.2337/db14-1938 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[46] Mattijssen F, Alex S, Swarts HJ, Groen AK, van Schothorst EM , Керстен С. Angptl4 служит эндогенным ингибитором переваривания липидов в кишечнике. Mol Metab [Интернет] 2014. [цитировано 26 сентября 2016 года]; 3:135-44. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/24634819.; PMID: 24634819; http://dx.doi.org/ 10.1016/j.molmet.2013.11.004 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[47] Robciuc MR, Naukkarinen J, Ortega-Alonso A, Тюйнисмаа Х. , Райвио Т., Риссанен А., Каприо Дж., Энхольм К., Яухиайнен М., Пиетиляйнен К.Х. Уровни сывороточного ангиопоэтин-подобного белка 4 и его экспрессия в жировой ткани обратно коррелируют с ожирением у монозиготных близнецов. J Lipid Res [Интернет] 2011. [цитировано 26 сентября 2016 г.]; 52:1575-82. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2159.6930; PMID: 21596930; [48] Hu GX, Chen GR, Xu H, Ge RS, Lin J. Активация AMP-активируемой протеинкиназы короткоцепочечными жирными кислотами является основным механизмом, лежащим в основе благотворного влияния диеты с высоким содержанием клетчатки на метаболический синдром. Медицинские гипотезы 2010 г.; 74:123-6; PMID: 19665312; http://dx.doi.org/ 10.1016/j.mehy.2009.07.022 [PubMed] [CrossRef] [Google Scholar]
, Райвио Т., Риссанен А., Каприо Дж., Энхольм К., Яухиайнен М., Пиетиляйнен К.Х. Уровни сывороточного ангиопоэтин-подобного белка 4 и его экспрессия в жировой ткани обратно коррелируют с ожирением у монозиготных близнецов. J Lipid Res [Интернет] 2011. [цитировано 26 сентября 2016 г.]; 52:1575-82. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/2159.6930; PMID: 21596930; [48] Hu GX, Chen GR, Xu H, Ge RS, Lin J. Активация AMP-активируемой протеинкиназы короткоцепочечными жирными кислотами является основным механизмом, лежащим в основе благотворного влияния диеты с высоким содержанием клетчатки на метаболический синдром. Медицинские гипотезы 2010 г.; 74:123-6; PMID: 19665312; http://dx.doi.org/ 10.1016/j.mehy.2009.07.022 [PubMed] [CrossRef] [Google Scholar]
[49] Suganami T, Tanimoto-Koyama K, Nishida J, Itoh M, Yuan X , Мизуарай С., Котани Х., Ямаока С., Мияке К., Аоэ С. и др.. Роль пути Toll-подобный рецептор 4/NF-kappaB в индуцированных насыщенными жирными кислотами воспалительных изменениях во взаимодействии между адипоцитами и макрофагами. Arterioscler Thromb Vasc Biol [Интернет] 2007. [цитируется 26 сентября 2016 года]; 27:84-91. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/17082484; PMID: 17082484; http://dx.doi.org/10.1161/01.ATV.0000251608.09329.9a [PubMed] [CrossRef] [Google Scholar]
Arterioscler Thromb Vasc Biol [Интернет] 2007. [цитируется 26 сентября 2016 года]; 27:84-91. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/17082484; PMID: 17082484; http://dx.doi.org/10.1161/01.ATV.0000251608.09329.9a [PubMed] [CrossRef] [Google Scholar]
[50] Milanski M, Degasperi G, Coope A, Morari J, Denis R, Cintra DE, Tsukumo DML, Anhe G, Amaral ME, Takahashi HK и др.. Насыщенные жирные кислоты вызывают воспалительную реакцию преимущественно за счет активации передачи сигналов TLR4 в гипоталамусе: последствия для патогенеза ожирения. J Neurosci [Интернет] 2009 г.. [цитировано 26 сентября 2016 г.]; 29:359-70. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/19144836; PMID: 19144836; http://dx.doi.org/ 10.1523/JNEUROSCI.2760-08.2009 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[51] Caricilli AM, Nascimento PH, Pauli JR, Tsukumo DML, Velloso Л.А., Карвальейра Дж.Б., Саад М.Дж.А. Ингибирование экспрессии толл-подобного рецептора 2 улучшает чувствительность к инсулину и передачу сигналов в мышцах и белой жировой ткани мышей, получавших диету с высоким содержанием жиров. J Endocrinol [Интернет] 2008. [цитировано 26 сентября 2016 года]; 199:399-406. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18787058; PMID: 18787058; http://dx.doi.org/ 10.1677/JOE-08-0354 [PubMed] [CrossRef] [Google Scholar]
J Endocrinol [Интернет] 2008. [цитировано 26 сентября 2016 года]; 199:399-406. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18787058; PMID: 18787058; http://dx.doi.org/ 10.1677/JOE-08-0354 [PubMed] [CrossRef] [Google Scholar]
[52] Davis JE, Gabler NK, Walker-Daniels J, Spurlock ME. Дефицит Tlr-4 избирательно защищает от ожирения, вызванного диетами с высоким содержанием насыщенных жиров. Ожирение (Серебряная весна) [Интернет], 2008 г. [цитировано 26 сентября 2016 г.]; 16:1248-55. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/18421279; PMID: 18421279; http://dx.doi.org/10.1038/oby.2008.210 [PubMed] [CrossRef] [Google Scholar]
[53] Славин Ю.Л. Пищевые волокна и масса тела. Nutrition [Интернет], 2005 г. [цитировано 26 сентября 2016 г.]; 21:411-8. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/15797686; PMID: 15797686; http://dx.doi.org/10.1016/j.nut.2004.08.018 [PubMed] [CrossRef] [Google Scholar]
[54] Mennigen R, Nolte K, Rijcken E, Utech M, Loeffler B, Senninger Н, Брюэр М. Смесь пробиотиков VSL#3 защищает эпителиальный барьер, поддерживая экспрессию белка плотных контактов и предотвращая апоптоз в мышиной модели колита. Am J Physiol Gastrointest Liver Physiol [Интернет] 2009 г.. [цитировано 26 сентября 2016 г.]; 296:G1140-9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/19221015; PMID: 19221015; http://dx.doi.org/ 10.1152/ajpgi.90534.2008 [PubMed] [CrossRef] [Google Scholar]
Смесь пробиотиков VSL#3 защищает эпителиальный барьер, поддерживая экспрессию белка плотных контактов и предотвращая апоптоз в мышиной модели колита. Am J Physiol Gastrointest Liver Physiol [Интернет] 2009 г.. [цитировано 26 сентября 2016 г.]; 296:G1140-9. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/19221015; PMID: 19221015; http://dx.doi.org/ 10.1152/ajpgi.90534.2008 [PubMed] [CrossRef] [Google Scholar]
[55] Wang J, Tang H, Zhang C, Zhao Y, Derrien M, Rocher E, van- Хилкама Влиг ДЖЕТ, Стриссел К., Чжао Л., Обин М. и др.. Модуляция кишечной микробиоты во время опосредованного пробиотиками ослабления метаболического синдрома у мышей, получавших диету с высоким содержанием жиров. ISME J [Интернет], 2015 г. [цитировано 26 сентября 2016 г.]; 9:1-15. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/249.36764; PMID: 24936764; http://dx.doi.org/ 10.1038/ismej.2014.99 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[56] Li X, Guo J, Ji K, Zhang P. Волокна побегов бамбука предотвращают ожирение у мышей, модулируя микробиоту кишечника. Sci Rep [Интернет] 2016. [цитировано 26 сентября 2016 г.]; 6:32953. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/27599699; PMID: 27599699; http://dx.doi.org/ 10.1038/srep32953 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Волокна побегов бамбука предотвращают ожирение у мышей, модулируя микробиоту кишечника. Sci Rep [Интернет] 2016. [цитировано 26 сентября 2016 г.]; 6:32953. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/27599699; PMID: 27599699; http://dx.doi.org/ 10.1038/srep32953 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[57] Respondek F, Gerard P, Bossis M, Boschat L, Bruneau A, Rabot S , Вагнер А., Мартин Дж.-К. Фруктоолигосахариды с короткой цепью модулируют кишечную микробиоту и метаболические параметры гуманизированной гнотобиотической диеты, вызванной ожирением у мышей. PLoS One [Интернет] 2013 г. [цитируется 26 сентября 2016 г.]; 8:e71026. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/239.51074; PMID: 23951074; http://dx.doi.org/10.1371/journal.pone.0071026 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[58] Yang J, Bindels LB, Segura Munoz RR, Martinez I, Уолтер Дж., Рамер-Тейт А.Е., Роуз Д.Дж. Несопоставимые метаболические реакции у мышей, получавших диету с высоким содержанием жиров, дополненную неперевариваемыми ферулоилированными олиго- и полисахаридами, полученными из кукурузы, связаны с изменениями в микробиоте кишечника. PLoS One [Интернет] 2016 г. [цитировано 26 сентября 2016 г.]; 11:e0146144. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26731528; PMID: 26731528; http://dx.doi.org/10.1371/journal.pone.0146144 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
PLoS One [Интернет] 2016 г. [цитировано 26 сентября 2016 г.]; 11:e0146144. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26731528; PMID: 26731528; http://dx.doi.org/10.1371/journal.pone.0146144 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[59] Нильссон А., Йоханссон Э., Экстрем Л., Бьорк И. Влияние ужина из коричневой фасоли на маркеры метаболического риска и гормоны, регулирующие аппетит, при последующем стандартном завтраке: рандомизированное перекрестное исследование. PLoS One [Интернет] 2013 г. [цитируется 26 сентября 2016 г.]; 8:e59985. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23577078; PMID: 23577078; http://dx.doi.org/ 10.1371/journal.pone.0059985 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[60] Xiao S, Fei N, Pang X, Shen J, Wang L, Zhang B, Zhang M, Zhang X, Zhang C, Li M и др.. Диетическое вмешательство, направленное на кишечную микробиоту, для облегчения хронического воспаления, лежащего в основе метаболического синдрома. FEMS Microbiol Ecol [Интернет] 2014. [цитировано 26 сентября 2016 года]; 87:357-67. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/241179.23; PMID: 24117923; http://dx.doi.org/ 10.1111/1574-6941.12228 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
FEMS Microbiol Ecol [Интернет] 2014. [цитировано 26 сентября 2016 года]; 87:357-67. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/241179.23; PMID: 24117923; http://dx.doi.org/ 10.1111/1574-6941.12228 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[61] Эверард А., Лазаревич В., Гайя Н., Йоханссон М., Столман М., Бакхед Ф., Делзенн Н.М., Шренцель Дж., Франсуа П., Кани П.Д. Микробиом мышей, получавших пребиотики, обнаруживает новые мишени, участвующие в реакции хозяина при ожирении. ISME J [Интернет] 2014. [цитировано 26 сентября 2016 года]; 8:2116-30. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/24694712; PMID: 24694712; http://dx.doi.org/10.1038/ismej.2014.45 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[62] Алиси А., Бедоньи Г., Бавьера Г., Джорджио В., Порро Э., Пэрис С., Джаммария П., Реали Л., Анания Ф., Нобили В. Рандомизированное клиническое исследование: положительный эффект VSL#3 у детей с ожирением и неалкогольным стеатогепатитом. Aliment Pharmacol Ther [Интернет] 2014. [цитировано 7 июля 2016 г.]; 39:1276-85. Доступно по адресу: http://doi.wiley.com/10.1111/apt.12758; PMID: 24738701; http://dx.doi.org/ 10.1111/apt.12758 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Aliment Pharmacol Ther [Интернет] 2014. [цитировано 7 июля 2016 г.]; 39:1276-85. Доступно по адресу: http://doi.wiley.com/10.1111/apt.12758; PMID: 24738701; http://dx.doi.org/ 10.1111/apt.12758 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[63] Chen D, Yang Z, Chen X, Huang Y, Yin B, Го Ф, Чжао Х, Хуан Дж, У И, Гу Р. Влияние Lactobacillus rhamnosus hsryfm 1301 на микробиоту кишечника и метаболизм липидов у крыс, получавших диету с высоким содержанием жиров. J Microbiol Biotechnol [Интернет] 2015. [цитировано 26 сентября 2016 года]; 25:687-95. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/25418480; PMID: 25418480; http://dx.doi.org/10.4014/jmb.1409.09085 [PubMed] [CrossRef] [Google Scholar]
[64] Gauffin Cano P, Santacruz A, Á Moya, Sanz Y. Bacteroides uniformis CECT 7771 улучшает метаболическую и иммунологическую дисфункцию у мышей с ожирением, вызванным диетой с высоким содержанием жиров. PLoS One [Интернет] 2012 г. [цитируется 26 сентября 2016 г. ]; 7:e41079. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/22844426; PMID: 22844426; http://dx.doi.org/10.1371/journal.pone.0041079[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
]; 7:e41079. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/22844426; PMID: 22844426; http://dx.doi.org/10.1371/journal.pone.0041079[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[65] Cano PG, Santacruz A, Trejo FM, Sanz Y. Bifidobacterium CECT 7765 улучшает метаболические и иммунологические изменения, связанные с ожирением, у мышей, получавших диету с высоким содержанием жиров. Ожирение (Серебряная весна) [Интернет], 2013 г. [цитировано 26 сентября 2016 г.]; 21:2310-21. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/23418126; PMID: 23418126; http://dx.doi.org/ 10.1002/oby.20330 [PubMed] [CrossRef] [Google Scholar]
[66] Moya-Pérez A, Neef A, Sanz Y. Bifidobacterium pseudocatenulatum CECT 7765 уменьшает воспаление, связанное с ожирением, путем восстановления баланса лимфоцитов-макрофагов и структуры кишечной микробиоты у мышей, получавших диету с высоким содержанием жиров. PLoS One [Интернет] 2015 г. [цитировано 26 сентября 2016 г.]; 10:e0126976 Доступно по адресу: http://www. ncbi.nlm.nih.gov/pubmed/26161548; http://dx.doi.org/ 10.1371/journal.pone.0126976 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
ncbi.nlm.nih.gov/pubmed/26161548; http://dx.doi.org/ 10.1371/journal.pone.0126976 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[67] Новотны Нуньес I, Мальдонадо Гальдеано C, де Морено де Леблан A , Пердигон Г. Введение Lactobacillus casei CRL 431 снижает воспалительные цитокины в модели ожирения у мышей, вызванных диетой. Питание [Интернет] [цитировано 26 сентября 2016 г.]; 31:1000-7. Доступно по адресу: http://www.ncbi.nlm.nih.gov/pubmed/26059375; http://dx.doi.org/10.1016/j.nut.2015.02.006 [PubMed] [CrossRef] [Google Scholar]
[68] Ю Дж., Ким С. Пробиотики и пребиотики: текущее состояние и перспективы на будущее в отношении нарушений обмена веществ. Nutrients [Интернет], 2016 г. [цитировано 10 ноября 2016 г.]; 8:173 Доступно по адресу: http://www.mdpi.com/2072-6643/8/3/173; http://dx.doi.org/ 10.3390/nu8030173 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[69] Kobyliak N, Conte C, Cammarota G, Haley AP, Styriak I, Gaspar L , Фьюсек Дж. , Родриго Л., Крузляк П., Нисида С. и др.. Пробиотики в профилактике и лечении ожирения: критический взгляд. Nutr Metab (Лондон) [Интернет], 2016 г. [цитировано 10 ноября 2016 г.]; 13:14. Доступно по адресу: http://www.nutritionandmetabolism.com/content/13/1/14; PMID:26
, Родриго Л., Крузляк П., Нисида С. и др.. Пробиотики в профилактике и лечении ожирения: критический взгляд. Nutr Metab (Лондон) [Интернет], 2016 г. [цитировано 10 ноября 2016 г.]; 13:14. Доступно по адресу: http://www.nutritionandmetabolism.com/content/13/1/14; PMID:26
[70] Sáez-Lara M, Robles-Sanchez C, Ruiz -Охеда Ф., Плаза-Диас Дж., Гил А. Влияние пробиотиков и синбиотиков на ожирение, синдром резистентности к инсулину, диабет 2 типа и неалкогольную жировую болезнь печени: обзор клинических испытаний на людях. Int J Mol Sci [Интернет] 2016. [цитировано 10 ноября 2016 г.]; 17:928 Доступно по адресу: http://www.mdpi.com/1422-0067/17/6/928; http://dx.doi.org/ 10.3390/ijms17060928 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Различные болезненные состояния связаны с дисбалансом защитных и патогенных бактерий в кишечнике, называемым дисбиозом. Текущие данные показывают, что диетические факторы влияют на микробную экосистему в кишечнике. Изменения в структуре сообщества кишечной микробиоты не лишены последствий, учитывая широкое влияние микробов как на местный, так и на системный иммунитет. Цель этого обзора — дать представление о важности кишечной микробиоты в развитии заболевания и возможных терапевтических вмешательствах в клинических условиях. Мы вводим сложные трехсторонние отношения между диетой, микробами и кишечным эпителием. Далее следует краткое изложение клинических данных о дисбактериозе, вызванном диетой, как факторе, способствующем развитию желудочно-кишечных заболеваний, таких как воспалительные заболевания кишечника, синдром раздраженного кишечника и колоректальный рак, а также системных заболеваний, таких как ожирение, диабет, атеросклероз и неалкогольная жировая дистрофия. болезнь печени. Наконец, будут рассмотрены текущие диетические и микробные вмешательства, направленные на поддержание здорового микробного профиля.
Текущие данные показывают, что диетические факторы влияют на микробную экосистему в кишечнике. Изменения в структуре сообщества кишечной микробиоты не лишены последствий, учитывая широкое влияние микробов как на местный, так и на системный иммунитет. Цель этого обзора — дать представление о важности кишечной микробиоты в развитии заболевания и возможных терапевтических вмешательствах в клинических условиях. Мы вводим сложные трехсторонние отношения между диетой, микробами и кишечным эпителием. Далее следует краткое изложение клинических данных о дисбактериозе, вызванном диетой, как факторе, способствующем развитию желудочно-кишечных заболеваний, таких как воспалительные заболевания кишечника, синдром раздраженного кишечника и колоректальный рак, а также системных заболеваний, таких как ожирение, диабет, атеросклероз и неалкогольная жировая дистрофия. болезнь печени. Наконец, будут рассмотрены текущие диетические и микробные вмешательства, направленные на поддержание здорового микробного профиля.
• Нежелательное изменение микробиоты, приводящее к дисбалансу между защитными и вредными бактериями, называется дисбиозом.
• Рацион питания изменяет микробиоту кишечника экологически и функционально, что приводит к физиологическим последствиям для хозяина.
• Дисбиоз связан со многими заболеваниями человека, включая местные желудочно-кишечные и системные заболевания.
• Восстановление и поддержание здоровой микробиоты кишечника может быть эффективным, недорогим и безопасным средством от болезней, связанных с дисбактериозом.
Люди эволюционировали совместно с огромным количеством микроорганизмов, населяющих тело. У среднего человека в 10 раз больше бактериальных клеток, чем их собственное количество клеток. Эти микробы колонизируют кожу, полость носа и рта, мочеполовой и желудочно-кишечный тракт (ЖКТ). Среди всех участков ЖКТ является наиболее густонаселенной областью, только в толстой кишке содержится более 10 10 -10 12 колониеобразующих единиц на грамм фекалий, или 70% всех микробов в организме человека [1].
Хотя считалось, что плод стерилен внутриутробно, существуют некоторые доказательства того, что микробная ДНК и потенциально даже микробы подвергаются воздействию плода и кишечника плода через плаценту [обсуждается Luoto et al. в этом выпуске]. Во время рождения происходит микробная колонизация желудочно-кишечного тракта, которая затем быстро развивается материнскими и экологическими микробами. Колонизация кажется не случайной, а заранее запрограммированной; тем не менее, способ рождения ребенка, воздействие антибиотиков, питание и другие внешние факторы влияют на микробную экологию (рис. 1). Микробное разнообразие увеличивается в течение первых нескольких лет жизни, а затем стабилизируется к 2-4 годам, приближаясь к взрослому [2]. Большинство этих бактерий связываются с поверхностью слизистой оболочки кишечника и сохраняют свои специфические ниши с течением времени в качестве коренных популяций. Недавно введенные бактерии либо проходят через ЖКТ со стулом, либо конкурируют с местными бактериями за создание своей ниши. Хотя есть доказательства того, что кишечная микробиота относительно стабильна на протяжении всей жизни, внешние факторы, такие как стресс, употребление алкоголя, физические упражнения и выбор диеты, действительно изменяют экологию и функцию микробиоты у взрослых. Мы еще не понимаем, насколько динамична экология микробиоты, поэтому микробные изменения могут быть только преходящими и обратимыми, но для понимания этой пластичности требуются дополнительные исследования.
Хотя есть доказательства того, что кишечная микробиота относительно стабильна на протяжении всей жизни, внешние факторы, такие как стресс, употребление алкоголя, физические упражнения и выбор диеты, действительно изменяют экологию и функцию микробиоты у взрослых. Мы еще не понимаем, насколько динамична экология микробиоты, поэтому микробные изменения могут быть только преходящими и обратимыми, но для понимания этой пластичности требуются дополнительные исследования.
Развитие кишечной микробиоты у новорожденного. Кишечник плода в утробе матери подвергается воздействию микробной ДНК и потенциально материнских микробов. После рождения он быстро колонизируется бактериями, переносимыми из микробиоты влагалища, толстой кишки и кожи матери, в зависимости от способа родоразрешения и воздействия антибиотиков. Факторы окружающей среды также могут играть роль в приобретении микробов, в том числе: наличие микробных популяций в месте рождения и микробиота кожи лиц, контактирующих с ребенком, таких как отец, медсестра или врач. Колонизация продолжает увеличивать количество и разнообразие видов бактерий в кишечнике, и на нее влияют различные факторы развития, в том числе: генетика хозяина ребенка, диета матери, кормление грудью или смесью, антибиотики и воздействие микробов из окружающей среды, а также развивающаяся иммунная система. Такая микробиота становится более стабильной и приобретается к 2-4 годам.
Колонизация продолжает увеличивать количество и разнообразие видов бактерий в кишечнике, и на нее влияют различные факторы развития, в том числе: генетика хозяина ребенка, диета матери, кормление грудью или смесью, антибиотики и воздействие микробов из окружающей среды, а также развивающаяся иммунная система. Такая микробиота становится более стабильной и приобретается к 2-4 годам.
В желудочно-кишечном тракте человека содержится от 500 до 1000 видов бактерий, большинство из которых принадлежит только к двум типам: Firmicutes и Bacteroidetes (>90%). Другие типы, присутствующие в меньшей степени, включают: Actinobacteria, Proteobacteria, Fusobacteria, Spirochaetae и Verrucomicrobia. В то время как доминирующие типы относительно постоянны между особями, разнообразие увеличивается по таксономической линии, поскольку каждая особь содержит более сотни уникальных видов. У людей были идентифицированы три различных кластера кишечной микробиоты. Эти «энтеротипы» в основном обусловлены видовым составом и не имеют географической, возрастной или гендерной специфики [3]. Нежелательное изменение микробиоты, приводящее к дисбалансу между защитными и вредными бактериями, называется дисбиозом и может группироваться как специфический энтеротип. В подтверждение этого было показано, что энтеротипы связаны с хроническими заболеваниями, такими как воспаление толстой кишки [3], симптоматический атеросклероз [4] и неалкогольный стеатогепатит [5]. Такие факторы, как питательная нагрузка, макро- и микронутриенты, вызывают изменения в экологии и функциональности кишечной микробиоты, а долгосрочные режимы питания могут изменить исходный энтеротип [6]. Выявление диетических факторов, которые способствуют развитию полезных микробов и предотвращают проникновение патобионтов, может быть важной тактикой в профилактике заболеваний, связанных с дисбиозом.
Нежелательное изменение микробиоты, приводящее к дисбалансу между защитными и вредными бактериями, называется дисбиозом и может группироваться как специфический энтеротип. В подтверждение этого было показано, что энтеротипы связаны с хроническими заболеваниями, такими как воспаление толстой кишки [3], симптоматический атеросклероз [4] и неалкогольный стеатогепатит [5]. Такие факторы, как питательная нагрузка, макро- и микронутриенты, вызывают изменения в экологии и функциональности кишечной микробиоты, а долгосрочные режимы питания могут изменить исходный энтеротип [6]. Выявление диетических факторов, которые способствуют развитию полезных микробов и предотвращают проникновение патобионтов, может быть важной тактикой в профилактике заболеваний, связанных с дисбиозом.
Микробная экосистема кишечника оказывает огромное влияние на общее состояние здоровья человека-хозяина. Микробиота находится на стыке внутренней и внешней среды в кишечнике, образуя трехсторонние отношения с эпителиальными клетками кишечника и пищевыми антигенами (рис. 2). Благодаря такому заметному расположению микробиота способна поддерживать связь как с поверхностью слизистой оболочки кишечника, так и с просветной средой, содержащей частично переваренную пищу. Пищевые антигены взаимодействуют как с микробами, так и с кишечным эпителием. Микробы вносят физиологические изменения в хозяина, взаимодействуя с эпителиальными клетками кишечника через врожденные иммунные рецепторы [обсуждается Уокером в этом выпуске]. Кишечник содержит самую большую массу лимфоидной ткани в организме: кишечно-ассоциированную лимфоидную ткань (GALT). GALT передает сигналы с поверхности слизистой оболочки на остальную часть тела через различные иммунные клетки и иммунные рецепторы, включая врожденные толл-подобные рецепторы (TLR) и NOD-подобные рецепторы (NLR). Кишечная микробиота играет решающую роль в развитии желудочно-кишечного тракта, системного иммунитета и гомеостаза толстой кишки. Микробиота кишечника может модулировать функцию и реакцию кишечных иммунных клеток, таких как Т-регуляторные клетки, на бактериальные продукты.
2). Благодаря такому заметному расположению микробиота способна поддерживать связь как с поверхностью слизистой оболочки кишечника, так и с просветной средой, содержащей частично переваренную пищу. Пищевые антигены взаимодействуют как с микробами, так и с кишечным эпителием. Микробы вносят физиологические изменения в хозяина, взаимодействуя с эпителиальными клетками кишечника через врожденные иммунные рецепторы [обсуждается Уокером в этом выпуске]. Кишечник содержит самую большую массу лимфоидной ткани в организме: кишечно-ассоциированную лимфоидную ткань (GALT). GALT передает сигналы с поверхности слизистой оболочки на остальную часть тела через различные иммунные клетки и иммунные рецепторы, включая врожденные толл-подобные рецепторы (TLR) и NOD-подобные рецепторы (NLR). Кишечная микробиота играет решающую роль в развитии желудочно-кишечного тракта, системного иммунитета и гомеостаза толстой кишки. Микробиота кишечника может модулировать функцию и реакцию кишечных иммунных клеток, таких как Т-регуляторные клетки, на бактериальные продукты. Это необходимо для регуляции механизмов, которые поддерживают баланс как слизистого, так и системного иммунитета, что позволяет поверхности слизистой оболочки выдерживать безвредные бактерии, но при этом адекватно реагировать на вторжение патогенов. Производство короткоцепочечных жирных кислот (SCFA) кишечными микробами также играет важную роль в регуляции гомеостаза в кишечнике. Например, бутират, продуцируемый кишечными микробами, является не только основным источником энергии для колоноцитов, но также ингибирует пролиферацию кишечных клеток, что может уменьшить симптомы колита [7]. Учитывая жизненно важную связь между микробами и здоровьем кишечника, нормальное функционирование микробиоты имеет решающее значение для поддержания баланса местного и системного иммунитета. Как обсуждается ниже, при отсутствии здоровой микробиоты могут возникнуть иммунные нарушения. Выявление диетических факторов, которые контролируют микробную экологию кишечника, и их роли в восприимчивости к кишечным заболеваниям может дать представление о функционировании микробиоты у здоровых и больных людей.
Это необходимо для регуляции механизмов, которые поддерживают баланс как слизистого, так и системного иммунитета, что позволяет поверхности слизистой оболочки выдерживать безвредные бактерии, но при этом адекватно реагировать на вторжение патогенов. Производство короткоцепочечных жирных кислот (SCFA) кишечными микробами также играет важную роль в регуляции гомеостаза в кишечнике. Например, бутират, продуцируемый кишечными микробами, является не только основным источником энергии для колоноцитов, но также ингибирует пролиферацию кишечных клеток, что может уменьшить симптомы колита [7]. Учитывая жизненно важную связь между микробами и здоровьем кишечника, нормальное функционирование микробиоты имеет решающее значение для поддержания баланса местного и системного иммунитета. Как обсуждается ниже, при отсутствии здоровой микробиоты могут возникнуть иммунные нарушения. Выявление диетических факторов, которые контролируют микробную экологию кишечника, и их роли в восприимчивости к кишечным заболеваниям может дать представление о функционировании микробиоты у здоровых и больных людей. Тем не менее, из-за огромного разнообразия пищевых антигенов и кишечных микробов перед нами стоит задача определить точные взаимодействия между микробами, пищевыми антигенами и эпителием и их последствия для хозяина.
Тем не менее, из-за огромного разнообразия пищевых антигенов и кишечных микробов перед нами стоит задача определить точные взаимодействия между микробами, пищевыми антигенами и эпителием и их последствия для хозяина.
ЖКТ в гомеостатических и дисбиотических условиях. Кишечная микробиота находится стратегически на стыке внутренней и внешней среды кишечника. Он играет несколько важных биологических ролей, включая: помощь в переваривании и усвоении питательных веществ из частично переваренной пищи, выработку SCFA — основного источника энергии для эпителиальных клеток кишечника (IECs), стимуляцию иммунных реакций за счет высвобождения лигандов и защиту от энтеропатогенов за счет продукции антимикробные пептиды (АМП). Кроме того, комменсальные бактерии также работают как защитный барьер от патобионтов, конкурируя за пространство и пищу. Высокоселективный проницаемый монослой, состоящий из МЭК и прилегающих плотных соединений, действует как единственный барьер, отделяющий богатую микробами сторону просвета от стерильной подслизистой области. Повреждение этого слоя или потеря целостности плотных контактов в болезненном состоянии позволяет увеличить прохождение микроорганизмов и их иммуностимулирующих молекул, таких как МАМП, т. е. липополисахарида, в подслизистую оболочку, где в конечном итоге они могут попасть в кровоток, индуцируя провоспалительную сигнализацию. и рекрутировать лейкоциты. Бокаловидные клетки, обнаруженные в слое IEC, пополняют слой слизи, покрывающий эпителий, высвобождая большие гликопротеиновые полимеры, такие как муцин. Секреция капель слизи бокаловидными клетками регулируется микробиотой, поэтому ключевую роль в нарушении слизистого слоя играет дисбиоз. Диетические антигены (темно-серые треугольники) могут взаимодействовать с микробиотой и IEC, вызывая биологические реакции в обоих. После слоя IEC антигенпрезентирующие клетки (APC) действуют как следующая линия клеточной защиты. APC, которые включают дендритные клетки (DC), макрофаги типа M1 и M2, являются частью врожденного иммунного ответа, который защищает хозяина от вторжения патобионтов.
Повреждение этого слоя или потеря целостности плотных контактов в болезненном состоянии позволяет увеличить прохождение микроорганизмов и их иммуностимулирующих молекул, таких как МАМП, т. е. липополисахарида, в подслизистую оболочку, где в конечном итоге они могут попасть в кровоток, индуцируя провоспалительную сигнализацию. и рекрутировать лейкоциты. Бокаловидные клетки, обнаруженные в слое IEC, пополняют слой слизи, покрывающий эпителий, высвобождая большие гликопротеиновые полимеры, такие как муцин. Секреция капель слизи бокаловидными клетками регулируется микробиотой, поэтому ключевую роль в нарушении слизистого слоя играет дисбиоз. Диетические антигены (темно-серые треугольники) могут взаимодействовать с микробиотой и IEC, вызывая биологические реакции в обоих. После слоя IEC антигенпрезентирующие клетки (APC) действуют как следующая линия клеточной защиты. APC, которые включают дендритные клетки (DC), макрофаги типа M1 и M2, являются частью врожденного иммунного ответа, который защищает хозяина от вторжения патобионтов. Как правило, при дисбиотических состояниях чрезмерная активация врожденного иммунного ответа приводит к более высокой, чем обычно, экспрессии активированных макрофагов типа M1-M2, которые усиливают провоспалительные явления. Регуляторные Т-клетки (Treg) регулируют адаптивный иммунный ответ, поддерживая толерантность к собственным антигенам и подавляя гиперактивацию иммунных ответов. Недостаточная экспрессия Treg может привести к повышению уровня Th2 и Th27, что способствует хроническим воспалительным реакциям.
Как правило, при дисбиотических состояниях чрезмерная активация врожденного иммунного ответа приводит к более высокой, чем обычно, экспрессии активированных макрофагов типа M1-M2, которые усиливают провоспалительные явления. Регуляторные Т-клетки (Treg) регулируют адаптивный иммунный ответ, поддерживая толерантность к собственным антигенам и подавляя гиперактивацию иммунных ответов. Недостаточная экспрессия Treg может привести к повышению уровня Th2 и Th27, что способствует хроническим воспалительным реакциям.
Пищевые антигены могут взаимодействовать как с микробиотой, так и со слизистой оболочкой кишечника, инициируя биологические реакции у хозяина. Пища содержит множество соединений, которые формируют химию кишечника, а также всего тела. Например, пищевые антигены всасываются через кишечник, что приводит к образованию метаболитов в циркулирующих жидкостях, таких как кровь и лимфа [8]. Связь специфических метаболитов в организме с доминирующими бактериальными таксонами у младенцев предполагает, что химический состав рациона может определять микробную экологию кишечника [9]. ]. В то время как пищевые факторы могут напрямую влиять на функциональность эпителиальных клеток кишечника и лежащих в их основе иммунных клеток [10], пищевые антигены также изменяют кишечную экосистему, позволяя размножаться определенным микробным популяциям и ослабляя доминирование других (обзор Брауна и др. [11]). ]). Последствия дисбиоза не безобидны, а пагубны, когда патобионты (любые болезнетворные микроорганизмы) становятся заметными в микробных сообществах. Чтобы поддержать эту идею, микробы ротовой полости, секвенированные из древних зубов, найденных в скелетах разных периодов времени, становятся все более доминирующими кариесогенными или богатыми микробами, способствующими стоматологическим заболеваниям [12]. Эти микробные изменения произошли во время двух величайших диетических сдвигов в эволюции человека: переход от периода «палеолита» охотников-собирателей к периоду «неолита» богатого углеводами земледелия (около 10 000 лет назад) и начало индустриального периода, характеризующегося переработанными пищевыми продуктами (~160 лет назад).
]. В то время как пищевые факторы могут напрямую влиять на функциональность эпителиальных клеток кишечника и лежащих в их основе иммунных клеток [10], пищевые антигены также изменяют кишечную экосистему, позволяя размножаться определенным микробным популяциям и ослабляя доминирование других (обзор Брауна и др. [11]). ]). Последствия дисбиоза не безобидны, а пагубны, когда патобионты (любые болезнетворные микроорганизмы) становятся заметными в микробных сообществах. Чтобы поддержать эту идею, микробы ротовой полости, секвенированные из древних зубов, найденных в скелетах разных периодов времени, становятся все более доминирующими кариесогенными или богатыми микробами, способствующими стоматологическим заболеваниям [12]. Эти микробные изменения произошли во время двух величайших диетических сдвигов в эволюции человека: переход от периода «палеолита» охотников-собирателей к периоду «неолита» богатого углеводами земледелия (около 10 000 лет назад) и начало индустриального периода, характеризующегося переработанными пищевыми продуктами (~160 лет назад). Эти результаты подтверждают мнение о том, что диета вызывает дисбактериоз, который изменяет здоровье хозяина.
Эти результаты подтверждают мнение о том, что диета вызывает дисбактериоз, который изменяет здоровье хозяина.
Имеющиеся данные свидетельствуют о том, что диетические факторы изменяют экологию кишечника как у грызунов (обзор Брауна и др. [11]), так и у людей, и изменение экологии связано с клиническими последствиями (таблица 1). Питание новорожденных имеет решающее значение в начальном развитии микробной экологии [13]. Например, дети, находящиеся на искусственном вскармливании, имеют более высокие уровни патобионтов, таких как Enterobacteriaceae, и менее полезных микробов, таких как Bifidobacteria spp. по сравнению с детьми на грудном вскармливании [14]. Интересно, что у младенцев, которых кормили коровьим молоком, а не детской смесью с добавлением рыбьего жира, Бифидобактерии spp. [15], предполагая, что послеродовое питание можно использовать для целенаправленных изменений в микробном разнообразии. За пределами послеродового периода долгосрочный выбор диеты тесно связан с составом микробиоты кишечника [6]. У людей диеты, которые включают регулярное потребление красного мяса, как правило, благоприятствуют преимущественно экосистеме кишечника, богатой Bacteroides [16], в то время как у вегетарианцев преобладают виды Prevotella [17]. Европейские дети имеют дефицит Bacteroidetes и обогащены Enterobacteriaceae по сравнению с сельскими африканскими детьми, которые потребляют продукты, богатые клетчаткой [18]. Это исследование может стать важным ключом к пониманию роста неинфекционных заболеваний среди детей в Европе. Хотя общепризнано, что диеты с высоким содержанием жиров способствуют дисбактериозу, недавние данные нашей лаборатории показывают, что определенный тип диетических жирных кислот, а не общее количество калорий из жира, по-видимому, важен. Например, диеты, богатые омега-6 полиненасыщенными жирными кислотами (ПНЖК), вызывают цветение патобионтов, но изокалорийные диеты, дополненные омега-3 ПНЖК, могут обратить такие микробные изменения у мышей [19].,20].
У людей диеты, которые включают регулярное потребление красного мяса, как правило, благоприятствуют преимущественно экосистеме кишечника, богатой Bacteroides [16], в то время как у вегетарианцев преобладают виды Prevotella [17]. Европейские дети имеют дефицит Bacteroidetes и обогащены Enterobacteriaceae по сравнению с сельскими африканскими детьми, которые потребляют продукты, богатые клетчаткой [18]. Это исследование может стать важным ключом к пониманию роста неинфекционных заболеваний среди детей в Европе. Хотя общепризнано, что диеты с высоким содержанием жиров способствуют дисбактериозу, недавние данные нашей лаборатории показывают, что определенный тип диетических жирных кислот, а не общее количество калорий из жира, по-видимому, важен. Например, диеты, богатые омега-6 полиненасыщенными жирными кислотами (ПНЖК), вызывают цветение патобионтов, но изокалорийные диеты, дополненные омега-3 ПНЖК, могут обратить такие микробные изменения у мышей [19].,20].
Резюме исследований, показывающих, что факторы питания изменяют микробный профиль у людей и связанные с этим клинические последствия
Одной из основных функций микробиоты является расщепление пищи, чтобы сделать ее доступной для хозяина, и, как следствие, влияние дисбиоза на обмен веществ привлекло значительное внимание в современных исследованиях. «Гуманизированные» мыши или стерильные мыши, которым трансплантировали фекальную микробиоту человека, в настоящее время используются для проверки влияния микробиоты кишечника человека на физиологию млекопитающих. Используя эту модель, было показано, что гуманизированные мыши, получавшие «западную» диету с высоким содержанием жира и сахара, имели повышенное ожирение в результате снижения отношения Bacteroidetes к Firmicutes в фекальной микробиоте [21]. Точно так же было показано, что кишечный микробиом играет важную роль в развитии квашиоркора, тяжелой формы недоедания [22]. В этом исследовании фекальная микробиота малавийских близнецов, несовместимая с квашиоркором, была трансплантирована мышам. При кормлении малавийской диетой потеря веса и метаболические нарушения были более серьезными у мышей, получавших микробиоту от близнецов с квашиоркором, по сравнению с мышами, получавшими микробы от здоровых близнецов. Другое исследование изящно связывает специфические факторы питания с микробной экологией и сложными биологическими последствиями, происходящими в эпителиальных клетках кишечника [23].
«Гуманизированные» мыши или стерильные мыши, которым трансплантировали фекальную микробиоту человека, в настоящее время используются для проверки влияния микробиоты кишечника человека на физиологию млекопитающих. Используя эту модель, было показано, что гуманизированные мыши, получавшие «западную» диету с высоким содержанием жира и сахара, имели повышенное ожирение в результате снижения отношения Bacteroidetes к Firmicutes в фекальной микробиоте [21]. Точно так же было показано, что кишечный микробиом играет важную роль в развитии квашиоркора, тяжелой формы недоедания [22]. В этом исследовании фекальная микробиота малавийских близнецов, несовместимая с квашиоркором, была трансплантирована мышам. При кормлении малавийской диетой потеря веса и метаболические нарушения были более серьезными у мышей, получавших микробиоту от близнецов с квашиоркором, по сравнению с мышами, получавшими микробы от здоровых близнецов. Другое исследование изящно связывает специфические факторы питания с микробной экологией и сложными биологическими последствиями, происходящими в эпителиальных клетках кишечника [23]. В этом исследовании изучалась фекальная микробиота младенцев с различным потреблением олигосахаридов грудного молока, и было обнаружено, что различия в микробиоте модулируют основные генные сети, включая передачу сигналов, воспаление, гистамин, миграцию клеток и адгезию. Моторика ЖКТ является еще одной важной функцией, на которую влияют сложные взаимодействия между диетой и микробами. Когда гуманизированных мышей кормили диетой, содержащей ферментируемые фруктоолигосахариды (ФОС), время транзита через желудочно-кишечный тракт изменялось [24].
В этом исследовании изучалась фекальная микробиота младенцев с различным потреблением олигосахаридов грудного молока, и было обнаружено, что различия в микробиоте модулируют основные генные сети, включая передачу сигналов, воспаление, гистамин, миграцию клеток и адгезию. Моторика ЖКТ является еще одной важной функцией, на которую влияют сложные взаимодействия между диетой и микробами. Когда гуманизированных мышей кормили диетой, содержащей ферментируемые фруктоолигосахариды (ФОС), время транзита через желудочно-кишечный тракт изменялось [24].
Пищевые факторы изменяют микробную экологию в тонкой кишке, где в первую очередь перевариваются пищевые антигены, а также в слепой кишке и дистальном отделе толстой кишки, где пищеварение не является основной функцией хозяина, но важной функцией микробов. Кормление с высоким содержанием жиров вызывает дисбактериоз за счет прямого антимикробного действия желчи. Молекулы нерастворимых липидов расщепляются желчью и липазами на мелкие капли, которые превращаются в растворимые свободные жирные кислоты и моноглицериды, которые затем попадают в кровоток. Как показано, желчь, выделяемая во время кормления с высоким содержанием жиров, может влиять на рост или выживание некоторых микробов [25], хотя мы обнаружили, что различные типы жирных кислот играют большую роль в дисбактериозе, чем только кормление с высоким содержанием жиров [19].,20]. Процесс переваривания липидов может дать больше информации о том, как микробы могут быть связаны с различными заболеваниями.
Как показано, желчь, выделяемая во время кормления с высоким содержанием жиров, может влиять на рост или выживание некоторых микробов [25], хотя мы обнаружили, что различные типы жирных кислот играют большую роль в дисбактериозе, чем только кормление с высоким содержанием жиров [19].,20]. Процесс переваривания липидов может дать больше информации о том, как микробы могут быть связаны с различными заболеваниями.
Здоровая микробиота характеризуется высоким разнообразием и способностью противостоять изменениям в условиях физиологического стресса. Напротив, микробиота, связанная с заболеванием, характеризуется более низким видовым разнообразием, меньшим количеством полезных микробов и/или присутствием патобионтов. Учитывая роль микробиоты в опосредовании метаболизма и иммунитета хозяина, нарушение микробиоты было связано с различными заболеваниями желудочно-кишечного тракта человека и системно во всем организме. Здесь мы рассмотрим данные недавних клинических исследований, связывающих дисбиоз с различными заболеваниями, с акцентом на участие диетических факторов.
Здесь мы рассмотрим данные недавних клинических исследований, связывающих дисбиоз с различными заболеваниями, с акцентом на участие диетических факторов.
Функциональные функции желудочно-кишечного тракта человека включают абсорбцию питательных веществ, удаление отходов через перистальтику, защиту от проглоченных патогенов и предотвращение перемещения пищи или антигенов в кровоток. Микробиота кишечника регулирует некоторые из этих функций, включая перистальтику, барьерную функцию и поддержание сбалансированных воспалительных и гомеостатических реакций. Нарушение микробиоты кишечника делает ЖКТ уязвимым для локальных болезненных состояний (рис. 3).
Дисбактериоз и заболевания, вызванные питанием. На диаграмме обобщены желудочно-кишечные заболевания (в темно-серых прямоугольниках) и системные заболевания (в светло-серых прямоугольниках), соответствующие диетические факторы и индуцированные изменения кишечного микробного сообщества, обсуждаемые в этом обзоре.
Воспалительные заболевания кишечника
Клинические исследования выявили дисбиоз у пациентов с воспалительными заболеваниями кишечника (ВЗК), включая как болезнь Крона (БК), так и язвенный колит (ЯК). Исследования, изучающие близнецов, показали обогащение Actinobacteria и Proteobacteria и снижение Bacteroidetes у близнецов с ЯК по сравнению с их здоровыми братьями и сестрами [26]. Увеличение сульфидобразующих 9Подвиды 0183 Desulfovibrio и Fusobacterium varium , которые могут проникать в эпителий, присутствуют у пациентов с ЯК [27], в то время как противовоспалительная активность Faecalibacterium prausnitzii снижена [28]. Типичной чертой пациентов с ВЗК является снижение микробного биоразнообразия кишечника [29,30]. Например, у пациентов с БК были снижены уровни Faecalibacterium и Roseburia , повышены Ruminococcus [30] и Enterobacteriaceae, включая адгезивно-инвазивные Escherichia coli [31]. У грызунов было показано, что избыток молочного жира [32] и омега-6 ПНЖК [19] усугубляет ВЗК из-за дисбактериоза, что подтверждается 30%-ным увеличением риска язвенного колита при избыточном потреблении омега-6 ПНЖК [33].
Колоректальный рак
Было показано, что адаптация афроамериканцев к западной диете увеличивает заболеваемость и смертность от колоректального рака (КРР), что соответствует измененному микробному профилю в кале [34]. Показано, что у пациентов с КРР повышен уровень определенных видов бактерий, таких как Bacteroides fragilis, Enterococcus, Escherichia/Shigella, Klebsiella, Streptococcus, Peptostreptococcus, Roseburia и снижение количества Lachnospiraceae, продуцирующих бутират [35]. Растет количество данных, подтверждающих обратную связь между пищевыми волокнами, потреблением фруктов и овощей и риском развития колоректального рака. Длительное потребление клетчатки может привести к энтеротипу микробиоты, который положительно ассоциируется с Firmicutes и Proteobacteria и, наоборот, с Bacteroidetes, Actinobacteria [6] и 9.0183 Бифидобактерии [36]. Это может быть связано с улучшением функции кишечного барьера, поскольку полезные микробы улучшают целостность барьера, и это связано с уменьшением осложнений у пациентов, перенесших колэктомию [37]. Потребление пищевых волокон также может снизить риск развития колоректального рака, стимулируя микробиоту кишечника, обогащенную продукцией SCFAs [38].
Потребление пищевых волокон также может снизить риск развития колоректального рака, стимулируя микробиоту кишечника, обогащенную продукцией SCFAs [38].
Синдром раздраженного кишечника
Диета и микробиота кишечника являются двумя важными компонентами, участвующими в патогенезе синдрома раздраженного кишечника (СРК). Плохо усваиваемые пищевые углеводы вызывают пролонгированную продукцию водорода в кишечнике больных СРК (Римские критерии III), что важно, поскольку количество продуцируемого метана соответствует симптомам заболевания [39].]. Пациенты с СРК имеют измененный углеводный и белковый энергетический метаболизм в кишечнике, сопровождающийся изменениями в разнообразии определенных родов кишечных бактерий [40], где обнаружено, что обогащенные Firmicutes и уменьшенные Bacteroidetes связаны с отдельной подгруппой пациентов с СРК [41]. . Исследования, проведенные у пациентов с СРК с преобладанием диареи, показали снижение содержания фекальных аэробных бактерий, Bifidobacteria и Verrucomicrobium , и повышение содержания Lactobacillus, Veillonella, Prevotella и Параспоро [42,43]. Кроме того, увеличение E. coli и снижение Leptum и Bifidobacteria и бактерий, участвующих в трансформации желчных кислот, сопровождается увеличением фекальных желчных кислот, которые действуют как эндогенное слабительное, что еще больше усугубляет симптомы заболевания [44]. ].
Кроме того, увеличение E. coli и снижение Leptum и Bifidobacteria и бактерий, участвующих в трансформации желчных кислот, сопровождается увеличением фекальных желчных кислот, которые действуют как эндогенное слабительное, что еще больше усугубляет симптомы заболевания [44]. ].
Помимо местных заболеваний ЖКТ, дисбактериоз кишечника также связан с системными заболеваниями, такими как ожирение, сахарный диабет, атеросклероз и неалкогольная жировая болезнь печени (НАЖБП) (рис. 3). Действительно, многие метаболические заболевания связаны с хроническим воспалением, вызванным липополисахаридом, основным компонентом внешней мембраны грамотрицательных бактерий. Другие причинные факторы, связанные с кишечной микробиотой, включают дисфункцию кишечного барьера, иммуномодуляцию, выработку короткоцепочечных жирных кислот и других метаболитов, а также изменения метаболических путей, участвующих в сборе питательных веществ или энергии.
Ожирение
Текущие данные показывают, что кишечные микробы играют решающую роль в общем сборе энергии, влияя на ожирение [45]. Диеты с ограничением жиров и углеводов приводят к увеличению Bacteroidetes и снижению Firmicutes [46]. Другие диеты с низким содержанием углеводов/высоким содержанием белка, устойчивым крахмалом [47] или высоким содержанием пищевых волокон [48] также приводят к заметному увеличению различных бактериальных популяций. У детей с ожирением микробиота обогащена Enterobacteriaceae [49], снижена Bacteroides и отношение Bacteroidetes к Firmicutes, которые отрицательно коррелируют с индексом массы тела [50]. У детей с ожирением также повышены уровни Desulfovibrio и Akkermansia muciniphila [49], которые считаются важными для дисфункции кишечного барьера [51]. Более того, дети с ожирением также имеют повышенный уровень SCFAs и более интенсивное использование субстрата, что свидетельствует о том, что микробы способны к увеличению сбора энергии [52]. Точно так же у подростков с ожирением были кишечные микробы, которые больше участвовали в синтезе de novo B12 и производстве бутирата [53]. У финских женщин с нарушением обмена веществ обнаружено увеличение Eubacterium rectal - Clostridium coccoides , которые эффективно собирают энергию и питательные вещества и положительно коррелируют с несколькими метаболическими маркерами [54].
Точно так же у подростков с ожирением были кишечные микробы, которые больше участвовали в синтезе de novo B12 и производстве бутирата [53]. У финских женщин с нарушением обмена веществ обнаружено увеличение Eubacterium rectal - Clostridium coccoides , которые эффективно собирают энергию и питательные вещества и положительно коррелируют с несколькими метаболическими маркерами [54].
Диабет
Диабет 2 типа (СД2) представляет собой нарушение обмена веществ, характеризующееся резистентностью к инсулину, нарушением проницаемости кишечника, эндотоксемией и хроническим воспалением, все из которых связаны с дисбактериозом, вызванным диетой [55]. Было показано, что у пациентов с СД2 в фекальной микробиоте снижена популяция фирмикутов, включая микробы из скоплений клостридий [56]. Недавно в метагеномном ассоциативном исследовании с участием 345 китайских субъектов была секвенирована их фекальная микробиота, и дисбактериоз был подтвержден у пациентов с СД2. Результаты показали, что фекальная микробиота пациентов была обогащена более условно-патогенными микроорганизмами и меньшим количеством микробов, участвующих в производстве бутирата. Это привело к усилению микробных функций, включая восстановление сульфатов и устойчивость к окислительному стрессу [57]. Другое исследование показало, что у пациентов с СД2 китайского происхождения также наблюдалось снижение микробиоты в 9 случаях.0183 Бифидобактерии spp. [58], число полезных микробов часто снижается в моделях СД2 на грызунах. Хотя появляется все больше данных, свидетельствующих о том, что кишечные микробы играют важную роль в патогенезе СД1, до сих пор мало доказательств, связывающих диетические факторы с прогрессированием заболевания.
Это привело к усилению микробных функций, включая восстановление сульфатов и устойчивость к окислительному стрессу [57]. Другое исследование показало, что у пациентов с СД2 китайского происхождения также наблюдалось снижение микробиоты в 9 случаях.0183 Бифидобактерии spp. [58], число полезных микробов часто снижается в моделях СД2 на грызунах. Хотя появляется все больше данных, свидетельствующих о том, что кишечные микробы играют важную роль в патогенезе СД1, до сих пор мало доказательств, связывающих диетические факторы с прогрессированием заболевания.
Атеросклероз
Последние данные показывают, что микробиота кишечника участвует в атеросклерозе, хроническом воспалительном заболевании артерий с образованием множественных бляшек, ограничивающих кровоток. Различные микробные побочные продукты или так называемые микробно-ассоциированные молекулярные паттерны (МАМП) играют ключевую роль в атерогенезе [59].]. Кроме того, метаболизм диетического фосфатидилхолина и последующее образование маркеров риска сердечно-сосудистых заболеваний зависят от микробиоты кишечника [60]. Специфические бактериальные филотипы присутствуют в атеросклеротических бляшках, которые являются общими для образцов полости рта или кишечника у пациентов с атеросклерозом, где количество бактериальной ДНК коррелирует с количеством лейкоцитов, обнаруженных в атеросклеротических бляшках [61]. Секвенирование образцов фекалий методом дробовика показало, что Bacteroides - и Ruminococcus -преобладающие энтеротипы были недостаточно и сверхэкспрессированы, соответственно, у пациентов с атеросклерозом. Микробиом болезни был обогащен генами, кодирующими синтез пептидогликана, но беден фитоендегидрогеназой, необходимой для метаболизма жирорастворимых антиоксидантов [4]. Хотя на сегодняшний день количество клинических исследований ограничено, они представляют собой мощное сообщение о потенциальных терапевтических стратегиях против атеросклероза, направленных на кишечник.
Специфические бактериальные филотипы присутствуют в атеросклеротических бляшках, которые являются общими для образцов полости рта или кишечника у пациентов с атеросклерозом, где количество бактериальной ДНК коррелирует с количеством лейкоцитов, обнаруженных в атеросклеротических бляшках [61]. Секвенирование образцов фекалий методом дробовика показало, что Bacteroides - и Ruminococcus -преобладающие энтеротипы были недостаточно и сверхэкспрессированы, соответственно, у пациентов с атеросклерозом. Микробиом болезни был обогащен генами, кодирующими синтез пептидогликана, но беден фитоендегидрогеназой, необходимой для метаболизма жирорастворимых антиоксидантов [4]. Хотя на сегодняшний день количество клинических исследований ограничено, они представляют собой мощное сообщение о потенциальных терапевтических стратегиях против атеросклероза, направленных на кишечник.
Неалкогольная жировая болезнь печени
НАЖБП связана с избыточным бактериальным ростом в тонкой кишке (SIBO) и результирующими эффектами повышенного содержания ацетальдегида, триметиламина, N-оксида триметиламина и фактора некроза опухоли-α [62]. Учитывая, что кишечник и печень соединены портальной венозной системой, это делает печень более уязвимой для транслокации бактерий, бактериальных продуктов, эндотоксина или секретируемых цитокинов. Обезогенная микробиота может изменять функцию печени, стимулируя печеночные триглицериды и модулируя системный метаболизм липидов, что косвенно влияет на накопление жирных кислот в печени [63]. В подтверждение этого, SIBO коррелирует с повышенной проницаемостью кишечника у людей [64] и стеатозом печени у пациентов с ожирением [65]. Тяжесть НАЖБП связана с хроническим воздействием эндотоксинов на человека [66]. Дефицит холина и развитие жировой дистрофии печени также связаны с изменением количества γ-Proteobacteria и Erysipelotrichi [67]. Изменение такого количества бактерий, вызванное диетой, также помогает прогнозировать риск развития жировой дистрофии печени.
Учитывая, что кишечник и печень соединены портальной венозной системой, это делает печень более уязвимой для транслокации бактерий, бактериальных продуктов, эндотоксина или секретируемых цитокинов. Обезогенная микробиота может изменять функцию печени, стимулируя печеночные триглицериды и модулируя системный метаболизм липидов, что косвенно влияет на накопление жирных кислот в печени [63]. В подтверждение этого, SIBO коррелирует с повышенной проницаемостью кишечника у людей [64] и стеатозом печени у пациентов с ожирением [65]. Тяжесть НАЖБП связана с хроническим воздействием эндотоксинов на человека [66]. Дефицит холина и развитие жировой дистрофии печени также связаны с изменением количества γ-Proteobacteria и Erysipelotrichi [67]. Изменение такого количества бактерий, вызванное диетой, также помогает прогнозировать риск развития жировой дистрофии печени.
Диета считается модифицируемым вмешательством; однако наше понимание того, как манипулировать диетой для поддержания здоровой микробиоты, находится в зачаточном состоянии, поскольку влияние многих диетических факторов часто изменяется, оспаривается или просто не имеет доказательств. Новый подход к изменению кишечных микробов заключается в использовании бактериотерапии (рис. 4). Хотя бактериотерапия может быть альтернативным подходом к профилактике, лечению или даже излечению заболеваний, нет ясности в отношении ее эффективности у людей.
Новый подход к изменению кишечных микробов заключается в использовании бактериотерапии (рис. 4). Хотя бактериотерапия может быть альтернативным подходом к профилактике, лечению или даже излечению заболеваний, нет ясности в отношении ее эффективности у людей.
Бактериотерапия в лечении заболеваний, связанных с дисбактериозом. Дисбактериоз приводит к измененному микробному составу, который часто характеризуется значительным снижением видового разнообразия и повышенным ростом типично недоминирующих таксонов. Бактериотерапия — это метод, при котором достигается восстановление исходной микробиоты или новой здоровой микробиоты посредством манипуляций с бактериями. Это достигается за счет использования одного или комбинации различных вмешательств, включая: удаление патогенных бактерий с помощью антибиотиков, добавление пребиотиков для стимулирования роста полезных бактерий, добавление пробиотиков для компенсации неадекватных уровней определенных бактериальных штаммов и, совсем недавно введение новой микробной экосистемы путем пересадки фекальных бактерий здорового донора.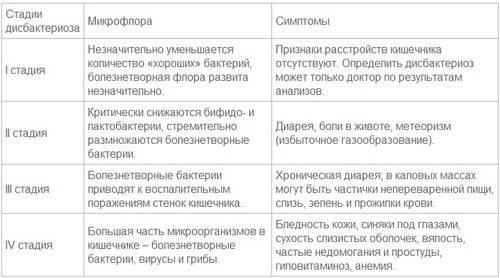
Пробиотики определяются как живые микроорганизмы, которые приносят пользу здоровью хозяина при приеме в адекватных количествах. Их обсуждает Версалович в этом выпуске. Пребиотики представляют собой неперевариваемые пищевые ингредиенты, которые благотворно влияют на хозяина, избирательно стимулируя рост и/или активность полезных кишечных бактерий. Комбинация пробиотиков и пребиотиков называется симбиотиками. Пробиотики являются штаммоспецифичными и требуют достаточных доз и времени для оказания эффективного воздействия. Различные виды пробиотиков прошли клинические испытания в качестве потенциальных терапевтических средств как для локализованных, так и для системных заболеваний. Недавний обзор влияния пробиотиков на здоровье и болезни показан в таблице 2. Эффекты пробиотиков при местных желудочно-кишечных заболеваниях в целом положительные, хотя обычно отсутствуют доказательства того, что эти эффекты опосредованы кишечной микробиотой. Несмотря на то, что действие пробиотиков при системных заболеваниях еще в значительной степени неизвестно, они более вариабельны.
Несмотря на то, что действие пробиотиков при системных заболеваниях еще в значительной степени неизвестно, они более вариабельны.
Резюме клинических исследований с использованием пробиотиков против заболеваний, вызванных дисбактериозом
Хорошо задокументировано, что лечение антибиотиками вызывает отклонения в микробиоте хозяина. Хотя обычно считается, что такие изменения нормализуются в течение нескольких недель после прекращения приема антибиотиков, последние данные оспаривают это представление [68]. Например, значительное снижение разнообразия Bacteroides сохранялось до 2 лет после 7 дней введения клиндамицина [68]. Таким образом, в контексте дисбактериоза антибиотики можно рассматривать как палку о двух концах. Они эффективны в уничтожении патогенов, но также неспецифически снижают микробное разнообразие, позволяя условно-патогенным бактериям колонизировать новые гостеприимные ниши в экосистеме кишечника. Так обстоит дело с Clostridium difficile, условно-патогенный микроорганизм, появившийся в 1970-х годах у пациентов, получавших клиндамицин [69]. Другим примером противоречивого действия антибиотиков при дисбактериозе является их влияние на ВЗК. Например, клинически было показано, что использование ципрофлоксацина умеренно улучшает симптомы и частоту ремиссий у пациентов с болезнью Крона [70]; однако воздействие антибиотиков в детстве было связано с развитием ВЗК в последующие годы [71]. В клинических условиях это вызывает серьезную озабоченность в отношении надлежащего использования или отказа от антибиотиков. Важно разработать более специфическую антимикробную или одновременную терапию для восстановления или сведения к минимуму нарушений нормальной микробиоты.
Другим примером противоречивого действия антибиотиков при дисбактериозе является их влияние на ВЗК. Например, клинически было показано, что использование ципрофлоксацина умеренно улучшает симптомы и частоту ремиссий у пациентов с болезнью Крона [70]; однако воздействие антибиотиков в детстве было связано с развитием ВЗК в последующие годы [71]. В клинических условиях это вызывает серьезную озабоченность в отношении надлежащего использования или отказа от антибиотиков. Важно разработать более специфическую антимикробную или одновременную терапию для восстановления или сведения к минимуму нарушений нормальной микробиоты.
Одним из многообещающих подходов к лечению заболеваний, связанных с дисбиозом, является восстановление нормальной микробиоты путем трансплантации стула здорового донора хозяину с симптомами, что называется трансплантацией кала (ФТ) (рис. 4). В клинических условиях ФТ оказалась гораздо более эффективной и безопасной процедурой, чем стандартное лечение антибиотиками, при немедленном и длительном разрешении рецидива C.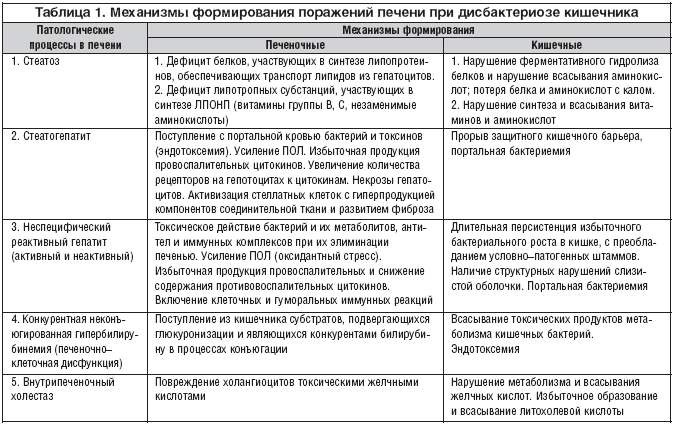 difficile . В настоящее время эта процедура не стандартизирована; однако его показатель успеха выше 95% [72] и кажущееся отсутствие побочных эффектов побудили экспертов исследовать его использование в лечении других хронических заболеваний, таких как ВЗК [73] и метаболический синдром [74]. По мере того, как наше понимание важной роли, которую микробиота хозяина играет в заболевании и иммунитете, увеличивается, использование методов манипулирования микробиотой становится более разумным. Например, одним из возможных будущих направлений ФТ является использование сохраненного здорового стула пациента для восстановления кишечной микробиоты после лечения антибиотиками или начала заболевания. Из-за своей недорогой природы ФТ может быть особенно благоприятна в популяциях, где дорогие методы лечения труднодоступны.
difficile . В настоящее время эта процедура не стандартизирована; однако его показатель успеха выше 95% [72] и кажущееся отсутствие побочных эффектов побудили экспертов исследовать его использование в лечении других хронических заболеваний, таких как ВЗК [73] и метаболический синдром [74]. По мере того, как наше понимание важной роли, которую микробиота хозяина играет в заболевании и иммунитете, увеличивается, использование методов манипулирования микробиотой становится более разумным. Например, одним из возможных будущих направлений ФТ является использование сохраненного здорового стула пациента для восстановления кишечной микробиоты после лечения антибиотиками или начала заболевания. Из-за своей недорогой природы ФТ может быть особенно благоприятна в популяциях, где дорогие методы лечения труднодоступны.
Взаимодействие между различными диетическими факторами и кишечными микробами может привести к дисбиозу, который вызывает различные иммунные реакции у хозяина, что приводит к повышенной восприимчивости к различным желудочно-кишечным и системным заболеваниям. Восстановление и поддержание здоровой микробиоты кишечника может быть эффективным, недорогим и безопасным средством от этих заболеваний.
Восстановление и поддержание здоровой микробиоты кишечника может быть эффективным, недорогим и безопасным средством от этих заболеваний.
Д.Л.Г. финансируется за счет грантов Канадского фонда Крона и колита, Совета по естественным наукам и инженерным исследованиям и Общества информирования о кишечных заболеваниях.
Авторы заявляют об отсутствии конфликта интересов. Написание этой статьи было поддержано Институтом питания Nestlé.
Авторское право: Все права защищены. Никакая часть данной публикации не может быть переведена на другие языки, воспроизведена или использована в любой форме и любыми средствами, электронными или механическими, включая фотокопирование, запись, микрокопирование или любую систему хранения и поиска информации, без письменного разрешения издателя. .
Дозировка препарата: авторы и издатель приложили все усилия, чтобы гарантировать, что выбор препарата и дозировка, указанные в этом тексте, соответствуют текущим рекомендациям и практике на момент публикации. Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Тем не менее, в связи с продолжающимися исследованиями, изменениями в правительственных постановлениях и постоянным потоком информации, касающейся лекарственной терапии и реакций на лекарства, читателю настоятельно рекомендуется проверять вкладыш в упаковке для каждого лекарства на предмет любых изменений в показаниях и дозировке, а также для дополнительных предупреждений. и меры предосторожности. Это особенно важно, когда рекомендуемый агент является новым и/или редко используемым лекарственным средством.
Отказ от ответственности: заявления, мнения и данные, содержащиеся в этой публикации, принадлежат исключительно отдельным авторам и участникам, а не издателям и редакторам. Появление рекламы и/или ссылок на продукты в публикации не является гарантией, одобрением или одобрением рекламируемых продуктов или услуг или их эффективности, качества или безопасности. Издатель и редактор(ы) отказываются от ответственности за любой ущерб, нанесенный людям или имуществу в результате любых идей, методов, инструкций или продуктов, упомянутых в содержании или рекламе.